KESETIMBANGAN DINAMIS
A. Pengertian Kesetimbangan
Pernahkah kalian membeli beras di warung atau pasar? Apakah penjual beras menimbang beras yang kalian beli? Jika kalian membeli beras 1 kg, maka anak timbangan yang dipakai juga mempunyai massa 1 kg. Beras sama dengan 1 kg jika telah terjadi kesetimbangan dengan anak timbangan tersebut.
Gambar 1.Timbangan merupakan alat yang menerapkan prinsip kesetimbangan statis
Secara garis besar kesetimbangan dapat dibedakan menjadi dua, yaitu kesetimbangan statis dan kesetimbangan dinamis. Apakah kesetimbangan statis dan dinamis itu? Jawaban pertanyaan tersebut akan kalian dapat jika mempelajari subbab ini dengan baik.
Mengapa benda yang diletakkan di atas meja tidak jatuh? Mengapa kita dapat berdiri di atas tanah? Semua benda yang diam dan tidak bergerak dikatakan dalam keadaan setimbang. Keadaan setimbang benda-benda yang tidak bergerak merupakan keadaan setimbang statis. Dalam kesetimbangan statis jumlah gaya yang bekerja pada benda tersebut sama dengan nol atau tidak ada kerja dalam kesetimbangan. Coba kalian dorong buku di atas meja. Pasti buku tersebut bergerak, bukan?
BAHAN AJAR
Melalui diskusi kelompok dan di bawah bimbingan guru menggunakan Lembar Kegiatan Siswa (LKS) diharapkan:
1. Siswa dapat menjelaskan pengertian kesetimbangan dinamis. 2. Siswa dapat menjelaskan pengertian reaksi irreversibel. 3. Siswa dapat menjelaskan pengertian reaksi reversibel.
4. Siswa dapat menjelaskan pengertian kesetimbangan homogen. 5. Siswa dapat menjelaskan pengertian kesetimbangan heterogen.
Perhatikan proses pendidihan air di rumah kalian. Amati dengan baik pada saat air mendidih, maka terjadi perubahan dari wujud cair menjadi wujud gas, yaitu uap air. Uap air yang te rj adi j ik a te rke na t utu p at au be nda lain da pa t berubah menjadi air lagi. Proses berubahnya air berbentuk cair menjadi uap dan sesudahnya dapat menjadi air lagi merupakan proses dapat balik. Jika kecepatan berubahnya air menjadi uap air sama dengan proses berubahnya uap air menjadi air, maka peristiwa tersebut merupakan proses kesetimbangan. Kesetimbangan yang terjadi karena adanya perubahan dua arah inilah yang dinamakan kesetimbangan dinamis .
Gambar 2. Kesetimbangan air dalam bentuk cair dan gas dalam sistem tertutup
B. Reaksi Irreversibel dan Reversibel
Coba lakukan kegiatan pembakaran kertas atau kayu. Apa yang terjadi jika kertas atau kayu dibakar? Kayu atau kertas yang dibakar akan menghasilkan arang dan abu. Arang dan abu tidak akan dapat kembali lagi menjadi kertas. Proses berubahnya kayu atau kertas menjadi arang dan abu dinamakan reaksi kimia yang berkesudahan atau reaksi satu arah, karena reaksi tersebut tidak dapat kembali seperti semula. Reaksi ini disebut juga reaksi irreversibel.
Apakah ada reaksi yang dapat balik? Dalam kehidupan sehari-hari sulit menemukan reaksi yang dapat balik. Proses-proses alami umumnya berlangsung searah, tidak dapat balik. Namun di laboratorium maupun dalam proses industri, banyak reaksi yang dapat balik. Reaksi yang dapat balik ini disebut reaksi reversibel.
Contoh reaksi reversibel sebagai berikut:
Jika campuran gas nitrogen dan hidrogen dipanaskan akan menghasilkan amonia: N2(g) + 3H2(g) 2NH3(g) ……(reaksi 1)
Sebaliknya, jika amonia dipanaskan akan terurai membentuk nitrogen dan hidrogen: 2NH3(g) N2(g) + 3H2(g) ……(reaksi 2)
Apabila diperhatikan ternyata reaksi 1 di atas merupakan kebalikan dari reaksi 2. Kedua reaksi itu dapat digabung sebagai berikut:
Tanda dimaksudkan untuk menyatakan reaksi dapat balik. Reaksi ke kanan disebut reaksi maju, sedangkan reaksi ke kiri disebut reaksi balik.
C. Kesetimbangan Kimia
Suatu reaksi dapat digolongkan ke dalam reaksi kesetimbangan dinamis (equilibrium reaction) jika reaksi yang dapat balik (reversibel) berlangsung dengan kecepatan yang sama, baik kecepatan ke arah hasil reaksi maupun kecepatan ke arah pereaksi dan reaksinya tidak bergantung pada waktu.
Dalam sistem kesetimbangan dinamis, reaksi yang menuju hasil reaksi dan reaksi yang menuju pereaksi berlangsung secara bersamaan dengan laju yang sama sehingga konsentrasi masing-masing zat dalam sistem kesetimbangan tidak berubah (tetap). Jika kita dapat melihat sistem kesetimbangan dinamis secara molekuler, akan tampak partikel-partikel dalam sistem kesetimbangan tidak tetap sebagai pereaksi atau hasil reaksi, melainkan bereaksi terus dalam dua arah secara dinamis. Pereaksi akan berubah menjadi hasil reaksi diimbangi oleh hasil reaksi berubah menjadi pereaksi. Jadi, kesetimbangan kimia disebut kesetimbangan dinamis karena secara mikroskopis zat-zat tersebut berubah setiap saat, tetapi secara makroskopis tidak ada perubahan yang dapat diamati atau diukur, tidak ada perubahan wujud maupun perubahan konsentrasi masing-masing zat.
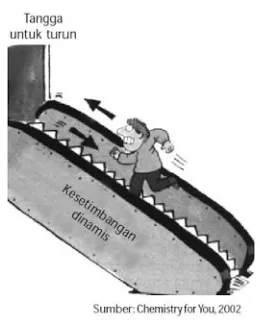
Keadaan setimbang dinamis dapat dianalogikan sebagai seseorang yang berjalan di eskalator, tetapi arahnya berlawanan dengan arah eskalator. Eskalator bergerak ke bawah dan orang tersebut bergerak ke atas dengan kecepatan yang sama. Akibatnya, orang tersebut seperti berjalan di tempat. Secara makroskopis, kedudukan orang tersebut tidak berubah sebab tidak bergeser dari posisinya, tetapi secara mikroskopis terjadi perubahan terus-menerus, seperti ditunjukkan oleh gerakan eskalator yang diimbangi oleh gerakan orang tersebut dengan kecepatan yang sama (perhatikan gambar 3).
Persamaan kimia untuk reaksi kesetimbangan dinyatakan dengan dua arah anak panah, misalnya pada reaksi pembentukan amonia, persamaan reaksi kimianya ditulis sebagai berikut:
N2(g) + 3H2(g) 2NH3(g)
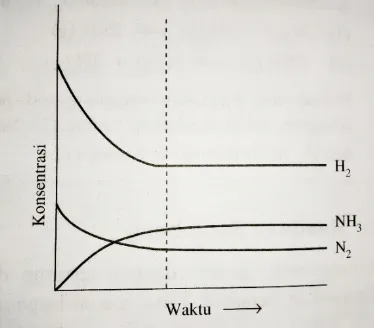
Perhatikan kembali reaksi pembentukan amonia di atas. Jika konsentrasi masing-masing zat dalam sistem diukur, kemudian hasilnya dituangkan ke dalam bentuk grafik hubungan antara konsentrasi zat dan waktu reaksi maka kurva yang terbentuk seperti pada gambar 4 berikut:
Gambar 4. Grafik perubahan konsentrasi pereaksi dan hasil reaksi menuju keadaan setimbang untuk reaksi: N2(g) + 3H2(g) 2NH3(g)
Konsentrasi N2 dan H2 (pereaksi) turun, konsentrasi NH3 (hasil reaksi) naik. Pada
keadaan setimbang konsentrasi masing-masing zat tetap.
Gambar 5. Grafik perubahan laju reaksi terhadap waktu pada reaksi bolak-balik: N2(g) + 3H2(g) 2NH3(g)
v1 = laju reaksi dari reaktan ke produk v2 = laju reaksi dari produk ke reaktan
Kesetimbangan tercapai pada saat v1 = v2
mengatur komposisi atmosfir yang relatif konstan dari waktu ke waktu. Proses kesetimbangan juga terjadi dalam tubuh makhluk hidup. Darah manusia, sebagai contoh, mempunyai suatu sistem yang mengatur pH tetap sekitar 7,4. Hal ini penting, karena perubahan kecil saja pada pH darah akan menggangu fungsinya, misalnya dalam pengikatan oksigen.
D. Kesetimbangan Homogen dan Heterogen
Suatu kesetimbangan seringkali terdapat dalam fase yang berlainan. Sebagaimana kita ketahui bahwa fase atau wujud zat secara garis besar ada 3 macam, yaitu padat, cair, dan gas. Berdasarkan wujud zat tersebut, kesetimbangan dapat dibedakan menjadi 2, yaitu:
1. Kesetimbangan Homogen
Homogen mempunyai arti serba sama, sehingga yang dimaksud dengan kesetimbangan homogen adalah kesetimbangan dimana komponennya (produk dan reaktan) dalam fasa yang sama. Perhatikan contoh persamaan reaksi berikut:
2SO2(g) + O2(g) 2SO3(g)
H2O(l) H+(aq) + OH-(aq)
Fe3+
(aq) + SCN-(aq) Fe(SCN)2+(aq)
2. Kesetimbangan Heterogen
Heterogen berarti beraneka ragam, sehingga kesetimbangan dikatakan heterogen jika dalam kesetimbangan terdapat lebih dari satu jenis fasa zat, baik produk maupun reaktan. Perhatikan contoh persamaan reaksi berikut:
CO2(g) + H2O(l) H2CO3(aq)
CaCO3(s) CaO(s) + CO2(g)
BaSO4(s) Ba2+(aq) + SO42−¿ ¿(aq)
TUJUAN PEMBELAJARAN
6. Siswa dapat meramalkan arah pergeseran kesetimbangan dengan menggunakan azas Le Chatelier.
7. Siswa dapat menganalisis pengaruh perubahan konsentrasi pada pergeseran kesetimbangan.
8. Siswa dapat menganalisis pengaruh perubahan suhu pada pergeseran kesetimbangan.
9. Siswa dapat menganalisis pengaruh perubahan tekanan dan volum pada pergeseran kesetimbangan.
Secara alamiah semua benda baik makhluk hidup maupun benda mati menginginkan dalam kondisi setimbang. Tetapi, adanya perubahan-perubahan alam menyebabkan tidak ada satu makhluk atau benda yang tetap dalam kondisi sama. Banyak faktor yang dapat menimbulkan terjadinya perubahan. Demikian pula halnya dengan kesetimbangan kimia. Kesetimbangan kimia merupakan keadaan setimbang yang diukur pada suhu tetap. Sehingga pada suhu yang berbeda akan terjadi kesetimbangan yang berbeda pula. Tidak hanya suhu, banyak faktor lain yang dapat mempengaruhi kesetimbangan kimia. Factor apa sajakah itu?
Ilmuan Prancis, Henry Le Chatelier (1850-1936) berpendapat bahwa jika pada kesetimbangan kimia dilakukan gangguan, maka akan terjadi pergeseran kesetimbangan, tetapi sistem akan berusaha mempertahankan kesetimbangan ,sehingga pengaruhnya jadi sekecil mungkin. Pendapat Henry Le Chatelier ini dikenal sebagai asas Le Chatelier, yang berbunyi:
Secara singkat, asas Le Chatelier dapat disimpulkan sebagai berikut : “Bila suatu keadaan setimbang menerima aksi, maka keadaan setimbang tersebut akan bereaksi untuk menghilangkan/ meminimalisasi aksi tersebut.”
Reaksi = - Aksi
Faktor-faktor yang Mempengaruhi Kesetimbangan
Beberapa aksi yang dapat menimbulkan perubahan pada sistem kesetimbangan antara lain, perubahan konsentrasi, perubahan tekanan dan perubahan suhu.
1. Perubahan konsentrasi
Perubahan konsentrasi baik produk maupun reaktan mengakibatkan terjadinya pergeseran kesetimbangan sistem. Berdasarkan asas Le Chatelier, apabila pereaksi atau produk reaksi berubah, maka kesetimbangan akan bergeser untuk mengurangi pengaruh perubahan konsentrasi yang terjadi sampai diperoleh kesetimbangan yang baru. Jika konsentrasi produk ditambah, maka kesetimbangan akan bergeser kearah reaktan dan sebaliknya. Jika konsentrasi produk dikurangi, maka kesetimbangan bergeser
kearah produk. Simak pengaruh perubahan konsentrasi terhadap kesetimbangan berikut
ini.
Konsentrasi pereaksi atau produk reaksi diperbesar/diperkecil
Misal karbon dioksida direaksikan dengan air akan berada dalam kesetimbangan berikut.
CO2(g) + H2O(l) H2CO3(aq)
Jika konsentrasi gas karbon dioksida diperbesar, maka kesetimbangan akan terganggu. Kesetimbangan reaksi bergeser kearah hidrogen karbonat, kemudian akan terbentuk kembali kesetimbangan baru dalam rangka mengatasi adanya perubahan tersebut. Sebaliknya, jika konsentrasi hydrogen karbonat diperbesar, maka akan terjadi pergeseran kesetimbangan ke arah gas karbon dioksida. Perlu diketahui bahwa selama suhu dijaga tetap, maka nilai tetapan kesetimbangan tidak akan berubah. Kesetimbangan hanya mengalami pergeseran sedangkan nilai tetapan akan tetap.
2. Perubahan suhu
Kenaikan suhu reaksi dalam kesetimbangan kimia secara termodinamika akan menaikkan kecepatan reaksi. Pergeseran kesetimbangan akibat perubahan suhu harus dilihat dari sifat reaksi tersebut apa merupakan reaksi eksoterm atau endoterm. Sebagaimana dengan perubahan konsentrasi, maka menurut asas Le Chatelier, bahwa apabila suhu dinaikkan maka reaksi akan bergeser ke arah reaksi yang memerlukan panas (endoterm). Sebaliknya, jika suhu diturunkan, maka reaksi akan bergeser kearah
reaksi yang mengeluarkan panas (eksoterm). Misal reaksi pembentukan gas SO3 yang
Pada reaksi kesetimbangan ini, reaksi pembentukan SO3 merupakan reaksi yang
mengeluarkan panas (eksoterm). Apabila pada kesetimbangan tersebut dilakukan perubahan suhu, misal suhu dinaikkan, maka sistem berusaha mengatasi perubahan suhu tersebut dengan cara menyerap panas yang diberikan. Dengan demikian, kesetimbangan akan bergeser ke arah endoterm, yaitu ke arah reaktan. Sedangkan, jika suhu diturunkan, maka sistem kesetimbangan akan bergeser ke arah eksoterm, dalam hal ini ke arah pembentukan produk, yaitu gas SO3.
Pada suhu tetap nilai tetapan kesetimbangan akan tetap sekalipun dilakukan perubahan konsentrasi dan tekanan. Tetapi, jika suhu berubah nilai tetapan kesetimbangan akan ikut berubah.
3. Perubahan tekanan dan Volume
Perubahan tekanan pada kesetimbangan reaksi akan mempengaruhi keadaan kesetimbangan. Pada suhu tetap, jika tekanan diubah, maka akan terjadi pergeseran kesetimbangan. Kesetimbangan yang dipengaruhi oleh tekanan adalah kesetimbangan homogen fase gas. Karena fase gas sangat mudah dipengaruhi tekanan. Menurut asas Le Chatelier, jika tekanan dalam sistem kesetimbangan diubah, maka sistem akan mengadakan aksi agar pengaruh tersebut berkurang. Perubahan tekanan tidak akan mengubah nilai tetapan kesetimbangan, karena pada sistem ini suhu dijaga tetap.
Sebagai contoh:
2NO2(g) N2O4(g) + energi
Pada sistem ini, jika tekanan diperbesar (volume diperkecil), maka
kesetimbangan akan bergeser ke arah zat yang memiliki jumlah mol lebih kecil (N2O4).
Sebaliknya, jika tekanan diperkecil (volume diperbesar), maka kesetimbangan akan
bergeser ke arah gas NO2, karena jumlah mol yang lebih banyak.
Bagaimana jika jumlah mol reaktan sama dengan produk? Jika jumlah mol reaktan sama dengan produk, maka perubahan tekanan tidak akan mempengaruhi kesetimbangan.
Contoh :
2HI(g) I2(g) + H2(g)
Untuk reaksi tersebut jika tekanan diperbesar atau diperkecil, maka tidak akan menyebabkan terjadinya pergeseran kesetimbangan, karena jumlah mol reaktan adalah 2, jumlah mol produk juga 2 (dari 1 mol I2 dan 1 mol H2).
Peran katalis dalam kesetimbangan adalah untuk mempercepat tercapainya kesetimbangan.
Banyak campuran yang terdapat di alam berupa kesetimbangan antara satu komponen dengan komponen yang lain. Oleh sebab itu, apabila ingin mengetahui perbandingan jumlah zat hasil reaksi dan pereaksi pada keadaan setimbang, maka kita perlu mempelajari hubungan kuantitatif antara pereaksi dan hasil reaksi pada keadaan setimbang.
1. Cara menyatakan Kesetimbangan Kimia
Hubungan kuantitatif antara pereaksi dan hasil reaksi pada keadaan setimbang dinyatakan dengan tetapan kesetimbangan, yaitu perbandingan antara konsentrasi pereaksi dengan hasil reaksi. Tetapan kesetimbangan untuk setiap reaksi berbeda-beda dan diperoleh melalui percobaan. Contoh percobaan yang sering dilakukan adalah reaksi kesetimbangan antara H2 dan
I2 menjadi HI.
Reaksi : H2(g) + I2(g) 2HI(g) pada temperatur 4580C. Banyaknya H2,I2 dan HI
yang mula-mula dicampurkan bervariasi dan sistem dibiarkan setimbang. Konsentrasi pada saat setimbang ditunjukkan pada tabel berikut
No. Konsentrasi Kesetimbangan [
HI
][
H
2] [
I
2]
[
HI
]
2[
H
2] [
I
2]
[H2] M [I2] M [HI] M
1 0,00421 0,00421 0,0294 1.658,76 48,76
2 0,0110 0,00420 0,0473 1.023,81 48,43
3 0,0110 0,0550 0,173 285,95 49,47
4 0,0430 0,0620 0,358 134,28 48,07
TETAPAN KESETIMBANGAN
Melalui diskusi kelompok dan di bawah bimbingan guru menggunakan Lembar Kegiatan Siswa (LKS) diharapkan:
10. Siswa dapat menjelaskan pengertian tetapan kesetimbangan.
11. Siswa dapat menuliskan tetapan kesetimbangan (Kc) untuk kesetimbangan homogen dan heterogen.
12. Siswa dapat menghitung harga Kc berdasarkan konsentrasi zat dalam kesetimbangan.
13. Siswa dapat menghitung harga Kc apabila ada dua Kc dari reaksi yang berkaitan.
Fraksi konsentrasi kolom manakah yang menunjukkan harga konstan? Tentunya pada
kolom
[
HI
]
2[
H
2] [
I
2]
.
Dari tabel diatas, terlihat bahwa berapa pun harga konsentrasi zat-zatpereaksi maupun hasil reaksi pada saat keadaan setimbang, perbandingan antara konsentrasi zat-zat pereaksi pangkat koefisien reaksi dengan konsentrasi zat-zat-zat-zat hasil reaksi pangkat koefisien adalah konstan. Perbandingan yang konstan itu disebut tetapan kesetimbangan (K). Tetapan kesetimbangan berharga tetap dan hanya bergantung pada stoikiometri reaksi dan temperatur.
Hal tersebut dapat dituliskan dalam bentuk persamaan matematika
K
=
[
HI
]
2[
H
2] [
I
2]
Selanjutnya, persamaan matematika itu disebut sebagai tetapan kesetimbangan konsentrasi yang dilambangkan dengan Kc.
mA + nB pC + qD
K
c=
[
C
]
p
[
D
]
q[
A
]
m[
B
]
nContoh : Tuliskan ungkapan tetapan kesetimbangan untuk reaksi berikut H2(g) + Br2(g) 2 HBr(g)
K
c=
[
HBr
]
2
[
H
2] [
Br
2]
2. Menuliskan Kc untuk kesetimbangan heterogen
Kesetimbangan heterogen adalah reaksi kesetimbangan yang mengandung zat-zat yang berada dalam beberapa fase. Dalam kesetimbangan kimia, persamaan kesetimbangan Kc
ditentukan oleh zat yang konsentrasinya berubah selama reaksi berlangsung. Konsentrasi zat padat (s) dan zat cair murni (l) tidak mengalami perubahan selama reaksi berlangsung sehingga zat yang berfase padat (s) dan cair murni(l) tidak dilibatkan dalam persamaan reaksi. Jadi pada kesetimbangan heterogen, penentuan Kc tidak melibatkan zat yang berfase padat dan cair murni.
Contoh: BiCl3(aq) + H2O(l) BiOCl(s) + 2HCl(aq)
K
c=
[
HCl
]
2
[
BiCl
3]
CaO(s) + SO2(g) CaSO3(s)
K
c=
[
SO
2]
Dengan melihat nilai Kc, kita dapat memperkirakan perbandingan antara hasil reaksi dan
pereaksi.
a. Jika Kc > 1 (nilai Kc sangat besar), zat-zat hasil reaksi lebih banyak daripada pereaksi.
Amati contoh reaksi dan grafik berikut
H2(g) + Br2(g) 2HBr(g)
K
c=
[
HBr
]
2
[
H
2] [
Br
2]
=
sangat besar
b. Jika Kc < 1 (nilai Kc sangat kecil), zat-zat hasil reaksi lebih sedikit daripada pereaksi.
Amati gambar berikut
N2(g) + O2(g) 2NO(g)
K
c=
[
NO
]
2
[
N
2] [
O
2]
=
sangat kecil
4. Menghitung Kc dalam suatu reaksi kesetimbangan
Kc dalam suatu reaksi kesetimbangan dapat diketahui, jika data mol pereaksi awal dan
sisa atau yang bereaksi diketahui. Agar lebih mudah, ikuti langkah-langkah menentukan Kc
dalam contoh soal berikut
Ke dalam wadah bervolume 10 liter, dimasukkan 8 mol NH3 sehingga terjadi reaksi 2NH3(g)
N2(g)+3H2(g). Jika dalam keadaan setimbang terdapat 4 mol NH3, hitunglah harga Kc.
Penyelesaian:
a. Tuliskan reaksi lengkapnya: 2NH3(g) N2(g) + 3H2(g)
2NH3(g) N2(g) + 3H2(g)
m : 8 mol m : mula-mula
t : t : terurai
s : 4 mol s : setimbang
c. Carilah mol setimbang dengan mencari mol di tabel t(terurai), kemudian mol yang lain dapat dicari dengan membandingkan koefisien reaksi. Agar memudahkan beri tanda minus(-) pada ruas pereaksi dan tambah(+) pada ruas hasil reaksi.
2NH3(g) N2(g) + 3H2(g)
m : 8 mol - -t : -4 +2 +6 s : 4 mol 2 mol 6 mol
d. Ubahlah mol pada saat setimbang (s) ke dalam satuan M(molar) dengan cara membagi
mol dengan volume.
[
NH
3]
=
4
10
=0,4
M ;
[
N
2]
=
10
2
=0,2
M ;
[
H
2]
=
10
6
=0,6
M
e. Tentukan nilai Kc dengan memasukkan nilai molar ke persamaan
K
c=
[
N
2] [
H
2]
3[
NH
3]
2=
(0,2
M
) (0,6
M
)3
(
0,4
M
)2=
0
,
27
jadi nilai K
c=
0
,
27
M
2
5. Hubungan antara dua Kc dari reaksi yang berkaitan
Contoh :
Jika tetapan kesetimbangan (Kc) untuk reaksi A + B C dan reaksi 2A + D C
berturut-turut adalah 4 dan 8, tetapan kesetimbangan untuk reaksi C + D 2B adalah Penyelesaian:
A + B C Kc1 = 4
2A + D C Kc2 = 8
C + D 2B Kc = ...
2C 2A + 2B (reaksi dibalik
K
c=
(
1
4
)
lalu dikali
2
K
c=
(
1
4
)
2 Jika reaksi dibalik, maka Kc menjadi 1/Kc
Jika reaksi dikali x, maka Kc menjadi (Kc)x
Jika reaksi dibagi x, maka Kc menjadi x √Kc
Jika reaksi-reaksi kesetimbangan dijumlahkan,
maka nilai tetapan kesetimbangannya adalah hasil
kali tetapan kesetimbangan dari reaksi-reaksi yang
2A + D C
K
c=
8
+C + D 2B
K
c=
(
1
4
)
2
x
8
=
1
2
Tetapan Kesetimbangan Tekanan Parsial ( Kp )
Tetapan kesetimbangan untuk sistem kesetimbangan gas juga dapat dinyatakan dengan tekanan parsial gas:
P = tekanan parsial senyawa gas
Perbandingan tekanan parsial = Perbandingan mol saat setimbang
Jika diketahui tekanan total suatu reaksi gas maka tekanan parsial tiap-tiap zatnya dapat ditentukan :
Jumlah mol total saat reaksi gas mencapai kesetimbangan dapat dicari dengan rumus gas
ideal :
Hubungan Kc dan Kp :
TETAPAN KESETIMBANGAN
GAS
Melalui diskusi kelompok dan di bawah bimbingan guru menggunakan Lembar Kegiatan Siswa (LKS) diharapkan:
14.Siswa dapat menghitung harga Kp berdasarkan tekanan parsial
gas pereaksi dan hasil reaksi pada keadaan setimbang. 15.Siswa dapat menentukan hubungan antara Kc dengan Kp.
16.Siswa dapat menghitung harga Kc berdasarkan Kp atau
Keterangan :
P = tekanan (atm) V = volume (m) n = mol
R = 0,082 L.atm/mol.K T = Suhu ( K )
∆n = Jumlah koefisien gas kanan - Jumlah koefisien gas kiri
Contoh Soal:
Sebanyak 10 mol gas N2 dicampurkan dengan 40 mol gas H2 dalam suatu ruangan 10 liter
kemudian dipanaskan pada suhu 427 C sehingga bereaksi membentuk NH3 menurut reaksi
kesetimbangan :
Apabila tekanan total campuran pada keadaan setimbang adalah 230 atm. Tentukanlah harga Kp !
Jawab :
Dengan menggunakan persamaan gas ideal jumlah mol gas dalam campuran saat setimbang dapat dihitung sebagai berikut :
Hati-hati!!! Suhu harus dalam Kelvin ( K ) maka T = 427 C + 273 = 700 K
Misal jumlah mol N2 yang bereaksi = x mol maka susunan kesetimbangan dapat dihitung sebagai
berikut :
karena jumlah mol totalnya = 40 mol, maka x dapat dicari : (10 - x) + (40 - 3x) + 2x = 40
-2x = -10 x = 5
Susunan mol saat kesetimbangan sebagai berikut : N2 = 10 - x = 5 mol
H2 = 40 - 3x = 25 mol
NH3 = 2x = 10 mol
Tekanan Parsial gas saat setimbang :
tekanan parsial N2 = 5/40 . 230 atm = 28,75 atm