BAB 2
TINJAUAN PUSTAKA
2.1 Keong Mas (Pomaceae canaliculata L.)
Keong mas (Pomaceae canaliculata L.) merupakan hewan lunak dari divisio
Mollusca yang siklus hidupnyapendek, bereproduksi cepat karena bersifat hermaprodit. Keong mas atau dikenal golden apple snail (GAS) sering dianggap sebagai salah satu penyebab kegagalan panen padi. Mollusca jenis ini hidup diperairan jernih, aliran airnya lambat, drainase tidak baik dan tidak cepat kering, bersubstrat lumpur dengan tumbuhan air yang melimpah.Keong mas dapat bertahan hidup sampai 6 bulan pada air yang memiliki pH 5-8, dan suhu antara 18-280C. Keong mas akan makan, bergerak dan tumbuh lebih cepat pada suhu yang tinggi. Pada suhu yang lebih rendah keong mas masuk dalam lumpur dan menjadi tidak aktif. Pada suhu diatas 320C hewan ini memiliki mortalitas yang
lebih tinggi (Anonimus, 2009).
Klasifikasi Keong mas menurut Saanin (1984) adalah sebagai berikut.
Kingdom : Animalia
Filum : Moluska
Kelas : Gastropoda
Ordo : Mesogastropoda
Famili : Ampullariidae
Genus : Pomacea
Gambar 2.1 : Keong Mas (Pomacea canaliculata L.)
Keong mas sanggup hidup 2-6 tahun dengan keperidian yang tinggi. Telur diletakkan dalam kelompok pada tumbuhan, pematang, ranting, dan lain-lain, beberapa cm di atas permukaan air. Pada umumnya telur berwarna merah muda, dengan diameter telur berkisar antara 2,2-3,5 mm, tergantung pada lingkungan. Pada temperatur 32-36ºC dengan kelembaban 80-90% dan pada temperatur 42-44ºC dengan kelembaban 76-80% di rumah kaca BB Padi Sukamandi, tiap kelompok telur keong mas berisi 235 hingga 860 butir dengan rata-rata 485±180 butir. Daya tetas berkisar antara 61-75%.Telur menetas setelah 8-14 hari. Pada temperatur 23-32ºC, dalam sebulan seekor keong mas dapat bertelur 15 kelompok yang terdiri atas 300 sampai 1.000 butir tiap kelompok (Hatimah dan Ismail, 1989).
Keong mas atau siput murbai (Pomacea Canaliculata L.)merupakan siput air tawar yang diintroduksi ke Indonesia pada tahun 1981 sebagai hewan hias. Sejak awal introduksi ada dua pendapat yang bertentangan perihal keong mas. Satu pihak mendukung introduksi keong mas dan membiakkanya sebagai komoditas ekspor, pihak lain mengkhawatirkan keong mas menjadi hama tanaman (Direktorat Perlindungan Tanaman Pangan, 2008).
Secara kimia abu cangkang keong mas terdiri dari oksida logam berupa 61,95 % CaO, 10,20% SiO2, 3,15% Fe2O3, 0,18% MgO, 4,81% Al2O3, 0,03% SO3,
0,05% K2O, 0,04% Na2O, 0,01% P2O5, 0,01% MnO3 dan 0,01% TiO2 (Etuk, dkk,
2.2 Aktivasi Cangkang Keong Mas (Pomaceae canaliculata L.)
Aktivasi dalam pengolahan abu cangkang keong mas bertujuan untuk meningkatkan daya adsorpsi. Aktivasi dibagi menjadi dua yaitu aktivasi fisika dan kimia.Aktivasi fisika dapat dilakukan dengan bantuan panas, uap dan CO2,
sedangkan aktivasi kimia merupakan aktivasi dengan pemakaian bahan kimia yang dinamakan aktivator.Untuk aktivasi kimia dapat dilakukan dengan penambahan garam-garam karbonat, kolorida, sulfat, fosfat dari logam alkali tanah dan khususnya ZnCl2, asam-asam organik seperti H2SO4, H3PO4 (Melita,
2003).
Aktivasi kimia yaitu unsur-unsur mineral dari persenyawaan kimia yang ditambahkan akan meresap ke dalam ruang adsorben dan membuka permukaan yang mula-mula tertutup oleh komponen kimia dalam adsorben sehingga luas permukaan yang aktif bertambah. Na2CO3 berfungsi sebagai aktivator.Besarnya
penyerapan abu ini disebabkan oleh struktur abu yang terbuka dan relatif bersih dari pengotor yang ditandai dari tidak terjadi lagi perubahan berat setelah dilakukan pengabuan beberapa kali. Dengan adanya kalsinasi menyebabkan CaCO3 kehilangan CO2 sehingga terbentuk CaO. Kalsium oksida dapat dibuat
dengan memanaskan limestone, coral, kerang laut, atau kapur, yang sebagian besar disebut dengan CaCO3 pada suhu 500 – 6000C, untuk menghilangkan
karbon dioksida.
CaCO3(s) → CaO(s) + CO2(g)
2.3 Air
Air merupakan salah satu sumber daya alam yang memiliki fungsi sangat vital bagi kehidupan makhluk hidup yang ada di muka bumi.Pengertian tersebut menunjukkan bahwa air memiliki peran yang sangat strategis dan harus tetap tersedia dan lestari, sehingga mampu mendukung kehidupan dan pelaksanaan pembangunan dimasa kini maupun dimasa mendatang karena tanpa adanya air maka kehidupan tidak akan dapat berjalan (Soemarto, 1987).
Air banyak digunakan oleh manusia untuk tujuan bermacam-macam sehingga dengan mudah dapat tercemar.Beberapa bahan pencemar seperti bahan mikrobiologi (bakteri,virus, parasit), bahan organik (pestisida, deterjen) dan beberapa bahan inorganik (garam, asam, logam), serta beberapa bahan kimia lainnya sudah banyak ditemukan dalam air yang kita pergunakan.Dalam melakukan usaha pengawasan yang diikuti dengan usaha pencegahan pencemaran air, harus dititik beratkan pada pengontrolan sumber pencemarannya.Ada dua bentuk sumber pencemar, yaitu sumber pencemar utama (point source) dan sumber pencemar lainnya (non-point source).
Sumber pencemar utama biasanya berasal dari sumber polusi yang menyebabkan pencemaran kadar tinggi yaitu dari limbah pabrik maupun sarana pengolahan limbah. Sumber pencemar lainnya ialah sumber polusi dengan kadar pencemar relatif rendah yang berasal dari bermacam-macam sumber yang menyebar, misalnya dari lahan pertanian, rumah tangga, peternakan, dan sebagainya (Darmono, 2001).
2.3.1 Karakteristik air
Air merupakan senyawa yang disusun oleh unsur Hidrogen dan Oksigen dengan rumus molekulnya H2O, didalam kondisi suhu sekitar (250C) dan tekanan
1 atmosfir yang berupa fluida cair. Air menutupi sekitar 70% permukaan bumi dengan jumlah sekitar 1.368 juta 𝑘𝑘𝑚𝑚3 (Effendi, 2003).
Sifat kimia dari air yaitu mempunyai pH=7 dan oksigen terlarut (DO) jenuh pada 9 mg/L. Air merupakan pelarut yang universal, hampir semua jenis zat dapat larut di dalam air. Air juga merupakan cairan biologis, yakni didapat di dalam tubuh semua organisme.
Sifat biologis dari air yaitu di dalam perairan selalu didapat kehidupan fauna dan flora. Benda hidup ini berpengaruh timbal balik terhadap kualitas air (Soemirat, J. 2004)
2.3.2 Kualitas Air
Peraturan Pemerintah No.20 tahun 1990 mengelompokkan kualitas air menjadi beberapa golongan menurut peruntukannya.
1. Golongan A, yaitu air yang dapat digunakan sebagai air minum secara langsung tanpa pengolahan terlebih dahulu.
2. Golongan B, yaitu air yang dapat digunakan sebagai air baku air minum.
3. Golongan C, yaitu air yang dapat digunakan untuk keperluan perikanan dan peternakan.
4. Golongan D, yaitu air yang dapat digunakan untuk keperluan pertanian, usaha di perkotaan, industri, dan PLTA.
Pada hakikatnya, pemantauan kualitas air pada perairan umum memiliki tujuan sebagai berikut:
1. Mengetahui nilai kualitas air dalam bentuk parameter fisika, kimia, dan biologi.
2. Membandingkan nilai kualitas air tersebut dengan baku mutu sesuai dengan peruntukannya menurut Peraturan Pemerintah Republik Indonesia No.20 tahun 1990.
2.4 Kontaminasi Logam dalam Air
Logam berat merupakan unsur esensial yang sangat dibutuhkan setiap mahluk hidup, namun beberapa diantaranya (dalam kadar tertentu) bersifat racun. Logam berat yang sering mencemari lingkungan perairan adalah Hg, Zn, Cd, As, dan Pb.
Logam berat ini dapat dibagi dalam dua jenis.Jenis pertama adalah logam berat esensial, dimana keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup,namun dalam jumlah yang berlebihan dapat menimbulkan efek racun.Contoh logam berat ini adalah Zn, Cu, Fe, Co, Mn dan lain-lain. Sedangkan jenis kedua adalah logam berat tidak esensial atau beracun, dimana keberadaanya dalam tubuh masih belum diketahui manfaatnya atau bahkan dapat bersifat racun, Seperti Hg, Cd, Pb, Cr dan lain-lain (Purnomo, D., 1991).
Menurut Fortner dan Porsi, faktor yang menyebabkan logam berat dikelompokkan ke dalam zat pencemar adalah:
1. Logam berat tidak dapat terurai melalui biodegradasi seperti pencemar organik.
2. Logam berat dapat terakumulasi dalam lingkungan terutama dalam sedimen sungai dan laut karena dapat terikat dengan senyawa organik dan anorganik melalui proses adsorpsi dan pembentukan senyawa kompleks (U.Fortsner,F Prosi., 1978).
2.4.1 Besi (Fe)
Besi merupakan salah satu unsur logam transisi golongan VIIIB yang mudah ditempa, mudah dibentuk, berwarna putih perak, memiliki nomor atom 26 dan mudah dimagnetisasi pada suhu normal. Logam besi terdapat dalam tiga
bentuk, yaitu α - iron (alpha-iron), γ - iron (gamma-iron), dan δ - iron (delta-iron). Perbedaan dari tiap bentuk besi tersebut adalah dari susunan atom-atom pada kisi kristal. Secara kimia besi merupakan logam yang cukup aktif, hal ini karena besi dapat bersenyawa dengan unsur-unsur lain, seperti unsur-unsur halogen (fluorin, klorin, bromin, iodin, dan astatin), belerang, fosfor, karbon, oksigen,dan silikon. Di alam,besi terdapat dalam bentuk senyawa-senyawa antara lain sebagai hematit (Fe2O3), magnetik (Fe2O4), pirit (FeS2), dan diderit (FeCO3). Besi murni diperoleh
dari proses elektroforesis dari larutan besi sulfat (Sunardi, 2006). Pada umumnya besi bersifat:
1. Terlarut sebagai Fe2+ (Fero) atau Fe 3+(Feri), contoh reaksi antara Fe2+ + H2O FeO + 2 H (C.H. Langford,1990)
2. Tersuspensi sebagai butiran koloidal (diameter < 1μm) atau lebih besar
sepertiFe2O3, FeO, FeOOH, Fe(OH)3 dan sebagainya.
Pada air permukaan jarangditemukan kadar besi (Fe) lebih besar dari 1mg/l, tetapi di dalam air tanah kadar besi(Fe) dapat jauh lebih tinggi. Konsentrasikadar besi (Fe) yang tinggi ini dapatdirasakan dan dapat menodai kain, danperkakas dapur. Pada air yang tidakmengandung oksigen (O2)seperti air
tanah, besi berada sebagai Fe2+ (ferro)yang cukup dapat terlarut, sedangkan padaair sungai yang mengalir dan terjadi aerasi,Fe2+ teroksidasi menjadi Fe3+. Fe3+ini sulitlarut pada pH 6 sampai 8 (kelarutan hanya dibawah beberapa μm/1),
bahkan dapatmenjadi ferihidroksida Fe(OH)3 atau salahsatu jenis oksida yang
merupakan zat padatdan bisa mengendap. Demikian pula dalamair sungai, besi berada sebagai Fe2+, Fe3+ terlarut dan Fe3+ dalam bentuk senyawaorganik berupa koloid (Alaerts, G. 1987).
2.4.1.1 Efek Toksik
Besi (Fe) adalah metal berwarna putih kecoklatan, liat dan dapat dibentuk, di alam didapat sebagai hematite, di dalam air minum besi menimbulkan rasa, warna kuning, pengendapan pada dinding pipa, pertumbuhan bakteri besi dan kekeruhan. Besi dibutuhkan oleh tubuh manusia dalam pembentukan haemoglobin, banyaknya besi di dalam tubuh dikendalikan pada fase absorbsi, tubuh manusia tidak dapat mengekskresikan besi, karenanya bagi mereka yang sering mendapat transfusi darah, warna kulitnya menjadi hitam karena akumulasi besi (Fe).
Kelebihan zat besi (Fe) bisa menyebabkan keracunan dimana terjadi muntah, kerusakan usus, penuaan dini, kematian mendadak, mudah marah, radang sendi, cacat lahir, kanker, hepatitis, hipertensi, infeksi, insomnia, sakit liver, masalah mental, rasa logam di mulut, rematik, sikoprenia, sariawan, perut, sickle-cell anemia, keras kepala sirosis ginjal, sembelit, diabetes, diare, pusing, mudah lelah, kulit kehitam-hitaman, sakit kepala, gangguan penyerapan vitamin dan mineral, serta hemokromatis (Parulian, 2009).
2.4.2Tembaga (Cu)
Tembaga (Cu) adalah salah satu logam dari golongan alkali IA dengan nomor atom 29; berat atom 63,546; diameter 8,92 ; adalah titik lebur 1083ºC; titik didih 2310ºC; jari-jari atom1,173 Å; sedangkan jari-jari ion 0,96 Å. Cu merupakan logam transisi yang berwarna jingga kemerahan tidak reaktif terhadap asam-asam encer seperti HCl dan H2SO4encer kecuali HNO3dan H2SO4 pekat yang
dipanaskan. Senyawa Cu(II) lebih stabil dalam larutan. Logam Cu dapat bersifat racun apabila bereaksi dengan larutan atau zat kimia lain dan memebentuk ion Cu(II) (M. Natsir Arsyad, 2001).
2.4.2.1 Efek Toksik
Dalam jumlah besar tembaga (Cu) dapat menyebabkan rasa yang tidak enak di lidah, selain dapat menyebabkan kerusakan pada hati (Sutrisno, 2004).
Sesuai dengan sifatnya sebagai logam berat beracun, Cu dapat mengakibatkan keracunan secara akut dan kronis.
a. Keracunan Akut
b. Keracunan Kronis
Pada manusia, keracunan Cu secara kronis dapat di lihat dengan timbulnya penyakit Wilson dan Kinsky. Gajala dari penyakit Wilson ini adalah terjadi hepatic cirrhosis, kerusakan pada otak dan demyelinasi, serta terjadi penurunan kerja ginjal dan pengendapan Cu dalam kornea mata. Penyakit Kinsky dapat diketahui dengan terbentuknya rembut yang kaku dan berwarna kemerahan pada penderita (Palar, H. 2008).
2.5 Destruksi
Teknik destruksi yang digunakan adalah Destruksi basah. Destruksi basah merupakan proses perombakan logam organik dengan menggunakan asam kuat, baik tunggal maupun campuran, kemudian dioksidasi menggunakan zat oksidator sehingga dihasilkan logam anorganik bebas. Destruksi basah sangat sesuai untuk penentuan unsur-unsur logam yang mudah menguap.Pelarut- pelarut yang dapat digunakan untuk destruksi basah adalah HNO3 dan HClO4.Pelarut-pelarut tersebut
dapat digunakan secara tunggal maupun campuran.Kesempurnaan destruksi ditandai dengan diperolehnya larutan jernih pada larutan destruksi yang menunjukkan bahwa semua konstituen yang ada telah larut sempurna atau perombakan senyawa-senyawa organik telah berjalan dengan baik (Raimon, 1993).
Menurut Sumardi (1981) metode destruksi basah lebih baik daripada cara kering karena tidak banyak bahan yang hilang dengan suhu pengabuan yang sangat tinggi. Hal ini merupakan salah satu faktor mengapa cara basah lebih sering digunakan oleh para peneliti. Di samping itu destruksi dengan cara basah biasanya dilakukan untuk memperbaiki cara kering yang biasanya memerlukan waktu yang lama.Kegunaan dari Destruksi Basah :
• Memperoleh unsur sampel dalam bentuk yang sesuai dengan metode yang digunakan.
• Mengurangi gangguan dari unsur lain atau zat pengotor
2.6 Adsorpsi
Salah satu metode yang digunakan untuk menghilangkan zat pencemardari air limbah adalah adsorpsi.Adsorpsimerupakan terjerapnya suatu zat (molekul atau ion) pada permukaan adsorben.Mekanisme penjerapan tersebut dapat dibedakan menjadi duayaitu, jerapansecara fisika (fisisorpsi) dan jerapan secara kimia (kemisorpsi). Pada prosesfisisorpsi gaya yang mengikat adsorbat oleh adsorben adalah gaya-gaya van derWaals. Molekul terikat sangat lemah dan energi yang dilepaskan pada adsorpsifisika relatif rendah sekitar 20 kJ/mol. Sedangkan pada prosesadsorpsi kimia, interaksi adsorbat dengan adsorben melalui pembentukan ikatankimia. Kemisorpsi terjadi diawali dengan adsorpsi fisik, yaitu partikel-partikeladsorbat mendekat ke permukaan adsorben melalui gaya van der Waals ataumelalui ikatan hidrogen. Kemudian diikuti oleh adsorpsi kimia yang terjadisetelah adsorpsi fisika.Dalam adsorpsi kimia partikel melekat pada permukaandengan membentuk ikatan kimia (biasanya ikatan kovalen), dancenderungmencari tempat yang memaksimumkan bilangan koordinasi dengan substrat(Atkins, 1999).
Proses adsorpsi antara abu cangkang keong mas dengan logam terjadi karena adanya gaya van der Walls yang terbentuk dari perbedaan muatan antara adsorbat terhadap oksida logam yang bersifat elektronegatif disamping itu juga terjadi ion exchange (pertukaran ion) antara kation yang terjadi terhadap kisi struktur CaO dengan Cu (Setiaka, 2011).
Hal ini juga sejalan dengan penelitian yang dilakukan oleh Setiaka, (2011), yang menyatakan bahwa ikatan van der Waals yang terjadi antara adsorben dan adsorbat merupakan ikatan yang lemah karena kesetimbangan adsorbsi reversibel (dapat terjadi reaksi balik) dan berlangsung cepat sehingga mudah untuk diganti dengan molekul yang lain. Mekanisme reaksi yang melibatkan bentuk oksida pada logam yang bereaksi dengan air adalah:
Selanjutnya mekanisme yang terjadi adalah adsorpsi terhadap ion Cu2+. Adanya proses adsorpsi ion Cu2+ oleh adsorben ini disertai dengan pelepasan ion H+ Karena proses adsorpsi terjadi prinsip pertukaran ion (ion exchange). Ion H+ pada bentuk hidroksida akan mudah lepas dan mengakibatkan ion tembaga akan terikat dan teradsorps secara kuat. Reaksinya adalah sebagai berikut:
Ca(OH)2(s) + 2Cu2+ → Ca(OCu)2(s) + 2H+(aq)
Adsorpsi pada abu cangkang keong mas ini disebabkan adanya kandungan mineral oksida (CaO).
2.7 Spektrofotometer Serapan Atom
Spektrometri merupakan suatu metode analisis kuantitatif yang pengukurannya berdasarkanbanyaknya radiasi yang dihasilkan atau yang diserap oleh spesi atom atau molekul analit.Salah satubagian dari spektrometri ialah Spektrometri Serapan Atom (SSA), merupakan metode analisis unsure secara kuantitatif yang pengukurannya berdasarkan penyerapan cahaya dengan panjang gelombangtertentu oleh atom logam dalam keadaan bebas (Skoog et. al., 2000).
Sejarah SSA berkaitan erat dengan observasi sinar matahari.Pada tahun 1802 Wollastonmenemukan garis hitam pada spektrum cahaya matahari yang kemudian diselidiki lebih lanjut olehFraunhofer pada tahun 1820. Brewster mengemukakan pandangan bahwa garis Fraunhofer inidiakibatkan oleh proses absorpsi pada atmoser matahari. Prinsip absorpsi ini kemudian mendasariKirchhoff dan Bunsen untuk melakukan penelitian yang sistematis mengenai spektrum dari logamalkali dan alkali tanah.Kemudian Planck mengemukakan hukum kuantum dari absorpsi dan emisisuatu cahaya. Menurutnya, suatu atom hanya akan menyerap cahaya dengan panjang gelombangtertentu (frekwensi), atau dengan kata lain ia hanya akan mengambil
2.7.1 Prinsip dasar Spektrofotometer Serapan Atom
Prinsip dasar Spektrofotometri serapan atom adalah interaksi antara radiasi elektromagnetik dengan atom.Spektrofotometri serapan atom merupakan metode yang sangat tepat untuk analisis zat pada konsentrasi rendah Teknik ini adalah teknik yang paling umum dipakai untuk analisis unsur (Khopkar, 2003).
Cara kerja Spektroskopi Serapan Atom ini adalah berdasarkan atas penguapan larutan sampel, kemudian logam yang terkandung di dalamnya diubah menjadi atom bebas. Atom tersebut mengapsorbsi radiasi dari sumber cahaya yang dipancarkan dari lampu katoda (Hollow Cathode Lamp) yang mengandung unsur yang akan ditentukan. Banyaknya penyerapan radiasi kemudian diukur pada panjang gelombang tertentu menurut jenis logamnya (Darmono,1995)
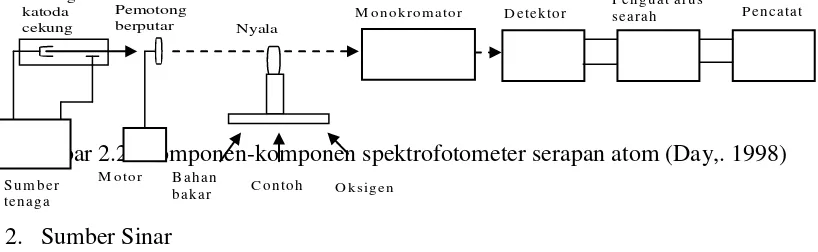
2.7.2 Intrumentasi Spektrofotometer Serapan Atom
Skematis ringkas peralatan Spektrofotometer Serapan Atom dengan nyala adalah:
Gambar 2.2. Komponen-komponen spektrofotometer serapan atom (Day,. 1998) 1.
2. Sumber Sinar
Sumber radiasi SSA adalah Hallow Cathode Lamp (HCL). Setiappengukuran dengan SSA kita harus menggunakan Hallow Cathode Lamp khususmisalnya akan menentukan konsentrasi tembaga dari suatu cuplikan. Maka kitaharus menggunakan Hallow Cathode Cu. Hallow Cathode Cu akan memancarkanenergi radiasi yang sesuai dengan energi yang diperlukan untuk transisi electron atom.
Hallow Cathode Lamp terdiri dari katoda cekung yang silindris yang terbuat dari unsur yang sama dengan yang akan dianalisis dan anoda yang terbuatdari tungsten. Dengan pemberian tegangan pada arus tertentu, logam mulaimemijar dan dan atom-atom logam katodanya akan teruapkan dengan pemercikan. Atom akan tereksitasi kemudian mengemisikan radiasi pada panjang gelombang tertentu (Khopkar, 2003).
Tabung katoda cekung
Pemotong
berputar Nyala M onokrom ator D etektor
3. Nyala
Nyala digunakan untuk mengubah sampel yang berupa padatan atau cairan menjadi bentuk uap atomnya, dan juga berfungsi untuk atomisasi. Untuk spektroskopi nyala suatu persyaratan yang penting adalah bahwa nyala yang dipakai hendaknya menghasilkan temperatur lebih dari 20000K untuk memenuhi persyaratan ini digunakan suatu gas pembakar bersama-sama dengan suatu gas pengoksidasi / oksidator, seperti udara ataupun gas dinitrogen oksida (N2O)
(Haswell,S.J.,1991). 4. Monokromator
Dalam spektroskopi serapan atom fungsi monokromator adalah untuk memisahkan garis resonansi dari semua garis yang tak diserap yang dipancarkan oleh sumber radiasi (Braun, R.D., 1982).
5. Detektor
Detektor pada spektrofotometer serapan atom berfungsi mengubah intensitas radiasi yang datang menjadi arus listrik. Pada Spektrofotometer Serapan Atom yang umum dipakai sebagai detektor adalah tabung penggandaan foton (PMT = Photo Multiplier Tube Detector) (Mulja,M., 1995)
6. Readout
Readout merupakan suatu alat petunjuk atau dapat juga diartikan sebagai sistem pencatat hasil.Pencatat hasil dilakukan dengan suatu alat yang telah terkalibrasi untuk pembacaan suatu transmisi atau absorbsi.Hasil pembacaan dapat berupa angka atau berupa kurva dari suatu recorder yang menggambarkan absorbansi atau intensitas emisi.
2.7.3 Gangguan pada SSA dan cara mengatasinya
Berbagai faktor dapat mempengaruhi pancaran nyala suatu unsur tertentu dan menyebabkan gangguan pada penetapan konsentrasi unsur.
1. Gangguan fisik alat
Gangguan fisik adalah semua parameter yang dapat mempengaruhi kecepatan sampel sampai ke nyala dan sempurnanya atomisasi.Parameterparameter tersebut adalah kecepatan alir gas, berubahnya viskositas sampel akibat temperatur nyala.Gangguan ini biasanya dikompensasi dengan lebih sering membuat kalibrasi atau standarisasi.
2. Gangguan ionisasi
Gangguan ionisasi ini biasa terjadi pada unsur-unsur alkali tanah dan beberapa unsur yang lain. Karena unsur-unsur tersebut mudah terionisasi dalam nyala.Dalam analisis dengan SSA yang diukur adalah emisi dan serapan atom yang tak terionisasi. Oleh sebab itu dengan adanya atom-atom yang terionisasi dalam nyala akan mengakibatkan sinyal yang ditangkap detektor menjadi berkurang. Namun demikian gangguan ini bukan gangguan yang sifatnya serius, karena hanya sensitivitas dan linearitasnya saja yang terganggu. Gangguan ini dapat diatasi dengan menambahkan unsur-unsur yang mudah terionisasi ke dalam sampel sehingga akan menahan proses ionisasi dari unsur yang dianalisis.
3. Gangguan akibat pembentukan senyawa refraktori
Gangguan ini dapat diakibatkan oleh reaksi antara analit dengan senyawa kimia, biasanya anion, yang ada dalam larutan sampel sehingga terbentuk senyawa yang tahan panas (refractory).Gangguan ini hanya dapat diatasi dengan menaikkan temperatur nyala, sehingga nyala yang umum digunakan dalam kasus semacam ini adalah nitrous oksida-asetilen (Agus, R. 2009).
Ada beberapa usaha untuk mengurangi gangguan kimia pada SSA yaitu dengan jalan:
a. Menaikkan temperatur nyala agar mempermudah penguraian untuk dipakai gas pembakar campuran C2H2 + NO2 yang memberikan nyala
b. Menambahkan elemen pengikat gugus atom penyangga, sehingga terikat kuat akan tetapi atom yang ditentukan bebas sebagai atom netral. Misalnya, penentuan logam yang terikat sebagai garam, dengan penambahan logam, yang lainnya akan terjadi ikatan lebih kuat dengan anion pengganggu.
c. Pengeluaran unsur pengganggu dari matriks sampel dengan cara eksitasi (Mulja, M. 1995)
2.7.4 Keuntungan Penggunaan Metode SSA
Analisis dilakukan dengan metode Spektrofotometer Serapan Atom (SSA) dengan pertimbangan bahwa
a. Metode analisis SSA dapat menentukan hamper keseluruhan logam b. Metode analisis SSA dapat menentukan logam dalam skala kualitatif
karena lampunya satu untuk setiap logam
c. Analisis unsur logam langsung dapat ditentukan walau sampel dalam bentuk campuran