BAB 2
TINJAUAN PUSTAKA
2.1 Genus Artocarpus
Genus Artocarpus merupakan salah satu genus dari Famili Moraceae yang
termasuk kepada tribe Artocarpeae. Tumbuhan genus Artocarpus terdiri dari 60
spesies dan terdistribusi mulai Srilangka, India, Pakistan, Indo China, Malaysia,
hingga kepulauan Solomon (Lemmens, 1995).
Famili Moraceae ini terdiri dari 60 genera yang terdiri dari 1400 spesies
terdistribusi di daerah tropis dan subtropis wilayah Asia. Genus Artocarpus terutama
terdiri dari pohon sukun dan nangka. Tumbuhan ini merupakan tumbuhan asli dari
Asia Selatan dan Asia Tenggara, New Guinea dan Pasifik Selatan. Tumbuhan ini
terdapat di hutan tropis biasanya ditemukan di bawah ketinggian 1.000 m.
Di Indonesia terdapat 32 spesies tumbuhan dalam genus Artocarpus ini
(Heyne, 1987). Spesies Artocarpus yang terdapat di ekosistem hutan beragam pada
habitat yang berbeda. Keragamannya yang ada di seluruh dunia bergantung pada cara
konservasi dan keadaan dari genus Artocarpus (Jagtab and Bapat, 2010), keragaman
yang paling besar adalah di Malesian. Spesies dalam genus Artocarpus terdistribusi
sebagai berikut: Malaysia 16 spesies, Sumatera 17 spesies, Borneo (Kalimantan) 23
spesies, Filipina 15 spesies, Sulawesi 6 spesies, Jawa 4 spesies, Sunda 3 spesies,
Maluku 8 spesies, dan New guenia 6 spesies (Lemmens, 1995).
2.2 Fitokimia pada Genus Artocarpus dan Aktivitas Biologi
Berdasarkan penelusuran literatur, spesies dalam genus Artocarpus
mengandung senyawa kelompok non fenol dan senyawa kelompok fenol. Senyawa
kelompok non fenol yang umumnya terdapat pada genus Artocarpus berupa senyawa
Kandungan senyawa kelompok fenol sangat beragam seperti: flavonoid, stilben, dan
santon. Flavonoid ini masih terbagi lagi atas turunan flavan, flavon, flavanon,
flavonol, dan lain-lain.
Terpenoid
Berdasarkan literatur, diketahui bahwa dari tumbuhan genus Artocarpus
diperoleh senyawa triterpen tetrasiklik dan pentasiklik. Kulit batang A.chaplasha
menghasilkan tiga senyawa yaitu: lupeol asetat 1, yang merupakan senyawa
pentasiklik, selanjutnya diperoleh senyawa triterpen tetrasiklik yaitu, sikloartenil
asetat, 2 dan isosikloartenol asetat, 3 (Shieh et al., 1992). Triterpen pentasiklik
lainnya adalah asam betulinat 4 yang berasal dari ekstrak heksana dan ekstrak
benzene kulit batang A. heterophyllus (Venkataraman, 1972).
1 2
Lupeol asetat ini diperoleh pula dari kulit akar segar A.communis (Shieh et
al., 1992). Triterpen sikloartenol 5, dan sikloartenon 6, diperoleh dari
A.heterophyllus, sedangkan dari A. elasticus reinw, dan A.communis diperoleh
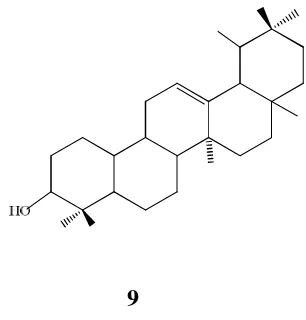
triterpen pentasiklik lupeol 7, α- amirin 8, dan β-amirin 9 (Venkataraman, 1972).
5 6
9
Distribusi senyawa triterpen tetrasiklik dan pentasiklik yang telah ditemukan
pada genus Artocarpus ditunjukkan pada Tabel 2.1 berikut.
Tabel 2.1. Distribusi senyawa triterpen yang telah ditemukan pada genus Artocarpus
Nama senyawa Nama spesies
Lupeol asetat, 1
Sikloartenol, 5
A.chaplasha, A. heterophyllus, A. nobilis,
A. altilis, A. lakoocha
Sikloartenon, 6 A. heterophyllus, A. nobilis, A. altilis,
A. lakoocha
Isosikloartenol asetat, 3 A.chaplasha
Sikloartenil asetat, 2 A.chaplasha, A. heterophyllus, A. nobilis,
A. altilis, A. lakoocha
Lupeol, 7 A. communis, A. elasticus
α-amirin, 8dan β-amirin, 9 A. communis, A. elasticus,
A. heterophyllus
Steroid
Mahato (1971), melaporkan bahwa senyawa steroid yaitu β-sitosterol, 10 telah
diisolasi dari tumbuhan A. chaplasha. β-sitosterol ini diperoleh juga dari A.communis
(Shieh et al., 1992).
10 Betasitosterol
Nama IUPAC : 5-Kolesten-24p-etil-3p-ol
Rumus molekul : C29H50O
Nama lain : (24R)-etilkolest-5-en-3-β-ol, betasitosterin, 24 -α
etilkolesterol, cinchol
Betasitosterol termasuk ke dalam kelompok steroid yang jalur
biosintesisnya searah dengan terpenoid. Terpenoid disebut juga isoprenoid
salah satu kelompok dari molekul hasil alam (natural product). Pembentukan
terpenoid secara kimia adalah dengan cara bergabungnya unit isopren dan
membentuk senyawa dengan berbagai cara yang berbeda. Hampir semua
struktur yang multi siklik bergabung satu dengan yang lain tidak hanya dengan
gugus fungsi, tapi juga dengan rangka dasar karbon. Terpenoid yang lebih besar
merupakan komponen yang penting untuk metabolisma makhluk hidup
termasuk hormon adrenal seperti testosterone dan estrogen, komponen membran
kolesterol, dan larutan lipid.
dari tumbuhan, tetapi untuk hal-hal tertentu. Metabolit sekunder ini mempunyai
fungsi yang berbeda, termasuk memberi bau, rasa, mengatur pertumbuhan,
penarik serbuk sari, dan komponen rosin.
Bahan alam, termasuk terpenoid, dari dahulu telah dipakai di dalam bidang
farmasi, pertanian, dan pemakaian komersil lain, seperti pengobatan kanker.
Terpen dengan berat molekul kecil selalu digunakan untuk parfum dan pemberi rasa.
Steroid dianggap berasal dari terpenoid, karena pada jalur biosintesisnya,
steroid diturunkan dari squalene, yang juga merupakan senyawa pembentuk
triterpene. Secara garis besar jalur biosintesisnya sebagai berikut. Senyawa precursor
dimulai dari senyawa asetil ko enzim A, yang bergabung sebanyak 2 molekul,
dengan beberapa jalur reaksi selanjutnya membentuk asam mevalonat. Setelah
mengalami beberapa tahap reaksi akan membentuk DMAPP (dimetilallil piropospat)
dan isomernya IPP (isopentenilpiropospat). Kedua senyawa ini bergabung dan
membentuk monoterpen. Monoterpen selanjutnya bergabung lagi dengan unit isopren
baru membentuk sesquiterpen (farnesilpiropospat). Dua molekul farnesilpiropospat
membentuk skualen, selanjutnya teroksidasi menjadi 2,3-epoksiskualen, yang dalam
suasana asam membentuk lanosterol (terpenoid). Lanosterol kehilangan 3 gugus
metil, yaitu dua dari atom C-4 dan satu dari C-14 membentuk kolesterol (steroid).
Reaksi biosintesis terpenoid sendiri dimulai dari asetilcoenzim A, reaksinya
seperti terdapat pada Gambar 2.2 berikut.
Hasil penelusuran literatur, suatu senyawa β-sitosterol asetat, merupakan
senyawa β-sitosterol yang bereaksi dengan asam asetat. Gugus OH pada β-sitosterol
bereaksi dengan asam asetat membentuk ester β-sitosterol asetat.
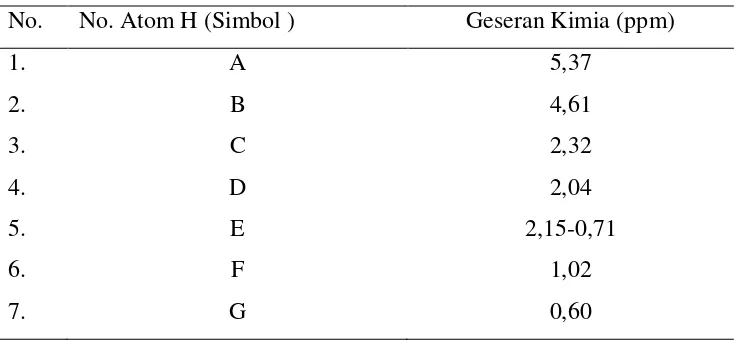
Geseran kimia yang terdapat pada β-sitosterol asetat dapat dilihat pada Gambar 2.3 di
bawah ini (http://www.chemicalbook.com/spektrum EN).
Gambar 2.3. Struktur β-sitosterol asetat dengan geseran kimia proton
Geseran kimia pada atom H tertentu pada β-sitosterol asetat Gambar 2.3
terdapat pada Tabel 2.2 berikut ini.
Tabel 2.2. Geseran kimia pada atom H pada β-sitosterol asetat
No. No. Atom H (Simbol ) Geseran Kimia (ppm)
1. A 5,37
2. B 4,61
3. C 2,32
4. D 2,04
5. E 2,15-0,71
6. F 1,02
Penyebaran β-sitosterol
Beta-sitosterol adalah sterol yang ditemukan pada tanaman, yang merupakan
subkomponen utama kelompok sterol yang dikenal sebagai pitosterol. Senyawa ini
berwarna putih dan memiliki struktur kimia yang sangat mirip dengan kolesterol.
Beta-sitosterol banyak ditemukan dalam dedak padi, bibit gandum, minyak jagung,
dan kedelai.
Manfaat β-sitosterol a. Mengontrol Kolesterol
Selama tiga dekade terakhir β-sitosterol telah diketahui dapat mengurangi
kadar kolesterol. Struktur β-sitosterol mempunyai kemiripan dengan kolesterol,
sehingga dapat memblokir penyerapan kolesterol dengan cara penghambatan
kompetitif. Meskipun β-sitosterol tidak diserap dengan baik oleh tubuh (5-10%), bila
dikonsumsi dengan kolesterol secara efektif memblokir penyerapan kolesterol, yang
mengakibatkan menurunkan kadar kolesterol serum. Beta-sitosterol juga dapat
meningkatkan profil lipoprotein (HDL, LDL).
b.Meningkatkan Kesehatan Prostat
Mencegah dan mengobati masalah prostat seperti benign prostatic
hyperplasia (BPH), dengan mengkonsumsi beberapa jenis herba seperti: ekstrak
palmetto, Pygeum africanum, jelatang menyengat, dan biji labu, yang mengandung
β-sitosterol.
Mekanisma kerja β-sitosterol dalam hal meningkatkan kesehatan prostate
belum diketahui, namun dalam suatu studi dikatakan bahwa β-sitosterol dapat
mengaktivasi siklus sphingomyelin dan menginduksi apoptosis di LNCaP sel kanker
prostat manusia secara invitro. Ada juga laporan yang menunjukkan bahwa β
c. Mempunyai Efek Anti-Kanker
Beta-sitosterol bertindak melawan kanker, dengan cara mengurangi
pertumbuhan prostat manusia dan sel kanker usus besar. Βetasitosterol juga dapat
mencegah leukemia limfositik.
d. Meningkatkan Kekebalan
Beta-sitosterol dapat meningkatkan kekebalan atlet yang sering menderita
tekanan kekebalan dan mengurangi respon inflamasi selama masa latihan dan
kompetisi. Beta-sitosterol telah menunjukkan tidak hanya untuk meningkatkan
kekebalan tubuh tetapi juga untuk meningkatkan proliferasi limfosit dan aktivitas sel.
Hal ini sangat berguna untuk orang-orang yang secara fisik stres, secara medis tidak
sehat atau baru sembuh dari sakit.
e. Menormalkan Gula Darah
Beta-sitosterol telah terbukti dapat menormalkan gula darah pada penderita
diabetes tipe II dengan merangsang pelepasan insulin yaitu dengan kehadiran
konsentrasi glukosa non-stimulasi, dan menghambat glukosa-6-fosfatase.
Di dalam hati, enzim glukosa-6-fosfatase adalah jalur utama untuk konversi
karbohidrat menjadi gula darah. Glukosa-6-fosfatase dephosphorylates
glukosa-6-fosfat menghasilkan D-glukosa bebas. D-glukosa bebas masuk ke dalam darah,
sehingga meningkatkan kadar gula darah.
Mengurangi kadar glukosa darah dengan down-regulasi glukosa-6-fosfatase
dapat membantu memperlambat diabetes yang disebabkan oleh usia tua.
Selain hal di atas β-sitosterol juga memiliki kemampuan untuk meredakan
peradangan, menyembuhkan borok, meningkatkan denyut rahim dan mengurangi
kram. Betasitosterol ini juga memiliki aktivitas anti-virus, anti-bakteri dan anti-jamur
Kelompok Senyawa Turunan Flavonoid
Penelitian terdahulu pada batang tumbuhan A.altilis (A. communis) diperoleh
senyawa-senyawa flavon yaitu: isosiklomulberin 11, sikloaltilisin 12, siklomorusin
13, siklomulberin 14, (Chen, 1993)
11 12
13 14
Isolasi pada kulit akar A.communis oleh Lin (1992), diperoleh:
piranoflavonoid yaitu siklokomunol 15, siklokomunin 16, dan dihidrosikloartomunin
17.
17
Shieh (1992), memperoleh senyawa flavonoid dengan rangka santon dari akar
tumbuhan A. communis yaitu artomunosanton 18, artomunosantentrion 19, dan
artomunosantentrion epoksida 20.
18 19
O
OH O
OMe
O
O O
O
20
Aida (1997), memperoleh piranobenzosanton, yaitu artobilosanton 21, dan
yaitu: artonol A 23, artonol B 24, artonol C 25, artonol D 26, dan artonol E 27 dari
tumbuhan A. communis.
21 22
23 24
27
Senyawa flavon terprenilasi, yaitu senyawa sikloartokarpin 28, artokarpin 29,
dan kaplasin 30, diisolasi dari ekstrak diklorometana dari akar dan batang
A.communis, sedangkan morusin 31, sikloartobilosanton 22, artonin E 32, and
artobilosantone 21 diisolasi dari akar yang mempunyai aktivitas antituberkulose
dengan konsentrasi daya hambat minimum (MIC) antara 3,12-100 g/mL (Jagtab
and Bapat, 2010).
28 29
32
Enam senyawa kimia yang diisolasi dari korteks akar Artocarpus, communis
(Weng et al., 2006) adalah empat flavonoid baru, yaitu: dihidroartomunosanton 33,
artomunoisosanton 34, siklokomunometanol 35, dan artomunoflavanon 36,
bersama-sama dengan dua senyawa yang telah dikenal, yaitu: artohamins B 37, dan
artokommunol 38. Dihidroartomunosantone 33, artohamins B 37, dan
artokommunol 38 yang diisolasi dari korteks akar A. communis menunjukkan efek
antiplatelet pada makhluk hidup. Senyawa ini menunjukkan daya hambat yang
signifikan pada agregasi sekunder yang diinduksi dengan adrenalin. Efek antiplatelet
senyawa ini yang utama disebabkan daya hambat pada pembentukan tromboksan.
(Weng et al., 2006.).
35 36
37 38
Dua prenilflavonoid baru, yaitu siklogerakomunin 39, dan artoflavon A 40,
diisolasi dari korteks akar A.communis. Bersama dengan senyawa tersebut diatas
diisolasi senyawa yang sudah dikenal yaitu: artomunoisosanton 34, artokomunol 38,
artohamin B 37, dan dihidroartomunosanton 33, (Lin et al., 2009).
Lima geranil dihidrocalcon,
1-(2,4-dihidroksifenil)-3-{4-hidroksi-6,6,9-trimetil-6a,7,8,10 a-tetrahidro-6H-dibenzo[b,d]piran-5-yl}-1-propanon (41
),1-(2,4-dihidroksifenil)-3-[3,4-dihidro-3,8-dihidroksi-2-metil-2-(4
metil-3-pentenil)-2H-1-benzopiran-5-il]-1-propanon (42),
1-(2,4-dihidroksifenil)-3-[8-hidroksi-2-metil-2-(3,4-epoksi-4-metil-1-pentenil)-2H-1-benzopiran-5-il]-1-propanon (43),
1-(2,4-dihidroksifenil)-3-[8-hidroksi-2-metil-2-(4-hidroksi-4-metil-2
pentenil)-2H-1-benzopiran-5-il]-1-propanon (44),and 2-[6-hidroksi
3,7-dimetilokta-2(E),7-dienil]-20,3,4,40-tetrahidroksidihidrocalcon (45), yang diisolasi dari daun A. altilis (Wang
et al., 2007).
41 42
45
Penelitian terhadap bagian tumbuhan A. communis relatif telah sempurna,
senyawa kimia dari bagian tumbuhan A. communis yang telah diteliti, aktivitas
biologinya dan penelitinya terdapat pada Tabel 2.3 berikut (Jones, et al., 2011).
Tabel 2.3. Senyawa kimia dari bagian tumbuhan Artocarpus communis yang telah
diteliti, aktivitas biologinya dan penelitinya
No. Senyawa Bagian Tanaman Aktivitas
Tabel 2.3 (Sambungan)
No. Senyawa Bagian Tanaman Aktivitas
Tabel 2.3 (Sambungan)
No. Senyawa Bagian Tanaman Aktivitas
Biologi 63 Cycloaltilisin 6 Influorescen stipule Patil et al., 2002 64 Cycloartenyl acetate Buah Amarasinghe et al.,
2008
65 Cycloartobiloxanthone Tidak tertentu Hakim et al., 2006 66 Cycloartocarpin Tidak tertentu Hakim et al., 2006 67 Cycloartomunin Kulit akar Nomura et al., 1998 68 Cycloartomunoxanthone Kulit akar Nomura et al., 1998 69 Cyclocommunin Kulit akar Nomura et al.1998 70 Cyclocommunol Kulit akar Nomura et al., 1998 71 Cyclocomunomethonol Kulit akar Wang et al., 2006 72 Cyclohexyl benzene Buah Iwaoka et al., 1994 73. Cyclomorucin Tidak tertentu Nomura et al., 1998 74 Cyclomulberrin Tidak tertentu Nomura et al., 1998 75 Cyclopentanol Buah (segar dan masak ) Iwaoka et al., 1994 76 Cycloaltilisin 7 Influorescen stipule Patil et al., 2002 77 Diethylen glycol monoethyl
ether
Buah (segar dan masak ) Iwaoka et al., 1994
78 Dihyroartomunoxanthone Kulit akar Wang et al., 2006 79 Dihydrocycloartomunin Kulit akar Nomura et al., 1998 80 Dihydroisocycloartomunin Kulit akar Nomura et al., 1998 81 Dimethylbenzenepropionic
acid
Buah (masak) Iwaoka et al., 1994
Tabel 2.3 (Sambungan)
No. Senyawa Bagian Tanaman Aktivitas
Biologi
Trans-2(or4)-2.3 Artocarpus camansi (Kulu)
Taksonomi Tanaman Artocarpus camansi
Dalam sistematika (taksonomi) tumbuh-tumbuhan, tanaman A.camansi dapat
diklasifikasikan sebagai berikut (Ragone, 2006):
Malaya, Jawa : Kelur, kulor, kulur, kuror
Botani Tanaman A. camansi, breadnut
Artocarpus camansi Blanco, famili Moraceae ( family Mulberry) merupakan
tumbuhan dengan tinggi 10-15 m (33-50 ft) dengan cabang utama sepanjang 5 m
atau lebih, bergetah berwarna putih pada setiap bagian tumbuhan.
Bunga berumah 1 yaitu bunga jantan dan bunga betina pada tumbuhan yang
sama pada ujung cabang, bunga jantan muncul lebih dahulu. Bunga jantan berbentuk
tongkat panjang yang biasa disebut ontel. Bunga betina berbentuk bulat bertangkai
pendek yang biasa disebut babal seperti pada nangka. Bunga betina ini merupakan
bunga majemuk sinkarpik seperti pada nangka. Daun alternate, besar dan panjangnya
40-60 cm (12-24 in). Gambaran pohon A.camansi dan buahnya terdapat pada
Gambar 2.4.
Penelusuran literatur yang dilakukan, penelitian terhadap senyawa kimia pada
tumbuhan A. camansi ini masih sangat kurang dibandingkan dengan kerabat satu
spesies yang sangat mirip yaitu A.altilis atau sukun.
Penelitian yang telah dilakukan umumnya terhadap biji dari buah A.camansi.
dan memperoleh hasil bahwa biji tumbuhan ini mengandung protein 4,8%, lemak
3,48%, karbohidrat 26,11%, sedangkan debu dan seratnya adalah 3,43 dan 1,20%.
(a)
(b) (c)
Gambar 2.4. Beberapa bagian pohon Artocarpus camansi dan buahnya.
(a). Pohon A.camansi
(b). Bahagian dalam buah A.camansi
(c). Bahagian luar buah A.camansi
Biji tumbuhan ini mengandung posfor, kalium, dan natrium yang tinggi, dan
leusine, isoleusine, lisine. Minyaknya kaya akan asam palmitat, oleat, linoleat, laktat,
dan sitrat, sedangkan asam malat, asetat, dan butirat ada dalam jumlah kecil. Biji
A.camansi dapat digunakan sebagai tepung, dan minyaknya sebagai sumber minyak
yang baik untuk dimakan.
Pemakaian sehari-hari buah A. camansi adalah untuk bahan makanan yang
dapat direbus sebagai sayuran dan sebagai bahan untuk sop. Buahnya mengandung
protein yang tinggi (13-20%), dan rendah lemak (6-29%). (Ragone, 1997).
2.4 Mekanisme Regulasi Glukosa Darah
Pankreas manusia memiliki 1-2 juta pulau Langerhans. Sel-sel di dalam pulau
Langerhans berdasarkan morfologinya dibagi menjadi 4 sel dan masing-masing sel
menghasilkan hormon, yaitu sel A (sel-α) yang menghasilkan glukagon, sel B (sel-β)
menghasilkan insulin, sel D menghasilkan somatostatin serta sel F menghasilkan
polipeptida pankreas. Insulin dan glukagon memiliki fungsi penting dalam
pengaturan metabolisme karbohidrat, protein dan lemak. Insulin bersifat anabolik
dengan meningkatkan simpanan glukosa, asam amino dan asam lemak, sedangkan
glukagon bersifat katabolik dengan memobilisasi glukosa, asam amino dan asam
lemak dari penyimpanan ke dalam aliran darah (Karam, 1998).
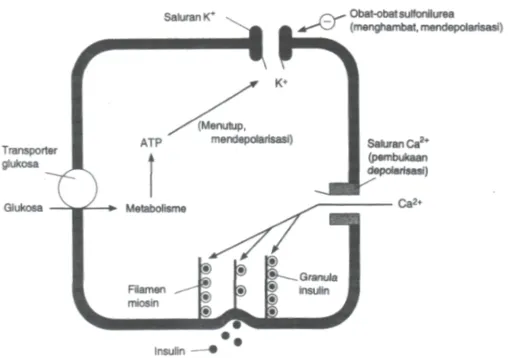
Pelepasan insulin dirangsang oleh sejumlah besar zat endogen dan eksogen.
Glukosa merupakan salah satu zat eksogen yang menjadi penentu utama fungsi sel-β
dalam mensintesis maupun melepaskan insulin. Glukosa yang berada di aliran darah
akan memasuki sel-β melalui transpor terfasilitasi yang diperantarai oleh GLUT2.
Selanjutnya glukosa mengalami proses metabolisme, diawali dengan fosforilasi
glukosa oleh glukokinase menjadi G6P dan selanjutnya mengalami glikolisis dan
siklus TCA, sehingga meningkatkan ATP intraselular dan menurunkan ADP. Akibat
meningkatnya rasio ATP/ADP, jumlah kalium yang masuk ke dalam sel berkurang
karena terjadi hambatan pada saluran kalium yang bergantung ATP. Penurunan ini
mendepolarisasi membran plasma sel-β dan menyebabkan terbukanya saluran
granula diikuti pelepasan insulin dan komponen lainnya ke sirkulasi (Lawrence,
2005). Proses pelepasan insulin terdapat pada Gambar 2.5 berikut.
Gambar 2.5. Proses pelepasan insulin (Karam, 1998)
Insulin kemudian berikatan dengan reseptornya di permukaan sel pada
jaringan target. Adapun jaringan target yang penting untuk pengaturan homeostasis
glukosa adalah hati, otot dan lemak. Selain itu, insulin juga bekerja pada sel darah, sel
otak dan sel gonad.
Reseptor insulin merupakan glikoprotein transmembran yang terdiri atas dua
subunit α dan dua subunit β yang dihubungkan oleh ikatan disulfida untuk membentuk heteroatomer β- α- α- β. Subunit α seluruhnya berada di ekstraseluler dan
mengandung domain pengikat insulin, sedangkan subunit β merupakan protein
transmembran yang memiliki aktifitas protein kinase, yakni tirosin. Setelah insulin
diikat, reseptor membentuk agregat dan secara cepat diinternalisasi. Interaksi antara
insulin dan reseptor menghasilkan sinyal yang ditransmisikan ke dalam sel untuk
anabolik insulin ini mencakup transpor glukosa, sintesis glikogen, lipid dan protein.
Transpor glukosa ke dalam sel otot rangka dan adiposa diperantarai oleh GLUT4.
Insulin juga meningkatkan pemasukan glukosa ke dalam sel hati, tetapi bukan
melalui peningkatan jumlah GLUT4 di membran sel, melainkan dengan memicu
glukokinase. Hal ini meningkatkan fosforilasi glukosa sehingga kadar glukosa bebas
intrasel tetap rendah, mempermudah masuknya glukosa ke dalam sel (Ganong, 2005).
Glukosa dalam sel selanjutnya dapat dimetabolisme dengan banyak cara. Glukosa
dapat dioksidasi melalui jalur Embden-Meyerhof dan daur Kreb untuk menghasilkan
energi. Selain itu glukosa juga digunakan untuk memperoleh kofaktor tereduksi yang
perlu untuk reaksi biosintetik.
Dalam otot rangka dan hati, glukosa disimpan dalam bentuk glikogen
(glikogenesis) untuk dapat dipakai kembali (glikogenolisis). Di dalam sel lemak,
glukosa dimetabolisme menjadi asetil koA yang kemudian digunakan untuk
mensintesis asam lemak. Pengesteran asam lemak dengan gliserol menghasilkan
trigliserida yang merupakan bentuk penyimpanan energi (Foye, 1996).
2.5 Diabetes Melitus
Diabetes melitus adalah sekumpulan gejala akibat gangguan metabolisme
lemak, karbohidrat dan protein karena defisiensi insulin, baik karena kurangnya
sekresi insulin, kurangnya aktifitas insulin maupun keduanya. Akibatnya terjadi
penurunan pemasukan glukosa ke dalam berbagai jaringan perifer dan peningkatan
pelepasan glukosa ke dalam sirkulasi dari hati. Dengan demikian terjadi kelebihan
glukosa ekstrasel dan pada banyak sel terjadi defisiensi glukosa intrasel.
Hiperglikemia yang terjadi menyebabkan glikosuria dan diuresis osmotik yang
menyebabkan dehidrasi. Dehidrasi menimbulkan polidipsia. Karena defisiensi
glukosa intrasel, nafsu makan meningkat, glukosa dibentuk dari protein
(glukoneogenesis), dan pasokan energi dipertahankan dengan metabolisme protein
dan lemak. Akibatnya terjadi penurunan berat badan, defisiensi protein, dan
Katabolisme lemak meningkat, dan sistem dibanjiri oleh trigliserida dan asam
lemak bebas. Sintesis lemak terhambat, dan jalur katabolik yang kelebihan beban
tidak dapat mengatasi kelebihan asetil koA yang terbentuk. Di hati, asetil koA diubah
menjadi benda keton. Dua dari benda keton ini adalah asam organik, dan jika keton
menumpuk dapat menimbulkan asidosis metabolik. Deplesi Na+ dan K+ terjadi pula
pada asidosis karena kation plasma ini diekskresikan dengan anion organik yang
tidak diganti oleh H+ dan NH4+ yang disekresi oleh ginjal. Akhirnya pasien atau
hewan yang mengalami asidosis, hipovolemia, dan hipotensi menjadi komatosa
karena efek toksik asidosis, dehidrasi, dan hiperosmolaritas pada sistem saraf dan
dapat meninggal bila tidak diobati (Ganong, 2005).
2.5.1 Klasifikasi Diabetes Melitus
American Diabetes Association (ADA) pada Tahun 1997 dan WHO pada
Tahun 1999 mengklasifikasikan diabetes melitus menjadi 4 tipe berdasarkan
etiologinya yaitu tipe 1, tipe 2, tipe spesifik lainnya atau akibat penyakit tertentu,
serta diabetes melitus gestasional.
Diabetes melitus tipe 1 terjadi pada 10% dari semua kasus diabetes. Ditandai
oleh adanya lesi yang menyebabkan kerusakan sel β-pankreas baik akibat mekanisme autoimmun (90%) atau penyebab yang belum diketahui (idiopatik) sehingga terjadi
defisiensi insulin absolut. Destruksi autoimun sel β pankreas disebabkan oleh
beberapa hal,yaitu terbentuknya antibodi sel pulau, antibodi terhadap asam glutamat
dekarboksilase serta antibodi insulin.
Diabetes melitus tipe 2 terjadi pada 90% dari semua kasus diabetes dan
ditandai penurunan sekresi insulin relatif dan penurunan sensitifitas insulin (resistensi
insulin), walaupun tidak selalu. Diabetes melitus tipe 2 lebih disebabkan pola hidup
kurang gerak dan obesitas dibandingkan pengaruh genetika.
Diabetes tipe spesifik lainnya terjadi pada 1-2% dari semua kasus diabetes.
Terdiri dari dua sub golongan, yaitu sub golongan A dimana terjadi mutasi spesifik
golongan B adalah diabetes yang berhubungan dengan kondisi patologis lainnya atau
suatu penyakit. Sub golongan A diakibatkan oleh abnormalitas genetika fungsi sel β
-pankreas dan abnormalitas genetika aktifitas insulin. Sub golongan B diakibatkan
oleh penyakit pankreas eksokrin, penyakit endokrin, akibat induksi obat-obatan atau
bahan kimia, infeksi, penyakit hati, diabetes karena faktor imun yang tidak umum,
serta beberapa sindroma genetika lainnya yang sering berhubungan dengan diabetes.
Diabetes gestasional didefinisikan terjadinya intoleransi glukosa selama
kehamilan atau terdeteksi pertama sekali pada saat kehamilan. Terjadi pada sekitar
7% dari seluruh kehamilan (The Expert Committee on the Diagnosis and
Classification of Diabetes Mellitus, 1997; World Health Organization, 1999; The
Committee of the Japan Diabetes Society on the diagnostic criteria of diabetes
mellitus, 2002; Triplitt, et al., 2005).
2.5.2 Diagnosis diabetes
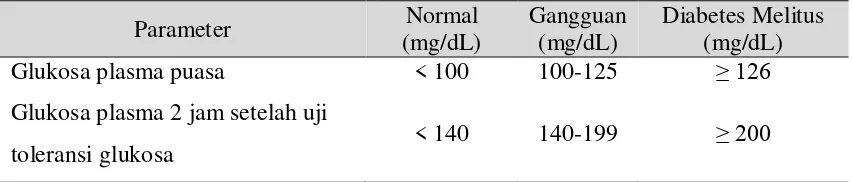
Kriteria yang dapat digunakan untuk menegakkan diagnosis diabetes melitus
adalah dari gejala yang timbul dan glukosa plasma. Adapun gejala diabetes ditandai
dengan poliuria, polidipsia serta penurunan berat badan walaupun terjadi polifagia
(peningkatan nafsu makan). Gejala lainnya adalah glikosuria, ketosis, asidosis dan
koma. Untuk parameter glukosa plasma, American Diabetes Association (ADA)
merekomendasi parameter glukosa puasa sebagai acuan utama untuk mendiagnosis
diabetes melitus pada orang dewasa. Namun selain itu bisa juga ditetapkan dari
glukosa plasma sewaktu maupun 2 jam setelah mengkonsumsi glukosa. Jika nilai
glukosa plasma masih belum dapat ditentukan dengan tegas, maka pengujian dapat
diulangi pada hari yang berbeda (Triplitt, et al., 2005). Diagnosis diabetes
Tabel 2.4. Diagnosis diabetes melitus
toleransi glukosa < 140 140-199 ≥ 200
2.5.3 Model Hewan Diabetes Melitus
Model hewan diabetes melitus digunakan untuk memvalidasi beraneka
tumbuhan obat yang diduga mempunyai potensi sebagai antidiabetes. Secara in vivo,
model hewan diabetes melitus dapat diperoleh dengan induksi secara farmakologi,
pembedahan maupun rekayasa genetika. Sebagai hewan uji, dapat digunakan hewan
pengerat (rodensia) maupun bukan pengerat (non rodensia), namun sebahagian besar
penelitian dilakukan pada hewan pengerat seperti tikus dan mencit. Hewan bukan
pengerat yang juga sering digunakan adalah kelinci, dan diklaim sebagai model
hewan yang lebih baik. (Frode dan Medeiros, 2008; Kelompok Kerja Ilmiah Phyto
Medica, 1993, Rees dan Alcolado, 2005).
Induksi secara farmakologi yang paling sering digunakan adalah dengan
menggunakan streptozotosin dan aloksan. Streptozotosin lebih dijadikan pilihan
dibandingkan aloksan karena diabetes melitus yang ditimbulkan lebih stabil dan
permanen (Frode dan Medeiros, 2008).
2.5.4 Parameter Pemeriksaan Diabetes Mellitus
Sebahagian besar publikasi ilmiah yang menggunakan induksi senyawa kimia
untuk memperoleh model diabetes mellitus, mengukur penurunan glukosa darah
setelah pemberian sampel uji berupa produk alami selama waktu tertentu. Hasilnya
dibandingkan terhadap kelompok hewan non diabetes dan/atau diabetes yang diterapi
dengan obat antidiabetes tertentu. Parameter yang diperiksa adalah glukosa darah,
2008). Pengamatan terhadap histologi pankreas juga dapat dilakukan dengan cara
mengambil pankreas dari hewan uji yang telah didekapitasi, kemudian diletakkan
dalam larutan formalin 10% dan segera diproses menggunakan parafin. Selanjutnya
pankreas dipotong setebal 5 µ m serta dilakukan pewarnaan dengan hematoksilin dan
eosin untuk pengamatan histopatologi dan diletakkan pada slide mikroskop untuk