KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL DAUN SUKUN
(Artocarpus altilis (Park.) Fosberg)
SKRIPSI
OLEH: DWI NOVIANTI
050804041
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL DAUN SUKUN
(Artocarpus altilis (Park.) Fosberg)
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH: DWI NOVIANTI
050804041
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL DAUN SUKUN
(Artocarpus altilis (Park.) Fosberg) OLEH:
DWI NOVIANTI 050804041
Dipertahankan di hadapan Panitia Penguji Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: Februari 2011
Pembimbing I, Panitia Penguji,
Dra. Suwarti Aris, M.Si., Apt. Dr. M. Pandapotan Nasution, MPS., Apt.
NIP 195107231982032001 NIP 194908111976031001
Pembimbing II, Dra. Suwarti Aris, M.Si., Apt.
NIP 195107231982032001
Dra. Aswita Hafni Lubis, M.Si., Apt.
NIP 195304031983032001 Dr. Marline Nainggolan, MS., Apt. NIP 195709091985112001
Drs. Panal Sitorus, M.Si., Apt. NIP 195310301980031002
Medan, Februari 2011 Fakultas Farmasi Universitas Sumatera Utara
Dekan,
KATA PENGANTAR
Puji syukur kepada Allah SWT atas nikmat yang tak terhingga sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi yang berjudul
“Karakterisasi Simplisia dan Isolasi Senyawa Flavonoida dari Ekstrak Etanol Daun Sukun (Artocarpus altilis (Park.) Fosberg)”. Skripsi ini diajukan sebagai salah satu syarat untuk memperoleh gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara.
Penulis mengucapkan terima kasih dengan segala ketulusan hati kepada
orangtua tercinta, ayahanda Abdul Khalik MS. dan ibunda Nurhayati atas do’a dan dukungan yang luar biasa, untuk abang dan adik-adik tersayang Mardiansyah, Nurdelima dan Mardina Ramadhani, untuk ibu Yusnizar serta Muhammad
Yusman yang telah memberikan nasehat, semangat dan pengorbanan baik moril dan material selama menempuh Pendidikan Strata 1.
Ucapan terima kasih yang sebesar-besarnya kepada Ibu Dra. Suwarti Aris, M.Si., Apt. dan Ibu Dra. Aswita Hafni Lubis, M.Si., Apt. selaku pembimbing yang telah memberikan waktu, bimbingan dengan penuh kesabaran, nasehat dan
tanggung jawab selama penelitian hingga selesainya penulisan skripsi ini. Penulis juga mengucapkan terima kasih kepada:
1. Dekan Fakultas Farmasi Universitas Sumatera Utara, Bapak Prof. Dr. Sumadio Hadisahputra, Apt. yang telah memberikan fasilitas selama masa pendidikan.
3. Bapak dan Ibu staf penguji yang telah memberikan kritik dan saran kepada penulis sehingga penulis dapat menyelesaikan skripsi ini.
4. Bapak Drs. Awaluddin Saragih, M.Si., Apt., selaku Kepala Laboratorium Obat
Tradisional dan Bapak Prof. Dr. rer nat Effendy De Lux Putra, SU., Apt. selaku Kepala Laboratorium Penelitian beserta seluruh staf yang telah
memberikan arahan dan mengizinkan penulis menggunakan fasilitas laboratorium selama penelitian.
5. Bapak/Ibu Pembantu Dekan, Bapak dan Ibu staf pengajar Fakultas Farmasi
USU yang telah memberikan didikan dan bimbingan selama penulis menuntut ilmu di Fakultas Farmasi USU
6. Sahabat-sahabat penulis: Sri Hati, Denny, Kikin, Uswa, Bang Fahmi, Pipi, Anna, Rina, bang Diding dan rekan-rekan mahasiswa Farmasi stambuk 2005 serta mahasiswa Farmasi ekstensi stambuk 2007 atas bantuan, semangat dan
persahabatan selama ini.
Penulis menyadari tulisan ini masih memiliki banyak kekurangan, oleh karena itu dengan segala kerendahan hati penulis mengharapkan kritik dan saran
yang membangun pada skripsi ini. Semoga skripsi ini bermanfaat bagi kita semua.
Medan, Februari 2011 Penulis,
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL DAUN SUKUN
(Artocarpus altilis (Park.) Fosberg)
ABSTRAK
CHARACTERIZATION OF SIMPLEX AND ISOLATION FLAVONOID COMPOUNDS FROM ETHANOL EXTRACT OF BREADFRUIT LEAVES
(Artocarpus altilis (Park.) Fosberg)
ABSTRACT
Breadfruit leaves (Artocarpi altilis folium) is one of the plants part that have been used to treatment, such as decoction water of breadfruit leaves according to empirical can be used to treat diabetes and hypertension. One of chemistry compounds of breadfruit leaf is flavonoid. The research objective would be to know characteristics of simplex and isolating flavonoid compounds of breadfruit leaves. The powdered simplex was examined characterized, phytochemical screening, extracted by percolation using 96% ethanol, and fractionated by liquid extraction using n-hexane, chloroform and ethylacetate solvent. The ethylacetate fraction was separated by preparative paper chromatography using 15% acetic acid as mobile phase, visualisation using 5% b/v aluminium chloride and 366 nm UV ray. The isolate were identified by UV spectrophotometer using shift reagent. The macroscopic examination result from breadfruit leaves simplex are leaf edges rolled, wrinkled leaf, intersperse leaf, incision in the edge, length 40-46 cm, width 30-33 cm and greenish brown color. The microscopic of simplex powder showed anomositic stomata, covering hairs, calcium oxalate crystal shaped druse, secretion gland and systolit. The determination result of water content was 6,66%, water soluble extract 12,60%, ethanol soluble extract 11,40%, total ash 14,20% and acid insoluble ash 4,20%. Phytochemical screening result of simplex powder showed flavonoids, saponins, steroids/triterpenoids, tannins and glycosides. The isolate result obtained three flavonoids, F1 has Rf = 0,12, indicated that F1 is flavonol with hydroxyl groups in position 3,7. F4 has Rf = 0, 67, indicated that F4 is flavanon and F5 has Rf = 0,73, indicated that F5 is flavanon.
Keywords: breadfruit leaves, characterization, isolation, flavonoids.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
BAB I PENDAHULUAN ... 1
1.1 Latar belakang ... 1
1.2 Perumusan masalah ... 2
1.3 Hipotesis ... 2
1.4 Tujuan ... 3
1.5 Manfaat ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian tumbuhan ... 4
2.1.1 Habitat (daerah tumbuh) ... 4
2.1.2 Sistematika tumbuhan ... 4
2.1.3 Nama daerah ... 5
2.1.4 Morfologi tumbuhan ... 5
2.1.6 Khasiat tumbuhan ... 5
2.2 Senyawa flavonoida ... 5
2.3 Ekstraksi ... 9
2.4 Kromatografi ... 11
2.5 Spektrofotometri UV ... 14
BAB III METODOLOGI PENELITIAN ... 16
3.1 Alat-alat ... 16
3.2 Bahan-bahan ... 16
3.3 Pengumpulan dan pengolahan daun tumbuhan sukun ... 17
3.3.1 Pengambilan daun tumbuhan sukun ... 17
3.3.2 Identifikasi tumbuhan ... 17
3.3.3 Pembuatan simplisia ... 17
3.4 Pembuatan larutan pereaksi ... 18
3.4.1 Pereaksi Mayer ... 18
3.4.2 Pereaksi Dragendorff ... 18
3.4.3 Pereaksi Bouchardat ... 18
3.4.4 Pereaksi Liebermann-Burchard ... 18
3.4.5 Pereaksi Molish ... 18
3.4.6 Pereaksi besi (III) klorida 1% b/v ... 19
3.4.7 Pereaksi timbal (II) asetat 0,4 M ... 19
3.4.8 Pereaksi asam klorida 6 N ... 19
3.4.9 Pereaksi asam klorida 2 N ... 19
3.4.10 Pereaksi asam sulfat 2 N ... 19
3.4.11 Pereaksi kloralhidrat ... 19
3.4.13 Pereaksi aluminium klorida 5% b/v ... 19
3.4.14 Pereaksi BAA (Butanol – asam asetat – air)... 20
3.4.15 Pereaksi Forestal ... 20
3.4.16 Pereaksi asam asetat 15% ... 20
3.4.17 Pereaksi asam asetat 50% ... 20
3.4.18 Pereaksi asam klorida 1% ... 20
3.5 Karakterisasi simplisia ... 20
3.5.1 Pemeriksaan makroskopik ... 21
3.5.2 Pemeriksaan mikroskopik ... 21
3.5.3 Penetapan kadar air ... 21
3.5.4 Penetapan kadar sari larut air ... 22
3.5.5 Penetapan kadar sari larut etanol ... 22
3.5.6 Penetapan kadar abu total ... 22
3.5.7 Penetapan kadar abu tidak larut asam ... 23
3.6 Skrining fitokimia serbuk simplisia ... 23
3.6.1 Pemeriksaan flavonoida ... 23
3.6.2 Pemeriksaan alkaloida ... 24
3.6.3 Pemeriksaan saponin ... 24
3.6.4 Pemeriksaan tanin ... 24
3.6.5 Pemeriksaan steroida/triterpenoida ... 24
3.6.6 Pemeriksaan glikosida ... 25
3.7 Pembuatan ekstrak ... 25
3.9 Analisis senyawa flavonoida dari ekstrak etanol dan hasil
fraksinasi secara KKt ... 27
3.10 Pemisahan senyawa flavonoida dari fraksi etilasetat secara KKt preparatif ... 27
3.11 Uji kemurnian isolat ... 28
3.12 Identifikasi isolat ... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
DAFTAR GAMBAR
Gambar Halaman
2.1. Kerangka flavonoida ... 6
2.2 Struktur dasar flavonoida ... 6
2.3. Struktur flavon ... 7
2.4. Struktur flavonol ... 7
2.5. Struktur flavanon ... 7
2.6. Struktur flavanonol ... 7
2.7. Struktur auron ... 8
2.8. Struktur kalkon ... 8
2.9. Struktur isoflavon ... 8
DAFTAR LAMPIRAN
Lampiran Halaman 1. Gambar tumbuhan sukun (Artocarpus altilis (Park.) Fosberg) dan
daun sukun segar ... 44
2. Hasil identifikasi tumbuhan sukun ... 45
3. Gambar simplisia dan serbuk simplisia daun sukun (Artocarpi altilis folium) ... 46
4. Bagan kerja penelitian ... 47
5. Tabel hasil pemeriksaan makroskopik simplisia daun sukun ... 48
6. Gambar hasil pemeriksaan mikroskopik serbuk simplisia daun sukun pada perbesaran 10x40 ... 49
7. Hasil perhitungan karakterisasi simplisia daun sukun ... 50
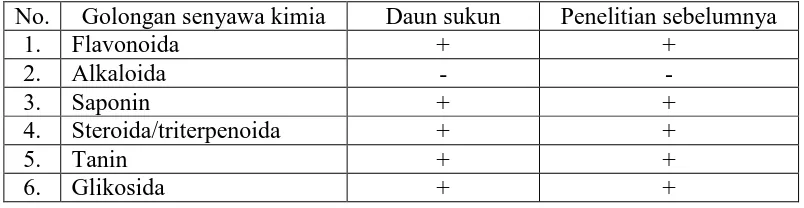
8. Tabel hasil karakterisasi simplisia dan hasil skrining fitokimia serbuk simplisia daun sukun dibandingkan dengan hasil penelitian sebelumnya... 55
9. Bagan pembuatan ekstrak etanol daun sukun secara perkolasi ... 56
10. Bagan ekstraksi cair-cair senyawa flavonoida dari ekstrak etanol ... 57
11. Bagan isolasi senyawa flavonoida dari ekstrak etanol ... 58
12. Gambar kromatogram hasil KKt ekstrak etanol ... 59
13. Gambar kromatogram hasil fraksinasi secara KKt dengan fase diam kertas Whatmann No.1 dan fase gerak BAA ... 60
14. Gambar kromatogram hasil fraksinasi secara KKt dengan fase diam kertas Whatmann No.1 dan fase gerak asam asetat 15% ... 61
15. Gambar kromatogram hasil fraksinasi secara KKt dengan fase diam kertas Whatmann No.1 dan fase gerak asam asetat 50% ... 62
16. Gambar kromatogram hasil fraksinasi secara KKt dengan fase diam kertas Whatmann No.1 dan fase gerak Forestal ... 63
18. Gambar kromatogram hasil KKt preparatif fraksi etilasetat dengan
fase diam kertas Whatmann No.3 dan fase gerak asam asetat 15% .... 65
19. Gambar kromatogram hasil KKt 2 arah isolat F1 dengan fase diam
kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam
asetat 15% ... 66
20. Gambar kromatogram hasil KKt 2 arah isolat F4 dengan fase diam
kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam
asetat 15% ... 67
21. Gambar kromatogram hasil KKt 2 arah isolat F5 dengan fase diam
kertas Whatmann No.1, fase gerak I BAA dan fase gerak II asam
asetat 15% ... 68
22. Gambar spektrum UV isolat F1 dalam metanol ... 69
23. Gambar spektrum UV isolat F1 dalam metanol dan setelah
penambahan NaOH ... 70
24. Gambar spektrum UV isolat F1 dalam metanol dengan penambahan
NaOH dan spektrum yang diukur setelah 5 menit ... 71
25. Gambar spektrum UV isolat F1 dalam metanol dan setelah
penambahan AlCl3/HCl ... 72 26. Gambar spektrum UV isolat F1 dalam metanol dengan penambahan
AlCl3 dan setelah penambahan AlCl3/HCl ... 73 27. Gambar spektrum UV isolat F1 dalam metanol dan setelah
penambahan NaOAc ... 74
28. Gambar spektrum UV isolat F1 dalam metanol dengan penambahan
NaOAc dan spektrum yang diukur setelah 5 menit ... 75
29. Gambar spektrum UV isolat F1 dalam metanol dan setelah
penambahan NaOAc/H3BO3 ... 76 30. Gambar spektrum UV isolat F4 dalam metanol ... 77
31. Gambar spektrum UV isolat F4 dalam metanol dan setelah
penambahan NaOH ... 78
32. Gambar spektrum UV isolat F4 dalam metanol dengan penambahan
NaOH dan spektrum yang diukur setelah 5 menit ... 79
33. Gambar spektrum UV isolat F4 dalam metanol dan setelah
34. Gambar spektrum UV isolat F4 dalam metanol dengan penambahan
AlCl3 dan setelah penambahan AlCl3/HCl ... 81 35. Gambar spektrum UV isolat F4 dalam metanol dan setelah
penambahan NaOAc ... 82
36. Gambar spektrum UV isolat F4 dalam metanol dengan penambahan
NaOAc dan spektrum yang diukur setelah 5 menit ... 83
37. Gambar spektrum UV isolat F4 dalam metanol dan setelah
penambahan NaOAc/H3BO3 ... 84 38. Gambar spektrum UV isolat F5 dalam metanol ... 85
39. Gambar spektrum UV isolat F5 dalam metanol dan setelah
penambahan NaOH ... 86
40. Gambar spektrum UV isolat F5 dalam metanol dengan penambahan
NaOH dan spektrum yang diukur setelah 5 menit ... 87
41. Gambar spektrum UV isolat F5 dalam metanol dan setelah
penambahan AlCl3/HCl ... 88 42. Gambar spektrum UV isolat F5 dalam metanol dengan penambahan
AlCl3 dan setelah penambahan AlCl3/HCl ... 89 43. Gambar spektrum UV isolat F5 dalam metanol dan setelah
penambahan NaOAc ... 90
44. Gambar spektrum UV isolat F5 dalam metanol dengan penambahan
NaOAc dan spektrum yang diukur setelah 5 menit ... 91
45. Gambar spektrum UV isolat F5 dalam metanol dan setelah
KARAKTERISASI SIMPLISIA DAN ISOLASI SENYAWA FLAVONOIDA DARI EKSTRAK ETANOL DAUN SUKUN
(Artocarpus altilis (Park.) Fosberg)
ABSTRAK
CHARACTERIZATION OF SIMPLEX AND ISOLATION FLAVONOID COMPOUNDS FROM ETHANOL EXTRACT OF BREADFRUIT LEAVES
(Artocarpus altilis (Park.) Fosberg)
ABSTRACT
Breadfruit leaves (Artocarpi altilis folium) is one of the plants part that have been used to treatment, such as decoction water of breadfruit leaves according to empirical can be used to treat diabetes and hypertension. One of chemistry compounds of breadfruit leaf is flavonoid. The research objective would be to know characteristics of simplex and isolating flavonoid compounds of breadfruit leaves. The powdered simplex was examined characterized, phytochemical screening, extracted by percolation using 96% ethanol, and fractionated by liquid extraction using n-hexane, chloroform and ethylacetate solvent. The ethylacetate fraction was separated by preparative paper chromatography using 15% acetic acid as mobile phase, visualisation using 5% b/v aluminium chloride and 366 nm UV ray. The isolate were identified by UV spectrophotometer using shift reagent. The macroscopic examination result from breadfruit leaves simplex are leaf edges rolled, wrinkled leaf, intersperse leaf, incision in the edge, length 40-46 cm, width 30-33 cm and greenish brown color. The microscopic of simplex powder showed anomositic stomata, covering hairs, calcium oxalate crystal shaped druse, secretion gland and systolit. The determination result of water content was 6,66%, water soluble extract 12,60%, ethanol soluble extract 11,40%, total ash 14,20% and acid insoluble ash 4,20%. Phytochemical screening result of simplex powder showed flavonoids, saponins, steroids/triterpenoids, tannins and glycosides. The isolate result obtained three flavonoids, F1 has Rf = 0,12, indicated that F1 is flavonol with hydroxyl groups in position 3,7. F4 has Rf = 0, 67, indicated that F4 is flavanon and F5 has Rf = 0,73, indicated that F5 is flavanon.
Keywords: breadfruit leaves, characterization, isolation, flavonoids.
BAB I PENDAHULUAN 1.1 Latar belakang
Indonesia merupakan pusat keragaman hayati dunia dan menduduki urutan terkaya dunia setelah Brazil. Di Indonesia diperkirakan hidup sekitar 40.000
spesies tumbuhan Spermatophyta, dari seluruh spesies tumbuhan tersebut, diperkirakan sekurang-kurangnya 9.600 spesies tumbuhan berkhasiat obat dan baru kurang lebih 300 spesies yang digunakan sebagai bahan obat tradisional
(Depkes, 2006).
Sukun (Artocarpus altilis (Park.) Fosberg) adalah salah satu tumbuhan
‛nangka-nangkaan’ yang dikenal dengan baik di Indonesia dan mudah didapat,
selain sebagai penghasil buah yang bernilai ekonomi, daun tumbuhan ini berkhasiat sebagai obat luar untuk mengobati pembengkakan limpa (Heyne,
1987). Air rebusan daun sukun secara empiris mampu mengobati penyakit diabetes yaitu dengan cara merebus daun sukun yang telah dikeringkan, setelah dingin air rebusan diminum 1 gelas setiap hari (Anonima, 2010).
Karakteristik simplisia dan skrining fitokimia telah dilakukan. Skrining fitokimia serbuk simplisia daun sukun menunjukkan adanya senyawa golongan
flavonoida, tanin, saponin, steroida/triterpenoida dan glikosida. Ekstrak etanol daun sukun telah terbukti secara praklinis mempunyai aktivitas antidiabetes dengan menggunakan tikus sebagai hewan percobaan (Intan, 2008). Hasil
penelitian tersebut didukung dengan adanya jurnal penelitian yang menyebutkan bahwa senyawa golongan flavonoida seperti flavanon, flavon, flavonol, isoflavon
Karakteristik simplisia daun sukun belum terdapat pada buku Materia Medika Indonesia (MMI), maka dipakai sebagai pembanding adalah karakteristik daun sukun berdasarkan hasil penelitian sebelumnya. Daun sukun yang digunakan
pada penelitian sebelumnya diambil dari Medan, sedangkan daun sukun yang digunakan pada penelitian ini diambil dari Tanjung Pura.
Berdasarkan uraian di atas, tujuan penelitian untuk menentukan karakterisasi simplisia dan mengisolasi senyawa flavonoida dari daun sukun secara KKt. Hasil isolasi senyawa flavonoida diidentifikasi secara
spektrofotometri UV menggunakan pereaksi geser (shift reagent).
1.2Perumusan masalah
Berdasarkan latar belakang di atas perumusan masalah penelitian yaitu:
1. Apakah karakteristik simplisia daun sukun sama dengan hasil penelitian sebelumnya?
2. Apakah golongan senyawa kimia yang terdapat pada simplisia daun sukun sama dengan hasil penelitian sebelumnya?
3. Apakah golongan senyawa flavonoida yang terdapat pada simplisia daun
sukun?
1.3Hipotesis
Berdasarkan perumusan masalah di atas maka dibuat hipotesis yaitu:
1. Karakteristik simplisia daun sukun sama dengan hasil penelitian sebelumnya.
3. Golongan senyawa flavonoida yang terdapat pada simplisia daun sukun adalah flavanon, flavonol dan antosianin.
1.4 Tujuan
Tujuan penelitian ini adalah:
1. Untuk menentukan karakteristik simplisia daun sukun dibandingkan dengan hasil penelitian sebelumnya.
2. Untuk mengetahui golongan senyawa kimia yang terdapat pada simplisia daun sukun dibandingkan dengan hasil penelitian sebelumnya.
3. Untuk mengetahui golongan senyawa flavonoida yang terdapat pada simplisia daun sukun.
1.5 Manfaat
Manfaat penelitian yang dilakukan adalah:
1. Memperoleh informasi mengenai karakteristik simplisia daun sukun yang
diteliti dibandingkan dengan hasil penelitian sebelumnya.
2. Memperoleh informasi mengenai kandungan golongan senyawa kimia yang terdapat pada simplisia daun sukun dibandingkan dengan hasil
penelitian sebelumnya.
3. Memperoleh informasi mengenai golongan senyawa flavonoida yang
terdapat pada simplisia daun sukun.
BAB II
TINJAUAN PUSTAKA 2.1 Uraian tumbuhan
Uraian tumbuhan meliputi habitat (daerah tumbuh), sistematika tumbuhan, nama daerah, morfologi tumbuhan, kandungan senyawa kimia dan khasiat
tumbuhan.
2.1.1Habitat (daerah tumbuh)
Tumbuhan sukun merupakan pohon besar yang tersebar hampir merata di
seluruh daerah terutama Jawa Tengah dan Jawa Timur dan banyak dikembangkan di wilayah Kabupaten Cilacap. Sukun tergolong tumbuhan tropik, mampu
beradaptasi dengan lingkungan dan dapat tumbuh subur di daerah yang memiliki ketinggian tempat antara 0 m – 100 m dari permukaan laut (Heyne, 1987; Triwiyatno, 2003).
2.1.2Sistematika tumbuhan Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae
Bangsa : Urticales Suku : Moraceae Marga : Artocarpus
2.1.3Nama daerah
Nama daerah dari sukun adalah Sakon (Aceh), Hatopul (Batak), Bakara (Makasar), Suku (Nias), Sukun (Sunda), Sukun (Jawa), Suun (Ambon) (Heyne,
1987).
2.1.4 Morfologi tumbuhan
Tumbuhan sukun memiliki tinggi 10-25 m, batang bulat, percabangan
simpodial, bergetah, permukaan kasar dan berwarna coklat. Daunnya tunggal, berseling, ujung runcing, tepi bertoreh, panjang 50-70 cm, lebar 25-50 cm,
pertulangan menyirip, tebal, permukaan kasar dan berwarna hijau. Bunga dari sukun berumah satu, bunga jantan silindris dengan panjang 10-20 cm berwarna kuning, bunga betina bulat dengan garis tengah 2-5 cm dan berwarna hijau.
Buahnya semu majemuk, bulat dengan diameter 10-20 cm, berduri lunak, berwarna hijau, mempunyai akar tunggang yang berwarna coklat (Depkes RI,
1997).
2.1.5Kandungan kimia
Kandungan kimia daun dan bunga tumbuhan sukun mengandung saponin,
flavonoida dan tanin, buahnya mengandung tanin, glikosida dan saponin, sedangkan kulit batangnya mengandung flavonoida (Depkes RI, 1997).
2.1.6Khasiat tumbuhan
Bunga jantan tumbuhan sukun berkhasiat sebagai obat sakit gigi dan daunnya untuk mengobati penyakit seperti liver, jantung, ginjal, diabetes,
2.2Senyawa flavonoida
Senyawa flavonoida merupakan senyawa polifenol yang mengandung 15 atom karbon dalam inti dasarnya, yang tersusun dalam konfigurasi C6 – C3 – C6,
yaitu 2 cincin aromatik yang dihubungkan oleh satuan 3 karbon yang dapat atau tidak dapat membentuk cincin ketiga (Markham, 1988).
Gambar 2.1. Kerangka flavonoida
Flavonoida terdapat dalam tumbuhan sebagai campuran dari flavonoida yang berbeda golongan dan jarang sekali dijumpai hanya flavonoid tunggal.
Flavonoida pada tumbuhan terdapat dalam berbagai bentuk struktur molekul dengan beberapa bentuk kombinasi glikosida. Oleh karena itu, dalam menganalisis flavonoida lebih baik memeriksa aglikon yang telah terhidrolisis daripada dalam
bentuk glikosida dengan strukturnya yang rumit dan kompleks (Harborne, 1987). Sistem penomoran untuk turunan flavonoida adalah:
Gambar 2.2. Struktur dasar flavonoida
Senyawa flavonoida dapat diklasifikasikan sebagai berikut:
Flavon dan flavonol merupakan senyawa yang paling tersebar luas dari semua pigmen tumbuhan kuning. Flavon berbeda dengan flavonol karena pada flavon tidak terdapat gugus 3-hidroksi. Hal ini mempengaruhi serapan UV-nya,
gerakan kromatografinya, serta reaksi warnanya dan karena itu flavon dapat dibedakan dari flavonol berdasarkan ketiga sifat tersebut. Hanya ada dua flavon
yang umum, yaitu apigenin dan luteolin. Jenis yang paling umum adalah 7- glikosida. Flavonol dalam tumbuhan sering terdapat sebagai glikosida, biasanya 3-glikosida. Aglikon flavonol yang umumnya dijumpai yaitu kemferol, kuersetin,
dan mirisetin (Harborne, 1987).
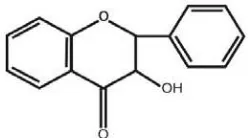
Gambar 2.3. Struktur flavon Gambar 2.4. Struktur flavonol 2. Flavanon dan flavanonol
Senyawa ini terdapat hanya sedikit sekali jika dibandingkan dengan flavonoida lain. Flavanon dan flavanonol tidak berwarna atau hanya kuning sedikit. Flavanon (dihidroflavon) sering terjadi sebagai aglikon, tetapi beberapa
glikosidanya dikenal, misalnya hesperidin dan naringin. Flavanonol (dihidroflavonol) merupakan flavonoida yang kurang dikenal, dan senyawa ini
tidak diketahui terdapat sebagai glikosida (Robinson, 1995).
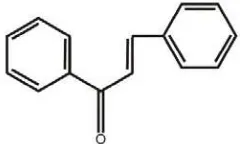
3. Auron dan kalkon
Auron berupa bercak kuning, dengan sinar lampu UV mereka tampak berbeda, warna auron kuning dan berubah menjadi merah jingga bila diuapi
amonia. Kalkon adalah pigmen fenol kuning yang berwarna coklat dengan sinar lampu UV. Salah satu kalkon yang umum, yaitu: butein, dan salah satu auron yang
umum, yaitu: aureusidin. Keduanya terdapat di alam sebagai glikosida dan terdapat khas dalam suku Compositae (Harborne, 1987).
Gambar 2.7. Struktur auron Gambar 2.8. Struktur kalkon
4. Isoflavon
Isoflavon sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna apapun. Beberapa isoflavon memberikan warna biru muda cemerlang
dengan sinar lampu UV bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung pudar yang dengan amonia berubah menjadi coklat pudar. Isoflavon merupakan golongan flavonoida yang penyebarannya terbatas
dan jumlahnya sedikit (Harborne, 1987).
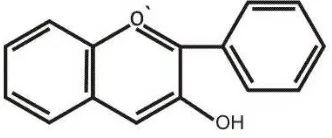
5. Antosianin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan, merupakan pembentuk dasar pigmen warna merah, ungu
dan biru pada tanaman, terutama sebagai bahan pewarna bunga dan buah-buahan. Sebagian besar antosianin adalah glikosida dan aglikonnya disebut antosianidin,
yang terbentuk bila antosianin dihidrolisis dengan asam. Antosianin yang paling umum adalah sianidin yang berwarna merah lembayung (Harborne, 1987;
Robinson, 1995; Sastrohamidjojo, 1996).
Gambar 2.10. Struktur antosianidin
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan menggunakan pelarut cair. Senyawa aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam golongan flavonoida, minyak atsiri, alkaloida dan lain-lain. Senyawa aktif
yang diketahui terkandung dalam simplisia akan mempermudah pemilihan pelarut dan cara ekstraksi yang tepat. Cara ekstraksi yang tepat tergantung pada tumbuhan
yang diekstraksi dan jenis senyawa yang diisolasi (Ditjen POM, 2000; Gritter, 1991).
Metode ekstraksi menurut Ditjen POM (2000) ada beberapa cara, yaitu:
1. Maserasi
Maserasi adalah proses ekstraksi simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan. Maserasi
kinetik berarti dilakukan pengadukan yang kontinu (terus-menerus). Remaserasi berarti dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan
maserat pertama dan seterusnya. 2. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Proses ini terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi
sebenarnya (penetesan/penampungan ekstrak) terus-menerus sampai ekstrak yang diinginkan habis tersari. Tahap pengembangan bahan dan maserasi antara dilakukan dengan maserasi serbuk menggunakan cairan penyari
sekurang-kurangnya 3 jam, hal ini penting terutama untuk serbuk yang keras dan bahan yang mudah mengembang.
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan dengan
adanya pendingin balik. 4. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru,
5. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada temperatur yang lebih tinggi dari temperatur ruangan, yaitu pada temperatur
40-50°C.
6. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur 96-98°C) selama
15-20 menit. 7. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai titik didih air.
2.4 Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan perbedaan perpindahan dari komponen-komponen senyawa diantara 2 fase yaitu fase diam
(dapat berupa zat cair atau zat padat) dan fase gerak (dapat berupa gas atau zat cair) (Gritter, 1991). Jika fase tetap berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan, jika zat cair dikenal sebagai kromatografi partisi
(Sastrohamidjojo, 1985).
Kromatografi dapat dibedakan atas berbagai macam tergantung pada pengelompokannya. Berdasarkan pada alat yang digunakan, kromatografi dapat
dibagi atas: kromatografi kertas (KKt), kromatografi lapis tipis (KLT), kromatografi cair kinerja tinggi (KCKT) dan kromatografi gas (KG) (Gandjar,
Kromatografi kertas
Keuntungan utama KKt ialah kemudahan dan kesederhanaan pada pelaksanaan pemisahan, yaitu hanya pada lembaran kertas saring yang berlaku
sebagai medium pemisahan. Senyawa pada KKt biasanya dideteksi sebagai bercak berwarna atau bercak berfluoresensi UV setelah direaksikan dengan penampak
bercak (Harborne, 1987). Keuntungan lain adalah jumlah flavonoida yang diperlukan untuk analisis sangat sedikit (biasanya sekitar 0,1 mg) (Markham, 1988).
Hal-hal yang perlu diperhatikan pada saat melakukan pemisahan secara KKt (Sastrohamidjojo, 1985):
1. Metode pemisahan (penaikan, penurunan atau mendatar). 2. Macam dari kertas.
3. Pemilihan dan pembuatan pelarut (fase gerak).
4. Kesetimbangan dalam bejana yang dipilih. 5. Pembuatan cuplikan.
6. Waktu pengembangan.
7. Metode deteksi dan identifikasi
Fase diam pada KKt digunakan sehelai kertas dengan susunan serabut dan
tebal yang sesuai. Pemisahan dapat dilakukan menggunakan pelarut tunggal atau menggunakan 2 pelarut yang tidak dapat bercampur, fase gerak merambat perlahan-lahan melalui fase diam yang membungkus serabut kertas.
tujuan untuk memperbesar kelarutan dari beberapa senyawa atau untuk mengurangi kelarutan (Sastrohamidjojo, 1985).
Menurut Gritter (1991), kromatogram dapat dikembangkan dengan cara
menaik atau cara menurun. Cara menaik yaitu kertas digantungkan pada bagian penutup bejana kromatografi, dan pelarut berada di bawah bejana. Cara menurun
lazimnya dipakai bejana yang lebih besar. Bejana dilengkapi dengan sejenis wadah pelarut yang dipasang pada penopang, dan kertas kromatografi dicelupkan ke dalam pelarut di dalam wadah itu dan berarti batang kaca supaya tetap pada
tempatnya.
Gerakan noda suatu senyawa dalam pengembang tertentu disebut bilangan
Rf senyawa itu dalam pengembang tersebut. Bilangan Rf didefinisikan sebagai jarak yang ditempuh oleh senyawa dibagi dengan jarak yang ditempuh oleh garis depan fase gerak (diukur dari garis awal), karena itu bilangan Rf selalu lebih kecil
dari 1,0. Pembanding bilangan Rf flavonoida yang belum dikenal dengan Rf yang telah dikenal dan sejenis merupakan cara yang berguna untuk membandingkan flavonoida yang sedang diidentifikasi dengan flavonoida yang tidak ada di
laboratorium (Markham, 1988).
Menurut Sastrohamidjojo (1985), faktor-faktor yang mempengaruhi harga
Rf adalah struktur kimia dari senyawa yang dipisahkan, suhu, kesetimbangan, sifat dari penyerap, tebal dan kerataan lapisan penyerap, pelarut, kertas, sifat dari campuran, derajat kejenuhan dari bejana pengembangan, tekhnik percobaan dan
2.5 Spektrofotometri UV
Spektrofotometri UV merupakan suatu cara analisis berdasarkan atas pengukuran serapan suatu larutan yang dilalui radiasi cahaya monokromatis.
Spektrum UV digambarkan sebagai hubungan antara panjang gelombang dengan intensitas serapan (transmitansi atau absorbansi) (Sastrohamidjojo, 1985).
Spektroskopi UV berguna untuk menganalisis struktur flavonoida. Cara tersebut digunakan untuk mengidentifikasi jenis flavonoida dan menentukan pola oksigenasi. Disamping itu, kedudukan gugus hidroksil fenol bebas pada inti
flavonoida dapat ditentukan dengan menambahkan pereaksi geser ke dalam larutan cuplikan dan mengamati pergeseran puncak serapan yang terjadi.
Spektrum flavonoida biasanya ditentukan dalam larutan dengan pelarut metanol atau etanol. Spektrum khas terdiri dari 2 pita absorpsi maksimum, yaitu pada rentang 240-285 nm (pita II) dan 300-550 nm (pita I) (Markham, 1988).
Langkah pertama yang dilakukan untuk menafsirkan spektrum yaitu menentukan jenis flavonoida dengan memperhatikan:
1. Bentuk umum spektrum dalam metanol
2. Panjang gelombang pita serapan 3. Data kromatografi kertas.
Langkah kedua adalah mempertimbangkan arti perubahan spektrum yang disebabkan oleh berbagai pereaksi geser (Markham, 1988).
Beberapa istilah dalam spektrofotometri UV menurut Noerdin (1985) dan
Silverstein, et al. (1981) antara lain:
1. Khromofor didefinisikan sebagai gugus fungsi yang menyerap radiasi di
2. Auksokrom didefinisikan sebagai gugus fungsi yang mempunyai elektron tidak berpasangan, tidak menyerap radiasi pada panjang gelombang lebih besar dari 200 nm, dan bila terikat dengan gugus khromofor akan mengubah
panjang gelombang dan intensitas penyerapan, contoh: OH, NH2, Cl.
3. Efek batokromik (pergeseran merah) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih panjang akibat terikat dengan gugus khromofor atau efek pelarut.
4. Efek hipsokromik (pergeseran biru) adalah suatu pergeseran pita serapan ke
panjang gelombang yang lebih pendek akibat terikat dengan gugus khromofor atau efek pelarut.
BAB III
METODOLOGI PENELITIAN
Penelitian ini adalah metode eksperimental. Penelitian meliputi
pengumpulan bahan baku pembuatan simplisia, karakterisasi simplisia, skrining fitokimia serbuk simplisia, pembuatan ekstrak, analisis KKt, uji kemurnian isolat
dan identifikasi isolat secara spektrofotometri UV dengan penambahan pereaksi geser (shift reagent).
3.1 Alat-alat yang digunakan
Alat-alat yang digunakan adalah spektrofotometer UV (Shimadzu UV-1800), sinar lampu UV 366 nm (Camag), neraca listrik (Vibra AJ), neraca kasar
(O’Haus), oven listrik (Fisher scientific), rotary evaporator (Buchi 461), freeze dryer (Edward), seperangkat alat penetapan kadar air, seperangkat alat perkolasi,
seperangkat alat refluks, bejana kromatografi, tanur, eksikator, mikroskop
(Olympus), lemari pendingin (Karl Kolb), blender (Philips), lemari pengering, penangas air, cawan porselin berdasar rata, cawan porselin, alat-alat gelas laboratorium, kaca objek dan kaca penutup.
3.2 Bahan-bahan yang digunakan
Bahan tumbuhan yang digunakan adalah daun sukun (Artocarpi altilis
folium). Bahan kimia yang digunakan berkualitas pro analisis kecuali dinyatakan lain adalah n-heksan, kloroform, etilasetat, metanol, isopropanol, toluen, benzen, n-butanol, amil alkohol, asam klorida pekat, asam sulfat pekat, asam asetat
anhidrida, aluminium (III) klorida, besi (III) klorida, raksa (II) klorida, natrium hidroksida, timbal (II) asetat, natrium asetat, asam asetat glasial, kalium iodida,
kloralhidrat, asam borat. Etanol 96% (hasil destilasi), air suling, kertas Whatmann No.1 dan No.3, pipa kapiler.
3.3 Pengumpulan dan pengolahan daun tumbuhan sukun 3.3.1 Pengambilan daun tumbuhan sukun
Pengambilan daun tumbuhan sukun dilakukan secara purposif, yaitu tanpa
membandingkan tumbuhan serupa dari daerah lain. Bahan penelitian ini adalah daun sukun yang diambil dari halaman belakang rumah di Jalan Berandan No. 8, Desa Pematang Tengah, Kecamatan Tanjung Pura, Kabupaten Langkat, Sumatera
Utara. Daun sukun yang diambil adalah daun yang berwarna hijau tua. Gambar tumbuhan dan daun sukun dapat dilihat pada lampiran 1 halaman 44.
3.3.2 Identifikasi tumbuhan
Identifikasi daun tumbuhan sukun dilakukan di ”Herbarium Bogoriense” Bidang Botani, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia
(LIPI), Bogor. Hasil identifikasi daun tumbuhan sukun dapat dilihat pada lampiran 2 halaman 45.
3.3.3 Pembuatan simplisia
Daun sukun yang telah dikumpulkan dicuci di bawah air mengalir hingga bersih, ditiriskan, lalu disebarkan di atas kertas koran polos, kemudian ditimbang
sebagai berat basah yaitu 2,5 kg, lalu dikeringkan di lemari pengering pada suhu 40oC hingga kering. Daun dianggap kering jika diremas mudah hancur, kemudian ditimbang sebagai berat kering yaitu 950 g. Simplisia kering selanjutnya diserbuk
menggunakan blender dan disimpan dalam wadah plastik sebelum digunakan. Gambar simplisia dan serbuk simplisia daun sukun dapat dilihat pada lampiran 3
3.4 Pembuatan larutan pereaksi 3.4.1 Pereaksi Mayer
Raksa (II) klorida sebanyak 1,36 g dilarutkan dalam air suling hingga 60
ml (larutan I), 5 g kalium iodida dilarutkan dalam 10 ml air suling (larutan II) kemudian larutan I dicampur dengan larutan II dan ditambahkan air suling hingga
100 ml (Depkes RI, 1980).
3.4.2 Pereaksi Dragendorff
Bismut (III) nitrat sebanyak 8 g dilarutkan dalam 20 ml asam nitrat
(larutan I) dan 27,2 g kalium iodida dilarutkan dalam 50 ml air suling (larutan II), kemudian larutan I dicampur dengan larutan II, didiamkan sampai memisah
sempurna. Diambil larutan jernih dan diencerkan dalam air secukupnya hingga 100 ml (Depkes RI, 1980).
3.4.3 Pereaksi Bouchardat
Kalium iodida sebanyak 4 g dilarutkan dalam 20 ml air suling sampai kalium iodida larut dengan sempurna, lalu ditambahkan 2 g iodium sedikit demi sedikit dan dicukupkan dengan air suling hingga 100 ml (Depkes RI, 1980).
3.4.4 Pereaksi Liebermann-Burchard
Asam sulfat pekat sebanyak 5 ml dicampurkan dalam 5 ml asam asetat
anhidrida (Harborne, 1987).
3.4.5 Pereaksi Molish
α-naftol sebanyak 3 g dilarutkan dalam asam nitrat 0,5 N secukupnya
3.4.6 Pereaksi besi (III) klorida 1% b/v
Besi (III) klorida sebanyak 1 g dilarutkan dalam air suling hingga diperoleh larutan 100 ml (Ditjen POM, 1979).
3.4.7 Pereaksi timbal (II) asetat 0,4 M
Timbal (II) asetat sebanyak 15,17 g dilarutkan dalam air suling bebas
karbondioksida hingga 100 ml (Ditjen POM, 1995).
3.4.8 Pereaksi asam klorida 6 N
Asam klorida pekat sebanyak 50 ml diencerkan dalam air suling hingga
100 ml (Markham, 1988).
3.4.9 Pereaksi asam klorida 2 N
Asam klorida pekat sebanyak 17 ml diencerkan dalam air suling hingga 100 ml (Ditjen POM, 1979).
3.4.10 Pereaksi asam sulfat 2 N
Asam sulfat pekat sebanyak 5,5 ml diencerkan dalam air suling hingga 100 ml (Depkes RI, 1980).
3.4.11 Pereaksi kloralhidrat
Kloralhidrat sebanyak 50 g dilarutkan dalam 20 ml air suling (Depkes RI, 1995).
3.4.12 Pereaksi natrium hidroksida 2 N
Natrium hidroksida sebanyak 8,002 g dilarutkan dalam air suling bebas karbondioksida hingga diperoleh larutan 100 ml (Ditjen POM, 1979).
3.4.13 Pereaksi aluminium klorida 5% b/v
Aluminium (III) klorida sebanyak 5 g dilarutkan dalam metanol hingga
3.4.14 Pereaksi BAA
n-butanol – asam asetat – air suling dengan perbandingan 4 : 1 : 5
dicampur di dalam corong pisah, dibiarkan selama 17 jam sampai memisah
sempurna, kemudian diambil lapisan atas (Markham, 1988).
3.4.15 Pereaksi Forestal
Asam asetat – air suling – asam klorida dengan perbandingan 30 : 10 : 3 dicampur lalu didiamkan selama 15 jam (Markham, 1988).
3.4.16 Pereaksi asam asetat 15%
Asam asetat sebanyak 15 ml diencerkan dalam air suling hingga 100 ml, dibiarkan selama 5 jam (Markham, 1988).
3.4.17 Pereaksi asam asetat 50%
Asam asetat sebanyak 50 ml diencerkan dalam air suling hingga 100 ml, dibiarkan selama 12 jam (Markham, 1988).
3.4.18 Pereaksi asam klorida 1%
Asam klorida pekat sebanyak 2,7 ml diencerkan dalam air suling hingga 100 ml, dibiarkan selama 5 jam (Markham, 1988).
3.5 Karakterisasi simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik, pemeriksaan
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan cara memperhatikan bentuk, ukuran, warna, bau, dan rasa simplisia daun sukun. Tabel hasil pemeriksaan
makroskopik simplisia dapat dilihat pada lampiran 5 halaman 48.
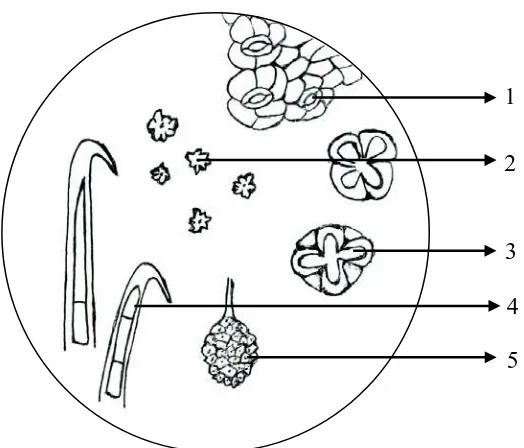
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik serbuk simplisia dilakukan untuk mengetahui fragmen dari simplisia dengan cara serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesi larutan kloralhidrat dan ditutup dengan kaca penutup kemudian
diamati di mikroskop. Gambar hasil pemeriksaan mikroskopik serbuk simplisia dapat dilihat pada lampiran 6 halaman 49.
3.5.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen). Alat meliputi labu alas 500 ml, tabung penerima 5 ml berskala 0,05 ml, pendingin,
tabung penyambung, pemanas listrik. Cara kerja:
Toluen 200 ml dan air suling 2 ml dimasukkan ke dalam labu alas bulat,
didestilasi selama 2 jam. Toluen didinginkan selama 30 menit dan volume air pada tabung penerima dibaca. Serbuk simplisia sebanyak 5 g yang telah ditimbang
seksama dimasukkan ke dalam labu tersebut, lalu dipanaskan hati-hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur kurang lebih 2 tetes tiap detik, hingga sebagian besar air terdestilasi, kemudian kecepatan
destilasi dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen yang telah dijenuhkan. Destilasi
sampai suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca. Kadar air dihitung dalam persen (WHO, 1992).
3.5.4 Penetapan kadar sari larut air
Serbuk simplisia sebanyak 5 g dimaserasi selama 24 jam dalam 100 ml air kloroform (2,5 ml kloroform dalam air suling 1000 ml) dalam labu bersumbat
sambil sesekali dikocok selama 6 jam pertama kemudian dibiarkan selama 18 jam, lalu disaring. Diuapkan 20 ml filtrat sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan dalam oven pada suhu 105oC hingga
diperoleh bobot tetap, kemudian dihitung kadar sari larut air (Depkes RI, 1995).
3.5.5 Penetapan kadar sari larut etanol
Serbuk simplisia sebanyak 5 g dimaserasi selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil sesekali dikocok selama 6 jam pertama dan dibiarkan selama 18 jam, lalu disaring. Diuapkan 20 ml filtrat pertama sampai
kering dalam cawan dangkal berdasar rata yang telah ditara. Sisanya dipanaskan dalam oven pada suhu 105oC hingga diperoleh bobot tetap, kemudian dihitung kadar sari larut etanol (Depkes RI, 1995).
3.5.6 Penetapan kadar abu total
Serbuk simplisia sebanyak 2 g yang telah digerus, ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijarkan perlahan-lahan pada suhu 550oC hingga arang habis, lalu didinginkan dan ditimbang hingga diperoleh bobot tetap. Kemudian dihitung
3.5.7 Penetapan kadar abu tidak larut asam
Abu yang telah diperoleh dari penetapan kadar abu total dididihkan dengan 25 ml asam klorida encer selama 5 menit. Bagian yang tidak larut asam
dikumpulkan, disaring melalui kertas saring bebas abu, kemudian dicuci dengan air panas. Residu dan kertas saring dipijarkan, didinginkan dan ditimbang hingga
diperoleh bobot tetap, kemudian dihitung kadar abu tidak larut asam (WHO, 1992).
Hasil perhitungan karakterisasi simplisia dapat dilihat pada lampiran 7 halaman
50-54.
Tabel hasil karakterisasi simplisia dapat dilihat pada lampiran 8 halaman 55.
3.6 Skrining fitokimia serbuk simplisia
Skrining fitokimia serbuk simplisia meliputi pemeriksaan senyawa golongan flavonoida, alkaloida, saponin, tanin, steroida/triterpenoida dan
glikosida.
3.6.1 Pemeriksaan flavonoida
Serbuk simplisia sebanyak 10 g ditambahkan 100 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas. Filtrat yang diperoleh kemudian diambil 5 ml lalu ditambahkan 0,1 g serbuk magnesium, 1 ml asam
3.6.2 Pemeriksaan alkaloida
Serbuk simplisia sebanyak 0,5 g ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan lalu
disaring. Filtrat dipakai untuk percobaan berikut:
a. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
b. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat c. Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit dua
atau tiga dari percobaan di atas (Depkes RI,1995).
3.6.3 Pemeriksaan saponin
Serbuk simplisia sebanyak 0,5 g dimasukkan ke dalam tabung reaksi dan ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat selama 10 detik, jika terbentuk buih yang mantap setinggi 1-10 cm yang stabil
tidak kurang dari 10 menit dan tidak hilang dengan penambahkan 1 tetes asam klorida 2 N, menunjukkan adanya saponin (Depkes RI, 1995).
3.6.4 Pemeriksaan tanin
Serbuk simplisia sebanyak 0,5 g disari dengan 10 ml air suling, lalu disaring. Filtrat diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml
larutan lalu ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%, jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Farnsworth, 1966).
3.6.5 Pemeriksaan steroida/triterpenoida
Serbuk simplisia sebanyak 1 g dimaserasi dengan 20 ml n-heksan selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap. Sisa ditambahkan 2
Liebermann-Burchard), jika timbul warna ungu atau merah kemudian berubah menjadi biru ungu atau biru hijau menunjukkan adanya steroida/triterpenoida (Harborne, 1987).
3.6.6 Pemeriksaan glikosida
Serbuk simplisia sebanyak 3 g disari dengan 30 ml campuran etanol 95% dengan air suling (7:3) dan 10 ml larutan asam sulfat 2 N. Direfluks selama 1 jam,
didinginkan dan disaring. Diambil 20 ml filtrat, ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok, lalu didiamkan selama 5 menit dan disaring. Filtrat disari dengan 20 ml campuran isopropanol dan kloroform (2:3)
dilakukan berulang-ulang sebanyak 3 kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC. Sisanya dilarutkan dalam 2 ml metanol. Larutan
sisa dimasukkan dalam tabung reaksi, selanjutnya diuapkan di atas penangas air. Sisa dilarutkan dalam 2 ml air suling dan 5 tetes pereaksi Molish, kemudian secara perlahan ditambahkan 2 ml asam sulfat pekat melalui dinding tabung. Glikosida
positif jika terbentuk cincin ungu pada batas kedua cairan (Depkes RI, 1995). Tabel hasil skrining fitokimia dapat dilihat pada lampiran 8 halaman 55.
3.7 Pembuatan ekstrak
Serbuk simplisia sebanyak 300 g dimasukkan ke dalam bejana tertutup dan dibasahi dengan cairan penyari etanol 96% sampai semua simplisia terendam,
dibiarkan selama 3 jam. Massa dipindahkan sedikit demi sedikit ke dalam perkolator, kemudian dituangi cairan penyari secukupnya sampai semua simplisia terendam dan terdapat selapis cairan penyari di atasnya, perkolator ditutup dengan
aluminium foil dan dibiarkan selama 24 jam. Kran perkolator dibuka dan dibiarkan tetesan ekstrak mengalir dengan kecepatan 1 ml tiap menit, ditambahkan
penyari di atas simplisia. Perkolasi dihentikan setelah tetesan perkolat terakhir tidak bereaksi lagi dengan pereaksi untuk uji senyawa golongan flavonoida. Perkolat yang diperoleh diuapkan menggunakan rotary evaporator pada
temperatur ±40oC, tekanan 2 atm, kemudian dipekatkan menggunakan freeze dryer pada suhu -40oC selama ±24 jam sehingga diperoleh ekstrak etanol (Depkes,
1986). Bagan pembuatan ekstrak dapat dilihat pada lampiran 9 halaman 56.
3.8Ekstraksi cair-cair senyawa flavonoida
Ekstraksi cair-cair senyawa flavonoida dari ekstrak etanol dilakukan
berturut-turut dengan pelarut n-heksan, kloroform dan etilasetat. Cara kerja:
Ekstrak etanol ditambah 20 ml etanol, lalu dilarutkan dalam air panas sebanyak 100 ml, dihidrolisis dengan asam (ditambah asam klorida 2 N), direfluks selama 5 jam, kemudian disaring dan didinginkan, lalu dimasukkan ke dalam
corong pisah, mula-mula difraksinasi dengan n-heksan sebanyak 100 ml, dilakukan 3 kali, diperoleh fraksi n-heksan dan fraksi air. Fraksi n-heksan dipisahkan, fraksi air kemudian difraksinasi lagi dengan kloroform sebanyak 100
ml, dilakukan 3 kali, diperoleh fraksi kloroform dan fraksi air, kemudian fraksi kloroform dipisahkan, fraksi air difraksinasi lagi dengan 100 ml etilasetat,
dilakukan 3 kali, diperoleh fraksi etilasetat dan fraksi air. Masing-masing fraksi dipekatkan.
Bagan ekstraksi cair-cair dari ekstrak etanol dapat dilihat pada lampiran 10
halaman 57.
Bagan isolasi senyawa flavonoida dari ekstrak etanol dapat dilihat pada lampiran
3.9 Analisis senyawa flavonoida dari ekstrak etanol dan hasil fraksinasi secara KKt
Ekstrak etanol dan hasil fraksinasi dilakukan KKt menggunakan 5 sistem fase gerak yaitu BAA, asam asetat 15%, asam asetat 50%, Forestal, asam klorida 1%, sebagai fase diam adalah kertas Whatmann No.1 yang berukuran 3 x 20 cm.
Cara kerja:
Ekstrak etanol, fraksi n-heksan, fraksi kloroform, fraksi etilasetat dan
fraksi air masing-masing ditotolkan pada kertas Whatmann dari tepi bawah, kemudian kertas tersebut dimasukkan ke dalam bejana kromatografi yang berisi fase gerak yang telah dijenuhkan, lalu dielusi sampai garis tanda. Kertas diangkat
dan dikeringkan, lalu disemprot dengan penampak bercak aluminium klorida 5% b/v dan diamati di bawah sinar lampu UV 366 nm.
Gambar kromatogram hasil KKt ekstrak etanol dapat dilihat pada lampiran 12 halaman 59.
Gambar kromatogram hasil KKt fraksi n-heksan, fraksi kloroform, fraksi etilasetat
dan fraksi air dapat dilihat pada lampiran 13-17 halaman 60-64.
3.10 Pemisahan senyawa flavonoida dari fraksi etilasetat secara KKt preparatif
Fraksi etilasetat dilakukan pemisahan secara KKt preparatif sebagai fase
gerak asam asetat 15% dan fase diam kertas Whatmann No.3 yang berukuran 15 x 15 cm.
Cara kerja :
Fraksi etilasetat yang telah diencerkan ditotolkan pada kertas berupa pita, kemudian dimasukkan ke dalam bejana kromatografi berisi fase gerak yang telah
diamati di bawah sinar lampu UV 366 nm. Bagian tengah kertas ditutup dengan kaca yang bersih sedangkan pada sisi kanan dan kiri kertas disemprot dengan penampak bercak aluminium klorida 5% b/v dan dikeringkan, lalu diamati di
bawah sinar lampu UV 366 nm, kemudian bercak diberi tanda dan digunting menjadi potongan-potongan kecil, direndam dalam metanol selama 24 jam dan
sekali-kali dikocok lalu disaring. Proses perendaman dan pelarutan diulangi hingga 3 kali sampai semua senyawa flavonoida tersari sempurna, selanjutnya filtrat dikumpulkan dan diuapkan hingga diperoleh isolat kental.
Gambar kromatogram hasil KKt preparatif fraksi etilasetat dapat dilihat pada lampiran 18 halaman 65.
3.11 Uji kemurnian isolat
Uji kemurnian isolat dilakukan secara KKt 2 arah menggunakan 2 sistem fase gerak yaitu sebagai fase gerak I BAA dan asam asetat 15% sebagai fase gerak
II.
Cara kerja:
Isolat ditotolkan pada kertas Whatmann No.1 berukuran 15 x 15 cm,
kemudian dimasukkan ke dalam bejana kromatografi yang telah jenuh dengan uap fase gerak I, lalu dielusi sampai garis tanda. Kertas dikeluarkan dan dikeringkan,
selanjutnya dielusi kembali dengan arah yang berbeda 90o memakai fase gerak II. Kertas dikeluarkan dan dikeringkan. Hasilnya dilihat di bawah sinar lampu UV 366 nm dan dideteksi dengan penampak bercak aluminium klorida 5% b/v dan
dilihat kembali di bawah sinar lampu UV 366 nm, kemudian dihitung harga Rf-nya (Markham, 1988). Gambar kromatogram hasil KKt 2 arah isolat dapat dilihat
3.12 Identifikasi isolat
Identifikasi isolat dilakukan secara spektrofotometri UV menggunakan pereaksi geser (shift reagent) (Markham, 1988; Mabry, et al. 1970).
Cara kerja:
1. Isolat dilarutkan dalam metanol, dimasukkan ke dalam kuvet lalu diukur
spektrumnya, kemudian ditambahkan 3 tetes natrium hidroksida 2 N ke dalam kuvet dan diukur spektrumnya. Spektrum diukur kembali setelah 5 menit.
2. Larutan isolat ditambahkan 6 tetes pereaksi aluminium klorida 5% b/v,
dicampur, lalu diukur spektrumnya, selanjutnya ditambahkan 3 tetes asam klorida 6 N, dicampur dan diukur spektrumnya.
3. Larutan isolat ditambahkan serbuk natrium asetat hingga 2 mm lapisan natrium asetat pada dasar kuvet, dicampur lalu diukur spektrumnya. Spektrum natrium asetat diukur kembali setelah 5 menit. Serbuk asam borat ditambahkan 1 mm
ke dalam kuvet, dicampur, kemudian diukur spektrum natrium asetat/asam borat.
Gambar spektrum isolat secara spektrofotometri UV menggunakan pereaksi geser
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi daun tumbuhan sukun yang dilakukan di “Herbarium
Bogoriense” Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia, (LIPI) Bogor, menunjukkan tumbuhan yang diteliti adalah Artocarpus
altilis (Park.) Fosberg, suku Moraceae.
Hasil pemeriksaan makroskopik simplisia daun sukun adalah ujung daun menggulung, daun berkerut, daun berseling, tepi bertoreh, panjang 40-46 cm, lebar
30-33 cm dan berwarna coklat kehijauan. Hasil pemeriksaan mikroskopik serbuk simplisia daun sukun terlihat stomata tipe anomositik, rambut penutup, kristal
kalsium oksalat bentuk druse, kelenjar sekresi dan sistolit.
Hasil karakterisasi serbuk simplisia daun sukun diperoleh kadar air 6,66%, kadar sari larut air 12,60%, kadar sari larut etanol 11,40%, kadar abu total 14,20%
dan kadar abu tidak larut asam 4,70%. Karakteristik simplisia daun sukun yang diperoleh berbeda dengan karakteristik simplisia daun sukun yang terdapat pada hasil penelitian sebelumnya, ini disebabkan karena tempat pengambilan tumbuhan
berbeda. Menurut Badan Pengawas Obat dan Makanan Republik Indonesia (2005), lingkungan tempat tumbuh yang berbeda sering mengakibatkan perbedaan
kadar kandungan senyawa aktif. Faktor lingkungan yang berpengaruh diantaranya tinggi tempat, keadaan tanah dan cuaca.
Penetapan kadar air dilakukan untuk mengetahui kandungan air dalam
simplisia karena air merupakan media yang baik untuk tumbuhnya mikroba. Penetapan kadar sari larut air dan kadar sari larut etanol dilakukan untuk
dilakukan untuk mengetahui kadar senyawa anorganik dalam simplisia, baik senyawa makro dan mikro. Kadar abu total yang diperoleh cukup besar, ini disebabkan karena pada simplisia daun sukun terdapat banyak kandungan mineral,
diantaranya adalah kalsium, besi, zinkum dan fosfor. Menurut Koswara (2006), sukun mempunyai komposisi gizi yang relatif tinggi, mengandung karbohidrat,
protein, lemak, serat, fosfor, kalsium, besi dan zinkum. Penetapan kadar abu tidak larut asam dilakukan untuk mengetahui kadar senyawa yang tidak larut asam.
Hasil skrining fitokimia menunjukkan adanya senyawa golongan
flavonoida, saponin, steroida/triterpenoida, tanin dan glikosida. Hasil perkolasi 300 g serbuk simplisia daun sukun diperoleh 57 g ekstrak etanol dan dari 15 g
ekstrak etanol dihidrolisis dengan penambahan asam klorida 2 N. Hasil hidrolisis kemudian difraksinasi menggunakan pelarut n-heksan, kloroform dan etilasetat, setelah pelarutnya diuapkan diperoleh 0,262 g fraksi n-heksan, 0,311 g fraksi
kloroform, 0,299 g fraksi etilasetat dan 0,270 g fraksi air. Menurut Harborne (1987), hidrolisis asam suatu glikosida pada kondisi tertentu mungkin saja tidak sempurna sehingga sudah merupakan hal yang biasa bila pada kromatogram
ditemukan glikosida maupun aglikonnya.
Hasil analisis KKt menggunakan 5 sistem fase gerak yaitu BAA, asam
asetat 15%, asam asetat 50%, Forestal dan asam klorida 1%, pada fraksi n-heksan tidak terdapat noda, ini membuktikan bahwa flavonoida tidak dapat larut dalam n-heksan karena n-heksan bersifat non polar. Menurut Markham (1988), senyawa
tidak mungkin mengandung flavonoida, ekstrak tersebut jangan dibuang sebelum diperiksa secara kromatografi.
Fraksi kloroform dan fraksi air dengan masing-masing fase gerak
menunjukkan noda yang tidak terpisah dengan baik, sedangkan pada fraksi etilasetat memberikan pemisahan noda terbaik dan jumlah noda yang lebih
banyak, sehingga pada uji selanjutnya hanya dilakukan pada fraksi etilasetat. Fraksi etilasetat dilakukan KKt preparatif, hasilnya diperoleh 5 pita, yaitu pita F1 berfluoresensi kuning mempunyai harga Rf = 0,11, F2 berfluoresensi hijau muda
mempunyai harga Rf = 0,34, F3 berfluoresensi ungu mempunyai harga Rf = 0,44, F4 berfluoresensi biru mempunyai harga Rf = 0,65 dan F5 berfluoresensi biru
ungu mempunyai harga Rf = 0,73. Isolat F2 dan F3 jumlahnya sangat sedikit sehingga analisis selanjutnya hanya dilakukan terhadap isolat F1, F4 dan F5.
Hasil uji kemurnian terhadap isolat F1, F4 dan F5 secara KKt 2 arah
dengan fase gerak I adalah asam asetat 15% dan fase gerak II adalah BAA menunjukkan 1 bercak dengan sinar lampu UV 366 nm. Isolat F1 berfluoresensi kuning mempunyai harga Rf = 0,11, F4 berfluoresensi biru mempunyai harga Rf =
0,65 dan F5 berfluoresensi biru ungu mempunyai harga Rf = 0,73, kemudian disemprot dengan penampak bercak aluminium klorida 5% b/v tetap menunjukkan
1 bercak, F1 berfluoresensi hijau kekuningan mempunyai harga Rf = 0,12, F4 berfluoresensi biru mempunyai harga Rf = 0,67 dan F5 berfluoresensi biru ungu mempunyai harga Rf = 0,73.
Menurut Markham (1988), BAA biasanya merupakan pengembang terbaik dari segi kekuatan pelarut dan pemisahan bercak, sehingga sudah menjadi
KKt 2 arah. Asam asetat 15% digunakan untuk mendeteksi glikosida, baik untuk membedakan antara mono-, di-, dan triglikosida.
Penafsiran spektrum UV dilakukan terhadap isolat F1, F4 dan F5 dengan
merujuk pada Mabry, et al. (1970) dan Markham (1988).
Penafsiran spektrum UV untuk isolat F1 adalah sebagai berikut:
1. Hasil spektrum isolat F1 dalam metanol memberikan 1 pita absorpsi maksimum yaitu 274 nm (pita II), ini menunjukkan adanya absorpsi pada cincin A (benzoil), tetapi pita I tidak muncul (lampiran 22 halaman 69). Isolat F1 ini
dapat diduga senyawa flavonol dengan gugus 3-OH bebas yang memiliki absorpsi maksimum pita I 352-385 nm dan pita II 240-280 nm.
2. Hasil spektrum isolat F1 dalam metanol dengan penambahan natrium hidroksida 2 N menunjukkan adanya absorpsi maksimum pada panjang gelombang 363 nm (pita I) (lampiran 23 halaman 70). Ini menunjukkan adanya
absorpsi pada cincin B (sinamoil).
Spektrum diukur kembali setelah 5 menit, hasil menunjukkan tidak terjadi penguraian (lampiran 24 halaman 71) yang menunjukkan tidak dijumpai
adanya gugus 3,4’-OH atau orto-diOH pada cincin A atau 3 gugus hidroksil yang berdampingan pada cincin B.
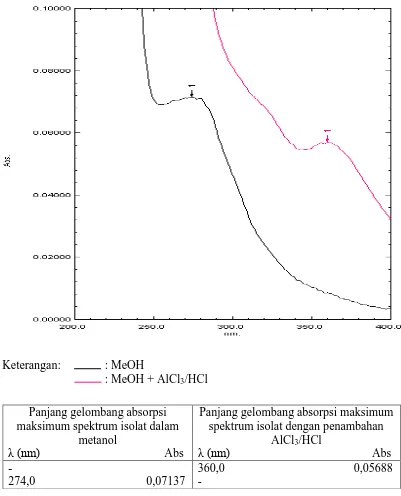
3. Hasil spektrum isolat F1 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N menunjukkan adanya absorpsi maksimum pada pita I yaitu 360 nm bila dibandingkan dengan spektrum dalam metanol
(lampiran 25 halaman 72). Ini menunjukkan tidak dijumpai adanya gugus 5-OH bebas, dimana seharusnya terjadi pergeseran batokromik sebesar 17-20 nm
OH
Spektrum isolat F1 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N ternyata tidak terjadi pergeseran pada pita I bila dibandingkan dengan spektrum dalam metanol dengan penambahan aluminium
klorida 5% b/v (lampiran 26 halaman 73). Dengan demikian, tidak dijumpai adanya 3 gugus OH yang berdampingan pada cincin B, dimana seharusnya
terjadi pergeseran hipsokromik sebesar 20 nm pada pita I.
4. Hasil spektrum isolat F1 dalam metanol dengan penambahan natrium asetat terjadi pergeseran batokromik sebesar 6 nm pada pita II yaitu 280 nm dengan
kenaikan intensitas bila dibandingkan dengan spektrum dalam metanol (lampiran 27 halaman 74), maka pada senyawa flavonol ini dijumpai adanya
gugus 7-OH bebas.
Spektrum diukur kembali setelah 5 menit, hasil menunjukkan tidak terjadi penguraian (lampiran 28 halaman 75).
5. Hasil spektrum isolat F1 dalam metanol dengan penambahan natrium asetat dan asam borat terjadi pergeseran batokromik sebesar 1 nm pada pita II yaitu 275 nm dengan kenaikan intensitas bila dibandingkan dengan spektrum dalam
metanol (lampiran 29 halaman 76), ini menunjukkan tidak dijumpai adanya gugus orto-diOH pada cincin B, dimana seharusnya terjadi pergeseran
batokromik sebesar 12-30 nm pada pita I.
Menurut Harborne (1987), flavonol sering terdapat sebagai glikosida, walaupun telah dikenal 2 atau 300 aglikon flavonol, yang umum hanya 3 saja: kemferol, kuersetin dan mirisetin. Kuersetin 7-glukosida sebagai contoh, dalam
pengembang asam asetat 15% mempunyai harga Rf = 0,1 dan dalam pengembang BAA mempunyai harga Rf 0,32. Isolat F1 berfluoresensi hijau kekuningan dan Rf
yang diperoleh sangat kecil sehingga dapat diduga golongan flavonol glikosida.
Penafsiran spektrum UV untuk isolat F4 adalah sebagai berikut:
1. Hasil spektrum isolat F4 dalam metanol memberikan 2 pita absorpsi maksimum
yaitu 323 nm (pita I) yang menunjukkan adanya absorpsi pada cincin B (sinamoil) dan 289 nm (pita II) yang menunjukkan adanya absorpsi pada cincin A (benzoil) (lampiran 30 halaman 77). Absorpsi maksimum pada pita I sesuai
untuk senyawa flavanon yaitu 300-330 nm dan absorpsi maksimum pada pita II sesuai dengan absorpsi maksimum senyawa flavanon yaitu 270-295 nm
sehingga diduga isolat F4 adalah senyawa flavanon.
2. Hasil spektrum isolat F4 dalam metanol dengan penambahan natrium hidroksida 2 N menunjukkan adanya pergeseran hipsokromik sebesar 16 nm
pada pita II yaitu 273 nm bila dibandingkan dengan spektrum dalam metanol (lampiran 31 halaman 78). Ini menunjukkan bahwa pada senyawa flavanon ini
tidak dijumpai adanya gugus 5,7-OH pada cincin A, dimana seharusnya terjadi pergeseran batokromik sebesar 35 nm pada pita II.
Spektrum diukur kembali setelah 5 menit, hasil menunjukkan tidak terjadi
3. Hasil spektrum isolat F4 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N terjadi pergeseran batokromik sebesar 11 nm pada pita II yaitu 300 nm dengan kenaikan intensitas bila dibandingkan
dengan spektrum dalam metanol (lampiran 33 halaman 80). Pergeseran ini menunjukkan tidak dijumpai adanya gugus 5-OH, dimana seharusnya terjadi
pergeseran batokromik sebesar 20-26 nm pada pita II.
Hasil spektrum isolat F4 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N terjadi pergeseran hipsokromik sebesar 2
nm pada pita II yaitu 300 nm dengan kenaikan intensitas bila dibandingkan dengan spektrum dalam metanol dengan penambahan aluminium klorida 5%
b/v (lampiran 34 halaman 81). Ini menunjukkan tidak dijumpai adanya gugus 5-OH, dimana seharusnya terjadi pergeseran hipsokromik sebesar 10-15 nm pada pita II.
4. Hasil spektrum isolat F4 dalam metanol dengan penambahan natrium asetat terjadi pergeseran hipsokromik sebesar 13 nm pada pita II yaitu 276 nm dengan penurunan intensitas bila dibandingkan dengan spektrum dalam metanol
(lampiran 35 halaman 82), ini menunjukkan tidak dijumpai adanya gugus 7-OH bebas, dimana seharusnya terjadi pergeseran batokromik sebesar 34-37 nm
pada pita II.
Spektrum diukur kembali setelah 5 menit, ternyata tidak terjadi penguraian pada pita II (lampiran 36 halaman 83) yang menunjukkan tidak dijumpai
adanya gugus 5,6,7-triOH pada cincin A.
5. Hasil spektrum isolat F4 dalam metanol dengan penambahan natrium asetat dan
nm dengan penurunan intensitas bila dibandingkan dengan spektrum dalam metanol (lampiran 37 halaman 84), ini menunjukkan tidak dijumpai adanya gugus 6,7-diOH pada cincin A, dimana seharusnya terjadi pergeseran
batokromik sebesar 10-15 nm pada pita II.
Hasil spektrum di atas menunjukkan bahwa senyawa tersebut adalah
golongan flavanon. Kesimpulan ini didukung dari tabel harga Rf beberapa golongan flavanon menurut Harborne (1987), salah satu contohnya adalah dihidrokuersetin yang mempunyai harga Rf = 0,78 dalam pengembang BAA,
mempunyai harga Rf = 0,67 dalam pengembang asam asetat 30% dan mempunyai panjang gelombang maksimum dalam etanol 289 nm untuk pita II dan 325 nm
untuk pita I.
Penafsiran spektrum UV untuk isolat F5 adalah sebagai berikut:
1. Hasil spektrum isolat F5 dalam metanol memberikan 2 pita absorpsi maksimum
yaitu 320 nm (pita I) yang menunjukkan adanya absorpsi pada cincin B (sinamoil) dan 285 nm (pita II) yang menunjukkan adanya absorpsi pada cincin A (benzoil) (lampiran 38 halaman 85). Absorpsi maksimum pada pita I sesuai
untuk senyawa flavanon yaitu 300-330 nm dan absorpsi maksimum pada pita II sesuai dengan absorpsi maksimum senyawa flavanon yaitu 270-295 nm
sehingga diduga isolat F5 adalah senyawa flavanon.
2. Hasil spektrum isolat F5 dalam metanol dengan penambahan natrium hidroksida 2 N terjadi pergeseran batokromik sebesar 9 nm pada pita II yaitu
flavanon ini tidak dijumpai adanya gugus 5,7-OH pada cincin A, dimana seharusnya terjadi pergeseran batokromik sebesar 35 nm pada pita II.
Spektrum diukur kembali setelah 5 menit, ternyata tidak terjadi penguraian
pada pita II (lampiran 40 halaman 87), ini menunjukkan tidak dijumpai adanya gugus orto-diOH pada cincin A.
3. Hasil spektrum isolat F5 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N bila dibandingkan dengan spektrum dalam metanol terjadi pergeseran batokromik sebesar 15 nm pada pita II yaitu 300 nm
dengan kenaikan intensitas (lampiran 41 halaman 88). Pergeseran ini menunjukkan tidak dijumpai adanya gugus 5-OH, dimana seharusnya terjadi
pergeseran batokromik sebesar 20-26 nm pada pita II.
Hasil spektrum isolat F5 dalam metanol dengan penambahan aluminium klorida 5% b/v dan asam klorida 6 N bila dibandingkan dengan spektrum dalam
metanol terjadi pergeseran hipsokromik sebesar 1 nm pada pita II dengan kenaikan intensitas (lampiran 42 halaman 89). Ini menunjukkan tidak dijumpai adanya gugus 5-OH, dimana seharusnya terjadi pergeseran hipsokromik
sebesar 10-15 nm pada pita II.
4. Hasil spektrum isolat F5 dalam metanol dengan penambahan natrium asetat
terjadi pergeseran hipsokromik sebesar 5 nm pada pita II yaitu 280 nm dengan penurunan intensitas bila dibandingkan dengan spektrum dalam metanol (lampiran 43 halaman 90) yang menunjukkan tidak dijumpai adanya gugus
Spektrum diukur kembali setelah 5 menit, hasil menunjukkan tidak terjadi penguraian (lampiran 44 halaman 91) yang menunjukkan tidak dijumpai adanya gugus 5,6,7-triOH pada cincin A.
5. Hasil spektrum isolat F5 dalam metanol dengan penambahan natrium asetat dan asam borat tidak terjadi pergeseran pada pita II dengan penurunan intensitas
bila dibandingkan dengan spektrum dalam metanol (lampiran 45 halaman 92). Ini menunjukkan bahwa pada senyawa flavanon ini tidak dijumpai adanya gugus 6,7-diOH pada cincin A, dimana seharusnya terjadi pergeseran
batokromik sebesar 10-15 nm pada pita II.
Hasil spektrum isolat F4 dan F5 menunjukkan bahwa kedua senyawa tersebut adalah golongan flavanon yang belum diketahui posisi gugus OH-nya
dengan penambahan pereaksi geser.
Menurut Mabry, et al. (1970), penambahan natrium asetat dan asam borat
terjadi pergeseran 10-15 nm pada pita I menunjukkan dijumpai adanya gugus 6,7-diOH pada cincin A, sedangkan menurut Markham (1988), penambahan natrium
asetat dan asam borat terjadi pergeseran 10-15 nm pada pita II menunjukkan dijumpai adanya gugus 6,7-diOH pada cincin A, sehingga tidak dapat dipastikan senyawa flavanon ini memiliki gugus 6,7-diOH pada cincin A dan diduga
yang diidentifikasi dengan penambahan pereaksi geser tidak dapat diketahui posisi gugus OH-nya, sehingga peneliti tersebut menyimpulkan senyawa flavanon yang diperoleh adalah golongan flavanon dengan gugus OH bebas kemungkinan terikat
BAB V
KESIMPULAN DAN SARAN 5.1 Kesimpulan
Hasil karakterisasi simplisia daun sukun adalah kadar air 6,66%, kadar sari larut air 12,60%, kadar sari larut etanol 11,40%, kadar abu total 14,20% dan kadar
abu tidak larut asam 4,70%. Hasil skrining fitokimia serbuk simplisia daun sukun menunjukkan adanya golongan senyawa flavonoida, steroida/triterpenoida, saponin, tanin dan glikosida. Karakteristik simplisia daun sukun yang diperoleh
berbeda dengan karakteristik simplisia daun sukun yang terdapat pada hasil penelitian sebelumnya. Hasil skrining fitokimia serbuk simplisia daun sukun sama
dengan hasil penelitian sebelumnya.
Hasil identifikasi isolat F1, F4 dan F5 secara spektrofotometri UV dengan penambahan pereaksi geser (shift reagent) diperoleh F1 adalah golongan flavonol
dengan gugus OH pada posisi 3,7. F4 dan F5 adalah golongan flavanon.
5.2 Saran
Disara