Teknologi Rhizobium pada Tanaman Kedelai
Muchdar SoedarjoBalai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Malang
PENDAHULUAN
Rhizobium, Bradyrhizobium, dan Azorhizobium yang lazim dikenal dengan istilah rhizobia dapat bersimbiosis dengan tanaman kacang-kacangan (Long 1996). Simbiosis diawali dengan pembentukan bintil akar dan rhizobia dalam bintil akar atau batang (bakteroid) menambat nitrogen dari atmosfer. Nitrogen dalam bentuk gas kemudian direduksi menjadi N tersedia untuk tanaman inang, sedangkan tanaman inang memasok fotosintat pada rhizobia sebagai sumber energi.
Beberapa proses penting dalam pembentukan bintil akar adalah perkembangan rhizobia di sekitar perakaran, melekatnya rhizobia pada bulu akar, perubahan bentuk bulu akar (root hair deformation, Had), pem-bengkokan ujung bulu akar (root hair curling, Hac), pembentukan calon (primordium) bintil akar, pembentukan benang infeksi, infeksi oleh rhizobia melalui benang infeksi, perkembangan rhizobia dalam bintil akar yang akhirnya berdiferensiasi menjadi bentuk bakteroid (Fisher and Long 1992, Denarie and Cullimore 1993, Vijn et al. 1993, Fellay et al. 1994, Relic et al. 1994, Long 1996).
Bintil akar efektif akan terbentuk bila terdapat kesesuaian (compatibility) antara tanaman inang dengan (Brady)Rhizobium (Lerouge et al. 1990, Schultz et al. 1992, Sanjuan et al. 1992). Bintil akar efektif adalah bintil akar yang dapat menambat N dari udara, dan bila dibelah bintil akar efektif berwarna merah karena adanya leghaemoglobin. Faktor abiotik dan biotik seperti kemasaman tanah (Muns and Keyser 1981, Soedarjo et al. 2003b, Soedarjo dan Sucahyono 2005), kelembaban tanah (Osa-Afiana dan Alexander 1979), Suhu tanah, senyawa organik dan anorganik sebagai sumber nutrisi (Dazzo et al. 1984, Tepfer et al. 1988, Murphy et al. 1995, Savka dan Farrand 1997, Soedarjo 1997), densitas sel rhizobium tanah (Brockwell et al. 1988, Singleton dan Tavares 1986) mempengaruhi proses pembentukan bintil akar.
Fiksasi N2 merupakan proses enzimatis oleh enzim nitrogenase dan memerlukan banyak energi. Oleh karena itu, sintesis dan fungsi enzim nitrogenase akan dikontrol melalui protein pengatur ‘regulatory proteins’ dan protein-protein lain yang diekspresi dari gen-gen nif dan fix (Fischer 1994). Gen nifD, nifK, dan nifH merupakan gen struktural yang masing-masing
mengode protein α FeMo protein, β FeMo protein dan Fe protein. Protein α FeMo, β FeMo merupakan bagian dari protein α β FeMo yang dalam bentuk aktif berupa homodimer α2β2 FeMo.
Inokulasi rhizobium di lapang bertujuan untuk meningkatkan nodulasi dan fiksasi N2 dari atmosfer. Akan tetapi, inokulasi tidak selalu meningkatkan nodulasi dan fiksasi N2. Faktor-faktor yang menghambat pertumbuhan tanaman kedelai pada umumnya dapat menurunkan nodulasi dan fiksasi N2 karena rhizobium membutuhkan fotosintat dari tanaman inang sebagai sumber energi. Faktor lingkungan seperti kemasaman, suhu, kelembaban tanah berpengaruh terhadap nodulasi dan fiksasi N2. Selain itu, kesesuaian rhizobium dengan tanaman inang, densitas sel rhizobium juga berpengaruh terhadap noduladi dan fiksasi N2.
KISARAN INANG BEBERAPA SPESIES RHIZOBIUM
Istilah kisaran inang (host range) digunakan untuk menggambarkan kemampuan suatu spesies rhizobium membentuk bintil akar efektif pada beberapa jenis tanaman kacang-kacangan (Higashi 1993). Rhizobia yang mampu membentuk bintil akar efektif pada satu atau dua tanaman dan beberapa jenis tanaman masing-masing dikenal memiliki kisaran inang sempit (narrow-host range) dan kisaran inang luas (broad-host range) (Tabel 1).
Tabel 1. Spesies Rhizobium dan kisaran tanaman inang.
Rhizobia Tanaman Inang Pustaka
Rhizobium meliloti Medicago, Melilotus, Trigonella Lerouge et al. 1992 Rhizobium etli Kacang (Phaseolus vulgaris) Cardenas et al. 1995 R. leguminasarum bv. trifolii Clover (Trifolium) Bloemberg et al. 1995 Rhizobium tropici kisaran inang luas: kacang, Poupot et al. 1993
lamtoro, alfalfa
Rhizobium NGR234 kisaran inang luas: 18 genera Price et al. 1992 tanaman kacang-kacangan
Rhizobium loti Lotus (Lotus spp) Lopez-Lara et al. 1995 Rhizoblum fredii Kedelai (Glycine max) Bec-Ferte et al. 1994 B. japonicum Kedelai (Glycine max) Sanjuan et al. 1992 Azorrhizobium caulinodans Sesbania rostrata Margaert et al. 1993
PROSES INFEKSI
Proses infeksi dimulai dari perkembang-biakan rhizobia dalam rhizosfer sampai dengan terlepasnya rhizobia ke dalam calon bintil akar. Tanaman kacang-kacangan mengeksudasi asam amino dan senyawa organik lainnya yang berfungsi sebagai kemoatraktan (tertariknya rhizobia ke sumber senyawa kimia) dan sebagai sumber energi untuk perkembangbiakan rhizobia di rhizosfer (Tepfer et al. 1988, Murphy, et al. 1995, Savka dan Farrand 1997, Soedarjo 1997). Kepadatan populasi rhizobia merupakan salah satu faktor penentu terjadinya nodulasi (Brockwell et al. 1988). Nutrisi sekitar perakaran tanaman juga mempengaruhi pola lekat rhizobia pada ujung akar (Dazzo et al. 1984). Pada kondisi kahat Ca2+, daya lekat rhizobia pada akar menurun (Smith et al. 1987).
Rhizobia yang melekat pada ujung akar menyebabkan ujung akar membengkok (Hac+, root hair curling) dan terperangkap dalam lengkungan akar tersebut (Higashi dan Abe 1980). Rhizobia yang terperangkap mungkin mendegradasi dinding sel yang menyebabkan ujung akar membengkok (Mateos et al. 1992). Degradasi dinding sel ini memungkinkan rhizobia masuk ke dalam sel korteks akar melalui benang infeksi (infection threads).
Proses infeksi oleh Bradyrhizobium pada akar tanaman kedelai dijelaskan secara rinci oleh Rolfe dan Gressholf (1988). Tahap awal dari proses ini adalah tanggapan akar tanaman terhadap sinyal, berupa senyawa kimia, yang dikeluarkan oleh Bradyrhizobium. Reaksi terhadap sinyal dari bakteri ini berupa terbentuknya calon bintil akar (primary nodule). Pada saat Bradyrhizobium melekat pada akar dan masuk ke dalam sel bulu akar, calon bintil akar kedua (secondary nodule) terbentuk di bawah calon bintil akar pertama. Benang infeksi terbentuk pada saat calon bintil akar kedua terbentuk.
Perubahan bentuk akar, pembengkokan ujung bintil akar, terbentuknya benang infeksi, bintil akar primer dan sekunder, dan terlepasnya rhizobia ke dalam sel kortek berlangsung karena tanaman inang mengeluarkan senyawa organik (flavonoid) yang dapat dikenali oleh rhizobium (Fisher dan Long 1992, Higashi 1993). Flavonoid dan protein NodD berfungsi untuk mengaktifkan transkripsi dari gen-gen nodulasi (nod genes). Protein yang terekspresi dari gen-gen nodulasi ini mengatalisis reaksi pembentukan senyawa kimia, Nod faktor. Nod faktor inilah yang menyebabkan terjadinya proses nodulasi (Relic et al. 1994). Dengan demikian, antara tanaman kacang-kacangan dan rhizobium terjadi komunikasi dua arah, penulis melukiskan fenomena ini sebagai komunikasi intim.
Setiap jenis tanaman mengeksudasi senyawa flavonoid yang berbeda, sehingga hanya dikenali oleh protein NodD tertentu. Senyawa flavonoid
yang dapat menginduksi gen-gen nodulasi pada alfalfa, clover, vetch, dan kedelai adalah 4,4' -dihydroxy-2'-methoxychalcone (A), 7,4'-dihydroxyflavone (B), 7,3'-dihydroxy-4'- methoxyflavone (C), dan daidzein (D) (Gambar 1). Protein NodD mengandung ujung karboksil (C terminal) yang beragam dan berinteraksi dengan flavonoid, sedangkan ujung amina (N terminal) dari protein NodD yang conserved (sikuense asam aminonya identik) berinteraksi dengan sikuens DNA yang dikenal dengan ‘nod box’ (Spaink et al. 1987). Nod box terletak di depan (upstream) gen-gen nodulasi (Gambar 2).
REGULASI GEN-GEN NOD
Gen-gen yang berperan dalam nodulasi dikelompokkan dalam tiga kategori (Higashi 1993 dan Long 1996). Pertama adalah gen yang berperan mengatur transkripsi dari gen-gen nodulasi, dan protein yang tersintesis (encoded) dari gen ini disebut sebagai protein pengatur (regulatory protein). Gen kelompok kedua adalah gen-gen yang diperlukan untuk pembentukan Nod faktor dan gen-gen tersebut terdapat pada semua spesies (Brady) Rhizobium, yaitu gen-gen nodABC(IJ). Dan kelompok yang ketiga adalah gen-gen yang diperlukan untuk memodifikasi Nod faktor sehingga Nod faktor ini hanya dikenali oleh spesies tanaman tertentu, dengan demikian kelompok ketiga ini sebagai determinan tanaman inang (host specificity determinant). Organisasi gen-gen nodulasi dari beberapa spesies Rhizobium ditunjukkan dalam Gambar 2. O O O O O O OH OH OH OH HO HO OCH3 OCH3 HO HO
(A)
(B)
(C)
(D)
Gambar. 1. Senyawa flavonoid Alfalfa (A = 4,4' -dihydroxy-2'-methoxychalcone), clover (B= 7,4'-dihydroxyflavone), vetch (C= 7,3'-dihydroxy-4'- methoxyflavone), kedelai (D= daidzein) yang dihasilkan oleh beberapa tanaman dan dapat menginduksi gen-gen nodulasi (Kijne 1992).
Flavonoid (nod gene inducer, lihat Gambar 1) berinteraksi dengan protein NodD untuk mengaktifkan transkripsi dari gen-gen nod. Untuk dapat mengaktifkan transkripsi suatu gen, flavonoid dan protein NodD melekat pada ‘nod box’ promoter (Gottfert 1993). Nod box terletak dalam promoter dari suatu gen atau operon, sikuens nukleotida dari ‘nod box’ ini ‘highly conserved’ (Gambar 2). Rhizobium meliloti mengandung 3 NodD dan SyrM (Gambar 2). Dalam hal ini, NodDl dan flavonoid (luteolin), NodD2 berinteraksi dengan methoxychalcone, berperan menginduksi transkripsi gen-gen nod. NodD3 juga dapat berinteraksi dengan flavonoid, akan tetapi dengan SyrM tidak diperlukan flavonoid untuk menginduksi transkripsi gen nodulasi. Protein NodD dikenal sebagai protein pengaktif karena fungsinya. Disamping protein pengaktif, juga terdapat protein penekan (repressor), NolR, yang terdapat pada beberapa strain R. meliloti (Kondorosi et al. 1989). Tidak dijumpai NolR pada spesies lain Rhizobium. Mutasi pada gen no1R menyebabkan keterlambatan pembentukan bintil akar. Hal ini meng-indikasikan bahwa protein NolR tidak sepenuhnya sebagai protein penekan akan tetapi sebagai pengatur (fine-tuner).
Pada Bradyrhizobium japonicum, gen nodW diperlukan untuk nodulasi pada beberapa tanaman inang dan mutasi pada gen ini menyebabkan gen-gen nodulasi lainnya tidak terekspresi secara sempurna (Stacey et al. 1994). Gen nodPQ dan nodH berfungsi sebagai ATP sulfurilase dan sulfotransferase Gambar. 2. Organisasi gen-gen nodulasi pada beberapa spesies Rhizobium (Higashi 1993). Arah panah menunjukkan arah transkripsi. Lingkaran atau kotak hitam sebelum anak panah (gen) adalah nod box, pSym dan kromosom menunjukkan bahwa gen-gen nodulasi terletak pada plasmid (symbiotic plasmid) dan kromosom.
T J C B A I X N M L R E F D J I A B C D F E L O T N M F H syrM D3 L Q P G E C IJ D1 A B H I N F G M II I I nol D2 D1 Y A B C S U I J Z V W
Rhizobium leguminosarum bv. TrifoliiANU843 pSym
Rhizobium leguminosarum bv. viciae pSym
Rhizobium meliloti pSym
Bradyrhizobium japonicum Kromosom
T J C B A I X N M L R E F D A B C I J T X N M L R E F D J I A B C D F E L O T N M L E F D A B C I J O T N M F H syrM D3 L Q P G E C IJ D1 A B H I N F G M F GH I N D1 A B C IJ Q P G E F H syrM D3 L M F GH I N D1 A B C IJ Q P G E F H syrM D3 L M II I I nol D2 D1 Y A B C S U I J Z V W II I I nol D2 D1 Y A B C S U I J Z V W II I I nol D2 D1 Y A B C S U I J Z V W
Rhizobium leguminosarum bv. TrifoliiANU843 pSym
Rhizobium leguminosarum bv. viciae pSym
Rhizobium meliloti pSym
pada R. meliloti (Hirsch 1992). Aktivitas kedua gen ini penting untuk mem-bentuk gugus sulfat pada ujung reduksi (reducing end, Gambar 3). Di samping berdasarkan hasil percobaan in vitro, fungsi dari gen-gen nodulasi didasar-kan pada kesamaan fungsi dengan fungsi protein yang telah diketahui dari organisme lain. Sebagai contoh, protein dari gen nodM mempunyai kesamaan fungsi dengan protein dari gen glms pada E. codi (Baev et al. 1991). Gen g1mS pada E. coli membentuk enzim (protein) yang mensintesis D-glucosamine, merupakan bahan sintesis Nod faktor. Fungsi dari gen-gen nodulasi telah diulas secara rinci oleh Higashi (1993), Hirsch (1992), dan Long (1990). Tidak seperti pada Rhizobium spp, Bradyrhizobium japonicum tidak mempunyai plasmid, sehingga gen-gen nod terdapat kromosom (Gambar 3).
SINTESIS NOD FAKTOR (LCO)
Nod faktor adalah oligomer dari N-acetylglucosamine dengan beberapa modifikasi pada ujung reduksi (reducing end) maupun ujung nonreduksi (non-reducing end) (Long 1996). Nod faktor juga dikenal dengan ‘Lipo-Chito-Oligosaccharide’ (LCO). Istilah reduksi dan nonreduksi diperoleh secara kesepakatan, tidak berhubungan dengan reaksi oksidasi maupun reduksi senyawa kimia (Gambar 3).
CH2OH HO HO CH2OH OH NH CO CH3 CH CH3 3 NH CO (CH2)7 CH (CH2)7 NH CO CH3 HO HO CH2 O OCH3 OH OH CH3 O
(ujung non-reduksi, non-reducing end) (ujung reduksi, reducing end)
Sintesis Nod faktor dikatalisis oleh enzim-enzim yang terekspresi dari gen-gen nodulasi (Higashi 1993; long 1996). Modifikasi Nod faktor terjadi pada ujung reduksi atau non-reduksi (sebelah kiri dan kanan). Modifikasi tersebut adalah hasil aktivitas dari enzim-enzim yang terekspresi dari gen yang berperan sebagai determinan tanaman inang (host specificity genes). Nod faktor yang dihasilkan oleh R. meliloti, NodRM-IV (S), mengandung gugus sulfat pada carbon-6 di ujung reducing (Denarie et al. 1992). Nod faktor tanaman kedelai terdiri dari 5 N-acetylglucosamine residu yang dihubungkan satu sama lainnya oleh b-1,4, pada non-reducing end diasilasi (N-acylation) oleh cis-asam vaksinik (vaccinic acid) dan pada ‘reducing end’ mengalami O-methylfukosilasi (O-methylfucosylation) (Carlson et al. 1993). Modifikasi ini memungkinkan Nod faktor dikenal (recognized) oleh tanaman inang tertentu sehingga terbentuk bintil akar efektif. Dengan demikian terjadi komunikasi intim antara Rhizobium dengan tanaman inang, komunikasi ini berupa pertukaran dan pengenalan sinyal yaitu flavonoid (oleh tanaman inang) dan Nod faktor (oleh Rhizobium).
Hasil penelitian in vitro menunjukkan bahwa Nod faktor menginduksi terbentuknya bintil akar dan juga sebagai sinyal sehingga rhizobia dapat masuk ke dalam akar melalui benang infeksi (Relic et al. 1994). Mereka juga melaporkan bahwa pada konsentrasi 10-6 M, Nod faktor menghambat
pertumbuhan tanaman. Gejala seperti pembengkokan ujung akar juga terlihat pada akar tanaman yang diinokulasi dengan mutan Rhizobium (tidak mengandung nodABC) setelah ke dalam sistem perakaran tersebut di-tambahkan Nod faktor.
MODEL PERTUKARAN SINYAL ANTARA RHIZOBIA
DAN TANAMAN INANG
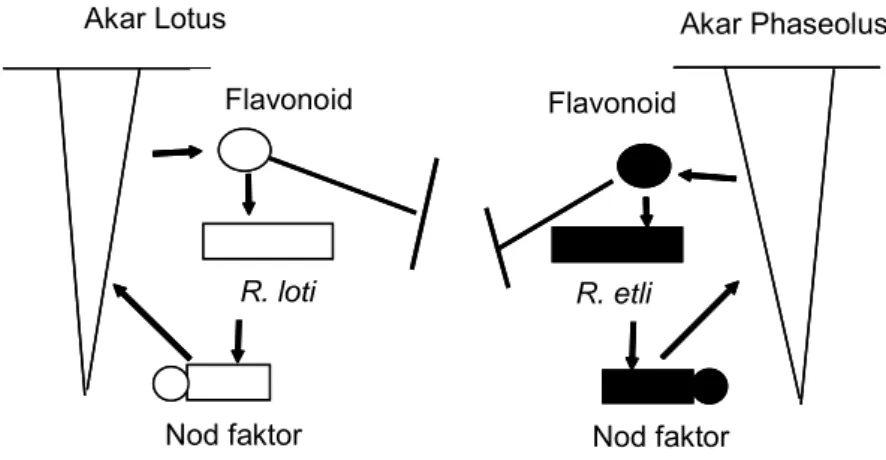
Setiap tanaman kacang-kacangan menghasilkan flavonoid tertentu yang dapat menginduksi gen-gen nod pada suatu spesies Rhizobium (Gambar 4, Long 1996). Flavonoid yang dihasilkan oleh lotus hanya dikenali oleh R. loti dan dapat menginduksi terbentuknya Nod faktor, sedangkan flavonoid dari Phaseolus hanya dikenali oleh R. etli dan menginduksi terbentuknya Nod faktor. Selanjutnya, Nod faktor yang terbentuk oleh R. loti dan R. etli menyebabkan terbentuknya bintil akar masing-masing pada tanaman lotus dan Phaseolus. Demikian juga pada simbiosis tanaman kedelai dengan Bradyrhizobium, flavonoid yang dieksudasi akar tanaman kedelai hanya dikenali oleh Bradyrhizobium dan tidak oleh Rhizobium yang bersimbiosis dengan tanaman lotus dan Phaseolus.
FIKSASI N
2DARI ATMOSFER
Proses fikasasi N2 dari atmosfer oleh (Brady)rhizobium spp. berlangsung secara enzimatis. Reaksi enzimatis ini dikatalisir oleh enzim nitrogenase, merupakan enzim kompleks yang terdiri dari dua komponen terpisah yaitu protein Fe (disebut juga komponen II atau dinitrogenase reduktase) dan protein MoFe (disebut juga komponen I atau dinitrogenase) (Dean and Jacobson 1992). Protein Fe berperan sebagai pengikat ATP (ATP-binding) dan donor elektron untuk mereduksi protein MoFe. Sedangkan protein MoFe merupakan tempat melekatnya substrat (substrate binding) dan tempat berlangsungnya proses reduksi. Selama proses fiksasi, protein Fe akan mengikat 2 molekul MgATP, mengalami reduksi, berasosiasi dengan protein MoFe dan mentransfer 1 (satu) elektron ke protein MoFe dalam suatu reaksi yang menyebabkan terjadinya hidrolisis ATP dan disosiasi kedua protein tersebut.
N2 + 8e- + 8H+ +16 MgATP 2NH
3 + H2 + 16MgADP + 16 Pi
Nitrogenase
Persamaan reaksi enzimatis di atas menggambarkan bahwa proses fiksasi memerlukan banyak energi untuk mereduksi 1 molekul N2 menjadi 2 molekul amonia yang dapat dimanfaatkan oleh tanaman. Sampai dengan 40 mol ATP mungkin diperlukan untuk mereduksi 1 mol N2 menjadi ammonia (Hill 1992). Oleh karena protein Fe hanya dapat mentransfer 1 elektron, maka dalam proses reduksi N2 tersebut diperlukan beberapa daur proses asosiasi dan disosiasi dari dua komponen enzim nitrogenase, protein Fe dan MoFe.
Gambar 4. Skema pertukaran sinyal antara tanaman inang dengan Rhizobium.
Akar Lotus Akar Phaseolus
Flavonoid Flavonoid
R. etli R. loti
Nod faktor Nod faktor
Akar Lotus Akar Phaseolus
Flavonoid Flavonoid
R. etli R. loti
ORGANISASI DAN FUNGSI GEN-GEN FIKSASI NITROGEN
Gen-gen yang diperlukan dalam proses fiksasi N2 (gen-gen nif dan fix) dikelompokkan ke dalam gen yang berperan untuk mensintesis polipeptida nitrogenase, mensintesis dan menginkorporasi kofaktor nitrogenase, menentukan fungsi dalam simbiosis, dan gen-gen pengatur (Fischer 1996). Peran gen-gen nif pada rhizobia (Rhizobium, Bradyrhizobium dan Azorhibium) dan Klebsiella serupa, sedangkan gen-gen fix tidak serupa dengan gen-gen fix pada Klebsiella (Fischer 1994).
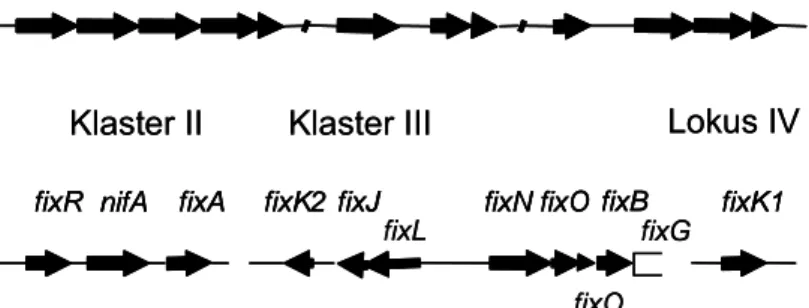
Bradyrhizobium tidak mempunyai plasmid sehingga gen-gen yang diperlukan untuk nodulasi pada tanaman kedelai dan proses fiksasi N2 terdapat pada kromosom. Gen-gen nif dan fix pada Bradyrhizobium terorganisir dalam tiga klaster, sedangkan gen fixK1 tersusun dalam lokus ke 4 (Gambar 5) (Fischer 1994). Gambar 5 juga menunjukkan bahwa pada umumnya gen-gen fiksasi nitrogen pada Bradyrhizobium terekspresi dalam bentuk ‘Operon’, yaitu satu transkripsi untuk beberapa gen.
Gen nifD dan nifK yang tersusun daam satu operon dengan gen nifENX masing-masing mengkode protein α dan β. Protein α dan β merupakan unit penyusun dinitrogense (protein FeMo) dan satu molekul enzim dinitrogenase memerlukan dua molekul dari masingmasing protein α dan β. Sehingga berat 1 molekul protein α2β2 FeMo kurang lebih 220.000.
Sedangkan protein Fe (ditrogenase reduktase) terekspresi dari gen nifH dan mempunyai berat molekul kurang lebih 60.000. Dengan demikian nifD, nifK dan nifH merupakan gen-gen struktural dari enzim nitrogenase. Sedangkan gen-gen yang lainnya diperlukan untuk sintesis kofaktor dari enzim nitrogenase (nifENB) dan meningkatkan aktivitas enzim nitrogenase (seperti nifS dan nifB) (Fisher 1994).
Gambar 5 Organisasi gen-gen nif dan fix pada Bradyrhizobium japonicum (Fischer 1994).
nifE nifN nifX
nifD nifK nifS nifB frxA nifH fixB fixC fixX
Klaster I
Klaster II
fixL
fixO fixG fixR nifA fixA fixK2 fixJ fixN fixO fixB fixK1
Klaster III Lokus IV
nifE nifN nifX
nifD nifK nifS nifB frxA nifH fixB fixC fixX
Klaster I
Klaster II
fixL
fixO fixG fixR nifA fixA fixK2 fixJ fixN fixO fixB fixK1 fixR nifA fixA fixK2 fixJ fixN fixO fixB fixK1
Tidak seperti pada R. meliloti, gen fixA terpisah dari operon gen fixBCX pada B. japonicum (Gambar 5). Gen fixA dan fixBCX esensial untuk fiksasi nitrogen karena diasumsikan berperan pada transport elektron ke enzim nitrogenase (Earl et al. 1987, Gubler dan Hennecke 1986). Gen lainnya yang tersusun dalam operon adalah fixNOQP dan dipostulasikan mempunyai fungsi dalam respirasi bakteroid (rhizobium dalam bintil akar) pada kondisi rendah oksigen (Preisig et al. 1993). Gen fixR yang tersusun dalam satu operon dengan gen nifA mungkin berperan dalam proses oksidasi dan reduksi (Baker 1992).
REGULASI EKSPRESI GEN NIF DAN FIX
Proses fiksasi N2 merupakan proses yang memerlukan energi tinggi dan enzim yang diperlukan untuk proses tersebut sangat peka terhadap oksigen. Tanaman kedelai memerlukan kondisi aerob (cukup oksigen) untuk tumbuh optimal. Oleh karena itu, mikroba simbion harus mengembangkan suatu mekanisme dimana proses fiksasi hanya akan berlangsung pada saat diperlukan dan sistem yang dapat menjamin proses fiksasi optimal walaupun lingkungan tumbuh kedelai aerobik.
Ekspresi gen-gen yang diperlukan untuk proses fiksasi N2 dikontrol melalui aktivitas gen-gen pengatur, fixLJK, nifA (regulatory genes). Dengan sistem ini rhizobium dapat mengetahui (sense) kondisi optimal yang diperlukan untuk proses fiksasi N2 dan meneruskan informasi (sinyal) ini untuk mengekspresi gen-gen fiksasi N2. Tingkat ketersedian O2 dalam sel sangat berpengaruh terhadap ekspresi gen-gen fiksasi N2.
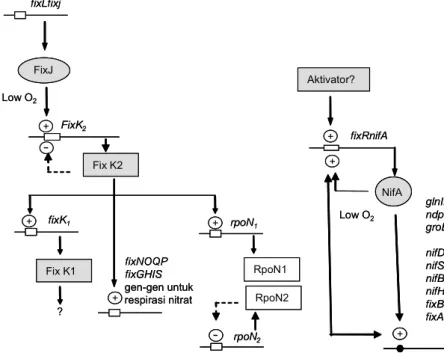
Gen-gen pengatur (fixL, fixJ, fixK, nifA dan rpoN) pada B. japonicum, R. meliloti dan A. caulinodans pada umumnya identik. Berbeda dengan R. meliloti dan A. caulinodan, ekspresi nifA pada B. japonicum tidak tergantung pada expresi gen fixJ dan fixK (Gambar 6) (Fisher 1994). Selain itu, ekspresi gen nifA pada B. japonicum tidak dipengaruhi oleh ekspresi gen ntrC, gen pengatur pada respon nitrogen.
Seperti pada R. meliloti gen pengatur fixL dan fixJ diperlukan untuk transkripsi gen-gen fixNOPQ dan fixGHIS pada B. japonicum. Gen fixL dan fixJ tersusun (organized) dalam operon dan masing-masing mengkode protein 55 kDa dan 22 kDa. Ekspresi fixL dan fixJ terjadi baik pada kondisi aerob atau anaerob. Mutasi pada gen fixL dan fixJ menurunkan laju fiksasi N2 sampai dengan 90%. Oleh karena ujung C (C-terimnal) dari protein FixL identik dengan sensor protein dari sistem dua komponen (two-component system), maka protein FixL diasumsikan berperan dalam sensing lingkungan dan akan mengalami ‘autophosphorylation’ (Monson et al. 1992, Monson
et al. 1993). Fungsi protein FixL meningkat pada kondisi oksigen rendah (Fischer 1994).
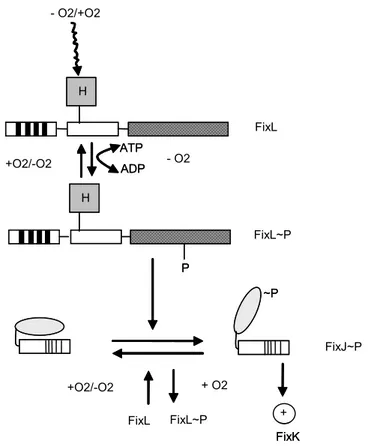
Protein FixL terbagi dalam tiga domain, yaitu ujung N yang mempunyai bagian yang terinkorporasi pada dinding sitoplasma, bagian tengah mengandung heme moiety dan mengikat O2, dan ujung C yang mengandung lokasi terjadinya autofosforilasi (Gambar 7) (Fisher 1994). Ujung C dari protein FixL ini homologous dengan protein lainnya yang tergolong dalam two-component system. Sehingga, protein FixL diasumsikan termasuk bagian dari two-component system. Pada kondisi kurang O2 autofosoforilasi pada protein FixL akan meningkat.
Protein FixJ pada B. japonicum mempunyai 205 residu asam amino dan kurang lebih sama dengan jumlah residu asam amino (204) pada R. meliloti. Ujung N dari protein FixJ mengandung asam amino aspartat pada residu 10, 11 dan 54 (Asp-10, Asp-11 dan Asp-54) dan lisin pada residu 104 (Lys-104) dan keberadaan keempat asam amino tersebut merupakan karakteristik dari protein yang berfungsi pada two-component response Gambar 6. Regulasi gen-gen nif dan fix pada Bradyrhizobium japonicum (skema oleh Fisher 1994, pustaka untuk membuat skema adalah Anthamatten et al. 1992, Fischer et al. 1986, Kullik et al. 1991, Thony et al. 1987, Thony et al. 1989). Anak panah dengan garis utuh dan anak panah dengan garis putus-putus menunjukkan regulasi gen positif dan negatif.
Low O2 Fix K2 Aktivator? + + + + + + NifA RpoN1 RpoN2 FixJ Low O2 fixLfixj FixK2 fixK1 + rpoN1 rpoN2 Fix K1 ? fixNOQP fixGHIS gen-gen untuk respirasi nitrat fixRnifA glnII ndp groESL3 nifDKENX nifS nifBfrxA nifH fixBCX fixA Low O2 Fix K2 Aktivator? + + + + + + + + + + + + + NifA NifA RpoN1 RpoN2 FixJ FixJ Low O2 fixLfixj FixK2 fixK1 + + rpoN1 rpoN2 Fix K1 ? fixNOQP fixGHIS gen-gen untuk respirasi nitrat fixRnifA glnII ndp groESL3 nifDKENX nifS nifBfrxA nifH fixBCX fixA
regulators (Parkinson and Kofoid 1992). Asam amino aspartat pada posisi 54 (Asp-54) mungkin merupakan lokasi fosforilasi karena mutasi pada asam amino di residu dekat dengan Asp-54 menurunkan fosforilasi oleh protein FixL (Weinstein et al. 1992). Pada kondisi tidak terfosforilasi, bagian ujung N dari protein FixJ mencegah terjadinya transkripsi FixJ. Protein FixJ mengalami perubahan bentuk setelah terfosforilasi oleh FixL dan menyebabkan terjadinya transkripsi FixJ (Gambar 7) (Fischer 1994).
Gambar 7. Model ekspresi gen fixK pada B. japonicum yang dikendalikan melalui protein FixLJ (Fisher 1994). Garis vertikal tebal hitam pada ujung terminal FixL bagian yang terinkorporasi pada dinding sitoplasma, kotak berhuruf H adalah heme moiety untuk mengetahui sinyal oksigen dan garis miring pada ujung C dari FixL adalah domain yang conserved yang umum dijumpai pada ‘protein sensor dari two-component regulatory system dan pada domain terdapat tempat fosforilasi. Protein FixJ mengandung dua domain, yaitu ujung N (bulat telur) merupkan tempat fosforilasi oleh protein FixL dan ujung C yang mengandung helix-turn-helix (garis vertikal).
H H - O2/+O2 ADP ATP - O2 FixL~P FixL +O2/-O2 ~P P FixJ~P + O2 +O2/-O2 FixL FixL~P + FixK H H - O2/+O2 ADP ATP - O2 FixL~P FixL +O2/-O2 ~P P FixJ~P + O2 +O2/-O2 FixL FixL~P + FixK
FAKTOR YANG MEMPENGARUHI NODULASI DAN
EFEKTIVITAS RHIZOBIUM
Kesesuaian Genotipe Kedelai dan Rhizobium
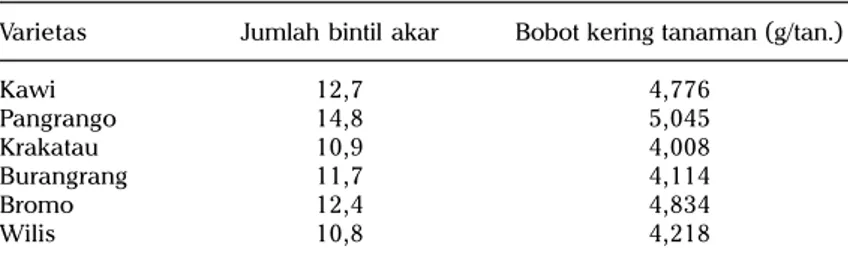
Dalam simbiosis, tanaman inang akan mengeksudasi falvonoid yang dapat dikenali oleh rhizobium untuk mensintesis Nod faktor sebagai awal dari nodulasi. Oleh karena itu, kesesuaian genetik antara Bradyrhizobium spp. dan tanaman inang menentukan infektivitas dan efektivitas Bradyrhizobium spp. (Patterson and Larue 1983, DuTeau et al. 1986, Betts and Herridge 1987, Cregan et al. 1989, Champion et al. 1992, Qian et al. 1996). Nodulasi terbatas oleh strain Bradyrhizobium tertentu dapat dimanfaatkan untuk menghasilkan genotipe tanaman yang hanya dapat membentuk bintil akar dengan strain yang sangat efektif (Champion et al. 1992, Qian et al. 1996). Seringkali, inokulasi Bradyrhizobium sp. tidak meningkatkan nodulasi, serapan N serta pertumbuhan tanaman (Adisarwanto, komunikasi pribadi). Hal ini mungkin disebabkan oleh ketidaksesuaian genetik antara inokulum dengan tanaman kedelai. Akan tetapi hasil kajian menunjukkan bahwa pengaruh interaksi antara genotipe tanaman kedelai (berbiji besar dan sedang) dengan Bradyrhizobium sp. terhadap nodulasi dan pertumbuhan tanaman tidak nyata (Soedarjo et al. 2003a, Soedarjo dan Sucahyono 2005). Hal ini mengisyaratkan bahwa inokulum Bradyrhizobium sp. maupun Bradyrhizobium sp. endogen kompatibel dengan genotipe tanaman kedelai (berbiji besar, sedang atau warna biji hitam) yang digunakan dalam kajian. Rumawas dan Rumawas 1988 melaporkan bahwa interaksi antara galur rhizobum dengan galur kedelai terhadap nodulasi tidak nyata. Hal ini menunjukkan bahwa inokulum rhizobium yang dibuat dari rhizobium endogen tidak spesifik untuk genotipe kedelai tertentu. Tabel 3 meng-indikasikan bahwa nodulasi (pada umur 6 MST) oleh Bradyrhizobium sp. sebanding pada semua genotipe kedelai (Soedarjo et al. 2003a)
Tabel 3. Pengaruh genotipe kedelai terhadap jumlah bintil akar (42 HST) dan bobot kering tanaman pada tanah Alfisol.
Varietas Jumlah bintil akar Bobot kering tanaman (g/tan.)
Kawi 12,7 4,776 Pangrango 14,8 5,045 Krakatau 10,9 4,008 Burangrang 11,7 4,114 Bromo 12,4 4,834 Wilis 10,8 4,218
Angka-angka selajur tidak berbeda nyata pada taraf 0,05 LSD Sumber: Soedarjo et al. 2003a
Densitas Sel Rhizobium
Densitas sel Bradyrhizobium spp. dalam tanah mempengaruhi keberhasilan nodulasi (Singleton and Tavares 1986). Inokulasi Bradyrhizobium spp. dalam tanah yang mengandung densitas sel Bradyrhizobium spp. rendah meningkatkan nodulasi dan fikasasi N2 (Moawad et al. 1988, Ravuri and Hume 1992, Daramola et al. 1994). Inokulasi Bradyrhizobium spp. pada tanaman kedelai yang ditanam pada tanah yang belum ditanami kedelai dapat meningkatkan nodulasi dan fikasasi N2, pertumbuhan tanaman, dan hasil biji (Patterson and Larue 1983, Sunarlim 1991, Daramola et al. 1994, Siswanto 1997).
Dengan menggunakan metode most probable number (MPN), densitas sel Bradyrhizobium spp. dalam tanah sawah Entisol dan Vertisol dilaporkan cukup tinggi, berkisar 5,8 x 104 – 7 x 109 se/g tanah (Soedarjo dan Sucahyono
2006). Densitas sel rhizobium yang tinggi di lahan sawah ini mungkin merupakan salah satu faktor signifikan tidak adanya pengaruh inokulasi terhadap nodulasi, serapan N, pertumbuhan dan hasil biji kedelai (Soedarjo dan Sucahyono 2005). Hasil ini juga mengindikasikan bahwa Bradyrhizobium spp. endogen efektif. Sedangkan tanah tegal (lahan kering non masam) yang belum pernah ditanami kedelai mempunyai densitas sel rhizobium rendah (Soedarjo dan Sucahyono 2005). Hasil kajian juga menunjukkan bahwa inokulasi pada lahan tegal yang belum pernah ditanami kedelai meningkatkan nodulasi dan serapan N.
Kompetisi Antara Rhizobium Endogen dan Inokulum Rhizobium
Inokulasi rhizobium dimaksudkan untuk meningkatkan nodulasi dan fiksasi N2 dari atmosfer, yang pada gilirannya akan meningkatkan kadar hara N dan pertumbuahan tanaman inang. Akan tetapi, seringkali inokulasi tidak berdampak pada peningkatan pertumbuhan tanaman inang. Hal ini mungkin disebabkan oleh inokulum tidak kompetitif dibandingkan dengan rhizobium endogen, sedangkan rhizobium endogen kurang efektif (Ellis et al. 1984, Moawad et al. 1984). Fenomena ini dikenal dengan istilah kompetisi antara rhizobium endogen dan inokulum rhizobium.
Peningkatan daya kompetisi dari inokulum dapat dilakukan dengan meningkatkan jumlah sel rhizobium yang diinokulasikan (Weaver and Frederick 1974), menggunakan genotipe kedelai yang hanya dapat membentuk bintil akar dengan strain rhizobium tertentu (Cregan and Keyser 1984, Cregan et al. 1989, Ishiyuka et al. 1991, Qian et al. 1996), dan menggunakan strain rhizobium yang dapat berkompetisi dengan rhizobium endogen (Beattie and Handelsman 1993).
Kemasaman Tanah
Sifat kimia tanah, seperti kemasaman dan toksisitas oleh Al, Fe, dan Mn, berpengaruh terhadap pertumbuhan dan fungsi rhizobium (Muns and Keyser 1981, Soedarjo et al. 2003b, Soedarjo dan Sucahyono 2005). Species Rhizobium berbeda tingkat toleransinya terhadap kemasaman tanah (Muns and Keyser 1981, Soedarjo et al. 2003b, Soedarjo dan Sucahyono 2005). Hasil kajian di laboratorium menunjukkan bahwa lebih dari 80% isolat rhizobium kedelai tipe tumbuh lambat (slow growers) toleran terhadap pH 4,0 dan sebagian besar dari isolat toleran masam tersebut toleran pada 100 ppm Mn dan 400 mM Al, 300 ppm Fe (Soedarjo et al. 2003b, Soedarjo dan Sucahyono 2005, Soedarjo dan Sucahyono 2006).
Suhu dan Kelembaban Tanah
Suhu tanah di sekitar perakaran tanaman berpengaruh terhadap pertumbuhan tanaman, jumlah dan bobot kering bintil akar kedelai serta efektivitas rhizobium menambat N dari atmosfer. Suhu optimum di sekitar perakaran tanaman untuk pertumbuhan tanaman kedelai dan nodulasi oleh rhizobium adalah 25oC. Di daerah tropis , termasuk Indonesia, suhu
tanah berkisar 25-30oC. Dengan demikian, kondisi tersebut kondusif untuk
pertumbuhan tanaman kedelai dan simbiosis dengan rhizobium. Suhu perakaran yang lebih tinggi dari 28oC dilaporkan menurunkan nodulasi oleh
rhizobium dan efektivitas enzim nitrogenase dalam menambat N maupun pertumbuhan tanaman kedelai (Manevar and Wollum II 1981). La Favre dan Eaglesham (1986) mengisyaratkan bahwa nodulasi akan menurun secara signifikan pada suhu lebih dari 30oC. Di daerah tertentu di Inodonesia,
terutama di Indonesia bagian timur, suhu disekitar perakaran mungkin lebih dari 30oC. Di daerah yang mempunyai tempaeratur harian relatif tinggi
rhizobium mengalami seleksi alam sehingga berkembang strain rhizobium yang adaptif dan efekif pada kondisi suhu tinggi di siang hari. Strain-strain rhizobium yang banyak ditemukan di daerah yang mempunyai suhu rendah umumnya ditemukan dalam jumlah sedikit didaerah yang mempunyai suhu relatif tinggi (Weber and Miller 1972).
Sel rhizobium sebagian besar tersusun dari air, sehingga kelembaban tanah merupakan faktor vital bagi pertumbuhan dan perkembangan rhizobium dalam tanah. Akan tetapi kondisi kelebihan air tidak menguntung-kan. Peningkatkan kelembaban tanah, seperti banjir atau penggenangan untuk tanam padi sawah, dapat menurunkan densitas sel rhizobium (Osa-Afiana and Alexander 1979, Soedarjo et al. 2006). Rhizobium merupakan mikroba aerob, memerlukan oksigen. Pada kondisi tergenang, tanah kekurangan oksigen karena ruang udara dalam tanah terisi oleh air. Oksigen
juga diperlukan oleh enzim nitrogenase dalam proses fiksasi N2 dari atmosfer. Dengan demikian keuntungan optimum dari simbiosis dengan rhizobium akan diperoleh apabila kedelai ditanam pada kondisi aerob, cukup oksigen.
Perlakuan Benih dengan Pestisida
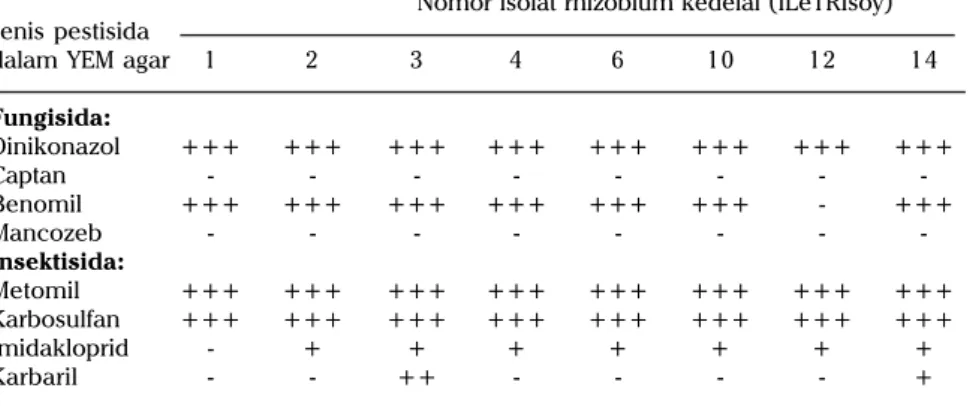
Perlakuan benih kedelai dengan pestisida dimaksudkan untuk mencegah serangan hama dan penyakit sedini mungkin. Pestisida yang terbawa oleh benih kedelai ini mungkin dapat meracuni rhzobium di sekitar perakaran tanaman (biocide). Oleh karena proses infeksi diawali oleh perkembang-biakan rhizobium disekitar perakaran tanaman, perlakuan dengan pestisida tertentu mungkin dapat menurunkan nodulasi oleh rhizobium endogen. Hasil kajian in vitro mengisyaratkan fungisida (bahan aktif Dinikonazol, Benomil) dan insektisida (bahan aktif Metomil dan Karbosulfan) aman untuk perlakuan benih (Tabel 4).
Jenis bahan aktif menentukan kompatibilitas fungisida dan insektisida sebagai seed treatment. Toksisitas insektisida organofosfor sistemik ter-hadap fungsi rhizobium berbeda. Disulfoton dan phorat merupakan contoh insektisida organofosfor sistemik yang masing-masing tidak kompatibel dan kompatibel dengan rhizobium (Pawar et al. 1978). Fungisida Benomil sebagai seed treatment dilaporkan tidak kompatibel dengan rhizobium (Pawar et al. 1978). Supriati (1986) melaporkan bahwa benomil, thiram, dan captan menurunkan fiksasi N oleh rhizobium.
Tabel 4. Pertumbuhan isolat rhizobium kedelai pada media YEM yang mengandung pestisida tertentu.
Nomor isolat rhizobium kedelai (ILeTRIsoy) Jenis pestisida
dalam YEM agar 1 2 3 4 6 10 12 14
Fungisida: Dinikonazol +++ +++ +++ +++ +++ +++ +++ +++ Captan - - - -Benomil +++ +++ +++ +++ +++ +++ - +++ Mancozeb - - - -Insektisida: Metomil +++ +++ +++ +++ +++ +++ +++ +++ Karbosulfan +++ +++ +++ +++ +++ +++ +++ +++ Imidakloprid - + + + + + + + Karbaril - - ++ - - - - +
+ dan - menunjukkan bahwa isolat rhizobium tumbuh dan tidak tumbuh.
Pola Tanam
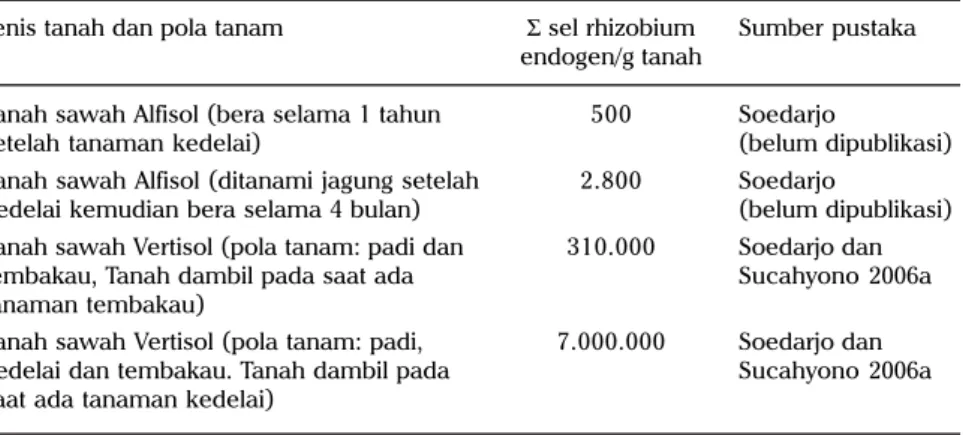
Bradyrhizobium spp. dapat tumbuh dan berkembang pada kondisi simbiosis dan nonsimbiosis sebagai heterotrop. Dengan demikian, ketersediaan bahan organik tanah akan berpengaruh terhadap densitas sel rhizobium dalam tanah. Pada umumnya tanah tegal (lahan kering) mengandung bahan organik relatif lebih rendah dari pada tanah sawah. Disamping itu, mutu bahan organik di lahan sawah umumnya lebih baik (C/N relatif rendah) daripada di lahan tegal (C/N relatif lebih tinggi). Bakteri heterotrop, termasuk rhizobium, akan tumbuh dan berkembang lebih baik pada ekosistem yang mempunyai banyak bahan organik dengan C/N rendah. Implikasinya, densitas sel rhizobium di tanah sawah akan lebih tinggi daripada tanah tegal (Tabel 5 dan 6) dan inokulasi rhizobium pada sawah pada umumnya tidak meningkatkan nodulasi dan pertumbuhan tanaman (Suryantini dan Adisarwanto 1990, Soedarjo dan Sucahyono 2005, Harsono dan Suryantini 1991, Pawirosemedi 2000).
Tabel 5. Kepadatan sel rhizobium endogen berdasarkan metode Most Probable Number. Jenis tanah dan pola tanam Σ sel rhizobium Sumber pustaka
endogen/g tanah
Tanah sawah Alfisol (bera selama 1 tahun 500 Soedarjo
setelah tanaman kedelai) (belum dipublikasi) Tanah sawah Alfisol (ditanami jagung setelah 2.800 Soedarjo
kedelai kemudian bera selama 4 bulan) (belum dipublikasi) Tanah sawah Vertisol (pola tanam: padi dan 310.000 Soedarjo dan tembakau, Tanah dambil pada saat ada Sucahyono 2006a tanaman tembakau)
Tanah sawah Vertisol (pola tanam: padi, 7.000.000 Soedarjo dan kedelai dan tembakau. Tanah dambil pada Sucahyono 2006a saat ada tanaman kedelai)
INOKULASI RHIZOBIUM PADA TANAMAN KEDELAI
DI LAHAN SAWAH
Inokulasi rhizobium dimaksudkan untuk meningkatkan jumlah rhizobium yang efektif dalam tanah, jumlah bintil akar yang efektif yang pada gilirannnya meningkatkan fiksasi N2 dari atmosfer. Dengan meningkatnya fiksasi N2, ketersediaan N tanaman meningkat sehingga pemupukan N lebih efisien. Akan tetapi beberapa hasil kajian menunjukkan bahwa inokulasi rhizobium di lahan sawah tidak meningkatkan nodulasi, pertumbuhan dan hasil tanaman kedelai. Soedarjo dan Sucahyono (2005) melaporkan bahwa inokulasi rhizobium pada tanah sawah (Entisol) di Probolinggo setelah padi tidak meningkatkan jumlah dan bobot bintil akar, pertumbuhan tanaman dan hasil biji kedelai. Pada tanah Entisol di Kendalpayak (lahan sawah), Malang, pengaruh inokulasi rhizobium tidak nyata terhadap jumlah dan bobot bintil akar, pertumbuhan dan hasil biji kedelai. Kajian rumah kaca Tabel 6. Densitas sel rhizobium pada tanah masam Ultisol.
No. Asal tanah Σ rhizobium Keterangan per g tanah
1 Kampungtua, Manggala, Tulang 22 Pola tanam ubi kayu monokultur Bawang, Lampung Tengah
2 Astomulyo, Punggur, 36 Pola tanam ubi kayu monokultur Lampung Tengah
3 Restu, Rumbia, 31 Pola tanam ubi kayu monokultur Lampung Tengah
4 Tanggulangin, Punggur, 36 Pola tanam ubi kayu monokultur Lampung Tengah
5 Pulung Kencono, Tulang 36 Pola tanam ubi kayu monokultur Bawang, Lampung Tengah
6 Bandar Agung, Kec. Terusan 11 Pola tanam ubi kayu monokultur Unye Lampung Tengah
7 Gotong Royong Kec. Gunung 5,5 Pola tanam ubi kayu monokultur Sugih Lampung Tengah
8 Pulung Kencono Kec. Tulang 80 Pada saat survey ada pertanaman Bawang Lampung Tengah kedelai umur 3 minggu,
sebelumnya pertanaman ubi kayu 9 Gunung Sugih, Kec. Gunung 5,5 Pola tanam ubi kayu monokultur
Sugih, Lampung Tengah, pertanaman ubi kayu
10 Kecubung, Kec Terbanggi 25 Pola tanam ubi kayu monokultur Besar, Lampung Tengah
11 Gunung Sugih, Kec. Gunung 55 Pola tanam ubi kayu monokultur Sugih, Lampung Tengah
12 Pulung Kencono, Kec. Tulang 250 Tanah telah ditanami kedelai Bawang, Lampung Tengah, selama 5 tahun.
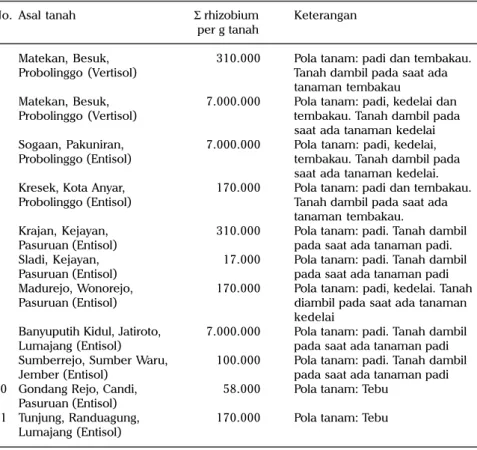
dan lapang pada jenis tanah vertisol menunjukkan bahwa inokulasi rhizobium tidak meningkatkan nodulasi, pertumbuhan tanaman dan hasil biji tanaman (Harsono dan Suryantini 1991, Pawirosemedi 2000). Hasil-hasil kajian ini mengindasikan bahwa lahan sawah cukup mengandung rhizobium endogen dan efektif. Asumsi ini didukung oleh hasil survei dengan menggunakan metode MPN bahwa densitas sel rhizobium tanah sawah di Jawa Timur cukup tinggi sampai dengan sangat tinggi (Tabel 7) (Soedarjo et al. 2006c). Tabel 7 juga menunjukkan bahwa tanah sawah Entisol dan Vertisol di Jawa Timur yang belum pernah ditanami kedelai mengandung sel rhizobium endogen cukup tinggi. Tanah-tanah yang disurvei bereaksi netral (nonmasam) dan kondisi ini kondusif bagi rhizobium endogen untuk tumbuh dan berkembang secara heterotrop, menggunakan bahan organik tanah sebagai sumber energi. Berdasarkan hasil beberapa kajian di lapang dan data jumlah populasi rhizobium di lahan sawah diasumsikan bahwa inokulasi rhizobium di lahan sawah yang nonmasam kurang diperlukan. Tabel 7. Densitas sel rhizobium pada tanah Entisol dan Vertisol, MK 2006.
No. Asal tanah Σ rhizobium Keterangan per g tanah
1 Matekan, Besuk, 310.000 Pola tanam: padi dan tembakau. Probolinggo (Vertisol) Tanah dambil pada saat ada
tanaman tembakau
2 Matekan, Besuk, 7.000.000 Pola tanam: padi, kedelai dan Probolinggo (Vertisol) tembakau. Tanah dambil pada
saat ada tanaman kedelai 3 Sogaan, Pakuniran, 7.000.000 Pola tanam: padi, kedelai,
Probolinggo (Entisol) tembakau. Tanah dambil pada saat ada tanaman kedelai. 4 Kresek, Kota Anyar, 170.000 Pola tanam: padi dan tembakau.
Probolinggo (Entisol) Tanah dambil pada saat ada tanaman tembakau.
5 Krajan, Kejayan, 310.000 Pola tanam: padi. Tanah dambil Pasuruan (Entisol) pada saat ada tanaman padi. 6 Sladi, Kejayan, 17.000 Pola tanam: padi. Tanah dambil
Pasuruan (Entisol) pada saat ada tanaman padi 7 Madurejo, Wonorejo, 170.000 Pola tanam: padi, kedelai. Tanah
Pasuruan (Entisol) diambil pada saat ada tanaman kedelai
8 Banyuputih Kidul, Jatiroto, 7.000.000 Pola tanam: padi. Tanah dambil Lumajang (Entisol) pada saat ada tanaman padi 9 Sumberrejo, Sumber Waru, 100.000 Pola tanam: padi. Tanah dambil
Jember (Entisol) pada saat ada tanaman padi 10 Gondang Rejo, Candi, 58.000 Pola tanam: Tebu
Pasuruan (Entisol)
11 Tunjung, Randuagung, 170.000 Pola tanam: Tebu Lumajang (Entisol)
INOKULASI RHIZOBIUM PADA TANAMAN KEDELAI
DI LAHAN KERING
Hasil survei menunjukkan bahwa densitas sel rhizobium di lahan kering di Jawa Timur beragam mulai dari densitas rendah (65 sel/g tanah) sampai dengan tinggi (90 000 sel/g tanah) (Soedarjo dan Sucahyono 2006). Inokulasi rhizobium dapat meningkatkan nodulasi pada tanah-tanah yang belum pernah ditanami kedelai atau tanah yang mempunyai populasi rhizobium endogen rendah (Sunarlim 1991, Siswanto 1997). Hasil kajian menunjukkan bahwa inokulasi rhizobium tidak meningkatkan nodulasi dan hasil tanaman di tanah tegal Alfisol yang belum pernah ditanami kedelai dan sudah lama tidak pernah ditanami kedelai (Tabel 3)(Soedarjo et al. 2003a). Harnowo dan Brotonegoro (1987) juga melaporkan bahwa inokulasi rhizobium di lahan kering Alfisol tidak meningkatkan nodulasi dan hasil kedelai (Tabel 8). Hasil kajian yang lainnya (Adisarwanto 1990) meng-isyaratkan bahwa inokulasi rhizobium pada tanah Alfisol (Kebun Percobaan Muneng, Probolinggo) tidak meningkatkan nodulasi dan hasil tanaman kedelai (Tabel 9). Hasil ini mengindikasikan bahwa tanah tegal Alfisol cukup mengandung rhizobium endogen yang efektif. Lahan kering di Gunung Kidul (Jawa Tengah) mungkin juga mengandung cukup rhizobium yang efektif sehingga inokulasi dengan rhizobium tidak meningkatkan nodulasi dan hasil kedelai (Purwaningsih et al. 2000).
Efektivitas rhizobium endogen lahan kering mungkin tidak akan beragam pada varietas kedelai yang telah dilepas di Indonesia. Hal ini di-indikasikan oleh hasil kajian lapang yang menunjukkan bahwa jumlah bintil akar dan hasil beberapa varietas unggul kedelai dan galur introduksi tidak berbeda baik pada kondisi diinokulasi maupun tidak diinokulasi rhizobium (Tabel 3 dan 9) (Sumarno et al. 1990, Soedarjo et al. 2003a).
Lahan kering masam pada umumnya mengandung sel rhizobium endogen sangat rendah, bahkan beberapa lokasi di lahan kering masam di Tabel 8. Pengaruh inokulasi terhadap nodulasi dan hasil tanaman kedelai di lahan kering
Alfisol, Probolinggo.
Bobot bintil akar basah (mg/10 tan) Hasil biji (t/ha) Perlakuan
MK 1986 MH 1986/1987 MK 1986 MH 1986/1987 Tanpa inokulasi 3,60 5,20 1,42 1,13 Inokulasi pada benih 3,69 5,80 1,43 1,08 Inokulasi di lubang tanam 3,18 6,60 1,49 1,05 Angka-angka selajur tidak berbeda nyata pada taraf 0,05 DMRT.
Lampung tidak mengandung rhizobium (lihat Tabel 6) (Soedarjo dan Sucahyono 2005). Selain itu, lahan masam mengandung unsur Al, Fe, dan atau Mn tinggi yang dapat merupakan kendala (constraints) pertumbuhan sel rhizobium dalam tanah. Sehingga inokulasi dengan rhizobium yang toleran kondisi masam dan efektif akan dapat meningkatkan nodulasi dan pertumbuhan tanaman. Tanaman kedelai yang mempunyai banyak bintil akar efektif akan mengandung cukup N tanaman melalui fiksasi N2 dari atmosfer dan tanaman akan tumbuh lebih baik. Hasil kajian menunjukkan bahwa inokulasi rhizobium di tanah Ultisol diperlukan untuk meningkatkan pertumbuhan tanaman kedelai (Tabel 10) (Ridwan dan Basri 1987, Sumarno et al. 1990).
Tabel 9. Pengaruh inokulasi terhadap nodulasi dan hasil tanaman kedelai di lahan kering Alfisol, Probolinggo.
Inokulasi rhizobium Σ bintil akar Hasil biji per tanaman (t/ha)
Tanpa inokulasi 21,5 1,27
Inokulum 2,5 g/kg benih 21,9 1,15 Inokulum 7,5 g/kg benih 19,0 1,02 Sumber: Adisarwanto (1990).
Tabel 10. Pengaruh inokulasi dan gentoipe kedelai terhadap jumlah bintil akar/6 tanaman di tanah Ultisol, Lampung Tengah, MH 1988-1989.
Jumlah bintil akar/6 tanaman Varietas/galur
Tanpa inokulasi Rhizogen Rata-rata
Wilis 17 163 90 Rinjani 58 163 110 Tambora 41 183 112 B-3357 47 157 102 630/1343-1 35 177 106 Rata-rata 40 b 169 a
Angka rata-rata tidak berbeda nyata pada taraf 0,05 DMRT. Sumber: Sumarno et al. 1990.
DAFTAR PUSTAKA
Adisarwanto, T. 1990. Kajian inokulum Rhizogen dan PPC terhadap pertumbuhan dan hasil kedelai di lahan kering. Penelitian Palawija 5: 24-30.
Anthamatten, D., B. Scherb, and H. Hennecke. 1992. Characterization of a fixLJ-regulated Bradyrhizbium japonicum gene sharing similarity with the Escherichia coli fnr and Rhizobioum meliloti fixK genes. J. bacteriol. 174: 2111-2120.
Baev, N., G. Endre, G. Petrovics, Z. Banfalvi, and A Koadorosi. 1991. Six nodulation gene of nod box locus 4 in Rhizobium meliloti are involved in nodulation signal production: nodM codes for D-glucosamine synthetase. Mol. Gen. Gen. 228:113-124.
Baker, M.E. 1992. Similarities between legume-rhizobium communication and steroid-mediated intercellular communication in vertebrates. Can J. Microbiol. 38: 541-547.
Bec-Ferte, M.P, H.B. Krishuan, D. Prome, A. Savagnac, S.G. Pueppke, and J.C. Prome. 1994. Structure of nodulation factors from the nitrogen fixing soybean symbiont Rhizobium fredii USDA257. Biochemistry 33:11782-11788.
Betts, J.H. and D.F. Herridge. 1987. Isolation of soybean lines capable of nodulation and nitrogen fixation under high levels of nitrate supply. Crop Sci. 27: 1156- 1161.
Beattie, G.A. and J. Handelsman. 1993. Evaluation of a strategy for identifying nodulation competitiveness genes in Rhizobium leguminosarum biovar phaseoli. J. Gen. Microbiol. 139: 529-538.
Bloemberg, ‘r.V E. Kamst, M. Harteveld, KM.G.M. van der Drift, J. Haverkamp, J.E. Thomas Oates, B.J.J. Lugtenberg, and H.p Spaink. 1995. A central domain of Rhizobium NodE protein mediates host spesifiaty by determining the hydrophobicity of fatty acyl moieties of nodulation factors. Mol. Microbiol. 16:1123-1136.
Brockwell, J., R. A. Holliday, and A. Pilka. 1988. Evaluation of the symbiotic nitrogen-fixing potential of soils by direct micrabiological means. Plant and Soil 108:163-170.
Cardenas, L., J. Dominguez, C. Cuinto, I. Lopez-Lara, B. Lugtenberg, H. Spaink, G. Rademaker, J. Haverkamp, and J. Thomas- Oates. 1995. Isolation, chemical structures and biological activity of the lipo-chitin oligosacchatide nodulation signals from Rhizobium etlii. Plant Mol. Biol. 29:453-464.
Carlson, R.W., J. Sanjuan, U.R. Bhat, J, Glushka, H.P. Spaink, A.H.M. Wijfjes, A.A.N. van Brussel, T.J.W. Stokkermans, N.K. Peter, and G. Stacey. 1993. The structures and biological activities of the lipo-oligosaccharide nodulation signal molecules. Mol. Plant-Microbe Interact. 7: 684-695. Champion, R.A., J.N. Mathis, D.W. Israel, and P.G. Hunt. 1992. Response of soybean to inoculation with efficient and inefficient Bradyrhizobium japonicum variants. Crop Sci. 32: 457-463.
Cregan, P.B. and H. Keyser. 1984. Host resriction of nodulation by Bradyrhizobium japonicum strain USDA 123 in soybean. Crop Sci.: 911-916.
Cregan, P.B, H.H. Keyser, and M.J. Sadowsky. 1989. Soybean genotype restricting nodulation of previously unrestricted serocluster 123 Bradyrhizobia. Crop Sci. 29: 307-312.
Daramola, D.S., S.K.A. Danso and G. Hardarson 1994 Nodulation, N2 fixation and dry matter yield of soybean (Glycine max (L.) Merill) inoculated with effective and ineffective Bradyrhizobium japonicum strains. Soil Biol. Biochem. 26: 883-889.
Dazzo, F. B. G.L. Truchet, J.E. Sherwood, E.M. Hrabak, M. Abe, and S.H. Pankratz. 1984. Specific phases of root hair attachment in the Rhizobium trifolii-clover symbiosis. Appl. Environ. Microbiol. 30:1017-1033.
Dean, D.R and M.R. Jacobson. 1992. Biochemical genetics of nirogenase, p. 763-834. In: Stacey, G, R. H. Burris and J. Evans (Ed.), Biological Nitrogen Fixation. Chapman and Hall, New York.
Denarie, J. and J. Cullimore. 1993. Lipo-oligosaccharide nodulation factors: A new class of signaling molecules mediating recognition and morphogenesis. Cell 74:951-954.
Denarie, J., F. Debelle and C. Rosenberg. 1992. Signaling and host range variation in nodulation. Annu. Rev. Microbiol. 46:497-531.
DuTeau, N.M., R.G. Palmer and A.G. Atherly 1986 Fast-growing Rhizobium fredii are poor nitrogen-fixing symbionts of soybean. Crop Sci. 26: 884-889.
Earl, C. D. C. W. Ronson and F.M. Ausubel. 1987. Genetic and structural analysis of Rhizobium meliloti fiA, fixB, fixC and fixX genes. J. Bacteriol. 169: 1127-1136.
Ellis, W.R., G.E. Ham and E.L. Schmidt. 1984. Persistence and rcovery of of Rhizobium japonicum inoculum in a field soil. Agron. J. 76:573-576.
Fellay, R, X. Perret, V Viprey, W Broughton, and S. berner. 1994. Organization of host-inducible transcripts on the symbiotic plasmid of Rhizobium sp. NGR234. Mol. Microliiol. 16:657-667.
Fischer H.M., A. Alvarez-Morales, and H. Hennecke. 1986. The pleiotropic nature of symbiotic regulatory mutans: Bradyrhizobium japonicum nifA is involved in control of nif genes expression and formation of determinate symbiosis. EMBO J. 5: 1165-1173.
Fischer, H.M. 1994. Genetic regulation of nitrogen fixation in rhizobia. Microbiological reviews. 3: 352-386.
Fischer, H.M. 1996. Environmental regulation of rhizobial symbiotic nitrogenfixation genes. Trends in Microbiol. 4: 317-320.
Fisher, R. F. and S. R. Long. 1992. Rhizobium-plant signal exchange. Nature 357:655-660.
Gottfert, M. 1993. Regulation and function of rhizobial nodulation genes. FEMS Micmbiol. Rev. 104:39-64.
Gubler, M. and H. Hennecke. 1986. FixA, B and C genes are essential for symbiotic and free-living, microaerobic nitrogen fixation. FEBS Lett. 200: 186-192.
Hill, S. 1992. Physiology of nitrogen fixationn in free living heterotrophs, p. 87-34. In: Stacey, G, R. H. Burris and J. Evans (Ed.), Biological Nitrogen Fixation. Chapman and Hall, New York.
Harnowo, D. dan S. Brotonegoro. 1987. Pengaruh inokulasi Rhizobium dan perawatan benih dengan insektisida pada pertumbuhan dan hasil biji kedelai Penelitian Palawija, 2(2): 89-94.
Harsono, A. dan Suryantini. 1991. Pengaruh inokulasi rhizobium dan pupuk K pada kedelai. Dalam: Hasil Penelitian Kacang-Kacangan Balittan Malang tahun 1990/1991: 78-83.
Higashi, S. 1993. Minireview: (Brady)Rhizcbium-plant communications involved in infection and nodula-tion. J. Plant Res. 106:201-211. Higashi, S. and M. Abe. 1980. Promotion of infection thread formation by
substances from Rhizobium. Appl. Environ. Micobiol. 39:297-301. Hirsch, A.M. 1992. Developmental biology of legume nodulation. New Phytol.
122:211-237.
Ishiyuka, J., A. Yokohama, and Y. Suemas. 1991. Relationship between serotypes of bradyrhizobium japonicum and their compatibility with RJ-cultivar for nodulation. Soil Sci. Plant Nutr. 37: 23-30.
Kijne, J.W. 1992. The Rhizobium infection process, p.349-398. In: Stacey, G., R.H. Burris and J. Evans (Eds.) Biological nitrogen fixation. Chapman and Hall, New York.
Kondorosi, E., J, Gyuris, J. Schmidt, M. John, E. Duda, B. Hoffman, J. Schell, and A. Kondorosi. 1983. Positif and negatif control of nod gene expression in Rhizobium meliluti is required for optimal nodulation. EMBO J. 8: 1331-1340.
Kullik I., S. Fritsche, H. Knobel, J. Sanjuan, H. Hennecke, and H.M. Fischer. 1991. Bradyrhizobium japonicum has two differentially regulated, functional homologs of s54 gen (rpoN). J. Bacteriol. 173: 1125-1138. La Favre, A.K. and A.R.J. Eaglesham. 1986. The effect of high Suhues on
soybean nodulation and growth with different strains of brady-rhizobia. Can. J. Microbiol. 32: 22-27.
Lerouge, P., P Roche, C. Faucher, F. Millet, G. Truchet, G.C. Prome, and J. Denarie. 1990. Symbiotic host-specificity of Rhi,zobium meliloti is determined by a sulfated and acylated glucosamine oligosac-charide signal. Nature 344:781-784.
Long, S. R 1996. Rhizobium symbiosis: Nod factors in perspective. The Plant Cell 8:1885-1898.
Lopez-Lara, LM., J.D.J. van den Berg, J.E. Thomas Oates, J. Glushka, B.J.J. Lugtenberg, and H.P Spaink. 1995. Structural identification of the lipo-chitin oligosaccharide nodulation signals of Rhizobiurr loti. Mol. Microbiol. 15:627-638.
Margaert, J., M. van Montagu, J.C. Prorie, and M. Holsters. 1993. Three unusual modifications, a D-arabinosyl, an N-methyl, and a carbomoyl group, are present on the Nod factors of Azorhizubium caulinodans ORS571. Proc. Natl. Acad. Sci. USA 90:1551-155b.
Mateos, P F., J.I. Jimenez-Zurdo, J. Chen, AS. Squartini, S.K Heack, E. Martinez-Molina, and D.H. Hubbell. 1992. Cell-associated pectinolytic and cellulolytic enzymes in Rhizobium leguminosarum biovar trifolii. Appl. Environ. Microbiol. 58:1816-1822.
Moawad, H.A.; W.R. Ellis, and E.L. Schmidt. 1984. Rhizosphere response as a factor in a competition among three serogroups of indigenous Rhizobium japonicum for nodulation of field grown soybeans. Appl. Environ. Microbiol. 47: 607-612.
Moawad, H., S.M.S. Badreldin, and M.A. Khalafalah 1988 Persistence and competitiveness of three Bradyrhizobium japonicum inoculant strains in clay loam Nile valley soil. Plant and Soil 108: 137-141.
Monevar, F. and A.G. Wollum II. 1981. Effect of high root Suhue and rhizobium strains on nodulation, nitrogen fixation, and growth of soybeans. Soil Sci. Soc. Am. J. 45: 1113-1120.
Monson, E.K., M. Weinstein, G.S. Ditta, and D.R. Helinski. 1992. The FixL protein of Rhizobium Meliloti can be seperated into a heme-binding oxygen-sensing domain and functional C-terminal kinase domain. Proc. Natl. Acad. Sci. USA 89: 4280-4284.
Monson, E.K., A.F. Lois, P.G. Agron, M. Weinstein, S.W. stanfield, G.S. Ditta, and D.R. Helinski. 1993. Ogxygen sensing by the Rhizobium meliloti two-component regulatory system, FixLJ, p.405-410. In: R. Palacios, J. Mora and W.E. Newton (Eds.), new Horizons in nitrogen fixation. Kluwer Academic Publishers, Dordrecht, The Netherlands.
Muns, D.N. and H.H. Keyser. 1981. Response of rhizobium strains to acid and aluminum stress. Soil Biol. Biochem. 13: 115-118.
Murphy, PJ., W Wexler, W Grzemski, J.P. Rao, and D. Gordon. 1995. Rhizopines-their role in symbiosis and competition. Soil Biol. Biochem. 27:525-529.
Osa-Afiana, L.O. and M. Alexander. 1979. Effect of moisture on the survival of rhizobium in soil. Soil Sci. Soc. Am. J: 925-930.
Parkinson, J.S. and E.C. Kofoid. 1992. Communication modules in bacterial signaling protein. Annu. Rev. Genet. 26: 71-112.
Patterson, T.G. and T.A. Larue 1983 Nitrogen fixation by soybeans: Sesonal and cultivar effects, and comparison of estimates. Crop Sci. 23: 488-492.
Pawar, N.B. and J.N. Ghulghule. 1978. Compatibility study of pesticides and rhizobium of gram (Cicer arietinum L.). Trop. Grain Leg. Bull. 11&12: 40-42.
Pawirosemedi, M. 2000. Pengaruh pemberian belerang (S) dan inokulasi Rhizobium pada Vertisol terhadap pertumbuhan dan produksi kedelai (Glycine max L.Merr) serta kadar hara N dab S daun indeks. Agrivita (Unibraw), 22(1): 58-63
Poupot, R, E. Martinez-Romero, and J.C. Prome. 1993. Nodulation factors from Rhizobium trnpici are sulfated or nonsulfated chito-pentasaccharides containing an N- methyl-N- acettylglucosamine terminus. Biochemistry 32:10430-10435.
Preisig, O D. Anthamatten, and H. Hennecke. 1993. Genes for a micro-aerobically induced oxidase complex in Bradyrhizobium japonicum are essential for a nitrogen-fixing endosymbiosis. Proc. Natl. Acad. Sci. USA 90: 3309-3313.
Price, N.PJ., B. Relic, F. Talmont, A. Lewin, D. Prome, S.G. Pueppke, F. Macllet, J. Denarie, J.C. Prome, and WJ. Broughton. 1992. Broad-host-range Rhizobium species strain NGR234 secretes a family of carbamoylated, and fucosylated, nodulation signals that are 0-acetylated or sulafated. Mol. Microbiol. 6:3575-3584.
Purwaningsih, S, S.H. Rahayu, Suciatmih, dan Kuntjoro. 2000. Pengaruh inokulasi bakteri rhizobium dan jamur mikoriza Vesikular-Arbuskular (MVA) terhadap pertumbuhan dan pembentukan polong kedelai var. Wilis. In: Gunawan et al. (Eds.). Prosiding Lokakarya Penelitian dan Pengembangan Produksi Kedelai di Indonesia, BPPT, Jakarta, 6-7 Agustus 1996. Direktorat Teknologi Lingkungan BPPT: 141-144. Qian, D., F.L. Allen, G. Stacey, and P.M. Greshoff. 1996. Plant genetic study of
restricted nodulation in soybean. Crop. Sci. 36: 243-249.
Ranga Rao, V. 1977. Effect of root Suhue on the infection process and nodulation in Lous and Stylosanthes. J. Experimnt. Bot 103: 241-259. Ravuri, V. and D.J. Hume 1992 Performance of a superior Bradyrhizobium japonicum and a selected Sinorhizobium fredii strain with soybean cultivars. Agron. J. 84: 1051-1056.
Relic, B. X. Perret, M. T Estrada-Garcia, J. Kopcinska, W Golinowski, H.B. Krichnan, S. G. Pueppke and W J. Broughton. 1994. Nod Factors of Rhizobium are a key to the legume door. Mol. Microbiol. 13:171-178. Ridwan dan I. H. Basri. 1987. Pemupukan NPK dan inokulasi rhizobium pada kedelai di tanah gambut dan podsolik bukaan baru. Pemberitaan Penelitian Sukarami, (12): 24-27.
Rolfe, B.G. and PM. Gressholf. 1988. Genetic analysis of legume nodule initiation. in Ann. Rev. Plant Physiol. Plant Mol. Biol. 38:297-319. Rumawas, A. dan F. Rumawas. 1988. Pengembangan inokulan Rhizobium
japonicum untuk kedelai di Institut Pertanian Bogor. In: Risalah Lokakarya Penelitian Penambatan Nitrogen secara Hayati pada Kacang-kacangan, Bogor, 30-31 Agustus 1988: 147-156.
Sanjuan, J. P Grob, M. Gottfert, H. Hennecke and G. Stac:y. 1992. NooiW is essential for full expression of the common nodulation genes of Bradyrhizobium japonicum. Mol. Plant-Microbe interact. 7:364-369. Savka, M.A and S.K Farrand. 1997. Modification of rhizobacterial populations
by engineering bacterium utilization of a novel plant-produced resource. Nature Biotechnol. 15:363-368.
Schultz, M., B. Quiclet-Sire, E. Kondorisi, H. Virelizier, J. N. Glushka, G. Endre, S. D. Gero and A. Kondorisi. 1992. Rhizobium meliloti produces a family of sulfated lipo-oligosaccharids exhibiting different degrees of plant host spesificity. Proc. NF-tl. Acad. Sci. USA 89:192-196.
Singleton, P. W. and J.W. Tavares 1986 Inoculation response of legumes in relation to the nodule number and effectiveness of indigenous Rhizobium population. Appl. Environ. Microbiol. 51:1013-1018. Siswanto, B. 1997. Pengaruh inoculasi baketri Rhizobium terhadap
pertumbuhan dan produksi kedele pada pertanaman pertama di lahan perhutanan sosial KPH Mjokerto. Habitat 8: 25-31.
Smith, G. J. W Kijne and B. J. J. Lugtenberg. 1987. Involvement of both cellulose fibrils and a Ca-dependent adhesion in the attachment ofRhizobium leguminosarum biovar viciae to pea root hair tips. J. Bacteriol. 169:4294-4301.
Soedarjo, M., A.G. Manshuri, M.M. Adie and K. Ishiki. 2003a. Effectiveness of commercial rhizobial inocula on the growth and seed yield of improved soybean varieties on Alfisol in East Java. Jpn. J. Trop. Agr. 47: 175-181.
Soedarjo, M., N. Saleh, T. Adisarwanto, D. Modar, A.G. Manshuri and K. Ishiki. 2003b. Characterization and effectiveness of acid-tolerant rhizobia isolated from nodules of soybean cultivated in Indonesia. Jpn. J. Trop. Agr. 47: 233-242.
Soedarjo, M. dan D. Sucahyono. 2005. Teknologi nodulasi dan kolonisasi mikoriza pada tanaman kedelai di lahan kering masam. Laporan Tahunan, Balitkabi, Malang.
Soedarjo, M., dan D. Sucahyono. 2006a. Estimasi densitas dan efektivitas rhizobium endogen lahan kering Alfisol pada tanaman kedelai, p: 431-440. Dalam: Suharsono et al. (Eds.), Peningkatan Produksi Kacang-kacangan dan Umbi-umbian Mendukung Kemandirian Pangan. Puslitbangtan, Bogor.
Soedarjo, M., dan D. Sucahyono. 2006b. Pengembangan pupuk hayati di lahan kering masam. Laporan Tahunan, Balitkabi, Malang.
Soedarjo, M., Suryantini dan Didik Sucahyono. 2006c. Pengelolaan pupuk N, pestisida, herbisida dan air untuk meningkatkan nodulasi dan fungsi rhizobium pada tanaman kedelai di lahan sawah. Laporan Tahunan Balitkabi, Malang.
Soedarjo, M. 1997. genetics of mimosine degradation by Rhizobium sp. strain TAL1145 that nodulates Leucaena spp. PhD. Dissertation, Dept. Microbiology of the University of Hawaii, 210 p.
Spaink, H.P., C.A. Wijffelman, E. Pees, R.J.H. Okker and B.J.J. Lugtenberg. 1987. Rhizobium nodulation gene nodD as a determinant of host specificity. Nature (London) 328:337-340.
Stacey, G., S. Luke, J. Sanjuan, Z. Banfalvi, A.J. nieuwkoop, J.Y Chun and L.S. Folsberg. 1994. NodZ, a unique host specific nodulation gene is involved in the fuccsylation of the lipooligosaccharide nodulation signal of Bradyrhizobium japonicum. J. Bacteriol. 176: 620-633. Sumarno, N. Sunarlim, dan Y. Supriati. 1990. Peningkatan efesiensi
penambatan nitrogen oleh bakteri Rhizobium japonicum. Dalam: Subandi, S. Sunarno dan A. Wijono (Eds.). Prosiding Lokakarya Penelitian Komoditas dan Studi Khusus, Bogor, 21-23 Agustus 1989. Badan Penelitian dan Pengembangan Pertanian, p. 281-295.
Sunarlim, N. 1991 Effect of nitrogen and Rhizobium inoculation on growth and yield of soybean in red-yellow podsolic soil. Penelitian Pertanian 12: 116-118.
Sunarlim, N. 1991. Effect of nitrogen and Rhizobium inoculation on growth and yield of soybean in red-yellow podsolic soil. Penelitian Pertanian 12: 116-118.
Supriati, Y. 1986. Pengaruh pestisida pada perlakuan benih kedelai terhadap kemampuan hidup dan aktivitas bakteri bintil akar (Bradyrhizobium). p. 85-92. Dalam Seminar Balittan Bogor tahun 1986. Balai Penelitian Tanaman Bogor.
Suryantini dan T. Adisarwanto. 1990. Kajian interaksi takaran dan jenis inokulum terhadap hasil kedelai di lahan sawah. Risalah Hasil Penelitian Tanaman Pangan. P.64-66.
Tepfer, D. A. Goldmann, N. Pamboukdjian, M. Maille, A. Lepingle, D. Chevalier, J. Denarie, and Rosenberg. 1988. A plasmid of Rhizohium meliloti 41 encodes catabolism of two coumpounds from root exudate of Calystegium sepium. J. Bacteriol. 170:1153-1161.
Thony, B., H.M. Fischer, D. Anthamatten, T. Bruderer, and H. Hennecke. 1987, The symbiotic nitrogen fixation regulatory operon (fixRnifA) of Bradyrhizobium japonicum is expressed aerobically and subject to a novel, nifA-independent type of activation. Nucleic Acids Res. 15: 8479-8499.
Thony, B., D. Anthamatten, and H. Hennecke. 1989. Dual control of the Bradyrhizobium japonicum symbiotic nitrogen fixation regulatory operon fixRnifA: Analysis of cis and transacting elements. J. Bacteriol. 171:4162-4169.
Vijn, L, L. das Neves, fL Van Kemmen, H. Fransen, and T. Bisseling. 1993. Nod factors and nodulation in plants. Sci. 260:1764-1765.
Weaver, R.W. and L.R. Frederick. 1974. Effect of inoculum rate on competitive nodulation of gycine max (L) Merrill. II. Field studies. Agron. J. 66: 233-236.
Weber, D.F. and V.L. Miller. 1972. Effect of soil Suhue on Rhizobium japonicum serogroup distribution in soybean nodules. Agron. J. 64: 796-798. Weinstein, M. A.F. lois, E.K. Monson, G.S. Ditta, and D.R. Helinski. 1992. Isolation
of phosphorylation-deficient mutants of the Rhizobium meliloti two-component regulatory protein, FixJ. Mol Microbiol. 6:2041-2049.