Infark Miokard Perioperatif
Suparto*, Cindy E. Boom**
*Fellow Anestesi Kardiovaskuler, RSJPN Harapan Kita, Jakarta
** Konsultan Anestesi Kardiovaskuler, RSJPN Harapan Kita, Jakarta
Abstrak
Kejadian infark miokard perioperatif/
perioperative myocardial infarct
(PMI
)
sering dijumpai
pada pasien dengan faktor resiko jantung yang menjalani tindakan operasi. Pencegahan PMI
menjadi sangat penting untuk memberikan hasil yang baik dari suatu operasi. Pada dasarnya
patofisiologi terjadinya PMI dapat berupa suatu ruptur plak atau akibat ketidakseimbangan
pasokan
dan kebutuhan oksigen. Terapi untuk PMI ditujukan pada stabilisasi plak dan
menjaga keseimbangan oksigen tersebut. Mendiagnosa suatu PMI memerlukan monitoring
jantung, baik melalui perubahan EKG,
transesophageal echocardiography
(TEE) maupun
biomarker. Tinjauan pustaka ini berisi tentang mekanisme, diagnosis, pilihan terapi serta
tatalaksana dalam penanganan infark miokard perioperatif
.
Kata kunci
: Infark miokard perioperatif, terapi, monitoring, pencegahan
Abstract
Perioperative myocardial infarct (PMI) is a common event in patients with cardiac risk
factors undergoing surgery. Prevention of a PMI is very important in improving
postoperative outcome. Basically, there are two mechanisms of PMI, due to plaque rupture
or oxygen supply-demand imbalance. Management of PMI is to address these two causes,
which are plaque stabilization and maintaining the balance of oxygen supply-demand.
Diagnosis of PMI however, needs a careful monitoring, either from recognizing the ECG
changes, TEE or from the cardiac biomarkers. These report will discuss the mechanism,
diagnosis, therapeutic options and management of perioperative myocardial infarct.
Key words: Perioperative myocardial infarct, therapy, monitoring, prevention
PendahuluanTerdapat lebih dari 230 juta tindakan operasi mayor yang dilakukan diseluruh dunia setiap tahun dan jumlah ini terus bertambah setiap tahunnya.1 Dari jumlah tindakan tersebut,
diperkirakan kejadian infark miokard perioperatif sekitar 1-4%.2
Angka harapan hidup yang bertambah membuat populasi pasien dengan usia lanjut semakin bertambah. Hal ini berdampak dengan lebih banyaknya pasien dengan
permasalahan kardiak yang menjalani operasi, sehingga infark miokard perioperatif juga diprediksi akan meningkat. Komplikasi kardiak merupakan penyebab paling sering terjadinya mortalitas dan morbiditas paska bedah.3 Kejadian mortalitas ini dipengaruhi
oleh kecepatan diagnosis dimana angka mortalitas pada diagnosis infark miokard perioperatif yang terlambat mencapai 30-70%.1
Insiden PMI pada pasien resiko rendah tanpa adanya riwayat penyakit jantung koroner
pengampungan dengan sentrifugasi.[Skripsi]. Depok: Universitas
Indonesia Depok. 2011
18. Camago L, Sauza L J, Pedro, Tourinto E K, Souza M M. Capillariaisis (Trichurida,
Trichinellidae, Capillaria hepatica) in the Brazilian Amazon: low pathogenicity, low infectivity and a novel mode. BioMed Central Parasites and Vectors. 2010;3:11.
sentra pembibitan desa sobangan, mengwi, badung. Indonesia Medicus Veterinus. 2015;4(1): 80-87.
20. Cancela M, Ruetalo N, Dell’Oca N, da Silva E, Smircich P, Rinaldi G, et al. Research article survey of transcripts expressed by the invasive juvenile stage of the liver fluke Fasciola hepatic. BMC
Genomics. 2010;11:227
Mekanisme Resistensi
Acinetobacter baumannii
terhadap
Antibiotik Golongan Karbapenem
Ade Dharmawan, Nicolas Layanto
Staf Pengajar Bagian Mikrobiologi
Fakultas Kedokteran Universitas Kristen Krida Wacana
Alamat korespondensi: [email protected]
AbstrakAcinetobacter baumannii (A. baumanii) merupakan salah satu spesies Acinetobacter tersering diisolasi dari manusia, dan lebih sering dijumpai pada infeksi nosokomial dibandingkan dengan infeksi di komunitas. Eksistensi bakteri ini di lingkungan terkait dengan keragaman reservoir, kemampuan memperoleh gen pembawa sifat resisten antimikroba, dan sifat resisten terhadap pengeringan. Infeksi disebabkan strain A. baumannii yang resisten terhadap banyak antibiotik tidak mudah dikendalikan dan menjadi permasalahan di berbagai negara. Karbapenem merupakan antibiotik utama yang dipakai untuk mengobati pasien infeksi oleh Acinetobacter sehingga menyebabkan peningkatan resistensi bakteri ini terhadap karbapenem. Mekanisme kerja karbapenem yaitu dengan menghambat polimerisasi dan perlekatan peptidoglikan pada dinding sel. Kurangnya penetrasi obat (mutasi porin dan efflux pumps) dan atau carbapenem-hydrolyzing beta-lactamase enzymes seperti OXA carbapenamases dan metalo-beta-laktamase (MBL) memperantarai terjadinya resistensi karbapenem.
Kata kunci : karbapenem, resistensi antibotik, Acinetobacterbaumannii.
Mechanism
of
Acinetobacter baumanii Resistance
against Carbapenem Class Antibiotics
Abstract
Acinetobacter baumannii (A. baumanii) is the most frequent species of Acinetobacter isolated from humans. A. baumanii is more commonly found in nosocomial infection than it is in community
acquired infection. A. baumannii’s existence in environments is associated with the diversity of its
reservoirs, its capacity to accumulate genes of antimicrobial resistence, and its resistence to desiccation. Infection by Multidrug resistent (MDR) strains of A. baumannii is not easy to manage and has become a problem in many countries. Carbapenem is the main antibiotic used to treat patients infected with Acimetobacter, causing its increased resistance to carbapenem. The mechanism of action of carbapenem is to inhibit the polymerization and peptidoglycan attachment to cell walls. Lack of drug penetration (porin mutations and efflux pumps) or carbapenem-hydrolyzing beta-lactamase enzymes such as OXA carbapenamases and metalo-beta-beta-lactamase (MBL) mediates carbapenem resistance.
Pendahuluan
Acinetobacter merupakan salah satu bakteri patogen utama yang banyak ditemukan di seluruh dunia. Di Indonesia, kasus infeksi
Acinetobacter sebesar 25,8%.1 Acinetobacter baumannii (A. baumanii) merupakan basil gram-negatif, pleomorfik berbentuk batang pendek agak bulat (kokobasilus), bersifat aerob dan sering dapat diisolasi dari lingkungan rumah sakit dan dari penderita rawat inap di rumah sakit.2 A. baumannii
banyak ditemukan sebagai bakteri penyebab infeksi nosokomial pada saluran kemih, infeksi luka operasi, infeksi pembuluh darah,
Ventilator-Associated Pneumonia (VAP) dan meningitis khususnya pasien dengan sistem imun yang rendah pada unit perawatan intensif (Intensive Care Unit/ICU).2
Antibiotik sering digunakan terkait dengan banyaknya kejadian infeksi bakteri. Antibiotik juga digunakan sebagai profilaksis untuk mencegah atau membatasi infeksi terutama pada pasien yang berisiko. Maka, penggunaan antibiotik secara rasional menjadi hal penting yang perlu diperhatikan.3 Pada
penelitian di rumah sakit di wilayah Asia dan Timur Tengah, ditemukan infeksi terbanyak disebabkan oleh Multi Drug Resistant A. baumannii.4
Menurut laporan Centers for Disease Control and Prevention (CDC), resistensi A. baumanii terhadap karbapenem meningkat dari 9% pada tahun 1995 menjadi 40% pada tahun 2004.5 Penelitian di ICU RSUP Sanglah
Denpasar didapatkan infeksi yang disebabkan
A. baumannii sebesar 18%. Dari delapan isolat yang diuji dalam penelitian tersebut, didapatkan resisten terhadap meropenem.6
Karbapenem merupakan antibiotik utama yang dipakai untuk mengobati pasien infeksi oleh
Acinetobacter sehingga menyebabkan banyak terjadi resistensi terhadap karbapenem.2
Penggunaan antibiotik yang tidak tepat dapat mempercepat fenomena alami resistensi. Pengendalian infeksi yang tidak baik, dapat meningkatkan penyebaran mikroorganisme yang sudah resisten.2
Acinetobacter baumannii
Acinetobacter spp. bersifat non-motil, non-fastidious, katalase positif, oksidase negatif, dan tidak memfermentasi glukosa.7 Genus Acinetobacter cenderung tumbuh
dengan baik pada media rutin, seperti agar darah domba pada suhu 37°C. Koloninya sebesar 1 hingga 2 mm, berkubah, berlendir, dan tidak berpigmen. Morfologi Acinetobacter variabel, biasanya berbentuk batang selama pertumbuhan yang cepat tetapi berbentuk kokobasil selama fase diam.8 Kemampuan menyerap zat warna kristal ungu pada pewarnaan gram bervariasi; karenanya, organisme ini terkadang salah diklasifikasikan sebagai kokus gram positif.8 Di antara spesies
Acinetobacter, A. baumanii yang paling
penting dalam infeksi nosokomial di dunia. Bakteri ini merupakan patogen yang bertanggung jawab pada infeksi oportunistik kulit, aliran darah, traktus urinarius dan jaringan lunak.7 Kebanyakan infeksi A.
baumanii terjadi pada pasien kritis di ICU, angka kejadiannya mencapai 20% di seluruh dunia.7
Beberapa faktor virulensi yang sudah diketahui melalui analisis fenotipik dan genomik, meliputi outer membrane porin, fosfolipase, protease, lipopolisakarida (LPS), kapsul polisakarida, sistem sekresi protein, dan
iron-chelating system.9 Banyak laporan
menunjukan A. baumanii dapat dengan cepat resisten terhadap antibiotik dan menjadi
multidrugs-resistant (MDR).7 WHO
menyatakan A. baumanii merupakan salah satu organisme ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa dan Enterobacter spp.) yang dapat menghindar dari efek obat antimikroba.7
Epidemiologi
Acinetobacter seringkali ditemukan pada penderita yang sedang dirawat di ICU, terutama penderita yang mendapatkan perawatan intubasi dan yang memerlukan banyak intervensi pada pembuluh darah atau perlengkapan monitoring, alat pembedahan atau kateter saluran urinarius. Jarang infeksi
Acenitobacter didapat pada penderita yang sudah dirawat di ruangan perawatan. Di rumah sakit, bakteri dapat terkumpul dalam larutan pembersih dan mampu bertahan hidup selama beberapa minggu pada perlengkapan medik dan kulit manusia. Berbagai faktor yang mempengaruhi pembentukan koloni bakteri atau terjadinya infeksi dengan spesies
Acinetobacter yang sudah kebal terhadap banyak obat, antara lain adalah masa rawat inap yang lebih lama di rumah sakit, terjadinya kontaminasi di ICU, penggunaan alat pernapasan mekanik (ventilator), paparan dengan agen antimikrobial, akibat pembedahan, tindakan yang invasif, dan adanya penyakit berat yang tidak diketahui (underlying disease). Telah terjadinya pencemaran lingkungan yang luas dapat dibuktikan dengan ditemukannya bakteri
Acinetobacter pada alat-alat perawatan pernapasan, perlengkapan perawatan luka, alat pengatur kelembaban, dan alat-alat lain untuk merawat penderita.2
Mekanisme Kerja Antibiotik pada Sel Bakteri
Antibiotik mempunyai peran vital pada pengobatan penyakit infeksi sejak
ditemukannya penisilin pada era tahun 1920an.10 Sejak itu, ratusan antibiotik telah
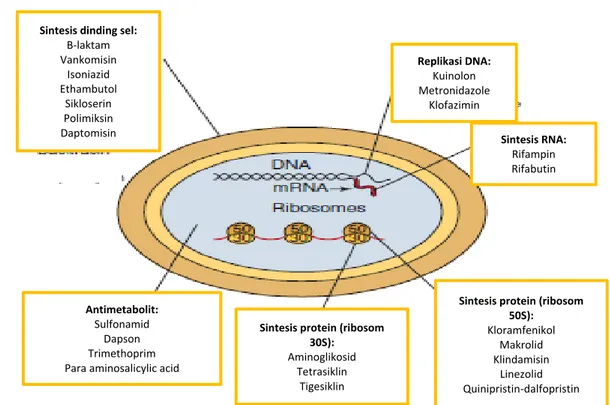
diproduksi dan disintesis untuk penggunaan klinik. Banyaknya jumlah serta variasi antibiotik yang ada pada saat ini memberi kesempatan yang lebih luas kepada para klinisi di dalam pemakaiannya. Namun perkembangan ini juga membuat para klinisi sulit untuk menentukan pengobatan penyakit infeksi. Untuk mengatasi hal ini terlebih dahulu perlu diketahui mekanisme kerja obat-obat antimikroba terhadap sel bakteri penyebab infeksi. Secara umum mekanisme kerja antibiotik pada sel bakteri dapat terjadi melalui beberapa cara yaitu menghambat sintesis dinding sel bakteri, menghambat fungsi membran plasma, menghambat sintesis asam nukleat, menghambat sintesis protein melalui penghambatan pada tahap translasi dan transkripsi meterial genetik, dan menghambat metabolisme folat.10
Gambar 1. Mekanisme Kerja Antibiotik pada Bakteri 11 Semua antibiotik golongan β-laktam
termasuk golongan karbapenem bersifat inhibitor selektif terhadap síntesis dinding sel bakteri, sehingga bersifat aktif pada bakteri yang dalam fase pertumbuhan. Tahap awal kerja antibiotik ini dimulai dari pengikatan
obat pada reseptor sel bakteri, yaitu pada protein pengikat penisilin (Penicillin-binding proteins/PBPs). Setelah obat melekat pada satu atau lebih reseptor, maka reaksi transpeptidasi akan dihambat dan selanjutnya sintesis peptidoglikan akan dihambat. Tahap
Sintesis dinding sel:
Β-laktam Vankomisin Isoniazid Ethambutol Sikloserin Polimiksin Daptomisin Replikasi DNA: Kuinolon Metronidazole Klofazimin Antimetabolit: Sulfonamid Dapson Trimethoprim Para aminosalicylic acid
Sintesis protein (ribosom 30S):
Aminoglikosid Tetrasiklin
Tigesiklin
Sintesis protein (ribosom 50S): Kloramfenikol Makrolid Klindamisin Linezolid Quinipristin-dalfopristin Sintesis RNA: Rifampin Rifabutin
Pendahuluan
Acinetobacter merupakan salah satu bakteri patogen utama yang banyak ditemukan di seluruh dunia. Di Indonesia, kasus infeksi
Acinetobacter sebesar 25,8%.1 Acinetobacter baumannii (A. baumanii) merupakan basil gram-negatif, pleomorfik berbentuk batang pendek agak bulat (kokobasilus), bersifat aerob dan sering dapat diisolasi dari lingkungan rumah sakit dan dari penderita rawat inap di rumah sakit.2 A. baumannii
banyak ditemukan sebagai bakteri penyebab infeksi nosokomial pada saluran kemih, infeksi luka operasi, infeksi pembuluh darah,
Ventilator-Associated Pneumonia (VAP) dan meningitis khususnya pasien dengan sistem imun yang rendah pada unit perawatan intensif (Intensive Care Unit/ICU).2
Antibiotik sering digunakan terkait dengan banyaknya kejadian infeksi bakteri. Antibiotik juga digunakan sebagai profilaksis untuk mencegah atau membatasi infeksi terutama pada pasien yang berisiko. Maka, penggunaan antibiotik secara rasional menjadi hal penting yang perlu diperhatikan.3 Pada
penelitian di rumah sakit di wilayah Asia dan Timur Tengah, ditemukan infeksi terbanyak disebabkan oleh Multi Drug Resistant A. baumannii.4
Menurut laporan Centers for Disease Control and Prevention (CDC), resistensi A. baumanii terhadap karbapenem meningkat dari 9% pada tahun 1995 menjadi 40% pada tahun 2004.5 Penelitian di ICU RSUP Sanglah
Denpasar didapatkan infeksi yang disebabkan
A. baumannii sebesar 18%. Dari delapan isolat yang diuji dalam penelitian tersebut, didapatkan resisten terhadap meropenem.6
Karbapenem merupakan antibiotik utama yang dipakai untuk mengobati pasien infeksi oleh
Acinetobacter sehingga menyebabkan banyak terjadi resistensi terhadap karbapenem.2
Penggunaan antibiotik yang tidak tepat dapat mempercepat fenomena alami resistensi. Pengendalian infeksi yang tidak baik, dapat meningkatkan penyebaran mikroorganisme yang sudah resisten.2
Acinetobacter baumannii
Acinetobacter spp. bersifat non-motil, non-fastidious, katalase positif, oksidase negatif, dan tidak memfermentasi glukosa.7 Genus Acinetobacter cenderung tumbuh
dengan baik pada media rutin, seperti agar darah domba pada suhu 37°C. Koloninya sebesar 1 hingga 2 mm, berkubah, berlendir, dan tidak berpigmen. Morfologi Acinetobacter variabel, biasanya berbentuk batang selama pertumbuhan yang cepat tetapi berbentuk kokobasil selama fase diam.8 Kemampuan menyerap zat warna kristal ungu pada pewarnaan gram bervariasi; karenanya, organisme ini terkadang salah diklasifikasikan sebagai kokus gram positif.8 Di antara spesies
Acinetobacter, A. baumanii yang paling
penting dalam infeksi nosokomial di dunia. Bakteri ini merupakan patogen yang bertanggung jawab pada infeksi oportunistik kulit, aliran darah, traktus urinarius dan jaringan lunak.7 Kebanyakan infeksi A.
baumanii terjadi pada pasien kritis di ICU, angka kejadiannya mencapai 20% di seluruh dunia.7
Beberapa faktor virulensi yang sudah diketahui melalui analisis fenotipik dan genomik, meliputi outer membrane porin, fosfolipase, protease, lipopolisakarida (LPS), kapsul polisakarida, sistem sekresi protein, dan
iron-chelating system.9 Banyak laporan
menunjukan A. baumanii dapat dengan cepat resisten terhadap antibiotik dan menjadi
multidrugs-resistant (MDR).7 WHO
menyatakan A. baumanii merupakan salah satu organisme ESKAPE (Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa dan Enterobacter spp.) yang dapat menghindar dari efek obat antimikroba.7
Epidemiologi
Acinetobacter seringkali ditemukan pada penderita yang sedang dirawat di ICU, terutama penderita yang mendapatkan perawatan intubasi dan yang memerlukan banyak intervensi pada pembuluh darah atau perlengkapan monitoring, alat pembedahan atau kateter saluran urinarius. Jarang infeksi
Acenitobacter didapat pada penderita yang sudah dirawat di ruangan perawatan. Di rumah sakit, bakteri dapat terkumpul dalam larutan pembersih dan mampu bertahan hidup selama beberapa minggu pada perlengkapan medik dan kulit manusia. Berbagai faktor yang mempengaruhi pembentukan koloni bakteri atau terjadinya infeksi dengan spesies
Acinetobacter yang sudah kebal terhadap banyak obat, antara lain adalah masa rawat inap yang lebih lama di rumah sakit, terjadinya kontaminasi di ICU, penggunaan alat pernapasan mekanik (ventilator), paparan dengan agen antimikrobial, akibat pembedahan, tindakan yang invasif, dan adanya penyakit berat yang tidak diketahui (underlying disease). Telah terjadinya pencemaran lingkungan yang luas dapat dibuktikan dengan ditemukannya bakteri
Acinetobacter pada alat-alat perawatan pernapasan, perlengkapan perawatan luka, alat pengatur kelembaban, dan alat-alat lain untuk merawat penderita.2
Mekanisme Kerja Antibiotik pada Sel Bakteri
Antibiotik mempunyai peran vital pada pengobatan penyakit infeksi sejak
ditemukannya penisilin pada era tahun 1920an.10 Sejak itu, ratusan antibiotik telah
diproduksi dan disintesis untuk penggunaan klinik. Banyaknya jumlah serta variasi antibiotik yang ada pada saat ini memberi kesempatan yang lebih luas kepada para klinisi di dalam pemakaiannya. Namun perkembangan ini juga membuat para klinisi sulit untuk menentukan pengobatan penyakit infeksi. Untuk mengatasi hal ini terlebih dahulu perlu diketahui mekanisme kerja obat-obat antimikroba terhadap sel bakteri penyebab infeksi. Secara umum mekanisme kerja antibiotik pada sel bakteri dapat terjadi melalui beberapa cara yaitu menghambat sintesis dinding sel bakteri, menghambat fungsi membran plasma, menghambat sintesis asam nukleat, menghambat sintesis protein melalui penghambatan pada tahap translasi dan transkripsi meterial genetik, dan menghambat metabolisme folat.10
Gambar 1. Mekanisme Kerja Antibiotik pada Bakteri 11 Semua antibiotik golongan β-laktam
termasuk golongan karbapenem bersifat inhibitor selektif terhadap síntesis dinding sel bakteri, sehingga bersifat aktif pada bakteri yang dalam fase pertumbuhan. Tahap awal kerja antibiotik ini dimulai dari pengikatan
obat pada reseptor sel bakteri, yaitu pada protein pengikat penisilin (Penicillin-binding proteins/PBPs). Setelah obat melekat pada satu atau lebih reseptor, maka reaksi transpeptidasi akan dihambat dan selanjutnya sintesis peptidoglikan akan dihambat. Tahap
Sintesis dinding sel:
Β-laktam Vankomisin Isoniazid Ethambutol Sikloserin Polimiksin Daptomisin Replikasi DNA: Kuinolon Metronidazole Klofazimin Antimetabolit: Sulfonamid Dapson Trimethoprim Para aminosalicylic acid
Sintesis protein (ribosom 30S):
Aminoglikosid Tetrasiklin
Tigesiklin
Sintesis protein (ribosom 50S): Kloramfenikol Makrolid Klindamisin Linezolid Quinipristin-dalfopristin Sintesis RNA: Rifampin Rifabutin
berikutnya adalah inaktivasi serta hilangnya inhibitor enzim-enzim autolitik pada dinding sel. Akibatnya, aktivasi enzim-enzim litik yang akan menyebabkan lisis bakteri.14
Antibiotik lain seperti basitrasin, teikoplanin, vankomisin, ristosetin dan novobiosin menghambat tahap awal pada sintesis peptidoglikan. Karena tahap awal dari sintesis berlangsung pada membran sitoplasma, maka agar menjadi efektif, antibiotik ini harus penetrasi melalui membran. Resistensi terhadap penisilin disebabkan oleh pembentukan enzim yang merusak penisilin, yaitu enzim β-laktamase.12 Enzim ini akan
menyebabkan terbukanya cincin β–laktam pada penisilin dan sefalosporin sehingga merusak aktivitas antimikroba.12
Antibiotik beta-laktam terdiri dari berbagai golongan obat yang mempunyai struktur cincin beta-laktam, yaitu penisilin, sefalosporin, monobaktam, karbapenem, dan inhibitor beta-laktamase. Obat-obat antibiotik beta-laktam umumnya bersifat bakterisid, dan sebagian besar efektif terhadap organisme Gram positif dan negatif.13 Antibiotik
betalaktam mengganggu sintesis dinding sel bakteri, dengan menghambat langkah terakhir dalam sintesis peptidoglikan, yaitu heteropolimer yang memberikan stabilitas mekanik pada dinding sel bakteri.13 Antibiotik
golongan β-laktam bersifat inhibitor selektif terhadap sintesis dinding sel bakteri dengan demikian aktif pada bakteri yang dalam fase pertumbuhan.14
Karbapenem merupakan antibiotik lini ketiga yang mempunyai aktivitas antibiotik yang lebih luas daripada sebagian besar betalaktam lainnya. Antibiotik yang termasuk karbapenem adalah imipenem, meropenem dan doripenem. Spektrum aktivitasnya yaitu
menghambat sebagian besar gram positif, gram negatif, dan anaerob. Ketiganya sangat tahan terhadap betalaktamase. Karbapenem memiliki efek samping, yang paling sering adalah mual dan muntah, dan kejang pada dosis tinggi yang diberi pada pasien dengan lesi susunan saraf pusat (SSP) atau insufisiensi ginjal.13 Meropenem dan doripenem
mempunyai efikasi serupa imipenem, tetapi lebih jarang menyebabkan kejang.13
Mekanisme Resistensi A. baumanii terhadap Karbapenem
A. Baumanii sudah menjadi salah satu patogen di layanan kesehatan yang banyak memiliki kemampuan untuk menjadi resisten terhadap antimikroba. Beberapa strain sangat resisten terhadap antibiotik yang banyak digunakan di klinik. A. baumanii memiliki beberapa mekanisme resistensi terhadap antibiotik, diantaranya adalah β-laktamase,
aminoglycoside-modifying enzyme, pompa efluks, defek permeabilitas dan modifikasi lokasi target.7 Akumulasi beberapa mekanisme
resistensi menyebabkan pilihan antibiotik menjadi terbatas.7
Karbapenem (imipenem, meropenem dan doripenem) secara umum digunakan untuk terapi infeksi yang disebabkan A. baumanii,
karena aktivitasnya yang efektif dan aman.7
Namun, penurunan kepekaan A. baumanii
terhadap karbapenem memaksa klinisi dan peneliti untuk mencari alternatif terapi.7
Beberapa mekanisme resistensi A. baumanii
yang sudah diketahui meliputi adanya enzim yang mendegradasi obat (beta-laktamase), modifikasi target, multidrug efflux pumps, dan
defek permeabilitas.13
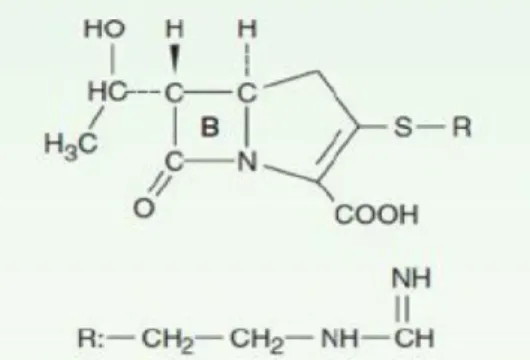
Gambar 2. Struktur Kimia Karbapenem15
Karbapenemase adalah β-laktamase
dengan kapasitas hidrolitik serbaguna. Mereka memiliki kemampuan untuk menghidrolisis penisilin, sefalosporin, monobaktam, dan
karbapenem. Bakteri yang menghasilkan β
-laktamase ini dapat menyebabkan infeksi serius di mana aktivitas karbapenemase
menjadikan banyak β-laktam menjadi tidak
efektif. Karbapenemase adalah anggota dari
kelas molekul A, B, dan D β-laktamase. Enzim
kelas A dan D memiliki mekanisme hidrolitik berbasis serin, sedangkan enzim kelas B adalah metallo-β-laktamase yang mengandung zinc di tempat aktif.16 Enzim kelas D karbapenemase terdiri dari OXA-tipe β
-laktamase yang sering terdeteksi di Acinetobacter baumannii.16
Karbapenem sering digunakan untuk mengobati infeksi bakteri multi resisten, salah satunya yang disebabkan oleh Acimetobacter.
Hampir setengahnya yang dilaporkan pada CDC National Healthcare Safety Network
pada tahun 2014 merupakan karbapenem resisten. Infeksi oleh A. baumannii resisten karbapenem dikaitkan dengan angka kematian yang tinggi, yaitu sebesar 52%.17
OXA β-laktamase mewakili salah satu keluarga plasmid encoded β-lactamase yang paling lazim pada akhir 1970-an dan awal 1980-an.16 Ketika kelas molekul D OXA β -laktamase ditempatkan secara terpisah dari kelas molekul serine β-lactamases lainnya, mereka terutama telah diidentifikasi di Enterobacteriaceae dan P. aeruginosa dan secara fungsional digambarkan sebagai penisilinase yang mampu menghidrolisis oxacillin dan cloxacillin.16 Umumnya kurang terhambat oleh asam klavulanat dan EDTA dan dikenal memiliki sejumlah besar variabilitas dalam urutan asam amino.16
OXA β-laktamase pertama dengan aktivitas karbapenemase pertama kali dijelaskan oleh Paton dkk. pada tahun 1993.16
Enzim dimurnikan dari strain A. baumannii
yang resisten terhadap berbagai obat yang diisolasi pada tahun 1985 dari seorang pasien di Edinburgh, Skotlandia.16 Karakterisasi
biokimia mengungkapkan β-laktamase dengan
pH isoelektrik (pI) nilai 6,65 yang berarti susah dihambat oleh asam klavulanat dan EDTA. 16 Enzim tersebut terdapat di ARI-1
(Acinetobacter resistant to imipenem). Susunan dari Enzim ARI-1 mengungkapkan bahwa itu milik kelas OXA D family dari β -laktamase, dan kemudian diganti namanya menjadi OXA-23.16 OXA-23 mewakili bagian
baru dari keluarga OXA, dengan identitas asam amino tertinggi sampai pada OXA-5 dan OXA-10 sebesar 36%.16
Hidrolisis karbapenem oleh kelas D family oxacillinase lemah, tetapi Heritier dkk. menunjukkan bahwa plasmid enzim OXA-23 dan OXA-58 yang disandikan berkontribusi resistensi karbapenem pada A. baumannii.15 Resistensi A. baumannii terhadap karbapenem diperantai akibat kurangnya penetrasi obat (mutasi porin dan efflux pumps) dan atau
carbapenem-hydrolyzing beta-lactamase enzymes seperti OXA carbapenamases dan metalo-beta-laktamase (MBL).18,19
Penutup
A. baumannii merupakan salah satu penyebab infeksi nosokomial pada saluran kemih, infeksi luka operasi, infeksi pembuluh darah, VAP dan pasien dengan sistem imun rendah yang berada di ICU. Antibiotik utama yang dipakai untuk mengobati pasien infeksi
A.baumannii adalah karbapenem. Oleh karena itu A. baumannii mengalami resistensi terhadap karbapenem. Mekanisme kerja karbapenem yaitu dengan menghambat polimerisasi dan perlekatan peptidoglikan pada dinding sel. Resistensi A. baumannii
diakibatkan kurangnya penetrasi obat (mutasi porin dan efflux pumps) dan atau carbapenem-hydrolyzing beta-lactamase enzymes seperti OXA carbapenamases dan metalo-beta-laktamase (MBL) yang memperantarai terjadinya resistensi karbapenem.
Daftar Pustaka
1. Moehario LK, Tjoa E, Kiranasari A, Ningsih I, Rosana Y, Kurniawati A. Trends in antimicrobial susceptibility of gram-negative bacteria isolated from blood in Jakarta from 2002 to 2008.J Infect Dev Ctries 2009;3(11):838-43. 2. Soekiman S. Infeksi nosokomial di rumah
sakit. Jakarta: CV sagung seto; 2016: h. 26-38.
3. Mandal B, Wilkins E, Dunbar E, Mayon R. Lecture notes: penyakit infeksi. Ed.6. Jakarta: Erlangga; 2008. h.15-24
4. Sieniawski K, Kaczka K, Gaqis L, Pomorski L. Acinetobacter baumannii
nosocomial infections. Polish J of surgery.2013;85(9):483-90.
5. Kraniotaki E, Manganelli R, Platsouka E, Grossato A, Paniara O, Palù G. Molecular investigation of an outbreak of multidrug-resistant Acinetobacter baumannii, with characterisation of class 1 integrons. Int J Antimicrob Agents. 2006 Sep;28(3):193-9. 6. Hamdiyati R, Pinatih KJP, Fatmawati
NND. Pola mikroba pasien yang dirawat di Intensive Care Unit (ICU) serta kepekaannya terhadap antibiotik di RSUP Sanglah Denpasar Bali Agustus-Oktober 2013. E-Jurnal Medika. 2016 Apr;5(4):. http://ojs.unud.ac.id/index.php/eum
berikutnya adalah inaktivasi serta hilangnya inhibitor enzim-enzim autolitik pada dinding sel. Akibatnya, aktivasi enzim-enzim litik yang akan menyebabkan lisis bakteri.14
Antibiotik lain seperti basitrasin, teikoplanin, vankomisin, ristosetin dan novobiosin menghambat tahap awal pada sintesis peptidoglikan. Karena tahap awal dari sintesis berlangsung pada membran sitoplasma, maka agar menjadi efektif, antibiotik ini harus penetrasi melalui membran. Resistensi terhadap penisilin disebabkan oleh pembentukan enzim yang merusak penisilin, yaitu enzim β-laktamase.12 Enzim ini akan
menyebabkan terbukanya cincin β–laktam pada penisilin dan sefalosporin sehingga merusak aktivitas antimikroba.12
Antibiotik beta-laktam terdiri dari berbagai golongan obat yang mempunyai struktur cincin beta-laktam, yaitu penisilin, sefalosporin, monobaktam, karbapenem, dan inhibitor beta-laktamase. Obat-obat antibiotik beta-laktam umumnya bersifat bakterisid, dan sebagian besar efektif terhadap organisme Gram positif dan negatif.13 Antibiotik
betalaktam mengganggu sintesis dinding sel bakteri, dengan menghambat langkah terakhir dalam sintesis peptidoglikan, yaitu heteropolimer yang memberikan stabilitas mekanik pada dinding sel bakteri.13 Antibiotik
golongan β-laktam bersifat inhibitor selektif terhadap sintesis dinding sel bakteri dengan demikian aktif pada bakteri yang dalam fase pertumbuhan.14
Karbapenem merupakan antibiotik lini ketiga yang mempunyai aktivitas antibiotik yang lebih luas daripada sebagian besar betalaktam lainnya. Antibiotik yang termasuk karbapenem adalah imipenem, meropenem dan doripenem. Spektrum aktivitasnya yaitu
menghambat sebagian besar gram positif, gram negatif, dan anaerob. Ketiganya sangat tahan terhadap betalaktamase. Karbapenem memiliki efek samping, yang paling sering adalah mual dan muntah, dan kejang pada dosis tinggi yang diberi pada pasien dengan lesi susunan saraf pusat (SSP) atau insufisiensi ginjal.13 Meropenem dan doripenem
mempunyai efikasi serupa imipenem, tetapi lebih jarang menyebabkan kejang.13
Mekanisme Resistensi A. baumanii terhadap Karbapenem
A. Baumanii sudah menjadi salah satu patogen di layanan kesehatan yang banyak memiliki kemampuan untuk menjadi resisten terhadap antimikroba. Beberapa strain sangat resisten terhadap antibiotik yang banyak digunakan di klinik. A. baumanii memiliki beberapa mekanisme resistensi terhadap antibiotik, diantaranya adalah β-laktamase,
aminoglycoside-modifying enzyme, pompa efluks, defek permeabilitas dan modifikasi lokasi target.7 Akumulasi beberapa mekanisme
resistensi menyebabkan pilihan antibiotik menjadi terbatas.7
Karbapenem (imipenem, meropenem dan doripenem) secara umum digunakan untuk terapi infeksi yang disebabkan A. baumanii,
karena aktivitasnya yang efektif dan aman.7
Namun, penurunan kepekaan A. baumanii
terhadap karbapenem memaksa klinisi dan peneliti untuk mencari alternatif terapi.7
Beberapa mekanisme resistensi A. baumanii
yang sudah diketahui meliputi adanya enzim yang mendegradasi obat (beta-laktamase), modifikasi target, multidrug efflux pumps, dan
defek permeabilitas.13
Gambar 2. Struktur Kimia Karbapenem15
Karbapenemase adalah β-laktamase
dengan kapasitas hidrolitik serbaguna. Mereka memiliki kemampuan untuk menghidrolisis penisilin, sefalosporin, monobaktam, dan
karbapenem. Bakteri yang menghasilkan β
-laktamase ini dapat menyebabkan infeksi serius di mana aktivitas karbapenemase
menjadikan banyak β-laktam menjadi tidak
efektif. Karbapenemase adalah anggota dari
kelas molekul A, B, dan D β-laktamase. Enzim
kelas A dan D memiliki mekanisme hidrolitik berbasis serin, sedangkan enzim kelas B adalah metallo-β-laktamase yang mengandung zinc di tempat aktif.16 Enzim kelas D karbapenemase terdiri dari OXA-tipe β
-laktamase yang sering terdeteksi di Acinetobacter baumannii.16
Karbapenem sering digunakan untuk mengobati infeksi bakteri multi resisten, salah satunya yang disebabkan oleh Acimetobacter.
Hampir setengahnya yang dilaporkan pada CDC National Healthcare Safety Network
pada tahun 2014 merupakan karbapenem resisten. Infeksi oleh A. baumannii resisten karbapenem dikaitkan dengan angka kematian yang tinggi, yaitu sebesar 52%.17
OXA β-laktamase mewakili salah satu keluarga plasmid encoded β-lactamase yang paling lazim pada akhir 1970-an dan awal 1980-an.16 Ketika kelas molekul D OXA β -laktamase ditempatkan secara terpisah dari kelas molekul serine β-lactamases lainnya, mereka terutama telah diidentifikasi di Enterobacteriaceae dan P. aeruginosa dan secara fungsional digambarkan sebagai penisilinase yang mampu menghidrolisis oxacillin dan cloxacillin.16 Umumnya kurang terhambat oleh asam klavulanat dan EDTA dan dikenal memiliki sejumlah besar variabilitas dalam urutan asam amino.16
OXA β-laktamase pertama dengan aktivitas karbapenemase pertama kali dijelaskan oleh Paton dkk. pada tahun 1993.16
Enzim dimurnikan dari strain A. baumannii
yang resisten terhadap berbagai obat yang diisolasi pada tahun 1985 dari seorang pasien di Edinburgh, Skotlandia.16 Karakterisasi
biokimia mengungkapkan β-laktamase dengan
pH isoelektrik (pI) nilai 6,65 yang berarti susah dihambat oleh asam klavulanat dan EDTA. 16 Enzim tersebut terdapat di ARI-1
(Acinetobacter resistant to imipenem). Susunan dari Enzim ARI-1 mengungkapkan bahwa itu milik kelas OXA D family dari β -laktamase, dan kemudian diganti namanya menjadi OXA-23.16 OXA-23 mewakili bagian
baru dari keluarga OXA, dengan identitas asam amino tertinggi sampai pada OXA-5 dan OXA-10 sebesar 36%.16
Hidrolisis karbapenem oleh kelas D family oxacillinase lemah, tetapi Heritier dkk. menunjukkan bahwa plasmid enzim OXA-23 dan OXA-58 yang disandikan berkontribusi resistensi karbapenem pada A. baumannii.15 Resistensi A. baumannii terhadap karbapenem diperantai akibat kurangnya penetrasi obat (mutasi porin dan efflux pumps) dan atau
carbapenem-hydrolyzing beta-lactamase enzymes seperti OXA carbapenamases dan metalo-beta-laktamase (MBL).18,19
Penutup
A. baumannii merupakan salah satu penyebab infeksi nosokomial pada saluran kemih, infeksi luka operasi, infeksi pembuluh darah, VAP dan pasien dengan sistem imun rendah yang berada di ICU. Antibiotik utama yang dipakai untuk mengobati pasien infeksi
A.baumannii adalah karbapenem. Oleh karena itu A. baumannii mengalami resistensi terhadap karbapenem. Mekanisme kerja karbapenem yaitu dengan menghambat polimerisasi dan perlekatan peptidoglikan pada dinding sel. Resistensi A. baumannii
diakibatkan kurangnya penetrasi obat (mutasi porin dan efflux pumps) dan atau carbapenem-hydrolyzing beta-lactamase enzymes seperti OXA carbapenamases dan metalo-beta-laktamase (MBL) yang memperantarai terjadinya resistensi karbapenem.
Daftar Pustaka
1. Moehario LK, Tjoa E, Kiranasari A, Ningsih I, Rosana Y, Kurniawati A. Trends in antimicrobial susceptibility of gram-negative bacteria isolated from blood in Jakarta from 2002 to 2008.J Infect Dev Ctries 2009;3(11):838-43. 2. Soekiman S. Infeksi nosokomial di rumah
sakit. Jakarta: CV sagung seto; 2016: h. 26-38.
3. Mandal B, Wilkins E, Dunbar E, Mayon R. Lecture notes: penyakit infeksi. Ed.6. Jakarta: Erlangga; 2008. h.15-24
4. Sieniawski K, Kaczka K, Gaqis L, Pomorski L. Acinetobacter baumannii
nosocomial infections. Polish J of surgery.2013;85(9):483-90.
5. Kraniotaki E, Manganelli R, Platsouka E, Grossato A, Paniara O, Palù G. Molecular investigation of an outbreak of multidrug-resistant Acinetobacter baumannii, with characterisation of class 1 integrons. Int J Antimicrob Agents. 2006 Sep;28(3):193-9. 6. Hamdiyati R, Pinatih KJP, Fatmawati
NND. Pola mikroba pasien yang dirawat di Intensive Care Unit (ICU) serta kepekaannya terhadap antibiotik di RSUP Sanglah Denpasar Bali Agustus-Oktober 2013. E-Jurnal Medika. 2016 Apr;5(4):. http://ojs.unud.ac.id/index.php/eum
7. Lee C-R, Lee JH, Park M, Park KS, Bae IK, Kim YB, Cha C-J, Jeong BC and Lee SH. Biology of Acinetobacter baumannii: pathogenesis, antibiotic resistance mechanisms, and prospective treatment options. Front. Cell. Infect. Microbiol. 2017;7:55.
8. Alsan M, Komplas M. Acinetobacter baumannii: An emerging and important pathogen. J Clin Outcomes Manag. 2010 Aug;17(8): 363–9.
9. Lin, M. F., and Lan, C. Y. Antimicrobial resistance in Acinetobacter baumannii: from bench to bedside. World J. Clin. Cases. 2014;2:787–814.
10. Brooks GF, Butel JS, Morse SA. Jawetz, Melnick, & Adelberg’s. Medical microbiology 26st ed, Prentice Hall International Inc; 2013: h.249-51.
11. Murray PR, Rosenthal KS, Pfaller MA. Manual of clinical microbiology. Ch:13. 9th ed. 2016: h. 163
12. Sudigdoadi S. Mekanisme timbulnya resistensi antibiotik pada infeksi bakteri. Bagian Mikrobiologi: Fakultas Kedokteran Universitas Padjadjaran; 2015: h. 2-5.
13. Menteri Kesehatan Republik Indonesia. Pedoman umum penggunaan antibiotik. dalam peraturan menteri kesehatan
Republik Indonesia nomor
2406/MENKES/PER/XII/2011.
14. Rahman V, Anggraini D, Fauziah D. Pola resistensi Acinetobacter baumannii yang diisolasi di intensive care unit (ICU) RSUD Arifin Achmad Provinsi Riau Periode 1 Januari hingga 31 Desember 2014. Riau: Jurnal Online Mahasiswa Fakultas Kedokteran (JOM FK). 2015; 2(2):1-8
15.Katzung BG, Trevor AJ. Basic and clinical pharmacology 13th ed. Chapter 43. 2015:
p. 1128
16.Queenan AM, Bush K. Carbapenemases:
the Versatile β-Lactamases. New Jersey:
Clinical Microbiology Reviews. 2008; 440 –58.
17.Bulens SN, Yi SH, Walters MS, et al.
Carbapenems Nonsusceptible
Acinetobacter baumannii, 8 US Metropolitan Areas, 2012-2015. Emerging Infectious Diseases. www.cdc.gov/eid. 2018:24(4)
18.Mayasari E, Siregar C. Prevalence of
Acinetobacter baumannii isolated from clinical specimens in Adam Malik Hospital. Padang: MKA. 2014;37(1):1-7 19.Rasyid R, Suharti N. Deteksi dan
identifikasi enzim metallo-beta lactamase (MBL) pada bakteri patogen yang resisten terhadap antibiotika karbapenem. Laporan Penelitian DIPA FK UNAND. Padang: Fakultas Kedokteran Universitas Andalas Padang. 2012
Tinjauan Pustaka
Penyakit Hemolitik pada Bayi Baru Lahir
Martina Rentauli Sihombing, Dominica Pita Sari
Staf Pengajar Bagian Patologi Klinik
Fakultas Kedokteran Universitas Kristen Krida Wacana
Alamat Korespondensi: [email protected]
AbstrakPenyakit hemolitik pada bayi baru lahir adalah sindrom anemia hemolitik dan ikterus yang terjadi akibat destruksi eritrosit yang sudah dilapisi oleh antibodi. Patofisiologi pada penyakit ini adalah karena adanya proses imun yang dimulai saat terjadi sensitisasi pada kehamilan pertama saat darah janin yang memasuki sirkulasi ibu. Adanya ketidakcocokan golongan darah atau rhesus tersebut memicu proses imun ibu membentuk antibodi sehingga menyebabkan penghancuran eritrosit bayi. Hal ini dapat disebabkan oleh adanya ketidakcocokan golongan darah ABO, rhesus, atau golongan darah lainnya. Perbedaan golongan darah antara ibu dan bayi terjadi saat ada faktor golongan darah janin yang diwariskan dari ayahnya tidak dimiliki oleh ibu. Gejala yang timbul antara lain hiperbilirubinemia, anemia, hepatosplenomegali, dan lainnya. Pemeriksaan laboratorium yang berfungsi sebagai pemeriksaan penyaring adalah: Uji Rossete, uji Kleihauer-Betke (KB), flowsitometri dan tes antiglobulin indirek. Pemeriksaan rutin lainnya adalah pemeriksaan darah rutin, kadar bilirubin, golongan darah dan rhesus. Penatalaksanaan saat kehamilan dapat berupa transfusi intrauterin atau imunomodulasi, sementara penatalaksanaan paska kelahiran dapat dengan transfusi tukar, fototerapi atau pemberian imunoglobulin
Kata kunci : Penyakit hemolitik pada bayi baru lahir, sensitisasi, antibodi, imunoglobulin
Hemolytic Disease of The Newborn
Abstract
Hemolytic Disease of the Newborn is a syndrome of hemolytic anemia and jaundice due to the destruction of erythrocytes. This condition is due to the blood type incompatibility of the mother and the baby, such as incompatibility of ABO blood groups, rhesus, or other blood groups. During the first pregnancy, when fetal blood enters the maternal circulation, sensitization occurs triggering an immune process. Antibodies are formed and coat erythrocytes, causing destruction of the baby's erythrocytes. The difference in blood type between mother and baby occurs when there is a factor of fetal blood type inherited from his father that not owned by the mother. Symptoms that arise include hyperbilirubinemia, anemia, hepatosplenomegaly, and others. Laboratory screening tests are conducted by Rossete test, Kleihauer-Betke test (KB), flowcytometry and indirect antiglobulin test. Other routine tests are routine blood tests, bilirubin levels, blood type and rhesus tests. Management during pregnancy can be either by intrauterine transfusion or immunomodulation, while postnatal management can consits of exchange transfusions, phototherapy or immunoglobulin administration. Keywords: Hemolytic Disease of the Newborn, sensitization, antibodies, immunoglobuline