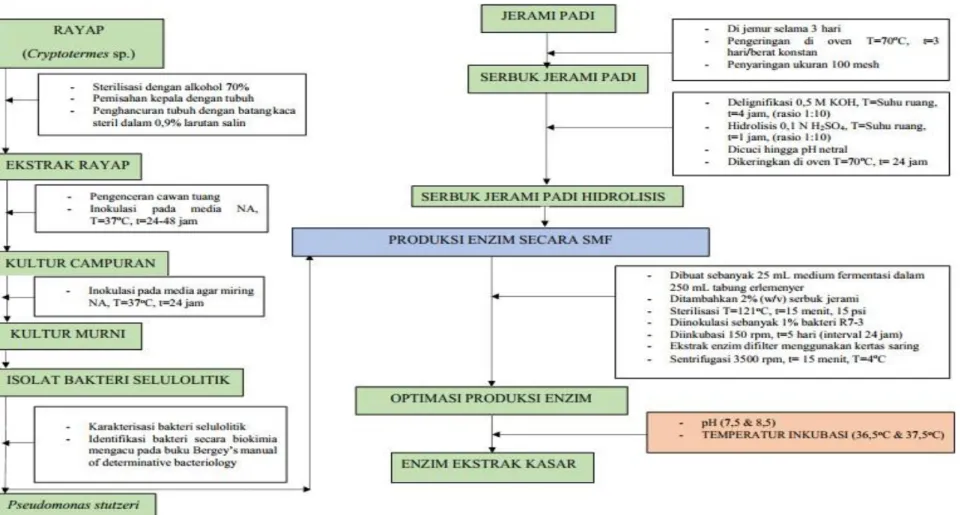
BAB III
METODE PENELITIAN
3.1 Jenis Penelitian
Jenis penelitian yang digunakan adalah penelitian eksperimen, dimana penelitian ini merupakan penelitian yang dilakukan untuk mengetahui pengaruh dari perlakuan yang dilakukan pada subjek dalam kondisi yang terkendalikan (Sugiyono, 2011).
3.2 Desain Penelitian
Desain penelitian yang digunakan adalah Rancangan Acak Lengkap (RAL) faktorial dengan tiga faktor, dimana Rancangan Acak Lengkap merupakan rancangan yang digunakan pada kondisi percobaan yang homogen (Lentner & Bishop, 1986).
Variabel bebas : pH (7,5;8,5), suhu inkubasi (36,5oC;37,50C), waktu inkubasi (0, 24, 48, 72, 96, 120 jam)
Variabel terikat : aktivitas enzim, biomassa
Variabel kontrol : bakteri R7-3, medium fermentasi substrat jerami padi Penentuan variabel bebas mengacu pada penelitian Sreedevi et al., (2013) dimana bakteri Pseudomonas optimum pada pH 7 dan suhu inkubasi 37
oC dan lama waktu inkubasi mengacu pada penelitian Shahid et al., (2016) selama lima hari (0, 24, 48, 72, 96, 120 jam).
Taraf (t) : 10 taraf Pengulangan : t (n – 1) ≥ 15
10 (n-1) ≥ 15 10n ≥ 25
n ≥ 2,5 ~ 3 pengulangan (Hanafiah, 2009)
27
Kombinasi Perlakuan Antara pH, Suhu inkubasi dan Waktu inkubasi
Faktor Banyaknya Taraf
Taraf
pH (V) Jenis : 2 taraf 7,5 (V1)
8,5 (V2) Suhu (N) Jenis : 2 taraf 36,5 oC
(N1)
37,5
oC (N2) Waktu (O) Jenis : 6 taraf 0 jam
(O1)
24 jam (O2)
48 jam (O2)
72 jam (O3)
96 jam (O4)
120 jam (O5)
Sehingga banyaknya percobaan adalah 24 taraf (Vx Nx Ox) x 3 pengulangan = 72 percobaan.
3.3 Populasi dan Sampel
Dalam penelitian ini populasi yang digunakan adalah enzim yang diproduksi oleh isolat bakteri selulolitik R7-3 yang diisolasi dari saluran pencernaan rayap kayu (Cryptotermes sp.) yang diambil dari furniture kursi kayu. Sampel yang digunakan dalam penelitian ini adalah aktivitas enzim selulase yang dihasilkan oleh enzim.
3.4 Waktu dan Tempat Penelitian
Penelitian ini dimulai pada bulan Februari 2019 sampai dengan Juli 2019, yang dilaksanakan di Laboratorium Riset Biologi Universitas Pendidikan Indonesia di Jalan Dr. Setiabudhi No. 299 Kota Bandung.
3.5 Alat dan Bahan
Alat dan bahan yang digunakan selama penelitian mulai dari tahapan pengambilan sampel, isolasi bakteri, pembiakkan isolat bakteri, seleksi bakteri
selulolitik, identifikasi bakteri selulolitik, pembuatan kurva tumbuh bakteri, pre-treatment jerami padi menjadi substrat yang akan digunakan untuk memproduksi enzim selulase, proses penghilangan lignin pada jerami padi (delignifikasi), pengukuran biomassa bakteri yang digunakan pada proses fermentasi untuk menghasilkan enzim selulase dan pengukuran aktivitas enzim selulase berdasarkan jumlah glukosa yang dihasilkan menggunakan metode DNS. Seluruh alat dan bahan tersedia di Laboratorium Riset, Gedung B Fakultas Pendidikan Matematika dan IPA, Universitas Pendidikan Indonesia.
Tabel alat dan bahan yang digunakan terlampir pada Lampiran-1.
3.6 Prosedur Penelitian
Dalam penelitian dilakukan beberapa tahap atau alur, tahap pertama dilakukan isolasi bakteri dari saluran pencernaan rayap hingga diperoleh biakan campuran. Tahap kedua dilakukan seleksi bakteri selulolitik dengan menggunakan medium CMC 1% dan dipilih lima bakteri terbaik berdasarkan indeks selulolitik terbesar. Tahap ketiga dilakukan identifikasi spesies secara morfologi, biokimia dengan merujuk pada buku Bergey’s Manual of Determinative Bacteriology. Tahap keempat dilakukan pembuatan substrat untuk produksi enzim selulase dengan cara membuat jerami hingga ukuran partikel 100 mesh, kemudian dilakukan tahapan delignifikasi secara kimia menggunakan asam dan basa. Tahap kelima dilakukan produksi enzim selulase menggunakan media serbuk jerami padi secara SmF (Submerged Fermentation) berdasarkan perbedaan suhu inkubasi, pH medium dan waktu inkubasi.
Selanjutnya, optimasi aktivitas enzim selulase ditentukan berdasarkan pada bersarnya aktivitas enzim selulase yang diketahui dengan cara menggunakan reagen DNS dan diukur menggunakan spektrofotometer dengan pajang 540 nm.
3.6.1 Tahap Persiapan
Kegiatan persiapan alat dan bahan dilakukan di dalam Laboratorium Riset Biologi, Universitas Pendidikan Indonesia. Persiapan alat dan bahan yang akan digunakan pada penelitian. Alat yang digunakan akan disterilisasi terlebih dahulu dengan cara dibungkus kertas dan dimasukkan
kedalam plastik tahan panas sementara itu, bahan yang akan disterilisasi dimasukkan kedalam wadah kaca bersih, kemudian diberi sumbat serta bungkus plastik. Alat dan bahan yang sudah dipersiapkan untuk disterilisasi, kemudian disterilisasi dengan menggunakan autoclave selama 20 menit pada suhu 121oC dengan tekanan 15 Psi (Shahid et al., 2016). Langkah pembuatan reagen dan media yang digunakan pada penelitian ini tercantum pada Lampiran-2.
3.6.2 Pengambilan Rayap
Rayap diperoleh dari potogan kayu furniture dan ditempatkan pada cawan Petri steril. Tahap pengambilan isolat bakteri rayap dilakukan dengan membersihkan permukaan tubuh rayap sebanyak 15 ekor dengan menggunakan alkohol 70%. Setelah permukaan tubuh rayap steril, kemudian dilakukan pemisahan antara tubuh dan kepala rayap secara steril, tubuh rayap yang diperoleh dihancurkan pada larutan salin 0,9%
menggunakan batang kaca (Gupta et al., 2012; Upadhyaya et al., 2014).
Dilakukan isolasi bakteri dari ekstrak tubuh rayap yang diperoleh.
3.6.3 Pembiakan Isolat Bakteri
Metode yang digunakan dalam isolasi bakteri menggunakan metode pengenceran cawan tuang, dimana dilakukan pengenceran organisme sehingga individu spesies dapat dipisahkan dari spesies lainnya.
Pengenceran dilakukan secara bertingkat hingga pengenceran ke-6.
Dengan menggunakan spread plate method sebanyak 0,1 mL hasil pengenceran diratakan pada permukaan medium NA (Nutrient Agar) dengan menggunakan spatel berbentuk L, kemudian di inkubasi dalam inkubator selama 24 jam. Setiap biakan bakteri campuran yang berbeda secara morfologi koloni dan telah tumbuh pada medium NA diisolasi untuk dibuat biakan murninya (Hadioetomo, 1990)
3.6.4 Seleksi Bakteri Selulolitik pada Media CMC
Berikut ini mrupakan tiga media untuk inokulasi bakteri, diantaranya :
1. NA (Nutrient Agar) dan NB (Nutrient Broth)
Medium NA dan NB digunakan sebagai media pertumbuhan mikroorganisme umum, terdapat sumber karbohidrat, senyawa nitrogen organik atau vitamin yang berguna untuk pertumbuhan mikroorganisme (Tankeshwar, 2016).
2. CMC (Carboxymethylcellulose) Agar
CMC agar digunakan sebagai media selektif mikroorganisme penghasil selulase. Adanya zona bening disekitar koloni menandakan bahwa mikroorganisme tersebut dapat menghidrolisis CMC (Hankin
& Anagnostakis, 1977).
3. Medium Fermentasi
Digunakan medium fermentasi sebagai media biakkan yang akan disaring enzim selulase ekstrak kasar untuk menentukan suhu dan pH optimal, dengan cara dilakukan pengujian aktivitas enzim (Shahid et al., 2016).
3.6.5 Seleksi Bakteri Selulolitik pada Media CMC Agar
Dilakukan seleksi bakteri selulolitik menggunakan CMC agar pada isolat bakteri murni yang telah tumbuh pada medium NA. Komposisi CMC agar terdiri dari MgSO4.7 H2O 0,05 gr/100 mL, Na2HPO4.2H2O 0,5 gr/100 mL, NaCl 0,23 gr/100 mL, yeast extraxt 0,2 gr/100 mL, CMC 1 gr/100 mL dan agar 2,5 gr/100 mL (Ji et al., 2003). Metode kertas cakram digunakan dalam penanaman bakteri pada medium CMC. Pertama dilakukan pembiakan dengan cara inokulasi 1 ose bakteri murni pada 25 mL media NB (Nutrient Broth) dan diinkubasi selama 24 jam dengan suhu 37oC, 120 rpm (Mulyadi et al., 2013). Bakteri yang telah dibiakan kemudian ditanam pada medium CMC agar yang berisi kertas cakram berdiameter ±6 mm sebanyak 10 µl (Niswah, 2014). Setelah bakteri ditanam pada media CMC agar, kemudian diinkubasi dengan suhu 37oC selama 24 jam. Setelah 24 jam, biakan pada media CMC agar diwarnai dengan Congo red 0,1% dan diinkubasikan kembali selama 30 menit kemudian dibilas dengan larutan NaCl 1% (Ji et al., 2003). Seleksi bakteri
selulolitik dilakukan berdasarkan zona bening yang terbentuk pada media CMC. Nilai Indeks Selulolitik (IS) dihitung dengan rumus sebagai berikut:
IS = Diameter zona bening − Diameter koloni Diameter koloni bakteri
(Sinaga, 2013).
Tabel 3.2
Instrumen Hasil Pengamatan Indeks Selulolitik Bakteri R7-3 Parameter yang diamati Bakteri R7-3
Diameter Kertas Cakram Diameter Zona Bening Indeks Selulolitik (IS)
3.6.6 Identifikasi Morfologi dan Biokimia Bakteri Selulolitik 1. Pengamatan Morfologi Koloni
Pengamatan morfologi koloni dilakukan selama 7x24 jam masa inkubasi. Merujuk pada Cappuccino dan Sherman (2014), ciri yang diamati mulai dari ukuran, bentuk, warna, penampakan bakteri (mengkilat atau suram), kenaikan permukaan (elevasi), kepekatan koloni dan tepian (margin).
Tabel 3.3
Instrumen Hasil Pengamatan Koloni Bakteri R7-3 Morfologi Koloni Bakteri R7-3
Bentuk Warna Elevasi Margin
2. Pewarnaan Bakteri
Untuk mengetahui ciri-ciri fisiologis bakteri R7-3, dilakukan teknik pewarnaan yaitu pewarnaan sederhana, pewarnaan gram, pewarnaan kapsul dan pewarnaan endospora (Cappuccino & Sherman, 2014).
Tabel 3.4
Instrumen Hasil Pengamatan Pewarnaan Bakteri R7-3 Jenis Pewarnaan Bakteri R7-3 Pewarnaan Gram
Pewarnaan Kapsul Pewarnaan Endospora
a. Pewarnaan Gram
Untuk melakukan pewarnaan gram dilakukan dengan membuat olesan tipis dari suspensi isolat bakteri berumur 24 jam, dilakukan fiksasi panas dengan cara melewatkan bagian bawah gelas objek diatas api bunsen. Terdapat pewarna yang dibutuhkan dalam melakukan pewarnaan Gram yaitu larutan kristal violet selama 3 menit, kemudian kelebihan warna dibuang dan ditetesi larutan lugol selama 45-60 detik. Setelah diteteskan larutan lugol, kemudian dibilas menggunakan alkohol 96% selama 1 menit dan dibilas dengan air menggunakan botol semprot. Selanjutnya ditetesi dengan safranin selama 3 menit. Kemudian dibilas dengan air dari botol semprot dan dikeringkan. Hasil pewarnaan di amati dibawah mikroskop dengan perbesaran 1000x. Sel bakteri Gram positif akan berwarna ungu sedangkan sel bakteri Gram negatif akan berwarna merah (Aryal, 2018).
b. Pewarnaan Kapsul
Untuk melakukan pewarnaan kapsul terdapat dua jenis pewarna yaitu metode pewarnaan negatif dengan nigrosin dimana pewarna tersebut mewarnai latar dari gelas objek dan metode pewarnaan positif mengunakan kristal violet yang mewarnai dinding sel bakteri. Dilakukan pembuatan apusan bakteri tanpa difiksasi panas. Apusan bakteri tersebut ditetesi dengan kristal violet selama 5-7 menit, kemudian kelebihan warna dicuci dengan CuSO4.5H2O 20% dan dikeringkan. Apusan bakteri diamati dengan mikroskop 1000x (Aryal, 2018).
c. Pewarnaan Endospora
Untuk mengetahui adanya spora pada bakteri, dilakukan pembuatan fiksasi biakan murni, setelah itu digenangi dengan malachite green 5%, kemudian apusan bakteri diuapkan selama 5 menit diatas penangas air kemudian dibersihkan dengan air mengalir. Olesan bakteri ditetesi oleh safranin selama 30 detik dan dicuci dengan air mengalir. Menggunakan perbesaran 1000x dapat diketahui warna spora adalah hijau (Hamdiyati & Kusnadi, 2018).
3. Uji Biokimia
Uji biokimia dilakukan untuk mendapatkan karakteristik bakteri R7- 3. Berikut ini uji biokimia yang akan dilakukan adalah uji hidrolisis (pati, lipid, kasein, gelatin), uji fermentasi karbohidrat (sukrosa, laktosa, glukosa, dekstrosa), reaksi susu litmus, produksi H2S, reaksi katalase dan tes IMViC (indol, Methyl red, Voges-Proskauer dan Sitrat) (Cappucino & Sherman, 2014).
Tabel 3.1
Instrumen Hasil Pengamatan Uji Biokimia Karakteristik Uji
Biokimia Bakteri R7-3 Sukrosa
Dekstrosa Laktosa Uji Lainnya
a. Uji Hidrolisis
Terdapat beberapa uji hidrolisis seperti hidrolisis pati, lipid, gelatin dan kasein.
a) Hidrolisis Lipid
Digunakan medium lipid dengan hasil positif ditunjukkan adanya zona bening di sekitar koloni dan terdapat perubahan medium lipid menjadi warna merah pada bagian bawah koloni bakteri.
Perubahan warna tersebut diakibatkan oleh terbentuknya asam lemak yang mengakibatkan pH medium menurun. Medium agar
lipid diinokulasikan bakteri dan diinkubasi pada suhu 37 C selama 24 jam (Cappucino & Sherman, 2014).
b) Hidrolisis Pati
Digunakan medium agar pati dimana bakteri yang mampu menghidrolisis pati. Hasil positif ditunjukkan dengan terbentuknya daerah zona bening disekitar koloni setelah ditetesi dengan lugol, hal tersebut menandakan bakteri memiliki enzim amilase untuk memecah pati. Pati dapat dihidrolisis oleh mikroorganisme tertentu dengan hasil akhir dekstrin. Medium yang digunakan pada hidrolisis pati adalah medium agar pati dimana bakteri diinokulasikan pada medium dan diinkubasi pada suhu 37oC selama 24 jam (Cappucino & Sherman, 2014).
c) Hidrolisis Gelatin
Digunakan medium gelatin dimana mikroorganisme yang mampu menghidrolisis gelatin karena memiliki eksoenzim proteolitik yang disebut gelatinase. Hasil positif ditunjukkan oleh gelatin yang akan tetap cair setelah diinkubasi oleh bakteri meskipun disimpan pada suhu 4oC. Pengujiannya dengan cara melakukan inokulasikan bakteri pada medium gelatin dan diinkubasikan pada suhu 37oC selama 24 jam, kemudian disimpan pada inkubator dengan suhu 4oC selama 30 menit (Cappucino & Sherman, 2014).
d) Hidrolisis Kasein
Digunakan medium susu skim agar, pengujiannya dengan cara diinokulasikan bakteri pada medium dan diinkubasi pada suhu 37oC selama 24 jam. Hasil uji positif ditandai adanya zona bening disekitar koloni (Cappucino & Sherman, 2014).
b. Uji Fermentasi
Uji fermentasi dilakukan untuk mengetahui kemampuan isolat bakteri dalam memfermentasi karbohidrat. Pada penelitian ini menggunakan 4 jenis gula yaitu glukosa, laktosa, dekstrosa dan sukrosa. Brom cresol purple (BCP) ditambahkan sebagai
indikator. Pengujian dilakukan dengan menginokulasikan isolate bakteri ke dalam medium kemudian diinkubasi selama 1-2 x 24 jam pada suhu 37oC. Hasil positif ditunjukkan dengan perubahan warna pada medium menjadi kuning dan adanya gas/gelembung pada tabung durham (Cappucino & Sherman, 2014).
c. Tes Susu Litmus
Medium susu litmus memiliki protein kasein, gula laktosa, viamin dan mineral. Tujuan dari tes ini untuk mengetahui komplemen enzim pada bakteri. Langkah pengujian ini dengan cara menginokulasi bakteri pada broth medium dan diinkubasi selama 37 C, hasil positif ditandai dengan perubahan warna pada medium (Aryal, 2018).
d. Uji Reaksi Katalase
Uji reaksi katalase dilakukan dengan menginokulasi bakteri pada medium nutrient agar dan diinkubasi 37oC selama 24 jam. Hasil kultur bakteri pada nutrient agar tersebut diteteskan larutan H2O2
23% pada permukaan koloni. Hasil positif ditunjukkan oleh adanya gelembung yang terbetuk setelah ditetesi H2O2 maka organisme tersebut menghasilkan enzim katalase (Cappucino &
Sherman, 2014).
e. Uji IMVIC
IMVIC merupaan singkatan dari (Indole, Methyl red, Voges- Proskauer dan Citrat).
a) Uji Indol
Tujuan uji indol untuk mengetahui kemampuan bakteria membentuk indol dari degradasi asam amino tryptophan. Media yang digunakan adalah tryphton broth, kemudian diinokulasikan bakteri pada medium tersebut lalu diinkubasi selama 24 jam. Hasil positif ditunjukkan oleh terbentuknya warna merah muda pada permukaan broth setelah ditetesi reagen Kovac’s pada kultur broth tersebut. Terbntuknya warna merah muda pada permukaan broth
dikarenakan indol yang dihasilkan bakteri bereaksi dengan para- dimetilaminobenzaldehid (p-dimetilaminobenzaldehid) yang terkandung pada reagen Kovac’s (Cappucino & Sherman, 2014).
b) Uji Methyl Red
Tujuan uji methyl red adalah untuk menentukan perubahan glukosa menjadi produk asam laktat, asam asetat atau asam format. Uji methyl red dilakukan dengan menginokulasi bakteri pada MR broth kemudian diinkubasi selama 24 jam. Setelah diinkubasi selama 24 jam, biakan ditetesi dengan methyl red pada masing-masing tabung reaksi, hasil positif ditunjukkan dengan warna merah muda pada broth, sedangkan hasil negatif ditunjukkan dengan warna kuning (Cappucino & Sherman, 2014).
c) Uji Voges-Proskauer
Tujuan dari uji Voges-Proskauer (VP) adalah untuk menentukan apakah glukosa dapat diubah menjadi asetil metil karbinol. Uji VP dilakukan dengan menginokulasi bakteri kedalam medium VP broth dan diinkubasi selama 24 jam. Setelah proses inkubasi, biakan ditetesi dengan 5 tetes reagen VP B (yang mengandung KOH), kemudian dihomogenkan. Reaksi positif ditunjukkan oleh adanya perubahan menjadi warna merah muda atau merah yang mengindikasikan adanya kehadiran aseton. Hasil negatif ditunjukkan oleh tidak berubahnya warna medium atau menjadi warna tembaga (Cappucino & Sherman, 2014).
d) Uji Sitrat
Dilakukan dengan menggunakan medium Simmons citrate agar.
Uji sitrat bertujuan untuk menguji kemampuan mikroorganisme dalam menggunakan sitrat sebagai sumber energi. Bakteri yang dapat tumbuh pada medium Simmon’s Citrate memproduksi enzim sitrat-permease yang dapat mengubah sitrat menjadi piruvat. Piruvat dapat masuk kedalam siklus metabolisme untuk menghasilkan energi. Hasil positif apabila medium berubah warna
dari hijau ke biru, hal tersebut dikarenakan peningkatan alkalinitas karena bakteri memetabolisme sitrat sehingga garam ammonium terhidrolisis menjadi ammonia. Uji sitrat dilakukan dengan menginokulasikan 1 ose bakteri pada medium Simmons citrate agar, kemudian diinkubasi pada suhu 37oC selama 24 jam (Aryal, 2018).
f. Uji Produksi H2S
Untuk mengetahui produksi H2S, medium SIM agar (sulfide, indole, motility) agar diinokulasikan bakteri dan diinkubasi pada suhu 37oC selama 1-2x 24 jam. Hasil positif ditunjukkan dengan perubahan warna medium menjadi hitam (Aryal, 2018).
g. Kebutuhan Oksigen
Uji kebutuhan oksigen dilakukan dengan menginokulasi bakteri pada medium nutrient agar, kemudian tutup medium dilapisi paraffin agar tidak ada udara yang masuk (Hamdiyati & Kusnadi, 2018).
h. Motilitas
Untuk melakukan uji motilitas, medium nutrient agar diinokulasikan bakteri dengan cara di stab menggunakan ose jarum kemudian diamati pertumbuhannya. Apabila bakteri bersifat motil maka, terdapat pertumbuhan disekitar bakteri yang diinokulasi dan medium berubah warna menjadi keruh (Cappucino
& Sherman, 2014).
3.6.7 Pembuatan Kurva Tumbuh Bakteri R7-3
Umur dan fase pertumbuhan biakan bakteri diketahui dengan cara membuat kurva tumbuh bakteri. Sebanyak 1 ose bakteri R7-3 diinokulasikan kedalam 25 mL medium NB, kemudian diinkubasi selama 24 jam dengan kecepatan 120 rpm. Kepadatan sel atau Optical Density (OD) diukur dengan spektrofotometer UV-VIS dengan panjang gelombang 600 nm. Pengukuran dilakukan selama 24 jam dengan interval waktu 60 menit (Wahyuningsih & Zulaika, 2018). Jerami yang sudah
dioven kemudian diblender dan disaring hingga ukuran partikel 100 mesh.
Setelah didapatkan serbuk jerami padi berukuran 100 mesh, kemudian dilakukan tahap delignifikasi menggunakan 0,5 M KOH selama 4 jam di suhu ruang dan 0,1 H2SO4 selama 1 jam di suhu ruang dengan masing- masing rasio perendaman 1:10. Kemudian jerami hasil pre-treatment dicuci dengan air hingga pH netral dan disterilisasi dengan otoklaf pada 121oC, tekanan 15 psi selama 15 menit (Goyal et al., 2014).
Pembuatan kurva tumbuh dilakukan untuk melihat fase logaritma atau fase eksponensial pertumbuhan bakteri R7-3. Proses pemanenan enzim selulase terbaik ada pada saat fase logaritma, hal ini disebabkan pada fase logaritma jumlah sel bakteri yang tumbuh berbanding lurus dengan banyaknya enzim yang diproduksi (Alam, 2013).
3.6.8 Pre-treatment Jerami Padi dan Delignifikasi
Jerami padi yang digunakan sebagai substrat untuk produksi enzim selulase dilakukan pre-treatment dan delignifikasi. Jerami padi yang akan di pre-treatment diperoleh 2 hari pasca panen dari pesawahan di jalan Sawah Lega III Cipageran Kota Cimahi. Pertama-tama dilakukan tahap pencucian, pemotongan dan pengeringan menggunakan oven dengan suhu 70oC selama 3 hari hingga berat jerami konstan (Nata et al., 2014).
3.6.9Produksi Enzim Selulase Menggunakan Metode SmF (Submerged Fermentation)
Sebanyak 1 ose bakteri yang digunakan sebagai mikroorganisme penghasil enzim ditumbuhkan pada 25 mL NB dalam 250 mL labu Erlemenyer dengan suhu 121oC, 15 psi selama 20 menit, kemudian diinkubasi pada suhu 37oC, 120 rpm selama 24 jam (Shahid et al., 2014).
Langkah produksi enzim secara SmF diperlukan 25 mL medium fermentasi (yeast extract 1 gr, sukrosa 2 gr, K2HPO4 1 gr dan FeSO4 0,01 gr/l) mengandung 0,5 mL basal salt solution (NaNO3 10 gr, KCl 2,5 gr, MgSO4 2,5 gr dan air distilasi 50 mL) (Kumar et al., 2009). Setelah dibuat medium fermentasi kemudian ditambahkan 2% (w/v) jerami yang telah
diberi perlakuan/ treatment, semua bahan dimasukkan kedalam tabung 100 mL dan disterilisasi menggunakan otoklaf dengan suhu 121oC, 15 psi selama 15 menit. Setelah disterilisasi, labu Erlemenyer yang berisi medium fermentasi didinginkan pada suhu ruang dan sebanyak 1%
inokulum kultur murni bakteri R7-3 pada densitas bakteri 106 CFU/mL diinokulasikan pada medium fermentasi. Setelah inokulasi, medium fermentasi diinkubasi pada suhu 36,5oC dan 37,5 oC dengan kecepatan agitasi 150 rpm, selama 0, 24, 48, 72, 96, 120 jam (Sreedevi et al., 2013;
Shahid et al., 2016; Phong et al., 2017).
Untuk memperoleh enzim selulase ekstrak kasar, media fermentasi disaring menggunakan kertas saring, kemudian dilakukan sentrifugasi selama 15 menit dengan kecepatan 3500 rpm pada suhu 4oC. Setelah proses sentrifugasi akan didapatkan enzim ekstrak kasar berupa partikel bening (supernatant) (Sholihati et al., 2015).
3.6.10 Pembuatan Larutan Standar Glukosa
Dilakukan pembuatan larutan stok glukosa dengan konsentrasi 1000 ppm yaitu, dengan melarutkan sebanyak 0,05 gram glukosa dengan 50 mL akuades. Larutan stok dengan konsentrasi glukosa 1000 ppm kemudian dilarutkan menjadi konsentrasi yang diinginkan yaitu 50, 100, 150, 200, 250, 300 dan 350 ppm (Rosyada, 2015).
3.6.11 Pembuatan Kurva Standar Glukosa
Penelitian ini membuat larutan standar glukosa dengan konsentrasi 50, 100, 150, 200, 250, 300 dan 350 ppm, dari masing-masing konsentrasi diambil 1 mL dan dimasukkan ke dalam tabung reaksi. Sebanyak 1 mL reagen DNS ditambahkan ke dalam tabung reaksi yang berisi larutan glukosa dan dihomogenkan menggunakan vorteks. Tabung reaksi yang berisi glukosa dan reagen DNS dididihkan selama 5-15 menit hingga larutan berwarna merah-coklat kemudian sebanyak 1 mL KNa-tartrat ditambahkan dan didinginkan. Setelah itu ditambahkan aquades hingga volume menjadi 10 mL dan dihomogenkan. Dengan menggunakan
spektrofotometer, absorbansi tiap konsentrasi glukosa diukur dengan menggunakan spektrofotometer pada panjang gelombang 540 nm. Setelah didapatkan kurva standar glukosa, untuk mengetahui konsentrasi glukosa dari sampel digunakan persamaan garis y = ax + b (Rosyada, 2015).
3.6.12 Pengukuran Parameter 1. Biomassa Bakteri R7-3
Untuk mengetahui jumlah bakteri pada saat proses fermentasi berlangsung dilakukan teknik perhitungan Optical Density (OD).
Diambil cairan medium fermentasi pada bagian permukaan sebanyak 1 mL dari masing-masing sampel, kemudian dimasukkan kedalam kuvet dengan aquades sebagai blanko setelah itu, diukur nilai absorbansi menggunakan spektrofotometer dengan panjang gelombang 610 nm (Lizayana et al., 2016). Pengambilan parameter biomassa bakteri R7-3 dilakukan untuk mengetahui hubungan antara biomassa bakteri dengan aktivitas enzim selulase yang dihasilkan oleh bakteri R7-3.
2. Uji Aktivitas Enzim Selulase
Aktivitas enzim selulase diukur dengan mereaksikan 0,5 mL CMC 1%
(disiapkan dalam 0,05 M buffer sitrat pH 5) dan 0,5 mL larutan enzim, kemudian diinkubasi pada suhu 50oC selama 30 menit. Setelah inkubasi, ditambahkan 1,5 mL larutan DNS untuk menghentikan reaksi dan didihkan selama 10 menit pada waterbath. Setelah sampel dingin dilakukan pengukuran absorbansi dengan panjang gelombang 540 nm menggunakan spektrofotometer. Jumlah gula yang dihasilkan ditentukan dengan standar glukosa dengan menunjukkan satu unit aktivitas selulosa didefinisikan sebagai jumlah enzim yang diproduksi 1 µmol glukosa per menit (Ghosh, 1987). Berikut ini rumus menentukan aktivitas enzim selulase (Aryani, 2012).
Aktivitas Selulase (U/mL) = Konsentrasi Gula Pereduksi x Fp x 10 t x BM Glukosa
Keterangan :
FP = Faktor pengenceran t = Waktu inkubasi (30 menit) BM = BM glukosa (180 dalton)
Tabel 3.2
Instrumen Pengukuran Biomassa Bakteri dan Aktivitas Enzim
36,5oC / 37,5oC
pH 7,5 pH 8,5
Waktu Pengambilan
Sampel Biomassa Bakteri R7-3
Konsentrasi Gula Pereduksi
(ppm)
Aktivita s Enzim (U/mL)
Biomassa Bakteri
R7-3
Konsentrasi Gula Pereduksi
(ppm)
Aktivita s Enzim (U/mL) 0 Jam
24 Jam 48 Jam 72 Jam 96 Jam 120 Jam
3.7 Analisis Uji Statistik
Analisis data menggunakan program SPSS 25 for Windows: Tahap pertama dilakukan tahap uji normalitas, kemudian dilakukan uji non parametrik dengan uji Mann-Whitnney.
Gambar 3.1. Alur penelitian optimasi produksi enzim selulolitik oleh bakteri R7-3 dari saluran pencernaan rayap (Cryptotermes sp.) menggunakan media serbuk