commit to user
Studi komparasi pembelajaran cooperatif learning dengan metode think pair share (TPS) yang dimodifikasi
dan numbered head together (NHT) pada materi pokok struktur atom terhadap prestasi belajar siswa
kelas x semester i SMA N 1 Sukoharjo
tahun pelajaran 2011/2012
SKRIPSI
Oleh :
Artista Eka Widyawati
X.3307010
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
ii
STUDI KOMPARASI PEMBELAJARAN COOPERATIF LEARNING
DENGAN METODE THINK PAIR SHARE (TPS) YANG DIMODIFIKASI
DAN NUMBERED HEAD TOGETHER (NHT) PADA MATERI POKOK STRUKTUR ATOM TERHADAP PRESTASI BELAJAR SISWA
KELAS X SEMESTER I SMA N 1 SUKOHARJO
TAHUN PELAJARAN 2011/2012
SKRIPSI
Oleh :
ARTISTA EKA WIDYAWATI
X3307010
Ditulis dan diajukan untuk memenuhi syarat mendapatkan gelar Sarjana
Pendidikan Program Studi Pendidikan Kimia Jurusan Pendidikan
Matematika dan Ilmu Pengetahuan Alam
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS SEBELAS MARET
SURAKARTA
commit to user
iii
PERSETUJUAN
Skripsi ini telah disetujui untuk dipertahankan di hadapan Tim Penguji
Skripsi Fakultas Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret
Surakarta.
Persetujuan Pembimbing
Pembimbing I
Elfi Susanti VH, S.Si, M.Si NIP. 19721023 199802 2 001
Pembimbing II
commit to user
iv
HALAMAN PENGESAHAN
Skripsi ini telah dipertahankan dihadapan Tim Penguji Skripsi Fakultas
Keguruan dan Ilmu Pendidikan Universitas Sebelas Maret Surakarta dan diterima
untuk memenuhi persyaratan mandapatkan gelar Sarjana Pendidikan.
Hari :………
Tanggal :………
Tim Penguji Skripsi :
Nama Terang Tanda Tangan
Ketua : Dra. Bakti Mulyani, M.Si ...
Sekretaris : Sri Retno Dwi Ariani, S.Si, M.Si ...
Anggota I : Elfi Susanti VH, S.Si, M.Si ...
Anggota II : Drs. J. S. Sukardjo, M.Si ...
Disahkan Oleh
Fakultas Keguruan dan Ilmu Pendidikan
Universitas Sebelas Maret
Dekan,
Prof. Dr. H. M. Furqon Hidayatullah, M. Pd.
commit to user
v
ABSTRAK
Artista Eka Widyawati. X3307010. STUDI KOMPARASI PEMBELAJARAN
COOPERATIF LEARNING DENGAN METODE THINK PAIR SHARE (TPS)
YANG DIMODIFIKASI DAN NUMBERED HEAD TOGETHER (NHT) PADA
MATERI POKOK STRUKTUR ATOM TERHADAP PRESTASI BELAJAR SISWA KELAS X SEMESTER I SMA N 1 SUKOHARJO TAHUN
PELAJARAN 2011/2012. Skripsi, Surakarta: Fakultas Keguruan dan Ilmu
Pendidikan. Universitas Sebelas Maret, Oktober 2011.
Tujuan dari penelitian ini adalah untuk mengetahui: (1) pengaruh metode Think Pair Share (TPS) yang dimodifikasi dan Numbered Head Together (NHT) terhadap prestasi belajar siswa materi pokok Struktur Atom kelas X semester 1 SMA Negeri 1 Sukoharjo tahun pelajaran 2011/2012, dan (2) pengaruh yang lebih baik antara metode Think Pair Share (TPS) yang dimodifikasi dan Numbered Head Together (NHT) terhadap prestasi belajar siswa materi pokok Struktur Atom kelas X semester 1 SMA Negeri 1 Sukoharjo tahun pelajaran 2011/2012.
Penelitian ini adalah penelitian eksperimental. Rancangan yang digunakan pada penelitian ini adalah “Randomized Pretest Posttest Design”. Sampel dalam penelitian ini adalah siswa kelas X.6 dan X.9 di SMA Negeri 1 Sukoharjo yang
diambil dengan teknik cluster random sampling. Data yang dikumpulkan
menggunakan tes kognitif dan angket afektif. Teknik analisis data menggunakan Uji t- pihak kanan.
Berdasarkan hasil penelitian dapat disimpulkan bahwa: (1) terdapat pengaruh metode Think Pair Share (TPS) yang dimodifikasi dan Numbered Head Together (NHT) terhadap prestasi belajar siswa materi pokok Struktur Atom kelas X semester 1 SMA Negeri 1 Sukoharjo tahun pelajaran 2011/2012, dan (2) metode Think Pair Share (TPS) yang dimodifikasi memberikan pengaruh lebih baik terhadap prestasi belajar siswa dibanding dengan menggunakan metode Numbered Head Together (NHT). Hal ini ditunjukkan dengan hasil menggunakan uji pihak kanan dengan taraf signifikansi 5%. Dimana hasil Dimana hasil uji t-pihak kanan untuk prestasi belajar kognitif diperoleh thitung = 3,0166 > ttabel = 1,667 dan untuk prestasi belajar afektif diperoleh thitung = 2,0923 > ttabel = 1,667.
commit to user
vi
ABSTRACT
Artista Eka Widyawati. X3307010. A COMPARATIVE STUDY OF
COOPERATIVE LEARNING USED MODIFIED THINK PAIR SHARE (TPS) AND NUMBERED HEAD TOGETHER (NHT) METHOD ON TOP IC ATOM IC STR UCTURE BY STUDENT LEARNING ACHIEVEMENT AT THE FIRST GRADE IN SMA N 1 SUKOHARJO ACADEMIC YEAR 2011/2012. Thesis. Surakarta: Faculty of Teacher Training and Education, Sebelas Maret University, October 2011.
The purpose of this research is to find out: (1) the effect of modified Think Pair Share (TPS) and Numbered Head Together (NHT) method on chemistry learning to Atomic Structure student learning achievement for X grade, SMA N 1 Sukoharjo academic year 2011/2012, and (2) better effect between modified Think Pair Share (TPS) and Numbered Head Together (NHT) method on topic Atomic Structure student learning achievement for X grade, SMA N 1 Sukoharjo academic year 2011/2012.
This research is an experimental research. Design of this research is “Randomized Prettest Posttest Design”. The sampel on this research are X.6 and X.9 student classes of SMA N 1 Sukoharjo which taken with cluster random sampling technique. Data is collected using cognitif test and affective questionnaire. Data analisis technique used “Right side t- test”.
According on the result of the research, it can be concluded that: (1) there
are an effect of modified Think Pair Share (TPS) and Numbered Head Together
(NHT) method on topic Atomic Structure student learning achievement for X grade, SMA N 1 Sukoharjo, academic year 2011/2012. (2) modified Think Pair Share (TPS) method give better effect achievement of student than Numbered Head Together (NHT) method. It could be realized that the result of counting by using t-test right side. The result of t-test right side for cognitive learning achievement was aequired tcount= 3,0166 > ttable= 1,667, for affective of learning achievement was aequired tcount= 2,0923 > ttable= 1,667.
Keyword: comparative study, modified Think Pair Share (TPS) method,
commit to user
vii
MOTTO
v
Allah tidak akan membebani seseorang melainkan sesuai
dengan kesanggupannya
(Al-Baqarah : 286)
v
Hidup harus terus maju, jangan engkau putus asa untuk
meraih segalanya.
v
Jadikan kekuranganmu menjadi kelebihanmu.
v
Kita tidak mampu mengubah masa lalu dan tidak mampu pula
untuk memastikan masa depan yang telah kita rancang sesuai
dengan kehendak, maka janganlah kita berlarut-larut dalam
kekecewaan karena sesuatu yang
commit to user
viii
PERSEMBAHAN
Karya ini saya persembahkan untuk:
·Ayah dan Ibu tercinta
·Faldo dan Happy tersayang
·Ifa, Beti, Indi and All Chemistry’07 ”Thank for Everything”
·Mas Agus yang selalu menyemangatiku
commit to user
ix
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah
melimpahkan rahmat, hidayah dan karunia-Nya sehingga penulis dapat
menyelesaikan skripsi ini dengan judul “Studi Komparasi Pembelajaran
Cooperatif Learning dengan Metode Think Pair Share (TPS) yang Dimodifikasi
dan Numbered Head Together (NHT) pada Materi Pokok Struktur Atom terhadap
Prestasi Belajar Siswa Kelas X Semester I SMA N 1 Sukoharjo Tahun Pelajaran
2011/2012”. Penyusunan skripsi ini dimaksudkan untuk memenuhi persyaratan
dalam rangka menyelesaikan studi tingkat sarjana (S1) di Program Kimia Jurusan
P. MIPA, FKIP Universitas Sebelas Maret Surakarta.
Banyak hambatan yang menimbulkan kesulitan dalam penelitian skripsi
ini, namun berkat bantuan dari berbagai pihak akhirnya kesulitan – kesulitan yang
timbul dapat teratasi. Pada kesempatan ini penulis ingin mengucapkan terima
kasih pada semua pihak yang telah membantu dalam penyusunan skripsi ini. Rasa
terima kasih ini penulis haturkan setulusnya kepada :
1. Bapak Prof. Dr. M. Furqon Hidayatullah, M.Pd., selaku Dekan Fakultas Keguruan dan Ilmu Pendidikan UNS yang telah memberikan ijin menyusun
skripsi ini.
2. Bapak Sukarmin, S.Pd, M.Si., selaku Ketua Jurusan P. MIPA FKIP UNS yang
telah memberikan ijin menyusun skripsi ini.
3. Ibu Dra. Bakti Mulyani, M.Si, selaku Ketua Program P. Kimia FKIP UNS
yang telah memberikan ijin menyusun skripsi ini dan selaku Ketua Penguji
yang telah memberikan banyak masukan.
4. Ibu Elfi Susanti VH, S.Si, M.Si, selaku Dosen Pembimbing I yang telah
memberikan bimbingan, dukungan, kepercayaan, kemudahan dan berbagai
masukan yang sangat membantu dalam penulisan skripsi ini.
5. Bapak Drs. J.S. Sukardjo, M.Si, selaku Dosen Pembimbing II yang telah
memberikan bimbingan, dukungan, kepercayaan, kemudahan dan berbagai
commit to user
x
6. Ibu Sri Retno Dwi Ariani, S.Si, M.Si, selaku Sekretaris Penguji yang telah
memberikan banyak masukan.
7. Ibu Nanik Dwi Nurhayati, S.Pd, M.Si, selaku Pembimbing Akademik atas
waktu bimbingan, nasehat, dan ilmunya bagi penulis selama ini.
8. Ibu Hj. Sri Lastari, S.Pd, M.Pd., selaku Kepala Sekolah SMA N 1 Sukoharjo
yang telah memberikan ijin untuk melaksanakan penelitian.
9. Ibu Endang Mulyani, S.Pd, selaku Guru bidang studi kimia SMA N 1
Sukoharjo yang telah memberikan kesempatan, kepercayaan, bimbingan
selama melakukan penelitian.
10. Para siswa SMA N 1 Sukoharjo terutama kelas X.6 dan X.9 atas kerja sama
kalian.
11. Indi, Ifa, Beti, Lian, Tita, Arika, Tresni dan Sintayuli, terima kasih atas
bantuannya.
12. Teman – teman Program P. Kimia 2007 yang tidak mungkin disebutkan satu
persatu.
Demikian skripsi ini disusun dan penulis sadar masih banyak kekurangan
didalamnya. Demi sempurnanya suatu pembelajaran, maka segala keterbatasan
dan kekurangan tersebut perlu senantiasa diperbaiki, oleh karenanya saran, ide,
dan kritik yang membangun dari semua pihak tetap penulis harapkan.
Semoga karya ini dapat memberikan manfaat bagi penulis dan
memberikan sedikit kontribusi serta masukan bagi dunia pendidikan guna
mencapai tujuan pendidikan yang optimal.
Surakarta, Oktober 2011
commit to user
xi
DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PENGAJUAN. ... ii
HALAMAN PERSETUJUAN ... iii
HALAMAN PENGESAHAN... iv
HALAMAN ABSTRAK... v
HALAMAN MOTTO ... vii
HALAMAN PERSEMBAHAN ... viii
KATA PENGANTAR ... ix
DAFTAR ISI ... xi
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I. PENDAHULUAN ... 1
A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 4
C. Pembatasan Masalah ... 4
D. Perumusan Masalah ... 5
E. Tujuan Penelitian ... 5
F. Manfaat Penelitian ... 6
BAB II. LANDASAN TEORI ... 7
A. Tinjauan Pustaka ... 7
1. Studi Komparasi ... 7
2. Pembelajaran Kooperatif ... 7
3. Metode Think Pair Share (TPS) ... 10
4. Metode Numbered Head Together (NHT) ... 11
5. Prestasi Belajar ... 12
6. Struktur Atom ... 14
commit to user
xii
C. Kerangka Berpikir ... 30
D. Hipotesis Penelitian ... 31
BAB III. METODOLOGI PENELITIAN ... 32
A. Tempat dan Waktu Penelitian ... 32
B. Metode Penelitian ... 32
C. Populasi dan Sampel ... 34
D. Variabel Penelitian ... 34
E. Teknik Pengumpulan Data ... 34
F. Instrumen Penelitian ... 36
1. Instrumen Penilaian Kognitif... 36
2. Instrumen Penilaian Afektif... 40
G. Teknik Analisis Data ... 42
1. Uji Prasyarat... 42
a. Uji Normalitas... 42
b. Uji Homogenitas... 43
c. Uji t- Matching... 44
2. Uji Hipotesis... 46
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 47
A. Deskripsi Data ... 47
1. Selisih Nilai Kognitif Materi Pokok Struktur Atom. 47 2. Nilai Afektif Materi Pokok Struktur Atom ... 48
B. Hasil Pengujian Prasyarat Analisis... 49
1. Uji Normalitas ... 50
2. Uji Homogenitas ... 50
3. Uji Keseimbangan (Uji t- Matching) ... 51
C. Hasil Pengujian Hipotesis ... 51
1. Uji t- Pihak Kanan Prestasi Belajar Kognitif dan Afektif... 51
D. Pembahasan Hasil Penelitian... 52
1. Situasi Kegiatan Belajar Mengajar ... 52
commit to user
xiii
3. Penilaian Afektif ... 55
4. Perbedaan dan Persamaan Pembelajaran dengan Metode TPS yang Dimodifikasi dan NHT... 57
BAB V. KESIMPULAN, IMPLIKASI DAN SARAN ... 58
A. Kesimpulan………. 58
B. Implikasi... 58
1. Implikasi Teoritis ……… 58
2. Implikasi Praktis ……… . 58
C. Saran... 58
DAFTAR PUSTAKA ... 60
commit to user
xiv
DAFTAR TABEL
Halaman
Tabel 1. Sifat-Sifat Partikel Dasar Atom... 24
Tabel 2. Susunan Atom Li, Ion Li+ dan Ion Li-... 26
Tabel 3. Konfigurasi Elektron Beberapa Unsur... 28
Tabel 4. Desain Penelitian Randomized Pretest-Postest Design... 33
Tabel 5. Rangkuman Hasil Uji Validitas Butir Soal Instrumen Try Out Kognitif ... 37
Tabel 6. Rangkuman Hasil Uji Reliabilitas Instrumen Try Out Kognitif... 38
Tabel 7. Rangkuman Hasil Uji Taraf Kesukaran Soal Instrumen Try Out Kognitif... 39
Tabel 8. Rangkuman Hasil Uji Daya Pembeda Soal Instrumen Try Out Kognitif... 40
Tabel 9. Skor Penilaian Afektif... 40
Tabel 10. Rangkuman Hasil Uji Validitas Butir Soal Instrumen Try Out Afektif... 41
Tabel 11. Rangkuman Hasil Uji Reliabilitas Instrumen Try Out Afektif... 42
Tabel 12. Rangkuman Deskripsi Data Penelitian... 47
Tabel 13. Perbandingan Distribusi Frekuensi Selisih Nilai Prestasi Belajar Kognitif Siswa dengan Metode TPS yang Dimodifikasi dan Metode NHT... 48
Tabel 14. Perbandingan Distribusi Frekuensi Nilai Afektif Siswa dengan Metode TPS yang Dimodifikasi dan Metode NHT... 49
Tabel 15. Rangkuman Uji Normalitas Selisih Nilai Kognitif……..….. 50
Tabel 16. Rangkuman Uji Normalitas Nilai Afektif... 50
Tabel 17. Rangkuman Hasil Uji Homogenitas Selisih Nilai Kognitif dan Afektif Siswa... 51
commit to user
xv
DAFTAR GAMBAR
Halaman
Gambar 1. Model Atom Dalton... 15
Gambar 2. Model Atom Thomson ... 18
Gambar 3. Percobaan Rutherford... 19
Gambar 4. Model Atom Rutherford... 20
Gambar 5. Model Atom Bohr... 21
Gambar 6. Model Atom Modern... 22
Gambar 7. Histogram Selisih Nilai Prestasi Belajar Kognitif Siswa dengan Metode TPS yang Dimodifikasi dan Metode NHT... 48
commit to user
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Silabus... 63
Lampiran 2. Rencana Pelaksanaan Pembelajaran... 65
Lampiran 3. Indikator Penilaian Kognitif... 82
Lampiran 4. Hubungan antara Indikator, Nomor Soal dan Jenjang Kognitif. 84 Lampiran 5. Soal Try Out Kognitif Materi Pokok Struktur Atom... 85
Lampiran 6. Kunci Jawaban Soal Try Out Kognitif Materi Pokok Struktur Atom... 97
Lampiran 7. Lembar Jawab Soal Try Out Kognitif Materi Pokok Struktur Atom... 98
Lampiran 8. Kisi-Kisi Penyusunan Angket Afektif ... 99
Lampiran 9. Angket Try Out Afektif Materi Pokok Struktur Atom... 100
Lampiran 10. Kunci Jawaban Angket Try Out Afektif Materi Pokok Struktur Atom ... 102
Lampiran 11. Uji Validitas Butir Soal, Reliabilitas, Daya Beda Soal, dan Taraf Kesukaran Soal Try Out Kognitif... 104
Lampiran 12. Uji Validitas dan Reliabilitas Try Out Penilaian Afektif... 110
Lampiran 13. Data Induk Penelitian... 115
Lampiran 14. Distribusi Frekuensi Data Prestasi Belajar Kognitif... 117
Lampiran 15. Distribusi Frekuensi Data Prestasi Belajar Afektif... 118
Lampiran 16. Uji Normalitas Nilai UN IPA SMP... 119
Lampiran 17. Uji Normalitas Prestasi Belajar Kognitif... 121
Lampiran 18. Uji Normalitas Prestasi Belajar Afektif ... 123
Lampiran 19. Uji Homogenitas Nilai UN IPA SMP ... 125
Lampiran 20. Uji Homogenitas Prestasi Belajar Kognitif... 126
Lampiran 21. Uji Homogenitas Prestasi Belajar Afektif ... 127
Lampiran 22. Daftar Nilai UN IPA SMP Kelas Eksperimen I dan Eksperimen II... 128
commit to user
xvii
Eksperimen II... 129
Lampiran 24. Uji Hipotesis Prestasi Belajar Kognitif ... 130
Lampiran 25. Uji Hipotesis Prestasi Belajar Afektif... 131
Lampiran 26. Daftar Kelompok untuk Kelas Eksperimen I... 132
Lampiran 27. Daftar Kelompok untuk Kelas Eksperimen II ... 133
commit to user
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Ilmu kimia merupakan salah satu cabang sains (IPA). Ilmu kimia sudah
mulai diperkenalkan kepada siswa sejak dini. Dalam kehidupan sehari-hari kita
selalu berhubungan dengan kimia, hal ini menjadikan mata pelajaran kimia
menjadi sangat penting kedudukannya dalam masyarakat. Kimia adalah salah satu
pelajaran yang mempelajari tentang materi dan perubahan yang terjadi di
dalamnya. Ilmu kimia juga mempelajari tentang zat-zat kimia yang bermanfaat
bagi kehidupan manusia. Berbagai peristiwa alam yang terjadi dalam kehidupan
sehari-hari juga dapat dipelajari di dalam ilmu kimia, namun selama ini masih
banyak siswa yang mengalami kesulitan dalam memahami dan mengikuti
pelajaran kimia.
Pendekatan yang digunakan dalam pembelajaran kimia adalah
pendekatan keterampilan proses, karena disamping mengetahui konsep juga harus
memiliki keterampilan proses. Namun dalam pelaksanaan proses belajar mengajar
ilmu kimia, sering terjadi hambatan-hambatan sehingga prestasi belajar siswa
masih rendah, kurang variasi (hanya berpegang pada diktat dan buku-buku saja).
Hal ini menjadikan pelajaran kimia kurang diminati bagi peserta didik.
Keberhasilan pencapaian tujuan pendidikan dipengaruhi oleh beberapa
faktor, diantaranya fasilitas yang ada, metode mengajar, serta kondisi guru dan
siswa. Untuk menyajikan materi kimia secara lebih menarik, guru harus
mempunyai kemampuan dalam mengembangkan metode mengajarnya sedemikian
rupa sehingga tujuan pembelajaran yang diharapkan dapat tercapai dengan baik.
Pembelajaran kimia yang dilakukan di SMA N 1 Sukoharjo masih
berpusat pada guru (teacher centered), sehingga siswa kurang terlibat secara aktif
dalam proses belajar tersebut. Penyampaian ilmu yang bersifat satu arah ini
menyebabkan siswa kurang bersemangat dalam menerima pembelajaran karena
siswa hanya sebagai obyek dalam proses belajar mengajar, sehingga yang
terbentuk pada diri siswa adalah pengetahuan kognitif yang kedalamannya masih
commit to user
diragukan. Pencapaian tujuan jangka panjang seperti berpikir kritis dan kreatif,
bekerjasama, serta berkemampuan mandiri hampir terabaikan. Dengan kata lain
ilmu yang sudah diperoleh tersebut sewaktu-waktu dapat hilang dan terlupakan
oleh siswa. Siswa juga terlihat kurang aktif dan cenderung bersikap individual,
sehingga kerjasama antar siswa masih kurang. Berdasarkan data nilai ulangan
harian materi pokok Struktur Atom siswa kelas X SMA N 1 Sukoharjo Tahun
Pelajaran 2009/2010, ± 50% siswa belum mencapai ketuntasan atau mendapatkan
nilai di bawah Kriteria Ketuntasan Minimal (KKM). Oleh karena itu perlu
dilakukan penggunaan metode pembelajaran yang dapat meningkatkan keaktifan
siswa dan juga agar siswa tidak merasa jenuh atau bosan dalam kegiatan
belajarnya sehingga prestasi belajar siswa dapat meningkat.
Perlunya penerapan metode pembelajaran yang tepat dan mengingat
pentingnya interaksi di dalam model pembelajaran kooperatif tersebut, maka
penggunaan metode pembelajaran kooperatif dalam pendidikan menjadi sangat
penting. Siswa harus berperan secara aktif dalam pembelajaran. Salah satu cara
yang tepat untuk mengajak siswa agar lebih aktif adalah dengan mengembangkan
interaksi dalam pembelajaran menggunakan metode kooperatif pada diri siswa,
yaitu dengan cara siswa menerapkan pengetahuannya, belajar memecahkan
masalah, mendiskusikan masalah dengan teman-temannya, mempunyai
keberanian menyampaikan ide atau gagasan, dan mempunyai tanggung jawab
terhadap tugasnya.
Struktur Atom merupakan salah satu materi pokok dalam mata pelajaran
kimia. Materi pokok Struktur Atom diberikan pada siswa kelas X semester I,
dimana siswa belum begitu mengenal pelajaran kimia. Oleh karena itu, dalam
penyampaiannya diperlukan metode pembelajaran yang mempermudah siswa
untuk dapat memahami materi pokok Struktur Atom.
Salah satu metode pembelajaran kooperatif yang dapat digunakan untuk
mengatasi masalah tersebut dan cocok untuk digunakan pada pembelajaran kimia
materi pokok Struktur Atom yang berupa hafalan adalah dengan menggunakan
pembelajaran kooperatif metode Think Pair Share (TPS). Tapi metode TPS
commit to user
kemampuan dan keterampilan guru yang maksimal dalam mengelola kelas
disebabkan banyaknya kelompok dalam kelas. Selain itu juga bila dalam
kelompok hanya terdiri dari dua siswa maka informasi yang diperoleh kelompok
tersebut hanya sedikit. Oleh karena itu dilaksanakan metode TPS yang
dimodifikasi. TPS yang dimodifikasi merupakan metode pembelajaran kooperatif
yang dirancang untuk mempengaruhi pola interaksi siswa. TPS yang dimodifikasi
ini bertujuan untuk mengajarkan siswa agar lebih mandiri dalam menyelesaikan
soal-soal yang dapat membangkitkan rasa percaya diri siswa. Selain itu, TPS yang
dimodifikasi juga mengajarkan siswa untuk bisa menerima perbedaan pendapat
dan bekerjasama dengan orang lain. Pembelajaran diawali dengan pengajuan
pertanyaan oleh guru dan meminta siswa untuk memikirkan jawabannya secara
individu, kemudian secara berkelompok, siswa mendiskusikan hasil pemikirannya
untuk menemukan jawaban paling benar. Setelah itu beberapa kelompok berbagi
dengan seluruh kelas tentang apa yang mereka diskusikan, sehingga dengan
metode tersebut diharapkan siswa dapat menguasai materi secara mendalam. TPS
yang dimodifikasi merupakan bentuk refleksi dari struktural kelas yang kurang
optimal, karena kurangnya interaksi antar siswa dengan anggota kelompoknya,
distribusi kemampuan berbendapat tidak merata, sehingga kelompok yang kurang
aktif enggan memberikan pendapat. Metode ini dapat diterapkan di kalangan
sekolah manapun, karena metode ini tidak membutuhkan banyak biaya, sehingga
dapat digunakan baik di sekolah yang kurang memiliki fasilitas hingga sekolah
elite.
Selain metode TPS yang dimodifikasi, dalam pembelajaran kooperatif
dikenal juga metode pembelajaran Numbered Head Together (NHT). Metode
NHT juga dapat digunakan pada materi pokok Struktur Atom karena metode ini
dapat menguji pemahaman siswa dalam setiap bagian dari materi yang diajarkan.
Metode pembelajaran ini memungkinkan siswa untuk lebih aktif dan bertanggung
jawab penuh untuk memahami materi pelajaran baik secara kelompok maupun
individual. Metode pembelajaran ini juga melibatkan para siswa dalam mereview
bahan yang tercakup dalam suatu pelajaran serta memeriksa pemahaman mereka
commit to user
menuntut siswa baik secara individual maupun kelompok untuk menguasai isi
pelajaran tersebut.
Berdasarkan uraian di atas, maka dilakukan penelitian dengan judul :
“STUDI KOMPARASI PEMBELAJARAN COOPERATIF LEARNING
DENGAN METODE THINK PAIR SHARE (TPS) YANG DIMODIFIKASI
DAN NUMBERED HEAD TOGETHER (NHT) PADA MATERI POKOK STRUKTUR ATOM TERHADAP PRESTASI BELAJAR SISWA KELAS
X SEMESTER I SMA N 1 SUKOHARJO TAHUN PELAJARAN
2011/2012”.
B. Identifikasi Masalah
Berdasarkan latar belakang masalah yang telah diuraikan di atas, maka
timbul berbagai masalah yang dapat diidentifikasi sebagai berikut:
1. Prestasi belajar siswa pada pelajaran kimia khususnya materi pokok Struktur
Atom masih rendah.
2. Pembelajaran masih berpusat pada guru (teacher centered), sehingga
keterlibatan atau keaktifan siswa dalam pembelajaran masih rendah dan siswa
kurang bersemangat dalam pembelajaran.
3. Perlu adanya pemilihan metode pembelajaran yang sesuai pada materi pokok
Struktur Atom pada siswa kelas X semester I SMA N 1 Sukoharjo tahun
pelajaran 2011/2012.
4. Pengaruh penerapan metode TPS yang dimodifikasi dan NHT terhadap
prestasi belajar siswa.
C. Pembatasan Masalah
Berdasarkan latar belakang masalah dan identifikasi masalah di atas,
maka perlu pembatasan masalah agar penelitian lebih terarah antara lain:
1. Subyek penelitian adalah siswa kelas X semester I SMA N 1 Sukoharjo tahun
pelajaran 2011/2012.
2. Metode pembelajaran yang digunakan dalam penelitian ini adalah metode
commit to user
Numbered Head Together (NHT) untuk kelas eksperimen II. Metode TPS
yang digunakan oleh peneliti adalah metode TPS yang dimodifikasi. Dalam
penelitian ini untuk metode TPS pada langkah berpasangan tidak dilakukan
secara berpasangan tetapi secara kelompok, sehingga oleh peneliti metode
tersebut disebut metode TPS yang dimodifikasi.
3. Materi pokok yang dipilih dalam pembelajaran kimia pada penelitian ini
adalah Struktur Atom.
4. Prestasi kognitif siswa dibatasi pada nilai kognitif siswa yang berasal dari
hasil pretes dan postes dan prestasi belajar afektif siswa dilihat dari hasil
angket afektif siswa.
5. Penelitian ini membutuhkan dua orang asisten untuk membantu jalannya
proses penelitian.
D. Perumusan Masalah
Masalah yang akan diteliti dalam penelitian ini dapat dirumuskan sebagai
berikut:
1. Adakah pengaruh metode Think Pair Share (TPS) yang dimodifikasi dan
Numbered Head Together (NHT) terhadap prestasi belajar siswa materi
pokok Struktur Atom kelas X semester 1 SMA Negeri 1 Sukoharjo tahun
pelajaran 2011/2012?
2. Apakah metode Think Pair Share (TPS) yang dimodifikasi pada
pembelajaran kimia materi pokok Struktur Atom kelas X semester 1 SMA
Negeri 1 Sukoharjo tahun pelajaran 2011/2012 memberikan pengaruh yang
lebih baik terhadap prestasi belajar siswa daripada metode Numbered Head
Together (NHT)?
E. Tujuan Penelitian
Sesuai dengan perumusan masalah yang diuraikan di atas, maka
penelitian ini mempunyai tujuan untuk mengetahui:
1. Pengaruh metode Think Pair Share (TPS) yang dimodifikasi dan Numbered
commit to user
Atom kelas X semester 1 SMA Negeri 1 Sukoharjo tahun pelajaran
2011/2012.
2. Pengaruh yang lebih baik antara metode Think Pair Share (TPS) yang
dimodifikasi dan Numbered Head Together (NHT) terhadap prestasi belajar
siswa materi pokok Struktur Atom kelas X semester 1 SMA Negeri 1
Sukoharjo tahun pelajaran 2011/2012.
F. Manfaat Penelitian
Hasil penelitian ini diharapkan dapat bermanfaat:
1. Manfaat Teoritis
a. Untuk menambah ilmu pengetahuan dalam mata pelajaran kimia,
khususnya pada materi pokok Struktur Atom.
b. Untuk memberikan informasi tentang pencapaian prestasi belajar siswa
yang diperoleh melalui pembelajaran kooperatif metode Think Pair Share
(TPS) yang dimodifikasi dan Numbered Head Together (NHT).
2. Manfaat Praktis
a. Bahan pemikiran bagi pengelola pendidikan, bahwa perlu adanya inovasi
dalam pembelajaran untuk menyiapkan sumber daya manusia yang
berkualitas. Salah satu diantaranya adalah agar mengembangkan metode
pembelajaran kooperatif yang merupakan bagian dari pembelajaran yang
berdasarkan paradigma belajar, sehingga diharapkan siswa menjadi lebih
aktif dan kreatif mengelola informasi, sehingga pembelajaran lebih
bermakna bagi siswa.
b. Bahan masukan pada guru kimia dalam menentukan metode pembelajaran
kimia yang berorientasi pada proses sehingga dapat lebih meningkatkan
pemahaman siswa pada materi pokok Struktur Atom.
commit to user
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
1. Studi Komparasi
a. Pengertian Studi
Studi dalam Kamus Besar Bahasa Indonesia artinya kajian, mempelajari
(Depdikbud, 1990: 860). Dalam skripsi ini studi berarti mempelajari.
b. Pengertian Komparasi
Komparasi berasal dari bahasa Inggris “comparation”, yang artinya
perbandingan (Depdikbud, 1990: 516). Penelitian komparasi akan dapat
menemukan persamaan-persamaan dan perbedaan-perbedaan tentang
benda-benda, tentang prosedur kerja, tentang ide-ide, dan kritik terhadap orang
(Suharsimi Arikunto, 2006: 267).
Dari berbagai pengertian di atas, maka studi komparasi adalah suatu
bentuk penelitian yang membandingkan antara variabel-variabel yang saling
berhubungan dengan menemukan perbedaan-perbedaan dan
persamaan-persamaan.
2. Pembelajaran Kooperatif
a. Hakekat Pembelajaran Kooperatif
Cooperative Learning atau pembelajaran kooperatif adalah pendekatan
pembelajaran yang berfokus pada penggunaan kelompok kecil siswa untuk
bekerja sama dalam memaksimalkan kondisi belajar untuk mencapai tujuan
belajar. Pembelajaran kooperatif adalah pembelajaran yang secara sadar dan
sengaja mengembangkan interaksi yang saling membantu untuk menghindari
ketersinggungan serta kesalahpahaman yang dapat menimbulkan permusuhan,
sebagai latihan hidup di masyarakat. Manusia memiliki derajad potensi, latar
belakang historis, serta harapan masa depan yang berbeda-beda. Karena
perbedaan itu, manusia dapat saling mencerdaskan (Nurhadi, 2004: 112). Selain
itu Mohammed Shafiuddin (2010: 589-590), mengemukakan pembelajaran
kooperatif adalah sebuah strategi pengajaran yang tersusun sistematis dimana para
commit to user
siswa bekerja sama dalam suatu kelompok kecil untuk mencapai tujuan bersama.
Pada metode pembelajaran kooperatif, siswa akan lebih mudah menemukan dan
memahami konsep-konsep yang sulit apabila siswa dapat saling mendiskusikan
masalah-masalah yang dihadapi dengan temannya.
Pembelajaran kooperatif merujuk pada berbagai macam metode
pembelajaran, dimana para siswa bekerja dalam kelompok-kelompok kecil untuk
saling membantu satu sama lainnya dalam mempelajari materi pelajaran. Dalam
kelas kooperatif, para siswa diharapkan dapat saling membantu, saling
mendiskusikan dan berpendapat, untuk mengasah pengetahuan yang mereka
kuasai saat itu dan menutup kesenjangan dalam pemahaman masing-masing
(Slavin, 2010: 4). Dalam metode pembelajaran kooperatif, para siswa akan duduk
bersama dalam kelompok yang beranggotakan 4-6 orang untuk menguasai materi
yang disampaikan oleh guru (Isjoni, 2010: 15).
Lingkungan belajar untuk cooperative learning ditandai oleh proses yang
demokratis dan peran aktif siswa dalam memutuskan segala yang seharusnya
dipelajari dan bagaimana caranya. Guru dapat menentukan strukturnya dalam
membentuk kelompok-kelompok dan menentukan prosedur secara keseluruhan,
tetapi siswa dibiarkan mengontrol interaksi dari menit ke menit di dalam
kelompok.
Menurut Nurhadi (2004: 116) ada beberapa alasan perlu
dikembangkannya pembelajaran kooperatif, antara lain:
1) Meningkatkan kepekaan dan kesetiakawanan sosial.
2) Memudahkan siswa melakukan penyesuaian sosial.
3) Menghilangkan sifat mementingkan diri sendiri atau egois.
4) Meningkatkan rasa saling percaya pada sesama manusia.
5) Meningkatkan kegemaran berteman tanpa memandang perbedaan
kemampuan, jenis kelamin, etnis, kelas sosial, dan agama.
Model pembelajaran kooperatif ditandai oleh struktur tugas, tujuan dan
reward yang kooperatif. Siswa dalam situasi pembelajaran kooperatif ini didorong
dan dituntut untuk mengerjakan tugas yang sama secara bersama-sama. Selain itu
commit to user
Terdapat enam fase atau langkah utama yang terlibat dalam pembelajaran yang
menggunakan model cooperative learning, yaitu:
1) Pembelajaran dimulai dengan guru memberi tahu tujuan-tujuan pembelajaran
dan membangkitkan motivasi belajar siswa.
2) Presentasi informasi, biasanya dalam bentuk teks lebih disukai daripada
bentuk ceramah.
3) Siswa diorganisasikan menjadi kelompok-kelompok belajar.
4) Siswa dibantu oleh guru, bekerja bersama-sama untuk menyelesaikan
tugas-tugas kelompok.
5) Presentasi hasil akhir dari berbagai kelompok, mendiskusikan semua hal yang
telah dipelajari siswa.
6) Memberi penghargaan pada usaha kelompok (Arend, 2001: 315-316).
Adeyemi (2008: 697), mengemukakan bahwa pembelajaran kooperatif
memiliki unsur-unsur pokok yang diperlukan untuk meyakinkan para siswa agar
bekerja sama ketika mereka dalam kelompok. Unsur-unsur pokok tersebut antara
lain:
1) Setiap anggota kelompok harus merasa sebagai bagian dalam tim dan bahwa
mereka mempunyai tujuan yang sama.
2) Setiap anggota kelompok harus menyadari bahwa masalah yang mereka
selesaikan adalah masalah bersama dan keberhasilan maupun kegagalan
kelompok akan dirasakan oleh semua anggota dalam kelompok.
3) Untuk mencapai tujuan bersama, seluruh siswa harus berpartisipasi dalam
diskusi.
4) Harus diyakinkan pada seluruh siswa bahwa kerja individual setiap anggota
kelompok akan menentukan keberhasilan kelompoknya.
b. Macam - Macam Metode pada Pembelajaran Kooperatif
Menurut Nurhadi (2004: 116-121) metode-metode yang termasuk dalam
pembelajaran kooperatif adalah sebagai berikut:
1) Metode STAD
2) Metode JIGSAW
commit to user
4) Metode struktural, yaitu metode Think Pair Share (TPS) dan Numbered Head
Together (NHT)
3. Metode Think Pair Share (TPS)
a. Pengertian Metode Think Pair Share (TPS)
Model pembelajaran kooperatif metode TPS timbul dari penelitian
tentang cooperative learning dan wait time. Metode pembelajaran yang
dikembangkan oleh Frank Lyman dan kawan-kawan dari University of Maryland
(1985) ini adalah cara efektif untuk mengubah pola wacana dalam kelas. Metode
pembelajaran ini menantang asumsi bahwa semua resitasi atau diskusi perlu
dilakukan dalam setting seluruh kelompok, dan memiliki prosedur-prosedur built
in untuk memberikan lebih banyak waktu kepada para siswa untuk berfikir dan
merespons serta saling membantu satu sama lain (Arend, 2001: 325).
TPS atau bertukar pikiran dengan pasangan merupakan jenis
pembelajaran kooperatif yang dirancang untuk mempengaruhi pola interaksi
siswa, sehingga memberi siswa kesempatan untuk bekerja sendiri serta bekerja
sama dengan orang lain. Selain itu Think Pair Share adalah suatu metode
pembelajaran kolaboratif yang efektif digunakan pada kelas yang besar,
mendorong para siswa untuk merefleksikan isi pelajaran, memberikan kesempatan
secara pribadi pada siswa untuk merumuskan pemikiran mereka sebelum berbagi
dengan siswa yang lain dan dapat membantu perkembangan ketrampilan berpikir
siswa yang lebih tinggi (Jim Aison, 2010: 7).
b. Keunggulan dan Kelemahan Metode Think Pair Share (TPS)
Keunggulan dari metode ini adalah optimalisasi partisipasi siswa, yaitu
memberi kesempatan lebih banyak kepada setiap siswa untuk dikenali dan
menunjukkan partisipasi mereka kepada orang lain. TPS dapat digunakan dalam
semua mata pelajaran dan untuk semua tingkatan usia anak didik (Anita Lie,
2010: 57).
Disamping mempunyai keunggulan, metode TPS juga mempunyai
kelemahan yaitu:
commit to user
2) Sangat memerlukan kemampuan dan keterampilan guru, waktu pembelajaran
berlangsung guru melakukan intervensi secara maksimal.
3) Menyusun bahan ajar setiap pertemuan dengan tingkat kesulitan yang sesuai
dengan taraf berfikir anak.
4) Mengubah kebiasaan siswa belajar dari cara mendengarkan ceramah diganti
dengan berfikir memecahkan masalah secara kelompok, hal ini merupakan
kesulitan tersendiri bagi siswa.
c. Langkah –Langkah Implementasi Metode Think Pair Share (TPS)
Langkah-langkah dalam TPS yaitu:
1) Berfikir
Guru mengajukan sebuah pertanyaan atau isu yang terkait dengan pelajaran
dan meminta siswa-siswanya untuk menggunakan waktu untuk memikirkan
sendiri tentang jawaban untuk isu tersebut. Siswa perlu diajari bahwa berbicara
tidak menjadi bagian dari waktu berfikir.
2) Berpasangan
Guru meminta siswa untuk berpasang-pasangan dan mendiskusikan segala
yang sudah mereka pikirkan. Interaksi selama periode ini dapat berupa saling
berbagi ide.
3) Berbagi
Pada tahap ini, guru meminta pasangan-pasangan siswa untuk berbagi sesuatu
yang sudah dibicarakan bersama pasangannya masing-masing dengan seluruh
kelas. Guru memilih satu nomor soal dan menunjuk salah satu siswa dalam
kelompok untuk mengerjakan ke depan. Jadi semua harus benar-benar bisa, dan
tidak ada siswa yang mendompleng keberhasilan siswa lain.
( Arend, 2001: 325-326)
4. Metode Numbered Head Together (NHT)
a. Langkah–Langkah Implementasi Metode Numbered Head Together
(NHT)
Metode pembelajaran Numbered Head Together (NHT) dikembangkan
oleh Spencer Kagan (1993). Tujuan utama penggunaan metode belajar NHT ini
commit to user
yang digunakan di dalam kelas untuk penggunaan metode NHT ini ada empat
langkah penting, yaitu:
1) Penomoran (numbering)
Guru membagi siswa dalam kelompok-kelompok kecil yang beranggotakan
3-5 orang tiap kelompok. Masing-masing anggota kelompok tersebut diberi
nomor urut yang berbeda untuk setiap anggota kelompok, demikian dengan
kelompok lain juga diberi nomor seperti kelompok tersebut.
2) Pengajuan pertanyaan
Guru mengajukan sebuah kasus atau pertanyaan kepada siswa. Pertanyaan ini
dapat bervariasi dari yang bersifat umum, spesifik ataupun penerapan. Soal yang
bersifat umum misalnya pertanyaan yang membutuhkan jawaban berupa pendapat
atau uraian, sedangkan spesifik misalnya pertanyaan mengenai suatu tempat
sehingga jawabannya pasti, dan pertanyaan yang bersifat penerapan misalnya
penerapan suatu rumus ke dalam suatu permasalahan hitungan.
3) Berfikir bersama
Para siswa ini yang termasuk dalam satu kelompok berfikir bersama
mengenai pemecahan soal maupun kasus yang diberikan oleh guru. Setiap
anggota kelompok harus meyakinkan bahwa semua anggota dalam kelompoknya
mengerti dan memahami jawaban dari soal tersebut.
4) Pemberian jawaban
Guru menyebutkan salah satu nomor dan para siswa dari setiap kelompok
yang memiliki nomor seperti yang disebutkan mengangkat tangan dan
memberikan jawaban untuk semua kelas. Jawaban dari masing-masing kelompok
didiskusikan dengan seluruh kelas.
(Nurhadi, 2004: 121)
5. Prestasi Belajar
a. Pengertian Prestasi Belajar
Menurut W.S Winkel (1996: 53), prestasi belajar dapat dilihat dari
perubahan-perubahan dalam pengertian kognitif, pengalaman, ketrampilan, nilai,
sikap, yang bersifat konstan. Prestasi belajar dapat diketahui dengan adanya
commit to user
tersebut dapat diperoleh informasi sehingga guru dapat mengetahui keberhasilan
pencapaian tujuan, penguasaan siswa terhadap materi pelajaran yang disampaikan,
ketepatan atau keefektifan metode mengajar, mengetahui kedudukan siswa di
kelas atau kelompoknya.
Dari uraian yang telah dikemukakan dapat disimpulkan bahwa prestasi
belajar adalah hasil usaha yang berupa perubahan tingkah laku yang diperoleh dari
proses belajar mengajar dan dapat diketahui dengan mengadakan penilaian
belajar.
b. Taksonomi Hasil Belajar
Menurut Bloom taksonomi hasil belajar terbagi menjadi 3 domain yaitu
domain kognitif, afektif, dan psikomotor.
1) Domain Kognitif
Menurut Robinson Situmorang, dkk (2005: 2.17) domain/kawasan kognitif
berkenaan dengan ingatan atau pengenalan dan pengembangan kemampuan
intelektual dan keterampilan berpikir. Jenjang taksonomi pendidikan dalam
kawasan kognitif yaitu aspek pengetahuan, pemahaman, penerapan, analisis, dan
evaluasi.
2) Domain Afektif
Menurut Robinson Situmorang, dkk (2005: 2.23) domain/kawasan afektif
berkenaan dengan minat, sikap, dan nilai serta pengembangan penghargaan dan
penyesuaian diri. Kawasan afektif terbagi menjadi 5 jenjang yaitu penerimaan
(receiving), pemberian respon (responding), pemberian nilai atau penghargaan
(valuing), pengorganisasian (organizing) dan karakterisasi (characterization).
3) Domain Psikomotor
Menurut Robinson Situmorang, dkk (2005: 2.26) domain/kawasan
psikomotor berkenaan dengan otot, keterampilan motorik, atau gerak yang
membutuhkan koordinasi otot (neomuscular coordination). Kawasan psikomotor
meliputi peniruan, penggunaan, ketepatan, perangkaian dan naturalisasi.
c. Fungsi Prestasi Belajar
Prestasi belajar mempunyai fungsi yang penting selain sebagai indikator
commit to user
evaluasi dalam pelaksanaan proses belajar mengajar. Menurut Zainal Arifin
(1990: 3) prestasi belajar mempunyai beberapa fungsi utama:
1) Sebagai indikator kualitas dan kuantitas pengetahuan yang telah dikuasai
peserta didik.
2) Sebagai bahan informasi dalam motivasi pendidikan.
3) Sebagai indikator intern dan ekstern dari suatu institusi pendidikan.
4) Dapat dijadikan indikator daya serap (kecerdasan) anak didik.
5) Hasil belajar yang dicapai siswa sangat erat kaitannya dengan rumusan tujuan
instruksional yang direncanakan guru sebelumnya.
6. Struktur Atom
a. Konsep Dasar Struktur Atom
Konsep dasar tentang atom sebenarnya sudah lama dikenal orang.
Konsep tersebut antara lain berasal dari pemikiran orang Yunani kuno yang
dipelopori oleh Democritus yang hidup pada akhir abad ke-4 dan awal abad ke-5
Sebelum Masehi. Menurut teori yang dikemukakannya, suatu benda dapat dibagi
menjadi bagian-bagian yang sangat kecil yang akhirnya tidak dapat dibagi lagi
yang disebut atom. Kata atom berasal dari bahasa Yunani yaitu “atomos” yang
berarti “tidak dapat dibagi lagi”. Disebutkan bahwa alasan ini berasal dari
observasi di mana butiran pasir dapat bersama-sama membentuk sebuah pantai.
Dalam analoginya, pasir adalah atom, dan pantai adalah senyawa. Analogi ini
kemudian dapat dihubungkan dengan pengertian Democritus terhadap atom yang
tidak bisa di bagi lagi walaupun sebuah pantai dapat dibagi ke dalam
butiran-butiran pasirnya, butiran-butiran pasir ini tidak dapat dibagi. Namun model Democritus
ini kurang memiliki bukti eksperimental, sehingga tidak dapat diterima oleh
beberapa ahli ilmu pengetahuan dan filsafat.
b. Perkembangan Teori Model Atom
Perkembangan teori model atom dipelajari mulai dari teori atom Dalton
hingga teori atom modern. Berikut ini penjelasan dari masing-masing teori model
commit to user
1) Model Atom Dalton
John Dalton merumuskan teori atom yang pertama sekitar tahun 1803-1807,
yang kita kenal sebagai teori atom Dalton. Berikut adalah postulat-postulat dalam
teori atom Dalton:
a) Setiap unsur terdiri atas partikel yang sudah tak terbagi yang disebut atom.
b) Atom-atom dari suatu unsur adalah identik. Atom-atom dari unsur yang
berbeda, termasuk mempunyai massa yang berbeda.
c) Atom dari suatu unsur tidak dapat diubah menjadi atom unsur yang lain,
tidak dapat dimusnahkan atau diciptakan. Reaksi kimia hanya merupakan
penataan ulang atom-atom.
d) Senyawa terbentuk ketika atom-atom dari dua jenis unsur atau lebih
bergabung dengan perbandingan tertentu. Misalnya air terdiri dari
atom-atom hidrogen dan atom-atom-atom-atom oksigen.
Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti
[image:32.595.113.513.195.512.2]pada tolak peluru, seperti gambar berikut ini:
Gambar 1. Model Atom Dalton
Kelemahan teori atom Dalton yaitu:
a) Tidak dapat menjelaskan perbedaan antara atom unsur yang satu dengan
unsur yang lain.
b) Tidak dapat menjelaskan sifat listrik materi.
c) Tidak dapat menjelaskan cara atom-atom saling berikatan.
(Michael Purba, 2006: 18-21)
2) Model Atom Thomson
a) Penemuan Elektron
Tahun 1897, Joseph John Thomson menemukan elektron. Thomson
melakukan percobaan dengan menggunakan tabung kaca bertekanan udara
commit to user
dipasang plat logam yang berfungsi sebagai elektrode. Kedua elektrode
tersebut dihubungkan dengan sumber arus listrik bertekanan tinggi.
Elektrode yang dihubungkan dengan kutub positif disebut anode,
sedangkan elektrode yang dihubungkan dengan kutub negatif disebut
katode. Tabung seperti itu dinamakan tabung sinar katode (tabung
Crookes).
Percobaan itu dilakukan sebagai berikut. Dengan menggunakan pompa
vakum, tekanan udara dalam tabung dapat diatur. Jika tekanan udara dalam
tabung dibuat cukup rendah, maka gas dalam tabung akan berpendar
(berpijar) dengan cahaya yang warnanya bergantung pada jenis gas dalam
tabung. Selanjutnya, jika tekanan gas dalam tabung dibuat semakin kecil,
maka akhirnya tabung menjadi gelap. Akan tetapi, bagian tabung di depan
katode berpendar dengan warna hijau. Perpendaran ini bersumber dari
radiasi katode menuju anode yang membentur gelas sehingga gelas
berpendar (mengeluarkan cahaya warna hijau). Sinar itu disebut sinar
katode. Selanjutnya diketahui bahwa sinar katode merupakan radiasi
partikel yang bermuatan negatif.
Berdasarkan hasil percobaan itu, Thomson mengungkapkan sifat-sifat
sinar katode sebagai berikut ini:
(1) Dipancarkan oleh katode dalam sebuah tabung hampa jika dilewatkan
arus listrik bertegangan tinggi.
(2) Merambat dalam garis lurus menuju anode.
(3) Jika membentur gelas, maka gelas berpendar (berfluoresensi). Dengan
adanya fluoresensi ini, kita dapat mengetahui adanya sinar katode.
(4) Dapat dibelokkan oleh medan listrik dan medan magnet ke kutub
positif. Oleh karena itu, sinar katode bermuatan negatif.
(5) Sinar tidak bergantung pada bahan elektrodenya. Hal itu berarti, setiap
elektrode dapat memancarkan sinar katode. Jadi, setiap materi
mengandung partikel seperti sinar katode.
Dari kelima sifat-sifat sinar katode itu, dapat disimpulkan bahwa sinar
commit to user
dasar tersebut kemudian disebut elektron. Berdasarkan hal itu, Thomson
menyimpulkan bahwa elektron merupakan partikel dasar penyusun atom.
Selanjutnya Thomson melakukan percobaan untuk menentukan harga
perbandingan muatan elektron dengan massanya. Thomson melakukan
percobaan seperti gambar. Dari percobaan itu, diperoleh harga e/m sebesar
1,76 x 108 C g-1. Nilai-nilai itu merupakan hasil pengukuran pengaruh
medan listrik dan magnet terhadap pembelokan sinar katode serta
pengukuran jari-jari kelengkungan dari pembelokan tersebut.
(Parning, 2005: 22-23)
b) Percobaan Tetes Minyak Millikan
Tahun 1909, Robert Millikan melakukan percobaan dengan tetes minyak
untuk menentukan muatan 1 elektron. Pada percobaan itu, tetes minyak
dapat menangkap satu, dua, tiga atau lebih elektron. Millikan menemukan
muatan tetes minyak yang besarnya adalah 1 x 1,6 x 10-19 C, 2 x 1,6 x 10-19
C, 3 x 1,6 x 10-19 C, dan seterusnya. Berdasarkan hal tersebut, Millikan
menyimpulkan bahwa muatan 1 elektron adalah 1,6 x 10-19 C dan diberi
tanda -1.
Berdasarkan percobaan Thomson dan Millikan massa elektron dapat
dihitung sebagai berikut:
(1) Dari percobaan Thomson : q/m = e/m = 1,76 x x108 C g-1.
(2) Dari percobaan Millikan : e = 1,6 x 10-19 C.
(3) Oleh karena itu, massa elektron : m = 9,11 x 10-28 gram.
(Parning, 2005: 24)
c) Teori Atom Thomson
Penemuan elektron atas jasa Joseph John Thomson dan Robert Andrews
Millikan pada tahun-tahun pertama abad ke-20 memberikan bukti
ketidaksempurnaan model atom Dalton yang mengatakan bahwa atom
adalah partikel terkecil yang tak dapat terbagi, tidak dapat diterima lagi.
Atom merupakan partikel yang bersifat netral, oleh karena elektron
bermuatan negatif, maka harus ada partikel lain yang bermuatan positif
commit to user
tersebut, Thomson memperbaiki kelemahan dari teori atom Dalton dan
mengemukakan teori atomnya yang dikenal sebagai Teori Atom Thomson,
yang menyatakan bahwa: “Atom merupakan bola pejal yang bermuatan
positif dan di dalamnya tersebar muatan negatif elektron”.
Model atom ini dapat digambarkan menyerupai roti kismis. Menurut
Thomson, atom terdiri dari materi bermuatan positif dan di dalamnya
tersebar elektron bagaikan kismis dalam roti kismis. Secara keseluruhan
atom bersifat netral. Model atom Thomson dapat dilihat pada gambar
[image:35.595.130.511.219.528.2]berikut:
Gambar 2. Model Atom Thomson
(Michael Purba, 2006: 25)
3) Model Atom Rutherford
a) Penemuan Inti Atom
Pada tahun 1910, Ernerst Rutherford melakukan serangkaian percobaan
untuk mengetahui lebih banyak tentang susunan atom. Eksperimen yang
dilakukan Rutherford adalah penembakan lempeng emas yang sangat tipis
dengan partikel alfa berenergi tinggi. Sinar alfa adalah salah satu jenis
radiasi yang dihasilkan oleh zat radioaktif. Dalam percobaan itu ditemukan
bahwa sebagian besar partikel alfa dapat menembus lempeng emas tanpa
pembelokan yang berarti, seolah-olah lempeng emas itu tidak ada. Akan
tetapi, kemudian didapati pula bahwa sebagian kecil dari partikel alfa
mengalami pembelokan yang cukup besar, bahkan beberapa diantaranya
dipantulkan. Rutherford menduga bahwa pembelokan dan pemantulan
sinar alfa tersebut terjadi karena sinar alfa berbenturan dengan suatu benda
commit to user
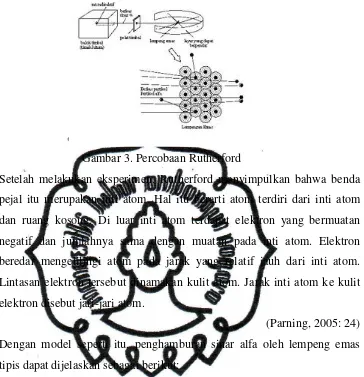
Gambar 3. Percobaan Rutherford
Setelah melakukan eksperimen, Rutherford menyimpulkan bahwa benda
pejal itu merupakan inti atom. Hal itu berarti atom terdiri dari inti atom
dan ruang kosong. Di luar inti atom terdapat elektron yang bermuatan
negatif dan jumlahnya sama dengan muatan pada inti atom. Elektron
beredar mengelilingi atom pada jarak yang relatif jauh dari inti atom.
Lintasan elektron tersebut dinamakan kulit atom. Jarak inti atom ke kulit
elektron disebut jari-jari atom.
(Parning, 2005: 24)
Dengan model seperti itu, penghamburan sinar alfa oleh lempeng emas
tipis dapat dijelaskan sebagai berikut:
(1) Sebagian besar partikel sinar alfa dapat tembus karena melalui daerah
hampa.
(2) Partikel alfa yang mendekati inti atom dibelokkan karena mengalami
gaya tolak inti.
(3) Partikel alfa yang menuju inti atom dipantulkan karena inti bermuatan
positif dan sangat pejal.
(Michael Purba, 2006: 27-28)
b) Teori Atom Rutherford
Melalui percobaan dengan menembaki plat emas yang sangat tipis dengan
sinar alfa, Rutherford menemukan inti atom yang bermuatan positif dan
massa atomnya terpusat pada intinya. Hipotesa dari Rutherford adalah
atom yang tersusun dari inti atom dan elektron yang mengelilinginya.
commit to user
elektron-elektron bergerak mengelilingi inti atom seperti planet-planet
mengitari matahari.
Kelemahan dari Rutherford tidak dapat menjelaskan mengapa elektron
tidak jatuh ke dalam inti atom. Berdasarkan teori fisika, gerakan elektron
mengitari inti ini disertai pemancaran energi sehingga lama-kelamaan
energi elektron akan berkurang dan lintasannya makin lama akan
mendekati inti dan jatuh ke dalam inti.
[image:37.595.114.512.178.485.2](Michael Purba, 2006: 29)
Gambar 4. Model Atom Rutherford
4) Model Atom Bohr
Pada tahun 1913, berdasarkan analisis spektrum atom, Niels Bohr
mengajukan model atom sebagai berikut:
a) Dalam atom terdapat lintasan-lintasan tertentu tempat elektron dapat
mengorbit inti tanpa disertai pemancaran atau penyerapan energi. Lintasan
itu, yang juga disebut kulit atom, adalah orbit berbentuk lingkaran dengan
jari-jari tertentu. Tiap lintasan ditandai dengan satu bilangan bulat yang
disebut bilangan kuantum utama (n), mulai dari 1, 2, 3, 4, dan seterusnya,
yang dinyatakan dengan lambang K, L, M, N, dan seterusnya. Lintasan
pertama, dengan n = 1, dinamai kulit K. lintasan kedua, dengan n = 2,
dinamai kulit L, dan seterusnya. Makin besar harga n (makin jauh dari
commit to user
Gambar 5. Model Atom Bohr
b) Elektron hanya boleh berada pada lintasan-lintasan yang diperbolehkan
(lintasan yang ada), dan tidak boleh berada di antara dua lintasan. Lintasan
yang akan ditempati oleh elektron bergantung pada energinya. Pada
keadaan normal (tanpa pengaruh luar), elektron menempati tingkat energi
terendah. Keadaan seperti itu disebut tingkat dasar (ground state).
c) Elektron dapat berpindah dari satu kulit ke kulit lain disertai pemancaran
atau penyerapan sejumlah tertentu energi. Perpindahan elektron ke kulit
luar akan disertai penyerapan energi. Sebaliknya, perpindahan elektron ke
kulit lebih dalam akan disertai pelepasan energi.
Kelemahan model atom ini adalah tidak dapat menjelaskan spektrum warna
dari atom berelektron banyak. Sehingga diperlukan model atom yang lebih
sempurna dari model atom Bohr.
5) Model Atom Modern (Model Atom Mekanika Kuantum)
Pada tahun 1927, Erwin Schrodinger, seorang ilmuwan dari Austria
mengemukakan teori atom mekanika kuantum atau mekanika gelombang. Teori
tersebut dapat diterima para ahli hingga sekarang.
Teori atom mekanika kuantum mempunyai persamaan dengan teori atom
Niels Bohr dalam hal tingkat-tingkat energi atau kulit-kulit atom, tetapi berbeda
dalam hal bentuk lintasan atau orbit tersebut. Dalam teori atom mekanika
kuantum, posisi elektron adalah tidak pasti. Hal yang dapat ditentukan mengenai
keberadaan elektron di dalam atom adalah daerah peluang terbesar untuk
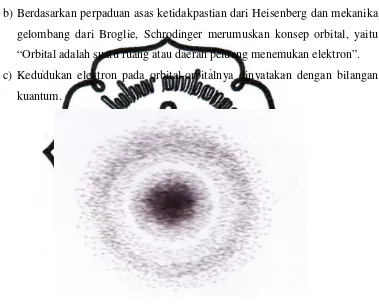
commit to user Teori atom modern adalah sebagai berikut:
a) Atom terdiri dari inti atom yang mengandung proton dan neutron,
sedangkan elektron-elektron mengitari inti atom yang berada pada
orbital-orbital tertentu dan membentuk kulit atom. Hal itu disebut dengan konsep
orbital.
b) Berdasarkan perpaduan asas ketidakpastian dari Heisenberg dan mekanika
gelombang dari Broglie, Schrodinger merumuskan konsep orbital, yaitu
“Orbital adalah suatu ruang atau daerah peluang menemukan elektron”.
c) Kedudukan elektron pada orbital-orbitalnya dinyatakan dengan bilangan
[image:39.595.132.511.211.516.2]kuantum.
Gambar 6. Model Atom Modern
Awan elektron disekitar inti menunjukkan tempat kebolehjadian elektron.
c. Partikel Penyusun Atom
1) Proton
Tahun 1886, Eugene Goldstein menemukan proton. Goldstein melakukan
penelitian menggunakan tabung sinar katode. Anode dan katode dari tabung
tersebut dihubungkan dengan sumber arus listrik bertegangan tinggi. Hasil
penelitian Goldstein menunjukkan fakta-fakta berikut. Jika katode tidak diberi
lubang, maka ruang di belakang katode gelap. Akan tetapi, jika katode dilubangi
dan diisi dengan gas hidrogen yang bertekanan sangat rendah, maka gas di
commit to user
dari anode dan memijarkan gas tersebut. Sinar itu disebut sinar anode (sinar
positif) atau sinar kanal (sinar terusan).
Sifat-sifat sinar anode adalah sebagai berikut:
a) Merupakan radiasi partikel yang disebut dengan proton.
b) Dalam medan listrik atau magnet dapat dibelokkan ke kutub negatif.
Berarti sinar anode bermuatan positif.
c) Perbandingan muatan dan massanya (e/m), bergantung pada gas yang
diisikan pada tabung. Perbandingan e/m terbesar terjadi jika gas yang
diisikan adalah gas hidrogen.
Selanjutnya, melalui percobaan diperoleh hasil bahwa massa 1 proton adalah
1,6726 x 10-24 gram (1 sma) dan muatan 1 proton adalah 1,6022 x 10-19 C dan
diberi tanda muatan + 1.
(Michael Purba, 2006: 31-32)
2) Neutron
Neutron ditemukan oleh James Chadwick pada tahun 1932, tetapi
keberadaannya telah diduga oleh Aston sejak tahun 1919. Pada tahun itu, Aston
menemukan spektrometer massa, yaitu alat yang dapat digunakan untuk
menentukan massa atom atau molekul. Dengan alat tersebut, Aston menemukan
bahwa atom-atom dari unsur yang sama mempunyai massa yang berbeda.
Fenomena ini disebut isotop. Juga ditemukan bahwa massa suatu atom ternyata
tidak sama dengan jumlah protonnya. Berdasarkan kedua fakta tersebut, Aston
menduga keberadaan partikel netral dalam atom yang jumlahnya dapat berbeda
meskipun unsurnya sama.
Selanjutnya pada tahun 1930, W. Bothe dan H. Becker menembaki inti atom
berilium dengan partikel alfa dan menemukan suatu radiasi partikel yang
mempunyai daya tembus tinggi. Pada tahun 1932, James Chadwick membuktikan
bahwa proton tersebut terdiri atas partikel netral yang massanya hampir sama
dengan massa proton. Oleh karena bersifat netral, partikel itu dinamai neutron.
Percobaan lebih lanjut membuktikan bahwa neutron juga merupakan partikel
dasar penyusun inti atom.
commit to user Neutron tidak bermuatan (netral).
(Michael Purba, 2006: 32)
3) Elektron
Elektron ditemukan oleh Joseph John Thomson pada tahun 1897. Penemuan
elektron berkaitan dengan percobaan-percobaan tentang hantaran listrik melalui
tabung hampa. Thomson melakukan percobaan dengan menggunakan tabung kaca
bertekanan udara sangat rendah. Tabung tersebut dinamakan tabung sinar katode.
Melalui percobaan itu, Thomson dapat menentukan harga e/m yaitu sebesar 1,76 x
108 C g-1.
Sedangkan muatan elektron ditemukan oleh Robert Millikan melalui
percobaannya dengan tetes minyak, yaitu sebesar 1,602 x 10-19 C dan diberi tanda
-1. Berdasarkan percobaaan Thomson dan Millikan, massa elektron dapat dihitung
[image:41.595.112.511.235.497.2]yaitu sebesar 9,11 x 10-28 gram.
Tabel 1. Sifat-Sifat Partikel Dasar Atom
Partikel Lambang Massa Muatan Penemu
Proton p 1,6726231 x 10-24 + 1 Goldstein/Rutherford
Neutron n 1,672492716 x 10-24 Netral J. Chadwick
Elektron e 9,1093897 x 10-28 - 1 J.J Thomson
(Michael Purba, 2006: 22-25)
d. Susunan Atom
Dengan ditemukannya struktur atom, maka antara atom yang satu dengan
yang lainnya dapat dijelaskan. Perbedaan tersebut disebabkan oleh perbedaan
susunan yaitu jumlah proton, elektron, dan neutronnya.
1) Nomor Atom
Jumlah proton dalam suatu atom disebut nomor atom atau nomor proton.
Jumlah proton khas bagi setiap unsur. Artinya, atom-atom dari unsur yang sama
mempunyai jumlah proton yang sama tetapi berbeda dari atom unsur lain. Oleh
karena suatu atom bersifat netral, maka jumlah elektron sama dengan jumlah
proton. Jadi, nomor atom juga menyatakan jumlah elektron dalam suatu atom.
commit to user Contoh:
Nomor atom karbon adalah 6, berarti setiap atom karbon mempunyai 6 proton dan
6 elektron.
2) Nomor Massa
Telah disebutkan bahwa proton dan neutron mempunyai massa yang hampir
sama, yaitu masing-masing sekitar 1 sma. Sedangkan massa sebuah elektron
sangat kecil. Oleh karena itu, massa sebuah atom praktis hanya ditentukan oleh
massa proton dan neutronnya, sedangkan massa elektron dapat dibaikan. Jumlah
proton dengan neutron dalam suatu atom disebut nomor massa.
3) Notasi Susunan Atom
Jumlah proton, elektron dan neutron dalam suatu atom dinyatakan dengan
lambang (notasi) sebagai berikut:
Dimana:
A = nomor massa = jumlah proton + jumlah neutron = p + n
Z = nomor atom = jumlah proton (p) = jumlah elektron (e)
X = lambang unsur
Oleh karena A = p + n, sedangkan p = Z, maka A = Z + n atau n = A – Z.
Jadi, jumlah neutron dalam suatu atom sama dengan selisih nomor massa dengan
nomor atomnya.
Contoh:
menyatakan atom Nitrogen dengan nomor atom dan nomor massa 14. Atom
ini mempunyai jumlah proton = 7, jumlah elektron = 7, dan jumlah neutron = 14
– 7 = 7.
4) Susunan Ion
Suatu atom dapat kehilangan elektron atau mendapat elektron tambahan.
Atom yang kehilangan elektron akan menjadi ion positif, sedangkan atom yang
mendapat tambahan elektron akan menjadi ion negatif.
Nomor massa = jumlah proton + jumlah neutron
commit to user
Contoh : atom 7 Li3 terdiri dari 3 proton, 3 elektron dan 4 neutron. Jika jumlah
elektronnya berkurang satu, maka atom litium berubah menjadi ion Li+.
Sebaliknya, jika atom litium mendapat tambahan 1 elektron, maka terbentuk ion
[image:43.595.113.514.214.518.2]Li-. Susunan atom Li, ion Li+ dan ion Li- adalah sebagai berikut:
Tabel 2. Susunan Atom Li, Ion Li+ dan Ion Li-
Spesi Σ Proton Σ Elektron Σ Neutron
Atom Li 3 3 4
Ion Li+ 3 2 4
Ion Li- 3 4 4
Dalam atom netral, jumlah elektron = Z
Dalam ion bermuatan +X, jumlah elektron = Z – X
Dalam ion bermuatan –X, jumlah elektron = Z + X
e. Isotop, Isobar, dan Isoton
1) Isotop
Atom yang mempunyai nomor atom yang sama tetapi memiliki nomor massa
yang berbeda disebut dengan isotop.
Contoh :
p = 7 p = 7 p = 7
e = 7 e = 7 e = 7
n = 6 n = 7 n = 8
Setiap isotop satu unsur memiliki sifat kimia yang sama karena jumlah
elektronnya sama.
2) Isobar
Atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi
mempunyai nomor massa sama disebut isobar.
Contoh : dan merupakan isobar.
3) Isoton
Atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi
mempunyai jumlah neutron sama disebut isoton.
Contoh : dan merupakan isoton, karena memiliki jumlah neutron sama
commit to user
f. Massa Atom dan Massa Atom Relatif
Dalam perhitungan kimia, kita tidak menggunakan massa atom absolute,
tetapi massa atom relatif. Massa atom relatif adalah perbandingan massa antara
atom yang satu terhadap atom yang lainnya. Massa pembanding yang telah
disepakati adalah 1/12 dari massa 1 atom C-12. Oleh karena umumnya unsur
terdiri dari beberapa isotop, maka pada penetapan massa atom relatif digunakan
massa rata-rata dari isotopnya. Dengan demikian, massa atom relatif adalah
perbandingan massa rata-rata dari 1 atom suatu unsur terhadap 1/12 massa 1 atom
C-12.
1/12 massa 1 atom C-12 ditetapkan sama dengan 1 sma, maka definisi di
atas ditulis sebagai berikut:
Dengan menata ulang persamaan di atas, diperoleh;
g. Konfigurasi Elektron
1) Menulis Konfigurasi Elektron
Sesuai dengan teori atom Niels Bohr, elektron berada pada kulit-kulit atom.
Kulit yang paling dekat dengan inti, yaitu kulit K, dapat ditempati 2 elektron, kulit
kedua (kulit L) dapat ditempati 8 elektron, dan seterusnya. Makin besar nomor
kulit, makin banyak jumlah elektron yang dapat berada di situ. Hal itu terjadi
karena makin besar nomor kulit, makin besar pula ruang cakupannya. Jumlah
maksimum elektron pada setiap kulit memenuhi rumus 2n2 (n = nomor kulit).
Kulit K (n = 1) maksimum 2 x 12 = 2 elektron
Kulit L (n = 2) maksimum 2 x 22 = 8 elektron
Kulit M (n = 3) maksimum 2 x 32 = 18 elektron
Kulit N (n = 4) maksimum 2 x 42 = 32 elektron
Kulit O (n = 5) maksimum 2 x 52 = 50 elektron
commit to user
Persebaran elektron dalam kulit-kulit atom disebut konfigurasi elektron.
Elektron pertama dan kedua akan menempati kulit K. Jadi, konfigurasi elektron
dari hidrogen (nomor atom = 1) dan helium (nomor atom = 2) ditulis sebagai
berikut:
K
1H : 1
2He : 2
Oleh karena kulit K hanya dapat ditempati maksimum 2 elektron, maka
elektron ketiga akan mengisi kulit L. Kulit L ini dapat ditempati maksimum 8
elektron. Jadi, unsur dengan nomor atom 3-10 akan mengisi hingga penuh kulit
[image:45.595.111.514.203.509.2] [image:45.595.118.510.511.723.2]kedua (kulit L). Konfigurasi elektron unsur-unsur tersebut dapat dilihat pada
Tabel 3.
Setelah kulit L terisi penuh, maka elektron berikutnya akan mengisi kulit M.
Meskipun kulit M belum terisi penuh, ternyata elektron ke-19 dan ke-20 mengisi
kulit N, sehingga konfigurasi elektron unsur K (nomor atom 19) dan Ca (nomor
atom 20) adalah sebagai berikut:
K L M N
19K : 2 8 8 1
20Ca : 2 8 8 2
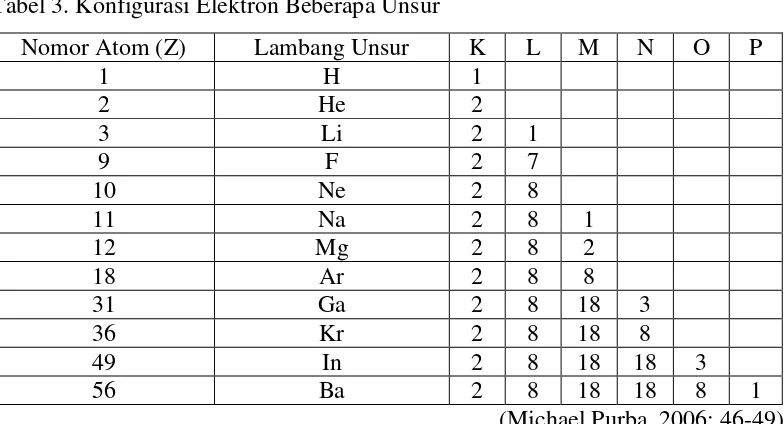
Tabel 3. Konfigurasi Elektron Beberapa Unsur
Nomor Atom (Z) Lambang Unsur K L M N O P
1 H 1
2 He 2
3 Li 2 1
9 F 2 7
10 Ne 2 8
11 Na 2 8 1
12 Mg 2 8 2
18 Ar 2 8 8
31 Ga 2 8 18 3
36 Kr 2 8 18 8
49 In 2 8 18 18 3
56 Ba 2 8 18 18 8 1
commit to user 2) Elektron Valensi
Elektron valensi adalah elektron yang dapat digunakan untuk membentuk
ikatan kimia. Untuk