Elektrolisis ”.
SKRIPSI
Disusun Oleh :
Titan Adria Permana 0631010020
Yance Lucky Otniel Imbiri 0631010065
Jurusan Teknik Kimia
Fakultas Teknologi Industri
Universitas Pembangunan Nasional “Veteran”
Jawa Timur
“PEMBENTUKAN GAS HIDROGEN (H2) DENGAN METODE ELEKTROLISIS”
Disusun oleh :
TITAN ADRIA PERMANA 0631010020
Telah disetujui untuk seminar hasil Pada 22 Februari 20011
Menyetujui Dosen Pembimbing
TITAN ADRIA PERMANA
NPM. 0631010020
Telah dipertahankan dihadapan dan diterima oleh dosen penguji
Pada tanggal 08 Maret 2011
Tim Penguji : Pembimbing :
1.
Ir. Isni Utami, MT
NIP. 19590710 198703 2 001
2.
Ir. Dwi Hery Astuti, MT
NIP. 19590520 198703 2 001
Mengetahui,
Dekan Fakultas Teknologi Industri
Universitas Pembangunan Nasional “Veteran” Jawa Timur Ir. Mu’tasim Billah, MS
NIP. 19600504 198703 1 001
Ir. Sutiyono, MT
Dengan mengucapkan puji syukur ke hadirat Tuhan yang Maha Esa, atas berkat dan
rahmatnya yang telah diberikan kepada penyusun untuk dapat menyelesaikan penelitian
dengan judul “ Pembentukan gas Hidrogen (H2) Dengan Metode Elektrolisis”. Dimana
penelitian ini merupakan tugas yang diberikan sebagai salah satu syarat untuk menyelesaikan
studi di jurusan teknik kimia.
Dalam menyelesaikan penelitian ini, penyusun banyak menemui berbagai hambatan
dan kesulitan sehingga laporan ini jauh dari kesempurnaan , penyusun tidak akan melupakan
jasa – jasa baik mereka yang telah memberikan dorongan, petunjuk, saran dan bimbingan
yang sangat membantu dalam penyelesaian laporan ini. Pada kesempatan ini , penyusun
mengucapkan terima kasih yang sebesar – besarnya kepada :
1. Bapak Ir,Sutiyono, MT selaku Dekan Fakultas Teknologi Industri UPN “Veteran”
Jawa Timur
2. Ibu Ir. Retno Dewati, MT selaku Ketua Jurusan Teknik Kimia UPN “Veteran” Jawa
Timur.
3. Bapak Ir. Mu’Tazim Billah, MT selaku Dosen Pembimbing yang telah membimbing
penyusun sehingga penyusun dapat menyelesaikan penelitian ini.
4. Seluruh civitas akademik jurusan Teknik Kimia, Fakultas Teknologi Industri UPN
“Veteran” Jawa Timur
Akhir kata, penyusun mengharapkan semoga laporan penelitian ini dapat bermanfaat
bagi semua pihak.
Surabaya, September 2009
Penyusun
LEMBAR PENGESAHAN
INTISARI ... i
KATA PENGANTAR ... ii
DAFTAR ISI ... iv
DAFTAR TABEL ... vii
DAFTAR GRAFIK ... viii
BAB I PENDAHULUAN I.1 Latar Belakang ... 1
I.2 Tujuan Penelitian ... 2
I.3 Perumusan Masalah ... 2
I.3 Manfaat Penelitian ... 3
BAB II TINJAUAN PUSTAKA II.1 Pengertian Dasar Reaksi Elektrolisis ... 4
II.1.a. Langkah-langkah Reaksi Elektrolisis ... 9
II.2 Perpindahan Massa Sebagai Langkah Penentu Laju ... 11
II.3 Kinetika Reaksi Elektroda ... 14
v
II.3.1.2 Perilaku Tabel Di Besar ... 17
II.3.1.4 Tabel Plot ... 19
II.4 Landasan Teori ... 22
II.5 Hipotesis ... 27
BAB III PELAKSANAAN PENELITIAN III.1 Alat-alat Yang Digunakan ... 28
III.2 Bahan-bahan Yang Digunakan ... 28
III.3 Gambar Susunan Alat ... 29
III.4 Prosedur Penelitian ... 30
BAB IV HASIL PENELITIAN DAN PEMBAHASAN IV.1 Tabel Hasil Penelitian ... 31
IV.1 Tabel Beda Potensial ... 34
IV.3 Grafik ... 44
V.1 Kesimpulan ... 46
V.2 Saran ... 46
Tabel 1 Tabel hasil Penelitian ... 31-33
Tabel 2 Tabel Beda Potensial ... 34
iii
menentukan kadar gas hidrogen menggunakan proses elektrolisis.Elektrolisis ialah
suatu arus listrik dialirkan ke dalam larutan penghantar arus listrik, maka akan terjadi
proses peruraian senyawa kimia dari larutan tersebut. Dalam proses elektrolisis
berlangsung reaksi reduksi dan oksidasi. Reaksi reduksi terjadi pada katoda,
sedangkan reaksi oksidasi terjadi pada anoda. Metode elektrolisis adalah suatu metode
yang akan mengubah listrik menjadi energy kimia. Pada percobaan kali ini, larutan
KOH yang diencerkan dengan H2O akan terpisah menjadi dua senyawa, yaitu H2O
dan H2.
Untuk merancang suatu alat hidrogenisator dengan menggunakan proses
elektrolisis, peranan mekanisme reaksi sangat penting. Mekanisme reaksi ini
dipengaruhi oleh jenis electrode yang digunakan, besarnya potensial listrik yang
dibutuhkan serta konstanta laju reaksi dari larutan KOH yang terlarut. Oleh
karenanya, penentuan konstanta laju reaksi suatu jenis larutan dengan elektrode
tertentu, membantu perencanaan suatu alat hidrogenisator. Dari hasil penelitian pada
saat waktu (t) antara 2 – 4 menit yang merupakan hasil terbesar atau optimal laju alir
BAB
I
PENDAHULUAN
I.1. Latar Belakang
Dalam merancang alat Hidrogenisator, persamaan laju reaksi berguna untuk
menentukan kadar gas hidrogen menggunakan proses elektrolisis.Elektrolisis ialah suatu
arus listrik dialirkan ke dalam larutan penghantar arus listrik, maka akan terjadi proses
peruraian senyawa kimia dari larutan tersebut. Dalam proses elektrolisis berlangsung
reaksi reduksi dan oksidasi. Reaksi reduksi terjadi pada katoda, sedangkan reaksi oksidasi
terjadi pada anoda menurut persamaan reaksi :
Pada katoda :
Pada anoda :
Metode elektrolisis adalah suatu metode yang akan mengubah listrik menjadi energy
kimia. Pada percobaan kali ini, larutan KOH yang diencerkan dengan H2O akan terpisah
menjadi dua senyawa, yaitu H2O dan H2. Dimana gas H2 tersebut akan ditampung dan
berfungsi sebagai pengabutan dalam pembakaran kendaraan bermotor.
electrode yang digunakan, besarnya potensial listrik yang dibutuhkan serta konstanta laju
reaksi dari larutan KOH yang terlarut. Oleh karenanya, penentuan konstanta laju reaksi
suatu jenis larutan dengan elektrode tertentu, membantu perencanaan suatu alat
hidrogenisator.
I.2. Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan konstanta laju reaksi gas hidrogen (H2).
I.3. Perumusan masalah
Pada penelitian ini dipilih reaksi penguji untuk pembentukan gas hidrogen (H2) :
Proses elektrolisis dilakukan pada kondisi perpindahan massa yang bertindak sebagai
pengendali reaksi keseluruhan. Pada reaksi diatas menunjukkan bahwa KOH yang
I.4. Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat memberikan manfaat, yaitu :
1. Membantu dalam merencanakan alat hidrogenisator .
2. Membantu penghematan BBM untuk kendaraan bermotor.
BAB II
TINJAUAN PUSTAKA
II.1. PENGERTIAN DASAR REAKSI ELEKTROLISIS
Bila suatu arus listrik dialirkan ke dalam larutan penghantar arus listrik, maka akan
terjadi proses peruraian senyawa kimia dari larutan tersebut. Proses ini disebut elektrolisis,
larutan penghantar arus listrik disebut elektrolit, dan logam (aktif, inert atau semikonduktor) yang menghantarkan arus listrik masuk dan keluar larutan disebut elektroda. Dalam proses elektrolisis berlangsung reaksi reduksi dan oksidasi. Reaksi reduksi terjadi pada katoda,
sedangkan reaksi oksidasi terjadi pada anoda menurut persamaan reaksi :
Pada katoda :
Pada anoda :
Reaksi total pada sel elektrolisis :
pada keadaan setimbang, jumlah elektron yang dilepaskan pada reaksi oksidasi sama dengan
Batasan elektrolisis merangkum semua phenomena yang berhubungan dengan dan
dihasilkan dari suatu reaksi yang terjadi pada elektroda dan larutan elektrolit. Michael Faraday
(1832-1833) yang pertamakali tentang elektrolisis, menyatakan bahwa berat ion yang dideposisi
(dibentuk) pada elektroda proporsional dengan muatan listrik yang melewati elektrolit, menurut
persamaan :
dengan :
W = berat reaktan (gram)
Wm = berat molekul reaktan
Q = muatan listrik (Cuolumb)
n = jumlah elektron yang dipindahkan tiap mol spesies
F = tetapan Faraday, 96490 C/ekuivalen = (Ne).
maka :
dengan :
N = jumlah mol spesies yang dielektrolisis
t = waktu (detik)
V = laju reaksi (mol/detik)
i = arus listrik (Ampere).
Pada umunya laju reaksi elektroda dinyatakan dalam satuan mol/detik per satuan luas permukaan
elektroda (A) maka :
V’ = laju reaksi per satuan luas elektroda, mol/det cm2
Dengan demikiam, untuk berat 1 (satu) mole ion yang terdeposisi pada elektroda dengan arus
sebesar satu ampere selama satu detik, dibutuhkan muatan listrik seharga 96490 Coulomb (4,6).
Pada proses elektrolisis terjadi perbedaan potensial antara elektroda dan elektrolit. Hal
Energi ini terjadi karena adanya perubahan neraca energi yang berarti pula adanya perubahan
komposisi kimia larutan elektrolit (4.6). Secara umum
Reaksi yang terjadi dapt dituliskan sebagai berikut :
dengan :
ΔG = perubahan energi bebas (KJ)
ΔGO = perubahan energi bebas standart (KJ)
R = konstanta gas (J/mol.K)
T = temperatur absolut (K)
C = konsentrasi (mol/l) M
a = aktivitas
untuk larutan encer harga γ = 1, sehingga persamaan 2.1.9 menjadi :
Perubahan energi bebas (ΔG), dihasilkan dari perpindahan sejumlah bilangan Avogardo elektron,
(Ne = F), akibat beda potensial (E), dinyatakan dengan
persamaan :
Subtitusikan persamaan 2.1.11 ke persamaan 2.1.10 menghasilkan persamaan 2.1.1 :
atau
dengan :
EO = potensial reduksi standart (V)
Hubungan antara potensial dengan kosentrasi pada kasetimbangan dapat dituliskan sebagai
berikut :
II.1.a. LANGKAH – LANGKAH REAKSI ELEKTROLISIS
Dalam reaksi elektroda sederhana pada persamaan 2.1.14, oksidan (O) mengalami
peristiwa reduksi membentuk reduktan R. Mekanisme reaksi sederhana secara umum dapat
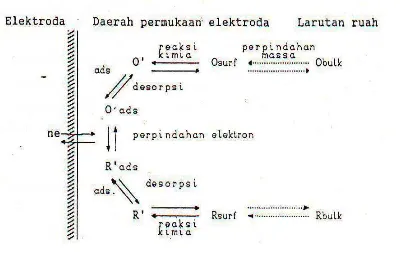
Gambar 2.1 menunjukan bahwa umumnya reaksi elektroda berlangsung melalui beberapa tahap
proses berikut :
1. Perpindahan massa (yaitu, O dari larutan ruah ke permukaan elektroda dan R dari
permukaan dari permukaan elektroda ke larutan ruah)
2. Reaksi kimia yang mendahui atau mengikuti perpindahan elektron. Reaksi disebut
homogen bila berlangsung pada satu phase, seperti protonasi atau demerisasi dan disebut
heterogen bila berlangsung pada phase yang berbeda seperti peruraian katalik pada
permukaan elektroda.
3. reaksi permukaan lain, seperti adsorpsi, desorpsi, atau kristalisasi (elektrodeposisi).
4. perpindahan elektron pada permukaan elektroda.
Reaksi yang paling sederhana hanya melibatkan perpinahan massa reaktan ke elektroda,
perpindahan elektron heterogen melibatkan spesies tak teradsorpsi, dan perpindahan massa hasil
(produk) ke larutan ruah. Reaksi yang lebih kompleks melibatkan rangkaian (berurutan)
berpindah elektron dan protonasi, mekanisme cabang, reaksi paralel, atau modifikasi permukaan
elektroda. Pada keadaan tunak laju reaksi semua tahap adalah sama dan sama dengan tahap yang
paling lambat. Jadi besarnya arus dibatasi oleh laju tahap yang paling lambat yang disebut tahap
II.2. PERPINDAHAN MASSA SEBAGAI LANGKAH PENENTU LAJU
Dalam reaksi elektroda yang hanya melibatkan perpindahan elektron, reaksi kimia dan
perpindahan massa, jika perpindahan elektron dan reaksi kimia berlangsung cepat dan
perpindahan massanya berlangsung sangat lambat maka dapat dianggap langkah yang
mengendali reaksi elektroda adalah perpindahan massa. Dalam hal ini, laju netto reaksi elektroda
(v) sama dengan laju perpindahan spesies elektroaktif ke permukaan (vmt) :
Sehingga :
Ada tiga proses perpindahan massa, yaitu :
1. Migarsi : perpindahan partikel bermuatan di bawah pengaruh suatu medan listrik
(gradient potensial listrik).
2. Diffusi : perpindahan spesies di bawah pengaruh gradient konsentrasi (gradient potensial
kimia).
3. konveksi : perpindahan karna pengadukan atau perpindahan hidrodinamika. Pada umunya
Proses perpindahan massa tersebut dituliskan oleh Nersnt-Plank dalam bentuk persamaan satu
demensional perpindahan massa sebagai berikut :
dengan :
Ji (x) = fluks spesies i (mol det-1cm-2)
x = jarak dari permukaan
Di = koefisien difusi (cm2)/det
Zi = muatan spesies i
Ci = konsentrasi spesies i
V (x) = kecepatan (cm/sec)
Bila proses migrasi dan konveksi diabaikan, maka laju perpindahan massa pada kondisi tunak
proporsional dengan gradient konsentrasi pada permukaan elektroda, diperoleh :
dengan :
CO* = konsentrasi O pada larutan ruah
CO ( x = 0 ) = konsentrasi O pada permukaan elektroda.
mO = koefisien perpindahan massa O (cm/det)
subtitusi persamaan 2.2.2 ke 2.2.3 menghasilkan :
Untuk reduktan R, yang dihasilkan pada permukaan CR ( x = 0 ) lebih besar daripada konsentrasi
ruah R, CR*, persamaan 2.2.6 dapat dituliskan :
Bila tidak ada R dalam larutan ruah, CR* = 0, misalnya R spesies yang tidak larut, maka :
Harga C0(x=0) dan CR(x=0) merupakan fumgsi potensial electrode E. perpindahan massa 0
terbesar terjadi bila C0(x=0) = 0 atau C0(x=0) jauh lebih kecil dibanding C0*. Nilai arus listrik
menjadi:
Persamaan (2.2.4) dan persamaan (2.2.8) dapat digunakan untuk mendapatkan nilai C0(x=0),
yaitu :
atau :
Bila perpindahan electron berlangsung cepat, maka konsentrasi O dan R di permukaan elektroda
dapat dianggap pada harga kesetimbangan. Hubungan antara konsentrasi dan potensial dapat
dinyatakan dengan persamaan Nerst untuk reaksi setengah sel (2.2.1), yaitu :
II.3. KINETIKA REAKSI ELEKTRODA
Kinetika reaksi elektroda berhubungan dengan laju reaksi elektrokimia pada antar muka
antara konduktor logam suatu larutan. Laju reaksi elektroda sangat bergantung pada potensial
di ketahui latar belakang awal kinetika elektrokimia dan dapat digunakan sebagai dasar untuk
menyusun teori kinetika elektrokimia secara analogi.
II.3.1 Kinetika Homogen
II.3.1.1.Kesetimbangan Dinamika
Reaksi molekuler sederhana substansi A menjadi B secara elementer, dapat di tuliskan :
kf
A B
kb
Reaksi terjadi pada setiap saat, laju reaksi ke kanan, Vf (mol det-1 cm-2), adalah :
Sedangkan laju reaksi ke kiri :
Dengan :
kf = konstanta laju reaksi ke kanan, cm . det-1
kb = konstanta laju reaksi ke kiri, cm . det-1
pada saat kesetimbangan laju konversi netto = 0, laju reaksi ke kiri = laju reaksi ke kanan, maka:
Teori kinetika selanjutnya memprediksikan harga ratio konsentrasi pada kesetimbangan seperti
pada Thermodinamika.
II.3.1.2. Kinetika Elektroda
Pada persamaan reaksi 0 + n e R , reaksi berlangsung
kekanan dengan laju reaksi Vf yang berbanding langsung dengan konsentrasi 0 dipermukaan.
Dengan : iC = arus katodik
Untuk laju reaksi Vb :
Dengan: ia = arus anodik
dan di dapatkan :
II.3.1.3. Perilaku Tabel di η Besar.
Untuk nilai besar η (baik negatif atau positif), salah satu syarat dalam tanda kurung
(2.2.21) menjadi diabaikan. Sebagai contoh, di overpotentials negatif besar, exp (- αnfη)>> exp
[(1-α) nfη] dan (2.2.21) menjadi :
Dengan demikian, kita menemukan bahwa garis pengobatan kinetik di atas tidak
menghasilkan hubungan bentuk Tabel, seperti yang disyaratkan oleh observasi, untuk kondisi
yang sesuai. Tabel konstanta empiris (lihat persamaan 3.2.4) didapatkan identifiel dari teori
sebagai :
Bentuk Tabel dapat diharapkan untuk menahan setiap kali reaksi Beck (yaitu proses anodik
ketika penurunan bersih dianggap, dan sebaliknya) menyumbang kurang dari 1% dari saat ini,
atau
Yang berarti pada 25OC bahwa
|η|>0,118/nV
Jika elektroda kinetik cukup lancar, kita akan mendekati perpindahan massa
terbatas saat ini dengan dia waktu seperti overpotential axtreme didirikan. hubungan Tabel tidak
dapat diamati untuk sistem seperti itu, karena mereka memerlukan adanya efek perpindahan
diperlukan, hubungan Tabel yang baik dapat dilihat. Ini poin di bawah skor kenyataan bahwa
perilaku Tabel adalah indikator kinetika sepenuhnya ireversibel. Sistem dalam kategori tidak
memungkinkan axcept aliran signifikan saat ini di overpotentials tinggi, di mana proses faradaic
secara efektif unidirectional dan, oleh karena itu, kimia ireversibel.
II.3.1.4. Tabel Plot
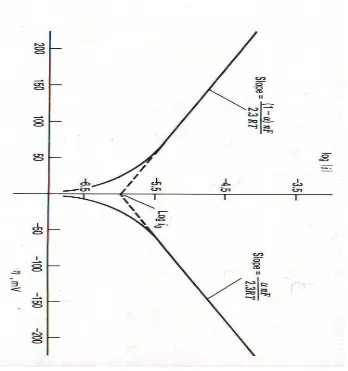
Sebuah plot log i vs η, dikenal sebagai plot Tabel yang berguna untuk mengevaluasi
parameter kinetik. Secara umum, ada cabang anodik dengan kemiringan (1 - α) nF/2.3RT dan
cabang katodik dengan kemiringan - αnF/2.3RT. Seperti menunjukkan pada gambar (2.2) kedua
segmen linier meramalkan kemungkinan untuk mencegat log i0. Plot tajam saat ini sebenarnya
menyimpang dari perilaku linier sebagai pendekatan η nol, karena reaksi kembali tidak bisa lagi
dianggap sebagai diabaikan. koefisien transfer dan tukar saat ini i0 adalah obsviously readly
diakses dari presentasi semacam ini, bila dapat diterapkan.
Beberapa plot Tabel nyata diperlihatkan dalam gambar (3.5.5) untuk Mn (IV / Mn (III) sistem
dalam asam pekat (32). The deviotions negatif pada overpotensial linieritas bentuk yang sangat
besar berasal dari keterbatasan yang ditetapkan oleh perpindahan massa. Wilayah yang sangat
overpotensial rendah menunjukkan falloffs tajam karena alasan yang dijelaskan di atas.
Pada metode alternatif untuk plotting data i-η, yang memungkinkan penggunaan data yang
[image:31.612.104.452.259.630.2]
atau
Dimana :
F : konstanta Faraday ( 96485 Coulumb)
n : jumlah elektron yang dipertukarkan
II.4. LANDASAN TEORI
Metode yang akan digunakan dalam percobaan ini adalah metode Elektrolisa
terhadap terhadap bulk (ruah). Metode elektrolisa terhadap bulk ini berguana sebagai salah satu
cara untuk mengolah adanya aliran gas yang terdapat dalam larutan KOH + H2O.
Dalam metode elektrolisa ini terdapat dua parameter yang dapat dikontrol atau dijadikan
sebagai suatu variabel tetap, yaitu :
1. Pengontrolan terhadap potensial atau potensiostatik.
2. Pengontrolan terhadap kuat arus atau intensiostatik.
Dalam percobaan ini yang akan digunakan adalah cara potensiostatik. Pengontrolan
terhadap potensiostatik ini biasa dilakukan dengan metode coulometri. Metode coulumetri
potensiostatik adalah suatu metode pengukuran muatan listrik secara kuantitatif yang diperlukan
untuk reaksi elektrolisa dan melibatkan spesies tertentu dalam larutan.
Dalam pengunaan metode coulometri potensiostatik yang harus diperhatikan adalah :
1. Reaksi yang terjadi harus diketahui stokiometrinya.
2. Reaksi yang terjadi merupakan reaksi tunggal dan tidak terjadi reaksi samping.
Pada metode ini kuat arus selama proses elektrolisa selalu diamati, sehingga kuat arus
mula – mula dapat ditentukan dan proses terjadinya elektrolisa dapat diteliti. Persamaan –
Dengan : m0 = koerfisien perpindahan massa
C0* = konsentrasi reaktan pada larutan bulk
C0(X=0) = konsentrasi reaktan pada permukaan eletroda
Sehingga:
Karena C0(x=0) <<< C0* , maka :
dengan iĮ = limiting current
dengan : N0 = jumlah mol dari reaktan pada sistem.
Persamaan (2.4.6) terjadi bila larutan dianggap homogen, dimana sejumlah volume yang
sangat kecil pada lapisan difusi dipermukaan elektroda diabaikan. Karena :
Maka persamaan (2.4.6) dan (2.4.7) akan diperoleh :
dan
Dari persamaan (2.4.5) yang kita tahu bahwa perubahan iĮ (t) berbanding lurus dengan perubahan
Co* (t), maka (t) dapat dinyatakan sebagai :
sehingga jumlah muatan listrik pada t adalah :
Persamaan (2.4.12) kita substitusikan ke persamaan (2.4.13) akan diperoleh :
bila :
maka :
II.5 Hipotesis
Dengan memperhatikan uraian dan persamaan – persamaan diatas, maka reaksi
BAB III
PELAKSANAAN PENELITIAN
Penelitian uji metode koulometri potensiostatik ini mengarahkan besarnya energi
bebas, ∆G yang dihasilkan dari perpindahan sejumlah bilangan avogadro electron (Ne =
F), akibat dari adanya perbedaan Potensial, E.
III.1 Alat – alat yang digunakan
Dalam percobaan ini diperlukan beberapa alat untuk mendukung ketelitian dalam
percobaan, antara lain :
a. Sel elektrolisis (tabung steinless)
b. Potensiostat
c. Selang
Alat – alat tersebut nantinya disesuaikan sehingga membentuk suatu rangkaian yang akan
diperlihatkan pada gambar sub bab III.3.
III.2 Bahan – bahan yang digunakan
b. Aquadest
III.3 Gambar susunan alat
III.4 Prosedur
Dalam penelitian ini dipelajari reaksi elektrolisis larutan KOH dengan elektroda
(stainless steel) kation-anion yang digunakan sebagai proses reaksi pemebentukan gas
H2, dengan reaksi :
Sel elektrolisis terbuat dari bahan logam stainless steel dialiri arus listrik yang
dihubungkan dengan potensiostat, dengan peubah 3 - 4 volt yang berfungsi sebagai
sumber tegangan listrik bermuatan negatif dan positif, dalam percobaan ini digunakan
bermacam – macam peubah konsentrasi larutan KOH dengan konsentrasi 0.2M, 0.25M
dan 0.3M.
Kemudian pengamatan dilakuakan laju reaksi gas hidrogen yang terbentuk selama 10
menit dilakukan dengan mencatat setiap rentang waktu arus listrik mulai dari 3 - 4 volt
untuk setiap perhitungan konsentrsi larutan beserta laju reaksi tekanan gas H2 yang
BAB
IV
HASIL
PENELITIAN
DAN
PEMBAHASAN
IV.I. Tabel Hasil Penelitian
Pengamatan pada konsentrasi 0,2 M
Voltase (V) volt
Arus (ic)
ampere
Waktu (t) menit
V1 = 3 ic1 = 85 2
V2 = 4 ic2 = 80 4
V3 = 4 ic3 = 77 6
V4 = 4 ic4 = 75 8
V5 = 4 ic5 = 70 10
Perhitungan konsentrasi pada 0,2 M :
KOH = 0,2
BM KOH = 46 mol
KOH = 0,2/46 gr/lt
= 0,0043478 gr
Pengamatan pada konsentrasi 0,25 M
Voltase (V) volt
Arus (ic)
ampere
Waktu (t) Menit
V1 = 3 ic = 70 2
V2 = 4 ic = 67 4
V3 = 4 ic = 65 6
V4 = 4 ic = 62 8
V5 = 4 ic = 60 10
Perhitungan konsentrasi pada 0,25 M :
KOH = 0,25 M
BM KOH = 46
KOH = 0,25/46 gr/lt
= 0,0054347 gr
Pengamatan pada konsentrasi 0,3 M
Voltase (V) volt
Arus (ic)
ampere
Waktu (t) Menit
V1 = 3 ic1 = 60 2
V2 = 4 ic2 = 57 4
V3 = 4 ic3 = 55 6
V4 = 4 ic4 = 52 8
V5 = 4 ic5 = 50 10
Perhitungan konsentrasi pada 3 M :
KOH = 3 M
BM KOH = 46
KOH = 0,2/46 gr/lt
= 0,0043478 gr
IV.2. Tabel Beda potensial (η = E Eq)
Pada konsentrasi 0,2 M ,
E Eq (volt) ic (ampere) η = E Eq
Dari grafik dibawah ini , dapat di ketahui slope dan intersepnya :
#) Slope dapat di hitung dengan persamaan :
Δί0 = Δη
= Δy/Δx
= 5 / 8,5
= 0,588
#) Intersepnya dapat di lihat langsung pada grafik.
Pada Konsentrasi 0,25 M
E Eq (volt) ic (ampere) η = E Eq
Dari grafik dibawah ini , dapat di ketahui slope dan intersepnya :
#) Slope dapat di hitung dengan persamaan :
Δί0 = Δη
= Δy/Δx
= 5,5 / 9
= 0,611
#) Intersepnya dapat di lihat langsung pada grafik.
Pada Konsentrasi 0,3 M
E Eq (volt) ic (ampere) η = E Eq
, ,
, ,
, ,
, ,
, ,
Dari grafik dibawah ini , dapat di ketahui slope dan intersepnya :
#) Slope dapat di hitung dengan persamaan :
Δί0 = Δη
= Δy/Δx
= 5 / 8
= 0,625
#) Intersepnya dapat di lihat langsung pada grafik.
Dengan menggunakan persamaan :
Ct = C(0) . e-p . t
berbanding lurus dengan
it = i(0) . e-p . t Menghitung Nilai Ct pada konsentrasi 0,2 M
#) Ct = C(0) . e-p . t Ct = 0,2 . e (-0,625x2)
Ct = 57 x 10-3
#) Ct = 0,2 . e (-0,625x4)
Ct = 16 x 10-3
#) Ct = 0,2 . e (-0,625x6)
Ct = 5 x 10-3
#) Ct = 0,2 . e (-0,625x8)
Ct = 1,5 x 10-3
#) Ct = 0,2 . e (-0,625x10)
t (menit) C0 (M) P (slope) Ct
, , x ‐
, , x ‐
, , x ‐
, , , x ‐
, , , x ‐
Menghitung Nilai Ct pada konsentrasi 0,25 M #) Ct = C(0) . e-p . t
Ct = 0,25 . e (-0,611x2)
Ct = 74 x 10-3
#) Ct = 0,25 . e (-0,611x4)
Ct = 22 x 10-3
#) Ct = 0,25 . e (-0,611x6)
Ct = 7 x 10-3
#) Ct = 0,25 . e (-0,611x8)
Ct = 2 x 10-3
#) Ct = 0,25 . e (-0,611x10)
t (menit) C0 (M) P (slope) Ct
2 0,25 0,611 74 x 10-3
4 0,25 0,611 22 x 10-3
6 0,25 0,611 7 x 10-3
8 0,25 0,611 2 x 10-3
10 0,25 0,611 0,6 x 10-3
Menghitung Nilai Ct pada konsentrasi 0,3 M
#) Ct = C(0) . e-p . t Ct = 0,3 . e (-0,588x2)
Ct = 92 x 10-3
#) Ct = 0,3 . e (-0,588x4)
Ct = 29 x 10-3
#) Ct = 0,3 . e (-0,588x6)
Ct = 9 x 10-3
#) Ct = 0,3 . e (-0,588x8)
Ct = 3 x 10-3
#) Ct = 0,3 . e (-0,588x8)
t (menit) C0 (M) P (slope) Ct
2 0,3 0,588 92 x 10-3
4 0,3 0,588 29 x 10-3
6 0,3 0,588 9 x 10-3
8 0,3 0,588 3 x 10-3
10 0,3 0,588 0,8 x 10-3
[image:56.612.73.496.258.693.2]
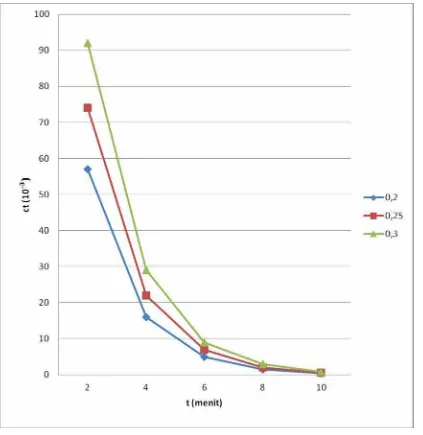
Grafik IV.1 Hubungan antara waktu dan konsentrasi terhadap laju alir
pembentukan gas H
2
IV.3 Hasil Pembahasan :
Melihat grafik 0,2M ; 0,25M ; 0,3M tersebut diatas, dapat dikatakann bahwa ketiga
konsentrasi memiliki kecenderungan yang hampir sama dan bersifat asyntotis pada waktu (t) : 10
menit. Namun dari grafik diatas dapat dilihat laju alir pembentukan gas hidrogen (H2) yang
optimal pada 0,2 M ; 0,25 M dan 0,3 M ialah pada waktu (t) 4 – 6 menit. Karena pada data dari
tabel serta grafik juga menunjukkan pada saat waktu (t) antara 2 – 4 menit yang merupakan hasil
terbesar atau optimal laju alir pembentukan gas hidrogen (H2) yaitu pada konsentrasi 0,3 M.
BAB
V
Kesimpulan
Dan
Saran
V.I.Kesimpulan
Konsentrasi 0,2 M
Pada konsentrasi 0,2 M dengan menggunakan tolak ukur pada grafik dan perhitungan
tabel maka, didapatkan hidrogen (H2) yang belum maksimal atau bisa dikatakan belum mencapai
tittik standar seperti yang kami harapkan dikarenakan konsentrasi tersebut masih belum
mendekati titik gas hidrogen (H2) yang dibutuhkan.
Konsentrasi 0,25 M
Pada konsentrasi 0,25 M masih menghasilkan hasil gas hidrogen (H2) yang relatif,
juga,akan tetepi hasil telah mencapai
V.II. Saran
Bagi peneliti yang ingin mencoba menggembangkan penelitian ini diharapkan dapat
menggunakan konsentrasi 0.4M, 0.5M , 0.6M dan seterusnya, serta waktu yang lebih lama demi
Daftar
pustaka
1. ALLEN J. BARD, Department of Chemistry University of Texas
2. LARRY R. FAULKNER, Department of Chemistry University of Illinois
3. JOHN O’M BOCKRIS, Professor of Electrcochemistry University of Pennsylvania.
Philadelphia.pennsylvania
4. AMULYA K.N. REDDY, Professor of Electrochemistry Indian Institute of Science.
Bangalore. India