UNTUK PENGENDALIAN HAMA Spodoptera exigua HUBNER (LEPIDOPTERA:NOCTUIDAE)
Rusdi Rusli dan Trizelia1)
1) Jurusan Hama dan Penyakit Tumbuhan Faperta Unand, Kampus Limau Manis Padang 25163
Abstrak
Penelitian ini bertujuan untuk mendapatkan isolat Beauveria bassiana
yang virulen terhadap larva Spodoptera exigua dan jenis substrat terbaik untuk perbanyakan massal B. bassiana. Penelitian dilaksanakan di Laboratorium Pengendalian Hayati, Jurusan Hama dan Penyakit Tumbuhan Faperta Unand dari bulan Mei sampai dengan November 2008 B. bassiana diisolasi dari serangga dan tanah kemudian dibiakkan dalam medium SDAY. Penelitian ini menggunakan 11 isolat dan 4 taraf konsentrasi konidia (106-109 konidia/ml).
Isolat yang virulen kemudian diperbanyak pada berbagai jenis substrat. Cendawan entomopatogen diinokulasikan langsung pada larva S. exigua instar III. Hasil penelitian menunjukkan bahwa pada konsentrasi 108 konidia/ml, isolat
BbHhKA12memiliki virulensi yang tertinggi dengan mortalitas larva instar III 100.00% dan nilai LT50 1.85 hari. Mortalitas larva S. exigua instar III sangat
dipengaruhi oleh jenis isolat dan konsentrasi konidia. Jenis media perbanyakan sangat berpengaruh nyata terhadap sporulasi B. bassiana. B. bassiana yang diperbanyak pada beras menghasilkan jumlah konidia tertinggi yaitu 7.10 x 109
konidia/g substrat dan berbeda nyata dengan B. bassiana yang diperbanyak pada substrat lain. B. bassiana yang diperbanyak pada kulit kentang menghasilkan jumlah konidia yang sedikit hanya 1.05 x 109 konidia/g substrat.
Kata kunci: Beauveria bassiana, virulen, isolat, Spodoptera exigua, sporulasi
PENDAHULUAN
Menurut Sastrosiswojo (1994) kehilangan hasil akibat serangan larva S. exigua dapat mencapai 57%. Pada serangan berat dapat menyebabkan kehilangan hasil sampai 100%, karena daun yang ada habis dimakan oleh larva sehingga kegagalan panen tidak bisa dihindari. Serangan berat ini biasanya terjadi pada musim kemarau yang mengakibatkan produksi tanaman menurun (Shepard et al. 1997; Utami 1997).
Sampai saat ini untuk mengendalikan hama S. exigua para petani masih mengandalkan insektisida kimia karena mereka menganggap insektisida merupakan jaminan untuk keberhasilan usaha taninya. Aplikasi penggunaan insektisida kimia dilakukan dalam selang waktu 2-3 hari sekali dan bahan kimia yang disemprotkan merupakan campuran dari berbagai jenis insektisida (Utami 1997). Hal ini sangat disayangkan mengingat Indonesia sedang menuju era pembangunan pertanian yang berwawasan lingkungan, sehingga penggunaan insektisida kimia sintetis harus digunakan seminimal mungkin.
Salah satu cara pengendalian hama S. exigua yang ramah lingkungan adalah dengan menggunakan musuh alami serangga hama baik berupa predator, parasitoid maupun patogen. Salah satu jenis patogen serangga yang banyak terdapat di alam dan dapat digunakan untuk pengendalian serangga hama secara hayati adalah cendawan entomopatogen Beauveria bassiana (Bals.) Vuill. (Deuteromycotina: Hyphomycetes).
B. bassiana merupakan salah satu spesies cendawan patogen pada
serangga yang telah memperoleh perhatian besar dan telah dimanfaatkan untuk pengendalian serangga hama pada berbagai komoditas tanaman, karena cendawan ini mempunyai daya bunuh yang tinggi terhadap berbagai jenis serangga hama, mudah diperbanyak dan tidak bersifat toksik terhadap vertebrata (Wraight et al. 2000).
sanguinipes Fabricius (Orthoptera: Acrididae) menyebabkan mortalitas nimfa sampai di atas 80% (Inglis et al. 1999). Di Indonesia B. bassiana telah digunakan secara luas untuk pengendalian hama penggerek buah kopi,
Hypothenemus hampei (Ferr.) (Coleoptera: Scolytidae) yang telah digunakan di
hampir semua propinsi penghasil kopi (Haryono et al. 1993). Hasil penelitian Trizelia (2005) menunjukkan bahwa B. bassiana dapat dimanfaatkan untuk pengendalian hama kubis Crocidolomia pavonana (Lepidoptera: Pyralidae). Hasil penelitian Yurham (2008) menunjukkan bahwa aplikasi cendawan B. bassiana
pada larva S. exigua instar III dengan konsentrasi 106 konidia/ml menghasilkan
mortalitas larva sebesar 35 % dan pada konsentrasi 109 konidia/ml mortalitas larva
mencapai 80%.
Salah satu keuntungan penggunaan cendawan B. bassiana sebagai bioinsektisida adalah cendawan ini relatif mudah diperbanyak (diproduksi) pada berbagai jenis media (substrat). Beberapa jenis media (substrat) yang telah digunakan untuk perbanyakan konidia B. bassiana antara lain beras, jagung, gandum, kedelai, dan kentang. Hasil penelitian Wahyunendo (2002) menunjukkan bahwa pada media beras jumlah konidia B. bassiana yang dihasilkan dapat mencapai 2.4 x 109 konidia/gr substrat setelah diinkubasikan
selama 28 hari.
Sampai saat ini media buatan (substrat) yang umum digunakan sekarang ini untuk perbanyakan massal B. bassiana, adalah beras dan jagung. Kedua media ini mampu menghasilkan konidia yang tinggi. Dengan meningkatnya harga beras dan jagung dan dalam rangka pemanfaatan limbah organik, maka perlu dicari media (substrat) alternatif yang dapat digunakan sebagai bahan perbanyakan cendawan dengan kemampuan sporulasi yang masih tinggi. Substrat alternatif tersebut dapat dengan memanfaatkan limbah organik seperti kulit kentang, kulit kopi, ampas tebu dan kulit ubi jalar. Indonesia yang merupakan negara agraris mempunyai potensi menghasilkan limbah organik yang sangat besar seperti limbah kelapa sawit, kopi, tebu,padi, jagung dan lain-lain. Namun usaha pemanfaatannya masih belum dilakukan secara maksimal.
organik lebih banyak digunakan sebagai kompos untuk meningkatkan kesuburan tanah, sedangkan pemanfaatannya sebagai substrat perbanyakan agens hayati B.
bassiana belum banyak dilaporkan. Oleh karena itu informasi tentang
penggunaan limbah organik lain sebagai media perbanyakan agens hayati B.
bassiana sangat diperlukan dalam rangka pemanfaatan limbah organik sebagai
media perbanyakan bioinsektisida yang murah dan bisa dilakukan oleh petani. Disamping bisa diperbanyak, konidia yang dihasilkan diharapkan juga bersifat virulen terhadap serangga hama dan mampu disimpan lama.
Dalam jangka panjang, penelitian ini bertujuan untuk menghasilkan paket teknologi baru berupa bioinsektisida yang berbahan aktif cendawan entomopatogen B. bassiana isolat lokal. Hasil penelitian ini diharapkan dapat digunakan sebagai dasar pertimbangan dalam pemilihan dan aplikasi isolat B.
bassiana yang tepat dan efektif untuk pengendalian hama S. exigua di lapangan.
METODE PENELITIAN Koleksi dan Perbanyakan Isolat
Isolat B. bassiana yang digunakan dalam penelitian ini merupakan koleksi Laboratorium Entomologi Jurusan HPT Faperta Unand, Laboratorium Patologi Serangga Jurusan HPT IPB, dan koleksi langsung dari serangga yang terinfeksi di lapangan dan dari tanah dari lokasi yang berbeda. Seluruh isolat ditumbuhkan pada medium Sabouraud dextrose agar dengan yeast extract (SDAY) (dekstrosa 40 g, pepton 10 g, ekstrak khamir 2.5 g, agar 15 g, kloramfenikol 0.5 g dan akuades 1 l)
Isolasi B. bassiana dari tanah dilakukan dengan mengambil tanah sekitar perakaran tanaman. Pengambilan tanah dilakukan dengan cara penggalian tanah pada kedalaman 10-15 cm dengan menggunakan sekop tangan kecil. Contoh tanah dimasukkan kedalam kantong plastik dan dibawa ke laboratorium untuk diproses. Sebelum prosesing, contoh tanah diayak terlebih dahulu dengan menggunakan ayakan yang berukuran 0.4 mm.
diambil sebanyak 10g, dilarutkan dalam 90 ml akuades steril yang telah diberi 0.05% Tween 80 dan divorteks selama 2 menit. Suspensi tanah diencerkan sampai 3 kali dan 0.1 ml suspensi dimasukkan dalam cawan Petri yang telah berisi medium DOC2 untuk isolasi B. bassiana. Cawan Petri diinkubasikan selama 8 hari dan koloni B. bassiana yang ada diisolasi kembali kembali dan dimurnikan pada media SDAY.
Seluruh isolat B. bassiana hasil isolasi dari serangga yang terinfeksi dan dari tanah (Tabel 1 ) ditumbuhkan pada medium Sabouraud dextrose agar dengan
yeast extract (SDAY).
Tabel 1. Isolat B. bassiana dan daerah asal
Isolat Sumber inang Lokasi
BbTPL1 Tanah Cabai Padang Luar (Agam)
BbLoBr1 Leptocorisa oratorius (F.) (Hemiptera: Coreidae)
Bogor
BbHhTK1 Hypothenemus hampei (Ferr.) (Coleoptera: Scolytidae)
Teluk Kecimbung (Sarolangun) BbHhTK9 Hypothenemus hampei (Ferr.)
(Coleoptera: Scolytidae) Teluk Kecimbung(Sarolangun) BbHhKA2 Hypothenemus hampei (Ferr.)
(Coleoptera: Scolytidae)
Kayu Aro (Solok)
BbHhKA12 Hypothenemus hampei (Ferr.) (Coleoptera: Scolytidae)
Kayu Aro (Solok)
BbTKS Tanah Kakao Solok
BbLoDk1 Leptocorisa oratorius (F.) (Hemiptera:
Coreidae) Duku
BbHhM2 Hypothenemus hampei (Ferr.) (Coleoptera: Scolytidae)
Matur (Agam)
BbTMB1 Tanah kopi Matur (Agam)
BbTMA2 Tanah kopi Matur (Agam)
Identifikasi dilakukan secara makroskopis dan mikroskopis. Kunci identifikasi yang digunakan adalah kunci Barnett dan Hunter (1972) dan Poinar dan Thomas (1984).
Penyediaan tanaman bawang daun
Tanaman dipupuk dan pupuk NPK (200kg/ha Urea, 200 kg/ha TSP, 100 kg/ha KCl) dan tanaman tidak disemprot dengan pestisida.
Perbanyakan larva S. exigua
Larva S. exigua dikumpulkan dari pertanaman bawang daun di lapangan dan kemudian dipelihara dalam kotak plastik dan diberi makanan berupa daun bawang yang masih segar. Makanan larva diganti setelah habis atau sudah tidak segar lagi.
Larva-larva tersebut dipelihara sampai membentuk pupa dan imago. Selanjutnya imago-imago yang diperoleh dimasukkan ke dalam kurungan serangga yang telah berisi tanaman bawang daun sebagai tempat peletakkan telur. Sebagai makanan imago digunakan madu dengan konsentrasi 10%. Kelompok telur yang diletakkan dipindahkan ke kotak plastik lain dan dipelihara sampai menetas.
Penyiapan Suspensi Konidia
Seluruh isolat diperbanyak pada media SDAY dalam cawan petri pada suhu 25o C selama 15 hari. Konidia cendawan dipanen dengan cara
menambahkan 5 ml akuades steril dan 0.05% Tween 80 sebagai bahan perata ke dalam cawan Petri dan konidia dilepas dari media dengan kuas halus. Suspensi disaring dan konsentrasi konidia dihitung dengan menggunakan hemositometer.
Skrining isolat B. bassiana
Instar larva S. exigua yang diuji adalah larva instar III yang berumur satu hari. Konsentrasi konidia dari masing-masing isolat yang digunakan adalah108
konidia/ml. Inokulasi cendawan dilaksanakan dengan cara menyemprotkan suspensi konidia pada bagian dorsal tubuh larva dengan menggunakan handsprayer. Kemudian larva diberi makan dengan daun kubis segar. Percobaan diulang empat kali dan setiap satuan percobaan terdiri dari 10 ekor larva. Mortalitas larva diamati setiap hari hingga tujuh hari setelah aplikasi cendawan.
Uji Pengaruh Berbagai Konsentrasi Konidia B. bassiana.
Uji dilakukan menggunakan larva S. exigua instar III. Konsentrasi konidia dari isolat virulen yang digunakan adalah 109, 108, 107, 106 konidia/ml dan 0
(kontrol). Aplikasi konidia pada larva dilakukan dengan cara meneteskan suspensi konidia pada bagian dorsal tubuh larva. Kemudian larva diberi makan dengan daun bawang segar. Uji diulang empat kali dan setiap satuan percobaan terdiri dari 10 ekor larva. Mortalitas larva diamati setiap hari hingga tujuh hari setelah aplikasi B. bassiana.
Percobaan disusun dalam rancangan acak lengkap (RAL) dengan 5 taraf konsentrasi konidia. Data hasil percobaan diolah dengan sidik ragam dan dilanjutkan dengan pengujian nilai tengah menggunakan uji Duncan (DNMRT) pada taraf nyata 5%.
.
Perbanyakan massal B. bassiana
Substrat yang digunakan untuk perbanyakan massal cendawan entomopatogen B. bassiana terpilih adalah substrat padat berupa beras, jagung, dan limbah organik (kulit kentang, kulit ubi jalar, jerami dan ampas tebu).
HASIL DAN PEMBAHASAN
Skrining isolat B. bassiana
Penelitian ini bertujuan untuk memilih isolat B. bassiana yang virulen terhadap larva S. exigua. Hasil penelitian menunjukkan bahwa isolat B. bassiana
yang berasal dari geografi dan sumber yang berbeda mempunyai virulensi yang berbeda nyata terhadap larva S. exigua instar III. Isolat BbHhKA12, BbLoDk1, BbLoBr1, BbTPL1merupakan isolat yang paling virulen dengan rata-rata mortalitas larva S. exigua tertinggi yaitu 95.0 – 100.0% pada pengamatan hari ketujuh setelah aplikasi konidia. Isolat BbTMA2merupakan isolat yang mempunyai kategori virulensi sangat rendah dengan mortalitas 52.5% (Tabel 2). Adanya perbedaan virulensi antar isolat merupakan hal yang sudah umum terjadi pada cendawan entomopatogen.
Tabel 2. Mortalitas larva S. exigua instar III tujuh hari setelah aplikasi 11 isolat B.
bassiana pada konsentrasi 108 konidia/ml.
Isolat Mortalitas (%) ± SD
BbHhKA12 100.0 ± 0.00 a
BbLoDk1 100.0 ± 0.00 a
BbLoBr1 97.5 ± 5.00 a
BbTPL1 95.0 ± 5.77 a
BbTMB1 92.5 ± 15.00 ab
BbHhTK9 90.0± 8.16 ab
BbTKS 87.5 ± 5.00 ab
BbHhTK1 82.5 ± 9.57 ab
BbHhKA2 65.0 ± 5.77 c
BbHhM2 57.5 ± 9.57 cd
BbTMA2 52.5 ± 9.57 d
Kontrol 15.0 ± 5.77 e
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata menurut uji Duncan (DNMRT) pada taraf nyata 5%.
sumber lain. Hasil penelitian beberapa peneliti sebelumnya juga menunjukkan bahwa cendawan entomopatogen B. bassiana yang berasal dari serangga yang sama dengan serangga uji tidak selalu mempunyai patogenisitas yang lebih tinggi terhadap serangga uji, sehingga perlu dilakukan pengujian isolat yang lebih banyak untuk mendapatkan isolat yang lebih virulen (Kreutz et al. 2004). Oleh karena itu dalam program pengendalian hama secara hayati, pemilihan isolat yang akan digunakan harus dilakukan secara hati-hati.
Hasil penelitian ini juga menunjukkan bahwa tidak ada korelasi yang kuat antara virulensi dengan sumber isolat. Daoust dan Roberts (1982) juga melaporkan bahwa tidak ada korelasi antara asal inang dan geografi dari isolat dengan virulensi isolat M. anisopliae terhadap larva Culex pipiens pipiens Linn. (Diptera: Culicidae). Selanjutnya Wang et al. (2004) juga melaporkan hal yang sama dimana virulensi strain V. lecanii tidak berkaitan dengan asal isolat.
Adanya perbedaan virulensi dari 11 isolat B. bassiana yang diuji diduga disebabkan karena adanya perbedaan karakter genetik dan fisiologi antar isolat. Hasil penelitian Trizelia (2005) menunjukkan bahwa perbedaan virulensi antar isolat B. bassiana terhadap larva C. pavonana disebabkan oleh adanya perbedaan karakter fisiologi dan genetik dari isolat.
Perbedaan virulensi antar isolat B. bassiana terhadap larva S. exigua
diduga disebabkan oleh adanya perbedaan karakter fisiologi seperti daya kecambah konidia. Pada umumnya isolat yang virulen mempunyai daya kecambah konidia yang lebih tinggi. Daoust dan Roberts (1982) mengemukakan bahwa adanya perbedaan virulensi antar isolat Metarhizium anisopliae
(Metschnikoff) Sorokin terhadap larva Culex pipiens pipiens Linn. (Diptera: Culicidae) disebabkan oleh adanya perbedaan daya kecambah konidia dari masing-masing isolat. Isolat yang virulen memiliki daya kecambah konidia yang lebih tinggi daripada isolat yang avirulen. Selanjutnya Geden et al. (1995) juga mengemukakan bahwa adanya perbedaan virulensi isolat B. bassiana terhadap
Musca domestica Linn. (Diptera: Muscidae) disebabkan oleh adanya perbedaan
Selain faktor daya kecambah konidia, kemampuan sporulasi juga dapat digunakan sebagai indikator isolat. Isolat yang virulen memiliki kemampuan sporulasi yang lebih baik dibandingkan dengan isolat yang avirulen. Hasil penelitian yang telah dilaporkan oleh beberapa peneliti lain menunjukkan bahwa isolat yang virulen mempunyai kemampuan sporulasi yang lebih tinggi daripada isolat yang avirulen (Devi et al. 2003)
Perbedaan virulensi antar isolat juga dapat disebabkan oleh adanya perbedaan karakteristik pertumbuhan isolat. Isolat yang virulen memiliki pertumbuhan yang lebih padat, lebih tebal dan menghasilkan konidia yang lebih banyak sehingga lebih mudah dipanen dari permukaan media. Geden et al. (1995) mengemukakan bahwa isolat B. bassiana yang virulen terhadap Musca
domestica memiliki pertumbuhan yang lebih cepat, miselianya lebih padat dan
konidia yang dihasilkan lebih tinggi. Isolat yang avirulen tumbuh lebih lambat, sering terkontaminasi oleh bakteri, pertumbuhan miselia lebih tipis dan jumlah konidia yang dihasilkan lebih rendah. Junianto dan Sulystiowati (1994) juga melaporkan bahwa isolat B. bassiana yang memiliki patogenisitas yang tinggi terhadap imago Hypothenemus hampei (Ferr.) (Coleoptera: Scolytidae) memiliki pertumbuhan yang terbaik.
Ukuran konidia juga berhubungan dengan virulensi cendawan entomopatogen terhadap serangga. Hasil penelitian Altre dan Vanderberg (2001b) menunjukkan bahwa virulensi berbagai isolat Paecilomyces fumosoroseus (Wize) Brown and Smith terhadap larva Plutella xylostella L. (Lepidoptera: Plutellidae) dipengaruhi oleh ukuran konidia. Isolat yang mempunyai ukuran konidia lebih kecil, kurang virulen dibandingkan dengan isolat yang ukuran konidianya yang lebih besar. Moslim et al. (1999) juga mengemukakan bahwa spora M. anisopliae
yang berukuran lebih panjang (12-14 m) lebih virulen terhadap larva Oryctes rhinoceros Linn. (Coleoptera: Scarabaeidae) dibandingkan dengan spora yang berukuran lebih pendek (6-8 m).
yang virulen memiliki aktivitas enzim yang lebih tinggi dibandingkan dengan isolat yang avirulen.
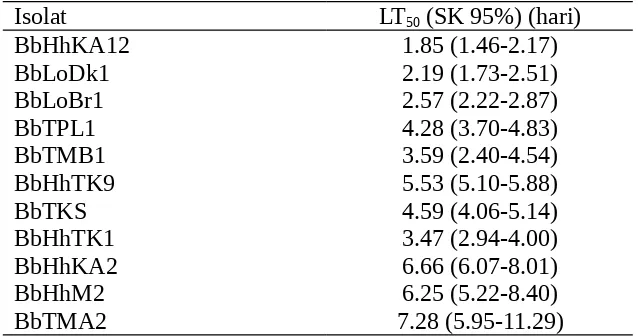
Berdasarkan nilai LT50 terlihat ada perbedaan antar isolat (Tabel 3) dan
perbedaan nilai LT50 berkaitan dengan virulensi isolat. Neves dan Alves (2004)
mengemukakan bahwa waktu kematian serangga dipengaruhi oleh dosis aplikasi dan virulensi dari isolat. Nilai LT50 B. bassiana berkisar antara 1.85 hari – 7.28
hari. Isolat BbHhKA12memiliki nilai LT50 tersingkat dibandingkan dengan isolat
[image:11.595.166.485.333.501.2]lain (1.85 hari) dan hal ini berarti bahwa waktu yang dibutuhkan untuk mematikan 50% larva S. exigua instar III lebih singkat dibandingkan dengan isolat lain.
Tabel 3. Nilai LT50 berbagai isolat B. bassiana.
Isolat LT50 (SK 95%) (hari)
BbHhKA12 1.85 (1.46-2.17)
BbLoDk1 2.19 (1.73-2.51)
BbLoBr1 2.57 (2.22-2.87)
BbTPL1 4.28 (3.70-4.83)
BbTMB1 3.59 (2.40-4.54)
BbHhTK9 5.53 (5.10-5.88)
BbTKS 4.59 (4.06-5.14)
BbHhTK1 3.47 (2.94-4.00)
BbHhKA2 6.66 (6.07-8.01)
BbHhM2 6.25 (5.22-8.40)
BbTMA2 7.28 (5.95-11.29)
Adanya perbedaan nilai LT50 antar isolat B. bassiana juga dilaporkan oleh
Junianto dan Sulistyowati (1994) yang mengemukakan isolat B. bassiana yang virulen terhadap H. hampei (Bb-704) lebih cepat mematikan imago dengan nilai LT50 yang lebih pendek yaitu 4.6 hari daripada isolat yang avirulen (Bb-706) yang
memiliki nilai LT50 7.1 hari. Beberapa peneliti lainnya juga melaporkan bahwa
isolat B. bassiana yang virulen mempunyai nilai LT50 yang lebih singkat
dibandingkan dengan isolat yang avirulen (Cottrell dan Shapiro-Ilan 2003; Samuels dan Coracini 2004).
peningkatan mortalitas larva terjadi setelah tiga hari Hal ini mengindikasikan bahwa B. bassiana memiliki cara kerja yang lambat dalam mematikan larva.
Lebih lamanya waktu kematian serangga S. exigua instar III akibat infeksi
B. bassiana disebabkan oleh cendawan B. bassiana membutuhkan proses
beberapa tahap untuk sampai menginfeksi dan mematikan serangga, yaitu penempelan konidia pada tubuh serangga, perkecambahan, penetrasi, invasi dan kolonisasi dalam hemosul, jaringan dan organ. Waktu untuk masing-masing tahap ini bervariasi tergantung pada jenis cendawan, inang dan lingkungan (Alves 1998. diacu dalam Neves dan Alves 2004). Selanjutnya Neves dan Alves (2004) menambahkan bahwa waktu dari infeksi sampai kematian serangga dipengaruhi oleh dosis aplikasi dan virulensi dari isolat.
Hasil penelitian Neves dan Alves (2004) menunjukkan bahwa penempelan konidia B. bassiana pada kutikula Cornitermes cumulans (Kollar) (Isoptera: Termitidae) terjadi sampai 6 jam setelah aplikasi dan perkecambahan mulai terjadi antara 6 – 12 jam setelah aplikasi. Penetrasi terjadi 12 – 24 jam setelah inokulasi dan kematian serangga terjadi antara 48 – 72 jam setelah inokulasi. Hashim (2000) melaporkan bahwa penempelan dan perkecambahan konidia B. bassiana
pada kutikula larva Crocidolomia binotalis Zell. mulai terjadi 4 – 6 jam setelah aplikasi dan kematian larva terjadi antara 24 – 48 jam setelah inokulasi.
Larva S. exigua instar III yang mati akibat infeksi B. bassiana ditandai dengan adanya miselia atau konidia yang berwarna putih pada permukaan tubuh larva Satu hari setelah serangga mati, miselia yang berwarna putih mulai menembus kutikula keluar dari tubuh serangga, kemudian berkembang terus dan pada akhirnya menutupi seluruh tubuh larva.
Adanya variasi antara isolat B. bassiana dalam kecepatan mematikan serangga juga dilaporkan oleh Kassa et al. (2002) yang mengemukakan bahwa isolat B. bassiana yang berbeda mempunyai kecepatan mematikan yang berbeda terhadap Sitophilus zeamais (Motsch.) (Coleoptera: Curculionidae). Untuk isolat PPRC-HH, kematian awal mulai terjadi pada hari kedua dan pada hari keempat kematian serangga uji telah mencapai 100% sehingga nilai MSTnya (Median
Survival Time) lebih pendek. Untuk isolat lain, mortalitas S. zeamais mulai
Selain dari faktor isolat, adanya variasi waktu kematian serangga juga tergantung pada jenis serangga. Pada imago H. hampei, kematian akibat infeksi
B. bassiana mulai terjadi pada hari keempat setelah aplikasi dan laju mortalitas
meningkat nyata pada hari ke-4 – 8 setelah inokulasi (Junianto dan Sulistyowati 1994), sedangkan pada imago Helopeltis antonii Sign. (Hemiptera: Miridae) yang telah diaplikasi dengan B. bassiana pada konsentrasi 108, kematian mulai terjadi
pada hari ke-4 dan pada hari ke-5 seluruh imago telah mati (Sudarmadji dan Gunawan 1994). Akan tetapi hasil penelitian Yoon et al. (1999) menunjukkan bahwa kematian larva P. xylostella akibat infeksi B. bassiana sudah mulai terjadi satu hari setelah aplikasi dan mortalitas meningkat nyata pada hari kedua dan setelah tiga hari tidak terjadi peningkatan mortalitas yang nyata.
Uji Pengaruh Berbagai Konsentrasi Konidia B. bassiana.
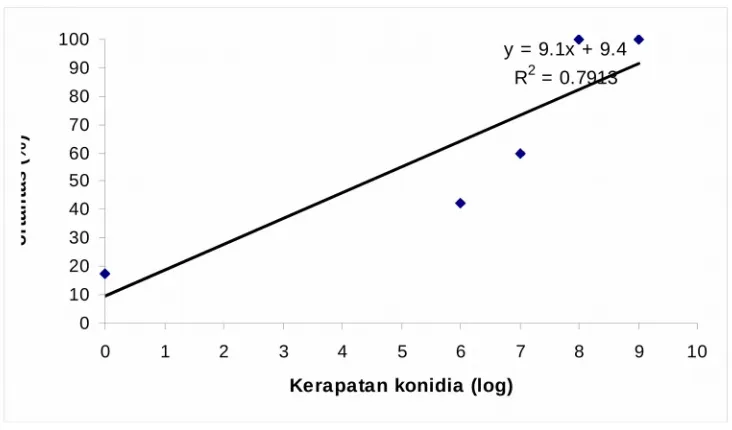
Hasil penelitian menunjukkan bahwa konsentrasi konidia B.bassiana
berpengaruh nyata terhadap mortalitas larva S. exigua instar III. Ada korelasi yang kuat (R2 = 0.7913) antara tingkat kerapatan konidia dengan mortalitas
Mortalitas larva S. exigua meningkat dengan meningkatnya konsentrasi konidia
B.bassiana (Gambar 4). Pada konsentrasi 106 konidia/ml hanya menghasilkan
mortalitas larva sebesar 42.5%, dan mortalitas larva meningkat menjadi 100% pada konsentrasi 108 dan 109 konidia/ml. Hal ini berarti bahwa semakin tinggi
Gambar 1. Rata-rata mortalitas larva S. exigua instar III tujuh hari setelah aplikasi beberapa konsentrasi konidia B. bassiana
Yoon et al. (1999) mengemukakan bahwa peningkatan mortalitas larva P.
xylostella akibat infeksi B. bassiana dengan meningkatnya konsentrasi konidia
disebabkan oleh adanya peningkatan jumlah konidia yang menempel pada tubuh larva dengan meningkatnya konsentrasi. Pada konsentrasi 107 konidia/ml. jumlah
konidia yang menempel pada tubuh larva sekitar 1813.89 konidia sedangkan pada konsentrasi 108 konidia/ml jumlah konidia yang menempel pada tubuh larva
adalah 9861.11 konidia.
Perbanyakan massal B. bassiana pada berbagai substrat
Hasil analisis sidik ragam terhadap sporulasi atau jumlah konidia B.
bassiana pada masing-masing substrat menunjukkan bahwa jenis substrat
[image:15.595.110.514.251.380.2]berpengaruh sangat nyata terhadap jumlah konidia B. bassiana yang dihasilkan (F=79.01; db=6, 21; P<0.0001) (Tabel 4).
Tabel 4. Jumlah konidia B. bassiana yang dihasilkan pada beberapa jenis substrat
Substrat Jumlah konidia/g substrat (x109) SD
Beras 7.10 ± 0.86a
Ampas tebu + kulit kentang 2.89± 0.70b
Ubi jalar + ampas tebu 2.40 ± 0.43bc
Jerami + kulit kentang 2.12 ± 0.23cd
Jagung 1.52 ± 0.15de
Ubi jalar 1.21 ± 0.15e
Kulit kentang 1.05 ± 0.18e
KK=17.97
Pada Tabel 4 dapat dilihat bahwa jenis media perbanyakan sangat berpengaruh nyata terhadap sporulasi B. bassiana. B. bassiana yang diperbanyak pada media beras menghasilkan jumlah konidia tertinggi yaitu 7.10 x 109
konidia/g substrat dan berbeda nyata dengan B. bassiana yang diperbanyak pada substrat lain. B. bassiana yang diperbanyak pada kulit kentang menghasilkan jumlah konidia yang sedikit hanya 1.05 x 109 konidia/g substrat. Hasil penelitian
Wahyunendo (2002) menunjukkan bahwa pada media beras jumlah konidia B.
bassiana yang dihasilkan dapat mencapai 2.4 x 109 konidia/gr substrat setelah
diinkubasikan selama 28 hari.
Substrat yang akan dipilih sebagai media perbanyakan cendawan entomopatogen harus memiliki kemampuan menghasilkan konidia yang tinggi, karena konidia sangat penting untuk infeksi dan pemencaran cendawan. Bidochka
et al. (2000) mengemukakan bahwa cendawan entomopatogen B. bassiana yang
ditumbuhkan pada medium kompleks seperti PDA akan mampu menghasilkan konidia lebih dari 109 konidia/cawan Petri.
yang terdapat pada substrat. Beras memiliki kandungan nutrisi yang lebih tinggi dibandingkan dengan kulit kentang, ampas tebu, kulit ubi jalar atau jerami sehingga mampu menginduksi terjadinya sporulasi. Rayati et al (2001) mengemukakan bahwa perbedaan nutrisi pada substrat sangat mempengaruhi jumlah konidia yang terbentuk.
Hasil penelitian peneliti lain juga menunjukkan bahwa jenis substrat yang digunakan untuk perbanyakan B. bassiana sangat berpengaruh terhadap jumlah konidia yang dihasilkan. Hasil penelitian Nuraida (2007) menunjukkan bahwa B. bassiana yang diperbanyak pada substrat beras menghasilkan jumlah konidia tertinggi (2.75 x 1010 konidia/g) dibandingkan dengan B. bassiana yang
diperbanyak pada substrat jagung (1.65 x 1010 konidia/g). Hasil penelitian Santa
et al (2005) juga menunjukkan bahwa pada substrat campuran kulit kentang dan
ampas tebu (50-50%) mampu menghasilkan konidia B. bassiana sebanyak 3.8 x 109 konidia/gr substrat, lebih tinggi dibandingkan dengan menggunakan kulit
kentang saja atau campuran kulit kentang dengan kulit kopi. Menurut Santa et al (2005) kulit kentang merupakan sumber karbon untuk fermentasi sedangkan ampas tebu mengandung karbohidrat, protein, garam-garam mineral dan vitamin yang dibutuhkan untuk perkembangan cendawan entomopatogen. Menurut Tanada dan Kaya (1993) pembentukan konidia cendawan B. bassiana membutuhkan sumber karbon seperti glukosa, khitin, glukosamin dan zat tepung sedangkan sumber nitrogen diperlukan untuk perkembangan hifa.
Kemampuan cendawan B. bassiana untuk membentuk konidia mempunyai arti yang penting karena konidia merupakan propagul cendawan entomopatogen yang berperan utama untuk pemencaran dan infeksi (Wraight et al. 2001). Apabila sporulasi sedikit, maka pemencaran B. bassiana akan terbatas dan kemampuannya sebagai agens pengendali hayati juga akan berkurang (Junianto dan Sukamto 1995). Menurut Jenkins et al. (1998) jumlah konidia yang dihasilkan pergram substrat oleh cendawan entomopatogen merupakan informasi yang utama yang sangat dibutuhkan untuk perbanyakan massal cendawan yang akan diproduksi sebagai bioinsektisida.
Patogenisitas atau virulensi isolat cendawan entomopatogen B. bassiana
terhadap larva S. exigua sangat bervariasi tergantung pada sumber isolat serta konsentrasi konidia. Isolat BbHhKA12merupakan isolat yang paling virulen, menghasilkan mortalitas larva 100% dengan nilai LT50 yang singkat hanya 1.85
hari dibandingkan dengan isolat lain. Secara umum untuk mendapatkan isolat B.
bassiana yang virulen bisa didapatkan dari serangga yang bukan serangga inang
uji dan dari daerah lain. Semakin tinggi konsentrasi konidia, semakin tinggi mortalitas larva S. exigua. Oleh karena itu dalam pengendalian S. exigua dengan
B. bassiana kedua faktor ini (isolat dan konsentrasi konidia) harus
dipertimbangkan.
Jumlah konidia yang dihasilkan sangat tergantung pada jenis substrat. Beras merupakan substrat yang terbaik untuk perbanyakan massal B. bassiana. Diantara berbagai jenis limbah organik yang digunakan, campuran ampas tebu dan kulit kentang merupakan substrat yang terbaik untuk perbanyakan B.
bassiana dibandingkan dengan jenis limbah lain.
SARAN
Untuk pengembangan B. bassiana sebagai bioinsektisida perlu kajian lebih lanjut tentang formulasi dan uji efektivitasnya pada pertanaman bawang di lapangan.
UCAPAN TERIMA KASIH
Melalui kesempatan ini penulis menyampaikan penghargaan dan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi, Departemen Pendidikan Nasional, sesuai dengan Surat Perjanjian Pelaksanaan Pekerjaan Penelitian Nomor120/H.16/PL/HB.PSN/IV/2009 tanggal 16 April 2009 yang telah membantu pendanaan penelitian ini sehingga penelitian ini dapat berjalan dengan lancar.
DAFTAR PUSTAKA
Barnett HL, Hunter BB. 1972. Illustrated genera of imperfect fungi. Third Edition. Minneapolis: Burges Publishing Company.
Bidochka MJ, Kamp AM, de Croos JNA. 2000. Insect pathogenic fungi: from genes to populations. Di dalam: Kronstad JW, editor. Fungal
Pathology. Netherlands; Kluwer Academic Publishers. Hlm 171-193.
Cottrell TE, Shapiro-Ilan DI. 2003. Susceptibility of a native and an exotic lady beetle (Coleoptera: Coccinellidae) to Beauveria bassiana. J Invertebr
Pathol 84:137-144.
Daoust RA, Roberts DW. 1982. Virulence of natural and insect-passaged strains
of Metarhizium anisopliae to mosquito larvae. J Invertebr Pathol
40:107-117.
Devi PSV, Prasad YG, Chowdary DA, Rao LM, Balakrishnan K. 2003. Identification of virulent isolates of the entomopathogenic fungus
Nomuraea rileyi (F) Samson for management of Helicoverpa armigera
and Spodoptera litura. Mycopathologia 156:365-373
Eken C, G Tozlu, E Dane, S Coruh, E Demirci. 2006. Pathogenicity of
Beauveria bassiana (deuteromycotina:Hyphomycetes) to larvae of the
small poplar longhorn beetle, Saperda populnea
(Coleoptera:Cerambycidae). Mycopathologia 162: 69-71.
Geden CJ, Rutz DA, Steinkraus DC. 1995. Virulence of different isolates and formulations of Beauveria bassiana for house flies and the parasitoid
Muscidifurax raptor. Biol Contr 5:615-621.
Haryono H, Nuraini S, Riyatno. 1993. Prospek penggunaan Beauveria bassiana
untuk pengendalian hama tanaman perkebunan. Di dalam: Simposium Patologi Serangga I. Prosiding Makalah Simposium Patologi Serangga I. Yogyakarta, 12-13 Oktober 1993. Yogyakarta; Persatuan Entomologi Indonesia. hlm. 75-81.
Inglis GD,Duke GM, Kawchuk LM, Goettel MS. 1999. Inluence of oscillating temperatures on the competitive infection and colonization of the migratory grasshopper by Beauveria bassiana and Metarrhizium flavoviridae. Biol Contr 14:111-120.
Jenkins NE, Heviefo G, Langewald J, Cherry AJ, Lomer CJ. 1998. Development of mass production technology for aerial conidia for use as mycopesticides. Biocontr News & Inform 19(1):21N-31N.
JuniantoYD, Sulistyowati E. 1994. Virulence of several Beauveria bassiana
Bals. Vuill. isolates on coffee berry borer (Hypothenemus hampei Ferr.) under various relative humidities. Pelita Perkebunan 10(2):81-86. JuniantoYD, Sukamto S. 1995. Pengaruh suhu dan kelembaban relatif terhadap
perkecambahan, pertumbuhan dan sporulasi beberapa isolat B. bassiana.
Pelita Perkebunan 11(2):64-75.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. Laan PA van der. penerjemah. Jakarta: Ichtiar Baru-Van Hoeve. Revisi dari : De Plagen
van de Cultuurgewassen in Indonesie.
Kassa A, Zimmermann G, Stephan D, Vidal S. 2002. Susceptibility of Sitophilus
zeamais (Motsch.) (Coleoptera: Curculionidae) and Prostephanus
truncates (Horn) (Coleoptera: Bostrichidae) to entomopathogenic fungi
Kreutz J, Vaupel O, Zimmerman G. 2004. Efficacy of Beauveria bassiana (Bals.) Vuill. against the spruce bark beetle, Ips typographus L. in the laboratory under various conditions. JEN 128(6)
doi:10.1111/j.1439-0418.2004.00813. 384-389.
Neves PMOJ, Alves SB. 2004. External events related to the infection process of
Cornitermes cumulans (Kollar) (Isoptera: Termitidae) by the
entomopathogenic fungi Beauveria bassiana and Metarhizium
anisopliae. Neotropical Entomology 33(1):051-056.
Poinar Jr GO dan Thomas GM. 1984. Laboratory Guide to Insect Pathogens and Parasites. New York: Plenum Press. 392 hlm.
Poprowski TJ, Caruthers RI, Speese J, Vacek DC, Wendel LE. 1997. Early-season applications of the fungus Beauveria bassiana and introduction of the Hemipteran predator Perillus bioculatus for control of colorado potato beetle. Biol Contr 10:48-57.
Roberts DW, Yendol WG. 1971. Use of fungi for microbial control of insects. Di dalam: Burges HD dan Hussey NW. Editor. Microbial Control of
Insects and Mites. New York: Academic Press. hlm. 125-149.
Samuels RI, Coracini DLA. 2004. Selection of Beauveria bassiana and
Metarhizium anisopliae isolates for the control of Blissus antillus
(Hemiptera: Lygaeidae). Sci Agric (Piracicaba. Braz) 61(3):271-275. Santa HSD, Santa ORD, Brand D, Vandenberghe LPS dan Soccol CR. 2005.
Spore production of Beauveria bassiana from agro-industrial residues. Braz Arch Biol Technol 48:1-10
Sastrosiswojo S. 1994. Development and implementation of Integrated Pest management in Some Vegetable Crops. Lembang Horticultural Research Institute. 22 hlm.
Shepard M et al. 1997. Prospect for IPM in secondary food crops. Makalah disajikan pada Kongres V dan Simposium Entomologi, Perhimpunan Entomologi Indonesia, Bandung, 24-26 Juni 1997. Bandung. 31 hlm. Shimazu M, Maehara N, Sato H. 2002. Density dynamics of the
entomopathogenic fungus, Beauveria bassiana Vuillemin (Deuteromycotuna: Hyphomycetes) introduced into forest soil, and its influence on other soil microorganisms. Appl Entomol Zool 37(2):263-269.
Sudarmadji D, Gunawan S. 1994. Patogenisitas fungi entomopatogen Beauveria
bassiana terhadap Helopeltis antonii. Menara Perkebunan 62(1):1-5.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego: Academic Press, INC. Harcourt Brace Jovanovich, Publisher.
Trizelia. 2005. Cendawan Entomopatogen Beauveria bassiana (Bals.) Vuill. (Deuteromycotina: Hyphomycetes): Keragaman Genetik, Karakterisasi Fisiologi, dan Virulensinya terhadap Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae). [Disertasi]. Bogor: Institut Pertanian Bogor. Utami KP. 1997. Virus SENPV atasi ulat grayak pada bawang merah. Trubus
337-TH XXVIII-Desember :74-76.
Wahyunendo YD. 2002. Sporulasi cendawan entomopatogen Beauveria
bawah pengaruh suhu dan sinar matahari. [Skripsi]. Bogor: Institut Pertanian Bogor.
Wang L, Huang J, You M, Liu B. 2004. Time-dose-mortality modeling and virulence indices for six strains of Verticillium lecanii against sweetpotato whitefly. Bemisia tabaci (Gennadius). JEN 128(7)
doi:10.1111/j.1439-0418.2004.00879. 494-500.
Willoughby BE, Glare TR, Kettlewell FJ, Nelson TL. 1998. Beauveria bassiana
as a potential biocontrol agent against the clover root weevil. Sitona
lepidus. Di dalam: Proceeding 51 st New Zealand Plant Protection
Conference New Zealand: hlm. 9-15.
Wraight SP et al. 2000. Evaluation of the entomopathogenic fungi Beauveria
bassiana and Paecilomyces fumosoroseus for microbial control of the
silverleaf whitefly, Bemisia argentifolii. Biol Contr 17:203-21.
Wraight SP, Jackson MA, de Kock SL. 2001. Production, stabilization and formulation of fungal biocontrol agents. Di dalam: Butt TM, Jackson C dan Magan N, editor. Fungi as Biocontrol Agents. United Kingdom: CABI Publishing. hlm. 253-287.
Yoon CS, Sung GH, Park HS, Lee SG, Lee JO. 1999. Potential of the entomopathogenic fungus. Beauveria bassiana strain CS-1 as a biological control agent of Plutella xylostella (Lep: Yponomeutidae). J