ABSTRACT
THE EFFICACY OF Beauveria bassiana FROM
GROWTH MEDIUM CONTAINING THREE CARRIER SUBSTANCES ON THE MORTALITY OF Helopeltis spp. (Hemiptera: Miridae)
By
Ni Wayan Ike Puspa Martina(1), Purnomo(2), And Yuyun Fitriana(2)
Helopeltis spp. (Hemiptera: Miridae) is one of the important pests of cocoa. This pest attacks the fruit and cause retardation of fruit development. Several
management methods such as cultural technique, frequently harvesting, sanitation, fruit wrapping and insecticide are reported inefficient and ineffective. Therefore, it needs an alternative method that is more effective for controlling Helopeltis spp. One of the efforts is Beauveria bassiana (white muscardine fungi). The efficacy of B. bassiana to control Helopeltis spp. is depend mainly on the isolate, spore density and growth medium quality. Thus, that in the growth medium needs additional materials that are able to improve the effectiveness of B. bassiana. The research objectives was to investigate the influence of addition of carrier substance (powder of cricket, Hongkong caterpillar, and shrimp shell) to the density and viability of the spore of B. bassiana, and to find out the efficacy of B. bassiana on the mortality of Helopeltis spp. This research was arranged by factorial randomized block design consist of two factors. The first factor was types of carrier substance contain 5 treatments; SDA medium + cricket powder, SDA medium + Hongkong caterpillar powder, SDA medium + shrimp shell powder, insecticide (permetrin), and sterile water as control. The second factor was the concentration of carrier substances in 5 levels; 0; 0,5; 1; 1,5; and 2%, each concentration was repeated three times. Observation was performed on the
mortality of Helopeltis spp. after application. Data obtained were analyzed using analysis of variance (ANOVA), and continued with least significant difference (LSD) test at 5% of significant level. The result showed that growth diameter of
treatments. Furthermore, addition of carrier substance had significantly affected to the density, viability, and mortality of Helopeltis spp. The carrier substance that gave the highest mortality (78.33%) was the cricket powder.
1. Alumni Departement Plant Protection of Agriculture Faculty Lampung University
ABSTRAK
UJI EFIKASI Beauveria bassiana DARI MEDIA PERTUMBUHAN DENGAN TIGA BAHAN PEMBAWA TERHADAP MORTALITAS
Helopeltis spp. (Hemiptera: Miridae)
Oleh
Ni Wayan Ike Puspa Martina(1), Purnomo(2), Dan Yuyun Fitriana(2)
Helopeltis spp. (Hemiptera; Miridae) merupakan salah satu hama yang sangat merugikan bagi tanaman kakao, serangannya dapat menyebabkan buah berhenti berkembang bahkan pada serangan berat menyebabkan buah mati. Kultur teknis, panen sering, sanitasi, penyarungan buah dan penyemprotan insektisida, ternyata kurang efisien dan atau tidak efektif. Oleh karena itu perlu suatu alternatif pengendalian yang lebih efektif dan aman salah satunya dengan pemanfaatan jamur B. bassiana. Keefektifan B. bassiana untuk mengendalikan hama sasaran sangat tergantung pada keragaman jenis isolat, kerapatan spora dan kualitas media pertumbuhannya, sehingga diperlukan bahan tambahan yang dapat meningkatkan faktor -faktor pendukung pertumbuhan B. bassiana yaitu dengan penambahan bahan pembawa. Penelitian ini bertujuan untuk mempelajari pengaruh
penambahan bahan pembawa yaitu tepung jangkrik, ulat hongkong dan kulit udang terhadap kerapatan dan viabilitas (perkecambahan) spora jamur B. bassiana
dan mengetahui pengaruh aplikasi jamur B. bassiana terhadap mortalitas
Helopeltis spp. Penelitian ini mengunakan Rancangan Acak Kelompok Faktorial, yang terdiri dari dua faktor yaitu faktor pertama jenis bahan pembawa yang terdiri dari 5 perlakuan (media SDA + tepung jangkrik, media SDA + tepung ulat
hongkong, media SDA + tepung kulit udang, insektisida (berbahan aktif
permetrin) dan air steril sebagai control). Faktor kedua adalah konsentrasi jenis bahan pembawa yang digunakan terdiri dari 5 taraf yaitu 0; 0,5; 1; 1,5; dan 2%, masing-masing terdiri atas 3 ulangan. Data yang diperoleh merupakan mortalitas
mortalitas Helopelti spp. tepung yang menghasilkan mortalitas tertinggi terdapat pada tepung jangkrik sebesar 78,33%.
UJI EFIKASI Beauveria bassiana DARI MEDIA PERTUMBUHAN DENGAN TIGA BAHAN PEMBAWA TERHADAP MORTALITAS
Helopeltis spp. (Hemiptera : Miridae)
Oleh
Ni Wayan Ike Puspa Martina
Skripsi
Sebagai Salah Satu Syarat untuk Mencapai Gelar SARJANA PERTANIAN
Pada
Jurusan Proteksi Tanaman
Fakultas Pertanian Universitas Lampung
FAKULTAS PERTANIAN UNIVERSITAS LAMPUNG
UJI EFIKASI Beauveria bassiana DARI MEDIA PERTUMBUHAN DENGAN TIGA BAHAN PEMBAWA TERHADAP MORTALITAS
Helopeltis spp. (Hemiptera: Miridae)
Oleh
Ni Wayan Ike Puspa Martina
UNIVERSITAS LAMPUNG BANDAR LAMPUNG
DAFTAR GAMBAR
Gambar Halaman
1. Kakao terserang Helopeltis spp. ... 91
2. Imago Helopeltis spp. ... 91
3. Nimfa Helopeltis spp. stadia 2... 92
4. Rak pembiakan Helopeltis spp. ... 92
5. Tiga jenis suspensi berisi bahan pembawa ... 93
6. Jamur B. bassiana yang ditumbuhkan pada Media SDA berisi bahan pembawa ... 93
7. Spora jamur B. bassiana ... 94
8. Pengambilan jamur B. bassiana untuk aplikasi ... 94
9. Aplikasi terhadap Helopeltis spp. (Penyemprotan terhadap serangga uji) .... 95
10. Helopeltis spp. yang telah diaplikasi. ... 95
11. Pakan alternatif (timun) yang telah terserang Helopeltis spp. ... 96
12. Helopeltis spp. terinfeksi B. bassiana ... 96
A. Di Laboratorium ... 96
B. Di Lapang ... 96
13. Haemocytometer (alat pengukur kerapatan spora) ... 97
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xvi
I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Tujuan Penelitian ... 3
C. Kerangka Pemikiran ... 4
D. Hipotesis ... 6
II. TINJAUAN PUSTAKA ... 7
A. Tanaman Kakao (Theobroma cacao L.) ... 7
1. Syarat Tumbuh ... 8
2. Hama Yang Menyerang ... 8
2.1Hama Penghisap Buah Kakao (Helopeltis spp.) ... 9
2.2Gejala Serangan Penghisap Buah Kakao (Helopeltis spp.) ... 10
B. Pengendalian Hayati ... 11
C. Beauveria bassiana ... 12
D. Konsentrasi spora ... 14
III. BAHAN DAN METODE ... 16
A. Tempat dan Waktu Penelitian ... 16
B. Alat dan Bahan ... 16
C. Metode Penelitian ... 17
D. Pelaksanaan Penelitian ... 20
1. Perbanyakan Helopeltis spp. ... 20
2. Penyiapan Isolat B. bassiana ... 20
3. Pembuatan Bahan Pembawa... 21
4. Penyiapan Media Berisi Bahan Pembawa ... 21
5. Pengujian Diameter Isolat Jamur Entomopatogen ... 22
6. Pengujian Kerapatan dan Viabilitas (Perkecambahan) Spora ... 22
6.1 Perhitungan Kerapatan Spora ... 22
6.2 Perhitungan Viabilitas (Perkecambahan) Spora ... 23
7. Pengujian Virulensi Isolat Entomopatogen Terhadap Serangga Uji Helopeltisspp. ... 23
8. Pengamatan... 24
8.1 Uji Pertumbuhan Isolat Jamur Entomopatogen ... 24
8.2 Pengujian Kerapatan, Viabilitas dan Virulensi ... 24
IV. HASIL DAN PEMBAHASAN ... 25
A. Diameter, Kerapatan Dan Viabilitas Spora ... 25
B. Mortalitas Helopeltis spp. ... 28
V. KESIMPULAN ... 33
DAFTAR PUSTAKA ... 34
DAFTAR PUSTAKA
Ariani, V.N. 2003. Kepadatan Jumlah Konidia Beauveria bassiana (Bals) Vill pada Beberapa Komposisi Media Biakan Menir Beras. Skripsi. Universitas Lampung. Bandar Lampung.
Arifin, A. Z. 2010. Pemanfaatan Jamur Entomopatogen Synnematium sp. dan
Beauveria bassiana untuk Mengendalikan Wereng Pucuk (Sanurus indecora Jacobi) dan Kepik Penghisap (Helopeltis antonii) pada Jambu Mete (Anacardium occidentale). Tersedia di
http://www.scribd.com/doc/12919079/. Diakses tanggal 16 September 2010.
Atmadja, W.R. 2003. Status Helopeltis antonii sebagai Hama pada Beberapa Tanaman Perkebunan dan Pengendaliannya. Jurnal Litbang Pertanian,
22(2), hal 57-63.
Borror, D.J., Charles, A.T., & Norman, F.J. 1992. Pengenalan Pelajaran Serangga. Gadjah Mada University Press, Yogyakarta.
Daud, I.D., Papulung.A, & Mery. 1993. Efektivitas Lima Konsentrasi Suspensi Spora Beauveria bassiana Vuill. terhadap Mortalitas Tiga Instar Larva
Darna catenataSnellen (Lepidoptera: Limacodidae). hlm. 125−134.
Dinas Perkebunan Provinsi Lampung. 2009. Harga Kakao di Lampung Selatan Bertahan. Lampung. http://www.ungkap.com/nasional/355-harga-kakao-di-lampung-selatan-bertahan.html. Diakses tanggal 8 Agustus 2011. Gabriel, P.B dan Riyatno. 1989. Metarhizium anisopliae (Metsch) Sorokin
Taksonomi, Patologi, Produksi dan Aplikasinya. Proyek Pengembangan Perlindungan Tanaman Perkebunan. Direktorat Perlindungan Tanaman Perkebunan. Jakarta 26 hlm.
Herlinda, S., Utama, M. D., Pujiastuti, Y., & Suwandi. 2006. Kerapatan dan Viabilitas Spora Beauveria bassiana (Bals.) Akibat Subkultur dan Pengayaan Media, Serta Virulensinya terhadap larva Plutella Xylostella
James, R.R. 2001. Effect of exogeneous nutrients on conidial germination and virulence against the silverlef whitefly for two hyphomycetes. J. Invertebr. Pathol. (77): 99−107.
James, R.R. & S. Jaronski. 2000. Effect of low viability on infectivity of
Beauveria bassiana conidia toward the silverleaf whitefly. J. Invertebr. Pathol. (76): 227−228.
Kalshoven, L.G.E. 1981. ThePests of Crops in Indonesia. T. Ichtiar Baru – Van Hoeve, Jakarta.
Oka, I. N., 2005. Pengendalian Hama Terpadu dan Implementasinya di Indonesia. Gadjah Mada University Press. Yogyakarta.
Pracaya. 2009. Hama dan Penyakit Tanaman (Edisi Revisi, Seri Agriwawasan). Penebar Swadaya. Jakarta.
Prasasya, A. 2008. Uji Efikasi Jamur Entomopatogen Beauveria bassiana
Balsamo dan Metarhizium anisopliae (Metch.) Sorokin terhadap Mortalitas Larva Phragmatoecia castanae Hubner di Laboratorium. Skripsi.
Universitas Sumatera Utara. Diakses tanggal 16 September 2010.
Purnomo, H. 2010. Pengantar Pengendalian Hayati. Andi offset Yogyakarta. Rukmana dan Saputra, U.U.S. 1997. Hama Tanaman dan Teknik Pengendalian.
Kanisus. Yogyakarta.
Siregar, T.H.S., Riyadi, S., & Nuraeni, L. 2006. Pembudidayaan, Pengolahan, dan Pemasaran Coklat. Penebar Swadaya. Jakarta.
Soetopo, D. & Indrayani, I.G.A.A. 2009. Jamur Entomopatogen Beauveria bassiana : Potensi dan Prospeknya dalam Pengendalian Hama Tungau.
Perspektif 82 :65 - 73.
Soetopo, D. & Indrayani, I.G.A.A. 2007. Status Teknologi dan Prospek Beauveria bassiana untuk Pengendalian Serangga Hama Tanaman Perkebunan yang Ramah Lingkungan. Perspektif 61: 65 - 73.
Sudarmo, S. 1989. Pengendalian Hama dan Penyakit Hama Perkebunan. Kanisus. Yogyakarta.
http://erlanardianarismansyah.wordpress.com/2009/12/13/beauveria-bassiana-dan-metarrhizium-anisopliae-bioinsektisida-ramah-lingkungan/. Diakses tanggal 1 September 2010.
Tohidin, Lisrianto. A.T, & Machdar. B.P. 1993. Daya bunuh jamur
entomopatogen Beauveriabassiana (Balsamo) Vuillemin (Moniliales : Moniliacea) terhadap Leptocoriza acuta Thunberg (Hemiptera: Alydidae) di rumah kaca. hlm. 135−143.
Untung, K. 2001. Pengantar Pengelolaan Hama Terpadu. Gadjah Mada University Press. Yogyakarta.
Wahyono, T.E. & Tarigan, N. 2007. Uji Patogenisitas Agen Hayati Beauveria bassiana dan Metarhizium anisopliae Terhadap Ulat Serdang (Xystrocera festiva). Buletin Teknik Pertanian 12 (1) : 27-29.
I. KESIMPULAN
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan bahwa :
1. Penambahan bahan pembawa terhadap media SDA tidak berpengaruh terhadap pertumbuhan diameter jamur B. bassiana, namun berpengaruh terhadap kerapatan spora, viabilitas (perkecambahan) spora dan virulensi B. bassiana.
2. Kerapatan spora tertinggi sebesar 14,5 x 106 spora/ml pada bahan pembawa tepung jangkrik, juga menghasilkan viabilitas tertinggi sebesar 62,75% dan keduanya menghasilkan virulensi tertinggi sebesar 78,33% terhadap
mortalitas Helopeltis spp..
MENGESAHKAN
1. Tim Penguji
Ketua : Prof. Dr. Ir. Purnomo, M.S. ………..
Sekretaris : Yuyun Fitriana, S.P., M.P. ………
Penguji
Bukan Pembimbing : Ir. Sudi Pramono, M.P. .………...
2. Dekan Fakultas Pertanian
Prof. Dr. Ir. Wan Abbas Zakaria, M.S. NIP 196108261987021001
Judul Skripsi : UJI EFIKASI
Beauveria bassiana
DARI
MEDIA PERTUMBUHAN DENGAN
TIGA BAHAN PEMBAWA
TERHADAP MORTALITAS
Helopeltis
spp. (HEMIPTERA: MIRIDAE)
Nama Mahasiswa : Ni Wayan Ike Puspa Martina
NPM : 0614041009
Jurusan : Proteksi Tanaman
Fakultas : Pertanian
MENYETUJUI
1. Komisi Pembimbing
Prof. Dr. Ir. Purnomo, M.S. Yuyun Fitriana, S. P., M. P. NIP 19640613 1987031002 NIP 198108152008122001
2. Ketua Jurusan
I. METODE PENELITIAN
A. Tempat Dan Waktu Penelitian
Penelitian ini dilaksanakan pada bulan Agustus 2010 sampai dengan November 2011 di Laboratorium Hama Tumbuhan dan Laboratorium Penyakit Tumbuhan, Jurusan Proteksi Tanaman, Fakultas Pertanian, Universitas Lampung.
B. Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah serangga hama
Helopeltis spp., mentimun, media SDA (Sabouraud Dextrose Agar), isolat
Beauveria bassiana, tepung jangkrik(Gryllotalpa americana Pal.) , tepung ulat hongkong (Tenebrio molitor), tepung kulit udang (Penaeus monodon), insektisida, aqua destilata steril, tissue dan alkohol 70%.
C. Metode Penelitian
Penelitian ini terdiri dari dua tahap. Tahap pertama adalah uji pertumbuhan jamur
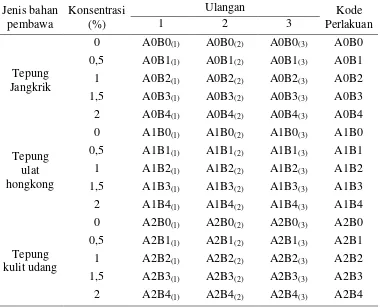
Tabel 1. Perlakuan uji pertumbuhan, kerapatan spora dan viabilitas jamur
Faktor A : A0 = Tepung jangkrik, A1 = Tepung ulat hongkong, A2 = Tepung kulit udang
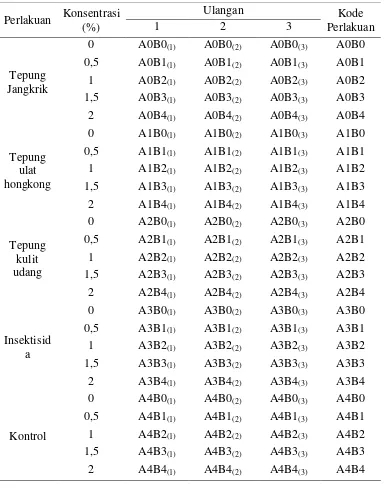
Tabel 2. Perlakuan untuk uji Mortalitas Helopeltis spp.
Secara rinci langkah-langkah penelitian dapat diuraikan sebagai berikut :
1. Perbanyakan Helopeltis spp.
Perbanyakan serangga hama Helopeltis spp. dilakukan dengan menggunakan mentimun sebagai bahan pakan alternatif. Sebagai indukan diambil imago dan nimfa dari lapang yaitu dari Kebun POLINELA dan dari kebun kakao milik petani di daerah Gedongtataan, Lampung Tengah dan di daerah Sidorejo, Lampung Timur. Imago diletakkan di dalam satu stoples plastik berdiameter 16 cm dan tinggi 17 cm yang sudah berisi mentimun yang diletakkan di dinding. Stoples kemudian ditutup dengan kain sippon yang berukuran 30 x 30 cm dan diikat dengan karet gelang. Apabila imago telah memasuki periode bertelur maka mentimun yang sudah berisi telur dipindahkan pada stoples kosong. Setiap stoples dimasukkan 4 – 5 buah mentimun kemudian ditutup kain sippon, diikat dengan karet gelang dan diberi tanggal. Setelah telur menetas, nimfa dipindah ke stoples plastik lain yang sudah berisi mentimun baru dengan menggunakan kuas kecil. Mentimun diganti setiap hari sampai nimfa Helopeltis spp. dapat bartahan hingga menjadi imago dan bertelur. Demikian seterusnya hingga diperoleh jumlah imago yang diinginkan.
2. Penyiapan Isolat B. bassiana
perbanyakan tersebut selanjutnya akan digunakan untuk pengujian lebih lanjut dalam penelitian ini.
3. Pembuatan Bahan Pembawa
Bahan pembawa yang digunakan adalah tepung jangkrik (Gryllotalpa americana
Pal.); tepung ulat hongkong (Tenebrio molitor)dan tepung kulit udang (Penaeus monodon). Bahan pembawa tepung ulat hongkong, tepung jangkrik dan tepung kulit udang diperoleh dengan cara memanaskan masing – masing 100 ekor imago jangkrik dan ulat hongkong hidup serta 100 g kulit udang dengan menggunakan oven pada suhu 100ºC selama 3 jam. Selanjutnya jangkrik, ulat hongkong dan kulit udang tersebut dihaluskan dengan mengunakan blender sehingga menjadi tepung ukuran lolos saringan 1 mm (Herlinda et al., 2006).
4. Penyiapan Media Berisi Bahan Pembawa
Media pertumbuhan yang digunakan dalam penelitian ini adalah media SDA (Sabaoraud Dextrose Agar). Media SDA tersebut kemudian ditambahkan bahan pembawa dengan konsentrasi 0; 0,5; 1; 1,5; dan 2%. Media 0% merupakan media tanpa bahan pembawa. Media 0,5; 1; 1,5; dan 2% dibuat dengan mencampurkan berturut-turut 0,5; 1; 1,5; dan 2% larutan bahan pembawa dari 30 g bahan
5. Pengujian Kecepatan Pertumbuhan Isolat Jamur B. bassiana Pada Media Berisi Bahan Pembawa
Isolat jamur B. bassiana diambil dengan menggunakan bor gabus (ukuran 10 mm) dan ditumbuhkan pada bagian tengah cawan Petri yang berisi media yang
mengandung bahan pembawa pada tiap-tiap konsentrasi. Setelah itu cawan Petri yang berisi isolat jamur B. bassiana tersebut diinkubasi pada suhu ruang selama 14 hari.
6. Pengujian Kerapatan dan Viabilitas (Perkecambahan) Spora 6.1 Perhitungan Kerapatan Spora
Biakan jamur B. bassiana pada pengujian sebelumnya dipotong dengan
menggunakan bor gabus berukuran 10 mm. Kemudian satu potongan bor gabus dimasukkan ke dalam tabung reaksi steril (ukuran 10 ml) yang berisi 10 ml air steril dan dikocok dengan shaker (kecepatan 470 osilasi/menit) hingga tercampur merata (± 10 menit). Selanjutnya, suspensi tersebut diencerkan hingga 10
-5
.diambil satu bor gabus. Kerapatan spora dihitung dengan menggunakan
haemositometer dengan cara mengambil sebanyak 1 ml suspensi kemudian diteteskan pada haemositometer tersebut dan dihitung kerapatan sporanya di bawah mikroskop binokuler dengan perbesaran 10 x 40 kali.
Kerapatan spora dihitung dengan mengunakan rumus Gabriel dan Riyatno (1989)
Keterangan:
C : kerapatan spora per ml larutan
t : jumlah total spora dalam kotak sampel yang diamati d : tingkat pengenceran
n : jumlah kotak sampel (5 kotak besar x 16 kotak kecil)
0,25 : faktor koreksi penggunaan kotak sampel skala kecil pada haemositometer
106 : konstanta
6.2 Perhitungan Viabilitas (Perkecambahan) Spora
Viabilitas spora dihitung dengan cara menginkubasi suspensi spora (dari suspensi penghitungan kerapatan spora) selama 24 jam. Setelah itu satu tetes suspensi tersebut diteteskan pada kaca preparat dan ditutup dengan gelas penutup, lalu dihitung jumlah spora-spora yang berkecambah dan tidak berkecambah pada bidang pandang di bawah mikroskop dengan perbesaran 400 kali. Perhitungan viabilitas spora dilakukan pada jam ke- 24 setelah inkubasi. Viabilitas spora dihitung dengan rumus Gabriel & Riyatno (1989) sebagai berikut:
%
V : perkecambahan spora
g : jumlah spora yang berkecambah u : jumlah spora yang tidak berkecambah
7. Pengujian Virulensi Isolat Jamur B. bassiana Terhadap Serangga Uji
Helopeltis spp.
dengan 100 ml aquades dan diaduk hingga spora tercampur dengan aquades. Suspensi tersebut disemprotkan pada 20 ekor serangga uji sebanyak 20 ml. Kemudian imago tersebut dipelihara dalam satu stoples yang ditutup kain kasa dan diberi pakan timun. Parameter virulensi yang diamati adalah mortalitas imago. Pengamatan dilakukan setiap hari selama 7 hari, dan sampai imago mati. Mortalitas imago dihitung berdasarkan rumus Prijono (1989 dalam Herlinda 2006), sebagai berikut:
PI : Persentase infeksi
a : jumlah serangga mati terinfeksi b : jumlah serangga yang diuji
8. Pengamatan
8.1Uji Pertumbuhan Isolat Jamur B. bassiana
Pengamatan dilakukan setiap minggu terhadap diameter jamur yang tumbuh dari tiap-tiap konsentrasi. Data diameter yang didapat merupakan rata-rata 3 kali pengukuran diameter jamur yang tumbuh.
8.2Pengujian Kerapatan, Viabilitas (Perkecambahan) Spora Dan Virulensi
Yad-yad acarati sresthas, Tat-tat evetaro janah Sa yat pramanam kurute, Lokas tad anuvartate
“Apapun juga kebiasaan yang baik itu dilakukan, orang lain juga akan mengikutinya.
Teladan apapun yang dilakukannya, dunia akan mengikutinya”
Bgvdgta (III.21)
”Mulai” ad
alah kata yang penuh kekuatan, cara terbaik untuk
menyele
saikan sesuatu adalah, “mulai”, t
api juga
mengherankan, pekerjaan apa yang dapat kita selesaikan
kalau kita hanya memulainya
(Clifford Warren)
Kegagalan biasanya merupakan langkah awal
menuju sukses, tapi sukses itu sendiri sesungguhnya
baru merupakan jalan tak berketentuan menuju
puncak sukses
I. PENDAHULUAN
A. Latar Belakang
Provinsi Lampung merupakan daerah potensial untuk pengembangan komoditas kakao karena sumber daya alam dan kondisi sosial budaya yang mendukung serta luas areal kakao yang cenderung mengalami peningkatan. Berdasarkan data dari Dinas Perkebunan Provinsi Lampung, pada tahun 2009 luas perkebunan kakao 38.865 ha dengan rincian 35.667 ha perkebunan rakyat dan 3198 ha perkebunan swasta. Sementara produktivitasnya mencapai 25.663 ton/tahun terdiri atas 21.662 ton/tahun dari perkebunan rakyat dan 4.001 ton/tahun perkebunan swasta (Dinas Perkebunan Provinsi Lampung, 2011).
Berbeda dengan luas lahannya yang semakin bertambah, produktivitas kakao justru cenderung menurun dari tahun ke tahun. Penurunan produksi tanaman kakao disebabkan oleh banyak faktor diantaranya masalah hama dan penyakit tanaman. Hama yang menyerang tanaman kakao diantaranya adalah penggerek
buah kakao(Conopomorpha cramerella) (Lepidopdera; Gracillariidae), penggerek batang/cabang kakao (Zeuzera coffeae dan Zeuzera roricyanea)
Helopeltis spp. merupakan salah satu serangga hama yang sangat merugikan bagi tanaman kakao. Hama ini menyebabkan kerugian besar apabila menyerang buah – buah muda. Serangannya dapat menyebabkan buah berhenti berkembang bahkan pada serangan berat menyebabkan buah kering (Sudarmo, 1989).
Helopeltis spp. menyerang pada stadia nimfa dan dewasa, dengan menusukkan bagian mulutnya yang bentuknya seperti tabung kedalam jaringan daun, batang, buah yang berwarna hijau dan lunak untuk menghisap cairan buah. Sebelum melakukan aktivitas makan baik nimfa maupun serangga dewasa terlebih dahulu memasukkan ludah yang meracuni sel-sel tanaman. Mula-mula tampak adanya cairan berwarna tua di sekitar tusukan dan berubah menjadi berwarna coklat muda (Pracaya, 2009).
Beberapa teknik pengendalian telah direkomendasikan untuk mengendalikan
Helopeltis spp., diantaranya secara mekanik dengan penangkapan serangga hama, pemangkasan tunas-tunas muda atau ranting-ranting agar tanaman tidak rimbun karena Helopeltis menyenangi tempat yang terlindung dari matahari, tidak
menanam tanaman yang disenangi Helopeltis secara berdekatan misalnya tanaman mentimun, dan secara kimiawi (Sudarmo, 1989).
semut gramang karena semut dapat berperan sebagai predator bagi Helopeltis spp. serta dengan kepinding buas sebagai pemangsa Helopeltis muda (Untung, 2001). Selain penggunaan predator dan parasitoid sebagai musuh alami, penggunaan jamur entomopatogen juga memiliki potensi yang cukup baik dalam pengendalian
Helopeltis spp. (Atmadja, 2003). Saat ini telah diteliti lebih dari 750 spesies jamur penyebab penyakit pada serangga (jamur entomopatogen). Beberapa spesies jamur entomopatogen layak dipertimbangkan sebagai agen pengendali hayati, diantaranya adalah Beauveria bassiana, Metarhizium anisopliae, Cordyceps, dan Hirsutella sp. (Wahyono, 2007).
Jamur B. bassiana merupakan salah satu spesies jamur entomopatogen yang telah memperoleh perhatian besar dan telah dimanfaatkan untuk pengendalian serangga hama pada berbagai komoditas tanaman, karena jamur ini mempunyai daya bunuh yang tinggi terhadap berbagai jenis serangga hama, mudah diperbanyak dan tidak bersifat toksik terhadap vertebrata(Suriarti, 2009).
B. Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Mempelajari pengaruh penambahan bahan pembawa yaitu tepung
jangkrik, ulat hongkong dan kulit udang terhadap kerapatan dan viabilitas (perkecambahan) spora jamur Beauveria bassiana
2. Mengetahui pengaruh aplikasi jamur B. bassiana dengan penambahan bahan tepung jangkrik, ulat hongkong dan kulit udang terhadap mortalitas
C. Kerangka Pemikiran
Saat ini penggunaan insektisida kimia masih menjadi andalan untuk
mengendalikan serangga hama. Penggunaan insektisida kimia secara berkala dalam kurun waktu tertentu dapat menyebabkan resistensi dan resurgensi hama sasaran, keracunan bagi petani, terbunuhnya serangga-serangga berguna, pencemaran lingkungan dan residu pestisida dalam produk perkebunan (Oka, 1995).
Pertanian berkelanjutan pada abad 21 akan lebih mengedepankan alternatif pengelolaan serangga hama yang ramah lingkungan dan meminimalkan kontak antara manusia dan insektisida kimia (Soetopo & Indrayani, 2007). Salah satu alternatif pengendalian yang banyak dikembangkan adalah penggunaan patogen serangga (entomopatogen), khususnya jamur entomopatogen B. bassiana
(Soetopo & Indrayani, 2009).
B. bassiana merupakan jamur entomopatogen yang memiliki potensi sebagai insektisida mikrobial karena bersifat parasit pada serangga, dapat tumbuh pada media buatan, mudah diproduksi secara massal, serta memiliki kisaran inang yang luas (Purnomo, 2010). Suriarti (2009),melaporkan bahwajamur B.
Keefektifan B. bassiana untuk mengendalikan hama sasaran sangat tergantung pada keragaman jenis isolat, kerapatan spora, kualitas media tumbuh, jenis hama yang dikendalikan, umur stadia hama, waktu aplikasi, frekuensi aplikasi, dan faktor lingkungan meliputi sinar ultra violet, curah hujan, dan kelembaban (Tanada & Kaya, 1993 dalam Ariani, 2003).
Selain itu (Hunt et al., 1984 dalam Arifin, 2010) menyatakan bahwa perkecambahan konidia jamur B. bassiana baik pada integumen serangga maupun pada media buatan umumnya membutuhkan nutrisi tertentu, seperti glukosa, glukosamin, kitin dan nitrogen, terutama untuk pertumbuhan hifa.
Tidak semua spora jamur entomopatogen yang diaplikasikan berhasil mencapai sasaran karena mobilitas serangga yang tinggi terutama hama dari ordo
Homoptera dan Hemiptera, cara aplikasi yang tidak benar serta adanya proses ganti kulit pada serangga. Salah satu upaya untuk mengatasi hal tersebut adalah dengan menambahkan bahan pembawa (carrier) sebagai makanan cadangan (starter) bagi spora sebelum berhasil menginfeksi serangga.
demikian, adanya penambahan zat-zat tersebut dapat menghambat penurunan viabilitas.
Pengembangan lebih lanjut dari potensi jamur entomopatogenik, perlu terus dilakukan dengan mengadakan berbagai penelitian untuk meningkatkan viabilitas dan virulensinya. Percobaan-percobaan di lapangan sangat diperlukan untuk dapat mengevaluasi keefektifannya dan kendala-kendala yang timbul.
D. Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Media pertumbuhan jamur B. bassiana yang mengandung bahan pembawa tepung jangkrik, tepung ulat hongkong dan tepung kulit udang mempunyai kemampuan tumbuh, tingkat kerapatan spora, viabilitas spora, dan virulensi yang berbeda terhadap Helopeltis spp.
Dengan rasa syukur kepada Hyang Widhi Wasa
Ku persembahkan karya ini sebagai tanda cinta dan kasihku
kepada :
Bapak Nyoman Mertha Yasa dan Ibu Wayan Mertha Sari,
adik-adik (Ni Made Riya Novi Antari, Ni Nyoman Sujatining
Manah, Ni Ketut Mega Sari Dewi, I Putu Fernanda Putra
Adisanem dan I Nengah Scorsad Suargaloka Nanta) yang
selalu mendo’akan dan memberi semangat, s
erta kasih
RIWAYAT HIDUP
Penulis dilahirkan di Kecamatan Sekampung Udik, Kabupaten Lampung Timur, pada tanggal 22 Maret 1988, sebagai anak pertama dari enam bersaudara, dari pasangan Bapak Nyoman Mertha Yasa dan Ibu Wayan Mertha Sari.
Penulis menyelesaikan Pendidikan Taman Kanak-kanak di TK Aisyah Bustanul Alfa pada tahun 1994, Sekolah Dasar di SD Negeri 1 Bauh Gunung Sari pada tahun 2000, Sekolah Lanjutan Tingkat Pertama di SLTP Negeri 23 Bandar
Lampung pada tahun 2003, dan Sekolah Menengah Atas di SMA Negeri 1 Bandar Lampung pada tahun 2006.
Pada tahun 2006, penulis terdaftar sebagai mahasiswa Jurusan Proteksi Tanaman Fakultas Pertanian Universitas Lampung melalui jalur Penelusuran Kemampuan Akademik dan Bakat (PKAB). Penulis aktif dalam organisasi internal kampus, pernah menjabat menjadi Bendahara Unit Pelaksana Teknis Klinik Tanaman Himaprotekta tahun 2007 – 2008.
Pada tahun 2007 penulis pernah mengikuti kegiatan Latihan Kepemimpinan Manajemen Mahasiswa Tingkat Dasar (LKMM-TD) dengan tema “Optimalisasi
SANWACANA
Puji syukur penulis panjatkan kepada Hyang Widhi Wasa yang telah memberikan kemudahan kepada penulis untuk menyelesaikan skripsi ini yang berjudul Uji Efikasi Beauveria bassiana Dari Media Pertumbuhan Dengan Tiga Bahan
Pembawa Terhadap Mortalitas Helopeltis spp., sebagai salah satu syarat untuk
memperoleh gelar Sarjana di Fakultas Pertanian, Universitas Lampung.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada : 1. Bapak Prof. Dr. Ir. Purnomo, M. S., selaku Pembimbing I yang telah
memberikan, motivasi, bimbingan, waktu, tenaga, gagasan dan kepercayaan selama penulis merencanakan, melaksanakan penelitian, menganalisis data dan menyelesaikan skripsi.
2. Ibu Yuyun Fitriana, S. P., M. P., selaku Pembimbing II atas bimbingan, petunjuk, dan dukungan yang telah diberikan kepada penulis demi sempurnanya skripsi ini.
3. Bapak Ir. Sudi Pramono, M. P., selaku Penguji atas segala saran dan arahan yang memperkuat substansi skripsi ini.
4. Bapak Ir. Nur Yasin, M.Si., selaku Pembimbing Akademik.
6. Bapak Prof. Dr. Ir. Wan Abbas Zakaria, M.S. selaku Dekan Fakultas Pertanian Universitas Lampung.
7. Kedua orangtua (Bapak Nyoman Mertha Yasa dan Ibu Wayan Mertha Sari), adik-adik (Ni Made Riya Novi Antari, Ni Nyoman Sujatining Manah, Ni Ketut Mega Sari Dewi, I Putu Fernanda Putra Adisanem dan I Nengah Scorsad Suargaloka Nanta) yang selalu mendo’akan dan memberi semangat, serta kasih sayangnya selama ini.
8. Keluarga di Banjit nenekku tercinta (Wayan Mertha), bibiku Nyoman Sribek, Pamanku (Ketut Arnaya, Wayan Ratip dan Komang Gde Astawe) sepupuku Wayan Nick , Wayan Aryandika, Luh Arnita, Made Asmare, Budi dan seluruh keluarga besarku di Banjit, yang selalu memberikan motivasi dan nasihatnya selama ini.
9. Keluarga di Sidorejo yang selalu memberikan motivasi.
10.Lulus Satria Pearl, S.P., yang selalu memberikan kasih sayang, semangat,
bantuan, do’a, dan nasihatnya. Semoga tali silaturrahmi ini terjalin sampai
akhir hayat.
11.Sahabatku, Cicilia Rina Fitriani, Nina Rosliana, Nyoman Dewi, Luh Devi, Nyoman Sutarjana S.T., I. Ketut ike, S.P., Ketut Anom dan Komang Suarjane yang selalu memberikan motivasi, do’a, canda tawa, dan persahabatan yang takkan pernah lekang oleh waktu.
S.P., Chandra Gotama, S.P., Agung Riski Johansyah, Arif Zainuri, Slamet Ruadi, Bezi Astriana, Sri Henny Octavia, Agis Palupi, Novita Sari darwin, Tria Agustina, Widiantoro, Wahyu Susanto, atas persaudaraan, kekompakan, serta semangatnya selama ini.
13.Teman-temanku di Asrama Astrid, Raflesia dan Jayanti, Heni Istcharoh, S.E., Asih Puji Lestari, Reny Aprilia, Merry Kristiani, Alfe, Rifa, Novi, Nina, Cici, Intan, Mulyani, Lina, Epy ningsih, Epy,
14.Kanda dan yundaku angkatan 2000 (Joni Hidayat, S.P.), 2002 (Ketut Arta, S.P.), 2003 (Rommy Meika, dan Ikhsan Supomo, S.P.), 2004 (M. Taufik Akbar, S.P., dan Mahfud Wahyu Saputra, S.P.), 2005 (Juanda Barus, S.P., Aryo Nugroho, S.P., David Darmawan, S.P., Puji Lestari, S.P), 2007 (Siti Juhariah dkk), dan seluruh keluarga besar di HPT.
Bandar Lampung, Penulis,
I. TINJAUAN PUSTAKA
A. Tanaman Kakao (Theobroma cacao L.)
Kakao (Theobroma cacao) merupakan tumbuhan berbentuk pohon yang berasal dari Amerika Selatan. Di alam ketinggian pohonnya dapat mencapai 10 m, namun dalam budidayanya ketinggian tanaman dibuat tidak lebih dari 5 m dengan tajuk menyamping yang meluas. Hal ini dilakukan untuk memperbanyak cabang produktif. Dari biji tumbuhan ini dihasilkan produk olahan yang dikenal sebagai cokelat (Siregar et al., 2006).
Menurut Siregar et al. (2006) tanaman kakao diklasifikasikan sebagai berikut: Kerajaan : Plantae
Divisi : Magnoliophyta Kelas : Magniliopsida Ordo : Malvales Famili : Malvaceae Genus : Theobroma
Spesies : Theobroma cacao
Bunga berukuran kecil, tunggal, namun tampak terangkai karena sering sejumlah bunga muncul dari satu tunas. Jumlah bunga kakao mencapai 5000 sampai 12.000 bunga per pohon per tahun, tetapi jumlah buah matang yang dihasilkan sekitar 1%. Buah kakao berupa buah buni yang daging bijinya lunak dan ketebalan kulit buah mencapai 1 – 2 cm (Siregar et al., 2006).
1. Syarat Tumbuh
Sejumlah faktor iklim turut serta berpengaruh terhadap perkembangan tanaman kakao, seperti curah hujan, temperatur, dan sinar matahari. Tanaman kakao tumbuh dengan baik pada areal dengan curah hujan 1100 – 3000 mm per tahun dan temperatur maksimum 30 – 32 ºC dan minimun 18 – 21º C. Tanaman kakao merupakan tanaman yang biasa hidup di hutan sehingga dalam perkembangannya membutuhkan naungan untuk mengurangi pencahayaan penuh (Siregar et al., 2006).
2. Hama yang Menyerang
Hama yang sering menyerang tanaman kakao antara lain adalah belalang (Valanga nigricornis), ulat jengkal (Hypsidra talaka Walker), kutu putih (Planoccos lilaci), penghisap buah (Helopeltis spp.), dan penggerek batang
2.1 Hama Penghisap Buah Kakao (Helopeltis spp.)
Menurut Borror (1992), hama penghisap buah kakao diklasifikasikan sebagai berikut :
Telur Helopeltis spp. berwarna putih dengan panjang 1,5 – 2,0 mm, bentuknya seperti tabung gas, tetapi sedikit bengkok dengan penutup bulat dan terdapat dua rambut pada satu ujung. Telur dimasukkan satu-satu dalam jaringan tanaman yang lunak dan hanya rambutnya saja yang terlihat dari luar. Umumnya telur diletakkan pada tangkai daun atau urat-urat daun yang besar. Setiap ekor serangga betina mampu meletakkan telur rata-rata 18 butir. Telur akan menetas setelah 4 – 5 hari tergantung temperatur (Kalshoven, 1981).
cokelat muda, antena berwarna cokelat tua, tonjolan pada thoraks mulai terlihat. Nimfa instar ketiga tubuh berwarna cokelat muda, antena berwarna cokelat tua, tonjolan pada thoraks terlihat jelas dan bakal sayap mulai terlihat. Untuk nimfa instar keempat dan kelima memiliki ciri yang sama (Atmadja, 2003).
Serangga dewasa memiliki panjang tubuh sekitar 7 – 9 mm dan lebar 2 mm serta memiliki kaki dan antena yang sangat panjang dengan warna tubuh bermacam-macam ada yang hitam, merah, orange, kuning dan hijau. Betina dewasa mampu bertahan hidup 7 – 16 hari sedangkan jantan dewasa mampu bertahan hidup selama 6 – 37 hari (Atmadja, 2003). Serangga betina dewasa mampu menghasilkan telur berkisar antara 30 – 60 butir dalam satu siklus hidupnya, bahkan beberapa jenis (spesies) ada yang menghasilkan sampai 500 butir telur (Atmadja, 2003).
1. Gejala Serangan
Nimfa dewasa merusak dengan cara menusukkan bagian mulutnya yang
B. Pengendalian Hayati
Pengendalian hayati adalah pengendalian semua makhluk hidup yang dianggap sebagai OPT (Organisme Pengganggu Tumbuhan) dengan cara memanfaatkan musuh alami, memanipulasi inang, lingkungan atau musuh alami itu sendiri. Pengendalian hayati bersifat ekologis dan berkelanjutan. Ekologis berarti pengendalian hayati harus dilakukan melalui pengelolaan ekosistem pertanian secara efisien dengan sedikit mungkin mendatangkan akibat samping negatif bagi lingkungan hidup. Sedangkan berkelanjutan dapat diartikan sebagai kemampuan untuk bertahan dan menjaga upaya agar tidak merosot atau menjaga agar suatu upaya terus berlangsung (Purnomo, 2010).
Pengendalian hayati memiliki arti khusus, karena pada umumnya beresiko kecil, tidak mengakibatkan resurgensi, tidak membahayakan kesehatan manusia maupun lingkungan dan tidak memerlukan banyak input luar. Pengendalian ini secara terpadu diharapkan dapat menciptakan kondisi yang tidak mendukung bagi kehidupan organisme penyebab penyakit atau mengganggu siklus hidupnya. Beberapa mikroorganisme entomopatogen baik bakteri, jamur maupun virus, dapat digunakan untuk mengendalikan populasi hama serta terbukti aman bagi parasitoid dan predator (Untung, 2001).
Serangga yang terinfeksi biasanya akan berhenti makan sehingga menyebabkan imunitasnya menurun, 3 – 5 hari kemudian mati dengan ditandai adanya
pertumbuhan konidia pada integumen.
C. Beauveria bassiana
Jamur entomopatogen penyebab penyakit pada serangga ini pertama kali
ditemukan oleh Agostino bassi di Beauce (Perancis), yang kemudian mengujinya pada ulat sutera Bombyx mori. Penelitian tersebut bukan saja sebagai penemuan penyakit pertama pada serangga, tetapi juga yang pertama untuk binatang. Sebagai penghormatan kepada Agostino Bassi, jamur ini kemudian diberi nama
Beauveria bassiana (Soetopo & Indrayani, 2007).
Menurut Barnett (1960) dalam A. Prasasya (2008), B. bassiana dapat diklasifikasikan sebagai berikut :
Kerajaan : Plantae
Divisi : Amastigomycota Sub Divisi : Deutromycotina Kelas : Deutromycetes Ordo : Moniliales Famili : Moniliaceae Genus : Beauveria
Spesies : Beauveria bassiana
spora jamur ini ternyata tumbuh berkelompok, sehingga berupa bola-bola spora (McCoy et al., 1988 dalam Ariani, 2003).
B. bassiana juga dikenal sebagai penyakit white muscardine karena miselia dan konidia (spora) yang dihasilkan berwarna putih. Bentuknya spora oval, dan tumbuh secara zig zag pada konidiofornya dan biasanya cukup kelihatan pada badan inangnya. Jamur ini memiliki kisaran inang serangga yang sangat luas, meliputi ordo Lepidoptera, Coleoptera, dan Hemiptera. Selain itu, infeksinya juga sering ditemukan pada serangga-serangga Diptera maupun Hymenoptera (McCoy
et al., 1988dalam Ariani, 2003).
B. bassiana masuk kedalam tubuh serangga melalui penetrasi di ruas tubuh serangga. Spora jamur B. bassiana masuk ke tubuh serangga inang melalui kulit, saluran pencernaan, spirakel dan lubang lainnya. Selain itu inokulum jamur yang menempel pada tubuh serangga inang dapat berkecambah dan berkembang membentuk tabung kecambah, kemudian masuk menembus kutikula tubuh serangga. Penembusan dilakukan secara mekanis dan atau kimiawi dengan mengeluarkan enzim atau toksin. Jamur ini selanjutnya akan mengeluarkan racun
B. bassiana memproduksi toksin yang disebut beauvericin. Antibiotik ini dapat menyebabkan gangguan pada fungsi hemolimfa dan nukleus serangga, sehingga mengakibatkan pembengkakan yang disertai pengerasan pada serangga yang terinfeksi. Selain secara kontak, B. bassiana juga dapat menginfeksi serangga melalui inokulasi atau kontaminasi (Arifin, 2010).
D. Konsentrasi Spora
Keberhasilan pengendalian hama dengan jamur entomopatogen juga ditentukan oleh konsentrasi jamur yang diaplikasikan (Hall 1980), yaitu kerapatan spora dalam setiap mililiter air. Jumlah spora berkaitan dengan banyaknya biakan jamur yang dibutuhkan setiap hektar. Kerapatan spora yang dibutuhkan untuk
mengendalikan hama bergantung pada jenis dan populasi hama yang akan dikendalikan (Tohidin et al., 1993; Wikardi, 1993).
Pada tanaman pangan, kerapatan spora yang dibutuhkan lebih tinggi dibandingkan dengan pada tanaman perkebunan. Untuk mengendalikan hama ulat daun kelapa sawit (Darna catenata) hanya dibutuhkan kerapatan spora B. bassiana 39,90 x 106/ml untuk mencapai mortalitas 100% (Daud et al., 1993).
E. Penambahan Bahan Pembawa
Tidak semua spora jamur entomopatogen yang diaplikasikan berhasil mencapai sasaran karena mobilitas serangga yang tinggi terutama hama dari ordo
dengan menambahkan bahan pembawa (carrier) sebagai makanan cadangan (starter) bagi spora sebelum berhasil menginfeksi serangga. Dengan demikian, spora yang gagal menginfeksi serangga masih dapat bertahan dengan makanan cadangan.
Media SDB (Sabouraud Dextrose Broth) yang diperkaya dengan tepung jangkrik dapat meningkatkan kerapatan dan viabilitas (perkecambahan) spora B. bassiana
(Herlinda, 2006). Kandungan nutrisi media SDB yang diperkaya dengan tepung jangkrik menambah energi yang terdapat di dalam media, berupa khitin dan protein. Kedua zat tersebut merupakan energi yang banyak terdapat pada integument serangga. Dengan demikian, adanya penambahan zat-zat tersebut dapat menghambat penurunan viabilitas.