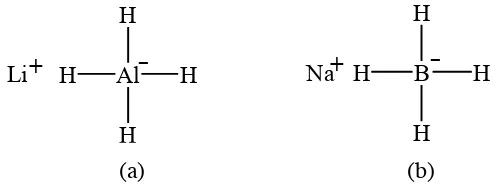SINTESIS SINAMIL BENZOAT MELALUI REAKSI ESTERIFIKASI ANTARA BENZOIL KLORIDA DAN SINAMIL ALKOHOL HASIL
REDUKSI SINAMALDEHIDA
SKRIPSI
Diajukan kepada Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta
untuk memenuhi Sebagian Persyaratan guna Memperoleh Gelar Sarjana Kimia
Oleh:
Maghisya Tri Oktanni 11307144031
PROGRAM STUDI KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS NEGERI YOGYAKARTA
MOTTO
“You will never know that you never try” “Learning by doing”
HALAMAN PERSEMBAHAN
Skripsi ini saya persembahkan untuk :
Kedua orang tua saya, Bapak Anas Yusup dan Ibu Ninik Sumi Rahayu
Kakak-kakak saya, Adi dan Bayu
Kees Vink, Chin Fei Chan, Nikola, Ima, Fahma, Tami, Kiki
KATA PENGANTAR
Puji syukur senantiasa penulis panjatkan ke hadirat Allah SWT atas
karunia, rahmat dan hidayah-Nya, sehingga penulis dapat menyelesaikan
penelitian dan penyusunan tugas akhir skripsi dengan judul “Sintesis Sinamil
Benzoat Melalui Reaksi Esterifikasi Antara Benzoil Klorida dengan Sinamil
Alkohol Hasil Reduksi Sinamaldehida” ini dapat berjalan dengan lancar. Skripsi
ini merupakan salah satu persyaratan memperoleh gelar Sarjana Sains Kimia.
Penulis menyadari bahwa dalam menyelesaikan penyususnan skripsi ini
telah mendapat bimbingan, bantuan dan arahan dari berbagai pihak. Oleh karena
itu penulis menyampaikan ucapan terima kasih kepada :
1. Bapak Dr. Hartono selaku Dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Negeri Yogyakarta,
2. Bapak Jaslin Ikhsan, Ph.D. sebagai Ketua Jurusan Kimia Fakultas
Matematika dan Ilmu Pengetahuan Alam Universitas Negeri Yogyakarta
dan sebagai Ketua Program Studi Kimia yang telah memberikan saran
selama penyusunan tugas akhir skripsi,
3. Ibu C. Budimarwanti, M. Si sebagai dosen pembimbing Tugas Akhir
Skripsi yang telah memberikan banyak bantuan, saran, dan arahan dalam
penyelesaian tugas akhir skripsi,
4. Ibu Prof. Dr. Sri Atun Sebagai dosen penguji I yang telah bersedia
memberikan masukan yang membangun dalam penyelesaian laporan
tugas akhir skripsi,
5. Ibu Dr. Amanatie, M.Pd, M.Si Sebagai dosen penguji II yang telah
bersedia memberikan masukan yang membangun dalam penyelesaian
laporan tugas akhir skripsi,
6. Ibu Sulistyani, M.Si Sebagai sekretaris penguji yang telah bersedia
memberikan masukan yang membangun dalam penulisan laporan tugas
7. Semua pihak yang telah membantu terselesaikanya penyusunan laporan
tugas akhir skripsi ini.
Dengan terbatasnya kemampuan dalam menulis maka penulis menyadari
bahwa laporan tugas akhir skripsi ini masih banyak kekurangan dan masih jauh
dari sempurna, oleh karena itu penulis mengharapkan masukan berupa kritik dan
saran ysng bersifat membangun guna kesempurnaan laporan tugas akhir skripsi
ini.
Akhir kata penulis mengharapkan semoga laporan tugas akhir skripsi ni
dapat berguna dan memberikan manfaat bagi lembaga, fakultas, jurusan,
mahasiswa dan tentunya pembaca yang menginginkan perubahan, Amin.
Penulis
DAFTAR ISI
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERNYATAAN ... iv
MOTTO ... v
HALAMAN PERSEMBAHAN ... vi
KATA PENGANTAR ... vii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
ABSTRAK ... xv
ABSTRACT ... xiv
BAB 1. PENDAHULUAN A. Latar Belakang Masalah ... 1
B. Identifikasi Masalah ... 2
C. Pembatasan Masalah ... 2
D. Perumusan Masalah ... 3
E. Tujuan Penelitian ... 3
F. Manfaat Penelitian ... 3
BAB II. KAJIAN PUSTAKA A. Deskripsi Teori 1. Sinamaldehida ... 4
2. Senyawa Benzoil Klorida ... 5
3. Reaksi Reduksi ... 6
4. Reaksi Esterifikasi ... 8
5. Kromatografi Lapis Tipis (KLT) ... 10
7. Spektroskopi Massa ... 13
B. Penelitian Yang Relevan ... 13
C. Kerangka Berfikir ... 14
BAB III. METODE PENELITIAN
A. Subjek dan Objek Penelitian
1. Subjek Penelitian ... 15
2. Objek Penelitian ... 15
B. Alat dan Bahan
1. Alat Penelitian ... 15
2. Bahan-bahan Penelitian ... 15
C. Prosedur Penelitian
1. Reaksi Reduksi Sinamaldehida Menggunakan Natrium Borohidrida ... 16
2. Analisis Senyawa Hasil Reduksi dengan KLT ... 16
3. Elusidasi Struktur Senyawa Hasil Reduksi Sinamaldehida ... 16
4. Reaksi Esterifikasi Senyawa Hasil Reduksi Sinamaldehida dengan
Benzoil Klorida ... 17
5. Analisis Senyawa Hasil Esterifikasi ... 17
6. Elusidasi Struktur Senyawa Hasil Esterifikasi ... 17
D. Teknik Analisis Data
1. Analisis Kualitatif ... 17
2. Analisis Kuantitatif ... 18
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN
A. Hasil Penelitian
1. Reaksi Reduksi Sinamaldehida
a. Hasil Reduksi Sinamaldehida ... 19
b. Kromatogram KLT Hasil Reduksi Sinamaldehid ... 19
c. Spektrum Senyawa Hasil Reduksi Sinamaldehida Menggunakan
Spektroskopi IR ... 20
d. Kromatogram dan Spektrum Massa Senyawa Hasil Reduksi
Sinamaldehida ... 22
a. Hasil Sintesis Esterifikasi ... 23
b. Kromatogram KLT Hasil Esterifikasi ... 23
c. Spektrum Senyawa Hasil Esterifikasi Menggunakan Spektroskopi IR ... 24
d. Kromatogram dan Spektrum Massa Senyawa Hasil Esterifikasi ... 25
B. PEMBAHASAN 1. Sintesis Senyawa Sinamil Alkohol a. Reduksi Sinamaldehida ... 27
b. Kromatogram KLT Hasil Reduksi Sinamaldehida ... 29
c. Spektrum IR Senyawa Sinamaldehida dan Senyawa Hasil Reduksi Sinamaldehida ... 29
d. Kromatogram dan Spektrum Massa Senyawa Hasil Reduksi Sinamaldehida ... 30
2. Sintesis Sinamil Benzoat a. Esterifikasi Sinamil Alkohol dan Benzoil Klorida ... 34
b. Kromatogram KLT Senyawa Hasil Esterifikasi ... 36
c. Spektrum IR Senyawa Hasil Esterifikasi ... 37
d. Kromatogram dan Spektrum Massa Senyawa Hasil Esterifikasi ... 37
BAB V. KESIMPULAN DAN SARAN A. Kesimpulan ... 41
B. Saran ... 41
DAFTAR PUSTAKA ... 42
DAFTAR TABEL
Tabel 1. Daerah Serapan Gugus Fungsi Utama Pada Spektroskopi Infra
Merah ... 12
Tabel 2. Data Hasil Reaksi Reduksi Sinamaldehida dengan NaBH4 ... 19
Tabel 3. Daerah Serapan Senyawa Hasil Reduksi Sinamaldehida
Pada Spektrum IR ... 21 Tabel 4. Keterangan Kromatogram GC Senyawa Hasil Reduksi
Sinamaldehida ... 22
Tabel 5. Data Hasil Reaksi Sinamil Alkohol Esterifikasi Antara Sinamil
Alkohol dengan Benzoil Klorida ... 23
Tabel 6. Daerah Serapan Senyawa Hasil Esterifikasi Pada Spektrum IR ... 25
Tabel 7. Keterangan 5 Puncak Tertinggi Kromatogram GC Senyawa
DAFTAR GAMBAR
Gambar 1. Kulit Batang Kayu Manis ... 4
Gambar 2. Struktur Sinamaldehida ... 5
Gambar 3. Struktur Benzoil Klorida ... 5
Gambar 4. Mekanisme Reaksi Subtitusi Nukleofilik Asil Halida ... 6
Gambar 5. Struktur LiAlH4 (a) dan Struktur NaBH4 (b) ... 7
Gambar 6. Reaksi Antara Asam Karboksilat dengan Alkohol ... 9
Gambar 7. Reaksi Antara Alkohol dengan Asil Klorida ... 9
Gambar 8. Reaksi Pembentukan Ester dengan Piridina ... 9
Gambar 9. Reaksi Anhidrida Asam Dengan Alkohol ... 10
Gambar 10. KLT sinamaldehida dan Hasil Reduksi Sinamaldehida ... 19
Gambar 11. Spektrum IR Sinamaldehida ... 20
Gambar 12. Spektrum IR Senyawa Hasil Reduksi ... 21
Gambar 13. Kromatogram GC Senyawa Sinamaldehida ... 22
Gambar 14. Spektrum Massa Puncak Ke-5 Hasil Reduksi ... 23
Gambar 15. KLT Hasil Reduksi Sinamaldehida dan Hasil Esterifikasi ... 24
Gambar 16. Spektrum IR Hasil Esterifikasi ... 25
Gambar 17. Kromatogram GC Senyawa Hasil Esterifikasi ... 26
Gambar 18. Spektrum Massa Puncak Ke-14 Hasil Esterifikasi ... 26
Gambar 19. Prosedur Kerja Reduksi Sinamaldehida ... 48
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan Mol Reaksi Reduksi Sinamaldehida dan
Reaksi Esterifikasi ... 46
Lampiran 2. Perhitungan Rendemen Senyawa Hasil Reaksi Reduksi Sinamaldehida dan Senyawa Hasil Esterifikasi ... 47
Lampiran 3. Diagram Alir Reaksi Reduksi Sinamaldehida ... 48
Lampiran 4. Diagram Alir Reaksi Esterifikasi ... 49
Lampiran 5. Spektrum IR Senyawa Sinamaldehida ... 50
Lampiran 6. Spektrum IR Senyawa Hasil Reaksi Reduksi Sinamaldehida ... 51
Lampiran 7. Spektrum IR Senyawa Hasil Esterifikasi ... 52
Lampiran 8. Kromatogram GC Senyawa Hasil Reduksi Sinamaldehida ... 53
Lampiran 9. Spektrum Massa Puncak ke-5 Senyawa Hasil Reduksi Sinamaldehida ... 54
Lampiran 10. Kromatogram GC Senyawa Hasil Esterifikasi ... 55
Lampiran 11. Spektrum Massa Puncak ke-14 Senyawa Hasil Esterifikasi .. 56
SINTESIS SINAMIL BENZOAT MELALUI REAKSI ESTERIFIKASI ANTARA BENZOIL KLORIDA DAN SINAMIL ALKOHOL HASIL
REDUKSI SINAMALDEHIDA
Oleh :
Maghisya Tri Oktanni NIM 11307144031
Pembimbing: C Budimarwanti, M.Si
ABSTRAK
Penelitian ini bertujuan untuk mensintesis senyawa sinamil benzoat melalui reaksi esterifikasi antara asam asetat dengan sinamil alkohol hasil reduksi sinamaldehida.
Penelitian ini dimulai dengan mereduksi sinamaldehida menjadi sinamil
alkohol menggunakan reduktor NaBH4 pada suhu kamar. Hasil reduksi
sinamaldehida direaksikan dengan benzoil klorida dan piridina pada suhu kamar selama 4 jam. Senyawa hasil reduksi sinamaldehida dan hasil reaksi esterifikasi diidentifikasi dengan menggunakan KLT, Spektrofotometer IR, dan spektrofotometer GC-MS.
Hasil penelitian ini menunjukkan bahwa reduksi sinamaldehida menghasilkan cairan berwarna kuning jerami yang mengandung sinamil alkohol dengan kadar 81,31% dan rendemen 63,94%. Hasil reaksi esterifikasi antara benzoil klorida dan sinamil alkohol menghasilkan cairan cokelat yang mengandung sinamil benzoat dengan kadar 12,44% dan rendemen 5,78%.
SYNTHESIS OF CINNAMYL BENZOATE THROUGH ESTERIFICATION BETWEEN BENZOYL CHLORIDE AND CINNAMYL ALCOHOL FROM REDUCTION PRODUCT OF
CINNAMALDEHYDE
By :
Maghisya Tri Oktanni NIM 11307144031
Supervisor: C Budimarwanti, M.Si
ABSTRACT
The purpose of the experiment was to synthesis cinnamyl benzoate through esterification reaction between benzoyl chloride and cinnamyl alcohol from reduction product of cinnamaldehyde.
This research was started by reducing cinnamaldehyde to cinnamyl
alcohol using NaBH4 reductor at room temperature. Then, the reduction
product of cinnamaldehyde reacted with benzoyl chloride through esterification reaction using pyridine at room temperature for 4 hours. The product of reduction and esterification was characterized by TLC, IR spectrometer, and GC-MS spectrometer.
The result of this research shows that reduction of cinnamladehyde produced yellow liquor that contain cinnamyl alcohol with content 81.31% and 63.94% randemen. The result of esterification reaction between benzoyl chloride and cinnamyl alcohol produce brown liquor that contain cinnamyl benzoate with content 12.44% and 5.78% randemen.
BAB I
PENDAHULUAN
A. Latar Belakang
Minyak atsiri atau yang dikenal sebagai minyak eteris (aetheric oil),
adalah kelompok besar minyak nabati yang merupakan bahan dasar dari
wangi-wangian atau minyak gosok. Dalam perdagangan minyak atsiri dikenal
sebagai bibit minyak wangi (Ruslan Harris, 1987: 1). Indonesia merupakan
salah satu penghasil minyak atsiri terkemuka di dunia. Saat ini Indonesia
telah mengekspor beberapa minyak atsiri antara lain minyak cengkeh, minyak
adas, minyak sereh, minyak pala, minyak kayu manis, dan minyak akar
wangi. Usaha untuk meningkatkan nilai tambah minyak atsiri yaitu dengan
mengisolasi komponen-komponen penyusunnya dan kalau memungkinkan
diubah menjadi turunannya yang lebih berguna (Finnen, 1987:130).
Sinamaldehida merupakan komponen utama minyak kayu manis
(Guenther,1990: 1). Sinamaldehida merupakan senyawa yang memiliki gugus
fungsi aldehida dan alkena terkonjugasi cincin benzena. Penelitian Ping dkk.
(2010) menyebutkan bahwa minyak kayu manis memiliki efek antidiabetes
pada tikus, sedangkan komponen yang terkandung dalam minyak kayu manis
adalah sinamaldehida (42-75%), sinamil asetat, karyofilen, linalool, eugenol.
Sinamaldehida yang terkandung dalam minyak kayu manis bermanfaat
sebagai antidiabetes (Prasetya dan Ngadiwiyana, 2006: 1).
Sinamaldehida memiliki gugus fungsional aldehida, maka dapat
dilakukan reaksi reduksi menggunakan reduktor, misalnya dengan NaBH4
atau dengan LiAlH4 menjadi sinamil alkohol. Terdapat 2 bentuk konformasi
dari struktur sinamaldehida yaitu trans-sinamaldehida dan cis-sinamaldehida
(Egawa, et al., 2003:7 )
Sinamil alkohol merupakan suatu senyawa organik yang memiliki
gugus fungsi –OH dan apabila direaksikan dengan suatu asil halida dengan
bantuan piridina melalui reaksi esterifikasi akan menghasilkan suatu senyawa
esterifikasi antara sinamil alkohol dengan suatu asil halida ini bertujuan untuk
mengikat hasil samping yaitu HCl, supaya tidak bereaksi dengan alkohol.
Reaksi esterifikasi memiliki banyak keunggulan, diantaranya adalah persen
hasil yang didapatkan relatif banyak. Selain itu, prosedur untuk melakukan
reaksi esterifikasi tidak terlalu sulit.
Sinamil benzoat merupakan senyawa antimycotic yang disintesis dari
reaksi esterifikasi antara benzoil klorida dengan sinamil alkohol dengan
bantuan piridina dan hasilnya cairan berwarna oranye yang mempunyai titik
didih 37°C (Tomohide Koga , et al., 1993: 524)
Penelitian bertujuan untuk mensintesis senyawa sinamil alkohol dari
reduksi sinamaldehida dengan menggunakan natrium borohidirda, dan
mensintesis senyawa sinamil benzoat melalui reaksi esterifikasi senyawa
sinamil alkohol hasil reduksi sinamaldehida dengan benzoil klorida. Hasil
reaksi reduksi sinamaldehida dan reaksi esterifikasi yang diperoleh
diidentifikasi dengan KLT, spektroskopi IR, spektroskopi GC-MS.
B. Identifikasi Masalah
Berdasarkan latar belakang yang telah diuraikan, maka dapat
diidentifikasi beberapa maslah sebagai berikut:
1. Sumber senyawa sinamaldehida yang akan direduksi
2. Reduktor yang digunakan untuk mereduksi senyawa sinamaldehida
3. Metode yang digunakan untuk sintesis sinamil benzoat
4. Metode karakterisasi senyawa hasil reduksi sinamaldehida dan senyawa
hasil reaksi esterifikasi.
C. Pembatasan Masalah
Berdasarkan dari identifikasi masalah diatas dilakukan pembatasan
masalah pada penelitian ini, yaitu:
1. Senyawa sinamaldehida yang direduksi adalah sinamaldehida p.a
Merck
2. Reduktor yang digunakan untuk mereduksi senyawa sinamaldehida
3. Metode yang digunakan untuk sintesis sinamil benzoat melalui reaksi
esterifikasi antara sinamil alkohol hasil reduksi sinamaldehida dengan
benzoil klorida
4. Metode analisis instrumentasi yang digunakan adalah KLT,
spektroskopi IR, spektroskopi GC-MS.
D. Perumusan Masalah
Berdasarkan pembatasan masalah diatas, dapat dirumuskan masalah
sebagai berikut:
1. Apakah senyawa sinamil alkohol dapat disintesis melalui reaksi
reduksi sinamaldehida menggunakan NaBH4?
2. Apakah senyawa sinamil benzoat dapat disintesis melalui reaksi
esterifikasi antara benzoil klorida dengan sinamil alkohol hasil reduksi
sinamaldehida?
E. Tujuan Masalah
Berdasarkan rumusan masalah di atas, penelitian ini bertujuan untuk:
1. Mensintesis senyawa sinamil alkohol dari reduksi sinamaldehida
menggunakan NaBH4.
2. Mensintesis senyawa sinamil benzoat melalui reaksi esterifikasi antara
benzoil klorida dengan sinamil alkohol hasil reduksi sinamaldehida.
F. Manfaat Penelitian
Manfaat yang diperoleh dari penelitian ini antara lain :
1. Mempelajari mekanisme reaksi reduksi dan esterifikasi
2. Mengetahui karakter senyawa hasil esterifikasi antara benzoil klorida
BAB II
TINJAUAN PUSTAKA
A. Deskripsi Teori 1. Sinamaldehida
Sinamaldehida adalah komponen utama dalam minyak kayu manis. Di
dunia kedokteran, sinamaldehida diketahui memiliki sifat anti agregasi
platelet dan sebagai vasodilasator secara in vitro. Platelet adalah kolesterol
yang menempel pada pembuluh darah. Agregasi (pengumpulan) platelet
menyebabkan terjadinya aterosklerosis atau lemak mengeras di pembuluh
arteri. Selain itu, minyak kayu manis banyak digunakan dalam industri
makanan, minuman, dan kosmetika sebagai pemberi rasa dan aroma (Smith,
1986).
Gambar 1. Kulit Batang Kayu Manis
(Sumber : http://kayu-manis.com/manfaat-kayu-manis/)
Sinamaldehida terdapat pada kulit kayu manis (Cinnamomum verum)
atau lebih dikenal sebagai kayu manis, ialah sejenis pohon penghasil
rempah-rempah. Sejak abad ke-16, kayu manis telah digunakan sebagai bumbu
masak. Kayu manis merupakan rempah-rempah dalam bentuk kulit kayu yang
biasa dimanfaatkan masyarakat Indonesia dalam kehidupan sehari-hari.
Selain sebagai penambah cita rasa masakan, sejak dulu kayu manis dikenal
punya berbagai khasiat. Bahkan, kayu manis saat ini sudah menjadi bagian
dari bahan baku dalam industri jamu dan kecantikan. Selain itu, kayu manis
(vertigo), masuk angin, diare, perut kembung, muntah-muntah, susah buang
air besar, asma, sariawan, peluruh keringat (diaforetik), peluruh kentut
(karminatif), meningkatkan nafsu makan dan menghilangkan sakit.(Siamala
Munusamy, 2012).
Sinamaldehida merupakan senyawa yang memiliki gugus fungsi
aldehida dan alkena terkonjugasi cincin benzen. Sinamaldehida memiliki 2
bentuk konformasi yaitu trans-sinamaldehida dan cis sinamaldehida.
Kelimpahan relatif dari cis-sinamaldehida sebesar 22% dan
trans-sinamaldehida sebesar 78%. Secara umum struktur dari trans-sinamaldehida dapat
dilihat dalam Gambar 2.
Gambar 2. Struktur Sinamaldehida
2. Senyawa Benzoil Klorida
Benzoil klorida dengan rumus molekul C6H5COCl merupakan salah
satu senyawa turunan asam benzoat. Gugus OH pada asam benzoat diganti
dengan halida Cl (asil klorida). Asil klorida merupakan senyawa yang paling
reaktif diantara senyawa turunan asam karboksilat lainnya (Riswiyanto, 2009:
294). Gambar 3 berikut ini adalah struktur benzoil klorida.
Gambar 3. Struktur Benzoil Klorida
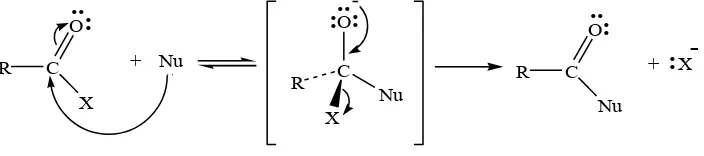
Benzoil klorida merupakan salah satu golongan asil halida. Asil
halida merupakan senyawa yang paling reaktif dan senyawa ini dapat
bereaksi dengan bermacam-macam nukleofil (Sabirin Matsjeh, et. al, 1993:
430). Reaksi dengan asil halida biasanya tidak memerlukan katalis. Reaksi
yaitu adisi nukelofilik pada gugus karbonil kemudian diikuti eliminasi pada
ion klorida (Fessenden dan Fessenden, 1998: 641). Gambar 4 berikut
menggambarkan mekanisme reaksi subtitusi nukleofilik asil halida
R C
O
X
+ Nu
O
C Nu X
R R C
O
Nu
+ X : .. : : .. : .. :
-Gambar 4. Mekanisme Reaksi Subtitusi Nukelofilik Asil Halida
Sifat fisika dan kimia benzoil klorida adalah sebagai berikut (MSDS
Sigma Aldrich & Merck Millipore) :
Bentuk : Cair
Berat molekul : 140,57 g/mol
Titik didih : 197,2 o
C (387 o
F)
Titik beku : -1 oC (30,2 oF)
Tekanan uap : 0,1 kPa (pada20 oC)
Titik leleh : -0,6 oC
Kelarutan dalam air : 20 o
C (penguraian)
Densitas : 1,21 g/cm3 (20 o
C)
3. Reaksi Reduksi
Reduksi senyawa organik umumnya berkaitan dengan bertambahnya
hidrogen atau berkurangnya oksigen (Solomons, 1988: 683). Reaksi reduksi
berlangsung dengan penurunan tingkat bilangan oksidasi dan penangkapan
elektron. Proses reduksi didefinisikan sebagai konversi suatu atom dari
tingkatan oksidasi yang lebih tinggi ke tingkatan oksidasi yang lebih rendah
(Sastrohamidjojo, 2009: 122). Reduksi senyawa aldehida melalui hidrogenasi
katalitik atau dengan hidrida logam akan meghasilkan alkohol primer,
sedangkan reduksi keton akan menghasilkan alkohol sekunder. Alkohol
Dua senyawa hidrida logam yang biasa digunakan adalah litium aluminium
hidrida dan natrium borohidrida (Carey, 2008: 622-626). Reaktifitas litium
aluminium hidrida dan natrium borohidrida sangat berbeda. Gambar 5 berikut
ini adalah struktur litium aluminium hidrida dan natrium borohidrida :
Li H Al
H
H
H
+
-
Na H BH
H
H
+
-(a) (b)
Gambar 5 (a) Struktur LiAlH4 dan (b) Struktur NaBH4
a. Litium Aluminium Hidrida
Reduksi dengan LiAlH4 harus dilakukan dalam larutan anhidrat
(Solomons, 1988:687). LiAlH4 jauh lebih reaktif dibandingkan dengan
NaBH4. Agen pereduksi ini bereaksi hebat dengan air dan alkohol, sehingga
setiap reaksi dengan LiAlH4 tidak boleh melibatkan pelarut air maupun
alkohol (Clark, 2004).
b. Natrium Borohidrida
Natrium borohidrida merupakan agen pereduksi yang lebih lemah
daripada litium aluminium hidrida. Reaksi menggunakan natrium
borohidrida dapat dilakukan pada pelarut air atau alkohol. Untuk mereduksi
aldehida atau keton, dipilih natrium borohidrida karena lebih mudah
penanganannya dan tidak reaktif terhadap air (Fessenden dan Fessenden,
1998: 570). Natrium borohidrida memiliki nama ilmiah natrium boro tetra
hidrida. Senyawa tersebut merupakan padatan berwarna putih, tidak berbau,
bersifat basa (pH=11) dengan berat jenis 1,07 g/cm3
(Merck milipore,
2012).
Reaksi yang terjadi ketika aldehida direduksi dengan NaBH4 secara
keseluruhan adalah
langkah kunci dalam reduksi senyawa karbonil baik menggunakan LiAlH4
maupun NaBH4 adalah transfer ion hidrida dari logam ke karbon karbonil.
Ion hidrida ini bertindak sebagian nukleofil (Solomons, 1988: 687).
Berikut ini mekanisme reaksi yang terjadi (James, 2015):
1. Langkah pertama adalah penyerangan karbonil aldehida oleh ion
hidrida.
H O
H B
H
H
H H
O
H
+ Na+ + BH3 Na+
:
..
: :
..
-2. Langkah kedua adalah penambahan asam, oksigen terprotonasi untuk
membentuk alkohol primer netral. Ion hidrogen sebenarnya melekat pada
molekul air sebagai H3O
+
.
H O
H
: :
..
-H2O H
+
H OH
H + H2O
4. Reaksi Esterifikasi
Ester adalah suatu senyawa yang mengandung gugus –COOR dengan
R dapat berbentuk aril maupul alkil. Suatu ester dapat dibentuk dengan reaksi
esterifikasi berkatalis asam (Riswiyanto, 2009). Reaksi esterifikasi dapat di
golongkan menjadi 3 yaitu :
a. Reaksi antara asam karboksilat dengan suatu alkohol
Reaksi antara asam karboksilat dengan alkohol ini menggunakan katalis
asam untuk membentuk suatu ester (Fessenden dan Fessenden, 1988: 87).
R C O
OH + R
'
OH R C + H2OO
OR
'
Ester
Asam Karboksilat Alkohol
Gambar 6. Reaksi Antara Asam Karboksilat Dengan Alkohol
Laju esterifikasi suatu asam karboksilat bergantung pada halangan
sterik dalam alkohol dan asam karboksilatnya. Kuat asam dari asam
karboksilat hanya memainkan peranan kecil dalam laju pembentukan ester
(Fessenden dan Fessenden, 1982).
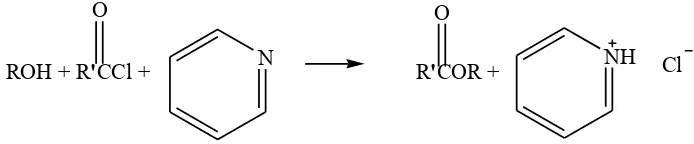
b. Reaksi antara asil klorida dengan suatu alkohol
Reaksi antara klorida asam dengan alkohol dikenal dengan nama
alkoholis. Reaksi esterifikasi klorida asam dengan alkohol sangat dipengaruhi
oleh hambatan ruang (sterik hinderence). Urutan kereaktivitasan alkohol
dalam reaksi esterifikasi alkohol dengan klorida asam adalah alkohol 1o>
alkohol 2o
> alkohol 3o
(Riswiyanto, 2009: 295). Gambar 7 adalah reaksi
antara alkohol dan asil klorida dengan piridina.
ROH + R'CCl + N R'COR + NH Cl
O O
Gambar 7. Reaksi Antara Alkohol Dengan Asil Klorida
Gambar 8 adalah mekanisme reaksi pembentukan ester menggunakan
piridina. R C Cl Cl + R-OH R' C OR O Cl
R' C OR
O
+ H Cl N
C O
R' OR +
N H Cl .. : .. .. : .. .. ..
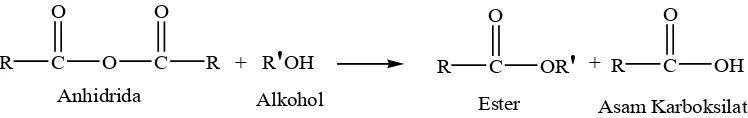
c. Reaksi antara suatu anhidrida asam dengan alkohol
Reaksi dengan anhidrida asam berlangsung lebih lambat dibandingkan
reaksi dengan asil klorida dan biasanya campuran reaksi yang terbentuk perlu
dipanaskan (Fessenden dan Fessenden, 1982). Berikut ini adalah reaksi
antara suatu anhidrida asam dengan alkohol.
R C
O
O C
O
R + R
'
OH R CO
OR
'
R CO
OH
Anhidrida Alkohol Ester
Asam Karboksilat +
Gambar 9. Reaksi Anhidrida Asam Dengan Alkohol
5. Kromatografi lapis Tipis (KLT)
Kromatografi lapis tipis (KLT) merupakan salah satu jenis
kromatografi analitik, KLT sering digunakan untuk identifikasi awal, karena
keuntungan menggunakan KLT yaitu murah dan sederahana. (Khopkar,
2008:164). Kromatografi lapis tipis dapat memisahkan senyawa dengan
kecepatan tinggi, sensitif, dan mudah untuk memperoleh kembali
senyawa-senyawa yang terpisahkan. Adsorben dilapiskan pada lempeng kaca yang
berperan sebagai penunjang fase diam. Fase gerak akan merayap pada fase
diam sehingga terbentuk kromatogram (Khopkar, 2008: 164). Bila pelarut
telah mencapai batas akhir pada plat. Pelarut dibiarkan menguap pada plat
kemudian diidentifikasi dengan cara fisika dan kimia (Hardjono
Sastrohamidjojo, 2007: 27). Dalam mengidentifikasi noda-noda dapat
menggunakan harga Rf (retordation factor) yang didefinisikan sebagai
Rf = ����� ������ ��������
����� ������ �����
Faktor yang mempengaruhi gerakan noda dan harga Rf antara lain
(Sastrohamidjojo, 2007: 35-36):
b. Sifat penyerap dan derajat aktivitasnya (biasanya aktivitas dicapai
dengan pemanasan dalam oven),
c. Ketebalan dan kerataan lapisan penyerap,
d. Derajat kemurnian pelarut (fasa gerak),
e. Derajat kejenuhan dari uap dalam bejana pengembang,
f. Teknik percobaan,
g. Jumlah cuplikan yang digunakan (noda berlebihan memungkinkan
terbentuk ekor dan efek ketidakseimbangan lainnya sehingga dapat
mengakibatkan kesalahan pada harga Rf),
h. Suhu,
i. Kesetimbangan.
6. Spektroskopi IR
Spektroskopi inframerah merupakan metode analisis baik kualitatif
maupun kuantitatif yang didasarkan atas serapan radiasi infamerah. Radiasi
inframerah memiliki panjang gelombang radiasi dari 0,78 sampai 1000 μm
atau bilangan gelombang dari 12800 sampai 10 cm-1. Spektrum inframerah
dikelompokkan atas dasa spektrum inframerah dekat dengan bilangan
gelombang 6000 sampai 2000 cm-1
. Spektrum inframerah jauh dengan
bilangan 2000 sampai 10 cm-1. Akan tetapi yang lebih sering diapakai adalah
inframerah dengan bilangan gelombang 4000 sampai 670 cm-1
( I Wayan
Muderawan, 2009).
Berdasarkan intensitasnya pita-pita inframerah dalam sebuah
spektrum dikelompokkan menjadi 3 yaitu kuat (s, strong), sedang (m,
medium), dan lemah (w, weak). Suatu pita lemah yang tumpang tindih dengan
pita kuat disebut bahu (sh, shoulder) (Fessenden dan Fessenden, 1986: 316).
Informasi mengenai struktur suatu senyawa dapat diperoleh dari analisis
daerah vibrasi suatu spektrum IR. Spektrum IR adalah gambar antara persen
transmitasi (%T) lawan bilangan gelombang (Sitorus, 2009: 34). Ada
beberapa faktor yang mempengaruhi frekuensi vibrasi yaitu (Kemp, 1975:
a. Penggabungan (couple) vibrasi,
b. Ikatan hidrogen,
c. Efek elektronik,
d. Konjugasi menurunkan frekuensi C=O str dan C=C str, apakah
konjugasi menghasilkan α, β atau cincin armoatik,
e. Sudut ikatan,
f. Efek medan.
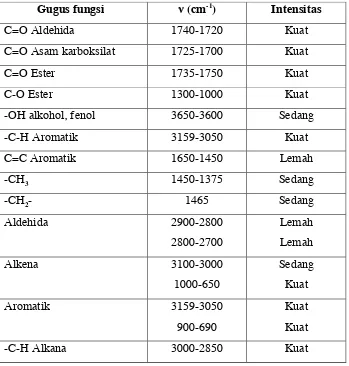
Tabel 1 berikut ini merupakan daerah serapan gugus fungsi utama
pada spektroskopi inframerah (Field, et. al, 2008) :
Tabel 1. Daerah serapan gugus fungsi utama pada spektroskopi
inframerah
Gugus fungsi ν (cm-1) Intensitas
C=O Aldehida 1740-1720 Kuat
C=O Asam karboksilat 1725-1700 Kuat
C=O Ester 1735-1750 Kuat
C-O Ester 1300-1000 Kuat
-OH alkohol, fenol 3650-3600 Sedang
-C-H Aromatik 3159-3050 Kuat
C=C Aromatik 1650-1450 Lemah
-CH3 1450-1375 Sedang
-CH2- 1465 Sedang
Aldehida 2900-2800
2800-2700
Lemah
Lemah
Alkena 3100-3000
1000-650
Sedang
Kuat
Aromatik 3159-3050
900-690
Kuat
Kuat
7. Spektroskopi Massa
Spektroskopi massa adalah suatu metode analisis dimana molekul
terion kemudian ion-ion terpisah berdasarkan massanya. Teknik ini
digunakan untuk mengetahui berat molekul dan rumus molekul. Selain itu
juga dapat memberikan informasi tentang struktur molekul. Spektra massa
melibatkan dua proses yang berbeda. Pertama adalah ionisasi sampel,
kemudian diikuti pemisahan dan deteksi ion-ion (Pine, 1987: 1120).
Pada spektroskopi massa molekul organik ditembak dengan berkas
elektron bertenaga tinggi sehingga molekul organik berubah menjadi ion-ion
bermuatan positif yang disebut sebagai ion induk. Ion induk dapat pecah
menjadi ion-ion yang lebih kecil lagi menjadi ion anak, proses ini sering
disebut fragmentasi (Sastrohamidjojo, 2007: 163). Proses fragmentasi dari
radikal kation akan menghasilkan fragmen netral dan fragmen bermuatan
positif. Lepasnya elektron dan molekul menghasilkan radikal kation dan
proses ini dinyatakan sebagai M M+.
M+ m1
+
+ m2
.
atau m1
+.
+ m2
Spektrum massa merupakan gambar antara limpahan reaktif lawan
perbandingan massa/muatan (m/e). Partikel-partikel netral yang dihasilkan
dalam fragmentasi, yaitu molekul tak bermuatan (m2) atau radikal (m2
.) tidak
dapat dideteksi dalam spektrometer massa (Hardjono, 2007: 163).
Pemecahan/fragmentasi ion molekuler terjadi bila tenaga yang digunakan
untuk menumbuk lebih besar dari pada tenaga berkas elektron (10-15 eV),
biasanya tenaga yang digunakan adalah 70 eV (Hardjono, 2007: 167).
B. Penelitian yang Relevan
Penelitian yang dilakukan oleh Aning Riwanti (2014) dengan
mereduksi senyawa vanilin menggunakan reduktor NaBH4. Produk yang
Penelitian ini relevan pada penggunaan reduktor NaBH4 dan kondisi reaksi
yang digunakan.
Penelitian yang telah dilakukan oleh Titik Taufikkurohmah (2005)
yang telah berhasil mensintesis p-Metoksisinamil p-Metoksisinamat
((PMS)2O) melalui reaksi esterifikasi antara asil klorida PMS-Cl dengan
alkohol PMS-OH. Penelitian ini relevan pada penggunaan asil klorida dengan
suatu alkohol.
Penelitian yang dilakukan oleh Asep Riswoko (2006) yang telah
menghasilkan selulosa ester melalui reaksi esterifikasi antara selulosa dengan
gugus asil klorida dengan bantuan piridina pada suhu 50-80oC. Penelitian ini
relevan dengan penggunaan piridina untuk mengikat HCl agar tidak bereaksi
dengan alkohol.
C. Kerangka Berfikir
Senyawa sinamil benzoat merupakan senyawa ester. Sinamil benzoat
diperoleh dari hasil reaksi esterifikasi antara sinamil alkohol hasil reduksi
sinamaldehid dengan benzoil klorida dengan bantuan basa lemah seperti
piridina. Sinamil alkohol didapatkan dengan mereduksi gugus aldehida pada
sinamldehida. Reduktor yang digunakan untuk mereduksi adalah NaBH4.
Pada penelitian ini diawali dengan reduksi sinamaldehida menjadi
sinamil alkohol dengan menggunakan reduktor NaBH4. Hasil dari reduksi ini
kemudian diidentifikasi dengan menggunakan KLT, spektroskopi IR, dan
spektroskopi GC-MS. Tahap berikutnya yaitu sintesis sinamil benzoat, sintesis
ini dilakukan antara sinamil alkohol hasil reduksi sinamaldehida dengan
benzoil klorida menggunakan piridina. Cairan hasil esterifikasi ini di
identifikasi dengan menggunakan KLT, spektroskopi IR, dan spektroskopi
BAB III
METODE PENELITIAN A. Subjek dan Objek Penelitian
1. Subjek penelitian
Subjek penelitian ini adalah senyawa ester turunan benzoat hasil
esterifikasi sinamil alkohol dengan benzoil klorida.
2. Objek penelitian
Objek penelitian ini adalah karakteristik senyawa ester turunan benzoat
hasil esterifikasi sinamil alkohol dengan benzoil klorida.
B. Alat dan Bahan Penelitian 1. Alat penelitian
1. Spektrofotometer GC-MS Shimadzu QP-2010S
2. Spektrofotometer IR Shimadzu 8201PC
3. Satu set alat refluks
4. Satu set alat KLT
5. Neraca analitik
6. Spatula
7. Aluminium foil
8. Kertas saring
9. Alat-alat gelas laboratorium
2. Bahan-bahan penelitian
1. Sinamaldehida p.a. Merck
2. Benzoil klorida Em.801804
3. Piridina p.a Merck
4. Etanol absoult p.a. Merck
5. NaBH4 p.a Merck
7. HCl p.a Merck
8. CH2CL2 p.a. Merck
9. CaCl2 p.a Merck
10.Akuades
11.Plat KLT Merck Si gel 60 GF254
C. Prosedur Penelitian
1. Reduksi Sinamaldehida Menggunakan Natrium Borohidirida
Sinamaldehida sebanyak 10,56 gram (0,08 mol) dimasukkan dalam
labu leher tiga 250 mL yang dilengkapi dengan water bath dan pengaduk
magnet. Sebanyak 0,76 gram (0,02 mol) NaBH4 dilarutkan dalam 40 mL
etanol absolut dan dimasukkan ke dalam labu leher tiga. Campuran diaduk
selama 40 menit menggunakan magnetic stirrer pada suhu kamar.
Kemudian campuran diasamkan dengan HCl 6 M disertai pengadukan
sampai pH = 4,5. Campuran kemudian disaring sehingga didapatkan
residu dan filtrat. Filtrat yang diperoleh kemudian diekstraksi tiga kali,
masing-masing menggunakan CH2Cl2 sebanyak 15 mL. Fasa organik
dikeringkan dengan CaCl2 kemudian disaring. Filtrat disimpan untuk
dilakukan karakterisasi.
2. Analisis Senyawa Hasil Reduksi Dengan KLT
Hasil reduksi sinamaldehida dan sinamaldehida sebagai
pembanding, ditotolkan pada lempeng silika gel. Pengembangan dilakukan
di dalam chamber yang telah dijenuhi kloroform : n-heksana (2:1). Noda
dilihat di bawah lampu UV, ditandai, kemudian dihitung Rf
masing-masing noda.
3. Elusidasi Struktur Senyawa Hasil Reduksi
Senyawa hasil reduksi sinamaldehida dikarakterisasi dengan
4. Esterifikasi Senyawa Hasil Reduksi Sinamaldehida Dengan Benzoil Klorida
Sebanyak 2,03 gram (0,015 mol) filtrat reduksi sinamaldehida dan
2,11 gram (0,015 mol) benzoil klorida dimasukkan dalam labu leher tiga
yang dilengkapi dengan magnetic stirrer, campuran diaduk selama 20
menit pada suhu kamar . Kemudian dimasukkan tetes demi tetes piridina
sebanyak 5 mL, campuran direfluk selama 4 jam. Setelah refluk selesai,
kemudian campuran tersebut ditambahkan dietil eter 3 mL dan aquades 3
mL dan diekstraksi. Campuran tersebut akan membentuk 2 lapisan,
Lapisan bagian atas diambil dan dicuci dengan aquades 3 mL sebanyak 3
kali. Kemudian dimasukkan ke dalam rotary evaporator dan setelah
selesai hasilnya disimpan untuk di lakukan identifikasi.
5. Analisis Senyawa Hasil Esterifikasi Menggunakan KLT
Hasil esterifikasi dan hasil reduksi sinamaldehida sebagai
pembanding, ditotolkan pada lempeng silika gel. Pengembangan dilakukan
di dalam chamber yang telah dijenuhi kloroform : n-heksana (2:1). Noda
dilihat di bawah lampu UV dan ditandai, kemudian dihitung Rf
masing-masing noda.
6. Elusidasi struktur senyawa hasil esterifikasi
Senyawa hasil esterifikasi dikarakterisasi dengan menggunakan
spektroskopi IR dan GC-MS.
D. Teknik Analisis Data 1. Analisis Kualitatif
Analisis kualitatif pada penelitian ini dilakukan dengan :
a. KLT untuk mengetahui pemisahan senyawa yang terbentuk dengan
membandingkan antara senyawa produk dengan pereaksi.
b. Spektroskopi IR untuk mengetahui gugus fungsional yang terdapat
pada senyawa.
c. Spektroskopi GC-MS untuk mengetahui masssa molekul relatif,
2. Analisis Kuantitatif
Analisis kuantitatif bertujuan untuk mengetahui persen rendemen
senyawa yang dihasilkan. Perhitungan rendemen sinamil alkohol hasil
reduksi sinamaldehida dan sinamil benzoat hasil esterifikasi sinamil
alkohol dengan benzoil klorida adalah sebagai berikut (Winarto, 2013: 36)
% ��������=
����� ���� ℎ���� ����������
BAB IV
HASIL PENELITIAN DAN PEMBAHASAN A. HASIL PENELITIAN
1. Reduksi Sinamaldehida a. Hasil Reduksi Sinamaldehida
Reaksi reduksi sinamaldehida menggunakan reduktor natrium
borohidrida menghasilkan senyawa sinamil alkohol. Sinamaldehida yang
digunakan sebanyak 10,56 gram (0,08 mol) dan natrium borohidrida
sebanyak 0,76 gram (0,02 mol). Berikut ini data hasil reaksi reduksi
sinamaldehida dengan menggunakan reduktor NaBH4 disajikan pada Tabel 2
[image:35.595.192.443.340.451.2]berikut ini:
Tabel 2. Data Hasil Reaksi Reduksi Sinamaldehida dengan NaBH4
Parameter Hasil Pengamatan
Bau Harum
Berat 8,43 gram
Warna Kuning Jerami
Wujud Cair
b. Kromatogram Hasil Reduksi Sinamaldehida
Identifikasi hasil reduksi sinamaldehida dengan menggunakan
KLT. Eluen yang digunakan yaitu kloroform : n-heksana dengan
perbandingan 2 : 1 seperti yang ditunjukkan pada Gambar 10.
Gambar 10. Kromatogram hasil Sinamaldehida dan Hasil Reduksi
Sinamaldehida
Keterangan
Noda no 1 = Sinamaldehida
Noda no 2 = Hasil Reduksi
Sinamaldehida
Nilai Rf untuk noda no 1 adalah
Rf 1 = !,! !"
! !" = 0,84
Nilai Rf untuk noda no 2 adalah
Rf 2 =!,!" !"
! !" = 0,55
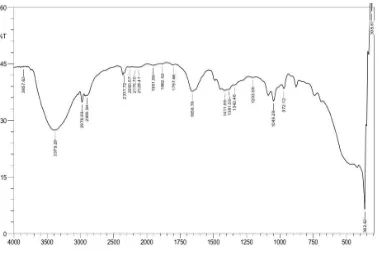
c. Spektrum IR Senyawa Hasil Reduksi Sinamaldehida
Gugus fungsi pada senyawa sinamaldehida dapat diidentifikasi dengan
melihat spektrum IR seperti yang ditunjukkan pada Gambar 11 dan hasil
[image:36.595.115.515.311.521.2]reduksi sinamaldehida ditunjukkan pada Gambar 12.
Gambar 11. Spektrum IR Senyawa Sinamaldehida
Gambar 12. Spektrum IR Senyawa Hasil Reduksi Sinamaldehida
Berdasarkan hasil analisis dari spektrum IR tersebut, senyawa
sinamaldehida dan senyawa hasil reduksi sinamaldehida memiliki beberapa
gugus fungsi seperti yang ditunjukkan Tabel 3.
Tabel 3. Daerah serapan senyawa hasil reduksi sinamaldehida pada spektrum IR
Bilangan gelombang (cm-1
)
Gugus Fungsi
Sinamaldehida Hasil Reduksi
Sinamaldehida 2816,64 dan
2743,56 (lemah) - C-H aldehida
1492,70 1411,89 C=C aromatik
1625,43 1658,78 C=C alkena
- 3379,29 (melebar) O-H alkohol
3059,76 3857,63 =C-H aromatik
- 2900,94 dan 2978,09 C-H alkana
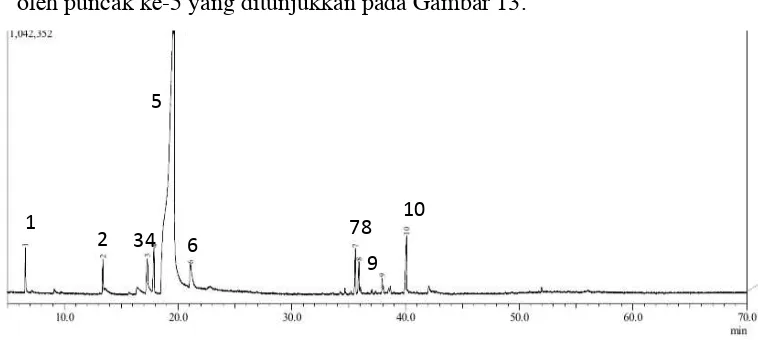
[image:37.595.116.505.494.721.2]d. Kromatogram dan Spektrum Massa Senyawa Hasil Reduksi Sinamaldehida
Kromatogram GC senyawa hasil reduksi sinamaldehida ditunjukkan
[image:38.595.126.505.153.324.2]oleh puncak ke-5 yang ditunjukkan pada Gambar 13.
Gambar 13. Kromatogram GC Senyawa Hasil Reduksi Sinamaldehida
Tabel 4. Keterangan Kromatogram GC Senyawa Hasil Reduksi Sinamaldehida
Puncak Retention Time
(Rt)
% area Perkiraan Senyawa
1 6,582 1,56 1-fenil-2-propena
2 13,395 1,24 Sinamil format
3 17,301 2,78 Sinamaldehida
4 17,883 2,54 3-kloro-1-propenil
5 19,585 81,31 Sinamil alkohol
6 21,081 2,52 1-fenil-1-propanol
7 35,596 2,23 3-fenil-1-pentena
8 35,897 1,40 Benzene,
(metilensiklopropil)
9 37,947 0,82 9,12-oktadekadien-1-ol
10 40,088 3,61 Benzenetanol
Sedangkan fragmentasi senyawa hasil reduksi sinamaldehida pada
puncak ke-5 dengan waktu retensi 19,585 menit ditunjukkan oleh
spektrum massa pada Gambar 14.
1
2 34 5
6
78 9
[image:38.595.127.499.367.646.2]Gambar 14. Spektrum Massa Puncak ke-5 Senyawa Hasil Reduksi Sinamaldehida
2. Sintesis Senyawa Sinamil Benzoat a. Hasil Sintesis Esterifikasi
Reaksi esterifikasi menggunakan sinamil alkohol dan benzoil klorida
dengan bantuan piridina menghasilkan senyawa ester sinamil benzoat.
Sinamil alkohol yang digunakan sebanyak 2,03 gram (0,015 mol) dan benzoil
klorida yang digunakan sebanyak 2,11 gram (0,015 mol). Hasil sintesis
ditunjukkan pada Tabel 5.
Tabel 5. Data Hasil Rekasi Esterifikasi Sinamil Alkohol dengan Benzoil
Klorida
Parameter Hasil Pengamatan
Bau Menyengat
Berat 1,66 gram
Warna Cokelat
Wujud Cair
b. Kromatogram Hasil Esterifikasi
Identifikasi hasil esterifikasi dengan menggunakan KLT. Eluen yang
digunakan yaitu kloroform : n-heksana dengan perbandingan 2 : 1 di
[image:39.595.186.443.443.560.2]
Gambar 15. Kromatogram Hasil Reduksi Sinamaldehida dan Hasil
Esterifikasi
Nilai Rf untuk noda no 1 adalah
Rf 1 = !,! !"
! !" = 0,76
Nilai Rf untuk noda no 2 adalah
Rf 2 =!,! !"
! !" = 0,3
c. Spektrum Senyawa Hasil Esterifikasi Menggunakan Spektroskopi IR
Gugus fungsi pada hasil esterifikasi dapat diidentifikasi dengan
melihat spektrum IR yang ditunjukkan oleh Gambar 16. Keterangan
Noda no 1 = Hasil esterifikasi
Noda no 2 = Hasil reduksi
sinamaldehida
Gambar 16. Spektrum IR Senyawa Hasil Esterifikasi
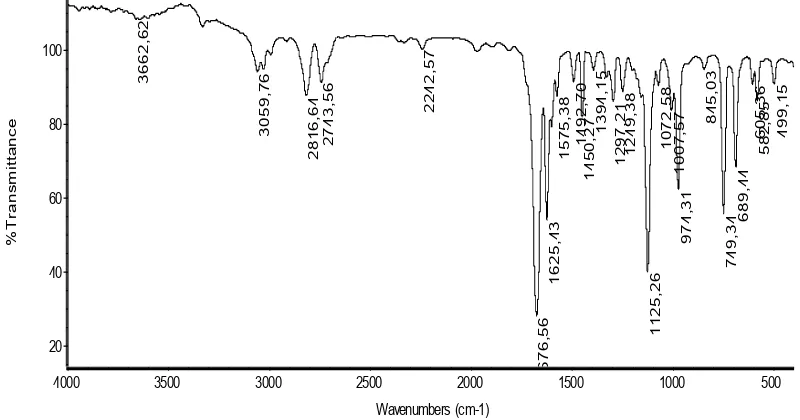
Berdasarkan hasil dari spektrum tersebut, senyawa hasil esterifikasi
[image:41.595.116.493.88.264.2]memiliki beberapa gugus fungsi seperti yang ditunjukkan Tabel 6.
Tabel 6. Daerah Serapan Senyawa Hasil Esterifikasi Pada Spektrum IR
Bilangan gelombang (cm-1)
Hasil esterifikasi Gugus Fungsi
1276,87 C-O-C
1716,15 C=O Karbonil
1450,32 C=C Aromatik
1600,61 C=C Alkena
3030,56 dan 3061,66 =C-H Aromatik
2980,04 C-H Alkana
d. Kromatogram dan Spektrum Massa Senyawa Hasil Esterifikasi
Berdasarkan kromatogram GC senyawa hasil esterifikasi, pada puncak
ke-14 dengan waktu retensi 19,249 menit dengan % area 12,44%
menunjukkan m/z 238, senyawa sinamil benzoat memiliki Mr 238. Puncak
tertinggi yaitu pada puncak ke-6 dengan waktu retensi 7,870 menit dengan %
area 37,38% merupakan senyawa etil benzoat (m/z = 150). Kromatogram
[image:42.595.137.505.164.294.2]hasil esterifikasi ditunjukkan pada Gambar 17.
[image:42.595.126.506.354.484.2]Gambar 17. Kromatogram GC Senyawa Hasil Esterifikasi
Tabel 7. Keterangan 5 Puncak Tertinggi Kromatogram GC Hasil Esterifikasi
Puncak Retention time (Rt) % area Perkiraan senyawa
1 2,257 3,76 Dietil eter
3 2,973 20,72 Piridina
6 7,870 37,38 Etil benzoat
9 10,328 10,55 Benzena, (3-etoksi-1-propenil)
14 19,249 12,44 Sinamil benzoat
Spektrum Massa senyawa sinamil benzoat hasil esterifikasi pada puncak
ke-14 ditunjukkan pada Gambar 18.
Gambar 18. Spektrum Massa Puncak ke-14 Senyawa Hasil Esterifikasi
1
3 6
9
B. PEMBAHASAN
1. Sintesis Senyawa Sinamil Alkohol a. Reduksi Sinamaldehida
Senyawa sinamil alkohol dihasilkan melalui reaksi reduksi
sinamaldehida dengan menggunakan natrium borohidrida. Langkah pertama
yang dilakukan yaitu menimbang sinamaldehida sebanyak 10,56 gram (0,08
mol) dan natrium borohidrida sebanyak 0,76 gram (0,02 mol). Kemudian
melarutkan natrium borohidrida yang telah ditimbang dengan 40 mL etanol
absolut. Pelarut etanol dipilih karena selain dapat melarutkan natrium
borohidrida, etanol merupakan pelarut organik yang tidak memiliki gugus
fungsi yang dapat direduksi dengan reduktor natrium borohidrida. Natrium
borohidrida yang sudah dilarutkan tadi dicampur dengan sinamaldehida yang
telah ditimbang. Campuran tersebut diaduk secara konstan dengan pengaduk
stirrer dan dijaga suhunya supaya tetap pada suhu kamar. Campuran diaduk selama 40 menit supaya reaksi berjalan secara maksimal dan gugus aldehida
dapat direduksi sepenuhnya oleh reduktor natrium borohidrida. Penambahan
natrium borohidrida ini menyebabkan larutan bersifat basa dengan pH ± 12.
Campuran diasamkan dengan menambahkan HCl 6 M bertetes-tetes sampai
pH mencapai ± 4,5. Penambahan HCl 6 M ini bertujuan untuk mengasamkan
campuran karena campuran bersifat basa dengan pH ± 12. Berikut ini reaksi
dekomposisi yang terjadi pada natrium borohidrida
NaBH4 (aq) + 4HCl (aq) NaCl (aq) +BCl3 (aq) + 4H2 (g)
Persamaan reaksi reduksi sinamaldehida menjadi sinamil alkohol yang terjadi
adalah:
OH
Sinamil alkohol O
H
Sinamaldehida
NaBH4 H+
Sinamaldehida C O H B H H H CH2 O + C O H Na H
Na+ + BH3
H H2O H
CH OH
H
Sinamil alkohol
+ H2O
:
..
-+: :
..
..
:
:
+:
..
Penyerangan karbonil aldehida oleh ion hidrida pada natrium borohidrida
kemudian setelah adanya penambahan asam, oksigen terprotonasi untuk
membentuk alkohol primer netral. Ion hidrogen sebenarnya melekat pada
molekul air sebagai H3O
+.
Setelah itu campuran disaring, filtrat diekstraksi dengan diklorometana
15 mL sebanyak 3 kali. Terbentuk fasa organik dan fasa air, lalu dipisahkan.
Pada ekstraksi pertama, hasilnya belum terpisah, lalu ditambahkan NaCl
jenuh 10 mL. Penambahan NaCl jenuh ini berfungsi sebagai salting out.
Salting out adalah peristiwa adanya zat terlarut tertentu yang mempunyai kelarutan lebih besar dibanding zat utama, akan menyebabkan penurunan
kelarutan zat utama atau terbentuknya endapan karena ada reaksi kimia. Pada
saat ekstraksi kedua, campuran dapat memisah dan pada ekstraksi ketiga
campuran sudah tidak memisah lagi, lalu ditambahkan sedikit NaCl jenuh.
Pada saat ekstraksi kedua kemungkinan masih ada sisa NaCl jenuh sehingga
masih dapat memisah. Fasa organik yang merupakan sinamil alkohol berada
di atas karena penggunaan NaCl jenuh sebagai salting out (ρ NaCl jenuh =
2,165 g/cm3
) menyebabkan fasa organik berada di atas. Seharusnya fasa
organik berada di bawah karena terdistribusi dalam fasa diklorometana (ρ air
= 1,00 g/cm3
; ρ CH2Cl2 = 1,33 g/cm
3
). Ekstraksi dilakukan sebanyak 3 kali
Proses selanjutnya yaitu penambahan CaCl2 pada fasa organik. Penambahan
CaCl2 dalam bentuk serbuk padat ini secukupnya dan berfungsi untuk
mengambil air yang masih ada dalam campuran. Kemudian campuran
disaring untuk memisahkan padatan CaCl2 dan filtratnya. Filtrat dimasukkan
ke dalam rotary evaporator untuk menghilangkan pelarut yang masih
tertinggal yakni pelarut etanol dan diklorometana. Hasil reduksi ini berupa
cairan berwarna kuning jerami dan berbau tajam dengan massa 8,34 gram.
Menurut MSDS sinamil alkohol berbentuk padatan berwarna putih
kekuningan memiliki titik leleh 33o
C, maka pada suhu ruangan sinamil
alkohol mudah meleleh.
b. Kromatogram KLT Hasil Reduksi Sinamaldehida
Analisis menggunakan kromatografi lapis tipis ini memiliki tujuan
untuk mengetahui Rf senyawa yang sudah terbentuk dan membandingkan
antara senyawa sinamaldehida dengan senyawa hasil reduksi sinamaldehida.
Eluen yang digunakan yaitu kloroform : n-heksana dengan perbandingan 2 :
1. Noda yang telah terbentuk kemudian diamati di bawah lampu UV dengan
panjang gelombang 366 nm.
Berdasarkan perhitungan Rf untuk noda 1 (noda sinamaldehida) yaitu
0,84 dan untuk noda 2 (noda hasil reduksi sinamaldehida) yaitu 0,55. Adanya
perbedaan nilai Rf untuk noda 1 dan 2 ini menunjukkan bahwa reaksi reduksi
sinamaldehida telah berlangsung. Nilai Rf sinamaldehida lebih besar dari
pada nilai Rf hasil reduksi sinamaldehida karena berdasarkan kepolarannya
senyawa aldehida lebih non polar daripada senyawa alkohol. Senyawa yang
lebih polar akan terikat pada fasa diam (plat KLT). Plat KLT ini terbuat dari
bahan silika yang memiliki sifat polar sehingga akan lebih lama tertahan di
silika.
c. Spektrum IR Senyawa Sinamaldehida Dan Senyawa Hasil Reduksi Sinamaldehida
Berdasarkan hasil spektrum IR, senyawa hasil reduksi sinamaldehida
fungsional yang menjadi ciri khas pada setiap senyawa, pada daerah 1676,56
cm-1
menunjukkan adanya gugus C=O Karbonil, pada daerah 1658,78 cm-1
C=C Alkena, pada daerah 1411,89 cm-1 menunjukkan gugus C=C Aromatik,
pada daerah 3379,29 cm-1 menunjukkan adanya gugus fungsi alkohol (-OH)
dengan puncak yang melebar, pada daerah 3857,63 cm-1 menunjukkan gugus
=C-H Alkena dan pada daerah 2900,94 dan 2978,09 cm-1 menunjukkan gugus
C-H alkana.
Dari kedua spektrum IR dapat diketahui perbedaan serapan gugus
fungsi yang muncul dengan munculnya gugus –OH pada spektrum IR
senyawa hasil reduksi sinamaldehida dan juga C-H alkana. Pada spektrum
hasil reduksi sinamaldehida sudah tidak ada gugus C-H aldehida dan C=O
aldehida yang terdapat pada spektrum sinamaldehida.
d. Kromatogram Dan Spektrum Massa Senyawa Hasil Reduksi Sinamaldehida
Instrumen GC-MS digunakan untuk mengetahui kadar (kemurnian),
massa molekul, dan fragmentasi senyawa hasil sintesis. Pada kromatogram
GC hasil reduksi sinamaldehida menunjukkan adanya 10 puncak yang
muncul. Senyawa sinamil alkohol ditunjukkan oleh puncak yang tertinggi
yaitu puncak ke-5 dengan waktu retensi 19,585 menit dengan kelimpahan
81,31%. Puncak ketiga yaitu senyawa sinamaldehida yang belum tereduksi
(2,78%).
Fragmentasi yang terjadi pada senyawa sinamil alkohol dapat
digunakan untuk memprediksi struktur senyawa sinamil alkohol. Fragmentasi
yang terjadi adalah :
HC H C
CH2
OH
Sinamil alkohol Mr = 134 g/mol
e 70 eV
HC H C
CH O
m/z = 134
H
H
:..
:.
+
HC CH +
m/z = 77 m/z = 51
+ +
Tipe fragmentasi kedua
HC H C CH2 OH HC H C CH2 OH Sinamil alkohol Mr = 134 g/mol
m/z = 134 e 70 eV HC H C CH OH
m/z = 134
HC H C
C
m/z = 116 H H
+ H2O
:
.
+:
:
.
+.
+ HC H C CH Om/z = 134
H
H
H2C CH2
m/z = 105
O +
H2C
CH2
m/z = 105
+ H2C CH2
HC C
C
m/z = 115
C C
m/z = 115 H H
C C
m/z = 115 H
H
m/z = 78
+ C C CH
m/z = 77 H
m/z = 78
+ H
:
+.
+ + +.
+ +m/z = 77 +
HC H C
C
m/z = 116
H HC
H C
C
m/z = 115
+ H
.
+..
+ HC C H CH C CH +m/z = 39 +
..
..
Tipe fragmentasi ketiga HC H C CH2 OH Sinamil alkohol Mr = 134 g/mol
e 70 eV HC H C CH O
m/z = 134
H H HC H C CH O
m/z = 134
H
H
HC=O +
H2C H C
m/z = 105
CH
m/z = 92
+ CH H
H2C H C
m/z = 105 H
:
.
+..
:
.
+:
+..
.
.
+ +..
+ CH3
m/z = 77 CH3
m/z = 92
m/z = 77
HC C H CH C CH +
m/z = 39
.
+ + + +..
..
.
HCFragmentasi senyawa sinamil alkohol yang diperoleh dari hasil
spektrum MS dan dibedakan dalam tiga macam pola fragmnetasi. Senyawa
sinamil alkohol dengan berat molekul 134 ditembak dengan elektron
pertama, ion molekul dengan m/z 134 kehilangan radikal COH membentuk
kation dengan m/z 105. Lalu melepaskan molekul H2C=CH2 menjadi kation
yang memiliki m/z 77 dan melepaskan molekul CH=CH yang menghasilkan
kation dengan m/z 51.
Pola fragmentasi yang kedua, ion molekul dengan m/z 134
melepaskan molekul air membentuk radikal kation dengan m/z 116 yang
kehilangan radikal H sehingga membentuk kation dengan m/z 115. Ikatan –
C-C≡CH mengalami fragmentasi dan membentuk radikal kation C6H6 (m/z
78). Kemudian radikal H membentuk kation dengan m/z 77 dan terfragmen
lagi membentuk kation dengan m/z 39.
Pola fragmentasi ketiga, ion molekul dengan m/z 134 kehilangan
radikal COH membentuk suatu kation dengan m/z 105 selanjutnya
melepaskan molekul CH menjadi radikal kation dengan m/z 92 dan
melepaskan radikal CH3 membentuk kation dengan m/z 77. Kemudian
pelepasan molekul C3H2 membentuk kation dengan m/z 39.
Radikal kation dengan m/z 92 merupakan base peak dari spektrum
massa sinamil alkohol karena distabilkan oleh elektron yang beresonansi pada
cincin benzena. Base peak adalah puncak tertinggi dalam suatu spektrum dan
diberi nilai intensitas sebesar 100%. Intensitas peak ini sebanding dengan
kelimpahan fragmen-fragmen yang bergantung pada stabilitas relatif mereka
(Fessenden dan Fessenden, 1986: 455).
Berdasarkan hasil dari analisis IR, KLT, dan GC-MS telah terbentuk
senyawa sinamil alkohol dengan kemurnian sebesar 81,31%. Secara teoritis,
sinamil alkohol yang dihasilkan sebesar 10,72 gram namun dalam penelitian
ini hanya diperoleh 8,43 gram. Sehingga melalui perhitungan diperoleh
rendemen sebesar 63,94% (perhitungan terlampir pada Lampiran 2).
2. Sintesis Sinamil Benzoat
a. Esterifikasi Sinamil Alkohol Dan Benzoil Klorida
Sintesis sinamil alkohol dilakukan melalui esterifikasi antara sinamil
katalis karena asil klorida merupakan turunan asam karboksilat yang paling
reaktif. Proses esterifikasi ini dilakukan beberapa kali untuk mendapatkan
hasil yang diinginkan.
Percobaan yang pertama, sinamil alkohol sebanyak 2,03 gram dan
piridina sebanyak 2 mL dimasukkan ke dalam labu leher tiga yang dilengkapi
penangas air dan pengaduk magnet, kemudian campuran diaduk dengan
menggunakan magnetic stirrer selama 30 menit pada suhu kamar, lalu
campuran ditambahkan dengan benzoil klorida secara tetes demi tetes
sebanyak 2,2 mL. Campuran tersebut direfluks pada suhu 70-75 o
C selama 3
jam. Hasilnya cairan berwarna orange kecoklatan jernih kemudian di
tambahkan dietil eter 4 mL lalu di ekstraksi. Campuran tersebut belum
sempurna membentuk dua lapisan.
Percobaan yang kedua, sinamil alkohol sebanyak 2,03 gram (0,015
mol) dan benzoil klorida sebanyak 2,11 gram (0,015 mol) dimasukkan ke
dalam labu leher tiga yang dilengkapi dengan penangas air dan pengaduk
magnet, kemudian direfluks selama 4 jam pada suhu 80-90 o
C. Hasil refluks
berbentuk gel, lalu ditambahkan tetes demi tetes piridina sebanyak 2 mL.
Campuran tersebut menjadi cairan. Kemudian ditambahkan sedikit metanol
dan membentuk endapan. Endapan larut dalam benzena.
Percobaan yang ketiga dilakukan dengan cara merefluk 2,03 gram
sinamil alkohol (0,015 mol) dan 2,11 gram benzoil klorida (0,015 mol) dalam
labu leher tiga, diaduk menggunakan magnetic stirrer selama 20 menit pada
suhu kamar, kemudian memasukkan tetes demi tetes piridina sebanyak 5 mL.
Fungsi piridina yaitu untuk mengikat HCl hasil samping agar tidak bereaksi
dengan alkohol. Campuran direfluk selama 4 jam. Setelah refluk, campuran
tersebut ditambahkan dietil eter 3 mL dan akuades 3 mL dan diekstraksi.
Penambahan dietil eter tersebut berfungsi sebagai pelarut organik nonpolar
yang memiliki titik didih rendah dan dapat melarutkan berbagai senyawa
organik dan air merupakan pelarut yang polar sehingga campuran tersebut
akan membentuk 2 lapisan, Lapisan bagian atas diambil dan diekstraksi
aquades sebanyak 3 kali ini berfungsi untuk mengambil air yang masih
tertinggal di dalam fasa organik. Kemudian fasa organik dimasukkan ke
dalam rotary evaporator untuk menghilangkan pelarut yang masih ada.
Setelah itu hasilnya dikarakterisasi dengan menggunakan KLT, spektroskopi
IR, dan GC-MS.
Reaksi yang terjadi pada proses esterifikasi antara sinamil alkohol dan
benzoil klorida merupakan reaksi subtitusi nukleofilik. Berikut ini adalah
mekanisme reaksi subtitusi nukleofilik pada sinamil benzoat (Riswiyanto,
2009:292). C O Cl C H2 H C C H HO + C H2 H C C H O H O Cl C H2 H C C H O O Cl -H
H + Cl N piridina C H2 H C C H O C O + N H Cl .. .. + .. -+
Cl- pada benzoil klorida memiliki fungsi sebagai gugus lepas yang
dapat diserang oleh sinamil alkohol sebagai nukleofil. Urutan reaktivitas
alkohol pada esterifikasi antara alkohol dengan halida asam adalah alkohol 1o
> alkohol 2o > alkohol 3o sehingga C karbonil pada benzoil klorida akan
diserang oleh OH primer yang terdapat pada sinamil alkohol. Kemudian
terjadi eliminasi pada ion klorida. Hasil samping berupa HCl yang diikat oleh
piridina.
b. Kromatogram KLT Senyawa Hasil Esterifikasi
Senyawa hasil esterifikasi dianalisis dengan menggunakan
sudah berjalan atau belum. Eluen yang digunakan yaitu kloroform :
n-heksana dengan perbandingan 2 :1. Noda yang telah terbentuk kemudian
diamati di bawah lampu UV dengan panjang gelombang 366 nm. Kemudian
noda diberi tanda untuk menghitung nilai Retordaction factor (Rf).
Berdasarkan perhitungan Rf untuk noda 1 (noda hasil esterifikasi) yaitu 0,76
dan untuk noda 2 (noda hasil sinamil alkohol) yaitu 0,3. Adanya perbedaan
nilai Rf untuk noda 1 dan 2 ini menunjukkan bahwa reaksi esterifikasi telah
berlangsung.
Nilai Rf hasil esterifikasi lebih besar dari pada nilai Rf sinamil alkohol
karena berdasarkan kepolarannya senyawa alkohol lebih polar daripada
senyawa ester. Senyawa yang lebih polar akan terikat lebih lama pada fasa
diam (plat KLT). Senyawa sinamil alkohol akan terikat kuat pada plat KLT
yang memiliki sifat polar.
c. Spektrum IR Hasil Esterifikasi
Berdasarkan hasil spektrum IR hasil esterifikasi menunjukkan adanya
perbedaan dengan spektrum sinamil alkohol ini menunjukkan reaksi sudah
berlangsung. Pada spektrum IR hasil esterifikasi menunjukkan adanya gugus
C-O-C pada daerah 1276,87 cm-1, terdapat gugus C=O karbonil pada daerah
1716,15 cm-1
, Adanya gugus C=C Aromatik 1450,32 cm-1
, gugus C=C
Alkena pada daerah 1600,61 cm-1
, gugus =C-H Aromatik atau =C-H Alkena
pada daerah 3030,56 cm-1
dan 3061,61 cm-1
dan gugus fungsi C-H Alkana
pada daerah 2980,04 cm-1.
Perbedaan spektrum IR antara sinamil alkohol dan hasil esterifikasi ini
ditandai dengan terbentuknya senyawa ester dengan munculnya serapan
gugus C-O-C pada daerah 1276,87 cm-1
, kemudian terdapat gugus C=O
karbonil pada daerah 1716,15 cm-1
, perbedaan lainnya ditandai dengan
hilangnya gugus –OH pada sinamil alkohol pada daerah 3379,29 cm-1.
d. Kromatogram Dan Spektrum Massa Senyawa Hasil Esterifikasi
Kromatogram GC senyawa hasil esterifikasi menunjukkan adanya 20
puncak yang muncul. Pada puncak ke-3 dengan waktu retensi 2,973 menit
karena penggunaan piridina yang berlebihan sehingga masih terdapat sisa
dalam senyawa. Puncak tertinggi yaitu ke-6 pada waktu retensi 7,870 menit
dengan % area 37,38% yaitu senyawa etil benzoat. Terbentuknya senyawa
etil benzoat ini dimungkinkan karena benzoil klorida lebih mudah bereaksi
dengan rantai alkana yang lebih pendek sehingga hasil reaksi lebih dominan.
Pada puncak ke-14 dengan waktu retensi 19,249 menit dengan % area
12,44% menunjukkan m/z 238, sedangkan Mr dari sinamil benzoat adalah
238 g/mol. Puncak ke-14 ini diperkirakan senyawa sinamil benzoat karena
memiliki Mr yang sama dengan hasil spektrum, untuk membuktikan senyawa
tersebut kemudian dilakukan pembuktian dengan pola fragmentasi sebagai
berikut
Tipe Fragmentasi 1
C O O C H2 H C C H Sinamil Benzoat Mr = 238 g/mol
e 70 e V
C O O C H2 H C C H
m/z = 238
C O O C H2 H C C H
m/z = 238
O C H2 H C C H
m/z = 105 C O +
.
+..
.
+ +.
m/z = 105 C
O +
m/z = 105 C
O +
m/z = 105
C
O
+
m/z = 77 +
+ C O
..
m/z = 77 +
+
+ HC CH
m/z = 51
Tipe Fragmentasi 2
C O O C H2 H C C H Sinamil Benzoat Mr = 238 g/mol
e 70 e V
C O O C H2 H C C H
m/z = 238
C O O C H2 H C C H
m/z = 238
O C H2 H C C H
m/z = 105
C O +
.
+.
+ +.
m/z = 105
C
O
+
m/z = 77 +
+ C O
..
..
m/z = 77 +
Pada fragmentasi yang pertama senyawa sinamil benzoat dengan berat
molekul 238 ditembak dengan elektron berenergi tinggi pada atom O yang
terikat pada gugus karbonil membentuk ion molekul dengan m/z 238. Ion
molekul m/z 238 mengalami pembelahan inti alfa pada ikatan C-O ester
sehingga menghasilkan kation dengan m/z 105. Selanjutnya kation dengan
m/z 105 mengalami perpindahan elektron π menuju O yang menyebabkan
kation beresonansi dengan muatan positif berada pada C karbonil. Kemudian
kation tersebut melepaskan gugus C=O menjadi kation dengan m/z 77
dilanjutkan dengan pelepasan molekul CH≡HC menghasilkan kation dengan
m/z 51.
Pada fragmentasi yang kedua senyawa sinamil benzoat dengan berat
molekul 238 ditembak dengan elektron berenergi tinggi pada atom O yang
terikat pada C-O ester membentuk ion molekul dengan m/z 238. Ion molekul
dengan m/z 238 mengalami pembelahan pada ikatan O-CH2 sehingga
menghasilkan ion molekul dengan m/z 105. Kemudian kation tersebut
melepaskan gugus C=O menjadi kation dengan m/z 77 dilanjutkan dengan
pelepasan molekul HC-C≡CH menghasilkan kation dengan m/z 39. Kation
dengan m/z 105 merupakan base peak (puncak dasar) dari spektrum massa
sinamil benzoat karena terdapat C benzilik yaitu C positif yang terikat
langsung pada cincin benzena sehingga struktur tersebut memiliki kestabilan
tinggi dan muncul sebagai base peak.
Berdasarkan hasil KLT, spektroskopi IR, dan GC-MS, senyawa
sinamil benzoat telah terbentuk. Pada kromatogram GC puncak ke-14 hanya
diperoleh kemurnian 12,44% dan dari hasil rendemen yang telah dilampirkan
pada Lampiran 2, diperoleh yaitu sebesar 5,78%. Senyawa sinamil benzoat
ini memiliki kemurnian kecil dapat dikarenakan masih terdapat
senyawa-senyawa pengotor dari proses esterifikasi, maka diperlukan proses pemurnian
BAB V
KESIMPULAN DAN SARAN A. Kesimpulan
Berdasarkan penelitian yang telah dilakukan dapat disimpulkan
bahwa:
1. Reaksi reduksi sinamaldehida dengan menggunakan reduktor NaBH4 telah
berhasil dilaksanakan dengan menghasilkan cairan berwarna kuning jerami
dan berbau harum yang mengandung senyawa sinamil alkohol dengan
kadar 81,31% dan rendemen sebesar 63,94%.
2. Reaksi esterifikasi antara benzoil klorida dan sinamil alkohol hasil reduksi
sinamaldehida telah berhasil dilakukan karena menghasilkan senyawa
ester berwarna cokelat dan berbau menyengat yang mengandung sinamil
benzoat dengan kadar 12,44% dan rendemen sebesar 5,78%.
B. Saran
Berdasarkan penelitian yang telah dilakukan, reaksi esterifikasi telah
berhasil dilakukan namun belum mencapai tingkat kemurnian yang optimal,
oleh karena itu ada beberapa saran dari penulis, antara lain:
1. Mencari kondisi waktu dan suhu yang tepat untuk melakukan proses
esterifikasi.
2. Melakukan pemurnian senyawa hasil reduksi maupun esterifikasi untuk
menghilangkan pengotor-pengotor yang masih ada dengan cara distilasi,
DAFTAR PUSTAKA
Aning Riwanti. (2014). Sintesis Vanilil Benzoat Melalui Reakksi Esterifikasi
Antara Benzoil Klorida d