SELEKSI DAN UJI AKTIVITAS FIKSASI NITROGEN (N
2)
BAKTERI METANOTROF ASAL SAWAH
PADA KONSENTRASI OKSIGEN (O
2) BERBEDA
BONARDO TIGOR SAGALA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
ABSTRAK
Bonardo Tigor Sagala. Seleksi dan Uji Aktivitas Fiksasi Nitrogen (N2) Bakteri Metanotrof Asal Sawah pada Konsentrasi Oksigen (O2) Berbeda. Dibimbing oleh IMAN RUSMANA dan ALINA AKHDIYA.
Bakteri metanotrof merupakan bakteri pengoksidasi CH4. Enzim spesifik pengoksidasi metan pada bakteri ini adalah metan monooksigenase (MMO) yang mampu menambahkan satu atom oksigen ke molekul CH4 untuk membentuk senyawa metanol. Selain itu, bakteri metanotrof juga dapat memfiksasi nitrogen. Bakteri metanotrof type II dan type X dapat memfiksasi nitrogen menggunakan enzim nitrogenase. Enzim nitrogenase sangat peka oksigen. Sebanyak 19 isolat bakteri metanotrof berhasil diremajakan dan diuji aktivitas fiksasi N2-nya pada konsentrasi oksigen yang berbeda. Aktivitas fiksasi N2 ditentukan berdasarkan akumulasi amonium pada media NMS bebas nitrogen. Akumulasi amonium yang tinggi ditemukan pada kultur isolat BGM 1, BGM 3, BGM 5, dan BGM 9. Akumulasi amonium tertinggi dimiliki oleh kultur isolat BGM 9 pada konsentrasi oksigen 30% yaitu 88,816 µM. Kerapatan sel tertinggi dimiliki oleh isolat BGM 5 dengan OD 0,103 pada konsentrasi oksigen 80%.
Kata kunci: Metan, bakteri metanotrof, fiksasi nitrogen, Nitrogenase
ABSTRACT
Bonardo Tigor Sagala. Selection and Nitrogen Fixing (N2) Activity Test of Methanotrophic Bacteria from Rice Field Under Different Concentration of Oxygen. Under supervision of IMAN RUSMANA and ALINA AKHDIYA.
Methanotrophic bacteria is methane oxydizing bacteria. This bacteria has a specific enzyme known as methane monooksigenase (MMO) catalizing reaction of CH4 and O2 to methanol. Methanotrophic bacteria also have ability to fix nitrogen. Methanotrophic bacteria type II and type X could fix nitrogen using nitrogenase enzyme. This enzyme is very sensitive to oxygen. As many as 19 isolates of methanotrophic bacteria was recultured and determined their nitrogen fixation activity at different oxygen concentration. Nitrogen fixation activity was determined by measuring ammonium accumulation in NMS free nitrogen medium. High ammonium accumulation was found at cultures of BGM 1, BGM 3, BGM 5, dan BGM 9 isolates. The highest ammonium accumulation (88,816 µM) was showed by BGM 9 isolate on 30% oxygen concentration and the highest cell density was showed by BGM 5 isolate (OD 0,103) on 80% oxygen concentration. Keyword: Methane, methanotrophic bacteria, nitrogen fixation, Nitrogenase
SELEKSI DAN UJI AKTIVITAS FIKSASI NITROGEN (N
2)
BAKTERI METANOTROF ASAL SAWAH
PADA KONSENTRASI OKSIGEN (O
2) BERBEDA
BONARDO TIGOR SAGALA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2009
Judul
: Seleksi dan Uji Aktivitas Fiksasi Nitrogen (N
2) Bakteri
Metanotrof Asal Sawah pada Konsentrasi Oksigen (O
2) Berbeda.
Nama
: Bonardo Tigor Sagala
NIM
: G34051698
Disetujui:
Pembimbing I,
Pembimbing II,
(Dr. Ir. Iman Rusmana M.Si)
(Alina Akhdiya M.Si)
NIP 196507201991031002 NIP 196812082001122001
Diketahui:
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Dr. Drh. Hasim, DEA
NIP 196103281986011002
PRAKATA
Puji syukur penulis panjatkan kepada Tuhan YME yang telah memberi rahmat dan kemudahan dalam menyelesaikan karya ilmiah ini. Tema penelitian penulis yaitu tentang reduksi emisi gas rumah kaca dari lahan sawah, dengan judul Seleksi dan Uji Aktivitas Fiksasi Nitrogen (N2) Bakteri Metanotrof Asal Sawah pada Konsentrasi Oksigen (O2) Berbeda. Penelitian ini dilaksanakan mulai bulan April sampai Agustus 2009 di Laboratorium Mikrobiologi Departemen Biologi, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Bapak Dr. Ir. Iman Rusmana, M.Si. dan Ibu Alina Akhdiya, M.Si. selaku pembimbing atas saran dan bimbingannya dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini. Terima kasih juga kepada Papah, Mamah (alm), Mamah, Mba Dian, Bang Haris, Inang Uda Lina atas doa, dukungan, dan segala cintanya. Terima kasih kepada Yohanna, Bu Ratna, Mba Rika, Ade, Tika, Lia, Dina, Puji, Bram, Una, Meli, Yurin, Nida, Ason, Bu Maysaroh, Pak Hadi, Ka Fina, keluarga besar laboratorium mikrobiologi FMIPA IPB, keluarga besar laboratorium Fisologi Tumbuhan FMIPA IPB, alumni dan adik-adik di SMAN 1 Depok, serta sahabat-sahabatku tercinta di Biologi 42 atas segala bantuan yang telah diberikan.
Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Oktober 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung pada tanggal 01 Desember 1986 dari ayah Robert Bulthon Sagala dan ibu Sri Banundari (alm). Penulis merupakan anak kedua dari dua bersaudara. Tahun 2005 penulis lulus dari SMU Negeri 1 Depok dan lolos seleksi masuk IPB melalui jalur Seleksi Penerimaan Mahasiswa Baru IPB (SPMB) pada Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam.
Selama mengikuti perkuliahan, penulis aktif sebagai staf Bioworld Himpunan Mahasiswa Biologi (Himabio) pada tahun 2007-2008, staf Komisi Kesenian Persekutuan Mahasiswa Kristen IPB (PMK) pada tahun 2008-2009. Penulis juga aktif dalam beberapa kegiatan yang diadakan oleh kampus IPB.
Penulis menjadi asisten praktikum mata kuliah Biologi Tingkat Persiapan Bersama IPB pada tahun 2009-2010, Fisiologi Tumbuhan pada tahun 2009, dan Ilmu Lingkungan pada tahun 2009 di Departemen Biologi FMIPA IPB. Penulis juga menjadi pengajar B’Expert Biologi tahun 2008. Penulis melakukan Praktik Kerja Lapang di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (Balai Besar Biogen) dari bulan Juli sampai Agustus 2008 dengan judul Manajemen dan Kegiatan Penelitian Bioteknologi Tanaman Padi
Oryza sativa di Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian (Balai Besar Biogen), Bogor, Jawa Barat.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vi
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE... 1
Bahan ... 1
Metode ... 2
HASIL DAN PEMBAHASAN ... 3
Hasil... 3
Peremajaan Isolat ... 3
Aktivitas Fiksasi N
2Bakteri Metanotrof ... 3
Aktivitas Fiksasi N
2Isolat Terpilih pada Konsentrasi O
2Berbeda ... 4
Pembahasan ... 4
SIMPULAN ... 5
SARAN ... 5
DAFTAR PUSTAKA ... 5
LAMPIRAN ... 7
vi
DAFTAR TABEL
Halaman
1
Kerapatan sel (OD
620) dan akumulasi amonium pada kultur bakteri metanotrof
pada media agar NMS dengan masa inkubasi 14 hari pada suhu 27-29
oC ……. 3
DAFTAR GAMBAR
Halaman
1 Morfologi koloni isolat BGM 1 pada media agar NMS dengan masa inkubasi
lima hari pada suhu 27-29
oC ………...…….………...… 3
2 Kerapatan sel kultur BGM 1, BGM 3, BGM 5, BGM 9
pada beberapa konsentrasi oksigen menggunakan media agar NMS
dengan masa inkubasi 14 hari pada suhu 27-29
oC.……..…... 4
3 Konsentrasi amonium dalam kultur BGM 1, BGM 3, BGM 5,
BGM 9 pada beberapa konsentrasi oksigen menggunakan media agar NMS
dengan masa inkubasi 14 hari pada suhu 27-29
oC………...………... 4
DAFTAR LAMPIRAN
Halaman
1 Kerapatan sel kultur isolat terpilih pada beberapa konsentrasi oksigen... 8
2 Akumulasi amonium dalam kultur metanotrof pada beberapa konsentrasi
oksigen... 9
3 Kurva standar larutan NH
4Cl 100 ppm... 9
1
PENDAHULUAN
Latar Belakang
Metan (CH4) merupakan salah satu gas rumah kaca utama yang dapat menyerap radiasi infra merah sehingga berkontribusi terhadap pemanasan global.
Intergovernmental Panel on Climate Change, IPCC (1992) menyatakan bahwa metan menempati urutan ketiga dalam hal pemanasan global setelah CO2 dan chloro
fluorocarbon (CFC). Salah satu sumber emisi metan berasal dari tanah sawah, oleh karena itu perlu upaya untuk menurunkan laju emisi tersebut tanpa mengorbankan sistem pertanian lahan sawah dan produksi beras Indonesia. Secara alami metan diproduksi di lingkungan anaerob oleh bakteri metanogen, sebesar 43% emisi metan ke atmosfer berasal dari lahan basah dan sawah (Wild 1995). Jumlah metan yang berada di atmosfer 20% berasal dari sawah dan 20% dari lahan rawa (Notohadiprawiro 2006).
Konsentrasi metan di atmosfer pada tahun 1990 adalah 1,72 ppm dengan laju peningkatan 1% per tahun, sedangkan untuk karbon dioksida pada tahun yang sama sebesar 354 ppm dengan laju peningkatan 0,5% per tahun (Lelieveld et al. 1993). Kontribusi peningkatan konsentrasi tersebut terhadap pemanasan global selama seratus tahun terakhir diperkirakan sebesar 19% metan dan 50% untuk CO2 (Bouwman & Sombroek 1990). Bahkan menurut Lelieveld
et al. (1993) dan Hanson & Hanson (1996) kontribusi CH4 dalam perubahan iklim mencapai 26 kali dari CO2. Hal ini disebabkan karena CH4 lebih efektif menyerap radiasi pada panjang gelombang 4 - 100 nm (irradiasi sinar infra merah) dibandingkan dengan CO2. Laju peningkatan konsentrasi metan di atmosfer dua kali lipat dibandingkan dengan CO2, oleh karena itu perlu diantisipasi pengaruhnya terhadap perubahan iklim global di masa mendatang.
Proses oksidasi metan dilakukan oleh bakteri metanotrof pada kondisi aerobik yang terdapat pada lapisan permukaan sedimen sawah (Conrad & Rothfus 1991). Bakteri metanotrof memanfaatkan metan sebagai donor elektron untuk menghasilkan energi dan sebagai sumber karbonnya. Oksidasi CH4 menjadi CO2 oleh bakteri metanotrof di lahan sawah dapat mencapai 80 % dari CH4 yang diproduksi oleh bakteri metanogen (Conrad & Rothfus 1991). Proses oksidasi metan tersebut dapat dilakukan oleh berbagai macam bakteri metanotrof seperti Methylobacter luteus,
Methylosinus trichosporium, Methylococcus capsulatus (Rao 1979).
Bakteri metanotrof dikelompokkan menjadi tiga, yaitu metanotrof tipe I, tipe II, dan tipe X. Pengelompokkan ini berdasarkan atas perbedaan internal membran, lintasan asimilasi formaldehid, dan siklus asam sitratnya. Contoh bakteri metanotrof tipe I adalah Methylomonas dan Methylobacter, contoh tipe II adalah Methylosinus dan
Methylosystis, dan contoh tipe X adalah
Methylococcus capsulatus (Hanson & Hanson, 1996).
Bakteri metanotrof tipe II and tipe X memiliki kemampuan untuk memfiksasi N2 (Hanson & Hanson, 1996). Fiksasi nitrogen adalah proses penambatan nitrogen bebas yang diubah menjadi amonium sehingga dapat dimanfaatkan sebagai sumber nitrogen oleh tanaman. Proses fiksasi nitrogen membutuhkan kondisi yang bebas oksigen, karena keberadaan oksigen akan menghambat ekspresi gen nif yang menyandikan enzim nitrogenase yang mengkatalisis proses fiksasi nitrogen.
Tujuan
Penelitian ini bertujuan mengetahui aktivitas fiksasi nitrogen (N2) bakteri metanotrof asal sawah wilayah Bogor dan Sukabumi pada konsentrasi oksigen (O2) yang berbeda.
Waktu dan Tempat
Penelitian dilakukan pada bulan April hingga Agustus 2009 di Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan adalah media selektif Nitrate Mineral Salts (MgSO4.7H2O 1.0 g/L, CaCl2.6H2O 0.2 g/L, KNO3 1.0 g/L, KH2PO4 0.272 g/L, Na2HPO4.12 H2O 0.717 g/L, NH4Cl 4.0 mg/L, Na2EDTA 0.5 g/L, FeSO4. 7H2O 0.2 g/L, H3BO3 0.03 g/L, CoCl2.6H2O 0.02 g/L, ZnSO4.7H2O 0.01 g/L, MnCl2. 4H2O 3.0 mg/L, Na2MoO4.2H2O 3.0 mg/L, NiCl2.6H2O 2.0 mg/L, CaCl2.2H2O 1.0 mg/L, dan Bacto agar 20 g/L), larutan garam fisiologis, larutan NH4Cl 100 ppm, Milli-Q water, larutan fenol-alkohol (C6H5OH) 10% , larutan Natrium Dihidro Nitroprusid (Na2[Fe(CN)NO]2. H2O) 0,5 %, dan larutan oksidan terdiri atas Natrium Sitrat
2
(C6H5Na3O7.2H2O) 20% dan Natrium Hipoklorit (NaOCl2) 5,25 %.
Metode
Peremajaan Isolat.
Isolat-isolatbakteri metanotrof asal sawah BGM 1, BGM 2, BGM 3, BGM 4, BGM 5, BGM 6, BGM 9, BGM 12, SKM 1, SKM 2, SKM 4, SKM 5, SKM 7, SKM 9, SKM 10, SKM 14, SKM 15, SKM 16, SKM 18 (Hapsari 2008) diremajakan pada medium agar Nitrate Mineral Salts (NMS) + 1% metanol dan diinkubasi pada suhu ruang selama 5-7 hari.
Seleksi Bakteri Metanotrof Pemfiksasi N2.
Sebanyak 1-2 lup isolat bakteri metanotrof dari media agar miring NMS diinokulasikan ke dalam tabung eppendorf steril yang berisi 1 ml larutan garam fisiologis steril selanjutnya eppendorf divortex hingga homogen. Sebanyak 500 µl biakan dari eppendorf diinokulasikan ke dalam botol serum 76 ml yang ditutup butyl rubber septum berisi 10 ml media cair NMS steril tanpa mengandung unsur N. Inkubasi dilakukan pada suhu ruang menggunakan alat shaker selama dua minggu. Kerapatan selnya diukur menggunakan spektrofotometer vis Genesys 20 Perancis λ 200-1000 nm pada OD620 dengan blanko medium NMS cair.
Pengukuran Jumlah Amonium yang
Diakumulasi dalam Biakan.
Sebanyak 1 ml sampel kultur diencerkan dengan 4 ml Milli-Q water dalam botol serum bertutup karet. Sampel ditambah dengan 0.2 ml fenol-alkohol 10% selanjutnya divortex hingga homogen. Setelah itu sampel ditambahkan dengan 0,2 ml Na-nitroprusid 0.5% kemudian divortex kembali hingga homogen. Selanjutnya sampel ditambahkan 0.5 ml campuran Na-sitrat : Na-hipoklorit (1:4). Selanjutnya sampel didiamkan selama satu jam sampai berubah menjadi warna biru (Cleseri et al. 1989). Setelah semua sampel berwarna biru kemudian diukur kadar amoniumnya menggunakan spetrofotometer (640 nm) dan blanko Milli-Q water. Selanjutnya dipilih empat isolat terbaik dari hasil pengukuran amonium yang diakumulasi tersebut, yaitu: BGM 1, BGM 3, BGM 5, dan BGM 9.
Uji Kemampuan Fiksasi N2 Isolat Terpilih pada Konsentrasi O2 Berbeda.
Pengukuran aktivitas fiksasi N2 pada konsentrasi oksigen berbeda dilakukan pada
botol serum steril 76 ml yang ditutup dengan
butyl rubber septum. Botol serum steril volume 76 ml diisi dengan 10 ml medium NMS cair tanpa unsur nitrogen. Kemudian udara saturasi pada masing-masing botol dikondisikan menjadi 10%, 30%, 50%, 80%, dan 100%. Pada botol serum yang ditutup
butyl rubber septum saturasi udara 10% dan 30%, komposisi gas di head space botol serum dibuat kondisi anaerobik dengan cara menghilangkan oksigen yang berada di botol serum. Sebelum gas dimasukkan, terlebih dahulu gas disaring dengan filter steril diameter 47 mm dengan pori 0.45 µm. Pengkondisian udara saturasi dilakukan dengan memperhitungkan volume headspace
botol serum. Udara saturasi dimasukkan pada masing-masing botol serum yang telah diberi perlakuan pembebasan oksigen sebanyak 6.6 ml dan 19.8 ml, sedangkan pada saturasi udara 50% dan 80% dibuat dengan cara udara saturasi dimasukkan pada masing-masing botol serum sebanyak 33 ml dan 13.2 ml, sedangkan untuk udara saturasi 100% tidak diberi perlakuan gas nitrogen murni pada botol serum.
Sebanyak 1-2 lup isolat bakteri metanotrof dari media agar miring NMS diinokulasikan ke dalam tabung eppendorf steril yang berisi 1 ml garam fisiologis steril lalu eppendorf divortex sampai homogen. Kemudian biakan dalam eppendorf diinokulasikan sebanyak 500 µl dengan cara menyuntikkannya menggunakan syringe steril 3 ml dari eppendorf tersebut ke dalam botol serum 76 ml berisi 10 ml media cair NMS steril tanpa unsur nitrogen.
Sampel diambil dengan menggunakan
syringe steril sebanyak 2.5 ml untuk diukur OD sel dengan panjang gelombang OD620 menggunakan spektrofotometer sebelum kultur diinkubasi. Selanjutnya kultur diinkubasi selama dua minggu di atas mesin
shaker pada suhu ruang. Pengukuran jumlah amonium yang diakumulasi dalam kultur dilakukan menggunakan spektrofotometer dengan panjang gelombang 640 nm dan pengukuran OD sel dengan panjang gelombang OD620 pada akhir inkubasi. Jumlah amonium yang diakumulasi dihitung dengan cara:
Keterangan:
a & b = konstanta pada persamaan linier kurva standar NH4Cl
y = OD amonium sampel F.P = faktor pengenceran (4)
[amonium] = y – b – OD amonium awal a x F.P
3
HASIL DAN PEMBAHASAN
Hasil
Peremajaan Isolat
Sebanyak 19 isolat bakteri metanotrof berhasil diremajakan dari 40 isolat metanotrof yang telah diisolasi dari tanah sawah asal Bogor dan Sukabumi (Hapsari 2008). Isolat tersebut terdiri atas: BGM 1, BGM 2, BGM 3, BGM 4, BGM 5, BGM 6, BGM 9, BGM 12, SKM 1, SKM 2, SKM 4, SKM 5, SKM 7, SKM 9, SKM 10, SKM 14, SKM 15, SKM 16, SKM 18.
Gambar 1 Morfologi koloni isolat BGM 1 pada media agar NMS dengan masa inkubasi lima hari pada suhu 27-29oC
Isolat-isolat tersebut menunjukkan warna koloni yang berbeda, yaitu putih (tipis/bening), putih krem (Gambar 1), pink, pink oranye, kuning terang, dan oranye (Hapsari 2008). Kecepatan pertumbuhan koloni tiap isolat pada media agar NMS bervariasi, yaitu mencapai ukuran ± 2 mm dalam waktu 3 - 14 hari.
Aktivitas Fiksasi N2 Bakteri Metanotrof
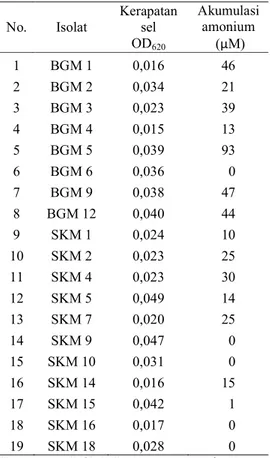
Seleksi uji aktivitas fiksasi nitrogen pada 19 isolat yang berhasil diremajakan pada medium NMS tanpa mengandung unsur N menunjukkan bahwa isolat BGM 1, BGM 3, BGM 5, dan BGM 9 merupakan isolat terpilih karena akumulasi amonium dalam media pertumbuhannya lebih tinggi dibandingkan dengan isolat yang lainnya. Kerapatan sel bakteri tertinggi dari isolat asal sawah Sukabumi (SKM) ditunjukkan oleh isolat SKM 5 dengan nilai OD620 sebesar 0.049, sedangkan isolat asal sawah Bogor (BGM)
ditunjukkan oleh BGM 12 dengan nilai OD620 sebesar 0.040 (Tabel 1).
Tabel 1 Kerapatan sel (OD620) dan akumulasi amonium pada kultur bakteri metanotrof pada media agar NMS dengan masa inkubasi 14 hari pada suhu 27-29oC No. Isolat Kerapatan sel OD620 Akumulasi amonium (µM) 1 BGM 1 0,016 46 2 BGM 2 0,034 21 3 BGM 3 0,023 39 4 BGM 4 0,015 13 5 BGM 5 0,039 93 6 BGM 6 0,036 0 7 BGM 9 0,038 47 8 BGM 12 0,040 44 9 SKM 1 0,024 10 10 SKM 2 0,023 25 11 SKM 4 0,023 30 12 SKM 5 0,049 14 13 SKM 7 0,020 25 14 SKM 9 0,047 0 15 SKM 10 0,031 0 16 SKM 14 0,016 15 17 SKM 15 0,042 1 18 SKM 16 0,017 0 19 SKM 18 0,028 0 Keterangan: BGM= Bogor metanotrof SKM= Sukabumi metanotrof
Meskipun secara umum isolat SKM memiliki nilai OD sel yang lebih tinggi namun berdasarkan jumlah amonium yang diakumulasi isolat BGM secara umum memiliki nilai konsentrasi amonium yang lebih tinggi. Berdasarkan pengukuran jumlah amonium yang diakumulasi, diperoleh empat isolat terbaik dalam pembentukan amonium yaitu isolat BGM 5, BGM 9, BGM 1, dan BGM 3. Jumlah amonium yang diakumulasi oleh isolat BGM 5 adalah 93 µM, isolat BGM 9 sebesar 47 µM, isolat BGM 1 sebesar 46 µM, dan isolat BGM 3 sebesar 39 µM. Isolat BGM 5 memiliki nilai konsentrasi amonium tertinggi yaitu 93 µM.
4
Aktivitas Fiksasi N2 Isolat Terpilih pada Konsentrasi O2 Berbeda
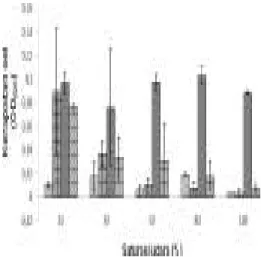
Setelah inkubasi selama 14 hari isolat terpilih menunjukkan kerapatan sel berbeda-beda pada konsentrasi oksigen berberbeda-beda (Gambar 2). Secara umum kerapatan sel empat isolat rendah pada saturasi udara 100% yaitu antara OD 0.003 dan 0.088 (OD620). Kerapatan sel tertinggi pada saturasi udara 100% dimiliki oleh isolat BGM 5 dengan OD 0.088. Kerapatan sel secara umum tinggi pada saturasi udara 10% yaitu antara OD 0.01 dan 0.097 (OD620). Kerapatan sel tertinggi pada saturasi udara 10% dimiliki oleh isolat BGM 5 dengan OD 0.097 (OD620).
Gambar 2 Kerapatan sel kultur BGM 1, BGM 3, BGM 5, BGM 9 pada beberapa konsentrasi oksigen menggunakan media agar NMS dengan masa inkubasi 14 hari pada suhu 27-29oC.
Hasil uji fiksasi N2 terhadap isolat BGM 1, BGM 3, BGM 5, dan BGM 9 pada konsentrasi O2 berbeda yaitu 10%, 30%, 50%, 80%, dan 100% menunjukkan jumlah amonium yang diakumulasi berbeda tiap isolatnya (Gambar 3). Secara umum jumlah amonium yang diakumulasi rendah pada saturasi udara 100% yaitu antara 0 dan 46.027 µM. Jumlah amonium yang diakumulasi tertinggi pada saturasi udara 100% dimiliki oleh isolat BGM 9 yaitu 46.027 µM. Jumlah amonium yang diakumulasi secara umum tinggi pada saturasi udara 30%, jumlah yang tertinggi pada saturasi udara 30% dimiliki oleh isolat BGM 9 yaitu 88.816 µM.
Gambar 3 Konsentrasi amonium dalam kultur BGM 1, BGM 3, BGM 5, BGM 9 pada beberapa
konsentrasi oksigen menggunakan media agar NMS dengan masa inkubasi 14 hari pada suhu 27-29oC.
Pembahasan
Bakteri metanotrof merupakan bakteri pengoksidasi metan pada kondisi aerob menggunakan sistem enzim spesifik yaitu metan monooksigenase (MMO) (Madigan et al. 2000). Isolat BGM 1, BGM 3, BGM 5, dan BGM 9 merupakan isolat terpilih karena dapat mengakumulasi amonium lebih tinggi dibandingkan dengan isolat lainnya. Amonium yang diakumulasi isolat BGM 12 memang cukup tinggi bila dibandingkan dengan isolat BGM 3, namun pemilihan isolat BGM 3 dikarenakan isolat tersebut termasuk dalam empat isolat terbaik pengoksidasi metan (Hapsari 2008). Perbedaan amonium yang diakumulasi dipengaruhi faktor pertumbuhan bakteri metanotrof dan aktivitas enzim nitrogenase.
Pada uji aktivitas fiksasi nitrogen menggunakan medium bebas N dengan konsentrasi udara yang berbeda (10%, 30%, 50%, 80%, dan 100%), pertumbuhan bakteri berbeda yang ditunjukkan oleh nilai kerapatan sel yang berbeda pada tiap isolatnya. Secara umum kerapatan sel keempat isolat rendah pada saturasi udara 100% dan tinggi pada saturasi udara 10%. Hal ini diduga bakteri menggunakan sumber N dari udara untuk pertumbuhannya. Tingkat pertumbuhan tertinggi bakteri metanotrof tipe I dan II terdapat pada medium tanpa unsur N terdapat pada konsentrasi oksigen yang rendah (Auman et al. 2001).
5
Pengamatan yang dilakukan terhadap kerapatan sel kultur cair isolat metanotrof terpilih menunjukkan kerapatan sel yang kecil. Kecilnya peningkatan kerapatan menunjukkan bahwa pertumbuhan isolat sangat lambat. Bakteri metanotrof merupakan bakteri yang tumbuh lambat (Begonja & Hrsák 1998), bahkan pada media agar NMS koloni bakteri ini baru tumbuh optimal pada umur 14 hari inkubasi.
Akumulasi amonium terendah dihasilkan oleh isolat BGM 1 dan BGM 5, sedangkan akumulasi amonium tertinggi dihasilkan oleh isolat BGM 9 (Gambar 3). Aktivitas nitrogenase akan terhambat apabila terdapat oksigen, namun oksigen juga dibutuhkan dalam respirasi aerob bakteri metanotrof untuk menghasilkan ATP yang mendukung aktivitas nitrogenase. Bakteri metanotrof tipe II umumnya hanya mampu memfiksasi nitrogen pada kondisi mikroaerofil (Murrel & Dalton 1983).
Proses fiksasi N2 menggunakan enzim nitrogenase. Enzim tersebut sangat peka terhadap keberadaan oksigen yang tinggi. Hal ini karena oksigen yang tinggi akan menghambat ekspresi gen nifD dan nifH yang menyandikan enzim nitrogenase (Auman et al, 2001). Oleh karena itu, oksigen dibutuhkan dalam jumlah sedikit untuk kecepatan fiksasi N2 maksimum (James & Olivares, 1997). Hasil penelitian yang telah dilakukan menunjukkan bahwa jumlah amonium yang diakumulasi rendah pada konsentrasi oksigen 100%.
Ketersediaan sumber energi (C-organik) di lingkungan rizosfer merupakan faktor utama yang menentukan banyaknya nitrogen yang dihasilkan (Alexander 1977; Zuberer & Silver 1998). Proses fiksasi satu molekul nitrogen membutuhkan 16 molekul ATP untuk selanjutnya diubah menjadi dua molekul amonia yang dalam proses ini dikatalisis oleh enzim nitrogenase.
SIMPULAN
Sebanyak empat isolat bakteri metanotrof memiliki aktivitas fiksasi nitrogen yang tinggi yaitu isolat BGM 1, BGM 3, BGM 5, dan BGM 9. Kerapatan sel tertinggi yang ditumbuhkan pada konsentrasi oksigen berbeda dimiliki oleh isolat BGM 5 dengan OD 0.103 (OD620) pada saturasi udara 80%. Jumlah amonium yang diakumulasi tertinggi dimiliki oleh isolat BGM 9 yaitu 88.816 µM pada saturasi udara 30%.
SARAN
Karakterisasi bakteri terbaik dalam memfiksasi nitrogen dan uji potensi untuk efektivitasnya di laboratorium dan di lapang perlu dilakukan.
DAFTAR PUSTAKA
Alexander M. 1977. Introduction to Soil Mycrobiology. Ed ke-2. New York : John Wiley and Sons.
Auman AJ, Speake CC, Lidstrom ME. 2001. nifH sequences and nitrogen fixation in type I and type II Methanotrophs. Appl Environ Microbiol67: 4009-4016. Begonja A, Hrsák D. 1998. Growth
characteristics and metabolic activities of the methanotrophic-heterotrophic groundwater community. J Appl Microbiol 85: 448-456.
Bouwman AF, Sombroek WG. 1990. Inputs to climate change by soil and agriculture related activities. Di dalam: Scharpenseel HW, Scomaker M, Ayoup A. (eds.) Soil on a warmer Earth. Elsivier. Amsterdam: hlm. 15-30.
Cleseri LS, Greenberg AE and Trussel RR. 1989. Standard Method For The Examination of Water and Waste Water. Port City Press. Baltimore. Conrad R, Rothfus F. 1991. Methane
oxidation in the soil surface layer of a flooded rice field and the effect of ammonium. Biol Fertil Soil12: 28-32. Hanson R, Hanson TE. 1996. Methanotrophic
Bacteria. J Microbiol Reviews60: 439-471.
Hapsari W. 2008. Isolasi dan karakterisasi bakteri metanotrof asal sawah di Bogor dan Sukabumi [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[IPCC] Intergovernmental Panel on Climate Change. 1992. The Suplementary Report to The IPCC Scientific. Hougton JT, Callendar BA, Varney SK, editor. Cambridge: Cambridge University Press.
James E, Olivares FL. 1997. Infection and colonization of sugarcane and other graminaceous plants by endophytic diazotrophs. Plant science 17: 77-119
6
Lelieveld J, Crutzen PJ, Bruhl C. 1993. Climate effects of atmospheric methane. Chemosphere26: 739–768. Madigan MT, Martinko JM, Parker J. 2000.
Brock Biology of Microorganisms. Ed ke-9. New Jersey : Prentice Hall. Murrell JC, Dalton H. 1983. Nitrogen Fixation
in Obligate Methanotrophs. J of General Microbiol129: 3481-3486. Notohadiprawiro T. 2006. Sawah dalam Tata
Guna Lahan. Yogyakarta: UGM Press. Rao NSS. 1979. Recent Advances in
Biological Nitrogen Fixation. New Delhi: Oxford and IBH Publishing Co. Wild A. 1995. Soils and The Environment: An
Introduction. Cambridge: Cambridge University Press.
Zuberer DA, Silver WS. 1998. Biological dinitrogen fixation (Acetylene reduction) associated with florida mangrove. Appl Environ Microbiol35: 567-575.
8
Lampiran 1 Kerapatan sel kultur isolat terpilih pada beberapa konsentrasi oksigen Isolat Saturasi
udara (%) Ulangan OD620 Rata-rata st. error
BGM 1 10 1 0,009 0,011 0,002 2 0,012 30 1 0,009 0,018 0,012 2 0,026 50 1 0,003 0,006 0,004 2 0,009 80 1 0,020 0,020 0,001 2 0,019 100 1 0,004 0,004 0,000 2 0,004 BGM 3 10 1 0,052 0,090 0,053 2 0,127 30 1 0,030 0,037 0,010 2 0,044 50 1 0,006 0,010 0,006 2 0,014 80 1 0,004 0,008 0,006 2 0,012 100 1 0,005 0,003 0,003 2 0,001 BGM 5 10 1 0,103 0,097 0,008 2 0,091 30 1 0,111 0,077 0,049 2 0,042 50 1 0,093 0,098 0,006 2 0,102 80 1 0,108 0,103 0,007 2 0,098 100 1 0,089 0,089 0,001 2 0,088 BGM 9 10 1 0,079 0,077 0,003 2 0,075 30 1 0,046 0,034 0,017 2 0,022 50 1 0,009 0,031 0,031 2 0,053 80 1 0,027 0,019 0,012 2 0,01 100 1 0,005 0,008 0,004 2 0,01
9
Lampiran 2 Akumulasi amonium dalam kultur metanotrof pada beberapa konsentrasi oksigen Isolat Saturasi udara (%) [Amonium] µM BGM 1 10 1,798 30 6,832 50 0,360 80 5,034 100 0 BGM 3 10 18,339 30 31,643 50 44,229 80 7,551 100 3,596 BGM 5 10 0 30 7,911 50 0 80 5,394 100 0 BGM 9 10 66,882 30 88,817 50 51,420 80 7,551 100 46,027