TINJAUAN PUSTAKA
Morfometrika dan Hidrodinamika Waduk Djuanda
Waduk Djuanda merupakan salah satu waduk di Jawa Barat yang dibangun di bagian tengah aliran sungai Citarum, terletak pada ketinggian 110 m dpl (diatas permukaan laut), pada 6o25’-6o35’ LS dan 107o22’- 107o30’ BT. Di bagian hulu waduk Djuanda terdapat Waduk Cirata dengan luas 6.200 ha dan Waduk Saguling dengan luas 5.340 ha sehingga tiga waduk ini membentuk waduk berjenjang (“cascade”) seperti terlihat pada Gambar 3.
Morfometrika waduk Djuanda berdasarkan data dari Perum Jasa Tirta II (dulu Perum Otorita Jatiluhur) tertera pada Tabel 1. Permukaan air waduk Djuanda berfluktuasi antara 92,9–106,8 m diatas permukaan laut atau sekitar 13,9 m per tahun. Volume air yang masuk waduk berkisar antara 83,76-221,87 m3/dt dan air yang dikeluarkan dari waduk berkisar antara 112,97-197,84 m3/dt (PJT II, 2002).
Tabel 1. Morfometrika waduk Djuanda
Parameter Morfometri Unit Nilai Luas permukaan air maksimum ha 8.300 Luas permukaan air minimum ha 5.847
Kedalaman maksimum m 97
Kedalaman rata-rata m 35,59
Volume waduk maksimum m3 2.954 x 106
Panjang garis pantai km 163
Pengembangan garis tepi 5.0
Ekosistem perairan waduk Djuanda yang dalam dengan kemiringan dasar perairan yang curam (rata-rata kemiringan 30o) terdiri atas tiga zona utama yaitu zona littoral, zona limnetik dan zona profundal. Zona littoral adalah daerah dangkal, bagian pinggir waduk dimana intensitas cahaya matahari dapat menembus sampai dasar perairan. Zona limnetik adalah daerah perairan terbuka setelah zona littoral, dari permukaan air sampai kedalaman tertentu dimana intensitas cahaya matahari masih efektif untuk berlangsungnya proses fotosintesis. Dengan demikian, kedalaman zona limnetik akan berubah tergantung kepada turbiditas perairan.
Gambar 3. Waduk berjenjang Djuanda, Cirata dan Saguling
Kecerahan air di zona limnetik berkisar antara 100-150 cm atau secara empiris penetrasi cahaya matahari hanya efektif sampai kedalaman antara 2,5-5 m. Berdasarkan fluktuasi permukaan air dan kecerahan air tersebut maka zona limnetik waduk Djuanda ditaksir mempunyai luas permukaan air antara 5.200-7.100 ha atau 63-86% dari total luasnya. Sisanya dengan luas antara 1.200-3.100 ha atau 14-37% dari luas total merupakan zona litoral. Zona profundal adalah daerah terdalam setelah zona limnetik sampai dasar perairan, tanpa cahaya matahari.
Pengaruh Peningkatan Unsur Hara N dan P terhadap Produksi dan
Pertumbuhan Fitoplankton di Zona Limnetik Waduk
Kualitas air waduk Djuanda mengalami perubahan sejak waduk selesai dibangun (tahun 1967) dan mengalami perubahan kembali setelah waduk Saguling (tahun 1983) dan Cirata (tahun 1985) selesai dibangun sampai dengan berkembangnya budidaya ikan dalam keramba jaring apung (KJA) di ketiga waduk tersebut. Sebelum waduk Cirata dan Saguling selesai dibangun sampai dengan sebelum budidaya ikan dalam KJA berkembang, tingkat trofik waduk Djuanda termasuk ke dalam perairan oligotrofik dan kemudian pada tahun 1988 telah berubah menjadi mesotrofik dengan produktivitas primernya berkisar antara 390-1.647 mgC/m3/hari (Nuroniah dan Kartamihardja, 1988). Proses eutrofikasi tersebut terus berlanjut dan pada tahun 2000, rata-rata produktivitas primernya meningkat menjadi 2.800 mgC/m3/hari (Sarnita, 2001) sehingga waduk tersebut sudah termasuk kedalam perairan eutrofik sampai hypereutrofik (Nastiti et al., 2001a).
Di Waduk Djuanda, penambahan unsur N dan P yang utama berasal dari sisa pakan dan kotoran ikan dalam budidaya KJA, baik budidaya ikan yang ada di waduk Djuanda maupun di waduk Cirata. Kandungan total N dan P Waduk Djuanda pada tahun 1988 masing-masing berkisar antara 0,11-1,05 mg/l dan 0,060-0,24 mg/l (Nuroniah dan Kartamihardja, 1988).
Nastiti et al. (2001) menyatakan bahwa beban total N dan P dari kegiatan budidaya KJA di waduk Saguling berturut-turut adalah 142.967,3 kg dan 8.334,5 kg; di waduk Cirata: 2.943.850,1 kg dan 168.187,1 kg serta di waduk Jatiluhur (Djuanda): 55.143,5 kg dan 2.979,5 kg. Penyumbang total N dan P terbesar di ketiga waduk berasal dari pakan yang terbuang dan kotoran ikan yaitu 91,3-99,9%. Jumlah total N dan P yang masuk ke perairan secara berlebihan tersebut telah menurunkan kualitas air, daya dukung perairan serta menurunkan produktivitas KJA.
Di ekosistem akuatik, phosfor (P) dan nitrogen (N), serta silika (S) untuk diatom, adalah nutrien yang paling potensial membatasi pertumbuhan fitoplankton (Hecky and Kilham, 1988). Nutrien yang membatasi laju reproduktif suatu populasi mungkin juga bervariasi diantara spesies fitoplankton yang berbeda (Sommer, 1989). Fosfor adalah tipe nutrien pembatas di perairan danau (Schindler, 1977; Henry et al., 1985; Hecky et al., 1993; Jansson, 1998; Saunders et al., 2000) sedangkan N hanya kadang-kadang saja menjadi faktor
pembatas. Nutrien yang membatasi produksi fitoplankton mungkin bervariasi baik secara temporal maupun spasial bergantung kepada masukan N dan P dari daerah tangkapan dan sedimen danau, atmosfer (Levine and Schindler, 1992) serta resiklus nutrien di danau (Schindler et al., 1993). Disamping nutrien utama, beberapa nutrien pembatas (trace elements) mungkin juga menghambat pertumbuhan fitoplankton. Sebagai contoh, ketersediaan Fe adalah faktor pembatas potensial bagi produksi primer di danau (Jones, 1992). Sebaliknya, ketersediaan karbon anorganik terlarut (dissolved inorgganic carbon, DIC) jarang menjadi faktor pembatas bagi produksi primer di daerah pelagis (Schindler et al., 1972), sebab danau adalah tipikal perairan yang biasanya supersaturasi dengan karbon dioksida (Cole et al., 1994).
Fitoplankton merupakan salah satu produser primer yang melakukan fotosintesis sehingga fitoplankton berperanan sangat penting dalam siklus energi di perairan. Produktivitas primer perairan bervariasi tergantung kepada kesuburannya, sebagai contoh danau yang telah mengalami eutrofikasi lanjut mempunyai produktivitas primer bersih sekitar 2,400 kcal/m2/tahun.
Di sistem akuatik, produser primer dipengaruhi oleh sumberdaya (pengaruh dari bawah atau bottom-up effects) dan konsumer (pengaruh dari atas atau top-down effects) (McQueen et al., 1986; 1989). Kedua mekanisme pengendalian tersebut berfungsi secara simultan (Vanni, 1996) dimana peranan kepentingannya mungkin bervariasi (Hansson, 1992; Saunders et al., 2000) tergantung kepada sistemnya. Di daerah pelagis danau, ketersediaan nutrien merupakan kekuatan “dari bawah” yang utama mempengaruhi produser primer. Pengaruh “dari bawah” tersebut akan semakin kuat pada tingkat trofik yang berdekatan dengan produser primer, dan secara bertahap akan menurun serta akan tidak dapat diprediksi jika bergerak menuju tingkatan trofik yang paling tinggi (McQueen et al., 1986; 1989).
Carpenter et al. (1985) menyatakan bahwa dua proses utama yang menentukan produktivitas primer di danau adalah pasok nutrien yang akan menentukan potensi produktivitas tingkat trofik dan resiklus serta pengambilalihan nutrien pada tingkat trofik berbeda yang akan menentukan produktivitas sebenarnya. Oleh karena itu, perbedaan jejaring makanan di sistem akuatik dan herbivor, karnivor alami serta resiklus nutrien berikutnya dapat menggambarkan perbedaan dalam produktivitas primer perairan dalam hubungannya dengan keberadaan pasokan nutrien.
Pengaruh Grazing Zooplankton terhadap Pertumbuhan
Komunitas Fitoplankton di Zona Limnetik Waduk
Biomassa fitoplankton ditentukan oleh pengaruh grazing zooplankton, laju konsumsi ikan pemakan plankton dan laju pertumbuhan serta mortalitas fitoplankton tersebut. Pada umumnya, selektifitas makanan pada grazing zooplankton ditentukan oleh ukuran partikel makanan (Wetzel, 1983). Sebagai contoh di danau Oglethorpe, microzooplankton yang berukuran 200 µm ternyata memakan mikroba yang lebih kecil, sedangkan macrozooplankton terutama mengkonsumsi fitoplankton berukuran lebih besar (Porter et al., 1996).
Balseiro and Modenutti (1998) menyatakan bahwa pengelompokkan zooplankton (zooplankton assemblages) mempengaruhi komunitas fitoplankton dalam dua cara. Pertama, spesies zooplankton tertentu mempunyai selektifitas grazing terhadap ukuran fitoplankton tertentu yang berdampak langsung terhadap spesies fitoplankton yang ada. Kedua, resiklus nutrien oleh zooplankton dapat mempengaruhi besaran dan terbatasnya nutrien secara alami dalam waduk sehingga mempengaruhi kompetisi nutrisi diantara fitoplankton. Di danau Andean, dua pengelompokkan zooplankton secara nyata terlihat bergantian mendominasi daerah pelagis danau. Pada musim dingin dan musim semi, populasi zooplankton didominasi oleh calanoid, Boeckella gracilipes. Sedangkan pada pertengahan musim panas didominasi oleh cladocera, Bosmina longirostris. Oleh karena rasio N:P dari Bosmina dan Boeckella berbeda maka terjadi pergeseran musiman didalam keterbatasan nutrien di danau tersebut. Bosmina meningkatkan unsur pembatas P, sedangkan Boeckella menurunkan unsur pembatas P. Periode calanoid dapat ditekan pada waktu tersebut jika terjadi suatu peremajaan ikan pemakan plankton, Galaxias maculatus yang besar dimana larva dari ikan tersebut menyenangi nauplii copepod. Pengaruh predasi ikan (pengaruh dari atas) tidak hanya mempengaruhi fitoplankton secara langsung dengan berubahnya jumlah grazing organisme yang bersifat herbivor tetapi juga dengan berubahnya jumlah resiklus nutrien secara alami oleh organisme herbivor.
Variasi musiman dan pergeseran jangka panjang pada kelimpahan jenis zooplankton yang berbeda adalah sesuatu yang umum terjadi di habitat akuatik. Oleh karena terjadi perbedaan dalam bentuk pemakanan dan selektivitas mangsa diantara spesies zooplankton, pergeseran kelimpahan musiman dapat secara dramatis berpengaruh terhadap beberapa proses ekosistem di waduk.
Brett et al. (1994) melaporkan bahwa pergeseran pada struktur komunitas zooplankton di danau Castle, California meningkatkan biomassa fitoplankton dan produksi primer serta menurunkan kecerahan air. Daphnia dan Holopedium yang makan dengan cara menyaring makanannya (filter-feeding) dan calanoid copepod, Diaptomus yang bersifat raptorial dan menyaring makanannya meningkatkan konsentrasi nutrien terlarut, menurunkan biomassa fitoplankton sehingga menyebabkan pergeseran didalam komposisi jenis fitoplankton, tetapi tidak mempengaruhi kelimpahan microzooplankton, bakterioplankton serta produksi primer. Diacyclops yang bersifat raptorial mengurangi kelimpahan microzooplankton tetapi sangat kecil sekali mempengaruhi parameter lainnya. Hasil tersebut menandakan bahwa pergeseran musiman dan pergeseran jangka panjang struktur komunitas zooplankton dapat secara dramatis menghambat proses ekosistem di danau Castle, California.
DeMott (1986) menyatakan bahwa rasa memegang peranan penting dalam seleksi makanan oleh zooplankton. Selektifitas pemakanan beberapa spesies zooplankton ditentukan oleh aroma di lingkungannya. Daphnia sp. yang sifat makannya filtrasi tidak terlalu sensitif terhadap aroma dan secara tidak sengaja mencerna partikel dengan kisaran ukuran tertentu, sedangkan copepoda, Bosmina sp. yang makannya bersifat grasping (grasping-feeders) lebih selektif. Rotifer menunjukkan respon yang beragam. Selektifitas makan dan sensitifitas terhadap rasa diantara taksa zooplankton (rotifer, copepod dan cladocera) menunjukkan bahwa zooplankton bukan kelompok fungsional homogen dari herbivor ataupun predator. Perbedaan spesifik spesies tersebut dalam selektifitas makanan mungkin mempunyai implikasi penting terhadap interaksi kompetisi diantara zooplankton dan tekanan grazing terhadap produser primer.
Grazing zooplankton dapat secara langsung mempengaruhi komposisi fitoplankton dan aktifitas fotosintesis melalui grazing secara selektif terhadap populasi fitoplankton (Gliwicz, 1975). Lebih lanjut dikatakan bahwa zooplankton dapat secara tidak langsung mempengaruhi aktifitas fotosintesis melalui regenerasi nutrien. Dari delapan faktor lingkungan yang diuji, yaitu insiden radiasi, suhu, total aliran pada kedalaman epilimnion, chlorophyll-a, pheopigments, intensitas grazing, sumbangan nannoplankton dan keragaman spesies menunjukkan bahwa prediktor yang paling nyata berpengaruh terhadap efisiensi fotosintesis adalah intensitas grazing. Suatu argumen menyatakan
bahwa semakin banyak nutrien tersedia untuk pertumbuhan alga maka proses fotosintesisnya semakin efisien. Korelasi data tersebut sesuai dengan hasil percobaan mesocosm di alam dengan perlakuan jumlah relatif yang berbeda dari tiga klas ukuran fitoplankton dan dengan atau tanpa Daphnia pulex. Hasil riset tersebut menunjukkan bahwa keberadaan grazer mengindikasikan terjadinya peningkatan laju fotosintesis per unit fitoplankton dan per unit khlorofil-a.
Hansen et al. (1997) menyatakan bahwa aliran karbon di ekosistem akuatik pada umumnya tergantung pada peranan herbivorous zooplankton meskipun zooplankton bukan satu-satunya kelompok fungsional yang homogen. Diantara spesies zooplankton terdapat perbedaan dalam hal laju pencernaan maksimum dan laju pengosongan makanan. Dari sekitar 60 species zooplankton yang berukuran antara 2-2,000 µm menunjukkan bahwa laju pencernaan dan laju pengosongan makanan menurun dengan menurunnya volume herbivorous zooplankton dengan nilai eksponen –0,23. Nilai eksponen tersebut adalah skala yang umum terjadi meskipun terdapat perbedaan yang nyata diantara kelompok zooplankton dengan ukuran tubuh yang sama.
Diantara protists, laju pencernaan dan laju pengosongan makanan pada ciliata adalah 2-4 kali lebih besar dari pada dinoflagellata. Diantara metazooplankton calanoid, laju pencernaan dan pengosongan makanan pada copepoda adalah satu tingkat lebih besar dari pada cladocera. Hal ini mungkin ada hubungannya dengan perbedaan dalam siklus hidup dan lebar relung. Oleh karena itu, dalam hubungannya dengan aliran karbon dalam jejaring makanan di sistem akuatik, zooplankton harus dipertimbangkan sebagai sejumlah kelompok fungsional yang berbeda. Kelompok fungsional tersebut dapat didasarkan pada ukuran tubuh (misal ciliata dengan mesozooplankton) dan kemungkinan strategi siklus hidup yang berbeda, misal copepoda dengan cladocera.
Havens (1999) melakukan studi untuk menjembatani perbedaan antara struktur komunitas (hubungan jejaring makanan, ukuran partikel dan kekayaan taksonomis) dan fungsi komunitas (efisiensi transfer ekologis). Empat model dinamika komunitas akuatik digunakan untuk mengembangkan metodologi yang mungkin berkorelasi dengan fungsi komunitas dan dibandingkan dengan 24 pengelompokan zooplankton yang diambil dari danau Okeechobee, Florida. Empat model tersebut adalah: (1) keterkaitan jejaring makanan (connectance webs), (2) diagram alir karbon (carbon flow diagrams), (3) spektra ukuran partikel (particle size-spectra) dan (4) evaluasi taksonomi (taxonomic evaluations).
Keterkaitan jejaring makanan atau peningkatan kompleksitas tidak menurunkan efisiensi transfer ekologis. Keterkaitan jejaring adalah prediktor yang sangat yang mendasar dan berguna dari beberapa sifat komunitas. Peningkatan kompleksitas jejaring makanan zooplankton ternyata meningkatkan panjangnya rantai makanan tetapi sebagai gantinya direfleksikan dengan meningkatnya omnivor. Beberapa omnivor makan lebih selektif dan sebagai akibatnya mengurangi transfer karbon ke tingkat trofik yang lebih tinggi bilamana mereka mendominasi pengelompokan plankton. Persentase Daphnia juga merupakan prediktor yang baik bagi efisiensi trofik disamping spektra ukuran. Terdapat hubungan yang konsisten antara ukuran zooplankton dan kemampuannya dalam mengeksploitasi produser primer. Bilamana zooplankton yang berukuran kecil dominan, jumlah karbon yang mengalir melalui jejaring makanan mikroba (microbial food web) lebih besar sehingga menurunkan efisiensi trofik zooplankton.
Dinamika musiman komunitas fitoplankton di danau temperate dapat dibedakan kedalam dua tipe dengan dua status yang saling bergantian (Lehman, 1980). Lebih lanjut dikatakan bahwa pada awal musim pertumbuhan, faktor-faktor abiotik mengendalikan pertumbuhan populasi sedangkan pada akhir musim pertumbuhan interaksi biotik berpengaruh sangat kuat terhadap suksesi komunitas. Faktor biotik yang penting adalah tekanan grazing yang selektif terhadap ukuran (size-selective) dari herbivor yang berbeda. Disamping itu, faktor biotik penting lainnya adalah resiklus nutrien oleh herbivor yang terjadi melalui eksresi dan pemecahan atau pemakanan sebagian sel alga. Percobaan di laboratorium dengan Daphnia pulex dan alga Chlamydomonas reinhardtii memperlihatkan bahwa peningkatan daur ulang nutrien berakibat terhadap peningkatan laju pertumbuhan intrinsik algae. Daphnia mendaur ulang antara 35-60% dari total herbivor mencerna P per hari. Laju P yang dilepas sama dengan yang terjadi pada protozoa dan rotifer.
Model Jejaring Makanan dan Transfer Efisiensi Trofik
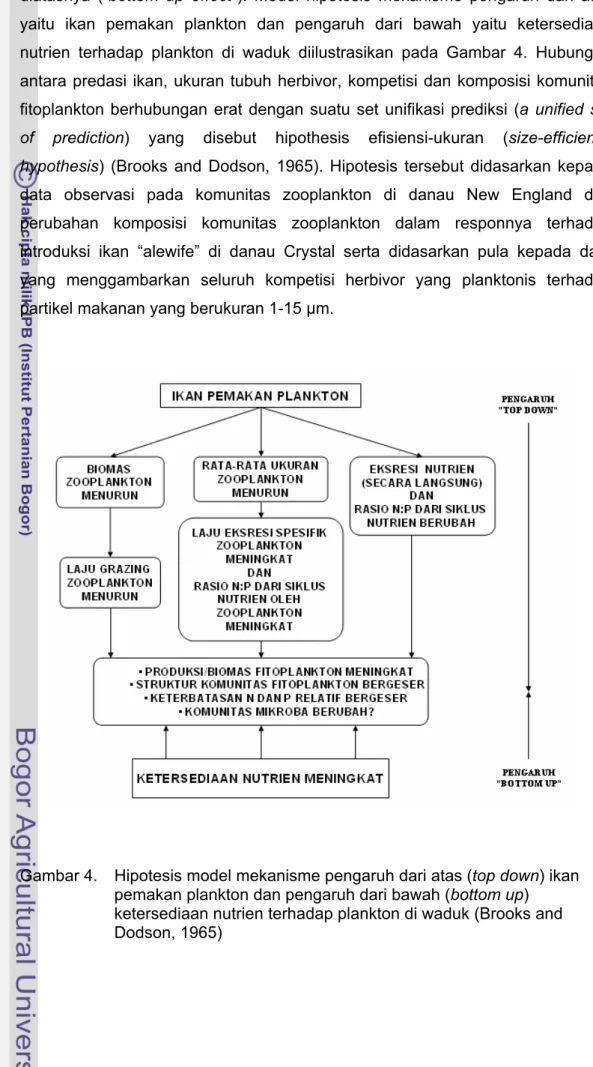
Model jejaring makanan menggambarkan hubungan keterikatan antar kompartemen mulai tingkatan trofik terrendah sampai dengan tingkatan trofik tertinggi. Di dalam jejaring makanan terdapat mekanisme saling mempengaruhi antara tingkatan trofik paling atas terhadap tingkatan trofik di bawahnya (“top down effect”) dan sebaliknya dari tingkatan trofik paling bawah ke tingkatan trofik
diatasnya (“bottom up effect”). Model hipotesis mekanisme pengaruh dari atas yaitu ikan pemakan plankton dan pengaruh dari bawah yaitu ketersediaan nutrien terhadap plankton di waduk diilustrasikan pada Gambar 4. Hubungan antara predasi ikan, ukuran tubuh herbivor, kompetisi dan komposisi komunitas fitoplankton berhubungan erat dengan suatu set unifikasi prediksi (a unified set of prediction) yang disebut hipothesis efisiensi-ukuran (size-efficiency hypothesis) (Brooks and Dodson, 1965). Hipotesis tersebut didasarkan kepada data observasi pada komunitas zooplankton di danau New England dan perubahan komposisi komunitas zooplankton dalam responnya terhadap introduksi ikan “alewife” di danau Crystal serta didasarkan pula kepada data yang menggambarkan seluruh kompetisi herbivor yang planktonis terhadap partikel makanan yang berukuran 1-15 µm.
Gambar 4. Hipotesis model mekanisme pengaruh dari atas (top down) ikan pemakan plankton dan pengaruh dari bawah (bottom up)
ketersediaan nutrien terhadap plankton di waduk (Brooks and Dodson, 1965)
Zooplankton ukuran besar ternyata makan lebih efisien dan dapat memakan partikel yang lebih besar. Dengan demikian, jika predasi (terutama oleh ikan) rendah, zooplankton yang berukuran besar akan bersaing penuh dengan zooplankton berukuran kecil dan sebaliknya akan terjadi jika predasi tinggi. Jika prediksi tersebut dianggap benar, maka hal tersebut sangat berimplikasi terhadap perubahan struktur komunitas fitoplankton. Zooplankton berukuran besar akan memakan baik net-fitoplankton maupun nannoseston sedangkan zooplankton berukuran kecil tidak akan memakan fitoplankton tersebut sehingga populasinya menjadi lebih melimpah.
Järvinen (2002) menyatakan bahwa di danau yang hanya terdapat beberapa atau tidak ada ikan pemakan plankton dicirikan dengan spesies zooplankton yang berukuran besar. Sebaliknya, danau yang dihuni oleh populasi ikan pemakan plankton yang melimpah (terutama European perch, Perca fluviatilis) mempunyai rata-rata distribusi ukuran zooplankton lebih kecil. Hal ini direfleksikan dalam distribusi biomassa fitoplankton di kolom air. Di danau dengan cladocera berukuran besar, biomassa fitoplankton di lapisan epilimnion rendah, yang menggambarkan pengaruh yang kuat dari grazing zooplankton terhadap algae di lingkungan perairan yang tanpa ikan pemakan plankton. Kondisi ini juga dapat dilihat setelah introduksi suatu tingkatan trofik baru, yaitu ikan pemakan plankton “whitefish” (Coregonus lavaretus) di danau L. Mekkojärvi. Beberapa pengaruh bertingkat yang diamati di danau meliputi: pengambil alihan Daphnia dan rotifer, peningkatan produksi dan biomassa fitoplankton, peningkatan biomassa protozoa, dan potensi pergeseran keterbatasan nutrien bagi fitoplankton. Hasil studi tersebut menggambarkan bahwa tingkatan terrendah dari jejaring makanan di danau dipengaruhi oleh ketersediaan sumberdaya dan interaksi predator-prey. Hal ini menunjukkan bahwa dengan tidak adanya ikan, Daphnia berukuran besar dapat berperan sentral dalam interaksi jejaring makanan. Daphnia dapat mengatur secara kuat kelimpahan fitoplankton dan protozoa, dan memberikan kontribusi nyata dalam siklus nutrien. Hasil tersebut juga menggambarkan bahwa respon ekosistem terhadap pertubasi mungkin bervariasi karena adanya interaksi trofik yang kompleks dan kompensasi respon potensial.
Produksi ikan di suatu perairan sebagian besar tergantung pada produk-tivitas primer dan sebagian lagi tergantung pada tingkat pemanfaannya (Jones, 1992). Lebih lanjut dikatakan bahwa tingkat produksi primer dan tingkat
pemanfaatan ikan ukuran komersial adalah saling bergantung satu sama lain. Jika produksi primer meningkat, maka ukuran partikel pada tiap tingkatan trofik cenderung meningkat. Pada umumnya, rata-rata transfer efisiensi dari satu trofik ke tingkatan trofik diatasnya, tidak lebih besar dari 10%. Pederson et al. (1976) menghitung transfer efisiensi antara tingkatan trofik primer dan sekunder pada berberapa danau di Daerah Aliran Sungai Danau Washington, Amerika yang menunjukkan nilai kisaran antara 4 – 13%. Hasil tersebut menyimpulkan bahwa transfer efisiensi energi menurun dengan meningkatnya status trofik. Brylinsky and Mann (1973) mengestimasi transfer efisiensi dengan cara membagi produksi sekunder dengan produksi fitoplankton dan hasilnya adalah sebagai berikut: transfer efisiensi organisme benthos herbivor berkisar antara 0,5-9,5%; zooplankton herbivor: 2,6-21% dengan rata-rata 14%; zooplankton carnivor: 0,2-2,5% dengan rata-rata 1,4% dan benthos carnivor: 0,1-3,4% dengan rata-rata 0,9%. Ricker (1969) menyatakan bahwa transfer efisiensi ikan (growth efisiensi) maksimum adalah sekitar 35% dan nilai tersebut menurun secara kontinyu dengan meningkatnya pertumbuhan ikan.
Prespektif Dinamika Ekosistem Pelagis Waduk Kaitannya dengan
Optimasi Pemanfaatannya bagi Produksi Ikan
Selama periode pemanfaatan waduk untuk budidaya keramba jaring apung berkembang cukup pesat, yakni sejak tahun 1986, ekosistem perairan waduk Djuanda mengalami perubahan yang cukup drastis terutama dengan meningkatnya beban unsur hara N dan P yang dihasilkan dari kegiatan budidaya. Komunitas ikan yang hidup pertama kali di Waduk Djuanda adalah ikan asli dari sungai Citarum dan anak-anak sungainya. Jenis ikan tersebut umumnya termasuk ikan sungai (riverine species) dengan kebiasaan makannya yang tergolong ikan karnivor, omnivor, herbivor atau detritrivor dan benthivor (Kartamihardja, 1991). Disamping itu, hadirnya berbagai jenis ikan budidaya yang lepas ke ekosistem perairan waduk akan berdampak terhadap perubahan struktur komunitas ikan asli yang menghuni waduk.
Konsep integritas biologis (biological integrity), kesehatan ekosistem dan keaneka ragaman hayati sering dipergunakan ahli ekologi untuk menentukan kondisi normal ekosistem. Konsep tersebut memerlukan informasi mengenai komponen ekosistem terutama integritas biologis. Callicott (1995) mendefinisikan integritas biologis sebagai kemampuan ekosistem dalam menyokong dan
memelihara suatu keseimbangan, keterpaduan, adaptasi komunitas organisme yang mempunyai komposisi spesies, keragaman dan organisasi fungsional sebanding dengan habitat alaminya. Jika suatu ekosistem mempunyai integritas biologis maka ekosistem tersebut juga sehat (Karr, 1995; Callicott, 1995), tetapi tidak berlaku sebaliknya (Callicott, 1995). Definisi kesehatan ekosistem lebih didasarkan kepada fungsi. Suatu ekosistem dikatakan sehat jika proses dan fungsi yang terjadi berjalan secara normal atau berubah secara perlahan (Callicott, 1995). Lebih lanjut dikatakan bahwa keterkaitan proses ekologis meliputi penyerapan energi matahari melalui proses fotosintesis dan alirannya menuju piramida trofik, akumulasi produksi biomassa dan dekomposisi, pertukaran karbon, nitrogen dan oksigen antara biota dan lingkungan. Konsep tersebut mengkaji pergerakan energi dan materi melalui trofik jejaring makanan sehingga meliputi sifat-sifat tingkatan komunitas dan sistem.
Pengelolaan Perikanan di Waduk Djuanda
Pemanfaatan sumberdaya ikan di perairan Waduk Djuanda sudah dilakukan sejak waduk tersebut selesai digenangi tahun 1967. Pengelolaan perairan waduk serbaguna, Djuanda dilakukan oleh Perum Jasa Tirta II (sebelumnya Perum Otorita Jatiluhur) yang merupakan suatu badan usaha pemerintah untuk mengakomodasi fungsi pemanfaatannya.
Pada umumnya, upaya pengelolaan perikanan di waduk yang luas dan serbaguna seperti Waduk Djuanda dilakukan melalui upaya-upaya penebaran ikan, pengelolaan lingkungan dan habitat perairan, pengaturan perikanan tangkap dan perikanan budidaya, penataan ruang (zonasi) dan gabungan dari opsi-opsi pengelolaan tersebut.
Penebaran ikan di waduk Djuanda untuk pertama kali dilakukan pada saat waduk resmi dioperasikan tahun 1965 (Sarnita, 1976). Sampai dengan tahun 2005 telah ditebarkan sebanyak 13 jenis ikan yang umumnya merupakan jenis ikan budidaya (Sarnita, 1976; 1999; Kartamihardja dan Hardjamulia, 1983; Kartamihardja and Umar, 2005). Penebaran ikan tersebut pada umumnya dilakukan tanpa banyak mempertimbangkan keadaan lingkungan perairan dan komunitas ikan aslinya. Pada waktu diresmikan, Waduk Djuanda ditebari dengan jenis ikan budidaya yang di antaranya tidak cocok dengan lingkungan perairannya, seperti ikan sepat siam (Trichogaster pectoralis), sepat rawa
(Trichogaster trichopterus), gurame (Osphronemus gouramy) dan tambakang (Helostoma temminckii). Selain penebaran ikan yang resmi dilakukan oleh pengelola waduk, sering juga terjadi penebaran yang tidak sengaja dilakukan, misalnya ikan yang lolos dari budidaya ikan dalam KJA dan atau terbawa dalam benih yang dipelihara. Contohnya, ikan bandeng (Chanos chanos) yang lolos dari KJA dan ikan oskar, kongo, goldsom dan ikan kaca yang disinyalir merupakan jenis ikan yang terbawa dalam benih ikan yang dipelihara (Kartamihardja and Umar, 2005).
Upaya pengelolaan lingkungan dan habitat perairan berupa upaya eradikasi (pemberantasan) tumbuhan dan gulma air yang dulu sering dilakukan, nampaknya pada saat ini sangat jarang dilakukan, kecuali pada waduk-waduk yang dikelola oleh perusahaan negara seperti Waduk Djuanda (Sarnita, 1983). Perbaikan habitat di waduk Djuanda juga dilakukan dalam upaya memperkaya makanan alami ikan dengan dilakukannya introduksi jenis zooplankton, yaitu Daphnia carinata (Sarnita, 1973).
Pengaturan atau regulasi yang berkaitan dengan usaha penangkapan ikan dan budidaya ikan di Waduk Djuanda telah dilakukan dan ditetapkan dengan surat keputusan Bupati Purwakarta. Pengaturan penangkapan ikan meliputi pembatasan musim penangkapan pada waktu ikan melakukan pemijahan yaitu bulan Oktober sampai Desember setiap tahunnya. Namun sejalan dengan perubahan komposisi jenis ikan asli yang akhir-akhir ini didominasi ikan nila, peraturan tersebut sudah tidak berfungsi lagi. Upaya pelestarian sumberdaya ikan asli juga dilakukan dengan menetapkan suaka perikanan (reservat) di daerah Ciparos. Pada awal penetapan daerah ini merupakan daerah pemijahan beberapa jenis ikan asli sungai Citarum, seperti Ikan tawes (Barbodes bramoides), ikan genggehek (Mystacoleucus marginatus), ikan lalawak (Barbodes bramoides) dan ikan nilem (Osteochillus hasselti) namun seiring dengan perubahan struktur komunitas ikannya, sekarang daerah suaka ini sudah tidak berfungsi lagi.
Pada awal pengembangan budidaya ikan dalam KJA di waduk Djuanda dilakukan dengan menetapkan jumlah unit KJA yang disesuaikan dengan daya dukung perairan, yakni sebanyak 3.700 unit (Kartamihardja, 1998) dan pengaturan zonasinya (Purnomo et al., 1993). Namun dalam perkembangannya, peraturan tersebut sudah tidak diindahkan lagi sehingga daya dukungnya sudah terlampaui dan pada tahun 2005 terdapat 7.250 unit KJA (ACIAR, 2005).
Miranda (2000) menyatakan bahwa tantangan utama pada pengelolaan perikanan di perairan waduk dalam kaitannya dengan keuntungan sosial dan ekonomis adalah habitat ikan dan degradasi lingkungan, ketidak sesuaian struktur komunitas ikan, sistem penangkapan yang tidak efisien, konflik antara pemangku kepentingan (stakeholders) dan tidak memadainya institusi yang bertanggung jawab terhadap pengelolaan. Oleh karena itu, pertimbangan utama dalam pengelolaan perikanan di waduk harus difokuskan terhadap pengelolaan lingkungan, ikan dan perikanan di waduk.