BIOAKTIVITAS SENYAWA ASAM HEKSADEKANOAT DAN
β-SITOSTEROL DARI HYDROID Aglaophenia cupressina Lamoureoux SEBAGAI BAHAN ANTIJAMUR TERHADAP JAMUR BUSUK
BUAH Mangifera indica
Julisda Herniati M1), Eva Johannes2), Nur Haedar3) Email : julisdaherniatim@gmail.com
1) Mahasiswa Jurusan Biologi FMIPA UNHAS 2,3)
Dosen Jurusan Biologi FMIPA UNHAS
Abstrak
Telah dilakukan penelitian tentang “Bioaktifitas Senyawa Asam Heksadekanoat dan β-sitosterol dari Hydroid Aglaophenia cupressina Lamoureoux Sebagai Bahan Antijamur Terhadap Jamur Busuk Buah mangga Mangifera
indica”. Penelitian ini bertujuan untuk mengetahui pada konsentrasi berapa senyawa Asam heksadekanoat dan
β-sitosterol efektif dalam menghambat pertumbuhan jamur pembusuk buah mangga Mangifera indica. Metode yang digunakan dalam penelitian ini adalah uji daya hambat dengan difusi agar menggunakan pencadang berdiameter 6 mm. Hasil penelitian ini menunjukkan bahwa konsentrasi senyawa asam heksadekanoat dan β-sitosterol yang paling efektif dalam menghambat pertumbuhan jamur pembusuk buah mangga adalah 30 ppm. Diameter hambatan tertinggi oleh Asam Heksadekanoat sebesar 25,5 mm dan β-sitosterol sebesar 22,5 mm. Kedua senyawa yang digunakan bersifat fungisidal pada jamur Aspergillus niger
pembusuk buah Mangifera indica.
Kata Kunci : Bioaktivitas, Asam Heksadekanoat, β-sitosterol, Aspergillus niger
PENDAHULUAN
Masalah utama dalam produksi dan pemasaran buah dan sayuran segar adalah aspek mutu dan keamanan pangan. Permasalahan ini merugikan perdagangan komoditas pangan di pasar regional maupun internasional. Di pasar internasional dibutuhkan produk dengan mutu tinggi, tidak hanya untuk buah segar, tetapi juga untuk produk olahannya (Johannes, 2012). Mangga
Mangifera indica adalah salah satu
tanaman buah-buahan yang menjadi komoditas pembangunan agribisnis. Namun volume ekspor mangga Indonesia hanya sebesar 0,22% dari ekspor total produk olahan buah. Hal ini sungguh ironis karena Indonesia merupakan penghasil mangga keenam terbesar di dunia. Beberapa kasus penolakan ekspor banyak terjadi pada komoditas mangga produksi dalam negeri, hal ini dikarenakan waktu tempuh yang cukup lama sehingga begitu sampai di negara tujuan, buah mengalami kebusukan, baik karena lalat buah maupun adanya penyakit antraknosa (Dewandari et al, 2009).
Upaya pemasaran mangga di Indonesia menjumpai beberapa permasalahan yaitu produk tidak seragam ukurannya, penampilan
kurang menarik, tingkat kematangan tidak menentu, kehilangan hasil sekitar 5-15%, dan belum ada karakterisisasi patologi untuk menentukan perlakuan pasca panen/pestisida (Kusumo, 1989). Penyakit pada mangga yang sering ditemukan antara lain: penyakit busuk
botryoplodia disebabkan oleh jamur
Botryodiplodia thebromae Pat., Antraknosa
disebabkan oleh jamur Colletotrichum
gloesporioides Penz. Var. minor Simmonds,
busuk ujung tangkai disebabkan oleh jamur
Diplodia natalensis Pole Evan, dan penyakit
busuk Aspergillus disebabkan oleh jamur yaitu Aspergillus niger van Tieghem (Soesanto, 2006).
Salah satu cara untuk mengatasi kontaminasi jamur pada buah adalah dengan menggunakan bahan antimikroba. Mekanisme penghambatan terhadap pertumbuhan mikroba oleh senyawa antimikroba dapat berupa perusakan dinding sel dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk, perubahan permeabilitas membran sitoplasma sehingga menyebabkan keluarnya bahan makanan dari dalam sel, perubahan molekul protein dan asam nukleat, penghambatan kerja enzim, dan penghambatan sintesis asam nukleat dan protein (Pelczar & Chan 1986).
senyawa bioaktif dari isolat hydroid
Aglaophenia cupressina Lamoureoux yang
memiliki sifat antimikroba dan dapat dikembangkan sebagai bahan dasar sanitizer. Hydroid tersebut adalah hewan invertebrata yang hidup di laut dan diketahui mengandung banyak senyawa bioaktif, yang menurut Suada dan Ni Wayan Suniti (2010) ekstrak kasar
Aglaophenia sp. (0,05%) mampu menekan
pertumbuhan Fusarium oxysporum f.sp. vanillae.
Berdasarkan uraian di atas, peneliti melakukan uji bioaktivitas senyawa asam heksadekanoat dan β-sitosterol isolat dari Hydroid Aglaophenia cupressina Lamoureoux sebagai bahan antijamur terhadap jamur busuk buah mangga Mangifera indica.
METODE Alat
Alat-alat yang digunakan pada penelitian ini adalah cawan petri, tabung reaksi, erlenmeyer 250 ml, gelas ukur 50 ml, inkubator, neraca digital, oven, spektrofotometer, otoklaf, bunsen, laminary air flow, jangka sorong, vortex, swab, pinset, rak tabung, spoit, pencadang, batang pengaduk, dan sendok tanduk.
Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah buah mangga Mangifera indica, senyawa asam heksadekanoat dan β-sitosterol isolat dari Hydroid Aglaophenia cupressina
Lamoureoux, NaCl fisiologis, medium Potato Dekstrose Agar (PDA), ketokonazol, DMSO (Dimetil sulfoksida), alkohol 70%, akuades, kertas label, kapas dan aluminium foil.
METODE KERJA Sterilisasi Alat
Alat-alat yang tahan pada pemanasan tinggi disterilkan dengan oven pada suhu 180oC selama ± 2 jam. Medium, aquades, dan alat-alat yang tidak tahan dengan pemanasan tinggi disterilkan dengan menggunakan otoklaf pada suhu 121oC selama ± 15 menit pada tekanan 2 atm. Sedangkan alat yang terbuat dari logam, seperti ose dan pinset disterilkan dengan pencucian menggunakan alkohol dan dipijarkan langsung di atas api bunsen hingga merah membara.
Penyiapan Medium Potato Dextrose Agar (PDA)
Menyiapkan medium PDA (Potato Dextrose Agar) sintetik, lalu ditimbang dengan neraca digital sebanyak 3,9 g kemudian dimasukkan dalam erlenmeyer yang berisi aquades 100 ml. Setelah itu dipanaskan di atas penangas sambil diaduk untuk menghomogenkan medium tersebut. Setelah homogen, dimasukkan kedalam otoklav dan disterilkan pada suhu 121oC pada tekanan 2 atm selama 15 menit. Isolasi Jamur Busuk Buah Mangga
Buah mangga Mangifera indica dipilih yang seragam, terutama dalam hal kematangan dan tanda-tanda penyakit. Bagian kulit buah mangga yang sudah mengalami pembusukan diambil menggunakan pinset kemudian diletakkan pada media tumbuh Potato dekstrose agar (PDA) dalam cawan petri dan diinkubasi pada suhu 37 oC selama 48-72 jam. Isolat kemudian dimurnikan pada media yang sama sampai diperoleh biakan murni.
Identifikasi Jamur
Pembuatan Preparat Jamur
Isolat jamur secara aseptik diambil menggunakan swab, kemudian diletakkan di atas gelas objek yang steril dan sebelumnya telah ditetesi dengan medium PDA cair hingga memadat. Preparat jamur kemudian dimasukkan ke dalam cawan petri yang dialasi dengan kertas saring steril yang telah dibasahi sedikit dengan aquades steril, lalu diinkubasi di dalam inkubator selama 48-72 jam pada suhu kamar 28oC. kemudian preparat jamur diamati di bawah mikroskop dengan perbesaran 100x.
Pengamatan Morfologi Koloni
Pengamatan morfologi koloni jamur dilakukan dengan memperhatikan ciri berikut (Gandjar, et al, 1999):
1.
Warna dan permukaan koloni (granular; seperti tepung; menggunung; licin; ada atau tidak tetes-tetes eksudat).2.
Garis-garis radial dari pusat koloni ke arah tepi koloni, ada atau tidak.3.
Lingkaran-lingkaran konsentris, ada atau tidak.Pengamatan mikroskopis preparat dilakukan dengan memperhatikan ciri (Gandjar, et al, 1999):
1.
Hifa berseptum atau tidak.2.
Hifa berpigmentasi hialin (tak berwarna, atau biru bila diberi cat) atau gelap (dematiaceous-cokelat kehijauan atau kehitaman, hitam kelam, hitam keabu- abuan)3.
Hifa berbentuk spiral, atau bernodul, atau mempunyai rhizoid.4.
Spora aseksual berbentuk sederhana seperti arthrosora, blastospora, klamidospora interkalar atau terminal) atau sporangiospora.5.
Spora aseksual berbentuk lebih khusus, seperti konidia atau aleurospora yang dibentuk pada hifa khusus yang disebut konidiofor. Hal lain yang harus dicatat adalah bentuk, jumlah, bersel banyak atau tidak, dan pengaturan letaknya: (a) bentuk gada, (b) bentuk gelondong, (c) bentuk bulan sabit, (d) bentuk bulat atau semi bulat, (e) bentuk tidak teratur, (f) bentuk silindris, (g) bentuk elips, (h) bentuk seperti bintang, (i) bentuk seperti benang.6.
Pengaturan spora aseksual: (a)diproduksi tunggal, (b) diproduksi berantai (rantai yang bercabang atau tidak bercabang), (c) berbentuk klaster (berkelompok).
7.
Spora seksual memiliki bentuk yang bervariasi seperti askospora, basidiospora dan zigospora, bergantung pada spesiesnya. Penyiapan Larutan UjiSenyawa asam heksadekanoat dan β-sitosterol masing-masing ditimbang sebanyak 0,3 mg dan dilarutkan dalam 10 ml DMSO (dimetil sulfoksida) sehingga diperoleh larutan dengan konsentrasi 30 ppm. Selanjutnya dibuat larutan uji dengan konsentrasi 20 dan 10 ppm.
Penyiapan Larutan Kontrol
Larutan kontrol yang digunakan adalah larutan ketokonazol 30 ppm sebagai kontrol positif. Ketokonazol diambil sebanyak 0,3 mg dan dilarutkan dalam 10 ml aquades, sehingga diperoleh larutan dengan konsentrasi 30 ppm. DMSO digunakan sebagai kontrol negatif. Penyiapan Suspensi Jamur Uji
Jamur uji yang telah diisolasi, disuspensikan
atau diencerkan dengan menggunakan larutan NaCl 0,9% yang steril kemudian dihomogenkan. Suspensi diukur kekeruhannya dengan menggunakan spektrofotometer hingga diperoleh nilai transmitan 75%.
Pengujian Daya Hambat Senyawa Asam Heksadekanoat dan β- sitosterol
Pengujian dilakukan dengan metode difusi agar yang menggunakan pencadang berdiameter dalam 6 mm, diameter luas 8 mm, dan tinggi 10 mm. Medium potato dekstrose agar (PDA) steril didinginkan pada suhu 40oC-45oC. Kemudian dituang secara aseptis ke dalam cawan petri sebanyak 10 ml dan dibiarkan memadat sebagai lapisan dasar atau base layer. Setelah memadat dimasukkan suspensi jamur uji msing-masing sebanyak 1 ml ke dalam 5 ml medium potato dekstrose agar (PDA) kemudian dihomogenkan dan dituang di atas lapisan base layer dan dibiarkan setengah padat sebagai lapisan pembenihan atau seed layer. Setelah itu pencadang diletakkan secara aseptis dengan pinset steril pada permukaan medium dengan jarak pencadang satu dengan yang lain 2-3 cm dari pinggir cawan petri, dan dibiarkan pada suhu kamar.
Masing-masing pencadang diisi dengan 0,25 ml senyawa asam heksadekanoat dan β-sitosterol isolat hydroid Aglaophenia
cupressina Lamoureoux dengan konsenterasi
masing-masing 10, 20, dan 30 ppm. Demikian pula larutan ketokonazol sebagai kontrol positif dan DMSO sebagai kontrol negatif dituang sebanyak masing-masing 0,25 ml menggunakan mikropipet. Selanjutnya diinkubasi pada suhu 37oC selama 48 jam dan 72 jam.
Pengukuran Diameter Daerah Hambatan Pengamatan dilakukan dengan mengukur diameter hambatan pertumbuhan jamur disekeliling pencadang dengan menggunakan jangka sorong. Pengukuran dilakukan pada inkubasi selama 48 jam dan 72 jam, untuk mengetahui kemampuan senyawa bioaktif hydroid tersebut dalam menghambat pertumbuhan jamur uji.
Analisis Data
berdasarkan kepekaan jamur terhadap senyawa asam heksadekanoat dan β-sitosterol isolat hydroid Aglaophenia cupressina
Lamoureoux berdasarkan wilayah
penghambatan pada 48 jam dan 72 jam inkubasi ditabulasi dan dianalisis. Potensi antifungi senyawa asam heksadekanoat dan β-sitosterol isolat dari Hydroid Aglaophenia
cupressina Lamoureoux diketahui dengan cara
pengamatan terhadap zona bening yang terbentuk mengelilingi pencadang. Zona hambatan tersebut diukur pada senyawa asam heksadekanoat dan β-sitosterol isolat dari Hydroid Aglaophenia cupressina Lamoureoux dengan konsentrasi 10, 20, 30 ppm. Data yang diperoleh dari hasil pengukuran dianalisis dengan cara membandingkan diameter zona hambatan kontrol (kontrol positif dan kontrol negatif) dengan zona hambatan dari semua sampel serta zona hambatan dari setiap jenis konsentrasi sampel. Demikian pula dianalisis pertumbuhan zona hambatan dari 48 jam dan 72 jam untuk mengetahui bioaktivitas senyawa asam heksadekanoat dalam menghambat pertumbuhan jamur pembusuk buah mangga. HASIL
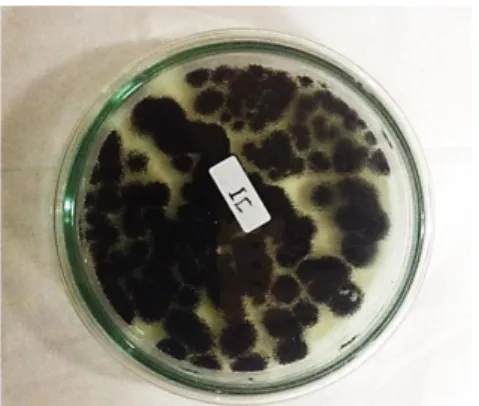
Isolasi Jamur Pembusuk Buah Mangga Mangifera indica.
Gambar 1. Isolat Jamur Pembusuk Buah
Mangifera indica
Gejala pembusukan buah yang diamati dimulai dengan menghitamnya bagian pangkal buah yang kemudian meluas ke seluruh kulit buah. Gejala ini mirip dengan penyakit busuk
Aspergillus yang dikemukakan oleh Barnet
dan Hunter (1998) bahwa umumnya buah yang berasal dari dataran rendah terinfeksi jamur
Aspergillus sp, buah yang terinfeksi oleh
jamur ini memiliki gejala pada pangkal buah
akan mengalami perubahan warna menjadi hitam dan seiring waktu akan meluas hingga menutupi permukaan kulit buah. Dari hasil isolasi diperoleh satu isolat jamur yang diberi kode MH yang menunjukkan ciri jamur seperti pada Gambar 8.
Identifikasi Jamur
Pengamatan Makroskopis Jamur
Pengamatan secara makroskopis dengan melihat warna koloni, bentuk koloni, permukaan koloni, pola pertumbuhan dan diameter koloni pada media Potato Dextrose Agar (PDA).
Gambar 2. Koloni Jamur
Pada awal pengamatan miselium jamur ini berwarna putih kekuningan tetapi pada hari ke-3 warna miselium mulai berubah menjadi warna kehitaman, pola pertumbuhan koloni bulat, tepi rata seperti kapas halus dengan diameter koloni 20 mm.
Pengamatan Mikroskopis Jamur
(a) (b)
(c)
Gambar 3. Hasil Pengamatan Mikroskopis, (a) Koloni Jamur, (b) Konidia Membentuk Kipas, (c) Hifa Bersekat
Ciri mikroskopis jamur MH adalah hifa hialin dan bersekat. Konidiofor tegak dan panjang dengan kepala konidia membesar, fialid hampir memenuhi seluruh permukaan vesikel. Ciri-ciri mikroskopis isolat yang diamati sesuai dengan jamur Aspergillus niger yang dikemukakan oleh Barnet dan Hunter (1998) yaitu memiliki konidiofor halus yang tegak ke atas membentuk globus. Konidia terdiri dari satu sel dan warna koloni bervariasi tergantung pada jenisnya. Fardiaz (1989) melaporkan, konidia atas Aspergillus niger berwarna hitam atau hitam kecokelatan, bagian atas membesar dan membentuk globusa, bagian ujung serupa batang-batang kecil.
Aktivitas Antijamur Senyawa Bioaktif Asam Heksadekanoat dan β- Sitosterol dari Hydroid Aglaophenia cupressina Lamoureox terhadap Isolat Jamur MH Pengujian dilakukan secara in vitro dengan metode difusi agar menggunakan pencadang. Pengujian aktivitas antijamur pada jamur MH dilakukan untuk menentukan pengaruh konsentrasi senyawa asam heksadekanoat dan β-sitosterol terhadap pertumbuhan jamur MH. Dalam pengujian ini digunakan dua senyawa murni yang telah diisolasi dari hydroid
Aglaophenia cupressina Lamoureoux yaitu
senyawa asam heksadekanoat dan senyawa β-sitosterol dengan konsentrasi masing-masing 10 ppm, 20 ppm, dan 30 ppm yang akan dibandingkan dengan ketokonazol sebagai kontrol positif (+) dan DMSO sebagai kontrol negatif (-). Pengujian dilakukan selama masa inkubasi 48 jam dan 72 jam.
(a) (b)
Gambar 4. Diameter daerah hambatan senyawa asam heksadekanoat hasil isolasi hydroid Aglaophenia cupressina
Lamoureoux terhadap isolat jamur MH pada inkubasi 48 jam (a) dan 72 jam (b)
(a) (b)
Gambar 5. Diameter daerah hambatan senyawa β-sitosterol hasil isolasi hydroid
Aglaophenia cupressina
Lamoureoux terhadap isolat jamur MH pada inkubasi 42 jam (a) dan 72 jam (b)
Pada gambar hasil uji daya hambat di atas memperlihatkan bahwa senyawa Asam heksadekanoat dan β-sitosterol pada konsentrasi 10 ppm, 20 ppm, dan 30 ppm mampu menghambat pertumbuhan jamur MH yang ditandai dengan terbentuknya zona bening disekitar pencadang pada semua konsentrasi yang digunakan.
Selama masa inkubasi 48 jam dan 72 jam terlihat bahwa terjadi perubahan diameter daerah hambatan. Hasil pengamatan juga menunjukkan adanya perbedaan daerah hambatan pada setiap tingkat konsentrasi. Martoredjo (1989) menyatakan bahwa konsentrasi suatu bahan yang berfungsi sebagai antimikroba merupakan salah satu faktor penentu besar kecilnya kemampuan dalam menghambat pertumbuhan mikroba yang diuji.
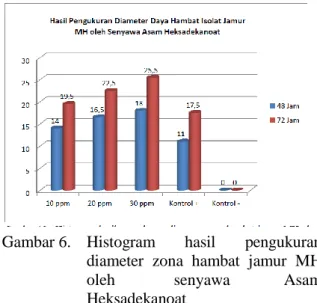
Gambar 6. Histogram hasil pengukuran diameter zona hambat jamur MH
oleh senyawa Asam
Pada gambar histogram di atas memperlihatkan bahwa konsentrasi 30 ppm merupakan konsentrasi dengan pengukuran daerah hambatan tertinggi, sedangkan pada konsentrasi 10 ppm merupakan konsentrasi dengan pengukuran daerah hambatan terendah. Hal ini membuktikan bahwa semakin besar tingkatan konsentrasi senyawa asam heksadekanoat semakin efektif dalam menghambat jamur MH. Diameter hambatan asam heksadekanoat pada jamur MH dengan waktu inkubasi 48 jam pada konsentrasi 10 ppm sebesar 14,0 mm dan mengalami peningkatan pada masa inkubasi 72 jam yaitu sebesar 19,5 mm. Kemudian konsentrasi 20 ppm menghambat pertumbuhan jamur sebesar 16,5 mm pada masa inkubasi 48 jam dan 22,5 mm pada masa inkubasi 72 jam. Untuk konsentrasi 30 ppm pada masa inkubasi 48 jam diameter hambatan sebesar 18,0 mm dan pada masa inkubasi 72 jam meningkat menjadi 25,5 mm. Berdasarkan hasil tersebut, senyawa asam heksadekanoat bersifat fungisidal.
Menurut Mycek et al (2001), suatu antimikroba bersifat bakteriostatik dan fungistatik jika suatu senyawa antimikroba mampu menghambat pertumbuhan mikroba jika pemberian senyawa diberikan secara terus menerus dan jika penambahan senyawa dihentikan atau habis maka pertumbuhan akan meningkat. Sedangkan untuk bakteriosidal dan fungisidal jika suatu senyawa antimikroba mampu membunuh dan menghentikan aktivitas fisiologis dari mikroba uji meskipun pemberian senyawa tersebut dihentikan
Ketokonazol sebagai kontrol positif memiliki diameter daerah hambatan 11,0 mm dan tidak terdapatnya daerah hambatan pada kontrol negatif DMSO. Pada penelitian ini dapat dibuktikan bahwa ketokonazol mampu menghambat pertumbuhan jamur MH, hanya saja bila dibandingkan dengan senyawa Asam Heksadekanoat dan β-sitosterol lebih rendah dalam menghambat pertumbuhan jamur MH. Adanya perbedaan diameter daerah hambatan pada masing-masing konsentrasi disebabkan karena perbedaan besarnya zat aktif yang terkandung pada konsentrasi tersebut. Semakin besar suatu konsentrasi, semakin besar pula komponen zat aktif yang terkandung di dalamnya sehingga daerah hambatan yang
terbentuk juga berbeda (Brooks et al., 2005). Untuk mengetahui lebih jelas perbedaan daerah hambatan pada masing-masing konsentrasi dapat dilihat pada histogram berikut.
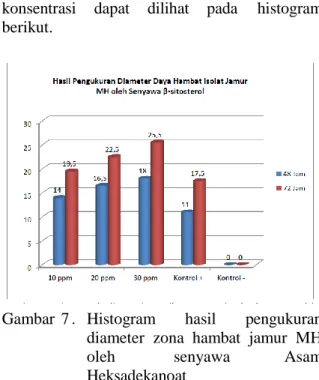
Gambar 7 . Histogram hasil pengukuran diameter zona hambat jamur MH
oleh senyawa Asam
Heksadekanoat
Pada gambar histogram terlihat kemampuan senyawa β-sitosterol pada konsentrasi 30 ppm sangat efektif dalam menghambat pertumbuhan jamur MH karena memiliki pengukuran daerah hambatan terbesar, dan pada konsentrasi 10 ppm walaupun memiliki diameter daerah hambatan terkecil namun senyawa β-sitosterol masih mampu menghambat pertumbuhan jamur MH.
Pengukuran daerah hambatan pada senyawa β-sitosterol pada konsentrasi 10 ppm memiliki diameter daerah hambatan 12,0 mm pada masa inkubasi 48 jam dan masa inkubasi 72 jam sebesar 18,5 untuk konsentrasi 20 ppm mampu menghambat pertumbuhan jamur sebesar 17,0 mm pada inkubasi 42 jam dan masa inkubasi 72 jam sebesar 22,5 mm, untuk konsentrasi 30 ppm dengan diameter daerah hambatan sebesar 19,5 mm pada masa inkubasi 48 jam dan terjadi peningkatan pada masa inkubasi 72 jam sebesar 23,5 mm. Berdasarkan hasil tersebut, senyawa β-sitosterol bersifat fungisidal. Ketokonazol sebagai kontrol positif dengan diameter hambatan 11 mm pada masa inkubasi 48 jam dan 20,5 mm pada inkubasi 72 jam. DMSO sebagai kontrol negatif tidak terdapat daerah hambatan.
Diameter daerah hambatan yang ditunjukkan pada gambar membuktikan bahwa senyawa asam heksadekanoat dan β-sitosterol efektif dalam menghambat jamur MH, dijelaskan oleh Cappucino (1992) bahwa apabila diameter hambatan oleh antibiotik sebesar 14 mm dinilai efektif untuk menghambat pertumbuhan mikroba uji setelah masa inkubasi 72 jam diameter zona.
Menurut Subakir (2004), suatu antifungi mampu menghambat pertumbuhan fungi uji dengan bekerja mempengaruhi dinding sel, membran sitoplasma maupun inti. Menurut Johannes (2013), mekanisme reaksi senyawa kimia dinding sel jamur dengan sisi aktif dari asam heksadekanoat dan β-sitosterol membentuk suatu senyawa kompleks. Dari hasil penelitian ini, asam heksadekanoat dan β-sitosterol bersifat fungisidal, sesuai dengan pendapat Pelczar dan Chan (1988) yang menyatakan bahwa senyawa aktif antijamur dapat bersifat fungistatik atau fungisidal. Selain ditentukan oleh sifat senyawa aktifnya juga ditentukan oleh sifat juga ditentukan oleh sifat morfologi jamur uji (Aspergillus niger).
KESIMPULAN
Berdasarkan hasil penelitian yang telah dilakukan dapat ditarik kesimpulan bahwa konsentrasi senyawa Asam heksadekanoat dan β-sitosterol yang paling efektif dalam menghambat pertumbuhan jamur pembusuk buah Mangga Mangifera indica adalah pada konsentrasi 30 ppm dan pada kedua senyawa tersebut bersifat fungisidal.
SARAN
Disarankan untuk dilakukannya penelitian lanjutan senyawa asam heksadekanoat dan β-sitosterol sebagai bahan pengawet makanan karena memiliki sifat antifungi.
DAFTAR PUSTAKA
Barnet, H. L. dan B. B. Hunter. 1998. Illustrated Genera of Imperfect Fungi. Fourth Edition. The American Phytopathological Society St. Paul, Minnesota.
Brooks, G. F., Janet S. B. dan Stepen A. M. 2005. Mikrobiologi Kedokteran Edisi Pertama. Salemba Medika, Jakarta.
Cappuccino, J.G., and Sherman, N., 1978, Microbiology A Laboratory Manual, Rockland Community College, Suffern, New York.
Denny, M. W., dan Steven, D. G., 2007. Encyclopedia of Tidepools and Rocky Shores. University of California Press. London. England.
Dewandari, K.T., Ira, M., dan Dondy, A.S.,
2009. Konsep SOP untuk
Penanganan Pascapanen Mangga Cv, Gedong untuk Tujuan Ekspor. Pusat Penelitian dan Pengembangan Standarisasi. Vol.11. NO 1.
Fardiaz. S., 1989. Mikrobiologi Pangan. IPB:PAU Pangan dan Gizi. Bogor.
Gandjar, I., R.A. Samson, K. van den Tweel-Vermeulen, A. Oetari, dan I. Santoso, 1999. Pengenalan Kapang
Tropik Umum. Yayasan Obor Indonesia. Jakarta.
Gusnawaty H S., Mariadi., dan Muliana., 2013. Pengaruh Perbedaan Frekuensi Aplikasi Pestisida Nabati Phymar C 711 Terhadap Kesembuhan Penyakit Busuk Batang Diplodi (Botryodiplodia Theobromae Pat.) Pada Tanaman Jeruk (Citrus reticulata L.)Vol.23. No. 03. Hal. 172-178.
Harris, V. A., 1996. Sessile Animal of the Sea Shore. Chapman and Hall.
London.
Jawetz, E., J. L. Melnick, and E.A. Adelberg. 2001. Mikrobiologi untuk Profesi Kesehatan (Review of Medical Microbiology) diterjemahkan oleh H. Tomang. EGC. Jakarta
Johannes E., (2008). Isolasi, Karakterisasi dan Uji Bioaktivitas Metabolit Sekunder dari Hydroid Aglaophenia cupressina Lamoureoux Sebagai Bahan Dasar Antimikroba. Program Pasca Sarjana Universitas Hasanuddin. Makassar.
Johannes, E., H. Usman dan M. Bilang, 2014. Bioaktivitas Senyawa Asam Heksadekanoat Hasil Isolat Dari Hydroid Aglaophenia Cupressina Lamoureoux Subagai Antibakteri Pada Bakteri Salmonella Typhi Dan Escherichia Coli.
http://repository.unhas.ac.id/handle/12345 6789/7478. Diakses pada tanggal 29 Januari 2015.
Johnson, M K., Alexander, K E., Lindquist, N., Loo, G., 1999. Potent antioxidant activity of a dithiocarbamate-related compound from a marine hydroid. Vol. 58 issue 8, Hal. 1313-1319.
Kozloff, Eugene N. 1990, Invertebrates.
Saunders College Publishing, United States.
Lubbock, 1979. Chemical Recognition and Nematocyte Excitation In A Sea Anemone, J. exp. Biol. (83):283.
Martoredjo, T. 1989. Pengantar Ilmu Penyakit Tumbuhan Bagian dari Perlindungan Tanaman. Andi offset. Yogyakarta.
Mellisa, K., Johnson, Karen E., Alexander Niels Lindquist and George Loo, 1999. Activity Antioksidan Potential of Hydroid. Department of Nutrition and Foodservice System. School of Human Enviromental Science niversity of North Carolina at Chapel Hill. Biochemical Pharmacology. Vol 58. 1313- 1319. Mycek, M.J., A.R. Harvey and P.C. Champe,
2001. Farmakologi: Ulasan
Bergambar (Lippincott’s Illustrated Reviews: Pharmacology. 2/E). Widya Medika. Jakarta.
Neuman and Maur, 1985. Useful and Harmful Interactions of Antibiotics. CRC Press, Inc. Boca Raton, Florida.
Pelczar MJ, Chan ECS. 1986 Dasar-dasar mikrobiologi 2. Diterjemahkan oleh Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL. Jakarta: Penerbit Universitas Indonesia;. hal. 489-522.
Powell KA & Faull JL. 1989. Commercial Approaches to The Use of Biological Control Agents. In Biotechnology of Fungi for Improving Plant Growth. Ed. Whipp JM, Lumsden RD. Cambridge: Cambridge University Press.
Pracaya, 2008. Bertanam Mangga. PT. Penerbit Swadaya. Jakarta.
Rizki. 2012. Uji Sensitivitas.
http://mikrobiologi-indonesia.blogspot.com/. Diakses pada tanggal 2 Oktober 2014.
Rupert, E. E. Barnes R.D., 1994. Invertebrate Zoology. Saunders College Publishing. Fort Worth.
Rusyana, A., 2011. Sistematika Invertebrata (Teori dan Praktik). Alfabeta. Bandung.
Soesanto L., 2006. Penyakit Pascapanen. Penerbit KANISIUS. Yogyakarta Suada I Ketut dan Ni Wayan Suniti, 2010. Supression ability of Crude Extract Derived from Marine Biota Against Fusarium oxysporum f.sp.vanillae.
Jurna Biologi, XIV (1): 7-10.
Tortora, G.J., Funke,B.R., and Case, C.L. 2001. Microbiology, An Introduction. Cumming Publishing Company, California.
Usman, H., 2012. Dasar-Dasar Kimia Organik Bahan Alam. Dua Satu Press. Makassar.
Wholefoods, 2003. Phythosterol : Sterol, Sterolin & β-sitosterol. http://wholefoods.com. Diakses pada tanggal 14 oktober 2014.