TINJAUAN PUSTAKA
Ubi jalar (Ipomoea batatas L.)Ubi jalar (Ipomoea batatas L.) termasuk tanaman palawija penting di Indonesia setelah jagung dan ubikayu (Suismono 1995). Tabel 1 memperlihatkan bahwa terjadi kenaikan dan penurunan produksi setiap tahunnya akibat kenaikan maupun penurunan luas panen. Namun demikian hasil per hektar lahan tanam menunjukkan peningkatan setiap tahunnya (periode 2000-2004), artinya terjadi optimalisasi lahan yang mampu meningkatkan hasil per hektar luas tanam.
Tabel 1. Produksi dan distribusi panen ubi jalar per tahun
Peningkatan hasil ini mendorong pemanfaatan komoditi ubi jalar menjadi bahan baku berbagai produk pangan. Berbagai produk ubi jalar yang dapat dikembangkan antara lain adalah produk-produk hasil pengembangan ubi jalar segar (seperti ubi yang dipanggang dalam oven), produk ubi jalar siap santap, produk ubi jalar siap masak, dan produk ubi jalar setengah jadi untuk bahan baku makanan (Juanda & Cahyono 2000).
Sebelum ubi jalar diolah menjadi beberapa produk turunannya tersebut perlu diketahui terlebih dahulu sifat-sifat morfologi, histologi maupun kandungan nutrisinya (Suismono 1995). Umbi tanaman ubi jalar memiliki ukuran, bentuk, warna kulit, dan warna daging bermacam-macam, tergantung varietasnya. Daging umbi tanaman ubi jalar ada yang berwarna putih, kuning, jingga dan ungu muda.
Bentuk umbi tanaman ubi jalar ada yang bulat, oval, dan bulat panjang. Selanjutnya jika bentuk umbi diketahui maka lama pengupasan dan perancangan
Periode tahun Produksi (ton) Luas panen (ha) Hasil/Ha (ku) 2000 1.827.687 194.262 94
2001 1.749.070 181.026 97
2002 1.771.642 177.276 99,94
2003 1.991.478 197.455 101
2004 1.901.802 184.546 103
alat pencucian dapat diperkirakan (Suismono 1995). Kulit umbi ada yang berwarna putih, kuning, ungu, jingga dan merah (Juanda & Cahyono 2000). Untuk kulit yang warnanya putih sampai kuning dapat diolah langsung sebab tanpa pengupasan tidak mempengaruhi produk, tetapi kulit umbi yang warnanya merah harus dilakukan pengupasan (Suismono 1995). Struktur kulit umbi tanaman ubi jalar juga bervariasi antara tipis sampai tebal dan bergetah antara bergetah sedikit sampai bergetah banyak (Juanda & Cahyono 2000).
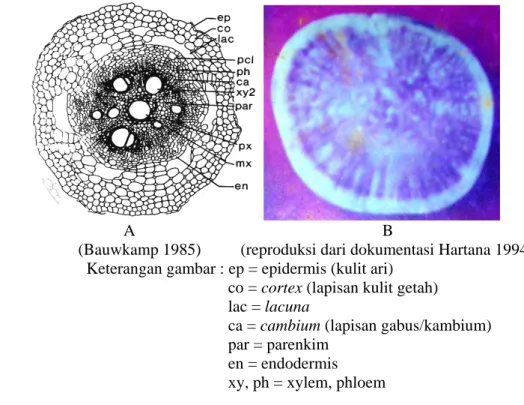
Kulit ubi jalar dapat dibagi menjadi 4 bagian pokok yaitu kulit ari, lapisan getah, lapisan gabus, dan daging umbi (Gambar 1). Enzim polifenol oksidase, yang menyebabkan terjadinya pencoklatan atau browning bila ada luka pada umbi, terletak dalam phellogen (cork cambium), phelloderm dan getah ubi jalar.
A B
(Bauwkamp 1985) (reproduksi dari dokumentasi Hartana 1994) Keterangan gambar : ep = epidermis (kulit ari)
co = cortex (lapisan kulit getah) lac = lacuna
ca = cambium (lapisan gabus/kambium) par = parenkim
en = endodermis
xy, ph = xylem, phloem
Gambar 1. Bagian-bagian kulit dan daging umbi ubi jalar
Sedangkan daging umbi terdiri dari parenchyme dan serat (Suismono 1995). Dengan mengetahui susunan kulit dan daging umbi akan dapat diketahui teknik pengupasan yang benar agar tidak terjadi pencoklatan (browning) dan
berpengaruh pada rendemen tepung (Suismono 1995). Dari komposisi gizinya, ubi jalar merupakan sumber karbohidrat dan
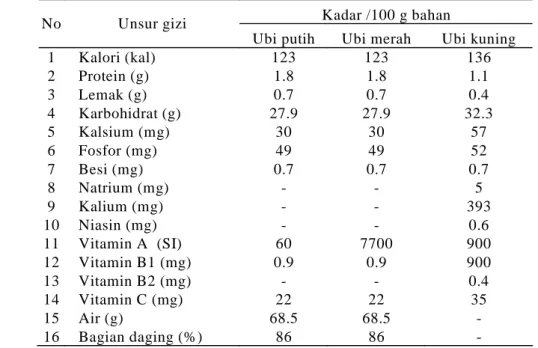
mengandung karbohidrat sebesar 27,9 gram dan menghasilkan kalori sekitar 123 kalori tiap 100 gram bahan (lihat Tabel 2). Vitamin yang terkandung dalam ubi jalar adalah vitamin A, vitamin C, vitamin B1 (thiamin), vitamin B2 (riboflavin), sedangkan mineral yang terkandung dalam ubi jalar adalah zat besi (Fe), fosfor (P), kalsium (Ca), dan natrium (Na). Kandungan gizi lain yang terdapat dalam ubi jalar adalah protein, lemak, serat kasar, kalori dan abu (Juanda & Cahyono 2000). Namun demikian, nilai gizi ubi jalar secara kualitatif maupun kuantitatif dipengaruhi oleh varietas, lokasi dan musim tanam (Suismono 1995).
Produksi vitamin yang tinggi pada ubi jalar belum banyak dikembangkan. Tabel 2 menunjukkan bahwa ubi jalar memiliki potensi vitamin A cukup tinggi (ubi jalar merah memiliki kadar vitamin A 7700 SI, setara dengan 2312 RE, dan ubi jalar kuning memiliki kadar vitamin A 900 SI setara dengan 270 RE, sedangkan Angka Kecukupan Gizi pria dewasa sebesar 700 RE/hari, Widyakarya Nasional Pangan dan Gizi VI). Namun demikian, ubi jalar memiliki kadar protein rendah yaitu sekitar 1,8 gram sehingga perlu penambahan sumber protein nabati lain dalam pembuatan produk makanan dari bahan ubi jalar.
Tabel 2. Komponen utama ubi jalar
Sumber : Direktorat Gizi Depkes R.I., 1981
Kadar /100 g bahan No Unsur gizi
Ubi putih Ubi merah Ubi kuning 1 Kalori (kal) 123 123 136 2 Protein (g) 1.8 1.8 1.1 3 Lemak (g) 0.7 0.7 0.4 4 Karbohidrat (g) 27.9 27.9 32.3 5 Kalsium (mg) 30 30 57 6 Fosfor (mg) 49 49 52 7 Besi (mg) 0.7 0.7 0.7 8 Natrium (mg) - - 5 9 Kalium (mg) - - 393 10 Niasin (mg) - - 0.6 11 Vitamin A (SI) 60 7700 900 12 Vitamin B1 (mg) 0.9 0.9 900 13 Vitamin B2 (mg) - - 0.4 14 Vitamin C (mg) 22 22 35 15 Air (g) 68.5 68.5 - 16 Bagian daging (%) 86 86 -
Selain kandungan gizi yang cukup lengkap, ubi jalar juga mengandung zat antigizi yaitu antitripsin, antikimotripsin dan rafinosa. Antitripsin dan antikimotripsin mampu menghambat aktivitas proteolitik enzim tripsin dan kimotripsin (Djuanda 2003). Namun kerja zat antigizi ini tidak akan aktif setelah bahan menjadi matang akibat pengolahan/pemanasan. Selain itu, ubi jalar juga mengandung senyawa-senyawa seperti ipomaemarone, furanoterpen, koumarin, dan polifenol yang menyebabkan rasa pahit. Senyawa-senyawa tersebut terbentuk dalam jaringan karena adanya luka serangan hama (Juanda & Cahyono 2000).
Tepung Ubi jalar
Salah satu pemanfaatan ubi jalar sebagai komoditas pangan adalah dalam bentuk tepung. Ubi jalar diubah menjadi tepung atau pati, sehingga dapat digunakan sebagai bahan baku industri alkohol, sirup, maltosa, glukosa, fruktosa, bahan perekat, biskuit, dan industri lainnya (Kadarisman 1985). Teknik pembuatan tepung ubi jalar merupakan salah satu jenis pengolahan yang penting, hal ini disebabkan tepung ubi jalar dapat disimpan lebih lama dan lebih luas penggunaannya dalam pembuatan berbagai jenis makanan (Santosa dkk. 1994).
Tepung ubi jalar merupakan bentuk produk olahan setengah jadi dari umbi ubi jalar. Pembuatan tepung ubi jalar di tingkat petani dapat dilakukan dengan membuat chip ubi jalar kering. Pengertian chip kering dan tepung ubi jalar adalah produk ubi jalar yang berbentuk irisan umbi yang dikeringkan lalu ditepungkan. Secara umum, tahap pembuatan tepung ubi jalar adalah tahap pencucian, pengupasan, perlakuan blanching, pengirisan, perendaman, pengeringan dan penepungan (Suismono 1995). Perlakuan tambahan yang dapat dipertimbangkan adalah pengepresan untuk mengurangi kadar air sehingga dapat mempercepat pengeringan.
Pencucian bertujuan untuk membersihkan umbi dari kotoran dan tanah. Proses ini disertai proses sortir terhadap hama ubi jalar yang biasanya ditandai dengan adanya lubang-lubang kecil pada umbi maupun luka memar atau kepoyohan.
Pengupasan dilakukan untuk mendapatkan kualitas bahan baku yang benar-benar bagus, karena sebenar-benarnya tanpa pengupasan pun masih dapat diterima oleh panelis pada uji organoleptik baik warna maupun aromanya. Namun demikian, kadar mikroba, kapang/khamir lebih banyak ditemukan pada produk yang tidak dikupas daripada yang dikupas (Suismono 1995). Jika dilakukan pengupasan akan terlihat jelas adanya penyimpangan mutu (biasanya berupa lubang atau warna daging yang berbeda) sehingga dapat diupayakan untuk di-trimming ataupun dibuang.
Perlakuan blanching (70-1050C) adalah pemanasan cepat untuk menginaktivasi enzim dan menstabilkan bahan pangan melawan perusakan selama penyimpanan jangka panjang. Blanching dapat dilakukan dalam air, uap, atau menggunakan energi mikrowave (Kidmose 2002).
Pengirisan adalah proses pengecilan ukuran yang bertujuan untuk mempercepat pengeringan dan mempermudah proses pengepresan serta penepungan. Pengirisan dapat dilakukan secara manual maupun menggunakan alat seperti slicer, pencacah sawut dan lain-lain.
Tahap berikutnya adalah persiapan pengeringan. Ada beberapa metode pengolahan ubi jalar yang melakukan tahap perendaman pada larutan sulfit sebelum pengeringan. Senyawa sulfit yang biasa digunakan adalah SO2, SO32-,
HSO3-, atau S2O52-. Reaksi bisulfit dengan kelompok karbonil dari gula pereduksi
serta komponen lain yang berperan dalam pencoklatan berlangsung secara dapat balik (reversible). Dengan demikian proses pencoklatan dapat dihambat. Tetapi hasil reaksi ini juga diduga mampu menghilangkan kromofor karbonil dalam struktur melanoidin sehingga menyebabkan efek bleaching pada pigmen. Proses pengikatan bisulfit dengan kelompok hidroksil juga dapat berlangsung secara tidak dapat balik (irreversible) membentuk sulfonat. Selain itu penggunaan sulfit atau metabisulfit dengan disemprot atau direndam memberi kontrol efektif terhadap enzim pencoklatan dalam hal ini enzim yang mengkatalis proses oksidasi senyawa fenolik (misal enzim fenolase atau polifenol oksidase) (Lindsay 1996).
Tahap produksi berikutnya adalah pengeringan. Pengeringan terjadi melalui penguapan cairan dengan pemberian panas ke bahan basah. Pengeringan adalah
operasi rumit yang melibatkan perpindahan massa dan panas sehingga menyebabkan perubahan mutu produk (Devahastin 2000). Dibandingkan pengering alami (dengan sinar matahari), pengering buatan memiliki lebih banyak keuntungan, misalnya bahan yang dikeringkan akan lebih seragam mutunya, cepat prosesnya serta terhindar dari bahan asing yang tidak diinginkan, karena dapat dikontrol kondisi lingkungannya.
Tepung ubi jalar merupakan hasil penepungan chip atau irisan ubi jalar kering. Penepungan yang dilakukan harus memperhatikan jenis dan teknologi mesin penepung berdasarkan tingkat kehalusan dan kapasitas produksi (Suismono 1995).
Standar mutu tepung ubi jalar belum ada. Namun bila ditinjau dari komponen mutu tepung umbi-umbian seperti pada tepung ubi kayu (SII tepung kasava N.2462-1991) meliputi : keadaan (bau, rasa, warna), benda asing, derajat putih, pati, cemaran logam (Pb, Cu, Zn, Hg dan As) serta cemaran mikroba (E.coli dan kapang), maka komponen mutu tepung di atas secara garis besar terdiri dari sifat fisik, kimia, dan mikrobiologis (Suismono 1995). Sementara kluster ubi jalar di Bogor Barat memiliki spesifikasi produk yaitu kadar air maksimal 6% dan total mikroba sebanyak 103 koloni/ml (Syah 2005).
Karotenoid dan Beta Karoten
Ubi jalar terutama yang berdaging umbi warna merah hingga kuning diketahui mengandung banyak karotenoid terutama beta karoten (Bauernfeind & Klaul 1981; Gross 1991). Purcell (1962) melakukan analisis karotenoid secara detail pada ubi jalar kuning jenis Goldrush dan ada 7 pigmen yang teridentifikasi yaitu phytoene (2,6%), phytofluene (0,8%), β-karoten (89,9%), ζ-karoten (1,2%),
β-karoten 5,8-epoksi (2,5%), γ-karoten (0,7%) dan hidroksi ζ- karoten (0,5%). Pada tahun 1970, Sweeney dan Marsh menyatakan bahwa fraksi karoten dalam ubi jalar adalah campuran all trans β-karoten (96,7%), neo-β-karoten B (0,1%), dan neo β-karoten U (3,2%). Woolfe (1992) menyebutkan bahwa lebih dari 89% total karoten pada ubi jalar oranye adalah beta karoten. Disebutkannya pula bahwa
ubi jalar memiliki dasar genetis yang sangat luas dengan variabilitas yang luar biasa sehingga belum ada bukti atau cara yang akurat untuk menunjukkan varietas ubi jalar mana yang kaya beta karoten.
Karrer dan Jucker (1950) dalam Muchtadi (1992) mendefinisikan karotenoid atas persetujuan Unit Internationale de Chimie, sebagai suatu zat warna kuning sampai merah yang mempunyai struktur alifatik atau alisiklik yang pada umumnya disusun oleh delapan unit isoprena, dimana kedua gugus metil yang dekat pada molekul pusat terletak pada posisi C-1 dan C-6, sedangkan gugus metil lainnya terletak pada posisi C-1 dan C-5, serta diantaranya terdapat ikatan ganda terkonjugasi.
Menurut Association of Vitamin Chemistry, London dalam Method of Vitamin Assay, secara umum karotenoid mempunyai sifat fisik dan kimia sebagai berikut :
• Larut dalam lemak
• Larut dalam kloroform, pewarna, karbon disulfida, petroleum eter
• Sukar larut dalam alkohol
• Sensitif terhadap oksidasi
• Auto oksidasi
• Stabil terhadap panas di dalam udara bebas oksigen kecuali untuk beberapa perubahan stereo isometrik
• Punya spektrum serapan yang spesifik
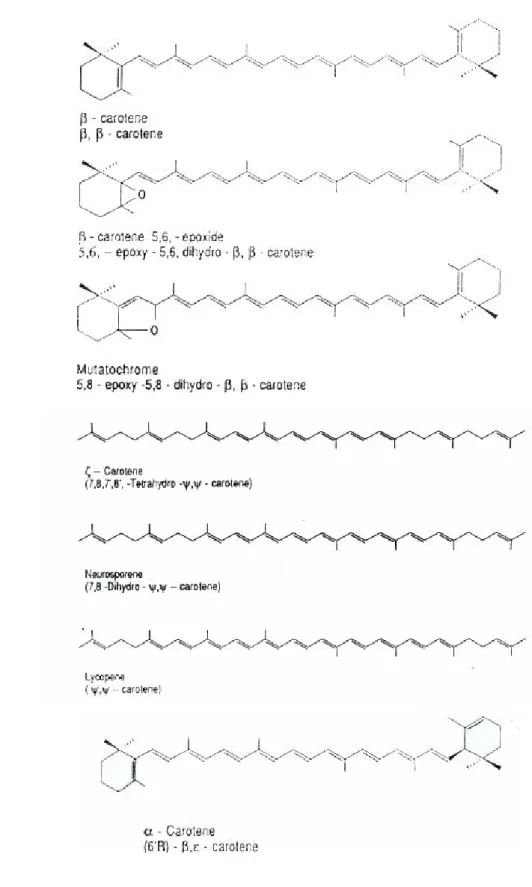
Meyer (1973) menjelaskan bahwa karotenoid dapat dikelompokkan menjadi 4 golongan, yaitu :
1. Karoten merupakan karotenoid hidrokarbon C40H56, yaitu alfa, beta dan
gamma karoten serta likopen
2. Xantofil dan derivat karoten yang mengandung oksigen dan hidroksil. Contoh : kriptoxantin dan lutein
4. Asam karotenoid, yaitu derivat karoten yang mengandung gugus karboksil
Sedangkan Bielsen (1994) hanya menggolongkan pigmen karotenoid ini menjadi 2 kelompok besar saja yaitu hydrocarbon carotenes dan oxygenated
xanthophylls.
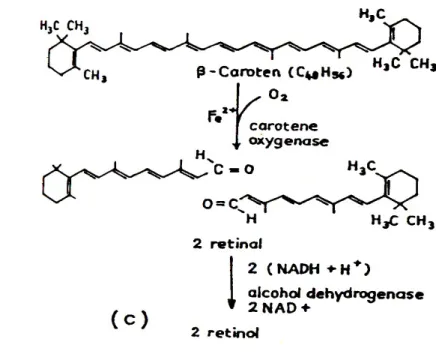
Dari suatu survey dasar diketahui bahwa vitamin A hanya ditemukan di makanan hewani berupa daging, hati, hingga telur. Vitamin A tidak ditemukan di makanan nabati, namun demikian tumbuhan mampu membentuk atau mensintesa senyawa karotenoid, yang merupakan prekursor vitamin A. Prekursor vitamin A ini merupakan pigmen warna kuning hingga merah yang dapat ditemukan pada daun atau buah dan sayuran. Karotenoid tersebut biasanya berupa beta karoten, alpha karoten, cryptoxanthin, lutein, zeaxanthin, dan likopen. Diantara jenis karotenoid yang ada, beta karoten memiliki aktivitas vitamin A (retinol) yang lebih besar ( Low et al. 1997). Hal ini akan tampak lebih jelas pada Gambar 2 yang menunjukkan bahwa beta karoten mampu membentuk 2 retinol di dalam mukosa usus, sedangkan jenis karotenoid yang lain (Gambar 3) hanya mampu membentuk paling tidak 1 retinol atau tidak sama sekali.
Gambar 2. Pengubahan beta karoten menjadi 2 retinol (Hassan 1987, Muchtadi 1992)
Karakterisasi beta karoten menurut Bauernfeind & Klaul (1981) terutama adalah sifatnya yang tidak larut dalam air, ethanol, methanol namun larut dalam minyak sayur dan memiliki titik leleh dalam kisaran 178 –184 oC.
Stabilitas Beta Karoten
Beta karoten sebagaimana karotenoid lain di alam, sebagian besar berupa hidrokarbon yang larut dalam air dan lemak, serta berikatan dengan senyawa yang strukturnya menyerupai lemak. Adanya struktur ikatan rangkap pada molekul beta karoten (11 ikatan rangkap pada 1 molekul beta karoten) menyebabkan bahan ini mudah teroksidasi ketika terkena udara. Menurut Walfford (1980) oksidasi karotenoid akan lebih cepat dengan adanya sinar dan katalis logam, khususnya tembaga, besi dan mangaan. Oksidasi dapat terjadi secara acak pada rantai karbon yang mengandung ikatan ganda. Pengaruh suhu terhadap oksidasi pada karotenoid dikemukakan oleh Worker (1957) dalam Muchtadi (1992) yaitu bahwa karotenoid belum mengalami kerusakan karena pemanasan pada suhu 600 C, sedangkan Mc Weeny (1968) berpendapat bahwa reaksi oksidasi karotenoid berjalan lebih cepat pada suhu yang relatif tinggi terutama jika terdapat prooksidan.
Marty dan Berset (1990) melakukan penelitian dengan beta karoten all trans sintetis dan menyatakan bahwa ketahanan molekul tersebut pada suhu tinggi dipengaruhi oleh kondisi medium. Pemanasan yang lama pada suhu 1800 C (pada kondisi tanpa oksigen) hanya menyebabkan sedikit kerusakan pada molekul ini, namun pada bahan pangan (dengan adanya komponen penyusun berupa pati, lemak, air dan lain-lain) serta dikombinasikan dengan pencampuran secara mekanis akan memberi kesempatan masuknya oksigen dan menyebabkan kerusakan molekul beta karoten all trans ini lebih besar hingga jauh lebih besar lagi.
Perubahan struktur beta karoten khususnya maupun karotenoid pada umumnya selama pengolahan dan penyimpanan dapat terjadi melalui beragam jalur, tergantung pada kondisi proses reaksinya.
Beberapa macam kerusakan karotenoid yang mungkin terjadi : 1. Kerusakan pada suhu tinggi
Eskin (1979) menyebutkan bahwa karotenoid akan mengalami kerusakan pada suhu tinggi yaitu melalui degradasi thermal sehingga terjadi dekomposisi karotenoid yang mengakibatkan turunnya intensitas warna karoten atau terjadi pemucatan warna. Hal ini terjadi dalam kondisi oksidatif.
2. Oksidasi
Eskin (1979) menyebutkan pula bahwa oksidasi dapat dikelompokkan menjadi 2 yaitu oksidasi enzimatis dan oksidasi non enzimatis. Oksidasi enzimatis dikatalis oleh enzim lipoksigenase. Hasil proses oksidasi ini berupa hidroksi beta karoten, semi karoten, beta karotenon, aldehid, dan hidroksi beta neokaroten yang menyebabkan penyimpangan citarasa. 3. Isomerisasi
Bentuk all trans memberikan warna kuat. Makin banyak ikatan cis, warna makin terang. Rantai poliene pada karoten bertanggung jawab akan ketidakstabilan karoten seperti kepekaannya terhadap oksidasi oleh oksigen dan peroksida, penambahan elektrofil (H+ dan asam Lewis), isomerisasi E/Z oleh panas, cahaya dan bahan kimia (Britton, Jensen, & Pfander 1995)
Khusus pada kerusakan beta karoten selama pengolahan dapat dinyatakan, salah satunya dengan persentase aktivitas provitamin A. Senyawa beta karoten dalam bentuk isomer trans mempunyai aktivitas provitamin A sebesar 100 persen. Kehilangan aktivitas provitamin A dapat terjadi selama sterilisasi anaerob dan bervariasi dari 5 sampai 50 persen tergantung pada suhu, waktu dan bentuk karotenoid (Andarwulan & Kuswara 1987).
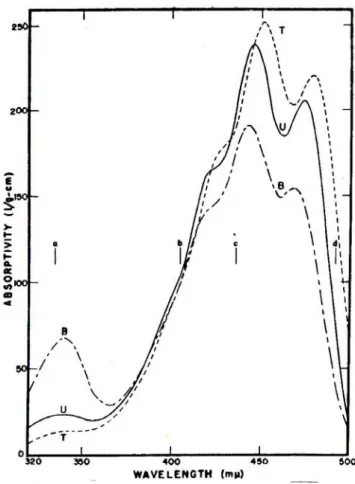
Karakteristik lain dari karotenoid adalah fenomena cis-trans. Secara teoritik, masing–masing ikatan rangkap dalam beta karoten dapat membentuk 2 macam konfigurasi. Kurva absorpsi spektra dari karotenoid yang mengalami isomerisasi dari bentuk trans ke cis, menggambarkan puncak trans isomer pada
Gambar 4. Spektrum absorbsi 3 macam stereoisomer beta karoten, trans beta karoten T, neo beta karoten U, neo beta karoten B. (Bauernfeind & Klaul 1981)
posisi terendah dibandingkan neo beta karoten B atau 13 mono cis beta karoten (pemasakan 400 menit) dan neo beta karoten U atau 9 mono cis beta karoten, kemudian dikenai cahaya yang makin besar panjang gelombangnya , menunjukkan perubahannya ke posisi puncak teratas (Gambar 4).
Sementara itu, perubahan struktur kimia beta karoten dari bentuk trans ke bentuk cis dapat dilihat pada Gambar 5. Perubahan ini menyebabkan penurunan aktivitas vitamin A dari 100% ke 30% saja (Andarwulan & Koeswara 1990).
Lebih lanjut, pemanfaatan antioksidan pangan akan mampu meningkatkan stabilitas beta karoten maupun karotenoid pada umumnya (Bauernfeind & Klaul 1981). Karotenoid yang digunakan sebagai bahan pewarna makanan biasanya distabilkan dengan tokoferol dan asam askorbat. Sejumlah penelitian menyebutkan bahwa antioksidan yang ditambahkan pada minyak mineral
Gambar 5. Perubahan struktur trans ke cis beta karoten (Mac Dougall 2002)
menunjukkan penurunan kadar beta karoten sebesar 20% dengan waktu terlama yaitu dengan antioksidan turunan phenylenediamine dan diphenylamine. Secara umum, Bauernfeind & Klaul (1981) mencatat bahwa stabilitas karotenoid dapat ditingkatkan dengan antioksidan pada formulasi yang cocok dan melibatkan asam askorbat dan ester asam bebasnya, tokoferol, lecithin, butylated hydroxyanisole (BHA) dan butylated hydroxytoluene (BHT).
Selain itu, menurut Chang dan Zhao (1995) penambahan pati jagung dan sulfit mampu memperlambat penurunan maupun rusaknya alpha, beta karoten dan total karoten pada wortel kering selama penyimpanan. Hingga penyimpanan bulan ke- 12 kadar beta karoten pada wortel kering yang dikenai perlakuan 2,5% pati jagung adalah sebesar 66% lebih baik dibanding kontrol sebesar 30,8%.
Hubungan Absorbansi Warna dengan Konsentrasi Pigmen
Beta karoten merupakan komponen penting dalam bahan pangan sebagai sumber vitamin A dan memberi warna kuning hingga oranye (Bauernfeind &
Klaul 1981). Intensitas warna beta karoten pada ubi jalar telah diperkirakan sebagai indikator nilai provitamin A bahan pangan tersebut (Takahata et al. 1993). Semakin rendah kadar beta karoten akan menurunkan warna dominan merah.
Mac Dougall (2002) menyebutkan bahwa warna kuning, oranye, merah karotenoid adalah terkait dengan sistem konjugasi ikatan rangkap karbon-karbon. Semua struktur trans dapat diubah menjadi isomer cis. Isomerisasi cis-trans menghasilkan perubahan warna produk yang ditunjukkan oleh sifat spektral karotenoid cis yang berbeda dengan karotenoid trans.
Hubungan antara absorbansi warna dengan konsentrasi dari pigmen warna yang diserap tersebut dinyatakan dalam hukum Beer (Nielsen 1998) yaitu :
A = abc
A = absorbansi b = tebal kuvet
a = absortivitas bahan c = konsentrasi pigmen
Makna yang dapat diambil dari hukum diatas adalah absorbansi berbanding lurus dengan konsentrasi pigmen.
Penelitian akhir-akhir ini telah banyak menelaah berbagai pengukuran konsentrasi pigmen secara cepat dengan mengkonversikan pengukuran warna dengan konsentrasi pigmen karena selain cepat, metode tersebut juga dapat dilakukan tanpa merusak bahan uji, seperti wortel, tomat, cabai, jeruk, ubi jalar dan bahan berwarna lainnya (Schoels 2002). Fratianni, et al (2005) mendapatkan konfirmasi komponen utama pembentuk warna pada tepung durum yaitu lutein dan beta karoten dengan membandingkan pengukuran colorimeter, WSB ( Water-Saturated Butanol) dan HPLC. Penelitian lain dalam review Schoels (2002) menunjukkan beberapa persamaan matematik untuk memperkirakan modifikasi pigmen yang terjadi selama proses produksi pangan. Beberapa peneliti menggunakan warna hue angle untuk mengkarakterisasi perubahan warna (Schoels 2002).
Penelitian-penelitian dengan bahan uji ubi jalar salah satunya adalah hasil penelitian Liener dan Sistrunk (1979) yang menunjukkan bahwa ada hubungan warna dengan total kandungan beta karoten. Pengukuran warna merah dengan
Color Difference Meter (CDM) pada varietas ubi jalar Centinnial, varietas Jasper dan varietas George Jet mempunyai kadar beta karoten masing-masing sebesar 18,5 mg/100 g , 15,5 mg/100 g dan 8,5 mg/100g dihasilkan nilai warna (L value) masing-masing 53,3 dan 50,4 serta 48,5. Penelitian berikutnya adalah penelitian Takahata et al. (1993) dan Camire et al. (1994) yang menggunakan pengukuran warna untuk perkiraan cepat (rapid estimation) kadar total karoten ubi jalar.
Ameny dan Wilson (1997) adalah peneliti berikutnya yang khusus mengamati hubungan antara nilai warna Hunter dan kadar beta karoten dalam ubi jalar Afrika berdaging umbi warna putih. Nilai warna Hunter tidak menunjukkan banyak perbedaan pada pengukuran melintang, membujur maupun diagonal ubi jalar mentah. Hubungan antara pengukuran warna dengan sistem Hunter dan pengukuran kadar beta karoten dengan HPLC dinyatakan dengan besarnya nilai korelasi linear dan nilai tertinggi diperoleh pada nilai b yaitu dengan nilai r sebesar 0.74. Perubahan warna yang terjadi pada saat pengolahan ubi jalar seperti warna merah yang semakin berkurang, munculnya warna biru atau hijau dinyatakan sebagai suatu peristiwa isomerisasi trans-cis struktur karoten, karena adanya kompleks protein dengan karoten ataupun karena adanya kerusakan struktur karoten yaitu terbentuknya karoten struktur epoksi.