SKRIPSI
KAJIAN PEMANFAATAN TEPUNG UBI JALAR UNGU (Ipomoea batatas (L) LAM.) DALAM PEMBUATAN SPREADS
UBI JALAR
Oleh
JESSICA ANDREA YAHYA F24060777
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
KAJIAN PEMANFAATAN TEPUNG UBI JALAR UNGU (Ipomoea batatas (L) LAM.) DALAM PEMBUATAN SPREADS UBI
JALAR
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada D epartemen Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
JESSICA ANDREA YAHYA F24060777
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
Utilization Of Purple Sweet Potato Flour (Ipomoea Batatas (L) Lam.) In Sweet Potato Spreads Production Studies
Jessica Andrea Yahya1, Dahrul Syah1, Sutrisno Koswara1
Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor, Kampus IPB Darmaga, PO.Box 220, Bogor 16002, Indonesia
Abstract
Purple sweet potato (Ipomoea babatas cv. Ayamurasaki) contains high amounts of anthocyanin. Processing purple sweet potato becoming flour will make it more available to be used in various product, like spreads. Aim of this research is to obtain flours with highest color intensity and anthocyanin content, an optimal recipe for producing sweet potato spreads, and describe characteristic of sweet potato spreads. The results showed that flour steamed 10 minutes and dried with sun light has the highest total anthocyanin (183,44 mg cyE/100g) and the best color appearance (L 40.25; a 13.29; b -3.74; ohue 344.37o; and C 13.81). Then, the purple sweet potato flour was used to make sweet potato spreads. Addition of 9% purple sweet potato flour and 0.6% glycerol monostearate with 30 minutes of mixing at 500C and 15 minutes of homogenization gave optimum emulsion stability for sweet potato spreads. Sweet potato spreads was divided into three different formula based on the ratio of shortening and oil. The result showed that ratio of shortening and oil had significant effect to spreadability, brightness, consumer acceptance, and emulsion stability of sweet potato spreads. Based on the fourth parameter, it was concluded that sweet potato spreads with 2:1 ratio of shortening to oil was the most optimum formula.
JESSICA ANDREA YAHYA. F24060777. Kajian Pemanfaatan Tepung Ubi Jalar Ungu (Ipomoea batatas (L) Lam) dalam Pembuatan Spreads Ubi Jalar. Di bawah bimbingan: Dahrul Syah dan Sutrisno Koswara. 2010.
RINGKASAN
Ubi jalar merupakan tanaman palawija yang berpotensi menjadi sumber karbohidrat utama serta memiliki produktivitas yang cukup besar. Salah satu varietas ubi jalar yang layak dikembangkan yaitu ubi jalar ungu (Ipomoea batatas var Ayamurasaki). Pengolahan ubi jalar ungu menjadi tepung selain dapat meningkatkan umur simpan, juga dapat memudahkannya untuk diolah menjadi beraneka ragam produk makanan salah satu diantaranya spreads ubi jalar ungu. Penelitian ini bertujuan untuk memperoleh tepung ubi jalar dan formula spreads ubi jalar terbaik.
Penelitian ini terdiri atas dua tahap, yaitu pembuatan tepung ubi jalar dan pembuatan spreads ubi jalar. Proses pembuatan tepung ubi jalar meliputi pencucian, pengupasan, pemotongan, pengukusan, penyawutan, pengeringan, penggilingan, dan pengayakan. Tepung ubi jalar terbaik ditentukan berdasarkan total antosianin dan profil warna tepung yang dihasilkan. Pembuatan spreads ubi jalar terdiri dari tahap penentuan formula dasar spreads dan kondisi proses pembuatanya, penentuan jumlah tepung ubi jalar yang ditambahkan, serta penentuan formula spreads ubi jalar terbaik. Formula spreads ubi jalar menggunakan peubah proporsi shortening terhadap minyak sebesar 1:1, 2:1, dan 3:1. Analisis yang dilakukan pada produk ini meliputi analisis stabilitas krimming, total antosianin, daya oles, warna, uji organoleptik, serta analisis proksimat pada formula spreads terbaik.
Hasil analisis total antosianin dan warna pada keempat jenis tepung menunjukkan semakin lama waktu pengukusan, semakin besar kandungan antosianin dan intensitas warnanya serta semakin semakin rendah kecerahanya. Proses pengeringan menggunakan sinar matahari juga menghasilkan tepung dengan kandungan antosianin dan intensitas warna yang lebih tinggi daripada tepung yang dikeringkan dengan tray drier. Tepung dengan pengukusan selama 10 menit dan pengeringan menggunakan sinar matahari merupakan tepung ubi jalar terbaik. Tepung ini menghasilkan rendemen sebesar 6,9555% dari berat ubi jalar mula-mula dengan kadar air sebesar 8,4312%bb, kadar abu sebasar 2,5596%bb, kadar protein sebesar 3,4295%bb, kadar lemak sebesar 0,6798%bb, dan kadar karbohidrat sebesar 84,8995%bb.
Penentuan formula dasar dan kondisi proses pembuatan spreads menunjukkan penambahan 0,6% GMS, pencampuran bahan selama 30 menit pada suhu 50oC, dan homogenisasi selama 15 menit menghasilkan spreads dengan kestabilan emulsi yang optimum. Formula dasar spreads selanjutnya ditambahkan tepung ubi jalar ungu sebanyak 9%. Tepung ubi jalar ungu ditambahkan setelah dipanaskan hingga suhu 60oC
ubi jalar tidak memiliki perbedaan yang signifikan. Hasil analisis daya oles objektif menunjukkan formula S1M1 memiliki daya oles yang paling besar, namun formula ini memiliki kestabilan emulsi yang paling rendah. Formula S3M1 memiliki kestabilan emulsi tertinggi, namun formula ini memiliki warna yang paling cerah dan sifat daya oles objektif yang paling rendah. Uji rating intensitas ketiga formula spreads dan produk spreads coklat komersil menunjukkan formula S1M1 merupakan formula yang paling mudah dioles, diikuti dengan formula S2M1 dan spreads coklat komersil. Hasil analisis rating hedonik menujukkan formula S1M1 dan S2M1 merupakan formula yang paling disukai.
Judul Skripsi : Kajian Pemanfaatan Tepung Ubi Jalar Ungu (Ipomoea batatas (L) Lam.) dalam Pembuatan Spreads Ubi Jalar
Nama : Jessica Andrea Yahya
NIM : F24060777
Menyetujui
Bogor, September 2010
Pembimbing I, Pembimbing II,
Dr. Ir. Dahrul Syah, Msc Ir. Sutrisno Koswara, Msc NIP 19650814.199002.1.001 NIP: 19640505.199103.1.003
Mengetahui,
Ketua Departemen ITP
Dr. Ir. Dahrul Syah, Msc NIP: 19650814. 199002. 1.001
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 4 Juni 1988 di Jakarta. Penulis adalah anak kedua dari dua bersaudara dari keluarga Ibu Setiawati Hidayat dan Bapak Robert C. Yahya. Penulis mengawali jenjang pendidikannya di TK Kemuliaan Bunda pada tahun 1993-1994, SD Kristen Yusuf pada tahun 1994-1996, dan SD Kemurnian 1 pada tahun 1996-2000. Kemudian dilanjutkan ke jenjang sekolah lanjutan di SLTP Tarakanita 2 Jakarta pada tahun 2000-2003 serta sekolah menengah SMA Tarakanita 2 Jakarta pada tahun 2003-2006. Pada tahun 2006, penulis diterima sebagai mahasiswa IPB melalui jalur Saringan masuk IPB (SPMB) dan pada tahun berikutnya terdaftar di departemen Ilmu dan Teknologi Pangan, Fakultas Telnologi Pertanian, Institut Pertanian Bogor.
Selama menduduki bangku kuliah di Departemen Ilmu dan Teknologi Pangan, penulis terlibat dalam organisasi Komisi Pelayanan Anak (KPA) dan Food Processing Club (FPC). Penulis juga terlibat dalam beberapa kepanitian seperti Lomba Cepat Tepat Ilmu Pangan tahun 2007 dan Paskah Besar Anak (KPA) sebagai Sie Konsumsi. Penulis pernah mengikuti Program Kreativitas Mahasiswa (PKM) bidang penelitian sampai pada tahap dibiayai. Selain itu, penulis juga aktif dalam mengikuti beberapa program pelatihan seperti training HACCP (Hazard Analysis Critical Control Point) dan ISO 9001 dan 22000.
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian, Penulis melakukan penelitian sebagai tugas akhir yang berjudul
i
KATA PENGANTAR
Puji syukur yang tak terhingga penulis panjatkan kepada Tuhan Yesus Kristus yang telah mencurahkan kasih dan berkat yang melimpah sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor. Penulisan skripsi yang berjudul “Kajian Pemanfaatan Tepung Ubi Jalar Ungu (Ipomoea batatas (L) Lam) dalam Pembuatan SpreadsUbi Jalar”
Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada:
1. Dr.Ir Dahrul Syah, Msc selaku dosen pembimbing akademik yang dengan sabar memberi bimbingan, masukan, dan nasehat kepada penulis selama perkuliahan dan penyusunan tugas akhir.
2. Ir. Sutrisno Koswara, Msc selaku dosen pembimbing kedua yang telah memberikan bimbingan, pengarahan, nasehat selama penelitian dan penyusunan skripsi ini.
3. Faleh Setia Budi ST, MT atas waktu, masukan, dan kesediaanya menjadi dosen penguji.
4. Orang tuaku tercinta yang selalu melimpahkan penulis dengan kasih sayang, doa, dukungan moril dan materi serta tidak pernah jenuh mendengar keluh kesah penulis.
5. Kakakku Grace yang dengan bijaksana memberikan masukan, nasehat, serta dukungan moril dan materi kepada penulis.
6. Keluarga besar Hidayat atas doa, dukungan, kasih sayang serta dukungan. 7. Bapak Eko hari Purnomo dan Ibu Didah Nur Faridah serta seluruh staf
pengajar ITP. Terima kasih atas bimbingannya selama penulis menjalani penelitian, mengolah data, dan ilmu-ilmu yang telah diberikan kepada penulis.
8. Seluruh teknisi dan laboran Departemen ITP: Pak Wahid, Bu Rubiah, Pak Gatot, Pak Rojak, Pak Sobirin, Pak Iyas, Pak Nurwanto, Pak Jun, Pak Karna terima kasih atas bantuan, saran, dan kerja samanya selama penulis melakukan penelitian.
9. Sahabat-sahabat terbaikku di ITP 43: Stephanie, Erinna, Prima, Feryana, Daisy, Stephanie GH, Nina, Rika, Dessyana, Yurina, Fenny, Mario, Stella, Syenny, Richie, Margaret, Dyas, Ci Iren atas kebersamaan, canda, dan dukungannya.
ii Yogi, ko Marcel, Kak Tuti. Terima kasih atas pinjaman alat, kebersamaan, serta masukan kepada penulis.
11.Teman-teman Six hoy dan Jumpelerz buat kebersamaan, canda, dan pengertian, dan dukungan bagi penulis.
12.Teman-teman tim Ubi: Saffiera dan Saidah.
13.Teman-teman tarQ: Ariyanti, Rio, Siu, Marcel, Yohanna atas dukungannya. 14.Seluruh teman-teman ITP 43, ITP 44, dan ITP 42 yang tidak dapat
disebutkan satu per satu atas kebersamaannya
15.Pihak-pihak lain yang tidak dapat disebutkan satu persatu yang telah membantu penulis dalam penyelesaian skripsi ini.
Penulis berharap skripsi ini dapat bermanfaat dan berguna bagi semua pihak. Penulis juga mengharapkan kritik dan saran yang membangun dari berbagai pihak untuk memperbaiki dan menyempurnakan penulisan skripsi ini.
Bogor, September 2010
iii
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. UBI JALAR ... 3
1. Ubi Jalar Ungu (Ipomoea Batatas Var. Ayamurasaki ... 5
2. Antosianin ... 7
3. Tepung Ubi Jalar ... 12
B. EMULSI ... 18
C. SPREADS... 21
III. METODE PENELITIAN... 23
A. BAHAN DAN ALAT ... 23
B. METODE PENELITIAN ... 23
1. Penelitian Pendahuluan... 23
2. Penelitian Utama... 25
C. METODE ANALISIS ... 28
1. Analisis Kimia ... 28
2. Uji Organoleptik ... 32
3. Analisis Fisik ... 32
IV. HASIL DAN PEMBAHASAN ... 34
A. PENELITIAN PENDAHULUAN ... 34
1. Pembuatan Tepung Ubi Jalar Ungu ... 34
2. Analisis Fisikokimia Tepung Ubi Jalar Ungu ... 38
2.1. Total Antosianin ... 38
2.2. Analisis Warna ... 41
iv
B. PENELITIAN UTAMA ... 45
1. Penentuan Formula dan Kondisi Proses Pembuatan Spreads Ubi Jalar ... 45
2. Total Antosianin ... 49
3. Análisis Warna ... 49
4. Kestabilan Emulsi ... 51
5. Analisis Daya Oles ... 52
6. Uji Organoleptik ... 56
6.1. Rasa ... 57
6.2. Aroma ... 57
6.3. Warna ... 57
7. Pemilihan Formula Terbaik ... 57
8. Analisis Proksimat ... 59
V. KESIMPULAN DAN SARAN ... 60
DAFTAR PUSTAKA ... 62
v
DAFTAR TABEL
Halaman
Tabel 1. Perkembangan produksi ubi jalar di Indonesia tahun 2005-2009 ... 4
Tabel 2. Kisaran HLB emulsifier dan penggunaanya ... 20
Tabel 3. Penilaian kemampuan daya oles spreads ... 21
Tabel 4. Tipe komposisi spreads ... 22
Tabel 5. Formula dasar spreads ... 25
Tabel 6. Formula spreads ubi jalar ... 28
Tabel 7. Rekapitulasi komponen hilang selama pembuatan tepung ubi jalar ... 36
Tabel 8. Hasil analisis warna tepung ubi jalar ... 41
Tabel 9. Hasil analisis proksimat tepung ubi jalar ungu ... 44
Tabel 10. Perbandingan shortening dan minyak formula spreads ubi jalar ... 48
Tabel 11. Hasil analisis warna spreads ubi jalar ... 50
Tabel 12. Hasil analisis reologi spreads ubi jalar dan spreads komersil ... 53
vi
DAFTAR GAMBAR
Halaman
Gambar 1. Ubi jalar ungu var Ayamurasaki ... 5
Gambar 2. Struktur antosianin dalam ubi jalar ungu ... 6
Gambar 3. Struktur kimia antosianidin ... 8
Gambar 4. Struktur antosianidin ... 8
Gambar 5. Reaksi degradasi cyanidin-3-monoglukosida ... 9
Gambar 6. Perubahan struktur molekul pelargonidin ... 11
Gambar 7. Pergerakan air dalam bahan pangan selama pengeringan ... 13
Gambar 8. Skema aliran udara tray drier ... 15
Gambar 9. Mekanisme kerja emulsifier ... 19
Gambar 10. Diagram alir pembuatan tepung ubi jalar ... 24
Gambar 11. Diagram alir pembuatan spreads ... 26
Gambar 12. Diagram alir pembuatan spreads ubi jalar ... 27
Gambar 13. Kurva hubungan antara shear rate dan shear stress ... 33
Gambar 14. Diagram alir kesetimbangan massa pembuatan tepung ubi jalar ... 36
Gambar 15. Pin disc mill ... 37
Gambar 16. Tepung ubi jalar ungu: (a) 7menit matahari, (b) 10 menit matahari (c) 7menit tray drier, (d) 10menit tray drier... 38
Gambar 17. Hasil analisis kadar antosianin tepung ubi jalar ... 39
Gambar 18. Spreads ubi jalar ... 48
Gambar 19. Hasil analisis kadar antosianin spreads ubi jalar ... 49
Gambar 20. Ketiga formula spreads ubi jalar ... 49
Gambar 21. Diagram warna Hunter-Munsel... 50
Gambar 22 Hasil analisis stabilitas krimming spreads ubi jalar ... 51
Gambar 23 Hasil uji rating intensitas daya oles spreads ubi jalar ... 55
vii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil analisis total antosianin tepung ubi jalar ... 67
Lampiran 2. Hasil pengolahan data total antosianin dengan SPSS11.5 ... 68
Lampiran 3. Hasil analisis warna tepung ubi jalar ... 69
Lampiran 4. Hasil pengolahan data analisis warna (chroma) dengan SPSS11.5 70
Lampiran 5. Hasil analisis proksimat tepung ubi jalar ... 71
Lampiran 6. Hasil analisis total antosianin spreads ubi jalar... 72
Lampiran 7. Hasil pengolahan data total antosianin spreads ubi jalar dengan SPSS11.5 ... 73
Lampiran 8. Hasil analsis kestabilan krimming spreads ubi jalar ... 74
Lampiran 9. Hasil analisis kestabilan krimming spreads ubi jalar dengan SPSS 11.5 ... 75
Lampiran 10. Hasil analisis warna spreads ubi jalar ... 76
Lampiran 11. Hasil pengolahan data analisis warna (lightness) spreads ubi jalar dengan SPSS11.5 ... 77
Lampiran 12. Hasil pengolahan data analisis warna (chroma) spreads ubi jalar dengan SPSS11.5 ... 78
Lampiran 13. Kuesioner analisis daya oles ... 79
Lampiran 14. Data hasil uji rating intensitas daya oles spreads ubi jalar ... 80
Lampiran 15. Hasil analisis ANOVA untuk uji intensitas daya oles ... 81
Lampiran 16. Kuesioner analisis rating hedonik ... 82
Lampiran 17. Data hasil uji rating hedonik spreads ubi jalar ... 83
Lampiran 18. Hasil pengolahan data untuk uji rating hedonik atribut rasa ... 85
Lampiran 19. Hasil pengolahan data untuk uji rating hedonik atribut aroma ... 86
Lampiran 20. Hasil pengolahan data untuk uji rating hedonik atribut warna ... 87
Lampiran 21. Hasil pengolahan data untuk uji rating hedonik atribut daya oles ... 88
Lampiran 22. Hasil pengukuran pengaruh laju geser terhadap gaya geser pada keempat jenis sampel ... 89
Lampiran 23. Hasil pengukuran reologi formula spreads ubi jalar dengan rotovisco ... 91
1
I. PENDAHULUAN
A.LATAR BELAKANG
Indonesia dikenal sebagai negara agraris yang memiliki berbagai tanaman palawija. Salah satu tanaman palawija tersebut adalah ubi jalar. Ubi jalar merupakan komoditas sumber karbohidrat utama, setelah padi, jagung, dan ubi kayu, dan mempunyai peranan penting dalam penyediaan bahan pangan, bahan baku industri maupun pakan ternak. Menurut Hidayat et al., (2007) ubi jalar berpotensi untuk dikembangkan menjadi sumber karbohidrat alternatif.
Dilihat dari segi budidayanya, tanaman ini sangat potensial di Indonesia mengingat produksinya pada lima tahun terakhir mencapai 9.536.949 ton. Hingga tahun 2008, luas lahan ubi jalar di Indonesia mencapai 174,561 Ha dengan produksi mencapai 1.880.977 ton (Deptan, 2009). Umbi dari ubi jalar sendiri sangat beraneka ragam tergantung varietasnya. Salah satu varietas ubi jalar yang layak dikembangkan yaitu ubi jalar ungu (Ipomoea batatas var Ayamurasaki).
Selain memiliki potensi produktivitas yang besar, yaitu sekitar 15-20 ton/Ha (Yusuf et al., 2003), Ayamurasaki mengandung pigmen antosianin yang cukup besar dan lebih stabil bila dibandingkan sumber antosianin lainnya, seperti kubis merah, elderberries, blueberries dan jagung merah. Ayamurasaki juga memiliki aktivitas antioksidan baik secara in vivo dan in vitro, dapat berperan sebagai antihipertensi, memperbaiki kerusakan pada hati yang disebabkan oleh karbon tetraklorida (CCl4), menurunkan kadar gula
2 diolah menjadi beraneka ragam produk makanan salah satu diantaranya spreads ubi jalar.
Spreads merupakan produk pangan berbentuk semi padat dan biasa dikonsumsi langsung dengan cara dioleskan pada permukaan roti. Karakteristik utama dari produk ini adalah kemudahannya untuk menyebar saat dioleskan ke permukaan roti. Adanya penambahan ubi jalar ungu dalam produk ini akan memberikan warna yang menarik serta sifat fungsional yang baik bagi kesehatan. Hal ini disebabkan tingginya kandungan antosianin yang dapat dijadikan sebagai nilai tambah produk spreads ubi tersebut.
Adanya penerapan bahan baku ubi jalar ungu dalam pembuatan spreads diharapkan dapat mendukung program diversifikasi pangan sekaligus meningkatkan nilai ekonomis dari ubi jalar ungu tersebut. Sehingga dapat meningkatkan minat terhadap ubi jalar ungu dan dapat mendorong produktivitasnya.
B.TUJUAN PENELITIAN
Penelitian ini bertujuan :
1. Memperoleh tepung ubi jalar ungu dengan kadar antosianin dan penampakan warna terbaik
2. Menentukan rasio penambahan tepung ubi jalar ungu yang menghasilkan spreads ubi jalar ungu dengan kualitas terbaik.
3
II. TINJAUAN PUSTAKA
A. UBI JALAR
Ubi jalar atau ketela rambat diduga berasal dari benua Amerika. Para ahli botani dan pertanian memperkirakan daerah asal tanaman ubi jalar adalah Selandia Baru, Polinesia, dan Amerika bagian tengah dan dibawa menuju Eropa bagian barat oleh Columbus pada tahun 1492 (Srisuwan et al., 2006). Karena tanaman ubi jalar memiliki kemampuan beradaptasi dengan baik, ubi jalar mulai menyebar di Asia, Afrika, dan Amerika Latin pada abad ke-17 dan abad ke-18. Hingga kini ubi jalar dianggap sebagai komoditi pangan yang penting setelah gandum, beras, jagung, kentang, jewawut, dan ubi kayu di dunia (Woolfe, 1992).
Klasifikasi lengkap taksonomi tumbuhan ubi jalar adalah kingdom Plantae, divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledonae, ordo Convolvulales, famili Convolvulaceae, genus Ipomoea, dan spesies Ipomoea batatas. Tanaman ini tumbuh baik di daerah beriklim panas dan lembab, dengan suhu optimum 27°C, kelembaban udara (RH) 50-60%, dengan curah hujan 750-1500 mm/tahun, dan lama penyinaran 11-12 jam per hari. Ubi jalar dapat tumbuh sampai ketinggian 1.000 meter dari permukaan laut dan tidak membutuhkan tanah subur untuk media tumbuhnya (Rukmana, 1997).
Umumnya ubi jalar dibudidayakan pada dataran rendah di Indonesia. Sistem pertanian yang umum digunakan adalah sistem rotasi. Tanaman ini umumnya dipanen sekitar 4-5 bulan setelah masa tanam. Ubi jalar umumnya ditanam pada awal musim kemarau (April-Juni) dan dipanen pada awal atau menjelang musim penghujan (Agustus-Oktober) di daerah sentra produksi. Namun karena daya adaptasinya yang luas, tanaman ini dapat ditanam sepanjang tahun asalkan kebutuhan air pada awal pertumbuhannya tercukupi (Hassanudin dan Wargiono, 2003).
4 sebesar 98,6 juta ton per tahun. Indonesia sendiri merupakan negara penghasil ubi jalar kedua terbesar di dunia setelah Cina (Christian, 2005).
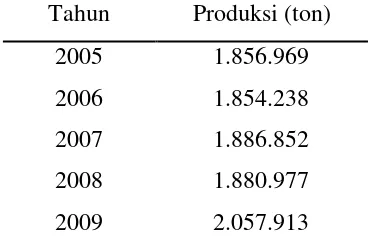
Bila dibandingkan dengan beras, jagung, dan kacang-kacangan, ubi jalar kurang populer di Indonesia sehingga produksi ubi jalar selama beberapa dekade terakhir terus menurun. Mulai berkembangnya berbagai produk berbasis ubi jalar serta kepedulian masyarakat terhadap kesehatan akhir-akhir ini, ternyata mendorong peningkatan produksi ubi jalar dalam negeri. Hal ini dibuktikan dengan meningkatnya produksi ubi jalar di Indonesia selama beberapa tahun terakhir. Produksi ubi jalar beberapa tahun terakhir dapat dilihat pada Tabel 1.
Tabel 1. Perkembangan produksi ubi jalar di Indonesia tahun 2005-2009 Tahun Produksi (ton)
2005 1.856.969
2006 1.854.238
2007 1.886.852
2008 1.880.977
2009 2.057.913
Sumber : Departemen Pertanian (2009)
Terdapat beberapa kendala dalam peningkatan pemanfaatan ubi jalar, antara lain (1) Bulkiness dan sifat mudah rusak, (2) sistem penyuplaian yang belum terbentuk sempurna, (3) kandungan bahan kering, (4) serangan hama kutu, (5) penyakit yang disebabkan virus dan fungi, (6) biaya pengolahan per unit yang cukup tinggi, (7) status ubi jalar sebagai pangan masyarakat menengah ke bawah, dan (8) sumberdaya dan petani ubi jalar yang sedikit dan miskin (Hassanuddin dan Wargiono, 2003).
5 Bunganya berbentuk lonceng dan berwarna putih atau campuran dengan warna jingga, akan tetapi kebanyakan ubi jalar tidak berbunga.
Ubi jalar umumnya dibagi menjadi dua golongan yaitu ubi jalar yang berumbi lunak karena banyak mengandung air dan ubi jalar yang berumbi keras karena banyak mengandung pati (Lingga et al., 1989). Warna kulit umbi ada yang berwarna putih, kuning, ungu atau ungu kemerah-merahan, tergantung varietasnya. Daging ubi berwarna putih, kuning atau jingga sedikit ungu (Rukmana, 1997). Salah satu varietas ubi jalar yang layak dikembangkan adalah ubi jalar ungu atau Ipomoea batatas var Ayamurasaki.
1. Ubi Jalar Ungu (Ipomoea batatas var Ayamurasaki)
Ubi jalar ungu (Ipomoea batatas var Ayamurasaki) atau bisa disebut Ipomoea batatas blackie merupakan varietas tanaman ubi jalar lokal generasi kedua di Jepang yang dikembangkan oleh lembaga National Agricultural Research Center for Kyushu Okinawa Region (KONARC) (Suda et al., 2003). Tanaman yang telah diusahakan secara komersial di beberapa daerah di Jawa Timur ini memiliki potensi hasil sebanyak 15-20 ton/ha (Jusuf et al., 2008).
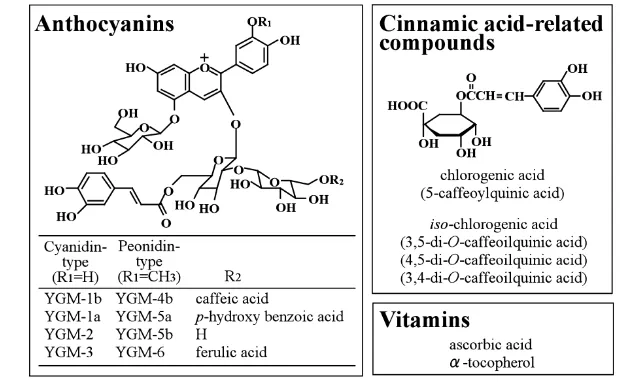
6 Menurut Suda et al.,(2003) total kandungan antosianin ubi jalar ungu sekitar 600mg/100g. Pigmen antosianin yang terkandung dalam ubi ini sendiri ditemukan dalam bentuk mono atau diasilasi cyanidin (YGM1a, -1b, -2 and -3) dan peonidin (YGM-4b, -5a, -5b and -6). Banyaknya kandungan antosianin terasilasi menyebabkan ubi jalar ini memiliki sifat yang stabil terhadap panas dan iradiasi ultraviolet (Hayashi, et al.,1996).
Gambar 2. Antosianin dalam ubi jalar ungu (Suda etal., 2003) Tingginya konsentrasi serta sifat pigmen antosianin yang stabil mendorong banyaknya makanan atau minuman yang menggunakan ubi ini sebagai bahan baku atau bahan pewarna. Beberapa produk yang memanfaatkan ubi jalar, diantaranya ice cream, minuman beralkohol, mie, chips, jus, confectionery, pie dan roti (Yamakawa et al.,1998).
7 Selain berperan sebagai antioksidan, ubi jalar juga dapat menghambat kerja angiotensin I-converting enzyme (ACE) yang berperan dalam mengatur tekanan darah, dengan kata lain ubi jalar ini dapat berperan sebagai antihipertensi. Sifat fungsional lain diantaranya dapat memperbaiki kerusakan pada hati yang disebabkan oleh karbon tetraklorida(CCl4),
menurunkan kadar gula darah postprandial serta berperan sebagai anti-mutagenik (Suda et al., 2003).
Walaupun kandungan antosianin pada ubi jalar ini besar dan stabil terhadap pemanasan, ubi jalar ungu mentah mudah mengalami pencoklatan. Selain dapat menurunkan intensitas warna ungu pada ubi, reaksi pencoklatan ini juga menurunkan kadar antosianin dalam ubi jalar. Hal inilah yang menyebabkan terjadinya perbedaan kadar antosianin pada minuman beralkohol yang dibuat dari ubi jalar ungu yang dikukus terlebih dahulu dengan ubi jalar ungu mentah. Menurut Saigusa et al., (2007) hal ini disebabkan adanya aktivitas enzim pencoklatan, seperti polifenol oksidase, atau enzim yang menyebabkan reaksi deasilasi pada ubi jalar tersebut. Oleh karena itu, dalam proses pengolahan diperlukan perlakuan pemanasan awal untuk menginaktivasi enzim tersebut.
2. Antosianin
Antosianin merupakan salah satu bagian penting dalam grup pigmen setelah klorofil. Antosianin berasal dari bahasa Yunani, anthos yang berarti bunga dan kyanos yang berarti biru gelap. Antosianin merupakan pigmen yang larut dalam air yang menghasilkan warna dari merah sampai biru dan tersebar luas dalam buah, bunga dan daun. Antosianin terdapat pada vakuola sel bagian tanaman. Antosianin umumnya ditemukan pada buah-buahan, sayuran, dan bunga; misalnya pada kol merah, strawbery, cherry, bunga kembang sepatu, dan sebagainya (Jackman dan Smith, 1996).
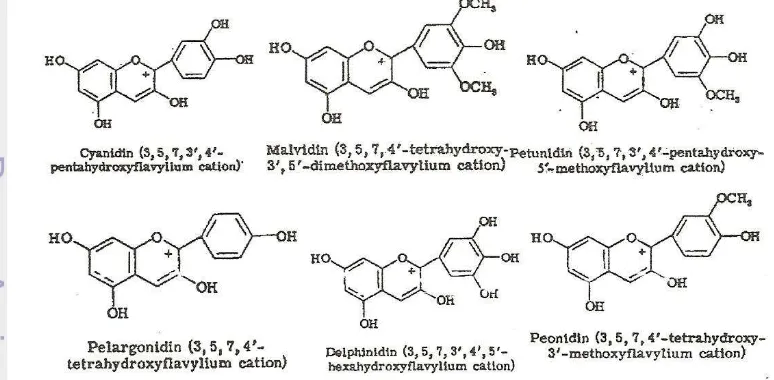
8 glikon (Brouillard, 1982). Apabila gugus glikon dihilangkan melalui proses hidrolisis maka dihasilkan antosianidin yang dapat dilihat pada Gambar 5.
Gambar 3. Struktur kimia antosianidin (Castañeda-Ovando et al., 2009) Gugus gula yang biasa berikatan dengan molekul antosianidin diantaranya glukosa, galaktosa, rhamnosa, xilosa, fruktosa, dan arabinosa. Pada tanaman, antosianin biasanya berada dalam bentuk glikosida. Glikosida ester dengan satu molekul monosakarida disebut monoglikosida, biosida, atau diglukosida jika memiliki dua molekul gula, dan triosida jika memiliki tiga molekul gula (Delgado-Vargas, 2000).
Terdapat lebih dari 500 jenis antosianidin telah ditemukan, akan tetapi hanya enam yang memegang peranan penting dalam bahan pangan, yaitu sianidin, malvidin, petunidin, pelargonidin, delfinidin, dan peonidin (Castañeda-Ovando et al., 2009). Struktur keenam antosianidin dapat dilihat pada Gambar 6.
9 Sifat dan warna antosianin di dalam jaringan tanaman dipengaruhi oleh beberapa faktor, diantaranya konsentrasi pigmen, letak, dan jumlah gugus hidroksi dan metoksi,serta kopigmentasi. Konsentrasi antosianin yang tinggi di dalam jaringan akan menyebabkan warna merah. Konsentrasi yang sedang akan memberikan warna jingga hingga ungu, sedangkan konsentrasi rendah akan memberikan warna biru (Markakis, 1982).
Jumlah gugus hidroksi atau metoksi pada struktur antosianidin selain mempengaruhi warna, juga mempengaruhi kestabilan antosianin. Jumlah gugus hidroksi yang dominan menyebabkan warna cenderung biru dan relatif tidak stabil. Sedangkan jumlah gugus metoksi yang dominan akan menyebabkan warna cenderung merah dan relatif stabil (Jackman dan Smith, 1996). Kestabilan antosianin dipengaruhi oleh beberapa faktor, seperti struktur dan konsentrasi antosianin, pH, suhu, enzim, dan cahaya (Elbe dan Schwartz, 1996).
a. Enzim
Menurut Huang (1955) diacu dalam Saigusa (2006), Enzim yang diisolasi dari Aspergillus niger menyebabkan degradasi warna pada pigmen antosianin dari blackberry, cyanidin-3-monoglukosida. Enzim antosianase mengkatalisis reaksi hidrolisis dari antosianin menjadi aglikon dan pecahan gula. Reaksi yang terjadi adalah cyanidin-3- monoglukosida dipecah oleh antosianase menjadi cyanidin dan glukosa (Lindy, 2008). Reaksi degradasi cyanidin-3-monoglukosida oleh enzim antosianase dapat dilihat pada Gambar 7.
Gambar 5. Reaksi degradasi cyanidin-3-monoglukosida (Eskin, 1979) Markakis (1982), mengemukakan bahwa kestabilan antosianin berefek terhadap ketahanan warna merah. Sebelum mengalami proses
10 lebih lanjut, buah chery dibekukan terlebih dahulu. Ketika dibutuhkan, chery mengalami pemanasan terlebih dahulu untuk merusak enzim antosianase.
b. Cahaya
Cahaya mempunyai dua pengaruh yang saling berlawanan terhadap antosianin yaitu berperan dalam pembentukan antosianin dalam proses biosintesisnya tetapi juga mempercepat laju degradasi warna antosianin. Menurut Lindy (2008), asilasi, metilasi bentuk diglikosida menjadikan antosianin lebih stabil terhadap cahaya, sedangkan diglikosida yang tidak terasilasi lebih tidak stabil demikian juga dengan monoglikosida.
c. pH
Faktor pH mempengaruhi kestabilan warna antosianin. Menurut Markakis (1982), antosianin lebih stabil dalam larutan asam dibanding dalam larutan alkali atau netral. Semakin asam sifat larutannya, maka antosianin semakin stabil.
Antosianin akan mengalami perubahan warna seiring dengan perubahan nilai pH. Pada pH tinggi, antosianin cenderung berwarna biru atau tidak berwarna. Kebanyakan antosianin menghasilkan warna pada pH kurang dari 4. Jumlah gugus hidroksi yang dominan menyebabkan warna cenderung biru dan relatif tidak stabil. Adapun jumlah gugus metoksi yang dominan dibandingkan gugus hidroksi pada struktur antosianidin menyebabkan warna cenderung merah dan relatif stabil (DeMan, 1997).
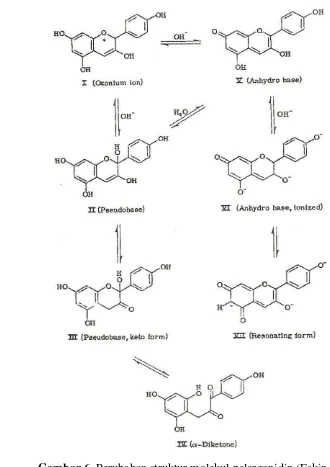
11 menghasilkan warna biru. Perubahan struktur molekul pelargonidin dapat dilihat pada Gambar 8.
Gambar 6. Perubahan struktur molekul pelargonidin (Eskin, 1979)
d. Suhu
12 terbukanya cincin aglikon sehingga terbentuk gugus karbinol dan kalkon yang tidak berwarna (Markakis, 1982)
Markakis (1982) melakukan pemanasan pada sari buah arbei pada suhu 1000C selama satu jam. Proses pemanasan tersebut menyebabkan dekstruksi antosianin hingga 50%. Hal ini menunjukkan waktu paruh antosianin pada suhu 1000C adalah 1 jam.
3. Tepung Ubi Jalar
Pengolahan ubi jalar menjadi tepung merupakan salah satu upaya pengawetan ubi jalar. Selain itu, proses pengolahan ini juga merupakan upaya peningkatan daya guna ubi jalar agar dapat dimanfaatkan sebagai bahan baku industri pangan. Keuntungan lain yang dapat diperoleh dari pengolahan ubi jalar menjadi tepung diantaranya kemudahan dalam pengangkutan dan penyimpanan, dapat diperkaya dengan zat gizi (fortifikasi), serta dapat diolah menjadi beraneka ragam produk makanan (Aini, 2004).
Proses pembuatan tepung ubi jalar diawali dengan proses pencucian dan pengupasan. Kemudian umbi diiris tipis-tipis, diparut atau dibuat pasta, baru kemudian dikeringkan dan ditepungkan (Aini, 2004). Menurut Fellow (2000), pengecilan ukuran bahan dapat meningkatkan laju pengeringan, pemanasan, dan pendingingan serta menyeragamkan ukuran bahan sehingga memudahkan proses penangananya.
Kandungan gula yang tinggi, adanya senyawa fenol, dan enzim polifenolase pada ubi jalar segar menyebabkan reaksi pencoklatan. Untuk mengatasi hal ini perlu dilakukan perlakuan pendahuluan. Perlakuan tersebut dapat berupa blansir atau perendaman sebelum pengeringan dengan mengunakan bahan kimia anti pencoklatan seperti natrium metabisulfit (Kadarisman dan Sulaeman, 1992).
13 air yang akan dikeringkan, energi proses pengeringan, efisiensi mesin pengering, dan kapasitas pengeringan (Suharto, 1991).
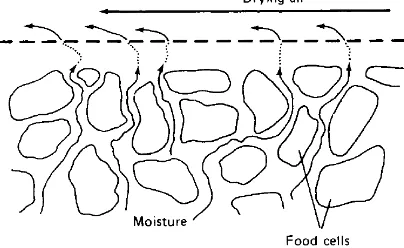
Selama proses pengeringan terjadi proses pindah panas dan pindah massa. Pindah panas disebabkan perbedaan temperatur, sedangkan pindah massa disebabkan perbedaan tekanan atau konsentrasi. Selama proses pengeringan, suhu pengering, kelembaban udara, kecepatan aliran udara sangat mempengaruhi laju pengeringan. Ketika udara panas dihembuskan menuju bahan yang akan dikeringkan, uap air berdifusi melewati lapisan perbatasan antara bahan dan udara dan dibawa oleh aliran udara. Adanya perbedaan tekanan uap air antara bagian dalam bahan dengan udara kering akan mendorong penguapan air dari bahan pangan (Fellows, 2000).
Gambar 7. Pergerakan air dalam bahan pangan selama pengeringan (Fellows, 2000)
14 Terdapat dua cara pengeringan yang biasa digunakan pada bahan pangan yaitu pengeringan secara alami dan pengeringan buatan dengan alat pengering. Pengeringan alami dilakukan dengan menggunakan sinar matahari. Suhu pengeringan dengan menggunakan sinar matahari adalah sekitar 35-45oC (Suharto,1991). Keuntungan pengeringan dengan sinar matahari yaitu biaya yang dibutuhkan lebih murah. Namun proses pengeringan ini memiliki beberapa kelemahan diantaranya sulitnya mengontrol suhu dan kelembaban udara, terjadinya kontaminasi mikroba, dan proses pengeringan dipengaruhi cuaca setempat.
Pengeringan dengan alat pengering buatan dapat memperoleh hasil yang diharapkan jika kondisi pengeringan terkontrol dengan baik. Umumnya pengeringan dengan menggunakan alat pengering berlangsung lebih cepat dibandingkan dengan penjemuran. Jenis bahan yang akan dikeringkan, mutu hasil yang dikeringkan, dan pertimbangan ekonomi mempengaruhi pemilihan alat dan kondisi pengering yang akan digunakan misalnya untuk jenis bahan padatan atau yang berbentuk lempeng maka alat yang sesuai untuk mengeringkan bahan tersebut adalah pengering kabinet atau tray drier.
Pembuatan tepung ubi jalar pada penelitian ini menggunakan metode pengeringan dengan penjemuran dan pengeringan dengan alat pengering cabinet (tray drier). Kedua metode tersebut diaplikasikan karena selain ubi jalar yang akan dikeringkan berupa padatan, kedua metode ini juga dapat diaplikasikan pada skala rumah tangga. Alat pengering kabinet terdiri dari suatu ruangan yang terisolasi untuk mencegah kehilangan panas. Sumber panas yang digunakan bisa berasal dari tenaga listrik atau gas. Alat ini umumnya digunakan untuk potongan buah dan sayuran. Pengeringan akan memakan waktu 5-10 jam atau kurang tergantung dari jenis bahan dan tingkat kadar air yang diinginkan (Suharto, 1991).
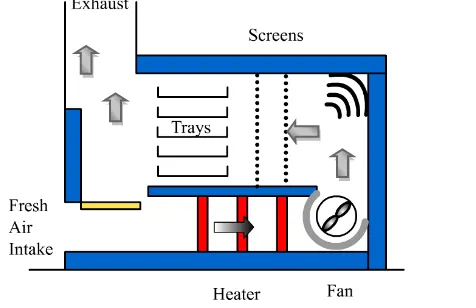
15 seluruh bagian pengering (Fellows, 2000). Adanya perbedaan kandungan air antara bahan dan udara pengering menjadi tenaga pendorong terjadinya pindah massa. Bahan yang akan dikeringkan diletakkan di atas nampan yang berlubang-lubang atau loyang sebagai lapisan yang tipis. Melalui loyang atau nampan tersebut juga terjadi proses pindah panas secara konduksi (Toledo, 1991).
Gambar 8. Skema aliran udara pada tray drier (Singh, 2010) Alat pengering ini tergolong cukup murah dan fleksibel untuk mengeringkan berbagai macam bahan. Namun, pengering ini memiliki beberapa kelemahan diantaranya rendahnya kontrol dan kurang seragamnya produk kering yang dihasilkan. Hal ini disebabkan blower dan elemen pemanas hanya terdapat pada satu sisi pada pengering kabinet. Sehingga bahan yang terdekat dengan eleman pemanas akan menerima panas lebih besar dan lebih cepat kering. Apabila tidak dikontrol dengan baik maka produk yang dihasilkan kurang seragam dan bahkan dapat terjadi kegosongan. Oleh karena itu dibutuhkan pertukaran posisi secara berulang dari masing-masing rak (Fellows, 2000).
Proses pengeringan akan menghasilkan sawut kering ubi jalar. Menurut SNI 01-3751-2006, tingkat kehalusan tepung terigu yang diperkenankan adalah minimal 95% tepung harus lolos ayakan 80 mesh. Oleh karena itu, pada pembuatan tepung ubi jalar dibutuhkan proses penggilingan untuk memperkecil ukuran partikel. Salah satu alat penggiling yang sering digunakan dalam proses pembuatan tepung adalah pin disc mill.
16 biasanya digunakan untuk menghancurkan bahan yang bersifat keras. Gaya pukul merupakan gaya yang paling umum digunakan. Gaya ini dapat digunakan untuk bahan yang kasar, sedang, dan halus. Gaya gesek merupakan gaya yang paling banyak digunakan untuk menghancurkan bahan yang lunak, tidak kasar, dan bahan berukuran kecil (Brennan et al., 1981).
Sifat bahan yang akan digiling dapat menentukan alat penggiling yang digunakan. Bahan yang bersifat keras akan lebih sulit dihancurkan. Bahan ini umumnya membutuhkan energi dan waktu kontak yang lebih besar. Umumnya selama proses penggilingan hanya sebagian kecil energi yang digunakan untuk menghancurkan bahan. Energi yang terbuang berubah menjadi panas yang dapat menyebabkan kerusakan bahan (Brennan et al., 1981).
Brennan et al. (1981) mengungkapkan suatu teori yang menyatakan bahwa energi dE yang dibutuhkan untuk menghasilkan perubahan ukuran dx pada bahan dinyatakan sebagai suatu fungsi energi terhadap ukuran bahan.
d� d� = −
� ��
Keterangan:E = energi yang dibutuhkan selama proses penggilingan (horsepower jam/ton)
x= ukuran bahan (m) a. Hukum Rittinger
Rittinger menyatakan bahwa energi yang dibutuhkan selama proses penggilingan berbanding lurus dengan luas permukaan partikel baru yang terbentuk. Hukum ini memiliki nilai n=2 (Brennan et al., 1981).
17 dinyatakan dalam horsepower jam/ton. K merupakan konstanta Rittinger yang spesifik terhadap jenis bahan dan mesin yang digunakan. Hukum ini banyak digunakan dalam proses pengilinggan bahan halus karena proses penggilingan ini menyebabkan meningkatnya luas permukaan bahan dalam jumlah besar (Brennan et al., 1981).
b. Hukum Kick
Kick mengungkapkan bahwa energi yang dibutuhkan dalam proses penggilingan berbanding lurus dengan rasio penurunan ukuran partikel. Hukum ini menyatakan nilai n sama dengan 1(Brennan et al., 1981).
d�
x1/x2 adalah rasio penurunan ukuran partikel.
Hukum ini lebih baik digunakan dalam proses penggilingan bahan yang bersifat kasar. Hal ini disebabkan sebagian besar energi digunakan untuk mematahkan bahan pada bagian retakan sehingga partikel mengalami deformasi. Menurut hukum ini energi yang dibutuhkan dalam proses penggilingan biasanya lebih rendah dibanding energi menurut hukum Rittinger (Brennan et al., 1981).
c. F.C.Bond- hukum ketiga penggilingan Menurut hukum ini, nilai n sama dengan 3/2
d�
Ketika x1dan x2 diukur menggunakan micrometer dan E dinyatakan
dalam kWh/short ton (907,16 kg), diperoleh � = 5��
Ei atau Bond Work Index merupakan energi yang dibutuhkan untuk
18 laboratorium. Hukum ini dapat diaplikasikan dalam proses penggilingan bahan yang bersifat kasar, sedang, dan halus (Brennan et al., 1981).
Pin disc mill menghancurkan bahan berdasarkan gaya gesek dan gaya tekan. Bahan yang akan dihancurkan dilewatkan diantara cakram dan dinding alat. Jarak antara cakram dan dinding alat dapat disesuaikan dengan hasil produk yang diinginkan (Fellows, 2000). Cakram yang berputar dengan kecepatan tinggi akan menyebabkan gaya gesek serta tumbukan pada dinding alat.
Selain itu adanya tonjolan-tonjolan logam pada cakram dan dinding alat dapat meningkatkan keefektifan proses pengilingan. Hal ini disebabkan adanya gaya gesek dan tekanan tambahan akibat adanya tonjolan-tonjolan logam tersebut (Fellows, 2000). Keunggulan lain dari alat ini adalah adanya saringan dengan ukuran saringan dengan ukuran lubang saring yang dapat disesuaikan dengan kehalusan hasil penepungan. Seluruh tepung akan tersaring melalui saringan ini, sedangkan yang kasar akan tertinggal di bagian atas termasuk jika terdapat kotoran-kotoran.
Pengayakan merupakan proses pemisahan ukuran secara mekanis. Proses ini banyak dilakukan pada industri pangan untuk memisahkan partikel berukuran halus dengan partikel berukuran besar. Selama proses pengayakan bahan diletakkan diatas ayakan dengan ukuran lubang tertentu. Bahan yang mempunyai ukuran lebih kecil dari diameter lubang pengayak akan lolos sedangkan bahan yang mempunyai ukuran lebih besar akan tertahan pada permukaan ayakan (Toledo, 1991).
B.EMULSI
19 pendispersinya adalah minyak. Contoh umum untuk emulsi o/w adalah susu, mayonaise, dan contoh emulsi w/o adalah margarin dan mentega (Boom, 2008).
Menurut Suryani et al., (2002), suatu sistem emulsi mempunyai kecendrungan untuk saling memisah, karena fase pendispersi dan fase terdispersinya merupakan bahan-bahan yang saling tidak melarut karena perbedaan polaritas. Adanya perbedaan polaritas menyebabkan tegangan antar permukaan diantara kedua fase tinggi, akibatnya kedua fase cenderung untuk saling memisah. Sehingga diperlukan emulsifier yang memiliki daya afinitas parsial dan berbeda untuk menyatukan kedua fase tersebut.
Emulsifier merupakan suatu molekul yang kedua sisinya memiliki perbedaan afinitas. Pada bagian yang bersifat hidrofobik akan cenderung larut pada fase lemak sedangkan bagian yang bersifat hidrofilik cenderung larut dalam air (Boom, 2008). Emulsifier juga dapat menurunkan tegangan antar muka dan tegangan permukaan. Turunnya tegangan antar muka ini akan mengurangi daya kohesi dan sebaliknya meningkatkan daya adhesi (Suryani et al., 2002).
Gambar 9. Mekanisme kerja emulsifier (Boom, 2008)
Saat emulsifier terikat pada permukaan, molekul ini akan membentuk lapisan tipis (film) yang akan menyelimuti partikel. Ketika dua droplet mendekat, adanya lapisan film emulsifier pada permukaan droplet akan mencegah partikel tersebut bersatu. Hal ini dapat mencegah terjadinya koalesen (Boom, 2008). Selain itu, penurunan tegangan antar muka oleh emulsifier akan mempermudah pembentukan permukaan interfasial yang sangat luas. Dengan demikian kontak antara fase terdispersi dan fase pendispersi lebih baik dengan adanya emulsifier (Suryani et al., 2002).
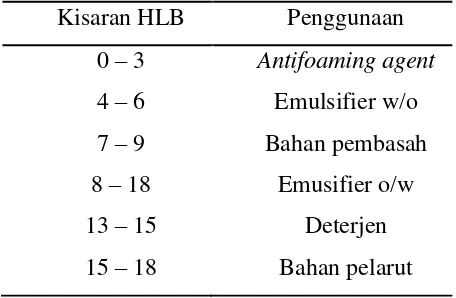
20 (Hydrophile-Lipophile Balance). Nilai HLB adalah rasio antara bagian hidrofilik dan lipofilik yang merupakan bagian dari sistem emulsi. Kisaran nilai HLB adalah 1-20. nilai HLB 10 menunjukkan jumlah yang sama antara bagian hidrofilik dan lipofilik (Whitehurst, 2004).
Tabel 2. Kisaran HLB emulsifier dan penggunaannya (Whitehurst, 2004) Kisaran HLB Penggunaan
Pemilihan emulsifier berdasarkan nilai HLB bertujuan untuk mengurangi sedapat mungkin banyaknya uji coba, yaitu memilih emulsifier yang sesuai kecendrungan melarutnya. Emulsifier yang mempunyai nilai HLB rendah (2-8) cenderung larut dalam minyak, sedangkan yang mempunyai nilai HLB tinggi (14-18) cenderung larut dalam air (Whitehurst, 2004). Kisaran nilai HLB emulsifier dan penggunaannya dapat dilihat pada Tabel 2.
Emulsi spreads yang mempunyai tipe emulsi air dalam minyak membutuhkan emulsifier non-ionik dengan bagian hidrofilik-lipofilik yang proporsional. Salah satu emulsifier yang cocok untuk untuk emulsi tersebut adalah gliserol monostearat. Emulsifier yang termasuk dalam kelompok emulsifier mono-digliserida ini mulai digunakan pada tahun 1930-an untuk memproduksi margarin (Moonen dan Bas, 2004).
21 gugus hidroksil yang bersifat hidrofilik, karenanya GMS dapat bertindak sebagai emulsifier.
C.SPREADS
Spreads merupakan produk berbentuk semi padat, memiliki tekstur lembut, dan viskositas yang cukup rendah sehingga mudah dioleskan ke suatu permukaan bahan makanan lain seperti roti. Kemampuan spreads untuk menyebar saat dioles (spreadable) menjadi karakteristik utama pada produk spreads (Kristanti, 1989).
Tabel 3. Penilaian kemampuan daya oles spreads (Moran, 1994) Nilai Tekanan
luluh (Pa)
Penilaian Panelis <50 Sangat lembut, hampir mengalir 50-100 Sangat lembut, tidak terlalu bisa dioles 100-200 Lembut, spreadable
200-800 Memuaskan, spreadable 800-1000 Keras tapi bisa dioles
1000-1500 Terlalu keras, hampir tidak dapat dioles >1500 Terlalu keras
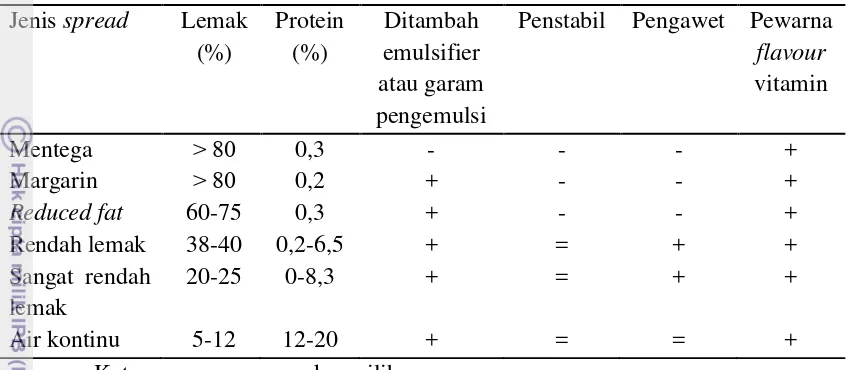
Flack (1997) mendefinisikan spreadable fats sebagai emulsi berbentuk padatan dan memiliki tekstur lunak dengan kandungan lemak antara 10-90%. Produk ini berwujud padatan pada suhu 20oC dan dapat dioles. Chrysam (1996) menyatakan spreads merupakan produk yang mirip dengan margarin tetapi kandungan lemaknya kurang dari 80%. Menurut Moran (1994), Fungsi lemak spreads adalah untuk meningkatkan palatabilitas produk roti dan kue dengan cara meminyaki (lubrication) roti ketika dimakan, sebagai sumber energi, memberikan flavour pangan, mengandung vitamin, sumber asam lemak essensial, berkontribusi pada rasa ketika dimakan, membentuk tekstur produk.
22 droplet fase mengandung air berukuran 2-4 µm (margarin) sampai 4-80 µm (untuk spreads rendah lemak).
Tabel 4. Tipe komposisi spreads (Moran, 1994) Jenis spread Lemak
Keterangan : = merupakan pilihan
Stabilitas emulsi produk spreads dipengaruhi dua mekanisme. Mekanisme pertama yaitu stabilisasi pengikatan dengan cara penyerapan partikel koloidal secara interfasial yang dapat menstabilkan droplet terdispersi. Mekanisme kedua yaitu adanya jaringan kristal lemak yang secara fisik
“mengunci” droplet air tetap di tempatnya, sehingga mencegah droplet
mengalami flokulasi dan koalesen (Rosseau et al., 2003).
23
III. METODOLOGI PENELITIAN
A. BAHAN DAN ALAT
Bahan yang digunakan dalam penelitian ini terbagi menjadi bahan untuk pembuatan tepung, spreads ubi jalar, dan bahan untuk analisis. Bahan untuk pembuatan tepung dan spreads ubi jalar adalah ubi jalar ungu segar, tepung ubi jalar ungu, gula pasir, garam, gliserol monostearat, minyak goreng, dan shortening. Bahan untuk analisis adalah tepung ubi jalar ungu, spreads ubi jalar, spreads coklat komersial, aluminium foil, akuades, buffer potassium klorida pH 1, buffer sodium asetat pH 4,5, larutan HCL, HgO, K2SO4, H2SO4,
larutan NaOH-Na2S2O3, H3BO3, indikator, heksana, metanol, indikator,
aquades, dan kertas saring.
Alat yang digunakan dalam penelitian ini terbagi menjadi tiga yaitu alat untuk pembuatan tepung, spreads ubi ungu, dan alat untuk analisis. Alat yang dibutuhkan untuk pembuatan tepung dan spreads ubi ungu diantaranya pisau, timbangan, steamer, homogenizer, baskom, mixer, ayakan 200 mesh, pin disc mill, tray drier, loyang dan termometer. Sedangkan peralatan untuk analisis meliputi spektrofotometer, sentrifuse, pipet mohr, pipet mikro, pipet tetes, erlenmeyer, gelas, piala, gelas ukur, neraca analitik, bulb, tabung reaksi, tabung reaksi bertutup, labu takar, vorteks, labu soxhlet, tanur, oven vakum, oven, dan pH-meter, chromameter. Selain itu, penelitian ini juga menggunakan Haake Viscometer yang terdiri atas Rotovisco RV20, rheocontroller RC 20, water circulator, sensor sistem M5, rotor SV2, dan komputer.
B.METODE PENELITIAN
Secara umum, penelitian ini terdiri dari dua tahapan yaitu penelitian pendahuluan dan penelitian utama.
1. Penelitian Pendahuluan
24
Gambar 10. Diagram alir pembuatan tepung ubi jalar Pencucian dan pengupasan
Pemotongan (tebal= 1 cm)
Pengukusan (t= 7atau10 menit)
Pengirisan dengan slicer tipe schredder
Pengeringan dengan sinar matahari, 2-3hari
Ubi jalar ungu
Sawut ubi jalar
Pengilingan dengan pin disc mill
Pengayakan 200 mesh
Tepung ubi jalar
25 Diagram alir pembuatan tepung ubi jalar ungu dapat dilihat pada Gambar 10. Tepung ubi ungu yang dihasilkan kemudian diukur intensitas warnanya menggunakan Chromameter Minolta dan kadar antosianinnya dengan metode pH diferensial. Tepung dengan kadar antosianin dan profil warna terbaik kemudian dianalisis proksimat dan digunakan dalam pembuatan spreads ubi ungu.
2. Penelitian Utama
Penelitian utama diawali dengan menentukan formulasi dasar spreads dan kondisi proses pembuatannya. Diagram alir pembuatan spreads dapat dilihat pada Gambar 11. Formula dasar spreads menggunakan GMS sebagai emulsifier pada beberapa konsentrasi agar diperoleh spreads dengan kestabilan emulsi paling optimum
Tabel 5. Formula dasar spreads (Kristanti,1989 dengan modifikasi)
Bahan Komposisi (%)
1 2 3
Gula halus 36,72 36.66 36,60
Air 24,48 24,44 24,40
Shortening 20 20 20
Minyak kelapa sawit 10 10 10
Susu 8 8 8
Garam 0,3 0,3 0,3
GMS 0,5 0,6 0,7
26
Gambar 11. Diagram alir pembuatan spreads (Kristanti, 1989 dengan modifikasi)
Shortening dan minyak goreng
GMS Pemanasan
T =600C
Mixing t=2 menit; T= 60oC
Mixing
t = 5 menit; T= 500C Gula
Mixing
t = 5 menit; T= 500C
Mixing
t = 5 menit; T= 500C
Mixing
t =13 menit; T= 500C
Homogenisasi t =12 menit, T=500C Susu
Garam
Air
Spreads
27
Gambar 12. Diagram alir pembuatan spreads ubi jalar (Kristanti, 1989 dengan modifikasi)
Pemanasan hingga T= 60oC Tepung ubi: air
= 1: 2 Shortening dan
minyak goreng
GMS
Gula
Susu
Garam
Air
Pemanasan T =600C
Mixing
t=2 menit; T= 60oC
Mixing
t = 5 menit; T= 500C
Mixing
t = 5 menit; T= 500C
Mixing
t = 3 menit; T= 500C
Mixing
t =10 menit; T= 500C
Mixing
t = 5 menit; T= 500C
Homogenisasi t =12 menit; T= 500C
Spreads ubi ungu Homogenisasi diselimuti
28 kelapa sawit dan shortening yang digunakan. Formula spreads ubi jalar dapat dilihat pada Tabel 6.
Berdasarkan formulasi tersebut dilakukan pengujian kestabilan emulsi dengan menggunakan sentrifuse, uji organoleptik, pengukuran daya oles dengan menggunakan rotovisco, analisis warna dengan chromameter, dan pengujian kadar antosianin dengan metode pH diferensial. Hasil dari kelima uji tersebut menjadi parameter dalam memilih formula spreads ubi jalar terbaik. Spreads ubi jalar terbaik kemudian dianalisis proksimat. Analisis proksimat terdiri atas analisis kadar air dengan mengunakan oven, analisis protein dengan metode mikro-Kjeldhal, analisis mineral dengan tanur, analisis lemak dengan soxhlet, dan analisis karbohidrat dengan metode by difference.
Tabel 6. Formula spreads ubi jalar (Kristanti,1989 dengan modifikasi)
Bahan Komposisi (%)
1.1.Kadar Air dengan Metode Oven (AOAC, 1995)
29 Pengeringan dilakukan sampai diperoleh bobot konstan. Perhitungan kadar air dilakukan dengan menggunakan rumus:
Kadar air %bb = a− b−c
a × 100% Keterangan :
a = Berat sampel mula-mula (gram)
b= Berat sampel dan cawan setelah dikeringkan (gram) c= Berat cawan kosong kering (gram)
1.2.Kadar Air dengan Metode Oven Vakum (AOAC, 1995)
Sebanyak 1-2 gram spreads ubi ungu dimasukkan ke dalam cawan alumunium yang sebelumnya yang telah dikeringkan dalam oven. Sampel dikeringkan pada oven vakum suhu 700C, 400 mmHg selama semalam kemudian didinginkan dalam desikator lalu ditimbang beratnya sampai mencapai berat konstan. Perbedaan berat sebelum dan sesudah pengeringan dihitung sebagai persen kadar air.
Kadar air %bb = a− b−c
a × 100% Keterangan :
a = Berat sampel mula-mula (gram)
b= Berat sampel dan cawan setelah dikeringkan (gram) c= Berat cawan kosong kering (gram)
1.3.Kadar Abu (AOAC, 1995)
Sampel ditimbang sebanyak 5 g di dalam cawan porselin. Sampel kemudian dipanaskan di dalam tanur 550oC selama 12-18 jam. Sampel kemudian ditimbang untuk menentukan bobot abu. Kadar abu dihitung menggunakan rumus:
Kadar abu % = bobot setelah pengabuan−bobot cawan
bobot awal sampel × 100%
1.4.Kadar Protein dengan Metode Mikro-Kjedhal (AOAC, 1995)
Sejumlah kecil sampel sekitar 0.1 gram ditimbang dan diletakkan ke dalam labu Kjeldhal 30 ml. Kemudian ditambahkan 1,9 gram K2SO4,
30 ditambahkan 0.1 ml H2SO4 untuk setiap 10 mg bahan organik di atas 15
mg. Sampel didihkan selama 1-1.5 jam sampai cairan menjadi jernih. Larutan kemudian dimasukkan ke dalam alat destilasi, dibilas dengan akuades, dan ditambahkan 10 ml larutan NaOH-Na2S2O3. Gas
NH3 yang dihasilkan dari reaksi dalam alat destilasi ditangkap oleh 5 ml
H3BO3 dalam Erlenmeyer yang telah ditambahkan 3 tetes indikator
(campuran 2 bagian merah metil 0.2% dalam alkohol dan 1 bagian methylene blue 0.2% dalam alkohol). Ujung tabung kondensor harus terendam di bawah larutan H3BO3. Kondesat tersebut kemudian dititrasi
dengan HCL 0.02 N yang sudah distandardisasi hingga terjadi perubahan warna kondensat menjadi abu-abu. Penetapan blanko dilakukan dengan menggunakan metode yang sama seperti penetapan sampel. Kadar protein dihitung dengan menggunakan rumus:
%N = Normalitas HCL × VHCl sam pel −VHCl blanko bobot sampel ×
14g N
mol 100%
Protein = %N × 6,25
1.5.Kadar Lemak dengan Metode Soxhlet (AOAC, 1995)
Sebanyak 2-3 gram sampel dibungkus dengan kertas saring lalu dimasukkan ke dalam labu soxhlet. Heksana dituang ke dalam labu lemak dan kemudian alat dirangkai. Refluks dilakukan selama 6 jam. Labu lemak yang berisi lemak hasil ekstraksi dan sisa pelarut heksana diangkat dan kemudian dipanaskan dalam oven pada suhu 1050C sampai pelarut menguap semua. Labu yang berisi lemak didinginkan dalam desikator dan kemudian ditimbang. Kadar lemak dihitung dengan menggunakan rumus:
Kadar lemak % = a−b
c × 100% Keterangan:
a = berat labu dan sampel akhir (g) b = berat labu kosong (g)
31
1.6.Kadar Karbohidrat (AOAC, 1995)
Analisis dilakukan dengan metode by difference yaitu dengan menghitung selisih yang dihasilkan setelah perhitungan kadar air, kadar abu, kadar lemak, dan kadar protein.
Kadar karbohidrat % = 100%−(P + KA + A + L)
Keterangan:
P = kadar protein (%) KA = kadar air (%) A = kadar abu (%) L = kadar lemak (%)
1.7.Total Antosianin (Giusti dan Worlstad, 2001)
Tepung dan spreads ubi ungu yang akan dianalisis kadar antosianinnya diekstrak terlebih dahulu menggunakan campuran larutan 15% HCl 1,5N dan 85% metanol. Sebanyak 1 gram sampel tepung dilarutkan menjadi 20 ml dengan campuran larutan 15% HCl 1,5N metanol. Sedangkan untuk sampel spreads ubi ungu menggunakan 1 gram sampel yang dilarutkan dengan larutan HCL-metanol menjadi 5 ml. Larutan tersebut didiamkan selama 2 jam dalam ruang gelap, kemudian disaring dengan menggunakan kertas saring.
Sebanyak masing-masing 1 ml sampel hasil ekstraksi dimasukkan ke dalam 2 buah tabung reaksi, tabung reaksi pertama ditambah larutan potasium klorida (0,025 M) pH 1 sebanyak 9 ml dan tabung reaksi kedua ditambahkan larutan sodium asetat 0,4 M pH 4,5 sebanyak 9 ml. Pengaturan pH dalam pembuatan potasium klorida dan sodium asetat menggunakan HCl pekat. Absorbansi dari kedua perlakuan pH diukur dengan spektrofotometer pada panjang gelombang 510 nm dan 700 nm setelah didiamkan selama 15 menit.
Nilai absorbansi sampel ekstrak dihitung dengan menggunakan persamaan:
A = [(A510 −A700)pH 1−(A510 −A700)pH 4,5]
Total Antosianin mg CyE 100g =
A × BM × FP
32 Keterangan:
A = Absorbansi
ε = Koefisien absorptivitas (β6,900 L/mol cm)
b = Diameter kuvet (1cm)
BM= Berat molekul sianidin-3-glikosida (449,2 g/mol) FP = Faktor pengenceran
2. Uji Organoleptik (Rahayu, 1998)
Analisis sensori dibagi menjadi dua yaitu uji rating hedonik dan uji rating intensitas. Parameter yang diuji dalam uji rating hedonik adalah adalah warna, rasa, aroma dan daya oles. Panelis yang digunakan berjumlah 30 orang. Panelis diminta untuk menilai produk spreads ubi dengan skala 1 sampai 5 (semakin tinggi skor penilaian, maka produk semakin disukai). Pada uji rating intensitas, spreads ubi yang diuji dioleskan di atas roti tawar dan menggunakan air menggunakan air sebagai penetral. Panelis kemudian memberikan penilaian intensitas daya oles dengan member tanda pada skala garis dengan panjang 15 cm. Pada saat pengujian organoleptik, Data akan
diolah dengan uji ANOVA dengan α=0.05 dan uji lanjut adalah uji Duncan.
3. Analisis Fisik
3.1.Analisis Warna (Hutchings, 1999)
Pengukuran intensitas warna dilakukan dengan menggunakan alat Chromameter CR 200 Minolta dengan sistem notasi warna Hunter (sistem warna L, a, dan b). Nilai L menunjukkan kecerahan, a dan b adalah koordinat-koordinat kromatisitas. Notasi a untuk warna hijau (a negatif) sampai merah (a positif) dan notasi b untuk warna kuning (b positif) sampai biru (b negatif).
Berdasarkan ketiga parameter Lab tersebut digunakan untuk menghitung nilai C* (ketajaman warna) dan nilai hue.
33
3.2.Analisis Stabilitas Krimming (Tangsuphom dan Coupland, 2005 yang dimodifikasi)
Analisis stabilitas kriiming dilakukan pada formula spreads dasar, spreads ubi jalar dan spreads komersil. Sejumlah sampel dimasukkan ke dalam tabung sentrifuse dan diputar pada kecepatan 4000 rpm selama 15 menit. Kemudian minyak yang terpisah diserap dengan menggunakan kertas minyak yang telah ditimbang terlebih dahulu. Kertas minyak tersebut kemudian ditimbang beratnya. Semakin besar nilai yang diperoleh, semakin rendah stabilitas emulsi yang terbentuk. Indeks krimming % = berat minyak yang terpisah (gram)
berat total sampel (gram) × 100%
3.3.Analisis Daya Oles
Pengukuran daya oles diukur dengan alat Haake-Rotovisco RV 20 Rot 2.4.3 dan rotor SV2. Pengukuran dilakukan pada suhu ruang (25oC) selama 5 menit, dikenakan laju geser 0,04-0,2 1/s, dan diukur viskositasnya secara kontinu. Penentuan nilai indeks sifat aliran (n),
indeks konsistensi (K), dan tekanan luluh (τo) dilakukan dengan
membuat plot antara shear rate pada sumbu x dengan shear stress pada sumbu y. Grafik yang diperoleh kemudian dipaskan grafiknya (curve fitting) dengan menggunakan model Herschel-Bulkley. Nilai tekanan luluh diperoleh dari titik potong antara grafik terhadap sumbu y.
Model Herschel-Bulkley: τ = τo+ K γn
34
IV.HASIL DAN PEMBAHASAN
A.PENELITIAN PENDAHULUAN
1. Pembuatan Tepung Ubi Jalar Ungu
Ubi jalar ungu (Ipomoea batatas L.) varietas Ayamurasaki diperoleh dari Desa Cibungbulang, Bogor. Ubi jalar ini memiliki ciri-ciri antara lain memiliki bentuk bulat hingga lonjong, kulit berwarna ungu kemerahan, dan daging umbi berwarna ungu tua. Menurut Widjanarko (2008), ubi jalar ini memiliki kadar air yaitu sekitar 67,77%.
Pembuatan tepung ubi jalar ungu diawali dengan proses pencucian dan pengupasan yang bertujuan untuk menghilangkan kotoran yang melekat pada kulit. Kotoran dan kulit yang terbuang selama kedua proses tersebut adalah sebesar 13,15%. Ubi yang telah dikupas kemudian direndam air untuk menunggu proses selanjutnya. Menurut Ambasari, et al. (2009), proses perendaman bertujuan untuk mencegah terjadinya kontak antara bahan dan udara yang dapat menyebabkan reaksi pencoklatan serta menghilangkan getah yang masih menempel. Ubi kemudian dipotong dengan tebal 1 cm untuk menjamin penetrasi panas yang merata pada bahan. Selanjutnya dilakukan pengukusan selama 7 atau 10 menit yang bertujuan untuk menginaktivasi enzim antosianase. Berdasarkan aktivitasnya enzim antosianase dibagi menjadi dua, yaitu enzim glukosidase dan enzim polifenol oksidase. Enzim glukosidase akan mengkatalisis reaksi hidrolisis ikatan glikosidik senyawa antosianin. Reaksi ini akan menghasilkan gula dan aglikon yang kemudian secara spontan akan terdegradasi membentuk kalkon yang tidak berwarna (Jackman dan Smith, 1996).
35 Menurut Vargas dan Lopez (2003), enzim ini dapat diinaktifasi dengan melakukan iradiasi dengan sinar gamma, pengemasan vakum, penambahan bahan kimia dan pemanasan. Menurut Saigusa (2007) inaktifasi enzim polifenol oksidase ditandai dengan tidak terjadinya proses pencoklatan atau diskolorisasi pada ubi jalar ungu yang telah dikukus terlebih dahulu. Selain itu inaktifasi enzim ini juga dapat ditentukan dari keberadaan enzim peroksidase. Enzim peroksidase merupakan enzim yang paling tahan terhadap panas. Oleh karena itu bila pada enzim peroksidase sudah inaktif maka enzim yang lebih rentan terhadap pemanasan seperti polifenoloksidase, pasti telah terinaktifasi (Fellows, 2000).
Inaktivasi enzim polifenol dengan pemanasan merupakan metode paling sederhana. Akan tetapi proses pemanasan juga dapat menurunkan kandungan antosianin pada ubi ungu. Oleh karena itu, dibutuhkan optimasi proses pengukusan ubi jalar ungu agar dapat menghasilkan tepung dengan warna dan kadar antosianin yang optimum. Pada penelitian ini dilakukan proses pengukusan selama 7 dan 10 menit.Ubi yang telah dikukus kemudian disawut untuk meningkatkan luas permukaan bahan sehingga memudahkan proses pengeringan. Proses pengeringan dilakukan dengan 2 metode, yaitu menggunakan bantuan sinar matahari dan tray drier pada suhu 55-600C. Pengeringan dengan menggunakan tray drier membutuh waktu selama 6-8 jam sedangkan pengeringan dengan bantuan sinar matahari membutuhkan waktu sekitar 2-3 hari.
Sawut ubi jalar yang telah kering ditandai dengan kemudahan sawut saat dipatahkan. Bila pada sawut mudah dipatahkan menunjukkan sawut telah kering. Proses pengeringan dilanjutkan dengan proses penggilingan dengan pin disc mill dan pengayakan dengan ayakan 200 mesh. Tepung ubi jalar yang diperoleh dimasukkan dalam plastik, diseal, dan disimpan pada lemari pendingin.
36 efisiennya alat penggiling yang digunakan, serta adanya sawut ubi jalar yang tertinggal pada mesin slicer selama proses penyawutan sebesar 9,24%. Hal ini dapat diatasi dengan membersihkan ubi yang tertinggal pada slicer dan tetap menggunakannya dalam proses selanjutnya.
Tabel 7. Rekapitulasi komponen hilang selama pembuatan tepung ubi jalar
Tahap Bagian yang hilang Estimasi jumlah (kg)
Pencucian Tanah dan pengotor 0,6478
Pengupasan Kulit 12,4092
Pemotongan Bagian tepi ubi jalar 0,0894
Pengukusan -
Pengirisan Ubi yang tertinggal pada slicer 9,2483
Pengeringan Air 50,2901
Pengilingan Tepung yang terbang dan terakumulasi pada alat
8,1439 Pengayakan Tepung yang terakumulasi pada alat
Tepung yang tidak lolos saringan 200 mesh
0,46 11,7558 * Asumsi pembuatan tepung ubi jalar berdasarkan basis 100 kg
Tanah dan pengotor Kulit Bagian tepi ubi jalar
Gambar 14. Diagram alir neraca massa pembuatan tepung ubi jalar Pencucian Pengupasan Pemotongan
Pengukusan Pengirisan
Pengeringan
Penggilingan
37 Selama proses penggilingan, tepung yang terbuang dan terakumulasi di alat sebesar 8,14%. Selain itu tepung hasil penggilingan yang tidak lolos ayakan 200 mesh adalah sebesar 11,76%. Hal ini menunjukkan performa kerja dari alat pin disc mill menjadi salah satu penyebab utama rendahnya rendemen proses pembuatan tepung ubi jalar.
Gambar 15.Pin disc mill
Rendahnya performa kerja alat pin disc mill dapat disebabkan adanya celah pada pin disc mill sehingga selama proses penggilingan banyak tepung yang terbuang. Selain itu, kurang efisiennya alat penggiling yang digunakan dapat disebabkan energi yang digunakan alat tidak cukup untuk menghasilkan tepung yang halus serta terlalu besarnya jarak antara cakram dan dinding alat. Besarnya jarak antara cakram dan dinding alat menyebabkan adanya bahan yang tidak tergiling dan ukuran partikelnya masih besar.
Rendemen pembuatan tepung ubi jalar dapat ditingkatkan dengan cara mengatur jarak antara cakram dan dinding alat menjadi semakin sempit dan mengganti motor penggerak pada pin disc mill. Penggantian motor bertujuan untuk meningkatkan energi yang dibutuhkan untuk meningkatkan luas permukaan partikel tepung. Semakin besar energi yang dihasilkan oleh alat penggiling, semakin besar gaya gesek dan pukul yang dialami bahan. Hal ini akan menghasilkan tepung yang berukuran lebih kecil.
38 Upaya lain yang dapat dilakukan yaitu dengan menutup celah-celah pada dinding tutup pin disc mill dengan karet. Penggilingan sawut secara berulang dapat meningkatkan waktu kontak antara bahan dan alat sehingga partikel tepung menjadi semakin kecil. Hal ini akan meningkatkan jumlah tepung yang lolos saringan 200 mesh dan meningkatkan rendemen tepung.
(a) (b)
(c) (d)
Gambar 16.Tepung ubi jalar ungu: (a) 7menit matahari, (b) 10menit matahari, (c) 7menit tray drier, (d) 10 menit tray drier
2. Analisis Fisikokimia Tepung Ubi Jalar Ungu 2.1. Total Antosianin