28
HASIL DAN PEMBAHASAN
Cendawan Penyebab Hawar Daun Tanaman Buah Merah
Gejala penyakit hawar daun tanaman buah merah (P. conoideus) di Kabupaten Manokwari banyak dijumpai di beberapa daerah yang banyak terdapat pertanaman tersebut, yaitu Desa Warkapi, Amban dan SP 8. Gejala hawar daun buah merah di lapangan berupa bercak kecil hingga meluas membentuk lingkaran besar tidak teratur, dengan warna coklat muda hingga coklat tua kehitaman dan bagian tepinya dikelilingi “halo” berwarna kuning (Gambar 5). Agrios (2005) menyatakan bahwa gejala hawar terjadi pada daun, cabang, ranting dan bunga yang menjadi coklat dengan sangat cepat serta menyeluruh dan menyebabkan kematian jaringan.
Gambar 5 Gejala hawar pada daun buah merah di lapangan.
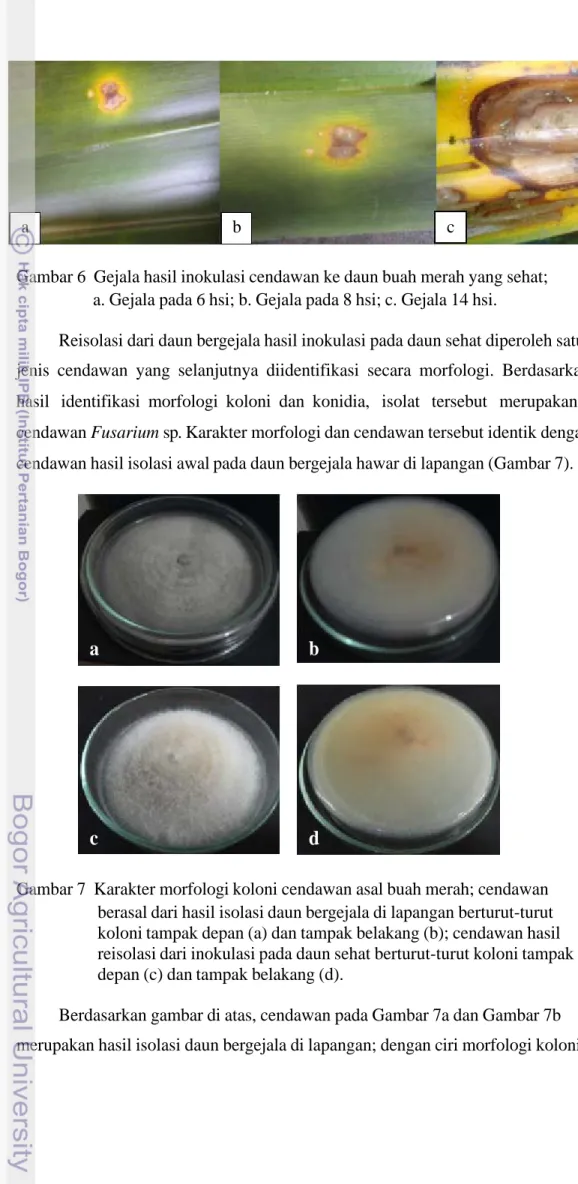
Berdasarkan hasil isolasi cendawan dari daun bergejala, diperoleh 22 jenis cendawan yang berasosiasi dengan gejala hawar. Cendawan – cendawan tersebut sebagian memiliki pertumbuhan koloni yang mirip dengan Fusarium dan sebagian lagi merupakan kapang kelabu, yaitu cendawan dengan miselia yang berwarna gelap. Hasil inokulasi isolat M2 (Madrad) pada tanaman sehat, diperoleh gejala hawar yang identik dengan gejala awal di lapangan (Gambar 6) yaitu terbentuk bercak yang berwarna berwarna coklat dan dikelilingi oleh “halo” berwarna kuning. Gejala tersebut muncul pada 6 hari setelah inokulasi (hsi) dan kemudian semakin meluas.
29
a b c
Gambar 6 Gejala hasil inokulasi cendawan ke daun buah merah yang sehat; a. Gejala pada 6 hsi; b. Gejala pada 8 hsi; c. Gejala 14 hsi.
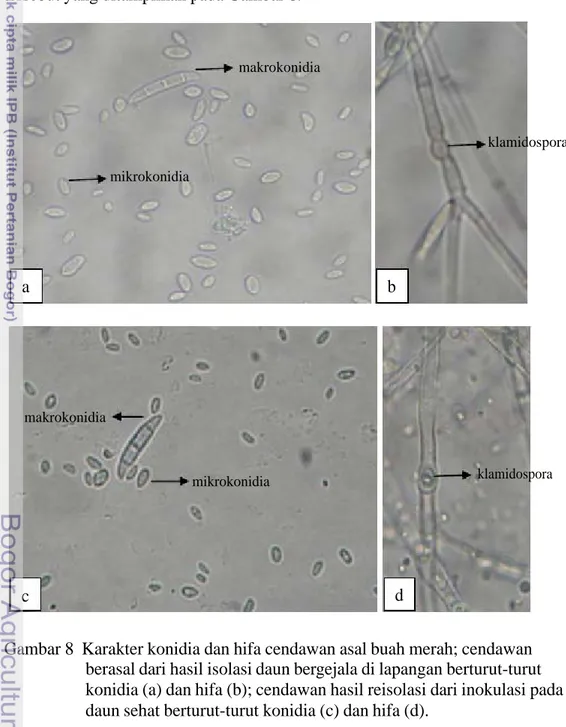
Reisolasi dari daun bergejala hasil inokulasi pada daun sehat diperoleh satu jenis cendawan yang selanjutnya diidentifikasi secara morfologi. Berdasarkan hasil identifikasi morfologi koloni dan konidia, isolat tersebut merupakan cendawan Fusarium sp. Karakter morfologi dan cendawan tersebut identik dengan cendawan hasil isolasi awal pada daun bergejala hawar di lapangan (Gambar 7).
a
b
c
d
Gambar 7 Karakter morfologi koloni cendawan asal buah merah; cendawan berasal dari hasil isolasi daun bergejala di lapangan berturut-turut koloni tampak depan (a) dan tampak belakang (b); cendawan hasil reisolasi dari inokulasi pada daun sehat berturut-turut koloni tampak depan (c) dan tampak belakang (d).
Berdasarkan gambar di atas, cendawan pada Gambar 7a dan Gambar 7b merupakan hasil isolasi daun bergejala di lapangan; dengan ciri morfologi koloni
30
depan berwarna putih, koloni belakang berwarna putih dan kuning muda, berbentuk : miselia tidak teratur dengan aerial timbul. Selanjutnya cendawan pada Gambar 7c dan Gambar 7d merupakan cendawan yang diperoleh dari daun bergejala hasil inokulasi ke daun sehat. Cendawan ini memiliki koloni depan yang berwarna putih, koloni belakang berwarna putih dan kuning muda, berbentuk tidak teratur dan miselianya agak timbul. Setelah diamati morfologi koloni, selanjutnya diamati konidia dan hifa yang dihasilkan oleh kedua cendawan tersebut yang ditampilkan pada Gambar 8.
makrokonidia klamidospora mikrokonidia a makrokonidia c mikrokonidia b d klamidospora
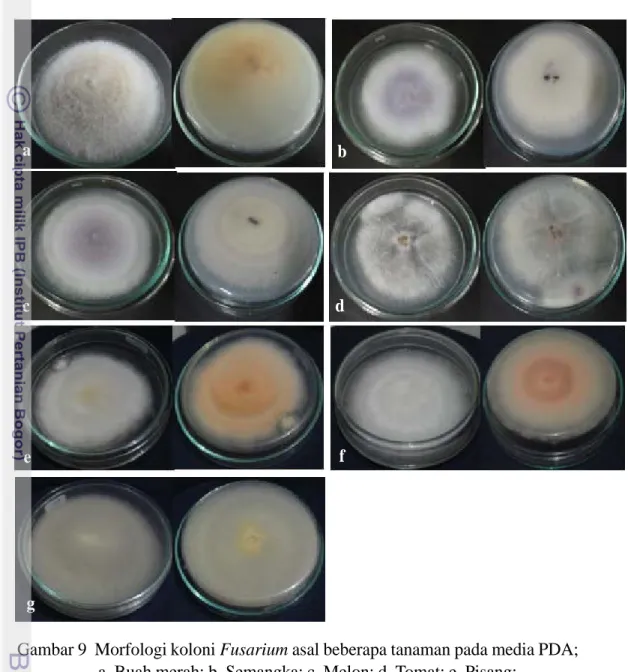
Gambar 8 Karakter konidia dan hifa cendawan asal buah merah; cendawan berasal dari hasil isolasi daun bergejala di lapangan berturut-turut konidia (a) dan hifa (b); cendawan hasil reisolasi dari inokulasi pada daun sehat berturut-turut konidia (c) dan hifa (d).
31
Berdasarkan gambar diatas, karakter mikroskopis cendawan pada Gambar 8a adalah makrokonidia berbentuk seperti kano (canoe) atau perahu, dengan ujung meramping dan sel basal membengkok, berwarna hialin, bersekat 3 dan bersel 4. Mikrokonidia berbentuk ovoid, berwarna hialin, ada yang bersekat dan ada yang belum membentuk sekat. Pada hifa terdapat sekat dan berwarna hialin serta klamidospora berbentuk semi bulat (Gambar 8b). Cendawan hasil reisolasi memiliki makrokonidia yang berbentuk seperti kano dengan ujung meramping, sel basal membengkok dan bersel 4 serta bersekat 3 (Gambar 8c); hifa berwarna hialin serta bersekat dan klamidospora berbentuk semi bulat (Gambar 8d). Dalam hasil penelitian, kecepatan pertumbuhan koloni Fusarium cukup lambat yaitu pada hari ke 12 memenuhi cawan petri.
Cendawan hasil isolasi, inokulasi dan reisolasi diidentifikasi dengan kunci identifikasi Watanabe (2002) dan Barnett & Hunter (1999), diperoleh cendawan penyebab hawar daun pada buah merah adalah Fusarium sp. Hal ini diperkuat oleh (Barnett & Hunter 1999), yang menyatakan bahwa Fusarium memiliki konidiofor yang bervariasi, ramping dan sederhana, gemuk, pendek, bercabang tidak teratur atau menghubungkan fialid, tunggal atau berkelompok membentuk sporodokia. Sporodokia ini membentuk makrokonidia dan mikrokonidia. Bentuk makrokonidia melengkung panjang dengan ujung mengecil dan mempunyai sekat antara lebih dari 1, terdiri dari beberapa sel, berbentuk perahu; sedangkan mikrokonidium bentuknya pendek, tidak bersekat atau bersekat satu, bersel satu, ovoid dan tunggal bujur atau ramping membengkok. Fusarium dapat sebagai parasit tanaman tingkat tinggi atau saprofit pada sisa-sisa tanaman.
Secara umum, koloni Fusarium berwarna putih, dengan merah muda sampai violet dengan tepian berwarna putih, atau kuning muda pada media dengan miselia yang umumnya seperti kapas, berbentuk bundar, dengan elevasi datar (Barnett & Hunter 1999). Klasifikasi Fusarium menurut Barnett & Hunter (1999) yaitu termasuk dalam sub divisi Fungi, kelas Deuteromycetes, bangsa Moniliales, famili Tuberculariaceae dan genus Fusarium.
Lahan pertanaman buah merah di Kabupaten Manokwari sebagian besar merupakan hak ulayat masyarakat lokal yang belum dibudidayakan secara baik. Di daerah Amban, buah merah ditanam di lahan kebun percobaan, dimana umur
32
tanaman mencapai ± 10 tahun. Tajuk dan percabangan saling menutup, tanaman relatif tinggi dan tidak dipupuk, sehingga pertumbuhannya kurang bagus. Lokasi lahan juga jarang dibersihkan, sehingga tampak lembab. Di daerah Warkapi dan Madrad, tanaman tumbuh di hutan di antara pepohonan lain, dengan jarak yang tidak teratur. Tanaman tidak terpelihara, umur relatif tua, sekeliling tanaman jarang dibersihkan dan sebagian besar tumbuh di tepi air sehingga lokasi lahan menjadi lembab. Di daerah SP 8 tidak dijumpai gejala hawar. Tanaman ditanam dengan jarak yang teratur, umur tanaman masih lebih muda yaitu 5 tahun, tajuk tidak saling menutupi dan lokasi lahan lebih terbuka, memperoleh cahaya matahari yang cukup.
Faktor-faktor yang mempengaruhi perkembangan Fusarium sp. penyebab hawar daun di lahan pertanaman buah merah antara lain adalah kelembaban lahan yang cukup tinggi, lahan yang tidak dibersihkan, tajuk yang tidak dipangkas sehingga menghalangi masuknya cahaya, tanaman yang umurnya sudah tua serta bahan perbanyakan tanaman yang telah terinfeksi. Ketika lahan tidak dibersihkan dengan teratur dan keadaannya lembab dapat memacu perkembangan patogen dengan cepat. Didukung juga dengan adanya aliran air disekeliling pertanaman yang dapat menyebarkan spora patogen; demikian juga bantuan angin yang menyebarkan spora melalui tajuk yang saling menutupi. Selain itu juga diduga lahan pertanaman yang sebelumnya telah terinfeksi patogen, menyebabkan tanah lahan pertanaman telah terinfestasi Fusarium dan bertahan dalam tanah tersebut. Hal ini didukung oleh pernyataan Ching (2008) yang berpendapat bahwa penyakit akibat Fusarium akan cepat berkembang jika kondisi lingkungan mendukung, dengan kondisi lahan pertanaman yang lembab. Penelitian Damicon & Manning (1985) dalam Nelson (2001) menyebutkan bahwa ketika tanah difumigasi dan ditanami dengan asparagus, setahun kemudian tanaman tersebut 100% diinfeksi oleh F. oxysporum.
Mekanisme Fusarium dalam menginfeksi tanaman yaitu mengeluarkan toksin seperti asam dehidrofusarik, likomarasmin, asam fusarik dan enzim pektinase yang akan mengubah struktur sel tanaman dan permeabilitasnya (Mendgen et al. 1996). Umumnya patogen ini mengawali infeksinya dari akar, karena merupakan patogen tular tanah (soilborne). Tetapi selanjutnya dapat
33
menyebar dalam beberapa cara, yaitu percikan dan aliran air, angin, bibit terinfeksi, pemindahan bibit, tanah terinfestasi, permukaan air drainase, pembubunan, luka karena serangga, alat pertanian, dan lain-lain (Nelson 2001). Faktor-faktor tersebut dapat membantu sebaran Fusarium sebagai patogen tular tanah mencapai organ tanaman selain akar (seperti daun, buah, bunga) serta mencapai daerah lain yang lebih jauh. Mekanisme infeksi Fusarium dalam menyebabkan hawar daun adalah spora jatuh ke sel tanaman (inokulasi) melalui perantara angin, masuk ke lubang alami, yaitu hidatoda di daun, kemudian berkembang biak dan hifanya akan mengkolonisasi jaringan daun. Jaringan akan dipenuhi oleh massa spora patogen; spora ini akan berkecambah dan menyumbat sistem jaringan, sehingga menimbulkan hawar dengan munculnya warna coklat kekuningan pada daun.
Penyakit terbanyak yang dihasilkan oleh patogen ini adalah penyakit layu
Fusarium yang menyerang akar dan menimbulkan kerugian yang cukup besar;
dapat menyebabkan busuk biji jagung dan damping off pada pesemaian kapas (Elsalam et al. 2003). Gejala hawar yang disebabkan oleh Fusarium masih sedikit dijumpai. Tetapi beberapa spesies Fusarium dapat menyebabkan hawar daun atau bercak daun pada rumput dan hawar pada biji gandum (Goldberg 2006 dan Zhuping 1994).
Karakter Morfologi Fusarium Asal Beberapa Tanaman
Isolat Fusarium sp. asal buah merah dibandingkan dengan 6 isolat Fusarium asal tomat, semangka, melon, pisang, nangka dan pepaya untuk mengetahui keragamannya. Tujuh jenis isolat dari tanaman yang berbeda ini memiliki perbedaan secara morfologi, mikroskopis dan molekuler. Untuk morfologi warna koloni ditampilkan pada Gambar 9. Isolat Fusarium asal melon merupakan
a
penyebab penyakit layu pada melon, isolat Fusarium asal semangka menyebabkan layu pada semangka, isolat Fusarium asal tomat merupakan penyebab penyakit layu pada tomat, Fusarium asal pisang menyebabkan busuk buah pisang,
Fusarium asal nangka menyebabkan busuk buah nangka serta isolat asal pepaya
yang diduga Fusarium menyebabkan busuk pada buah pepaya. Isolat asal melon, semangka dan tomat merupakan koleksi dari Laboratorium Klinik Tanaman dan
34
Laboratorium Mikologi Departemen Proteksi Tanaman IPB; sedangkan isolat asal pisang, nangka dan pepaya merupakan isolat yang diisolasi langsung dari tanaman sakit. a b c d e f D g
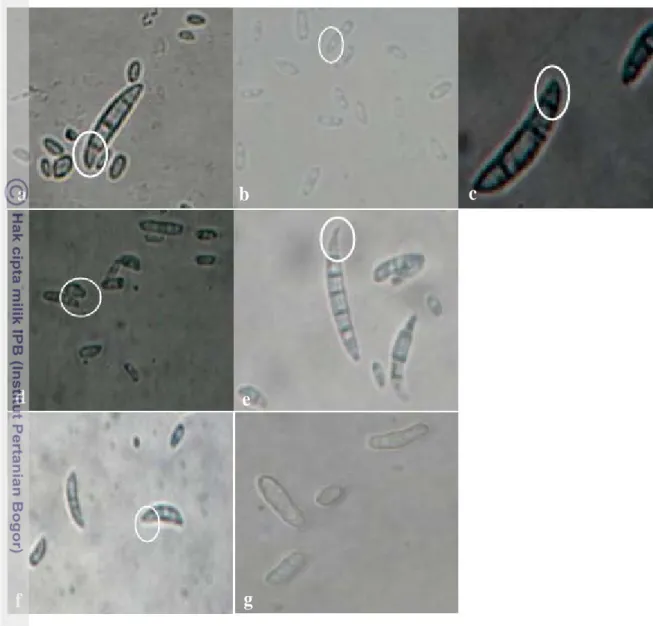
Gambar 9 Morfologi koloni Fusarium asal beberapa tanaman pada media PDA; a. Buah merah; b. Semangka; c. Melon; d. Tomat; e. Pisang;
f. Nangka; g. Pepaya; dari permukaan atas cawan petri (kiri); dari permukaan bawah cawan petri (kanan).
Koloni isolat buah merah berwarna putih, koloni belakang berwarna kuning muda kecoklatan, berbentuk tidak teratur seperti kerang, miselia cembung, tepian berserabut serta pertumbuhan koloni di dalam cawan petri adalah 12 hsi (Gambar 9a). Isolat asal semangka memiliki warna koloni putih dan bagian tengah berwarna ungu, koloni belakang berwarna putih keruh, berbentuk tidak teratur.
35
Miselia berciri aerial datar, tepian koloni berserabut. Pertumbuhan koloni di dalam cawan petri adalah 15 hsi (Gambar 9b). Isolat asal melon berwarna putih dan bagian tengah koloni berwarna ungu; koloni belakang berwarna putih keruh, miselia agak cembung, tepian berserabut, pertumbuhan koloni mencapai 15 hsi pada cawan petri; koloni yang tua akan berbentuk konsentris (Gambar 9c). Pada isolat tomat, warna koloni putih, koloni belakang berwarna putih keunguan, berbentuk tidak teratur, miselia datar dan tipis, dengan tepian berserabut serta pertumbuhan koloni 12 hsi pada cawan petri (Gambar 9d).
Selanjutnya isolat asal pisang berwarna putih salem (peach), koloni belakang berwarna krem salem; berbentuk tidak teratur, aerial datar dan agak tebal, tepian berserabut, pertumbuhan di cawan petri mencapai 12 hsi (Gambar 9e). Koloni yang dimiliki isolat nangka berwarna putih dan koloni belakang berwarna krem salem, berbentuk tidak teratur, miselia agak tebal, tepian berserabut dengan pertumbuhan di cawan petri mencapai 14 hsi (Gambar 9f). Isolat pepaya memiliki koloni berwarna kuning pucat dengan tepian putih keruh. Koloni belakang berwarna kuning muda dengan tepian transparan; berbentuk tidak teratur, aerial cembung dan lebat, tepian berserabut, pertumbuhan di cawan petri mencapai 6 hsi (Gambar 9g).
Secara morfologi koloni, isolat asal buah merah memiliki warna yang berbeda dengan isolat yang lain. Dari segi tipe miselia, isolat asal buah merah memiliki tipe miselia yang relatif tidak berbeda dengan isolat asal semangka, melon, tomat, pisang, nangka, yaitu agak cembung tetapi tidak lebat dan berbentuk seperti serabut. Isolat asal buah merah dan lainnya berbeda dengan isolat asal pepaya karena memiliki tipe miselia seperti rambut yang lebat dan cepat memenuhi cawan petri. Selanjutnya, setelah dilakukan perbandingan secara morfologi koloni, beberapa isolat Fusarium dari beberapa tanaman ini selanjutnya dibandingkan secara mikroskopis dengan melihat bentuk makrokonidia dan mikrokonidia (Gambar 10).
36
a
b
c
d
f
e
g
Gambar 10 Konidia Fusarium asal beberapa tanaman; a. Buah merah;
b. Semangka; c. Melon; d. Tomat; e. Pisang; f. Nangka; g. Pepaya; perbedaan pada ujung sel basal konidia (tanda lingkaran);
pengamatan dilakukan secara mikroskopis dengan perbesaran 1000x.
Konidia Fusarium asal buah merah ditunjukkan pada Gambar 10a, dengan makrokonidia berbentuk seperti kano, ujung meramping, sel basal membengkok, memiliki 3 sekat dengan 4 sel dan berwarna hialin. Mikrokonidia berbentuk ovoid dan bersekat 1 dan ada yang belum bersekat, berwarna hialin. Makrokonidia isolat asal semangka berbentuk seperti kano, ujung meramping dan meruncing, sel basal membengkok, memiliki 1-4 sekat dan hialin. Mikrokonidia berbentuk ovoid dan hialin (Gambar 10b). Isolat asal melon memiliki makrokonidia yang berbentuk seperti kano, ujung meruncing dan sel basal melengkung, bersekat 3-6
37
dan hialin. Mikrokonidia berbentuk ovoid, ujung melengkung bersekat 1-2 dan hialin (Gambar 10c).
Berikutnya, makrokonidia yang dihasilkan isolat tomat berbentuk seperti kano, ujung meruncing, sel basal membengkok, bersekat 1-3 dan hialin. Mikrokonidia berbentuk ovoid dan hialin (Gambar 10d). Isolat asal pisang memiliki makrokonidia berbentuk seperti kano, ujung meruncing, sel basal menipis dan melengkung bersekat 3-6 dan hialin. Mikrokonidia yang dihasilkan berbentuk ovoid, bersekat 1-2 dan hialin (Gambar 10e). Isolat asal nangka menghasilkan makrokonidia yang berbentuk seperti kano, ujung meruncing, sel basal menipis dan melengkung bersekat 1-4 dan hialin. Menghasilkan mikrokonidia yang berbentuk ovoid dan hialin (Gambar 10f). Isolat asal pepaya memiliki makrokonidia berbentuk ovoid, ujung menumpul, tidak bersekat dan hialin. Mikrokonidia yang dihasikan berbentuk semi bulat, tidak bersekat dan hialin (Gambar 10g). Secara keseluruhan, makrokonidia yang dihasilkan
Fusarium asal buah merah relatif tidak berbeda dengan isolat dari semangka,
melon dan tomat, yaitu makrokonidia berbentuk seperti kano dengan sel basal sedikit membengkok. Isolat asal buah merah berbeda dengan isolat asal pisang dan nangka; walaupun berbentuk seperti kano, tetapi sel basal makrokonidia yang dihasilkan isolat asal pisang dan nangka berbentuk melengkung dan menipis. Isolat buah merah dan isolat lainnya berbeda dengan isolat asal pepaya, dimana konidia yang dihasilkan tidak bersekat dan tidak berbentuk seperti kano.
Setelah dilakukan pengamatan pada morfologi koloni dan konidia beberapa
Fusarium diamati lagi pertumbuhan koloni masing-masing isolat ketika
ditumbuhkan pada media PDA. Pertumbuhan koloni isolat tersebut dapat dilihat pada gambar 12.
U kur ankol o ni (c m ) 38 10 9 8 7 6 5 4 3 2 1 Buah Merah Pisang Pepaya Nangka Semangka Melon Tomat 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
Pertumbuhan pada hari ke
-Gambar 11 Pertumbuhan koloni Fusarium asal beberapa tanaman.
Dari segi kecepatan pertumbuhan koloni, isolat buah merah memiliki pertumbuhan yang relatif sama dengan isolat semangka, melon, tomat, pisang dan nangka, yaitu pertumbuhan yang mencapai 12 – 15 hari. Isolat buah merah berbeda dengan isolat asal pepaya dimana pertumbuhan koloninya sangat cepat dibandingkan dengan isolat lain, yaitu 6 hari telah memenuhi cawan petri (Gambar 11). Dengan morfologi dan pertumbuhan koloni seperti itu, diduga isolat asal pepaya ini bukan merupakan Fusarium.
Pada dasarnya, perbedaan bentuk dari konidia adalah ciri umum untuk mengidentifikasi banyak spesies Fusarium, karena ciri tersebut berbeda antar spesies, dari segi panjang dan lebar konida, jumlah sekat, jumlah sel serta bentuk konidia yang seperti perahu atau bulan sabit tetapi sangat bervariasi antar spesies (Watanabe 2002). Konsep umum dari Fusarium pertama kali dianalisis dari adanya konidia berbentuk perahu (kano) atau pisang atau bulan sabit yang nampak pada semua genus; memiliki sedikit perbedaan yang membedakan antar spesies.
39
Karakter Molekuler Fusarium Asal Beberapa Tanaman
Karakterisasi molekuler dilakukan dengan teknik PCR dan sequencing menggunakan primer spesifik untuk genus Fusarium, yaitu ITS Fu-f dan
ITS-Fu-r (Elsalam et al. 2003). Karakterisasi molekuler dilakukan untuk
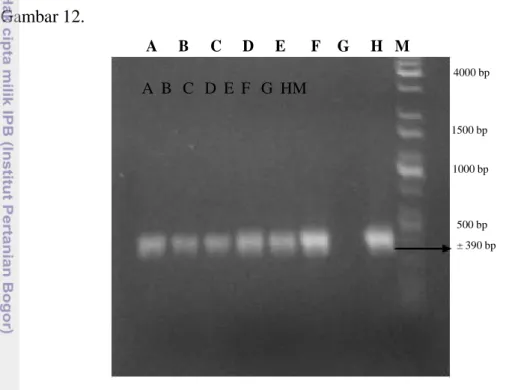
mengidentifikasi cendawan Fusarium penyebab hawar daun buah merah pada tingkat spesies, serta mendukung data morfologi dan mikroskopis yang telah diperoleh. Hasil amplifikasi DNA melalui elektroforesis ditampilkan pada Gambar 12. A B C D E F G H M 4000 bp A B C D E F G HM 1500 bp 1000 bp 500 bp ± 390 bp
Gambar 12 Amplifikasi gen 28S rDNA menggunakan primer ITS Fu-f dan Fu-r; A. Fusarium Buah Merah; B. Fusarium Buah Merah; C. Fusarium Semangka; D. Fusarium Melon; E. Fusarium Pisang; F. Fusarium Nangka; G. Fusarium Pepaya; H. Fusarium Tomat; G. Marker.
Berdasarkan hasil elektroforesis hasil PCR pada Gambar 12, terlihat bahwa isolat asal buah merah merupakan genus Fusarium karena terdapat pita DNA saat amplifikasi; demikian juga isolat semangka, melon, nangka, pisang dan tomat. Ukuran DNA yang teramplifikasi adalah ± 390 bp; hal ini sesuai dengan penelitian Elsalam et al. (2003), yang menggunakan primer yang sama dan menghasilkan pita DNA dari Fusarium dengan ukuran 398 bp. Isolat asal pepaya (G) bukan merupakan Fusarium karena tidak terdapat pita DNA seteleh amplifikasi. Dengan demikian, melalui PCR dan sequencing, hasil yang diperoleh
40
dalam uji molekuler mempertegas hasil sebelumnya yaitu morfologi dan mikroskpois bahwa isolat asal buah merah merupakan Fusarium.
Primer ITS Fu-f dan Fu-r yang digunakan didesain dari oligonukleotida pada daerah sekuen ITS (Internal Transcribed Spacer) mengandung data sekuen atau gen 18S subunit kecil (SSU), 5,8S dan 28S subunit besar (LSU) (Elsalam et
al. 2003). Daerah ini memiliki variasi sekuens yang tinggi antar spesies;
memberikan kegunaan bagi primer yang dihasilkan untuk deteksi spesies yang spesifik pada cendawan patogen jaringan tanaman yang telah terinfeksi secara alami; serta membedakan kedekatan hubungan spesies cendawan (Bryan et al. 1995; Elsalam et al. 2003). Primer ini mengamplifikasi daerah target spesifik antara ITS1 dan ITS2 yang mengandung 5,8S rRNA pada Fusarium. Munculnya pita DNA pada ukuran tertentu menandakan adanya amplifikasi fragmen spesifik DNA target sesuai dengan primer yang digunakan. Gen RNA ribosom (rDNA) memiliki karakter yang cocok untuk deteksi patogen pada tingkat spesies, karena rDNA ini sangat stabil, menunjukkan daerah yang conserve dan bermacam-macam di dalam genom (Hibbert et al. 1995).
Setelah diperoleh hasil elektroforesis PCR, dilanjutkan dengan sequencing untuk memperoleh padanan sekuen 28S rDNA dengan DNA database atau
genbank melalui program BLAST (Basic Local Alignment Search Tool) NCBI
(http//:www.ncbi.nlm.nih.org). Untuk hasil padanan sekuen tersebut dapat dilihat pada Tabel 1.
Tabel 1 Padanan sekuen 28S rDNA dengan DNA database menggunakan program BLAST NCBI
Hasil Penelitian Hasil Padanan dengan DNA Database
Asal Isolat Ukuran
(bp)
No Aksesi Kerabat Dekat Nilai
similaritas (%) Buah Merah Semangka Melon Pisang Nangka Tomat 397 393 393 393 393 391 HQ148102 EU588397 FR852562 FR872726 FR872728 FR851229 F. oxysporum F. oxysporum F. oxysporum F. equisetii F. equisetii F. oxysporum 100 99 99 99 99 98
41
Berdasarkan hasil padanan sekuen 28S rDNA dengan DNA database yang diketahui isolat Fusarium dari buah merah adalah Fusarium oxysporum. Isolat asal buah merah memiliki nilai homologi 100% dengan F. oxysporum yang diisolasi dari tanaman Echinacea purpurea dari nomor aksesi HQ148102. Selanjutnya isolat asal semangka memiliki nilai homologi 99% dengan F.
oxysporum yang diisolasi dari tanaman semangka dengan nomor aksesi
EU588397. Isolat asal melon memiliki nilai homologi 99% dengan F. oxysporum yang diisolasi dari tanaman melon dengan nomor aksesi FR852562. Isolat asal tomat memiliki nilai homologi 98% dengan F. oxysporum yang diisolasi dari tanaman tomat dengan nomor aksesi FR851229. Isolat asal pisang memiliki nilai homologi 99% dengan F. equisetii yang diisolasi dari tanaman tomat dengan nomor aksesi FR872726. Isolat asal nangka memiliki nilai homologi 99% dengan
F. equisetii yang diisolasi dari tanaman pepaya dengan nomor aksesi FR872728.
Koloni F. oxysporum umumnya berwarna merah muda sampai biru violet atau putih dan kuning dengan bagian tengah koloni berwarna lebih gelap dibandingkan dengan bagian tepi. Saat konidia terbentuk, tekstur koloni menjadi seperti wol atau kapas (Fran & Cook, 1998). Memiliki konidiofor hialin, sederhana, pendek atau tidak terdifensiasi dari hifa, terhubung dengan massa spora di ujung. Konidia hialin, terdiri dari dengan 2 jenis yaitu : makrokonidia berbentuk perahu lonjong yang agak ramping pada ujung sel, dan sel basal yang bengkok, dengan 4 sel; mikrokonidia elips dengan 1 sel. Klamidospora coklat, berbentuk semi bulat. Panjang makrokonidia 17,5- 29.1–45 µm dan diameter 2.9– 4.7 µm. Panjang mikrokonidia 6–15.8 µm dan diameter 1.9–3.7-5 µm. Klamidospora berdiameter 5.3-10.2–15 µm (Watanabe 2002). F. oxysporum memiliki 54 lebih forma spesialis yang telah diketahui dan dipublikasi.
Dari morfologi koloni yang diperoleh dalam penelitian, Fusarium asal buah merah memiliki morfologi koloni yang relatif tidak berbeda dengan deskripsi seperti di atas, yaitu koloni berwarna putih dan kuning. Tetapi hasil ini belum dapat menentukan nama spesies tersebut, karena belum dilakukan uji lanjut terhadap pengamatan konidiogen serta pengukuran konidia yang dapat mendukung penentuan nama spesies Fusarium tersebut. Meskipun pada hasil padanan sequencing DNA melalui program BLAST seperti pada Tabel 1 di atas
42
diperoleh hasil bahwa isolat asal buah merah merupakan F. oxysporum, namun hal ini belum bisa dijadikan dasar karena bisa terjadi hasil amplifikasi DNA tidak
ter-sequencing seluruhnya. Untuk memperoleh hasil yang lebih akurat, perlu
dilakukan pengujian terhadap ciri mikroskopis Fusarium secara lengkap, seperti konidia, klamidospora serta konidiogen serta ukuran panjang dan lebarnya.
Berdasarkan data sekuens yang dicocokkan dengan data dari genbank, menunjukkan adanya isolat yang spesiesnya sama, yaitu F. oxysporum dan F.
equisetii. Untuk mengetahui seberapa besar hubungan kekerabatan antar isolat
tersebut dilakukan uji filogenetik melalui program PAUP 4.0 (Gambar 14).
Fusarium asal buah merah
61
64
100
Fusarium asal melon Fusarium asal semangka Fusarium asal nangka Fusarium asal pisang Fusarium asal tomat
Gambar 13 Pohon filogenetik yang menggambarkan hubungan kekerabatan antar isolat Fusarium asal beberapa tanaman pada gen 28S rDNA yang dibuat dengan analisis Bootstrap Neighbor-joining program PAUP4.0.
Berdasarkan gambar diatas, dapat terlihat bahwa isolat Fusarium asal buah merah diduga merupakan cendawan primitif dan sangat berbeda dibandingkan dengan isolat yang lain. Isolat tersebut diduga memiliki kedekatan dengan isolat asal semangka, melon, tomat; sedangkan dibandingkan dengan isolat pisang dan nangka berkerabat jauh. Hasil penelitian menunjukkan isolat Fusarium penyebab hawar daun tanaman buah merah berbeda spesies dengan isolat Fusarium pada inang lain. Perbedaan ini dapat diamati pada morfologi koloni, konidia yang dihasilkan serta data sekuens yang diperoleh dari uji molekuler. Hal ini menunjukkan bahwa meskipun genus dan bahkan spesiesnya sama, tetapi jika memiliki kisaran inang yang berbeda, maka isolat tersebut berbeda pula. Ini didukung pula dengan data sekuens dari masing-masing isolat yang diperoleh
43
melalui uji sequencing (Lampiran 5). Perlu dilakukan karakterisasi secara lebih lengkap dan terinci bagi Fusarium penyebab hawar daun buah merah, agar dapat diketahui spesiesnya secara tepat dan dapat diketahui perbandingannya dengan
Fusarium asal tanaman lain.
Berdasarkan beberapa hasil penelitian, cendawan dari genus Fusarium banyak menjadi patogen tanaman, antara lain F. oxysporum f.sp niveum penyebab layu semangka, F. oxysporum f.sp lycopersici penyebab layu tomat, F. oxysporum f.sp cubense penyebab layu pisang dan sebagainya (Nelson 2001). Fusarium merupakan kelompok cendawan terbesar sebagai patogen tanaman. Cendawan ini memiliki kisaran inang yang luas dan banyak menginfeksi tanaman. Satu spesies
Fusarium mampu menginfeksi beberapa tanaman atau satu tanaman bisa diinfeksi
oleh beberapa spesies Fusarium. Contohnya, F. oxysporum dan F. equisetii memiliki keragaman yang sangat tinggi dalam morfologi kultur dan karakterisik fisiologi. Keragaman ini memungkinkan spesies tersebut berbeda (beragam) satu dengan lainnya karena perbedaan ekologi tempat, struktur genetik serta populasi yang berubah.
Berkaitan dengan hal tersebut diatas, maka perlu dilakukan perbandingan beberapa isolat Fusarium asal beberapa tanaman sehingga diketahui isolat tersebut sama atau berbeda. Kemungkinan Fusarium yang berasal dari melon, semangka dan tomat itu adalah cendawan yang sama dengan cendawan yang menginfeksi tanaman buah merah. Begitu juga sebaliknya, bisa terjadi Fusarium yang menginfeksi melon merupakan isolat yang berbeda dengan Fusarium yang menginfeksi buah merah, semangka dan tomat. Jika Fusarium asal melon, semangka dan tomat sama persis atau memiliki kekerabatan yang dekat dengan
Fusarium asal buah merah, maka isolat tersebut dapat menginfeksi tanaman buah
merah.
Analisis sequencing pada dasarnya mengarah pada identifikasi isolat cendawan yang mencerminkan hubungan filogeni, berdasarkan data sekuen rDNA dari gen yang sama tetapi berbeda spesies. Leslie et al. (2001) menjelaskan filogenetik dalam cendawan merupakan cara untuk membedakan spesies yang satu dengan yang lain menjadi sub kelompok yang lebih kecil dalam filogenetik. Dalam aplikasinya, banyak studi filogenetik cendawan menggunakan sekuen
44
DNA dari satu atau dua lokus dari isolat yang telah terkarakterisasi dengam baik. Sebagai contoh di dalam filogeni Fusarium, dilakukan berdasarkan sekuen ITS antara 2 sekuen Fusarium (Harrington & Potter 1997).
Karakter morfologi seperti warna koloni dan bentuk konidia saat ini yang
umum digunakan untuk membedakan spesies Fusarium karena praktis
diaplikasikan (Nelson et al. 2001). Walaupun bentuk makrokonidia sering memberikan deskripsi spesies yang baik, tetapi perbedaan bentuk dan ukuran makrokonidia dapat membingungkan, subjektif dan bergantung pada lingkungan makrokonidia dihasilkan (Leslie et al. 2001). Para ahli saat sekarang ini lebih
cenderung menggunakan sistem genetik dan molekuler sebagai dasar
mengidentifikasi spesies Fusarium dan mendeskripsikan takson baru. Sistem tersebut dianggap lebih akurat, lebih luas tersedia dalam aplikasinya dan kekerabatan dapat diperluas serta penentuan suatu spesies dan batas-batasnya lebih jelas. Akan tetapi karakter morfologi juga tetap digunakan, yang karakternya akan melengkapi dengan karakter yang diperoleh melalui teknik molekuler.
Kelimpahan Bakteri pada Rizosfer Tanaman Buah Merah
Pada pertanaman buah merah di Kabupaten Manokwari, yaitu di Desa Madrad, Warkapi, SP 8, dan Amban diperoleh jumlah koloni bakteri rizosfer yang berbeda antar satu daerah dengan yang lainnya. Bakteri rizosfer dari tiap daerah dihitung jumlah koloninya yang ditampilkan melalui diagram pada Gambar 14. Bakteri yang diisolasi dan dihitung adalah dari kelompok fluorescence, kelompok tahan panas dan kelompok kitinolitik.
Jum la hk ol o ni (L o gc fu/ gt ana h) 45 12 10 8 6 4 Kelompok Fluorescence Kelompok Tahan panas Kelompok Kitinolitik 2
0
Warkapi Madrad Amban SP 8
Lahan pengambilan sampel
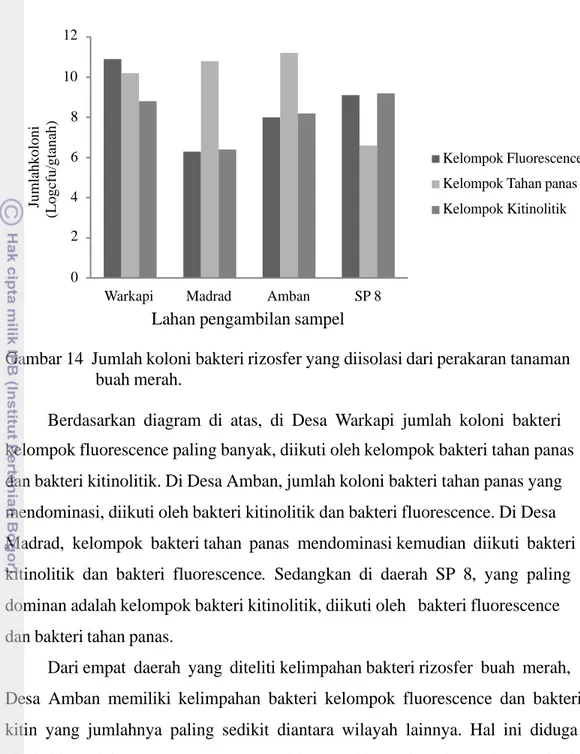
Gambar 14 Jumlah koloni bakteri rizosfer yang diisolasi dari perakaran tanaman buah merah.
Berdasarkan diagram di atas, di Desa Warkapi jumlah koloni bakteri kelompok fluorescence paling banyak, diikuti oleh kelompok bakteri tahan panas dan bakteri kitinolitik. Di Desa Amban, jumlah koloni bakteri tahan panas yang mendominasi, diikuti oleh bakteri kitinolitik dan bakteri fluorescence. Di Desa Madrad, kelompok bakteri tahan panas mendominasi kemudian diikuti bakteri kitinolitik dan bakteri fluorescence. Sedangkan di daerah SP 8, yang paling dominan adalah kelompok bakteri kitinolitik, diikuti oleh bakteri fluorescence dan bakteri tahan panas.
Dari empat daerah yang diteliti kelimpahan bakteri rizosfer buah merah, Desa Amban memiliki kelimpahan bakteri kelompok fluorescence dan bakteri kitin yang jumlahnya paling sedikit diantara wilayah lainnya. Hal ini diduga disebabkan oleh umur tanaman yang sudah tua, sehingga kepadatan akarnya tidak terlalu bagus dan kandungan organik pada rizosfer menurun, sehingga kelimpahan bakteri juga berkurang. Dugaan lain yaitu terjadi persaingan antar mikroba tanah, sehingga salah satu kelompok bakteri tidak mampu memperbanyak dirinya. Secara keseluruhan, bakteri rizosfer yang jumlahnya paling banyak terdapat di Desa Warkapi, diikuti oleh jumlah bakteri di Desa Madrad, SP 8 dan Amban. Di Desa Warkapi, pertanaman buah merah terdapat di hutan di antara pepohonan lain, dan belum ada campur tangan manusia secara intensif dalam hal pengolahan tanah. Tanah di daerah Warkapi merupakan tanah dengan tipe aluvial dan
46
memiliki genangan air yang cukup dalam dari endapan sungai. Di Desa Madrad, pertanaman buah merah berada di hutan dan berdampingan dengan tanaman lain yang juga dimanfaatkan masyarakat lokal. Diduga karena belum ada campur tangan manusia yang besar dalam budidayanya, sehingga jumlah bakteri rizosfer pada daerah ini masih cukup banyak. Tipe tanah di Desa Madrad adalah latosol dan kering. Pada Desa SP 8 dan Amban, jumlah koloni bakteri lebih sedikit; hal ini diduga karena adanya campur tangan manusia yang menyebabkan perubahan ekosistem dari rizosfer tersebut. Tipe tanah di Desa SP 8 adalah aluvial dan kering, sedangkan di Desa Amban adalah latosol dan kering. Pada ke dua desa
tersebut, lahan pertanaman buah merah merupakan lahan yang telah
dibudidayakan oleh masyarakat dan diduga tidak dilakukan pengolahan tanah yang baik sebelum penanaman. Heywood (1995) menyatakan bahwa perubahan atau perusakan ekosistem pada daerah rizosfer akan menyebabkan spesies mikroba pecah atau musnah.
Kelimpahan bakteri di daerah rizosfer sangat beragam dan antara satu wilayah dengan wilayah lainnya berbeda – beda (Lynch 1990). Adanya eksudat akar dan didukung dengan lingkungan di dalam tanah, akan mempengaruhi pertumbuhan dan interaksi organisme, khususnya mikroba tanah dengan tanaman dan tanah (Soesanto 2008). Bakteri di daerah rizosfer umumnya bersifat menguntungkan dan lebih banyak yang berperan sebagai agen hayati (Bustaman 2006). Keberlangsungan hidupnya juga lebih stabil dibandingkan dengan bakteri yang hidup di daerah filoplan. Hal ini disebabkan karena daerah rizosfer memiliki eksudat akar yang menjadi sumber nutrisi bagi organisme tanah, khususnya bakteri sehingga dapat berkembang dan mempertahankan diri pada daerah rizosfer. Menurut Campbell & Reece (2005), rizosfer merupakan daerah yang ideal bagi tumbuh dan berkembangnya mikroba tanah, termasuk agensia pengendali hayati. Bakteri rizosfer paling banyak dimanfaatkan karena kemampuannya dalam mendukung pertumbuhan tanaman serta menghambat patogen tanaman.
Komunitas lingkungan biotik dan abiotik di dalam tanah saling berpengaruh terhadap keberadaan mikroorganisme tanah, khususnya bakteri. Faktor tersebut berpengaruh sangat besar terhadap mikroba antagonis di dalam
Juml ah jeni sba kter i 47
tanah (Soesanto 2008). Makin banyak dan padat akar suatu tanaman di dalam tanah, makin kaya kandungan organik pada rizosfer sehingga makin padat pula populasi mikroba tanah, termasuk agen hayati. Loon et al. (1998) mengatakan bahwa bakteri merupakan salah satu kelompok mikroorganisme yang relatif mudah dikembangkan sehingga menjadi cepat melimpah jika dikembangkan dari biosfernya. Oleh karena itu dengan mengetahui kelimpahan dan keragaman bakteri potensial tersebut dapat berprospek dalam usaha pengendalian hayati penyakit tanaman. Bakteri rizosfer yang berpotensi sebagai agens biokontrol yang adalah dari Pseudomonads kelompok fluorescence dan nonfluorescence, bakteri tahan panas yang meliputi Bacillus, Clostridium, selanjutnya bakteri penghasil siderofor dan bakteri pendegradasi kitin (Baker & Cook 1974).
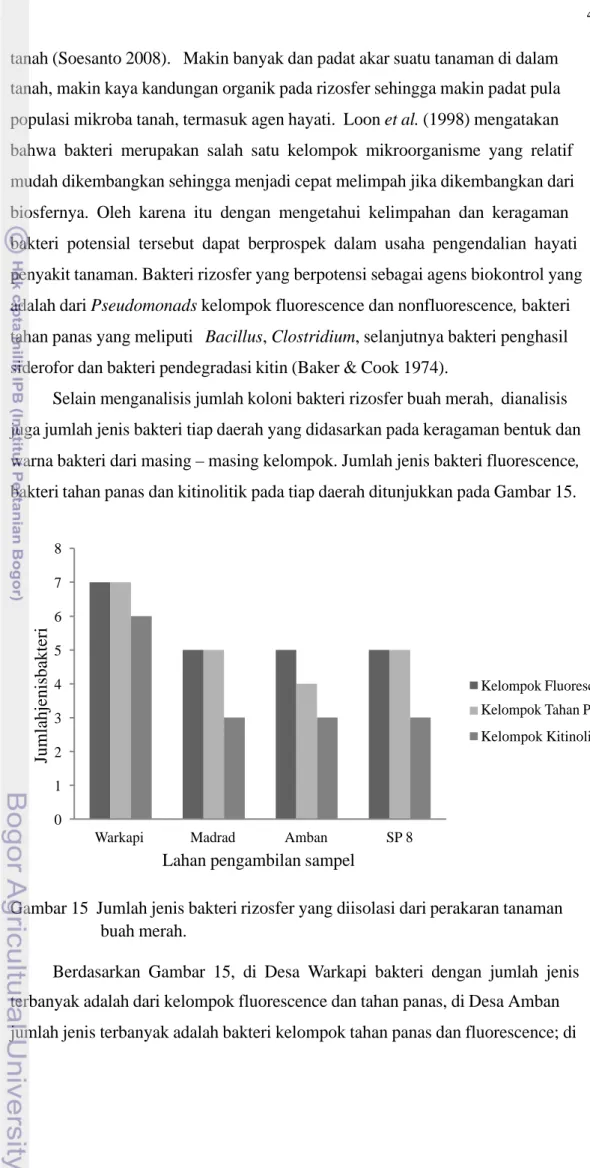
Selain menganalisis jumlah koloni bakteri rizosfer buah merah, dianalisis juga jumlah jenis bakteri tiap daerah yang didasarkan pada keragaman bentuk dan warna bakteri dari masing – masing kelompok. Jumlah jenis bakteri fluorescence, bakteri tahan panas dan kitinolitik pada tiap daerah ditunjukkan pada Gambar 15.
8 7 6 5 4 3 Kelompok Fluorescence Kelompok Tahan Panas Kelompok Kitinolitik 2
1 0
Warkapi Madrad Amban SP 8
Lahan pengambilan sampel
Gambar 15 Jumlah jenis bakteri rizosfer yang diisolasi dari perakaran tanaman buah merah.
Berdasarkan Gambar 15, di Desa Warkapi bakteri dengan jumlah jenis terbanyak adalah dari kelompok fluorescence dan tahan panas, di Desa Amban jumlah jenis terbanyak adalah bakteri kelompok tahan panas dan fluorescence; di
48
Desa Madrad, kelompok fluorescence paling banyak jumlah jenisnya; sedangkan di daerah SP 8, yang jumlah jenisnya mendominasi adalah kelompok fluorescence dan bakteri tahan panas. Bakteri kitinolitik pada empat daerah tersebut paling kecil jumlah jenisnya. Secara keseluruhan, jumlah jenis bakteri yang paling banyak keragamannya terdapat di Desa Warkapi, kemudian diikuti oleh Desa Madrad, SP 8 dan Amban. Coleman et al. (2004) menyatakan bahwa tiap –tiap
tanah karena perbedaan fisiko-kimianya, memiliki kekhasan penghuni
mikrobanya. Pada 1 g tanah bisa tercipta habitat unik yang dapat dihuni oleh beragam mikroba.
Dari hasil isolasi bakteri rizosfer buah merah pada empat daerah diperoleh 58 isolat, dengan rincian, kelompok bakteri fluorescence diperoleh 22 isolat, bakteri tahan panas diperoleh 21 isolat dan bakteri kitinolitik diperoleh 15 isolat. Perbedaan jumlah jenis bakteri pada tiap daerah mengarah pada perbedaan populasi satu jenis bakteri, yang disebabkan oleh keadaan tanah dan tanaman yang mempengaruhi rizosfer. Degens et al. (2000) menyatakan bahwa perubahan penggunaan lahan dapat mempengaruhi populasi dan komunitas mikroba dalam tanah.
Karakterisasi Isolat Bakteri Rizosfer
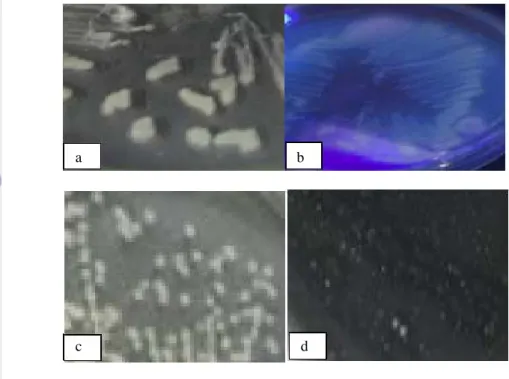
Berdasarkan hasil isolasi bakteri rizosfer, diperoleh 58 isolat bakteri yang termasuk dalam tiga kelompok bakteri, yaitu fluorescence, bakteri tahan panas dan bakteri kitinolitik. Isolat tersebut dikarakterisasi berdasarkan ciri morfologi dan fisiologi berdasarkan Schaad et al.(2001). Karakterisasi isolat bakteri yang mewakili berdasarkan morfologi koloni ditampilkan pada Gambar 16.
49
a b
c d
Gambar 16 Morfologi koloni bakteri rizosfer buah merah; a dan b. Bakteri kelompok fluorescence; b. Bakteri kelompok tahan panas; c. Bakteri kelompok kitinolitik.
Morfologi koloni dari masing masing kelompok memiliki warna dan bentuk yang relatif tidak berbeda. Bakteri kelompok fluorescence ditunjukkan pada Gambar 16a dan Gambar 16b, dimana bakteri ini memiliki koloni berwarna krem kekuningan, berbentuk bulat, elevasi timbul, tepian tidak beraturan dan sebagian besar dari bakteri ini menghasilkan perpendaran berwarna violet jika diamati dibawah sinar UV (Lampiran 2); tetapi ada isolat yang tidak menghasilkan perpendaran tersebut yaitu isolat FW1 dan FM3. Bakteri tahan panas memiliki koloni berwarna krem, berbentuk bundar, elevasi timbul dan tepian licin (Gambar 16c). Bakteri kitinolitik menghasilkan zona bening yang ukurannya bervariasi; koloni berwarna putih serta ada yang membentuk struktur seperti rantai (Gambar 16d). Secara keseluruhan deskripsi morfologi koloni dapat dilihat pada Lampiran 2, Lampiran 3 dan Lampiran 4.
Setelah diamati ciri morfologi koloni bakteri rizosfer buah merah, selanjutnya diamati ciri fisiologis bakteri tersebut berdasarkan uji Gram, uji hipersensitif serta uji endospora. Ciri fisiologi bakteri ditampilkan pada Tabel 2.
50
Tabel 2 Karakter fisiologi bakteri rizosfer yang diisolasi dari perakaran tanaman buah merah
Jenis Bakteri Uji Gram Uji Hipersensitif/HR Uji Endospora
Kelompok Tahan Panas Kelompok Fluorescence Kelompok Kitinolitik Gram positif/negatif Gram negatif/positif Gram positif/negatif Negatif Negatif/Positif Negatif Ada endospora/ tidak ada endospora
Tidak ada endospora
Tidak ada endospora
Dalam uji fisiologis, karakter yang diperoleh dari masing-masing kelompok bakteri berbeda-beda antar isolat. Secara umum dan sebagian besar menghasilkan karakter seperti pada Tabel 2 diatas; tetapi terdapat beberapa perbedaan antar isolat. Untuk bakteri kelompok tahan panas, yang merupakan Gram positif adalah isolat TA2, TA3, TA4, TA5, TW1, TW2, TW3, TW5, TW6, TW7, TM1, TM2, TM4, TSp1, TSp2, TSp3 dan TSp5; sedangkan isolat TA1, TW4, TM3 dan TSp4 merupakan Gram negatif. Untuk uji HR seluruh isolat bakteri tahan panas menghasilkan reaksi negatif. Selanjutnya isolat TA3, TA4, TA5, TW5, TW6, TW7, TM1, TM3, TM4, TSp1, TSp3, TSp4 dan TSp5 menghasilkan endospora; sedangkan isolat yang lainnya tidak menghasilkan endospora.
Untuk bakteri kelompok fluorescence yang termasuk bakteri Gram negatif adalah isolat FA1, FA2, FA3, FA4, FA5, FW1, FW2, FW3, FW4, FW5, FW6, FW7, FM1, FM2, FM3, FM4, FSp1, FSp3, FSp4 dan FSp5; sedangkan isolat FSp2 dan FM5 merupakan Gram positif. Untuk uji HR sebagian besar isolat menghasilkan reaksi negatif; tetapi isolat FW5, FM5 dan FSp1 menimbulkan respon hipersensitif pada tembakau. Untuk bakteri kelompok kitinolitik, isolat yang termasuk bakteri Gram positif adalah isolat KA1, KA2, KA3, KW1, KW2, KW3, KW5, KW6, KM1, KM2, KM3, KSp1, KSp2 dan KSp3; sedangkan isolat KW4 merupakan bakteri Gram negatif. Seluruh isolat bakteri kelompok ini tidak menimbulkan reaksi hipersensitif. Secara keseluruhan karakter fisiologi bakteri dapat dilihat pada Lampiran 2, Lampiran 3 dan Lampiran 4.
51
Deteksi Keberadaan Endospora
Endospora dihasilkan oleh bakteri dari kelompok tahan panas. Hasil isolasi bakteri rizosfer buah merah pada kelompok tahan panas, terdapat beberapa isolat yang menghasilkan endospora. Struktur endospora bakteri yang diperoleh ditunjukkan pada Gambar 17.
Gambar 17 Endospora bakteri tahan panas yang diisolasi dari perakaran tanaman buah merah.
Hasil penelitian menunjukkan struktur yang berwarna merah muda merupakan sel vegetatif, sedangkan struktur yang berwarna biru merupakan endospora (Gambar 17). Tipe endospora yang dihasilkan dalam penelitian adalah tipe sentral. Spora tipe sentral adalah spora yang terbentuk di tengah - tengah sel vegetatif (Nicholson 2002). Dari 21 isolat bakteri yang berhasil diisolasi dari rizosfer buah merah menggunakan media spesifik tahan panas, yaitu media TSA, terdapat 13 isolat yang menghasilkan endospora yaitu isolat TA3, TA4, TA5, TW5, TW6, TW7, TM1, TM3, TM4, TSp1, TSp3, TSp4, TSp5; sedangkan isolat TA1, TA2, TW1, TW2, TW3, TW4, TM2, TSp2 tidak menghasilkan endospora. Ini berarti tidak semua bakteri yang diisolasi merupakan kelompok bakteri penghasil endospora.
Bakteri tahan panas memiliki struktur sel vegetatif dan endospora (Errington 2003). Bakteri rizosfer yang menghasilkan endospora yaitu dari kelompok bakteri gram positif seperti Bacillus dan Clostridium. Spora yang dihasilkan merupakan struktur untuk bertahan hidup dalam waktu yang lama dan dalam kondisi lingkungan yang tidak menguntungkan seperti suhu yang tinggi (mencapai 100
52
ºC), kekeringan, senyawa kimia beracun, radiasi UV, radiasi ionisasi, dan enzim hidrolitik. Spora yang dihasilkan bakteri ini tidak berfungsi sebagai struktur reproduksi seperti cendawan, melainkan hanya sebagai struktur bertahan hidup.
Bacillus sp. merupakan salah satu bakteri rizosfer penghasil endospora yang
berpotensi sebagai agens biokontrol serta meningkatkan pertumbuhan tanaman tertentu.
Dalam lingkungan yang menguntungkan, spora bergerminasi menjadi sel vegetatif dan bila lingkungan tidak menguntungkan sel vegetatif berubah menjadi spora. Sel vegetatif memiliki mRNA dan di dalam sel ini terjadi aktivitas enzimatik, metabolisme (pengambilan O2) dan sintesis makromolekul. Sedangkan
pada endospora tidak terjadi aktivitas tersebut dan tidak memiliki mRNA. Setiap kali endospora terbentuk, sel vegetatif bakteri terhenti dan fase “tidur/dorman” dimulai dalam waktu yang panjang, sekitar 2,3 juta tahun (Errington 2003). Proses pembentukan spora (sporulasi) berlangsung selama 15 jam (Nicholson 2002).
Uji Hipersensitif pada Tembakau
Salah satu syarat utama bakteri untuk dijadikan sebagai agens biokontrol adalah tidak menimbulkan pengaruh negatif atau fitotoksisitas. Hal ini dapat diuji dengan uji hipersensitif yang merupakan reaksi yang ditemukan pada tanaman indikator dan tanaman bukan inang. Uji hipersensitif menggunakan bakteri rizosfer buah merah dan daun tanaman tembakau ditampilkan pada Gambar 18.
a b c Nekrosis
Gambar 18 Uji hipersensitif pada tembakau; a. Kontrol; b. Hipersensitif negatif; c. Hipersensitif positif.
Berdasarkan gambar diatas, semua isolat bakteri rizosfer yang menghasilkan reaksi hipersensitif positif berarti bersifat patogenik sehingga tidak dapat
53
digunakan sebagai agens biokontrol. Isolat yang bukan patogen tidak akan memberikan bercak nekrosis walaupun suspensi bakteri telah dimasukkan pada sel atau jaringan daun tembakau (Gambar 18b). Reaksi hipersensitif positif ditunjukkan dengan kematian cepat, kekeringan dan nekrosis kecoklatan pada jaringan daun tembakau setelah 24 jam (Gambar 18c). Isolat yang bereaksi positif dalam uji hipersensitif pada kelompok fluorescence adalah dari isolat FW5, FM5, FSp1; sedangkan isolat yang negatif hipersensitif adalah FA1, FA2, FA3, FA4, FA5, FW1, FW2, FW3, FW4, FW6, FW7, FM1, FM2, FM3, FM4, FSp2, FSp3, FSp4, FSp5. Untuk kelompok bakteri tahan panas dan bakteri kitinolitik, semua isolat bersifat negatif dalam uji hipersensitif (Lampiran 2, Lampiran 3 dan Lampiran 4). Bakteri yang bereaksi negatif dalam uji ini dapat diuji lanjut sebagai kandidat agens pengendali hayati. Hal ini dirujuk pada Soesanto (2008), yang mengatakan bahwa salah satu ciri mikroba pengendali hayati adalah diharapkan tidak menjadi kontaminan bagi organisme tak-sasaran, baik tanaman atau mikroba berguna bukan sasaran.
Isolat yang mempunyai respon hipersensitif positif diduga karena isolatnya merupakan galur virulen sehingga tanaman menghasilkan senyawa antimikroba. Ketidakcocokan antara tanaman dan bakteri patogen menyebabkan tanaman memiliki reaksi pertahanan, sehingga tanaman bisa menangkal serangan patogen dan patogen tidak dapat berkembang. Menurut Campbell & Reece (2005), setelah sel-sel pada tempat infeksi mengeluarkan senyawa kimia pertahanannya dan menutup daerah infeksi, sel-sel tersebut merusakkan dirinya sendiri sehingga terbentuk lesio atau luka pada daerah yang terinfeksi yang akan bertahan hidup dan pertahanannya akan membantu melindungi bagian tumbuhan yang lain. Respon hipersensitif menurut Klement et al. (1990) diartikan sebagai reaksi pertahanan yang cepat dari tanaman menghadapi patogen yang disertai kematian sel yang cepat atau nekrosis jaringan di daerah yang diinjeksi dengan suspensi bakteri. Gejala hipersensitif menyebabkan kematian sel yang sangat cepat yang membentuk satu kesatuan sebagai penghalang berkembangnya patogen ke sel inang yang lain dan akumulasi komponen zat fenolik berwarna cokelat sebagai hasil oksidasi. Uji ini menggunakan daun tanaman tembakau karena merupakan tanaman model yang telah diketahui sekuen gennya secara lengkap termasuk gen
54
yang mengkode resisitensi tanaman, selain itu juga ruang antar pembuluh daun lebar sehingga mudah untuk menginjeksikan suspensi isolat.
Uji Antibiosis
Uji antibiosis untuk mengetahui potensi bakteri rizosfer buah merah dalam menghambat Fusarium sp. penyebab hawar daun tanaman buah merah dilakukan dengan metode dual culture. Perhitungan daya hambat bakteri rizosfer terhadap
Fusarium sp. ditampilkan pada Tabel 3, Tabel 4 dan Tabel 5 dari masing-masing
kelompok bakteri fluorescence, bakteri tahan panas dan bakteri kitinolitik. Nilai persentase daya hambat tiap isolat digunakan untuk melihat kemampuan bakteri rizosfer buah merah yang terisolasi sebagai kandidat agens pengendali hayati
Fusarium sp. penyebab hawar daun. Perlakuan, pengukuran daya antibiosis serta
analisis statistik dilakukan terhadap masing-masing kelompok bakteri.
Tabel 3 Persentase daya hambat bakteri rizosfer kelompok fluorescence terhadap
Fusarium sp. penyebab hawar daun buah merah secara in vitro
Isolat 1) DayaHambat (%) 2) Isolat 1) Daya Hambat (%)2)
FW1 FW2 FW3 FW4 FW5 FW6 FW7 FM1 FM2 FM3 FM4 FM5 -14,37 bcde 3) -20,22 bcdefg -19,50 bcdef -5,64 bc -1,55 b -4,20 bc -3,64 b 26,39 cdefgh -10,50 bc -13,41 bcd -15,16 bcde -34,60 defgh FA1 FA2 FA3 FA4 FA5 FSp1 FSp2 FSp3 FSp4 FSp5 Kontrol -40,81 fgh -41,72 gh -11,89 bc -16,93 bcde -16,93 bcde -36,16 efgh -39,00 fgh 27,31 a -43,81 h -38,64 fgh 0,00 b
1). W = Warkapi, M = Madrad, A= Amban Pantai, Sp = SP 8
2). Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan hasil yang tidak berbeda nyata (uji selang ganda Duncan 5%
D ia m et er kol oni F us ar iu m sp.( cm ) F W1 F W2 F W3 F W4 F W5 F W6 F W7 F M1 F M2 F M3 F M4 F M5 FA1 FA2 FA3 FA4 FA5 FSp 1 FSp 2 FSp 3 FSp 4 FSp 5 K o nt rol 55
Pada Tabel 3, isolat FSp3 menghasilkan persentase daya hambat terbesar dibanding dengan isolat lain. Isolat FSp3 berbeda nyata dengan 21 isolat yang lain beserta dengan kontrol. Isolat ini menghasilkan hambatan tertinggi yang jauh diatas kontrol, yaitu sebesar 27,313. Hal ini menunjukkan bahwa isolat tersebut memiliki kemampuan menghambat Fusarium sp. Zona bening yang dibentuk oleh isolat ini mengakibatkan media tidak dapat ditumbuhi oleh cendawan. Untuk mengetahui perkembangan hifa cendawan dalam uji ini dapat dilihat dalam Gambar 19.
Tanda negatif pada Tabel 3 diatas menunjukkan miselia Fusarium sp. yang diberi perlakuan bakteri rizosfer makin berkembang. Hal ini berarti bahwa semua isolat bakteri rizosfer dari kelompok fluorescence (kecuali isolat FSp3) tidak mampu menghambat perkembangan miselia Fusarium sp., sehingga tidak dapat digunakan sebagai kandidat agens pengendali hayati patogen tanaman.
2 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 3 Hsi 4 Hsi 5 Hsi 0.2 0
Isolat bakteri fluorescence
Gambar 19 Pertumbuhan koloni Fusarium sp. dalam uji antibiosis menggunakan bakteri kelompok fluorescence.
Berdasarkan Gambar 19, tampak jelas bahwa isolat FSp3 menyebabkan pertumbuhan miselia cendawan menjadi terhambat dan penghambatan tersebut nyata pada hari ke-3 masa inkubasi.
Selanjutnya, nilai persentase daya hambat kelompok bakteri tahan panas terhadap Fusarium sp., penyebab hawar daun ditampilkan pada Tabel 4. Pada
56
tersebut, isolat TA4 menghasilkan persentase daya hambat terbesar dibandingkan dengan isolat lain. Isolat A4 berbeda nyata dengan TW1, TW2, TW3, TW4, TM1, TM2, TM3, TM4, TA1, TA2, TA3, TA5, TSp1, TSp2, TSp4, TSp5 dan kontrol. Pertumbuhan miselia yang dihambat oleh isolat TA4 tampak tertekan dibandingkan dengan isolat yang lain. Dari kelompok bakteri tahan panas, isolat TA4 menghasilkan hambatan tertinggi sebesar 54,08; sangat berbeda dengan kontrol.
Tabel 4 Persentase daya hambat bakteri rizosfer kelompok tahan panas terhadap
Fusarium sp. penyebab hawar daun buah merah secara in vitro
Isolat 1) Daya Hambat (%)2) Isolat 1) Daya Hambat (%)2)
TW1 TW2 TW3 TW4 TW5 TW6 TW7 TM1 TM2 TM3 TM4 5,81 gh 10,76 fgh 15,36 efgh 20,13 defg 42,62 abc 47,83 ab 42,96 abc 27,69 cdef 26,12 cdef 32,03 bcde 15,71 defgh TA1 TA2 TA3 TA4 TA5 TSp1 TSp2 TSp3 TSp4 TSp5 Kontrol 34,72 bcde 45,22 abc 29,77 bcdef 54,08 a 32,20 bcde 20,74 defg 21,18 defg 35,67 abcd 25,95 cdef 18,57 defgh 0,00 h
1). W = Warkapi, M = Madrad, A= Amban Pantai, Sp = SP 8
2). Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan hasil yang tidak berbeda nyata (uji selang ganda Duncan 5%
Kemampuan penghambatan yang dihasilkan oleh bakteri kelompok tahan panas ini dapat dilihat pada Gambar 20, sedangkan persentase daya hambat bakteri kelompok kitinolitik dan kemampuan penghambatan bakteri kitinolitik dapat dilihat pada Tabel 5 dan Gambar 21. Pada gambar 20, tampak jelas bahwa isolat TA4 menyebabkan pertumbuhan miselia cendawan menjadi terhambat dan penghambatan tersebut nyata pada hari ke-2 masa inkubasi.
D ia m et er kol oni F us ar iu m sp. (c m) T W1 T W2 T W3 T W4 T W5 T W6 T W7 T M1 T M2 T M3 T M4 TA1 TA2 TA3 TA4 TA5 T S p1 T S p2 T S p3 T S p4 T S p5 K o nt rol 57 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 1 His 2 His 3 His 0
Isolat bakteri tahan panas
Gambar 20 Pertumbuhan koloni Fusarium sp. dalam uji antibiosis menggunakan bakteri kelompok tahan panas.
Tabel 5 Persentase daya hambat bakteri rizosfer kelompok kitinolitik terhadap
Fusarium sp. penyebab hawar daun buah merah secara in vitro
Isolat 1) Daya Hambat (%)2) Isolat 1) Daya Hambat (%)2)
KW1 KW2 KW3 KW4 KW5 KW6 KM1 KM2 5,00 bc 3) 1,42 bc -9,55 c -8,25 c 14,04 b 2,92 bc 2,14 bc 11,89 b KM3 KA1 KA2 KA3 KSp1 KSp2 KSp3 Kontrol 2,27 bc 35,69 a 8,77 b 13,32 b 35,04 a 6,83 b 35,04 a 0,00 bc
1). W = Warkapi, M = Madrad, A= Amban Pantai, Sp = SP 8
2). Angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan hasil yang tidak berbeda nyata (uji selang ganda Duncan 5%
3). Tanda negatif (-) menunjukkan pemacuan pertumbuhan miselia Fusarium sp.
Pada Tabel 5, isolat A1 menghasilkan nilai persentase daya hambat terbesar dibandingkan dengan isolat lain. Isolat A1 berbeda nyata dengan KW1, KW2, KW3, KW4, KW5, KW6, KM1, KM2, KM3, KA2, KA3, KSp2 dan kontrol. Isolat KA1 dari kelompok kitinolitik merupakan isolat yang memiliki daya hambat tertinggi dibandingkan dengan kontrol, yaitu sebesar 35,692. Kemampuan
D ia m et er kol oni F us ar iu m sp.( cm ) 58
penghambatannya dapat dilihat pada Gambar 21, dimana penghambatan yang dihasilkan oleh isolat KA1 terlihat pada hari ke-3 masa inkubasi.
2 1.8 1.6 1.4 1.2 1 0.8 0.6 0.4 0.2 1 His 2 His 3 His 4 His 0
Isolat bakteri kitinolitik
Gambar 21 Pertumbuhan koloni Fusarium sp. dalam uji antibiosis menggunakan bakteri kelompok kitinolitik.
Berdasarkan Tabel 3, Tabel 4 dan Tabel 5 serta Gambar 19, Gambar 20 dan Gambar 21, bakteri rizosfer buah merah yang paling berpotensi menghambat pertumbuhan miselia Fusarium sp. penyebab hawar daun buah merah adalah isolat FSp3 dari kelompok fluorescence, isolat TA4 dari kelompok tahan panas serta isolat KA1 dari kelompok kitinolitik. Potensi penghambatan didasarkan pada nilai persentase daya hambat yang dihasilkan. Ketiga bakteri tersebut menghasilkan persentase penghambatan yang paling besar dan mampu
menghambat perkembangan cendawan. Kemampuan penghambatannya
dibuktikan dengan pertumbuhan miselia yang tidak mengarah pada koloni bakteri dan terdapat zona bening atau zona kosong antara bakteri dan cendawan (Gambar 22). Dari hasil isolasi dan uji potensi antagonis, hanya sedikit bakteri rizosfer yang berpotensi menghambat perkembangan Fusarium sp. secara in vitro. Pada Gambar 22 terlihat bahwa isolat FSp3, TA4 dan KA1 mampu menghambat cendawan patogen, sehingga pertumbuhan miselia cendawan berhenti atau tertekan. Semakin besar zona penghambatan yang dihasilkan oleh antagonis, maka semakin besar daya antibiosisnya.
59
a
b
c
Gambar 22 Uji antibiosis antara bakteri rizosfer dengan Fusarium sp. asal buah merah; a. Bakteri fluorescence; isolat FSp3 (kiri);kontrol (kanan); b. Bakteri tahan panas; isolat TA4 (kiri);kontrol (kanan); c. Bakteri kitinolitik; isolat KA1 (kiri); kontrol (kanan).
Bakteri dari kelompok fluorescence, kitinolitik dan tahan panas merupakan kelompok bakteri yang berpotensi sebagai agen hayati. Selain sebagai agen
pengendali hayati, bakteri rizosfer juga berpotensi dalam mendukung
pertumbuhan tanaman, sehingga dapat diduga bahwa diduga besar bakteri rizosfer yang berhasil diisolasi lebih berpotensi sebagai bakteri pendukung pertumbuhan tanaman. Bakteri yang berpotensi sebagai agens hayati menghasilkan senyawa
60
metabolit sehingga dapat menghambat pertumbuhan cendawan atau mikroba lainnya. Semakin besar daya hambat yang dihasilkan dari pengukuran antibiosis maka semakin besar potensi senyawa metabolit dari bakteri sebagai agen hayati fitopatogen.
Antibiosis merupakan salah satu mekanisme interaksi mikroba dan mikroba patogen lainnya dengan mengeluarkan senyawa metabolik yang umumnya berupa antibiotik, enzim dan senyawa toksin lainnya; yang efektif dalam menekan patogen tanaman (Pal & Gardener 2006). Hal ini seiring dengan laporan dari Djatnika & Wakiah (1995) bahwa mekanisme penghambatan bakteri rizosfer terhadap F. oxysporum f.sp. cubense dengan cara antibiosis dan lisis. Liu et al. (2007) menyatakan bahwa penghambatan yang kuat terhadap patogen dalam uji in
vitro mengindikasikan penekanan pertumbuhan cendawan tersebut disebabkan
oleh adanya senyawa antifungal yang dihasilkan oleh bakteri antagonis. Mekanisme penghambatan oleh mikroba antagonis adalah antibiotik dan senyawa metabolik yang dimilikinya masuk ke dalam sel patogen dan menghambat aktivitas patogen.
Bakteri kitinolitik merupakan bakteri yang mampu menghasilkan enzim kitinase yang dimanfaatkan untuk sumber karbon dan nitrogen melalui proses asimilasi kitin (Wang & Chang 1997). Enzim yang dihasilkan berfungsi untuk mendegradasi kitin yang merupakan komponen penyusun dinding sel cendawan. Bakteri kelompok flourescence memiliki ciri menghasilkan pigmen berwarna hijau yang berpendar di bawah cahaya ultraviolet. P.fluorescencemengeluarkan senyawaantibiotik, siderofor,HCN,asamsilikat,kitinasedanmetabolitsekunder lainnyayangsifatnyadapat menghambataktivitaspatogentanamanseperti F. oxysporum (Maurhofer et al. 1994). Senyawa tersebut dapat menyebabkan modifikasi struktur dinding sel dan perubahan fisiologis pada sintesa protein yang terlibat dalam pertahanan tanaman (de Brito et al. 1995). Senyawasideroforyang diproduksiolehbakteriinidapatmengkelationFe3+sehinggatidaktersediabagi
F. oxysporum untuk sporanya berkecambah sehingga kemampuannya dalam menginfeksitanamanmenjadiberkurang(Ramamoorthy et al.2002).
Bakteri kelompok tahan panas memiliki ketahanan menghadapi kondisi lingkungan ekstrim, terutama panas, sehingga mampu bertahan hidup dengan
61
menghasilkan endospora, bersifat saprofit dan dijadikan sebagai agen pengendali hayati. Yang tergolong kelompok tahan panas adalah Bacillus spp., dan
Clostridium sp. Genus Bacillus menghasilkan antibiotik seperti subtilin,
subtilosin, mycobacillin, subsporin, surfactin, bacillomycin, bacilysin, asam
sianida, fengycin dan bacilysocin yang dapat merusak membran sel mikroba lain (Maurhofer et al. 1994). Selain itu bakteri ini mampu menghasilkan enzim degradatif makromolekul seperti protease dan kitinase yang dapat menghancurkan dinding sel cendawan Fusarium.
Bakteri rizosfer atau bakteri pengkoloni akar memiliki kemampuan dalam menghambat pertumbuhan mikroba lainnya termasuk patogen tanaman serta mendukung pertumbuhan tanaman. Penggunaan bakteri rizosfer sebagai agen pengendali hayati untuk beberapa penyakit layu Fusarium sudah banyak digunakan diantaranya Bacillus spp., Paenibacillus sp., Pseudomonas sp., dan
Stenotrophomonas spp., dalam mengendalikan F. oxysporum f.sp ciceris pada
tanaman kacang buncis (Landa et al. 2004). Pseudomonads fluorescence mampu menekan penyakit layu pada melon (Larkin et al. 1996). Hasil penelitian melapokan bakteri kitinolitik Arthobacter sp. dan Hafnia sp., diketahui mampu mengendalikan Fusarium sp. dan Sclerotinia sp pada tanaman tomat dan arbei (Wang & Chang 1997). B. subtilis, B. cereus, B. licheniformis, B. megaterium dan
B. pumilus dapat berperan sebagai agen biokontrol untuk mengendalikan
pertumbuhan Fusarium sp. (Nelson 2001).
Mekanisme mikroba menekan mikroba patogen tanaman antara lain melalui antagonisme, antibiosis, hiperparasit, mengeluarkan senyawa volatil, menginduksi ketahanan tanaman dan sebagainya (Baker & Cook 1974). Pengendalian secara hayati semakin berkembang karena lebih unggul dibandingkan dengan pemakaian pestisida dan terbukti lebih aman bagi lingkungan (Pal & Gardener 2006). Dalam aplikasinya secara in vivo bakteri rizosfer tidak secara langsung menekan
Fusarium sp. penyebab hawar daun tanaman buah merah, karena habitat dari
bakteri sebagai agen antagonis ini adalah di tanah. Mekanisme penghambatan yang dilakukan oleh bakteri rizosfer kelompok fluorescence, kelompok tahan panas dan kelompok kitinolitik sebagai agen hayati terhadap Fusarium sp. penyebab hawar daun buah merah adalah secara tidak langsung yaitu dengan
62
meningkatkan ketahanan tanaman buah merah terhadap serangan Fusarium sp. Menurut Baker & Cook (1974), mekanisme penghambatan bakteri rizosfer sebagai agen hayati antara lain antagonis, persaingan, penginduksi ketahanan tanaman serta meningkatkan pertumbuhan tanaman. Defago (1990) menyatakan bahwa P. fluorescens dari rizosfer dapat merangsang akumulasi fitoaleksin sehingga tanaman menjadi lebih resisten.