Masruroh S.Intan | Airlangga University Page 1
Pengukuran Panjang Gelombang Foton Menggunakan
Percobaan Franck - Hertz
Intan Masruroh S, Anita Susanti, Reza Ruzuqi, dan Zaky Alam
Laboratorium Fisika Radiasi, Departement Fisika,
Fakultas Sains dan Terknologi, Universitas Airlangga Jalan Mulyorejo, Surabaya
email: maze.intan@gmail.com
ABSTRAK
Pada percobaan kali ini dilakukan pengukuran panjang gelombang foton bedasarkan percobaan Franck - Hertz. Selain menentukan panjang gelombang juga untuk menentukan tegangan eksitasi dari atom neon. Penentuan tengangan eksitsi neon didapat dari pengukuran tegangan yg dipercepat antara 0-80 volt. Dari tegangan percepatan didapat grafik naik-turun dari energi eksitasi juga diketahui bahwa energi yang didapatkan adalah diskret. Dengan nilai energi eksitasi diketahui pula nilai panjang gelombang foton. Alat yang digunakan dalam percobaan kali ini adalah Franck - Hertz Aparatus (No.seri osk 5221 Ogawa Seiki, Ltd, Jepang) dan multimeter. Pada percobaan ini kita tegangan eksitasi di dapat dari nilai rata-rata sehingga di dapat nilai Veks = ( 17,33±1,14)eV dan Energi eksitasi = 27,76 x 10-19 CeV . Dan dengan menggunakan ℎ𝑐
𝐸𝑒𝑘𝑠maka di dapat nilai λ= 715 Å sedangkan dari referensi nilai
Veks neon adalah 16,62 eV.
Kata kunci : Franck - Hertz, energi eksitasi atom, foton.
PENDAHULUAN
Percobaan Franck - Hertz adalah percobaan fisika yang memberikan pengutan terhadap model atom bohr. Pada tahun 1914 James Franck dan Gustav Hertz melakukan per cobaan dengan menembakan elektron pada atom merkuri. Dengan menggunakan tabung katode dan lampu neon. Skema percobaan Franck - Hertz seperti pada gambar 1.1 beda tegangan Vo dipasang diantara kisi G1 dan G2 sehingga setiap elektron yang mempunyai energi lebih besar dari harga minimum tertentu memberi kontribusi pada nilai arus Ia yang melalui ampermeter. Sehingga elektron yang memiliki energi lebih besar akan tereksitasi. Sehingga elektron yang tereksitasi akan memancarkan foton.
DASAR TEORI
Elektron adalah salah satu sub dasar penyusun atom. Elektron dianggap memiliki muatan negatif. Dengan menggunakan tabung katode yang dihubungkan dengan tegangan dan arus maka elektron dapat diamati dari perubahan tegangan dan arusnya. Sebagai partikel negatif kehadiran elektron tentu akan mempengaruhi besar kecilnya arus. Pada tabung katode yang memiliki tekanan udara relatif lebih rendah dari tekanan udara pada lab. sehingga
Masruroh S.Intan | Airlangga University Page 2 elektron di dalam tabun dapat menumbuk atom Hg tanpa kehilangan energi tumbukan ini disebut tumbukkan elastik. Sedangkan untuk mendapatkan nilai emisivitas elekrtron, maka dilakukn variasi nilai tegangan dari multimeter sehiingga elektron akan kehilangan energi setelah melakukan tumbukan yang menyebabkan atom Hg melakukan transisi dari keadaan dasar menuju keadaan tereksitasi.
METODE PERCOBAAN
Peobaan ini menggunkan konsep eksperimen Franck - Hertz. PELAKSANAAN PERCOBAAN
Percobaan ini dilaksanakan pada hari rabu 9 oktober 2013 di Lab.Radiasi Departemen Fisika Universitas Airlangga Surabaya. Pada pukul 15.00 s/d 16.20 WIB.
ALAT DAN BAHAN
Satu set Franck - Hertz aparatus (No.seri osk 5221 Ogawa Seiki, Ltd, Jepang) PROSEDUR PERCOBAAN
1. Mempersiapkan aparatus Franck - Hertz
2. Mengetahui kegunaan masing-masing tombol pada aparatus.
3. Mengatur tegangan awal pada skala 0 (nol)yang digunakan dan menghitung/mencatat arus yang yang di tunjukan skala (arus dan tegangan tidak akan dihitung dalam analisis karena belum di beri percepatan).
4. Menaikan tegangan dan mencatat nilai arus yang ditunjukan skala. 5. Melakukan step 4 sebanyak 4 kali.
6. Mendata perhitungan tadi sebagai set 1. Dan mengulang set sebanyak 4 kali. Sehingga di dapat 16 nilai Vg dan Ig.
7. Melakukan analisis dan menentukan nilai dari Veks dan panjang gelombang neon. DATA DAN ANALISIS
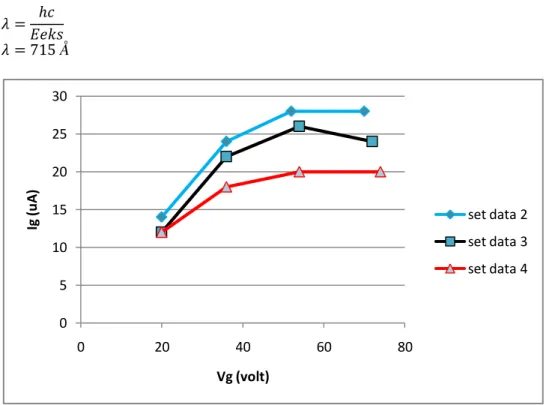
Dalam percobaan kali ini kam melakukan percobaan dengan mengumpulkan 4 set data berikut. Tabel 1. Data pengamatan nilai Vpemercepat dan Arus
Set data pengamatan 1 Set data pengamatan
No Ig Vg (volt) No Ig Vg (volt)
1 18 uA 30 1 14 uA 20
2 24 uA 50 2 24 uA 36
3 30 uA 64 3 28 uA 52
4 36 uA 68 4 28 uA 70
Set data pengamatan 3 Set data pengamatan 4
No Ig Vg (volt) No Ig Vg (volt)
1 12 uA 20 1 12 uA 20
2 22 uA 36 2 18 uA 36
3 26 uA 54 3 20 uA 54
Masruroh S.Intan | Airlangga University Page 3 Dari keempat set data tersebut ternyata ada 3 set data yang memiliki nilai saling mendekati hal ini tentu akan membuat statistik data yang baik. Karena data pada set satu memiliki kemungkinan merusak statistik pada pengukuran berulang Kali ini ,maka data set 1 tidak digunakan.
Untuk menghitung tegangan eksitasi dari tegangan Vn+1 - Vn sehingga menjadi Analisis data 1
ΔV1 = V2 – V1 = 36– 20 = 16V Veks1 = e ΔV1 = e 16V = 16 eV ΔV2 = V3 – V2 = 52 – 36 = 16V Veks2 = e ΔV2 = e 16V = 16 eV ΔV3 = V4 – V3 = 70 – 52 = 18V Veks3 = e ΔV3 = e 18V = 18 eV
Dengan menggunakan perhitungan seperti di atas di dapat nilai rata-rata Veks masing-masing data menjadi
Veks1 rata-rata = (16 eV + 16 eV + 16 eV)/3 =16 eV Veks2 rata-rata = (16 eV + 18 eV + 18 eV)/3 =17,33 eV Veks1 rata-rata = (18 eV + 18 eV + 20 eV)/3 =18, 67 eV
𝑉𝑒𝑘𝑠 = Veks1 + Veks2 + Veks1 = (16+17,33+18,67)/3 = 17,33 eV Veks = (17,33 ± 1,14) eV
Dengan kesalahan 4,2% terhadap literatur 16,62 eV Energi eksitasi dari atom neon didapat 27,76 x 10-19 CeV. Nilai panjang gelombang neon di dapat dari
𝜆 = ℎ𝑐 𝐸𝑒𝑘𝑠 𝜆 = 715 Å
Gambar 1.2 kurva arus anoda sebgai fungsi dari tegangan pemercepat untuk Neon di ambil dari hasil percobaan
0 5 10 15 20 25 30 0 20 40 60 80 Ig (u A ) Vg (volt) set data 2 set data 3 set data 4
Masruroh S.Intan | Airlangga University Page 4 PEMBAHASAN
Dalam era kuantum di bidang atom diawali dengan postulat bohr yang memberikan postulat bahwa elektron bergerak mengelilingi inti dengan orbit lingkaran pada orbit tertentu.elektron memiliki energi tertentu dan mngorbit tanpa meradiasi energi . dan cahaya diemisikan hanya ketika elektron berpindah dari satu orbit ke orbit lain yang lebih dalam. Dalam pengamatan spektroskopi diketahui bahhwa elektron bersifat diskret dan kuantisasi energi dari persamaan elektron untuk atom Hidrogen En = -(13,60/n2) n addalah bessar bilangan kuantum. Karena tingkat energi bernilai negatif negatif sehingga elektron tidak memiiliki cukup energi untuk keluar dari inti. Sehingga elektron hanya dapat berada pada keadaan dasar. Sedangkan foton akan dapat diamatai jika ada transisi elektron dari tingkat energi tinggi ke rendah.
Dengan menggunakan percobaan Franck - Hertz suatu atom dapat diamati eksitasinya. Dengan menggunakan tabung katode yang berisi gas Ne dan multimeter. Dengan menggunakan multimeter dan memvariasikan nilai akan datpat teramati emisivitas energinya. Ketika pada keadaan awal (asumsikan En = Edasar) nilai I adalah X uA. Kemudian tegangan dinaikan secara perlahan sehingga nilai I akan berubah sampai Y uA, pada skala tertentu I akan turun. Dan jika tegangan dinaikan kembali maka I akan naik lagi dan turun pada skala tertentu kedua. Nilai I dipengaruhi dari banyak nya foton yang tereksitasi. Ketika elektron pada keadaan dasar dan dipercepat dengan pemberian tegangan maka elektron yang ditembakan dari katode juga akan bertambah banyak dan tidak semua menumbuk atom Hg yang menghalangi akan ada atom yang diteruskan, atom-atom ini yang mempengaruhi I semakin besar. Ketika atom Ne berada pada suatu tingkat energi tertentu maka energi akan diserap sehingga tidakada elektron yang diteruskan maka arus akan menurun (tidak ada elektron yang sampai ke anoda). Berpindah dari suatu tingkat energi n+1 akan berpindah ke tingkat energi n sehingga akan membuang energi dalam bentuk foton. Dengan data pengamatan 1-4 hanya digunakan data 2-4, karena data 1 memiliki nilai yang cukup menyimpang dari data lain. ketika tegangan awal Vg akan menunjukan Ig1 dan ketika tegangan dinaikan Ig juga akan megalami kenaikan. Sehingga untuk menghitung tegangan eksitasi di lakukan pengurangan untuk nilai Vg+1 terhadap Vg. Sehingga di dapat nilai delta V yang merupakan Veks. Nilai Veks percoban ini merupakan rata-rata dari Veks tiap set data percobaan. Dari percobaaan di dapat nilai V terukur dari skala 0-80 Volt dan I terukur pada skala 20-36 uA. Dengan perhitungan analisis di dapat nilai Veks = (17,33 ± 1,14) eV dengan kesalahan 4,2% dari literatur yaitu 16,62 eV dan panjang gelombang 𝜆 = 715 Å.
KESIMPULAN
Dari percobaan Franck - Hertz didapatkan nilai Energi eksitasi terbaik dari atom Ne adalah (17,33 ± 1,14) eV dengan presentase kesalahan 4,2%. Dan nilai panjang gelombang Ne saat melakukan eksitasi adalah 715 Å.
DAFTAR PUSTAKA
1. Dosen Fisika Radiasi. 2011. Buku Petunjuk Fisika Eksperimental. Departemen Fisika, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya
2. Nugroho, Ardhy P. 2012. Pengukuran Energi Eksitasi Atom Ne Dan Panjang Gelombang Foton Dengan Eksperimen Franck-Hertz. Surabaya
Masruroh S.Intan | Airlangga University Page 5
Analisis Perhitungan
Set data pengamatan 1 Set data pengamatan
No Ig Vg (volt) No Ig Vg (volt)
1 18 uA 30 1 14 uA 20
2 24 uA 50 2 24 uA 36
3 30 uA 64 3 28 uA 52
4 36 uA 68 4 28 uA 70
Set data pengamatan 3 Set data pengamatan 4
No Ig Vg (volt) No Ig Vg (volt) 1 12 uA 20 1 12 uA 20 2 22 uA 36 2 18 uA 36 3 26 uA 54 3 20 uA 54 4 24 uA 72 4 20 uA 74 Analisis data 1 ΔV1 = V2 – V1 = 36– 20 = 16V Veks1 = e ΔV1 = e 16V = 16 eV ΔV2 = V3 – V2 = 52 – 36 = 16V Veks2 = e ΔV2 = e 16V = 16 eV ΔV3 = V4 – V3 = 70 – 52 = 18V Veks3 = e ΔV3 = e 18V = 18 eV Analisis data 1 ΔV1 = V2 – V1 = 36 – 20 = 16V Veks1 = e ΔV1 = e 16V = 16 eV ΔV2 = V3 – V2 = 54 – 36 = 18V Veks2 = e ΔV2 = e 18V = 18 eV ΔV3 = V4 – V3 = 72 – 54 = 18V Veks3 = e ΔV3 = e 18V = 18 eV Analisis data 1 ΔV1 = V2 – V1 = 36 – 20 = 16V Veks1 = e ΔV1 = e 16V = 16 eV ΔV2 = V3 – V2 = 54 – 36 = 18V Veks2 = e ΔV2 = e 18V = 18 eV ΔV3 = V4 – V3 = 74 – 54 = 20V Veks3 = e ΔV3 = e 20V = 20 eV
Veks1 rata-rata = (16 eV + 16 eV + 16 eV)/3 =16 eV Veks2 rata-rata = (16 eV + 18 eV + 18 eV)/3 =17,33 eV Veks1 rata-rata = (18 eV + 18 eV + 20 eV)/3 =18, 67 eV
Masruroh S.Intan | Airlangga University Page 6 n V V2 V1 16 256 V2 17,33 300,3289 V3 18,67 348,5689 Jumlaj 52 904,89 Rata2 17,33 301,63 ∆𝑉𝑒𝑘𝑠 = 𝛴 𝑉𝑒𝑘𝑠 2 − 𝑉𝑒𝑘𝑠 2 ∆𝑉𝑒𝑘𝑠 = 301,63 − 300,32 ∆𝑉𝑒𝑘𝑠 = 1,31 ∆𝑉𝑒𝑘𝑠 = 1,14 Veks = (17,33 ± 1,14) eV 𝑝𝑟𝑒𝑠𝑒𝑛𝑡𝑎𝑠𝑒 𝑘𝑒𝑠𝑎𝑙𝑎ℎ𝑎𝑛 = 𝑉𝑙𝑖𝑡𝑒𝑟𝑎𝑡𝑢𝑟 − 𝑉ℎ𝑎𝑠𝑖𝑙 𝑉𝑙𝑖𝑡𝑒𝑟𝑎𝑡𝑢𝑟 × 100% 𝑝𝑟𝑒𝑠𝑒𝑛𝑡𝑎𝑠𝑒 𝑘𝑒𝑠𝑎𝑙𝑎ℎ𝑎𝑛 = 16,62 − 17,33 16,62 × 100% 𝑝𝑟𝑒𝑠𝑒𝑛𝑡𝑎𝑠𝑒 𝑘𝑒𝑠𝑎𝑙𝑎ℎ𝑎𝑛 = −0,042 × 100% 𝑝𝑟𝑒𝑠𝑒𝑛𝑡𝑎𝑠𝑒 𝑘𝑒𝑠𝑎𝑙𝑎ℎ𝑎𝑛 = 4,2% Eeks = V ∙ 𝑒 Eeks = 17,33 eV ∙ 1,602 x 10-19 C Eeks = 27,76 x 10-19 CeV 𝜆 = ℎ𝑐 𝐸𝑒𝑘𝑠 𝜆 =6,626 × 10 −34 ∙ 2,998 × 108 27,76 × 10−19 𝜆 =19,86 × 10 −26 27,76 × 10−19 𝜆 = 0,715 × 10−7 𝑚 𝜆 = 715 × 10−10 𝑚 atau 𝜆 = 715 Å