METODOLOGI
Waktu dan Tempat Penelitian
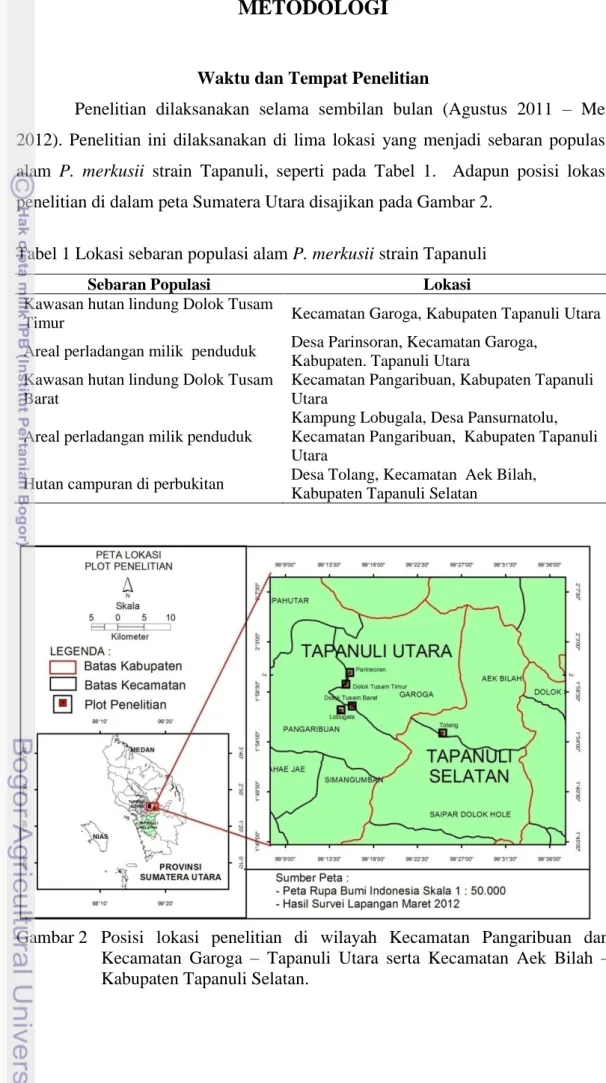
Penelitian dilaksanakan selama sembilan bulan (Agustus 2011 – Mei 2012). Penelitian ini dilaksanakan di lima lokasi yang menjadi sebaran populasi alam P. merkusii strain Tapanuli, seperti pada Tabel 1. Adapun posisi lokasi penelitian di dalam peta Sumatera Utara disajikan pada Gambar 2.
Tabel 1 Lokasi sebaran populasi alam P. merkusii strain Tapanuli
Sebaran Populasi Lokasi
Kawasan hutan lindung Dolok Tusam
Timur Kecamatan Garoga, Kabupaten Tapanuli Utara
Areal perladangan milik penduduk Desa Parinsoran, Kecamatan Garoga, Kabupaten. Tapanuli Utara
Kawasan hutan lindung Dolok Tusam Barat
Kecamatan Pangaribuan, Kabupaten Tapanuli Utara
Areal perladangan milik penduduk
Kampung Lobugala, Desa Pansurnatolu, Kecamatan Pangaribuan, Kabupaten Tapanuli Utara
Hutan campuran di perbukitan Desa Tolang, Kecamatan Aek Bilah, Kabupaten Tapanuli Selatan
Gambar 2 Posisi lokasi penelitian di wilayah Kecamatan Pangaribuan dan Kecamatan Garoga – Tapanuli Utara serta Kecamatan Aek Bilah – Kabupaten Tapanuli Selatan.
Kondisi Umum Lokasi Penelitian
Kelima lokasi penelitian merupakan sebaran alam P. merkusii strain Tapanuli yang terletak di kawasan perbukitan dengan kondisi topografi berat dengan ketinggian tempat berkisar antara 800 – 1300 mdpl. Posisi geografis kelima lokasi yang diteliti berada diantara 99o07’00” – 99o27’00” Bujur Timur dan 1o47’00” – 2o07’00” Lintang Utara. Secara lebih terperinci informasi mengenai kondisi ekologis kelima lokasi sebaran alam P. merkusii strain Tapanuli yang diteliti disajikan pada Tabel 2.
Tabel 2 Posisi geografis, ketinggian tempat, dan kelerengan lima lokasi sebaran alam P. merkusii strain Tapanuli pada ekosistem daratan Tapanuli yang diteliti
Pada Tabel 2 dapat diketahui urutan lokasi sebaran alam P. merkusii
strain Tapanuli dari yang tertinggi hingga yang terendah sebagai berikut: Dolok Tusam Barat, Lobugala, Dolok Tusam Timur, Tolang, dan Parinsoran. Adapun berdasarkan kondisi topografinya, sebagian besar lokasi sebaran alam P. merkusii
strain Tapanuli berada pada lokasi dengan kelerengan agak curam hingga sangat curam. Hanya di Parinsoran dan Lobugala, populasi alam P. merkusii strain Tapanuli berada pada kelerangan landai hingga agak curam. Berdasarkan hitungan jarak datar yang diukur dari software Geographical Information System
(GIS) dapat diketahui jarak datar antar lokasi penelitian (Tabel 3). Tabel 3 Jarak antar lokasi penelitian
Lokasi Jarak datar (km)
Dolok Tusam timur Parinsoran Dolok Tusam Barat Lobugala Tolang Dolok Tusam timur *****
Parinsoran 2.3 *****
Dolok Tusam Barat 4.2 6.3 *****
Lobugala 5.1 7.3 2.3 *****
Tolang 20.5 20.9 17.5 19.7 *****
No. LOKASI Ketinggian
Lintang Utara Bujur Timur (mdpl) Satuan Klasifikasi
1. DOLOK TUSAM TIMUR 01o59'29,8" 099o15'10,0" 1096 25 - 45% atau lebih curam - sangat curam 2. PARINSORAN 02o00'41,2" 099o15'34,4" 1031 8-25% landai - agak curam 3. DOLOK TUSAM BARAT 01o57'16,2" 099o15'50,1" 1269 15 - 45% atau lebih agak curam - sangat curam 4. LOBUGALA 01o56'49,2" 099o14'39,4" 1175 8-25% landai - agak curam 5. TOLANG 01o54'30,3" 099o25'02,2" 1059 25 - 45% atau lebih curam - sangat curam
Kelerengan Koordinat geografis
Sub-topik Penelitian 1:
Analisis Perubahan Tutupan Lahan, Sifat Kimiawi Tanah, dan Struktur Tegakan Populasi Alam P. merkusii strain Tapanuli pada Sebaran Alaminya
di Tapanuli – Sumatera Utara Bahan dan Alat
Bahan utama penelitian ini adalah citra Landsat 7 ETM+ (Enhanced Thematic Mapper) liputan tahun 1994, 2005, dan 2011 dan peta Rupa Bumi Indonesia (RBI) provinsi Sumatera Utara. Bahan lain berupa bahan tulis menulis dan beberapa software yang terkait, yakni: software ERDAS Imagine dan ArcView GIS. Adapun peralatan yang diperlukan untuk penelitian ini adalah: komputer, kompas, GPS, ring tanah untuk pengambilan contoh tanah, kamera digital, tally sheet.
Metode
1. Analisis tutupan lahan pada ekosistem hutan Tapanuli – Sumatera Utara Perubahan tutupan lahan dianalisis dengan menggunakan pengolahan citra satelit (Image Processing) elit dan analisa spasial. Sumber data untuk menganalisis perubahan tutupan lahan yaitu citra Landsat tahun 1994, 2005, dan 2011. Jenis citra yang digunakan adalah citra Landsat 7 ETM+ (seri 7 Enhanced Thematic Mapper Plus) yang memiliki resolusi menengah (1 pixel = 30 x 30 m) dengan daerah liputan cukup luas bila dibandingkan dengan citra SPOT-5 dan Quickbird.
Klasifikasi penutupan lahan secara digital dilakukan dengan menggunakan metode maximum likelihood classification (MLC). Tahapan pengolahan data citra dan analisis perubahan tutupan lahan adalah sebagai berikut :
a. Persiapan
Citra Satelit dibuat dalam format image (img) dan dibuat dalam bentuk Citra Komposit (layer stack) dengan kombinasi Band 542. Band 542 umum digunakan untuk klasifikasi lahan untuk penentuan tutupan lahan dan penggunanaan lahan karena menggambarkan perbedaan lahan bervegetasi dan non vegetasi dengan lebih jelas.
b. Cropping Area
Citra Satelit dipotong (cropping) sesuai dengan batas area yang akan diklasifikasi melalui metode Subset Image.
c. Klasifikasi Citra
Klasifikasi citra menggunakan gabungan tiga metode yaitu Unsupervised Classification, Supervised Classification (Maximum Likelihood) (Richards 1986), dan Visual Interpretation. Tiga metode tersebut lebih menghasilkan hasil klasifikasi citra yang mendekati kondisi lapangan atau hasil groundcheck. Pada kelas penggunaan lahan yang sulit dipisahkan berdasarkan karakteristik pixel-nya dilakukan deliniasi manual sesuai metode interpretasi visual (penafsiran visual). Kelebihan dari teknik interpretasi visual ini dibandingkan dengan interpretasi otomatis adalah dasar interpretasi tidak semata-mata kepada nilai kecerahan, tetapi konteks keruangan pada daerah yang dikaji juga ikut dipertimbangkan (Lillesand & Kiefer 1990). Dalam interpretasi manual ini peranan interpreter dalam mengontrol hasil klasifikasi menjadi sangat dominan, sehingga hasil klasifikasi yang diperoleh relatif lebih masuk akal.
d. Mengidentifikasi dan analisis obyek atau tipe vegetasi dari dengan menggunakan informasi spasial seperti ukuran, bentuk, tekstur, pola, bayangan asosiasi dan situs sesuai dengan konteks keruangan. Hasil identifikasi dan analisis obyek akan menentukan klasifikasi penutupan lahan yang terbagi menjadi lima kelas.
e. Konversi Format Raster ke Vektor
Proses ini untuk memudahkan dalam analisis spasial menggunakan
Geographic Information System (GIS)
f. Membuat antar waktu tampilan visual peta perubahan tutupan lahan analisis spasial pada masing-masing lokasi atau plot penelitian (5 lokasi). Selanjutnya untuk mendapatkan luas perubahan tutupan lahan dibuat matrik perubahan tutupan lahan antar waktu (1994, 2005dan 2011).
2. Analisis sifat kimia tanah dan struktur tegakan pada tapak tumbuh Pinus
merkusii strain Tapanuli
Kondisi tapak tumbuh dianalisis melalui analisis sifat kimia tanah pada lima lokasi sebaran alam P. merkusii strain Tapanuli. Contoh tanah diambil dari 4 lapisan kedalaman tanah yakni: 0-5 cm, 5-10 cm, 10- 20 cm, 20-30 cm pada setiap kluster plot penelitian dengan menggunakan ring tanah.
Plot pengamatan untuk analisis struktur tegakan berbentuk kluster plot yang penempatannya menggunakan metode purposive sampling. Setiap lokasi diwakili oleh 1 kluster plot yang terdiri atas 4 sub plot berbentuk lingkaran dengan luas masing-masing sub plot 0.1 ha sehingga luas per kluster plot adalah 0.4 ha. Kluster plot yang berbentuk lingkaran ini dipilih dengan pertimbangan kemudahan dan kepraktisan penggunaannya di lapangan. Penggunaan kluster plot ini diturunkan dari metode Forest Health Monitoring (FHM) yang membagi habis permukaan bumi dengan bentuk heksagon. Setiap heksagon memiliki luas 2400 hektar sehingga intensitas sampling untuk setiap kluster plot adalah 0.016 % (Mangold 1997) seperti disajikan pada Gambar 3. Parameter yang diamati adalah diameter dan tinggi tegakan P. merkusii strain Tapanuli.
Gambar 3 Bentuk Permanen Sampel Plot (PSP) mengacu pada metode Forest Health Monitoring (FHM) (Mangold 1997).
Setiap kluster plot terdiri atas 4 annular-plot dan 4 sub-plot. Annular-plot dan sub-plot nomor 1 berada di pusat, sedang annular-plot dan sub-plot lainnya berada pada azimuth tertentu dari annular-plot dan sub-plot nomor 1. Posisi annular-plot dan sub-plot nomor 2 berada pada azimuth 360o dari posisi annular-plot dan sub-annular-plot nomor 1. Posisi annular-annular-plot dan sub-annular-plot nomor 3 berada pada azimuth 120o dari posisi annular-plot dan sub-plot nomor 1. Posisi annular-plot dan sub-plot nomor 4 berada pada azimuth 240o dari posisi annular-plot dan sub-plot nomor 1. Antara titik pusat annular sub-plot 1 dengan titik pusat annular sub-plot yang lain berjarak 36.6 m. Setiap annular-plot memiliki luas 0.1 ha sehingga luas dalam 1 kluster plot adalah 0.4 m. Adapun total luas lingkaran kluster (di dalam dan di luar plot) menjadi 1 ha. Di dalam setiap sub-plot terdapat mikroplot dengan radius 2.07 m pada jarak 3.66 m dan azimuth 90o dari titik pusat sub-plot.
Sub-topik Penelitian 2:
Analisis Genetik Populasi Alam P. merkusii strain Tapanuli pada Sebaran Alaminya di Tapanuli – Sumatera Utara dengan Menggunakan Penanda
Molekuler Mikrosatelit Bahan dan alat
Bahan yang digunakan dalam penelitian ini adalah daun tanaman Pinus merkusii strain Tapanuli. Untuk proses ekstraksi, bahan kimia yang digunakan adalah buffer ekstrak, PVP 2%, Chloroform IAA, phenol, isopropanol dingin, NaCl, Etanol 95%, buffer TE, aquabidest, H2O, primer mikrosatelit, Qiagen Taq
polymerase, agarose, buffer TAE 1x, blue juice 10x, marker, Etidium bromida. Acrilamide, APS, Temed, Formalin, NaOH, NH4OH, Asetat 1%, Amonia,
AgNO3.
Sedangkan alat yang digunakan adalah sarung tangan karet, gunting, tube 1.5 ml, tube 0.2 ml spidol permanen, mortar, pestel, pipet mikro, tips, rak tube, vortex, mesin sentrifugasi, waterbath, freezer, timbangan analitik, desikator, mesin PCR, bak elektroforesis, cetakan agar, microwave, gelas ukur, ultraviolet transilluminator, alat foto DNA.
Metode
1. Pengambilan Sampel
Unit sampel untuk analisis genetik ini adalah populasi. Di dalam penelitian ini ada 5 populasi alam P. merkusii strain Tapanuli yang menyebar pada lokasi yang berbeda tetapi masih di dalam ekosistem hutan Tapanuli. Informasi kelima lokasi sebaran disajikan pada Tabel 1. Jumlah pohon yang dijadikan sampel untuk setiap lokasi populasi alam diupayakan mencapai 24-30 individu pohon, sedangkan sampel yang diambil untuk analisis genetika ini berupa daun. Prosedur pengambilan sampel di lapangan adalah sebagai berikut:
a. Daun diambil dari setiap individu pohon sebanyak 2 – 5 pucuk daun. b. Daun tersebut selanjutnya dimasukkan ke dalam plastik klips yang berisi
silika gel.
c. Dalam satu lokasi diharapkan dapat dijumpai 24 - 30
d. Setiap pohon yang daunnya diambil diukur tinggi, diameter dan letak geografisnya dengan menggunakan alat ukur
e. Jarak antar pohon sampel dalam satu populasi minimal 30 meter
f. Data mengenai tinggi, diameter dan letak geografis, serta pemetaan pohon induk maupun anakan dicatat kedalam lembar data (datasheet).
2. Ekstraksi DNA
Metode yang digunakan untuk ekstraksi DNA ini adalah metode CTAB (Cetyl Trimethyl Ammonium Bromide) yang telah dimodifikasi. Daun dipotong dengan ukuran 2 X 2 cm, kemudian digerus dengan menambahkan nitrogen cair di dalam pestel/mortar yang bersih. Hasil gerusan kemudian dimasukkan ke dalam tabung mikro 2 ml dan ditambahkan larutan buffer ekstrak sebanyak 500 – 700 µl. Agar daun hasil gerusan tercampur dengan larutan penyangga dan PVP 2% secara merata maka tabung yang berisi hasil gerusan tersebut di vortex. Setelah itu diinkubasi dalam dalam water bath selama 45 menit – 1 jam sambil dibolak-balik setiap 15 menit. Suhu optimal yang digunakan dalam proses inkubasi berkisar antara 65-700C. Apabila proses inkubasi melebihi suhu optimal maka DNA yang ada dalam tube akan rusak.
Setelah proses inkubasi, tabung mikro tersebut diangkat dan didinginkan selama 15 menit kemudian ditambahkan kloroform sebanyak 500 µl dan fenol
sebanyak 10 µl, lalu sentrifugasi pada kecepatan 13000 rpm selama 2 menit. Hasil sentrifugasi (supernatan) akan terpisah menjadi dua fase yaitu bagian atas merupakan fase air yang berisi asam nukleat dan bagian bawah yaitu fase organik yang berisi pelarut organik. Fase air dipisahkan dari fase organik dengan menggunakan pipet mikro lalu dipindahkan kedalam tabung mikro baru. Kemudian ditambahkan chloroform 500 µl dan fenol 10 µl sebanyak dua kali secara berulang yang bertujuan untuk memperoleh DNA yang memiliki tingkat kemurnian tinggi.
Supernatan yang telah terpisah dari fase organik, ditambahkan isoproponal dingin sebanyak 500 µl dan NaCl atau NaOAc sebanyak 500 µl dan 300 µl. Campuran ini disimpan dalam freezer selama 45 menit – 1 jam. Hasil pengendapan tersebut disentrifuge pada kecepatan 13000 rpm selama 2 menit kemudian cairan dalam tabung mikro dibuang. Hasil pengendapan akan berupa pelet DNA. Pelet DNA ini kemudian ditambahkan etanol 100% sebanyak 300 µl dan disentrifuge selama 2 menit pada kecepatan 13000 rpm, kemudian cairan etanol tersebut dibuang. Setelah itu pelet DNA yang tersisa dalam tabung mikro dikeringkan dalam desikator dengan posisi terbalik selama 10 menit lalu ditambahkan larutan TE sebanyak 20 µl difortex kemudian disimpan didalam freezer.
Selama proses pengeringan pelet DNA, disiapkan agarose 1% (0.33 gram agarose dalam 33 ml TAE). Untuk proses elektroforesis, diambil 3 µl DNA ditambahkan 2 µl blue juice 10 X dan kemudian di running pada tegangan 100 selama ± 30 menit. DNA akan bergerak kearah positif (anoda). Hasil elektroforesis kemudian direndam dalam larutan etidium Bromide (ETBR) 10 µl per 200 ml aquades selama 3 – 5 menit dan selanjutnya dilihat pada UV transiluminator.
3. Seleksi Primer
Primer adalah rantai pendek DNA yang dihasilkan secara buatan biasanya antara 10 – 25 nukleotida. Primer berfungsi sebagai titik mula terjadinya sintesis oleh enzim yang disebut DNA polymerase yang diperoleh dari bakteri Thermus aquaticus. Enzim ini biasa disebut juga Taq DNA polymerase. Enzim ini sesuai untuk proses amplifikasi karena dapat bertahan pada suhu tinggi hingga 950C
meskipun suhu optimum bagi aktifitas enzim adalah 720C. Setelah terjadi
annealing selanjutnya dilakukan perbanyakan fragmen DNA melalui proses ekstensi pada suhu 720C.
Seleksi primer dimaksudkan untuk mencari primer acak yang menghasilkan penanda polimorfik, karena tidak semua primer nukleotida dapat menghasilkan produk amplifikasi (primer positif) dan dari primer positif tidak semuanya menghasilkan fragmen DNA polimorfik. Proses penyeleksian primer yang digunakan dalam metoda mikrosatellite mengikuti primer yang pernah diuji oleh Nurtjahjaningsih et al. (2005), karena belum ada penelitian pendahuluan terhadap jenis P. merkusii alami yang dapat mengamplifikasi DNA tanaman ini. Dalam penelitian ini digunakan 7 primer yang dipilih dari hasil temuan mikrosatelit pada P. merkusii di hutan tanaman (Nurtjahjaningsih et al. 2005). Informasi tentang ketujuh primer mikrosatelit tersebut tersaji pada Tabel 4.
Tabel 4 Karakteristik primer mikrosatelit dari Pinus merkusii di hutan tanaman, di Pulau Jawa (Nurtjahjaningsih et al. 2005)
4. PCR (Polymerase Chain Reaction)
Proses PCR membutuhkan 4 komponen utama yaitu H2O, HotStar Mix,
primer dan DNA. DNA hasil proses ektraksi sebelum dilakukan proses amplifikasi PCR harus dilakukan pengenceran dengan menggunakan aquabidest. Besarnya perbandingan antara DNA dengan aquabidest tergantung dari tebal dan tipisnya DNA hasil ekstraksi.
Untuk proses PCR, DNA 1.5 µl dicampurkan dengan HotStar Mix 7.5 µl,
Nuclease-free water 2.5 µl dan primer 1.5 µl) disentrifugasi selama 5-10 detik
Suhu Nomor Akses
annealing (oC) ke Bank Gen
1. pm01 111-117 56 (TG)12 F: AGAGAAGGCACGATTTTGTC AB201535 R: TCCCACTAATCACTTTGAAAG 2. pm04 92 56 (TG)10 F: CTCTAAGTAGGACAAGGCCT AB201536 R: CATAATCCAAGGAGTCAAGG 3. pm05 112-118 52 (TG)9 F: GAGTCTAATTGCAAACCCCA AB201537 R: TGGAGATCTACCACTTTTTC
4. pm07 284-309 52 (AC)8(AT)4 F: GAATCTAAGCATATGAAATGAG AB201538
R: CTTGTTAATGCTACTAGTTATG
5. pm08 132 59 (AT)2(GT)11 F: GCTTCAATCTATTGACCCCAT AB201539
R: TAAAGGGGCAGCTGCTACAACCAATGG
6. pm09a 81-99 52 (AT)5(GT)18(AT)2 F: CCTTCTCATTTCGATATGCAC AB201540
R: ATTAAAGGTTATATGGGGCT
7. pm12 181-193 59 (GT)5CT(GT)5(AT)5 F: GAACAATCATTGCGGGTCCCG AB201541
R: TATGCTGCGTTTATATGTATAAGTGTC Ukuran Produk (bp)
Lokus
kemudian dimasukkan kedalam mesin PCR. Tahapan serta suhu PCR seperti disajikan dalam Tabel 5.
Tabel 5 Tahapan dalam proses PCR
Metode Tahapan Suhu (0C) Waktu (menit) Jumlah siklus Mikrosatelit Pre- Denaturation
Denaturation Annealing Extention Final Extention 95 95 53 72 72 2 1 2 2 5 1 35 1
Pengujian polimorfisme dilakukan dengan melihat pita hasil PCR yang divisualisasi berdasarkan hasil elektroforesis. Hasil pengujian ini dikatakan polimorfisme jika pola pita yang dihasilkan mempunyai sekurang-kurangnya lebih dari satu variasi, sedang hasil pengujian dikatakan monomorfik jika tidak memperlihatkan adanya variasi pada pola pita hasil elektroforesis.
5. Analisis Data
Hasil PCR yang telah dielektroforesis difoto dan dianalisis dengan melakukan skoring pita yang muncul. Pada metode RAPD pola pita yang muncul diterjemahkan kedalam data biner berdasarkan ada atau tidak adanya pita, sedangkan untuk data mikrosatelit dihitung berdasarkan banyaknya alel yang ditemukan sesuai panjang basa.
Hasil perhitungan pita-pita DNA tersebut kemudian dianalisis untuk mengetahui keragaman dalam populasi maupun antar populasi. Parameter keragaman genetik yang dihitung dalam penelitian ini adalah (Finkelday 2005) : a. Persentase Lokus Polimorfik (PLP)
Suatu lokus gen dikatakan polimorfik jika sekurang-kurangnya ada dua varian yang berbeda (alel). Sedang untuk monomorfik tidak memperlihatkan variasi genetik. Persentase lokus polimorfik dihitung dengan rumus;
Persentase Lokus Polimorfik (PLP) =
(
)
( ) ) ( LM LP LP X 100% dimana Σ (LP) ; jumlah lokus polimorfikΣ(LM) ; jumlah lokus monomorfik b. Jumlah alel yang teramati (na) =
LokusAlel
c. Jumlah alel yang efektif (ne) =
i
pi2
1
dimana, pi2 ; frekuensi genetik tipe ke i d. Heterozigositas harapan (He) = 1 –
i
pi2
dimana ; pi2 = frekuensi genetik tipe ke i e. Diferensiasi genetik (Gst) =
HT HS
HT )
(
dimana; HT = keragaman populasi total, HS = keragaman populasi tunggal Parameter keragaman genetik yang diukur seperti jumlah alel yang diamati (na), jumlah alel yang efektif (ne), jumlah lokus polimorfik, persen lokus polimorfik (PLP) dan heterozigitas harapan (He), diolah dengan software Pop
Gene 1.32. Jarak genetika antara populasi dihitung menggunakan koefisien Dice dan pembuatan dendogram menggunakan unweighted pair-group method arithmetic (UPGMA) berdasarkan jarak genetik Nei dengan perangkat lunak numerikcal taxonomy and multivariate system (NTSYS) versi 1.80.
Sub-topik Penelitian 3:
Analisis Kandungan Biomassa Karbon Tegakan Alam P. merkusii strain Tapanuli pada Sebaran Alaminya di Tapanuli –Sumatera Utara Bahan dan Alat
Bahan utama yang diperlukan untuk penelitian ini adalah tegakan populasi alam P. merkusii strain Tapanuli yang tumbuh di dalam kawasan hutan lindung Dolok Tusam – Tapanuli Utara – Sumatera Utara. Bahan lain yang dibutuhkan untuk penelitian ini adalah tally sheet, tali plastik, dan bahan-bahan yang dibutuhkan untuk kegiatan survey vegetasi di lapangan.
Adapun alat-alat yang diperlukan untuk penelitian pada ini meliputi peralatan survey (GPS, kompas, meteran, haga hypsometer, phy band, kamera digital), bor kayu, peralatan untuk pencatatan data (pensil, pulpen, alas tulis, penghapus), dan peralatan untuk analisis data (komputer, kalkulator, beberapa software).
Metode
Penyusunan model persamaan alometrik untuk pendugaan kandungan biomassa karbon pada populasi alam P. merkusii strain Tapanuli ini menggunakan metode destructive sampling (pembongkaran dan pengukuran biomassa sampel), yang urutan tahapannya sebagai berikut:
1. Pemilihan lokasi penelitian
Lokasi penelitian untuk pendugaan kandungan biomassa karbon P. merkusii
strain Tapanuli dipusatkan di dalam kawasan hutan lindung Dolok Tusam – Tapanuli Utara. Kegiatan pembuatan plot inventory untuk pendataan struktur tegakan P. merkusii strain Tapanuli yang akan diduga kandungan biomassa karbonnya dilakukan di dalam dan di luar kawasan hutan lindung Dolok Tusam – Tapanuli Utara. Adapun untuk kegiatan destructive sampling dilakukan di luar kawasan hutan lindung Dolok Tusam – Tapanuli Utara.
2. Penilaian struktur tegakan populasi alam P. merkusii strain Tapanuli Penilaian struktur tegakan ini bertujuan untuk mengetahui struktur kelas diameter pohon P. merkusii strain Tapanuli yang tersebar di dalam populasi alaminya tersebut. Data tentang struktur kelas diameter ini penting untuk menentukan jumlah dan lokasi pohon yang akan dijadikan sebagai sampel yang akan dibongkar dan diukur dalam metode destructive sampling.
3. Pelaksanaan destructive sampling
Destructive sampling merupakan metode pengukuran kandungan biomassa pohon dengan cara memanen dan mengukur kandungan biomassa pada semua bagian pohonnya, meliputi bagian atas tanah dan bagian bawah tanah. Penyusunan persamaan allometrik dilakukan dengan metode destructive sampling pada 36 pohon sampel (rentang diameter 13-82 cm) dan metode volumetrik pada 8 pohon sampel (diameter 75.0 cm, 79.5 cm, 86.0 cm, 95.0 cm, 104.0 cm, 110.9 cm, 115.5 cm, 120.6 cm). Sebaran kelas diameter pohon sampel ini ditentukan dengan mengacu pada sebaran kelas diameter tegakan alam P. merkusii strain Tapanuli yang tumbuh di dalam kawasan hutan lindung Dolok Tusam – Tapanuli. Metode
destructive sampling mengacu pada metode yang dikembangkan oleh Japan International Forestry Promotion & Cooperation Center (JIFPRO 2000), Siregar
(2007) dan Siregar (2011) yang secara umum tahapan kegiatannya sebagai berikut:
a. Penentuan pohon P. merkusii strain Tapanuli yang dipilih sebagai sampel, b. Sebelum ditebang, terlebih dahulu diukur diameter batang dan tinggi total
batangnya,
c. Penebangan sampel pohon P. merkusii strain Tapanuli terpilih,
d. Pemisahan dan penimbangan berat segar dari setiap bagian pohon (batang, cabang, ranting, daun, buah, dan akar.
e. Pembagian bagian batang sampel pohon P. merkusii strain Tapanuli yang telah ditebang menjadi beberapa sortimen,
f. Pengukuran berat segar dari setiap sortimen batang yang ditebang tersebut, g. Pengambilan sampel kayu dari setiap bagian pohon P. merkusii strain
Tapanuli yang telah ditebang tersebut sebanyak 250 gram,
h. Mengeringkan sampel daun, ranting, dan buah dengan menggunakan oven pada suhu 85oC selama 2 hari.
i. Mengeringkan sampel batang dan cabang dengan menggunakan oven pada suhu 85oC selama 4 hari.
j. Penghitungan berat kering total (JIFPRO 2000): BKT = (BKS x BST)/ BSS, dengan keterangan: BKT: Berat Kering Total (Kg), BKS: Berart Kering Sampel (gram), BST: Berat Segar Total (Kg), BSS: Berat Segar Sampel (gram),
k. Menyusun persamaan allometrik P. merkusii strain Tapanuli dengan menggunakan bantuan software Microsoft Office Excel (2007), dan software statistik (JMP) serta formula persamaan allometrik lokal sebagai berikut: Y = a(DBH)b; Y= a(DBH x Tinggi Total)b; Y= a(DBHxKerapatan jenis kayu)b; Y=a(DBHxTinggi TotalxKerapatan jenis kayu)b, Keterangan: Y= biomassa (Kg), DBH= Diameter setinggi dada (cm), a dan b = nilai koefisien persamaan;
l. Uji perbandingan persamaan allometrik hasil penelitian ini dengan persamaan allometrik lain yang sudah ada,
m.Pemilihan model terbaik persamaan allometrik berdasarkan nilai parameter statistik berikut: Koefisien Determinasi (R2), Koefisien Determinasi yang
disesuaikan (R2 adjusted), nilai Root Mean Square Error (RMSE) dan pengujian keberartian model regresi. Model yang dipih adalah model dengan nilai RMSE terkecil, R2 dan R2 Adjusted yang terbesar dan pengujian keberartian persamaan regresi. Persamaan allometrik yang terpilih selanjutnya dibandingkan dengan persamaan allometrik yang sudah ada.