ETIL ASETAT
DARI ALKOHOL DAN ASAM CUKA
I. JUDUL PERCOBAAN :
ETIL ASETAT DARI ALKOHOL DAN ASAM CUKA
II. PRINSIP PERCOBAAN
Esterfikasi adalah reaksi pengubahan dari suatu asam karboksilat dan alkohol menjadi suatu ester dengan menggunakan katalis asam.
III. MAKSUD DAN TUJUAN
o Untuk mengetahui pembuatan Etil asetat dari alkohol dan asam cuka
o Untuk memurnikan Etil asetat dengan cara distilasi
o Untuk mengetahui sifat fisika dan kimia Etil asetat
o Untuk mengetahui refraksi dari Etil asetat praktis
IV. REAKSI
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
V. LANDASAN TEORI
Senyawa organic secara umum digolongkan sebagai senyawa hidrokarbon aromatis. Senyawa hidrokarbon aromatis adalah senyawa hidrokarbon dengan rantai atom karbon tertutup (siklis). Senyawa hidrokarbon aromatis digolongkan menjadi senyawa aromatis hidrokarbon dan senyawa aromatis heterosiklis. Senyawa romatik hidrokarbon misalnya senyawa benzene dengan turunannya. Sedangkan senyawa aromatis heterosiklis misalnya pirimidin, furan dan pirol.
reversibel. Kekuatan asam karboksilat hanya memainkan peranan kecil dalam laju pembentukan ester. Metode ini bisa digunakan untuk mengubah alkohol menjadi ester, tetapi metode ini tidak berlaku bagi fenol, yaitu senyawa organik dimana gugus (-OH) terikat langsung pada sebuah cincin Benzena.
BAHAN BAKU Alkohol
Alkohol (atau alkanol) adalah istilah yang umum untuk senyawa organik apa pun yang memiliki gugus hidroksil (-OH) yang terikat pada atom karbon, yang ia sendiri terikat pada atom hidrogen atau atom karbon lain. Gugus alkil pada alkohol dapat berbentuk alifatik atau siklik, akan tetapi yang umumnya yang disebut alkohol adalah yang memiliki gugus alkil alifatik.
Alkohol yang memiliki satu gugus (–OH) disebut dengan monoalkohol, sedangkan yang memiliki lebih dari satu gugus (–OH) disebut dengan polialkohol. Alkanol merupakan monoalkohol turunan alkana. Rumus umum dari alkohol aalah CnH2n+1 (-OH) atau ditulis (R-OH), satu atom (H) dari alkana diganti oleh
gugus (OH).
Ada tiga jenis utama alkohol yaitu:
1. Alkohol primer, yaitu alkohol yang mengikat atom C primer.
2. Alkohol sekunder, yaitu alkohol yang mengikat atom C sekunder.
3. Alkohol tersier, yaitu alkohol yang mengikat atom C tersier.
Sifat-sifat Alkohol
Sifat Fisika Sifat Kimia
Merupakan cairan tidak berwarna.
Dapat dioksidasi, alkohol primer dioksidasi membentuk aldehid dan bila dioksidasi lebih lanjut membentuk asam karboksilat, alkohol sekunder bila dioksidasi membentuk keton, alkohol tersier jika dioksidasi maka tidak teroksidasi.
ester. Titik didih dan titik cairnya semakin tinggi jika
bobot molekulnya semakin besar. Mengalami reaksi subtitusi dan eliminasi.
Makin banyak atom karbonnya makin tinggi
bobot jenisnya. Alkohol adalah molekul polar dengan adanya
gugus (-OH)
Pada suhu kamar alkohol bersuhu rendah berbentuk cairan yang bersifat mobile suhu sedang serupa cairan kental sedangkan suhu berbentuk padatan.
Gugus fungsi (-OH) dapat melepaskan proton pada larutan, maka alcohol bersifat asam.
Kegunaan Alkohol :
Di dunia industri, Alkohol digunakan sebagai bahan baku pembuatan formaldehid, sebagai cairan antibeku, dan pelarut, seperti varnish, membuat polimer jenis plastik, sebagai bahan baku industri serat sintetik seperti dacron.
Dalam kehidupan sehari-hari alkohol juga dapat digunakan sebagai bahan pembuat minuman beralkohol (minuman keras), pelarut berbagai obat-obatan, untuk sterilisasi, untuk obat gosok (isopropil alkohol).
Asam Asetat
Asam asetat atau asam etanoat atau yang lebih dikenal asam cuka adalah senyawa kimia asam organik yang dikenal sebagai pemberi rasa asam dan aroma dalam makanan. Asam cuka memiliki rumus empiris CH3COOH atau CH3CO2H. Asam
alkanoat ini adalah asam-asam karboksilat yang rantai alkalinya jenuh. Asam asetat murni (disebut asam asetat glacial) adalah cairan higroskopis tak berwarna dengan titik beku 16,7 °C.
Pembuatannya juga bisa dengan mengoksidasi etanol.
CH3CH2OH + O2 → CH3COOH +H2O
Sifat-Sifat Asam Asetat
Sifat Fisik Sifat Kimia
Asam cuka berbentuk cairan berbau menyengat,
larut dalam air Bereaksi dengan basa membentuk garam
Jika berwujud padatan akan mengkilat
Garam-garam asam asetat yaitu asam aseton enceran, anhidrat dan glacial Asam Asetat anhidrat
Titik didihnya 118.5°C dan titik bekunya 16.7°C Sedikit terionisasi dengan air
Kegunaan Asam Asetat
Dalam kehidupan kita sehari-hari kegunaan asam cuka sangat banyak sekali yaitu,sebagai pelarut zat organik, untuk pengasaman bahan makanan, membuat berbagai ester, membuat tinta dan zat-zat warna dan propanol, sebagai bahan baku pembuatan polyvinyl acetate, yaitu bahan baku pembuatan lem kayu, Asam asetat juga digunakan dalam proses pembuatan pestisida dan masih banyak lagi.
BAHAN TAMBAHAN Asam Sulfat
Asam sulfat (H2SO4) merupakan asam mineral (anorganik) yang kuat. Zat ini larut dalam air pada semua perbandingan. Asam sulfat mempunyai banyak kegunaan dan merupakan salah satu produk utama industri kimia.
Asam sulfat murni yang tidak diencerkan, tidak dapat ditemukan secara alami di bumi oleh karena sifatnya yang higroskopis. Walaupun demikian, asam sulfat merupakan komponen utama hujan asam, yang terjadi karena oksidasisulfur dioksida di atmosfer dengan keberadaan air (oksidasi asam sulfit). Sulfur dioksida adalah produk sampingan utama dari pembakaran bahan bakar seperti batu bara dan minyak yang mengandung sulfur (belerang).
Sifat Fisika Sifat Kimia
Cairan tidak bewarna dan berbau asam Asam Sulfat encer tidak bereaksi dengan Hg, Cu
dan logam mulia
Merusak kulit dan jaringan tubuh seperti terkena luka bakar yang serius
Asam Sulfat pekat dalam keadaan panas akan mengoksidasikan logam-logam, sedangkan asam itu sendiri direduksikan menjadi (SO4)
Merangsang zat-zat organik (kayu, kertas, gula)
Kegunaan Asam Sulfat
Asam sulfat merupakan komoditas kimia yang sangat penting, , produksi asam sulfat suatu negara merupakan indikator yang baik terhadap kekuatan industri negara tersebut. Kegunaan asam sulfat, yaitu untuk memproduksi asam fosfat, yang digunakan untuk membuat pupuk fosfat dan juga trinatrium fosfat untuk deterjen. Asam sulfat juga digunakan dalam jumlah yang besar oleh industri besi dan baja untuk menghilangkan oksidasi, karat, dan kerak air sebelum dijual ke industri otomobil. Kegunaan asam sulfat lainnya yang penting adalah untuk pembuatan aluminium sulfat. Alumunium sulfat dapat bereaksi dengan sejumlah kecil sabun pada serat pulp kertas untuk menghasilkan aluminium karboksilat yang membantu mengentalkan serat pulp menjadi permukaan kertas yang keras. Aluminium sulfat juga digunakan untuk membuat aluminium hidroksida.
PRODUK Etil Asetat
Etil asetat adalah senyawa organik dengan rumus CH3CH2OC(O)CH3 atau
CH3COOC2H5. Senyawa ini merupakan ester dari etanol dan asam asetat.
Senyawa ini berwujud cairan, tak berwarna tetapi memiliki aroma yang khas. Etil asetat dapat melarutkan air hingga 30% dan larut dalam air hingga kelarutan 8% pada suhu kamar. Kelarutannya meningkat pada suhu yang lebih tinggi, namun senyawa ini tidak stabil dalam air mengandung basa atau asam. Etil asetat dapat dihirdolisis pada keadaan asam atau basa yang menghasilkan asam asetat dan etanol kembali. Katalis yang digunakan adalah asam sulfat (H2SO4), karena
stoiklometris, misalnya natrium hidroksida. Reaksi ini menghasilkan etanol dan natrium asetat yang tidak dapat di reaksi lagi dengan etanol.
Sifat-Sifat Etil Asetat
Sifat Fisika Sifat Kimia
Merupakan cairan tidak berwarna dan mudah
terbakar dengan bau yang khas Dapat dihidrolisis dengan air membentuk asam
karboksilat dan alkohol
Pada suhu tinggi berubah bentuk berupa minyak
dan lemak Tidak bereaksi dengan PCl3
Titik didihnya 77°C dan titik beku -84°C
Bereaksi dengan basa membentuk glisentida
Kegunaan Etil Asetat
Etil asetat digunakan sebagai pelarut dalam bahan cita rasa dan parfume.
METODE PROSES Distilasi
Distilasi merupakan teknik pemisahan yang didasari atas perbedaan perbedaan titik didik atau titik cair dari masing-masing zat penyusun dari campuran homogen. Dalam proses destilasi terdapat dua tahap proses yaitu tahap penguapan dan dilanjutkan dengan tahap pengembangan kembali uap menjadi cair atau padatan. Atas dasar ini maka perangkat peralatan destilasi menggunakan alat pemanas dan alat pendingin.
Proses destilasi diawali dengan pemanasan, sehingga zat yang memiliki titik didih lebih rendah akan menguap. Uap tersebut bergerak menuju kondenser yaitu pendingin, proses pendinginan terjadi karena kita mengalirkan air kedalam dinding (bagian luar condenser), sehingga uap yang dihasilkan akan kembali cair. Proses ini berjalan terus menerus dan akhirnya kita dapat memisahkan seluruh senyawa-senyawa yang ada dalam campuran homogen tersebut.
Macam-Macam Distilasi :
1. Distilasi Sederhana, prinsipnya memisahkan dua atau lebih komponen cairan berdasarkan perbedaan titik didih yang jauh berbeda.
baik, sehingga mampu memisahkan dua komponen yang memiliki perbedaan titik didih yang berdekatan.
3. Distilasi Azeotrop : memisahkan campuran azeotrop (campuran dua atau lebih komponen yang sulit di pisahkan), biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan azeotrop tersebut, atau dengan menggunakan tekanan tinggi.
4. Distilasi Kering : memanaskan material padat untuk mendapatkan fasa uap dan cairnya. Biasanya digunakan untuk mengambil cairan bahan bakar dari kayu atau batu bata.
5. Distilasi Vakum: memisahkan dua kompenen yang titik didihnya sangat tinggi, motede yang digunakan adalah dengan menurunkan tekanan permukaan lebih rendah dari 1 atm, sehingga titik didihnya juga menjadi rendah, dalam prosesnya suhu yang digunakan untuk mendistilasinya tidak perlu terlalu tinggi.
Kelebihan Destilasi :
1. Dapat memisahkan zat dengan perbedaan titik didih yang tinggi. 2. Produk yang dihasilkan benar-benar murni.
3. Sangat tepat digunakan untuk memisahkan larutan-larutan dalam bentuk homogen.
Kekurangan Destilasi :
1. Hanya dapat memisahkan zat yang memiliki perbedaan titik didih yang besar. 2. Biaya penggunaan alat ini relatif mahal.
3. Diperlukan energi yang besar dalam memanaskan larutan.
4. Dibutuhkan waktu yang lama untuk mendapatkan larutan dengan titik didih yang tinggi.
Campurkan 17 ml alkohol dan 17 ml asam asetat ke dalam labu distilasiTuangkan 80 ml alkohol dan 67 ml asam asetat ke dalam corong pemisah, lalu rangkai alat-alat distilasi
Panaskan oil bath hingga mencapai suhu 140OC Teteskan campuran yang berada dalam corong pemisah dengan perbandingan 3:1 (3 tetes corong pemisah : 1 tetes distilat)
Hasil distilat ditambahkan NaOH 20% sedikit demi sedikit hingga tidak memerahkan kertas lakmus biruPisahkan lapisan atas dan lapisan bawah yang terbentuk dengan corong pemisah
Lapisan atas dipisahkan kemudian dimasukkan ke dalam labu distilasi dengan ditambah sedikit CaCl2 Lakukan distilasi yang kedua untuk menghilangkan kandungan alkohol yang masih ada dalam larutan
Kemudian Etil asetat dipanaskan dengan fraksi suhu 77OC – 78OCHitunglah hasil presentasi praktis dan teoritisnya
A. ALAT :
1) Suatu labu alas bulat bervolume 0,5 L diberi tutup gabus yang berlubang dua 2) Dalam lubang pertama dimasukkan corong pemisah, sedang yang lainnya
dimasukkan sebuah pipa yang berhubungan dengan alat pendingin.
3) Labu diisi campuran 17 cc alkohol dan 17 cc asam sulfat kuat (dicampur dengan hati-hati)
4) Kemudian labu dipanaskan dalam pemanas minyak (oil bath) pada temperatur 140oC (termometer dimasukkan ke dalam minyak)
9) Kemudian kedua lapisan cairan yang terjadi dipisahkan memakai corong pemisah
10) Lapisan yang atas (yang mengandung estercuka) dikocok dengan CaCl2
exicatus untuk memisahkan alkohol yang masih ada
11) Kedua lapisan yang terjadi dipisahkan lagi dengan corong pemisah 12) Lapisan atas dimurnikan dengan jalan distilasi
13) Fraksi yang diambil adalah antara 77oC – 78oC
14) Hitung presentasi hasil praktis dan teoritis 15) Hasil praktis yang didapat ± 43 gram
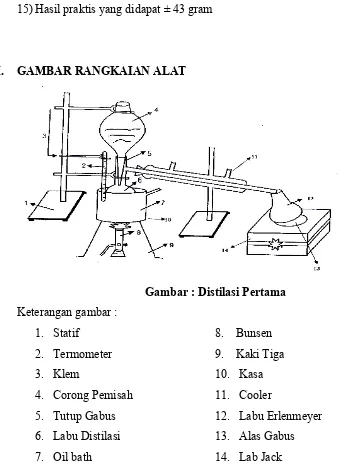
VIII. GAMBAR RANGKAIAN ALAT
Gambar : Distilasi Pertama Keterangan gambar :
1. Statif 8. Bunsen
2. Termometer 9. Kaki Tiga
3. Klem 10. Kasa
4. Corong Pemisah 11. Cooler
5. Tutup Gabus 12. Labu Erlenmeyer
6. Labu Distilasi 13. Alas Gabus
Gambar : Distilasi Akhir Keterangan gambar
1. Statif 7. Cooler
2. Klem 8. Labu Erlenmeyer
3. Termometer 9. Alas Gabus
4. Tutup Gabus 10. Lab. Jack
5. Labu Distilasi 6. Oil Bath
IX. DATA PENGAMATAN
Massa labu Erlenmeyer kosong 250 ml = 104,38 gram
Massa labu Erlenmeyer + Etil asetat = 145,20 gram
Volume Etil asetat = 48 ml
Mr Alkohol = 46 grammol
Mr Asam Asetat = 60 grammol
Mr Etil asetat = 88 grammol
X. PERHITUNGAN Diketahui :
Volume Alkohol = 17 ml + 80 ml = 97 ml
Volume H2SO4 = 17 ml
Volume As. Asetat = 67 ml
Densitas As. Asetat = 1,05 gramml
Massa Alkohol = Densitas Alkohol x Volume Alkohol
= 0,79 gramml x 97 ml
= 76,63 gram
Mol Alkohol = gramMr
=
76,63gram
46grammol = 1,665 mol
Massa As. Asetat = Densitas As. Asetat x Volume As. Asetat
= 1,05 gramml x 67 ml
= 70,35 gram
Mol As. Asetat = gramMr
=
70,35gram
60grammol = 1,173 mol
Penyelesaian :
C2H5OH + CH3COOH → CH3COOC2H5 + H2O
Mula-mula : 1,173 1,665 -
-Bereaksi : x x x x
Setimbang : 1,173 –x 1,665 – x x x
K = [CH3COOC2H5] [H2O]
[C2H5OH] [CH3COOH]
1
4 =
[x] [x]
[1,173−x] [1,665−x]
0,488 – 0,709x + 0,25x2 - x2 = 0
-0,75 x2 - 0,709 x + 0,488 = 0
0,75 x2 + 0,709 x - 0,488 = 0
X = −b ±
√
b2−4ac2a
X = −0,709±
√
0,7092−4x0,75x−0,4882x0,75
X = −0,7091,5±1,417
X1 = 0,472 X2 = 1,418
Secara Teoritis
Massa Etil asetat = 0,472 ml x 88 gramml = 41,527 gram
Secara Praktis
Massa Erlenmeyer + Etil asetat = 145,20 gram
Massa Erlenmeyer kosong = 104,38 gram -
Massa Etil asetat = 40,82 gram
% Rendeman Etil asetat = Massa Etil asetat praktisMassa Etil asetat teoritis x 100%
= 98,27 %
Volume Etilasetat praktis = 48 ml
Densitas Etil asetat = 40,8248mlgram
= 0,85 gramml
XI. PEMBAHASAN
17 ml alkohol dan 17 ml H2SO4 dicampurkan dalam labu distilasi
80 ml alkohol dan 67 ml asam cuka murni dituangkan dalam corong pemisah
Larutan dalam labu ditilasi dipanaskan mencapai suhu 140°C kemudian
teteskan larutan dari corong pemisah
Hasil distilat berwarna kuning bening (karena tabung erlenmeyer berkerak)
Larutan hasil distilat dikocok dengan NaOH 20% hingga lapisan atas tidak
memerahkan kertas lakmus biru
Lapisan atas dan lapisan bawah yang terbentuk dipisahkan dengan corong pemisah
Lapisan atas diberi tambahan CaCl2 (exicatus)
Kemudian larutan tersebut didistilat kembali dengan fraksi suhu 77°C - 78°C untuk memurnikan etil asetat
Distilat akhir dicapai pada suhu 75°C dengan hasil distilat berwarna bening
Bobot etil asetat yang didapat yaitu 40,82 gram
XI.KESIMPULAN
Etil asetat dapat dihasilkan dengan campuran etanol dan asam asetat dengan
reaksi esterifikasi dan metode distilasi sederhana.
XII.TUGAS
1. Analisis 5 Kesalahan
Kurangnya koordinasi antar anggota kelompok
Kecerobohan mengambil tindakan
Pada distilasi pertama terlalu banyak meneteskan Asam Asetat (tidak sesuai dengan perbandingan 3:1)
Suhu pemanasan Oil bath yang tidak konstan
Penambahan CaCl2 yang berlebihan
2. Mekanisme Pengikatan Etil Asetat
Mekanisme pengikatan reaksi etil asetat terdiri dari beberapa langkah:
1) Transfer proton dari katalis asam ke atom oksigen karbonil, sehingga meningkatkan elektrofilisitas dari atom karbon karbonil.
2) Atom karbon karbonil kemudian diserang oleh atom oksigen dari alkohol, yang bersifat nukleofilik sehingga terbentuk ion oksonium.
3) Terjadi pelepasan proton dari gugus hidroksil milik alkohol, menghasilkan kompleks teraktivasi
3. Jenis-Jenis Distilasi
Macam-Macam Destilasi :
1. Distilasi Sederhana : prinsipnya memisahkan dua atau lebih komponen cairan berdasarkan perbedaan titik didih yang jauh berbeda.
2. Distilasi Fraksionasi (Bertingkat) : sama prinsipnya dengan distilasi sederhana, hanya distilasi bertingkat ini memiliki rangkaian alat kondensor yang lebih baik, sehingga mampu memisahkan dua komponen yang memiliki perbedaan titik didih yang berdekatan.
3. Distilasi Azeotrop : memisahkan campuran azeotrop (campuran dua atau lebih komponen yang sulit di pisahkan), biasanya dalam prosesnya digunakan senyawa lain yang dapat memecah ikatan azeotrop tersebut, atau dengan menggunakan tekanan tinggi.
4. Distilasi Kering : memanaskan material padat untuk mendapatkan fasa uap dan cairnya. Biasanya digunakan untuk mengambil cairan bahan bakar dari kayu atau batu bata.
5. Distilasi Vakum : memisahkan dua kompenen yang titik didihnya sangat tinggi, motede yang digunakan adalah dengan menurunkan tekanan permukaan lebih rendah dari 1 atm, sehingga titik didihnya juga menjadi rendah, dalam prosesnya suhu yang digunakan untuk mendistilasinya tidak perlu terlalu tinggi. 6. Distilasi Uap : istilah yang secara umum digunakan untuk destilasi campuran
air dengan senyawa yang tidak larut dalam air, dengan cara mengalirkan uap air ke dalam campuran sehingga bagian yang dapat menguap berubah menjadi uap pada temperatur yang lebih rendah dari pada dengan pemanasan langsung. Untuk destilasi uap, labu yang berisi senyawa yang akan dimurnikan dihubungkan dengan labu pembangkit uap (lihat gambar alat destilasi uap). Uap air yang dialirkan ke dalam labu yang berisi senyawa yang akan dimurnikan, dimaksudkan untuk menurunkan titik didih senyawa tersebut, karena titik didih suatu campuran
4. Mekanisme Pengikatan Katalis
Sebagai asam, asam sulfat bereaksi dengan kebanyakan basa menghasilkan garam sulfat. Sebagai contoh, garam tembaga (II) sulfat dibuatdari reaksi antaratembaga (II) oksida dengan asam sulfat.
CuO + H2O4→ CuSO4 + H2O
Asam sulfat juga juga dapat digunakan untuk mengasamkan garam dan menghasilkan asam yang lebih lemah. Reaksi antara natrium asetat dengan asam sulfatakan menghasilkan asam asetat dan natrium bisulfat:
H2SO4 + CH3COONa → NaHSO4 + CH3COOH
Hal yang sama juga berlaku apabila mereaksikan asam sulfat dengan kalium nitrat. Reaksi ini akan menghasilkan asam nitrat dan endapan kalium bisulfat. Ketika dikombinasikan dengan asam nitrat, asam sulfat berprilaku sebagai asam sekaligus zat pendehidrasi membentuk ion nitronium NO2- yang penting dalam
reaksi nitrasi yang melibatkan substitusi aromatik elektrofilik. Reaksi jenis ini sangatlahpenting dalam kimia organik.
Asam sulfat bereaksi dengan kebanyakan logam via reaksi penggantian tunggal menghasilkan gas hidrogen dan logam sulfat. H2SO4 encer menyerang
besi, alumunium, seng, mengan, magnesium, dan nikel. Namun reaksi dengan timah dan tembaga memerlukan asam sulfat yang panas dan pekat. Timbal dan tungsten tidak bereaksi dengan asam sulfat. Reaksi antara asam sulfat dengan logam biasanya akan menghasilkan hidrogen seperti yang ditunjukan pada persamaan di bawah ini. Namun, reaksi dengan timah akan menghasilkan sulfur dioksida daripada hidrogen.
Fe(s) + H2SO4(aq)→ H2(g) + FeSO4(aq)
Sn(s) + 2 H2SO4(aq)→ SnSO4(aq) + 2 H2O(l) + SO2(g)
Proses Fischer-Tropsch adalah reaksi katalisasi kimia pada sintesis gas, dimana senyawa hidrokarbon disintesis melalui pencampuran hidrogen dan karbon monoksida melaui permukaan logam transisi. Pada proses Fischer-Tropsch ini dapat mengkonversi berbagai macam bahan bakar menjadi hidrokarbon cair dalam berbagai bentuk.
Pada proses Fischer-Tropsch, senyawa hidrokarbon disintesis melalui pencampuran hidrogen dan karbon monoksida melaui permukaan logam transisi. Dimana reaktan awal (sintesis gas) yang digunakan dalam proses Fischer-Tropsch adalah gas hidrogen (H2) dan karbon monoksida (CO) menghasilkan sebuah
produk hidrokarbon cair yang dapat digunakan sebagai bahan bakar pengganti.Proses ini telah menerima perhatian baru dari berbagai kalangan untuk memproduksi bahan bakar diesel rendah belerang untuk meminimalkan kerusakan lingkungan dari penggunaan mesin diesel dan mengurangi emisi gas karbon dioksida di udara.
Tujuan utama dari proses ini adalah untuk menghasilkan minyak sintetik pengganti, biasanya dari batu bara, gas alam atau biomassa, untuk digunakan sebagai minyak pelumas sintetik atau sebagai bahan bakar sintetik karena seiring penggunaan diesel meningkat dalam beberapa tahun terakhir. Bahan bakar sintetik ini dapat digunakan pada truk, mobil, dan beberapa mesin pesawat terbang. Kombinasi gasifikasi biomassa (BG) dan sintesis Fischer-Tropsch (FT) adalah sebuah cara alternatif untuk memproduksi bahan bakar transportasi terbarukan (biofuels).
Proses Fischer-Tropsch yang melibatkan proses berbagai persaingan reaksi kimia, yang menghasilkan sejumlah produk sampingan yang diinginkan dan yang tidak diinginkan. Yang paling penting adalah reaksi yang dihasilkan dalam bentuk alkana. Selain bentuk alkana, reaksi juga menghasilkan bentuk alkena, alkohol dan hidrokarbon oksigenasi lainnya. Biasanya, jumlah produk non-alkana yang dihasilkan hanya relatif kecil, meskipun katalis pendukung dari beberapa produk tersebut telah dikembangkan.
Dekatasi adalah proses pemisahan zat pada yang tidak ikut terlarut di dalam pelarutnya dengan cara dituangkan, sehingga akibatnya cairan tersebut akan terpisah dari zat padat yang tercampur. Kalau bicara tentang dekantasi pasti akan berkaitan dengan kristalisasi, filtrasi, ekstraksi, dan juga sublimasi. Karena beberapa istilah tersebut digunakan untuk mendefinisikan cara-cara pemisahan campuran dari bahan pencampurnya. Faktor yang mempengaruhi kelarutan endapan:
Suhu
pH
Efek garam
Kompleksasi
Derajat supersaturasi
Sifat pelarut
XIII. DAFTAR PUSTAKA
Fessenden dan Fessenden.. Kimia Organik Edisi Ketiga Jilid I.1986. Jakarta : Erlangga.
2014.”Buku penuntunpraktikum Teknik Kimia III”.Jakarta: Universitas Muhammadiyah Jakarta.
2014.”Ilmu Kimia Organik 2 Sekolah Menengah Farmasi”,Jakarta.Anshory Irfan.2000.”Kimia 2 SMU”.Jakarta: Erlangga
Fesenden.”Kimia Organik Jilid I”.