PENGARUH PENAMBAHAN Mn
2+DAN Mg
2+PADA MEDIA STONE
MINERAL SALT SOLUTION EXTRACT YEAST (SMSSe) TERHADAP
KINERJA ISOLAT BAKTERI DM-5
Nida Sopiah
1, La Ode Sumarlin
2, S. Hermanto
2, Zakki R. Mubarok
2Balai Teknologi Lingkungan (BTL), BPPT Serpong1 UIN Syarif Hidayatullah Jakarta2
ABSTRAK
Bioremediasi adalah salah satu upaya untuk mengurangi pencemaran minyak bumi dengan menggunakan mikroorganisme. Mikroorganisme yang digunakan dalam penelitian ini adalah isolat bakteri hidrokarbonoklastik berbentuk konsorsium. Tujuan dari penelitian ini adalah mengetahui pengaruh logam Mg2+ dan Mn2+ terhadap aktivitas bakteri yang dapat meningkatkan laju biodegradasi yang dilihat dari penurunan pH, kadar minyak bumi tersisa metode gravimetri, dan senyawa penyusun minyak bumi hasil biodegradasi (GCMS). Media yang digunakan adalah Stone Mineral Salt SolutionExtract Yeast (SMSSe) dengan variasi konsentrasi ion logam Mg2+ (100, 150, 200 ppm) dan Mn2+ (1, 5, 10 ppm). Perlakuan terbaik untuk penambahan ion mangan adalah pada media Mn-2 dengan persentase degradasi sebesar 90,54% dengan pH akhir sebesar 5,63 sedangkan media Mn-1 dan Mn-3 sebesar 85,26 % dan 86,42% dengan pH akhir sebesar 5,98 dan 5,76. Perlakuan terbaik untuk penambahan ion magnesium adalah pada media Mg-1 dengan persentase degradasi sebesar 69,37% dengan pH akhir sebesar 6,08 sedangkan media Mg-2 dan Mg-3 sebesar 36,52% dan 28,73% dengan pH akhir sebesar 6,35 dan 6,52.
Kata kunci : kofaktor, bioremediasi, minyak bumi, laju biodegradasi, bakteri hidrokarbonoklastik.
1. Pendahuluan
Minyak bumi adalah hasil alam yang hingga saat ini masih dieksploitasi sebagai sumber energi bahan bakar dan listrik sehingga lingkungan disekitar pengeboran minyak sangat mudah terkontaminasi (Notodarmojo, 2005). Pemulihan lingkungan yang tercemar ini memerlukan biaya yang sangat tinggi untuk pengangkutan dan pengadaan energi guna memulihkan materi yang tercemar seperti pembakaran (insinerasi) ataupun perlakuan kimia. Kelemahan teknik ini dapat membahayakan lingkungan beserta ekosistemnya. Salah satu alternatif pengolahan minyak tercemar yang aman adalah dengan memanfaatkan bioteknologi berupa teknik bioremediasi. Keunggulan teknik bioremediasi ini adalah menghilangkan kontaminan dengan biaya murah tanpa merusak materi terkontaminasi sehingga aman bagi lingkungan (Notodarmojo, 2005).
Sebelum suatu teknik bioremediasi diaplikasikan, polutan yang akan didegradasi dan potensi mikroorganisme harus sudah diketahui. Untuk itu sebelumnya perlu dilakukan pengujian yang terkait dengan laju biodegradasi pada suatu fungsi lingkungan tertentu. Menurut Madigan et al., (1997) bahwa untuk meningkatkan laju
biodegradasi salah satunya adalah nutrien tanah (C, N, P dan logam sebagai nutrisi dan kofaktor) yang dapat meningkatkan aktivitas mikroorganisme dalam mendegradasi minyak bumi. Hal ini didukung pula oleh penelitian Irianto (2000) bahwa tanah yang tercemar toluen (hidrokarbon aromatik) yang dicampurkan dalam media pertumbuhan yang diinkubasi selama 3 minggu lebih cepat
monooksigenase dalam proses biodegradasi hidrokarbon (Atlas & Bartha, 1992). Media Stone Mineral Salt Solution Extract Yeast (SMSSe) digunakan karena media ini sangat cocok bagi mikroorganisme jenis hidrokarbonoklastik. Hal ini sesuai dengan penelitian oleh Rani & Kadarwati bahwa media SMSSe memiliki nutrisi potensial bagi bakteri hidrokarbonoklastik. yang menghasilkan biosurfaktan dan biosolven. Namun aktivitas mikroorganisme ini bergantung pada jumlah kandungan dan keseimbangan nutrien yang ada sehingga perlu diteliti lebih lanjut kandungan nutrien yang tepat bagi bakteri hidrokarbonoklastik. Kondisi optimum bakteri ini akan meningkatkan aktivitas bakteri dalam mendegradasi minyak bumi secara menyeluruh yang dapat dilihat dari interpretasi kromatogram menggunakan GC-MS.
2. Metode Penelitian
Alat dan Bahan. Dalam penelitian ini digunakan pH meter, spektrofotometer UV-Vis Jasco V-530, Spektrofotometer Serapan Atom (SSA) Shimadzu
AA-6800F, GCMS Agilent technology 6890N network GC System sedangkan bahan berupa media NA, NB, dan SMSSe, isolat bakteri terseleksi (Konsorsium) yang berasal dari bongkaran bioremediasi drilling mud, sampel tanah yang berasal dari BTL, HCl p.a, HNO3 p.a, aquades,
alkohol 70%, spirtus, dan alumunium foil, n-heksan p.a, larutan standar ion logam Mg dan Mn 1000 ppm.
Sterilisasi Alat dan Media. Alat-alat yang digunakan dibersihkan dan Media NA, NB, serta SMSSe yang telah dibuat lalu disterilkan dengan menggunakan autoklaf pada suhu 121oC dan tekanan 2 atm selama 15 menit. Peralatan yang tidak tahan panas dapat disterilkan dengan menggunakan alkohol 70%. Komposisi pada masing-masing media dapat dilihat pada Lampiran 1, 2, 3.
Persiapan Tanah. Sampel tanah dikeringanginkan kemudian dipisahkan akar-akar maupun sisa tanaman, kerikil, dan kotoran lainnya. Sampel tanah ditumbuk pada lumpang porselen dan diayak dengan ayakan dengan ukuran lubang < 0,5 mm.
Destruksi Tanah dengan Metode Pengabuan Basah. Sebanyak 0,5 g sampel tanah ukuran < 0,5 mm ditimbang dan dimasukkan ke dalam erlenmeyer 250 mL. Lalu ditambahkan 5 mL HNO3
p.a dan 0,5 mL HCl p.a. dan dibiarkan semalam. Setelah itu dipanaskan dengan suhu 1000C selama satu jam. Suhu ditingkatkan lagi menjadi 1500C. Setelah uap kuning habis, suhu ditingkatkan lagi menjadi 2000C. Destruksi selesai setelah keluar asap putih dan sisa ekstrak kurang lebih 0,5 mL.
Erlenmeyer diangkat dan dibiarkan dingin. Ekstrak diencerkan dengan aquades hingga volume tepat 50 mL dan dikocok hingga homogen (Juknis Balitanah).
Analisis Kofaktor Tanah. Ekstrak kemudian dianalisa dengan menggunakan SSA dengan deret standar masing-masing sebagai pembanding kemudian dihitung dengan kadar Mg2+, Mn2+, Co2+, Cu2+, Zn2+, Ca2+ dengan persamaan :
ppm = ppm kurva x mL ekstrak 1000 mL-1 x 1000 g sampel-1
Peremajaan Isolat dan Pembuatan Laju Pertumbuhan Isolat Bakteri DM-5. Sebanyak 100 ml media Nutrient Broth (NB) dimasukkan ke dalam 2 buah Erlenmeyer 250 mL. Lalu disterilisasi pada suhu 120 0C dan tekanan 2 atm dalam autoklaf selama 15 menit. Setelah didinginkan, diinokulasi isolat sebanyak 1 ose secara aseptik ke dalam media tersebut dan Erlenmeyer yang pertama dihitung absorbansinya setiap jam dengan menggunakan spektrofotometer UV-Vis pada panjang gelombang 620 nm dengan NB steril sebagai blanko terhitung pada saat inokulasi 1 ose (dianggap 0 jam). Pada saat yang sama dilakukan TPC (Total Plate Count) dengan estimasi kepadatan bakteri antara 104,106,108 sel/mL sedangkan erlenmeyer yang lain disimpan dalam
Shacker Inkubator dengan kecepatan 100 rpm pada suhu 270C hingga mencapai fase eksponensial.
Uji Pengaruh Kofaktor terhadap Aktivitas Bakteri DM-5 dalam Mendegradasi Minyak Bumi. Sebanyak 1 mL isolat bakteri yang telah mencapai fase eksponensial dimasukan ke dalam medium SMSSe steril masing-masing 50 mL. Kemudian ditambahkan minyak Bumi 1% dan ditambahkan masing-masing logam Mn2+ (1 ppm, 5 ppm, 10 ppm) dan logam Mg2+ (100 ppm, 150 ppm, 200 ppm) ke dalam Erlenmeyer yang berbeda. Berikut adalah pemberian kode untuk masing-masing perlakuan agar memudahkan dalam penyebutan :
SMSSe Standar : Minyak Bumi 1%. SMSSe Kontrol : Minyak Bumi 1%+ Isolat. Mg-1:Minyak Bumi 1%+ Isolat+Mg 100 ppm. Mg-2:Minyak Bumi 1%+ Isolat + Mg 150 ppm. Mg-3:Minyak Bumi 1%+ Isolat+ Mg 200 ppm. Mn-1:Minyak Bumi 1%+ Isolat+ Mn 1 ppm. Mn-2:Minyak Bumi 1%+ Isolat+ Mn 5 ppm. Mn-3:Minyak Bumi 1%+ Isolat+ Mn 10 ppm.
Analisis Kadar Minyak Bumi Secara Gravimetri. Erlenmeyer yang berisi medium SMSSe hasil perlakuan dimasukkan ke dalam corong pisah dan ditambahkan 60 mL n-heksan p.a. Kemudian dikocok selama ± 15 menit lalu didiamkan sampai n-heksan terpisah. Terdapat 2 fase yaitu fase air serta fase campuran n-heksan dengan minyak bumi. Kemudian lapisan air dipisahkan dari campuran tersebut sedangkan lapisan minyak bumi yang terekstrak dalam n-heksan ditampung dalam gelas piala 100 mL.(telah diketahui bobotnya) melalui proses filtrasi menggunakan kertas saring yang telah diolesi Na2SO4 sekitar 0,5 gram. Gelas piala tersebut
dipanaskan pada suhu 70oC sampai n-heksan habis menguap dan yang tersisa hanya minyak. Gelas piala tersebut diangkat dan didiamkan sampai dingin lalu ditimbang dan dicatat Bobotnya. Prosedur yang sama dilakukan juga untuk kontrol (tanpa penambahan kofaktor) dan standar (tanpa penambahan isolat dan kofaktor).
Dihitung kadar minyak bumi dengan cara : Kadar minyak (g) = (W2 – W1)
Keterangan: W1 = berat gelas kimia kering (g)
W2 = berat gelas kimia dengan kadar
minyak yang diperoleh (g)
Analisis Senyawa dengan GC-MS. Minyak bumi tersisa (fraksi kering) yang diperoleh dari hasil fraksinasi diambil sebanyak 1 mg lalu dilarutkan dengan pelarut yang sesuai sebanyak 1 ml. Pelarut yang digunakan untuk fraksi hidrokarbon jenuh dan aromatik adalah n-heksan. Setelah semua fraksi tersebut larut kemudian diambil sebanyak 1 l dengan syring dan diinjeksikan ke dalam alat GC-MS yang telah disiapkan. Berikut adalah kondisi pengoperasian GC-MS (parameter pengujian) saat analisis sampel:
3. Hasil dan Pembahasan
Bakteri hidrokarbonoklastik yang digunakan dalam penelitian ini adalah isolat bakteri DM-5 yang berbentuk konsorsium. Sebelum ditambahkan ke media pertumbuhan, isolat bakteri diremajakan terlebih dahulu pada media nutrient agar (NA) untuk mendapatkan bakteri yang aktif kemudian dilakukan enrichment pada media
nutrient broth (NB) untuk mengetahui laju
pertumbuhan isolat bakteri yang tersaji pada kurva berikut :
Gambar 1. Kurva Pertumbuhan Isolat Bakteri DM-5
Laju pertumbuhan isolat DM-5 pada kurva di atas menunjukan bahwa fase lag terjadi pada jam ke-0 hingga jam ke-5 yang dapat dilihat dari kenaikan nilai absorbansi yang lambat dalam waktu yang lama (5 jam). Hal ini disebabkan oleh isolat bakteri DM-5 sedang melakukan penyesuaian (adaptasi) dalam sebuah media baru. Populasi Isolat bakteri DM-5 pada fase lag ini mencapai 1,883 109 sel/mL (Lampran 9). Jam ke-6 hingga jam ke-10 menunjukkan kenaikan nilai absorbansi yang semakin tinggi dalam waktu yang singkat (4 jam). Hal ini disebabkan tingginya aktivitas dan bertambahnya jumlah populasi isolat bakteri DM-5 (2,67 109-1,6 1012 sel/mL) yang dapat dilihat dari kekeruhan pada media dan nilai TPC yang semakin tinggi (fase eksponensial). Hal ini dukung pula oleh penelitian Jamilah (2005) dan Styani (2008) bahwa ada hubungan linear antara absorbansi dengan populasi isolat bakteri dimana cahaya yang melewati suspensi larutan akan diserap oleh sel-sel bakteri dan akan terbaca oleh alat. Dengan kata lain semakin besar nilai absorbansi larutan maka jumlah isolat pun bertambah yang terbukti dengan larutan yang semakin keruh dan nilai TPC semakin besar. Pada jam ke-11 dan ke-13 terjadi fase stationer dimana kenaikan nilai absorbansi terjadi secara perlahan dan hampir sama (1,5238-1,5343) yang menyatakan bahwa jumlah sel yang tumbuh hampir sama dengan jumlah sel sel yang mati.
Setelah mengetahui fase eksponensial isolat bakteri DM-5 pada jam ke-10 di atas maka isolat baru bisa ditambahkan ke dalam media pertumbuhan. Media pertumbuhan yang digunakan dalam penelitian ini adalah media Stone Mineral Salt SolutionExtract Yeast (SMSSe) karena media ini sangat cocok bagi mikroorganisme jenis hidrokarbonoklastik. Hal ini sesuai dengan penelitian oleh Rani & Kadarwati bahwa media SMSSe memiliki nutrisi potensial bagi bakteri hidrokarbonoklastik. yang menghasilkan biosurfaktan dan biosolven. Selain itu ditunjang juga dengan penelitian oleh Nugroho (2007) juga
Parameter Keterangan
Kolom
Agilent 19091S-436 HP-5MS, 0.25 mm x 6 m x 0.25 um
Gas
Pembawa/Carrier Helium at 25 cm/sec, measured 300 0C
Oven 40 0C
Injektor Splitless, 300 0C
Detektor MSD, 250 0C
Laju Alir 52.6 mL/min
0 0.2 0.4 0.6 0.8 1 1.2 1.4 1.6 1.8
0 2 4 6 8 10 12 14
Waktu (Jam)
A
b
so
rb
a
n
5 5.2 5.4 5.6 5.8 6 6.2 6.4 6.6 6.8 7 7.2
1 2 3 4 5 6 7
Waktu (Hari)
p
H
SMSSe Standar (Minyak)
SMSSe Kontrol (Minyak+Isolat)
Mn-1(Minyak+Isolat+Mn 1 ppm)
Mn-2(Minyak+Isolat+Mn 5 ppm)
Mn-3(Minyak+Isolat+Mn 10 ppm)
5.4 5.6 5.8 6 6.2 6.4 6.6 6.8 7 7.2
1 2 3 4 5 6 7
Waktu (Hari)
p
H
SMSSe Standar (Minyak) SMSSe Kontrol (Minyak+Isolat) Mg-1 (Minyak+Isolat+Mg 100 ppm)
Mg-2 (Minyak+Isolat+Mg 150 ppm)
Mg-3 (Minyak+Isolat+Mg 200 ppm)
menggunakan media SMSSe untuk mempelajari dinamika bakteri hidrokarbonoklastik berbentuk konsorsium.
Analisa Kofaktor Tanah. Pengelolaan lingkungan dengan teknik bioremediasi pada lahan yang tercemar minyak bumi seperti landfarming, biopile, dan lainnya membutuhkan waktu yang relatif lama dalam proses biodegradasi. Sehingga dibutuhkan suatu teknik biostimulasi (skala laboratorium) sebagai langkah awal untuk mengetahui kofaktor yang berpengaruh dalam mempercepat proses biodegradasi. Telah diketahui bahwa dalam tanah terdapat beberapa logam (dalam bentuk ionnya) yang berpotensi sebagai kofaktor antara lain : Fe2+ , Fe3+, Co2+, Cu2+, Mg2+, Mn2+, Ca2+, dan Zn2+ (Watts, 1997). Namun dalam penelitian ini kandungan ion logam pada sampel tanah hanya berfokus pada ion logam Ca2+, Mg2+, Mn2+, Zn2+,Co2+, dan Cu2+ yang dapat dilihat pada tabel berikut :
Tabel 1. Kandungan Ion Logam pada Sampel Tanah
Hasil analisis ini menunjukkan bahwa kadar Cu2+, Co2+, dan Zn2+ di dalam sampel tanah paling rendah dibanding logam lainnya. Oleh karena itu, ketiga logam tersebut diduga bukan kofaktor yang mempengaruhi proses biodegradasi minyak bumi sehingga tidak digunakan dalam penelitian. Ion logam Ca2+ pun tidak ditambahkan dalam media karena jumlahnya dirasa cukup mengingat dalam media SMSSe sendiri terdapat CaCO3 dengan konsentrasi 5000 ppm dan untuk
Ca2+ sendiri dalam media sebesar 2000 ppm. Sedangkan dalam tanah, kadar ion logam Mg2+ dan Mn2+ ini termasuk besar sehingga kedua logam ini dipilih untuk ditambahkan dalam media (dalam bentuk ion) dan divariasikan konsentrasinya (variabel tidak tetap) untuk mengetahui kondisi optimum yang dibutuhkan oleh bakteri hidrokarbonoklastik. Selain itu alasan lain kedua logam ini dipilih karena fungsi kedua logam yang berbeda dalam proses metabolisme bakteri. Ion logam Mn2+ berfungsi sebagai akseptor elektron yang pada akhirnya akan mempertahankan jumlah bakteri hidrokarbonoklastik (Notodarmojo, 2005) sedangkan ion logam Mg2+ berfungsi sebagai
stimulus yang dapat menstimulasi keluarnya enzim ekstraseluluer seperti enzim lipase (Aisaka & Terada, 1979) sehingga diharapkan kedua logam ini dapat berpengaruh terhadap laju biodegrasi minyak bumi.
Pengaruh Penambahan Ion Logam Mn2+ dan Mg2+ terhadap Perubahan pH Media SMSSe.
Perubahan pH menandakan bahwa dalam media tersebut terjadi proses biodegradasi minyak bumi menjadi metabolit-metabolit asam. Besarnya penurunan pH berbeda-beda bergantung pada besarnya persentase biodegradasi dan bakteri pendegradasinya. Penurunan pH berbeda-beda pada
masing-masing media perlakuan dengan
penambahan ion mangan yang tersaji pada gambar berikut :
Gambar 2. Pengaruh penambahan Mn2+ terhadap perubahan
pH
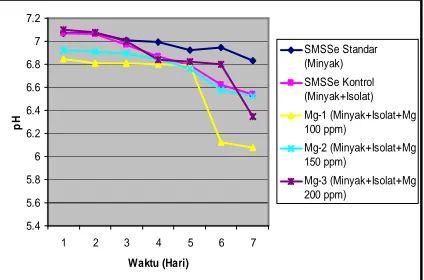
Hasil penelitian menunjukan bahwa penurunan pH terbesar ada pada media Mn-2 (6,57-5,63) sedangkan penurunan pH terkecil ada pada media Mn-1 (6,97-5,98), SMSSe kontrol (7,07-6,54) dan SMSSe standar (7,07-6,83). Sedangkan pada media dengan penambahan ion magnesium penurunan pH tidak terlalu tinggi seperti media dengan penambahan ion mangan yang dapat dilihat pada gambar berikut :
Gambar 3. Pengaruh penambahan Mg2+ terhadap perubahan
pH
No Nama Logam Konsentrasi dalam
Tanah, mg/kg
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
K
a
d
a
r
M
in
y
a
k
B
u
m
i
T
er
si
sa
%
(b
/v
)
Mn-1 Mn-2 Mn-3 Blanko Standar
Media Perlakuan
Hasil penelitian menunjukkan penurunan pH yang signifikan yang terjadi pada hari ke-6 dan ke-7 (Gambar 16). Media dengan penurunan pH terbesar adalah media Mg-1 (dari 6,85 menjadi 6,08), sedangkan penurunan pH terkecil adalah media Mg-3 (dari 6,92 menjadi 6,52). Jika dibandingkan dengan kontrol, penurunan pH yang terjadi hampir sama dengan media Mg-3 (7,07-6,54). Penurunan pH yang relatif tinggi pada media Mn-2 dan Mg-1 ini menandakan bahwa pada media ini terjadi peningkatan aktivitas isolat bakteri DM-5 dalam mendegradasi minyak bumi sehingga asam-asam organik dan asam-asam lemak yang dihasilkanpun semakin bertambah. Asam lemak dan asam-asam organik ini akan mengalami reaksi ionisasi menghasilkan H+ dan basa konjugasi. Semakin tinggi konsentrasi H+ yang dihasilkan dari metabolit asam tersebut maka semakin turun nilai pH media SMSSe. Sehingga dapat dikatakan pada media Mn-2 dan Mg-1 memiliki konsentrasi H+ yang lebih tinggi dibandingkan media perlakuan lainnya.
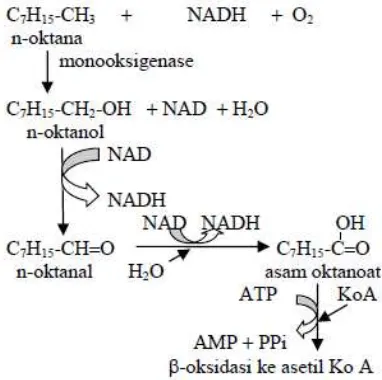
Dalam proses biodegradasi alkana seperti oktakosan (C28H58) akan teroksidasi pada gugus
metil terminal membentuk alkohol primer dengan bantuan enzim monooksigenase. Alkohol akan dioksidasi lebih lanjut menjadi aldehida, kemudian asam organik dan akhirnya dihasilkan asam lemak. Asam organik dan asam lemak inilah yang pada akhirnya akan menurunkan pH media Reaksi lengkap dapat dilihat pada gambar di bawah ini :
Gambar 4. Reaksi Biodegradasi Alkana (Atlas & Bartha, 1998)
Metabolit-metabolit asam yang dihasilkan biasanya berupa senyawa aldehid dan asam karboksilat yang kemudian terionisasi dengan bantuan air yang terkandung dalam media
pertumbuhan. Berikut adalah reaksi ionisasi metabolit asam yang dihasilkan pada proses biodegradasi Jadi semakin banyak metabolit-metabolt asam yang dihasilkan maka konsentrasi H+ dalam media akan semakin tinggi sehingga pH menurun. Sehingga dapat dikatakan bahwa konsentrasi H+ pada media Mn-2 dan Mg-1 lebih tinggi jika dibandingkan dengan media 1, Mn-3, Mg-2, Mg-3 SMSSe standar dan kontrol.
Pengaruh Penambahan Ion Logam Mn2+ dan Mg2+ terhadap Perubahan Kadar Minyak Tersisa pada Media SMSSe. Selain perubahan pH, laju biodegradasi dapat pula ditunjukan dari penurunan kadar minyak bumi tersisa. Pada media dengan penambahan ion mangan terlihat bahwa nilai kadar minyak bumi tersisa lebih rendah (media Mn-1= 0,0726%, media Mn-2=0,0466%, media Mn-3=0,0669%) (Gambar 15) jika dibandingkan dengan kontrol (0,4366%) dan standar (0,4926%).
Gambar 5. Pengaruh Penambahan Mn2+ terhadap Laju Biodegradasi
Media dengan penambahan ion mangan dapat menurunkan pH dan minyak bumi tersisa lebih rendah yang berarti efesiensi biodegradasi meningkat jika dibandingkan dengan media kontrol dan media standar. Hal ini disebabkan oleh ion mangan dalam proses biodegradasi akan digunakan sebagai akseptor elektron apabila ketersedian oksigen berkurang. Sesuai dengan penelitian Irianto (2000) bahwa terjadi penurunan nilai BOD (Biologycal Oxygen Demand) selama waktu inkubasi pada tiap minggunya. BOD adalah jumlah oksigen yang akan digunakan oleh bakteri dalam proses biodegradasi. Dengan adanya NO3
dari NH4NO3
-, Mn2+ dari MnCl2.2H2O yang teroksidasi
menjadi Mn4+, SO4 2-
dari MgSO4 dalam media
SMSSe maka kekurangan oksigen dalam proses biodegradasi dapat digantikan oleh akseptor elektron lainnya dengan urutan sebagai berikut :
O2 NO3
Mn4+ Fe3+ SO4
CO2
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4 0.45 0.5
K
a
d
a
r
M
in
y
a
k
B
u
m
i
T
er
si
sa
%
(b
/v
)
Mg-1 Mg-2 Mg-3 Blanko Standar
Media Perlakuan
Jadi dengan ditambahkannya ion mangan pada media Mn-1, Mn-2, Mn-3 menyebabkan
proses biodegradasi akan cenderung
mempertahankan jumlah sel bakteri
hidrokarbonoklastik yang sebagian besar membutuhkan oksigen (aerob). Sedangkan pada media SMSSe kontrol yang tidak ditambahkan ion mangan menyebabkan proses biodegradasi berlangsung lambat. Hal ini kemungkinan
disebabkan oleh jumlah sel bakteri
hidrokarbonoklastik yang berkurang akibat kekurangan ketersediaan oksigen sehingga aktivitas bakteri menurun dan jumlah metabolit-metabolit asam yang dihasilkan juga akan menurun.
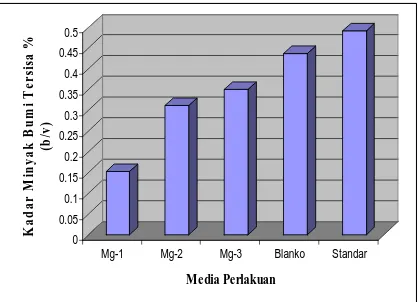
Dari ketiga media yang ditambahkan ion mangan, media perlakuan terbaik ada pada media Mn-2 yang dapat dilihat dari penurunan pH dan persentase biodegradasi yang paling tinggi (90,54%) dibandingkan media Mn-1 (85,26%) dan Mn-3 (86,4%2). Hal ini kemungkinan disebabkan pada media Mn-1 dengan penambahan ion mangan 1 ppm hanya dapat mempertahankan jumlah bakteri dalam waktu yang singkat dan selanjutnya akseptor elektron akan bergeser ke arah anaerob. Dengan kata lain jumlah bakteri hidrokarbonoklastik akan menurun dan biodegradasi akan berjalan lambat. Sedangkan pada media Mn-3 dengan penambahan ion mangan 10 ppm terjadi kenaikan pH dan kadar minyak tersisa yang masih tinggi jika dibandingkan media Mn-2. Hal ini disebabkan oleh aktivitas bakteri DM-5 menurun akibat ion mangan dalam media terlalu besar. Hal ini sesuai dengan Notodarmojo (2005) yaitu jika jumlah suatu logam itu sendiri melebihi kemampuan penggunaan mikroorganisme itu sendiri maka logam tersebut dapat bersifat toksik sehingga akan mengganggu aktivitas mikroorganisme pada media. Sedangkan dengan penambahan ion logam magnesium memiliki kadar minyak tersisa yang lebih tinggi jika dibandingkan dengan media dengan penambahan ion mangan namun masih di bawah kadar minyak tersisa media SMSSe kontrol yang tersaji pada gambar berikut :
Gambar 6. Pengaruh Mg2+ terhadap Laju Biodegradasi
Minyak Bumi
Hasil penelitian menunjukkan bahwa kadar minyak bumi tersisa yang terkecil ada pada media Mg-1 sebesar 0,1509% dengan persentase biodegradasi sebesar 69,37% sedangkan sisa minyak terbesar ada pada media media 3 sebesar 0,3511% dengan persentase biodegradasi sebesar 28,73%. Minyak tersisa pada media Mg-1 relatif lebih rendah jika dibandingkan dengan media Mg-2, Mg-3, dan SMSSe kontrol. Hal ini disebabkan oleh aktivitas isolat bakteri DM-5 yang meningkat pada media Mg-1 dan diduga menghasilkan enzim lipase yang lebih banyak sehingga menyebabkan minyak bumi lebih cepat terdegradasi. Hal ini disebabkan oleh pada media dengan penambahan magnesium aktivitas bakteri pun meningkat karena ion Mg dapat menstimulai pelepasan enzim ekstraseluler seperti lipase dari dinding sel (Aisaka & Terada, 1979). Lipase adalah enzim ekstraseluler yang dapat mengoksidasi senyawa lipid. Jadi semakin banyak jumlah enzim lipase maka akan membantu enzim monooksigenase yang aktif akibat adanya akseptor elektron seperti oksigen, NO3,
Mn2+, SO4
dalam mendegradasi hidrokarbon. Biodegradasi dengan penggunaan enzim ekstraseluler ini melalui jalur sub terminal (Nugroho, 2009) yang dapat dilihat pada gambar berikut :
Gambar 7. Reaksi Biodegradasi alkana Jalur Sub terminal (Atlas & Bartha, 1992)
40 6080100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420
Scan 2266 (25.327 min): KONTROL.D
57
85
111
207
141
159183 239 258281
320
301 337355 379 405 429
keton (2-oktakosanon) yang selanjutnya dioksidasi menjadi senyawa ester. Ester yang telah terbentuk akan mengalami hidrolisis menjadi alkohol primer dimana oksigen karbonil dari suatu ester dapat diprotonkan sedangkan karbon yang bermuatan positif parsial, dapat diserang oleh nukleofil lemah seperti air.
Alkohol primer yang terbentuk tersebut kemudian mengalami dehidrogenasi sehingga membentuk aldehid (1-Heksakosenal) dan selanjutnya menjadi asam karboksilat sehingga dapat menurunkan pH media karena bersifat asam.
Penambahan ion magnesium pada media Mg-1 adalah media dengan aktivitas bakteri tertinggi yang dapat dilihat pada penurunan pH dan laju biodegradasi yang dapat dilihat dari kadar minyak yang tersisa (Gambar 6). Namun pada media Mg-2 dan Mg-3, aktivitas isolat bakteri DM-5 menurun sehingga laju biodegradasi berjalan lambat. Walaupun aktivitas bakteri menurun pada media Mg-2 dan Mg-3 jika dibandingkan dengan SMSSe kontrol dan standar, kedua media ini masih tergolong cepat karena nilai persentase biodegradasinya lebih tinggi (36,52% dan 28,73%) jika dibandingkan dengan SMSSe kontrol (11,37%).
Analisis Senyawa Hasil Biodegradasi Isolat Bakteri DM-5. Perubahan struktur minyak bumi yang telah didegradasi oleh bakteri Isolat Bakteri DM-5 dapat diketahui dengan menggunakan GC-MS. Setelah 7 hari perlakuan, terjadi proses biodegradasi pada masing-masing media dan dipilih media dengan perlakuan terbaik. Hasil penelitian menunjukkan bahwa media perlakuan terbaik adalah media Mg-1 untuk media dengan penambahan ion magnesium dan media Mn-2 untuk media dengan penambahan ion mangan yang tersaji pada gambar berikut ini :
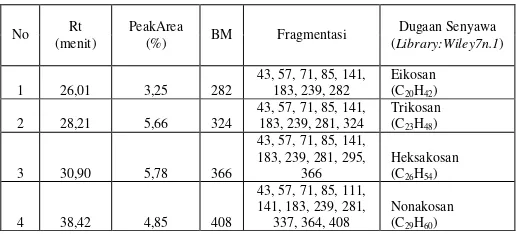
Tabel 3. Interpretasi Data GC-MS media Mg-1
No Rt
(menit)
PeakArea
(%) BM Fragmentasi
Dugaan Senyawa
(Library:Wiley7n.1)
1 26,01 3,25 282
Tabel 4. Interpretasi Data GC-MS media Mn-2
No Rt
(menit)
PeakArea
(%) BM Fragmentasi
Dugaan Senyawa
(Library:Wiley7n.1)
1 26,04 2,57 282
Hasil analisis GC-MS menunjukkan bahwa puncak No.1 pada media kontrol dengan waktu retensi 25,33 menit memberikan spektrum massa yang dapat dilihat pada gambar dibawah ini :
Gambar 7. Spektrum Massa Puncak Ke-1 Media SMSSe Kontrol
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Hal ini sesuai dengan penelitian oleh Budarti dan Burhan (2010) bahwa hasil analisa spektrum massa hidrokarbon alifatik memiliki puncak dasar pada m/z 57. Puncak ini diperoleh dari pemutusan C4H9
+
50 100 150 200 250 300 350 400 450 500 550 600 650 700 750 800
Scan 2347 (26.015 min): SAMPEL 2.D
57
Scan 2350 (26.040 min): SAMPEL 1.D 57
85
113 141
207
169 239 281 380 323 351
259 301 405 501
50 100 150 200 250 300 350 400 450 500
Scan 2608 (28.232 min): KONTROL.D 57
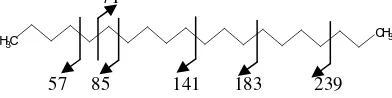
pola fragmentasinya : 71
57 85 141 183 239
Gambar 8. Pola Fragmentasi Eikosan
Sedangkan Puncak No.1 pada media Media SMSSe Mg-1 dengan waktu retensi 26,01 menit memberikan spektrum massa berikut :
Gambar 9. Spektrum Massa Puncak Ke-1 Media Mg-1
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 282 diduga adalah senyawa eikosan (C20H42). Pola fragmentasi pada media ini sama
dengan media SMSSe kontrol (Gambar 7). Sedangkan puncak No.1 pada media Media SMSSe Mn-2 dengan waktu retensi 26,02 menit memberikan spektrum massa berikut :
Gambar 10. Spektrum Massa Puncak Ke-1 Media Mn-2
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 282 diduga adalah senyawa eikosan (C20H42). Pola fragmentasi pada media ini
sama dengan media SMSSe kontrol (Gambar 23). Dari hasil analisa menunjukkan bahwa ketiga spektrum massa puncak No.1 pada media SMSSe kontrol, Mg-1 dan Mn-2 diduga adalah senyawa eikosan (C20H42). Namun peak area yang
berbeda-beda menunjukkan bahwa pada masing-masing media terjadi biodegradasi oleh isolat DM-5. Peak area yang tertinggi adalah pada media SMSSe kontrol yaitu 4,32% sedangkan pada media Mg-1 dan Mn-2 mengalami penurunan yaitu 3,25% dan 2,57%. Ini menandakan bahwa eikosan mengalami biodegradasi menjadi senyawa lain sehingga terjadi penurunan kelimpahan senyawa eikosan pada sampel yang dapat teramati dari penurunan peak area.
Pada puncak No.2 pada Media SMSSe kontrol dengan waktu retensi 28,23 menit memberikan spektrum massa yang dapat dilihat pada gambar di bawah ini :
Gambar 11. Spektrum Massa Puncak Ke-2 Media SMSSe Kontrol
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 324 diduga adalah trikosan (C23H42). Berikut adalah pola fragmentasinya :
71
57 85 141 183 239 281
Gambar 12. Pola Fragmentasi Trikosan
C H3
406080 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440
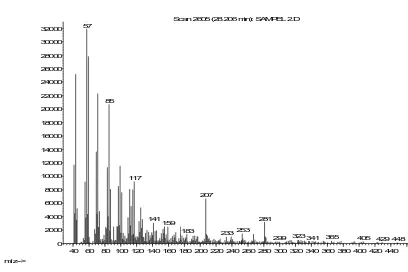
Scan 2605 (28.206 min): SAMPEL 2.D
57
183 233 299323341365 405429 448
4060 80100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420
Scan 2608 (28.232 min): SAMPEL 1.D
57
169 239 256 281
323
191 223 306 343365 394417
50 100 150 200 250 300 350 400 450
Scan 2926 (30.934 min): KONTROL.D 57
258 317 346365386408 479
406080 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440
Scan 2922 (30.899 min): SAMPEL 2.D
57
299 378 405 429 453
Sedangkan pada Media Mg-1 dengan waktu retensi 28,21 menit memberikan spektrum massa yang dapat dilihat pada gambar dibawah ini :
Gambar 13 Spektrum Massa Puncak Ke-2 Media Mg-1
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 324 diduga adalah Trikosan (C23H42). Pola fragmentasi trikosan pada media ini
sama dengan pola fragmentasi pada media SMSSe kontrol.
Sedangkan pada media Mn-2 puncak No.2 dengan waktu retensi 28,23 menit memberikan spektrum massa yang dilihat pada gambar dibawah ini :
Gambar 14. Spektrum Massa Puncak Ke-2 Media Mn-2
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 324 diduga adalah Trikosan (C23H42). Pola fragmentasi trikosan pada media ini
sama dengan pola fragmentasi pada media SMSSe kontrol.
Dari hasil analisa menunjukkan bahwa ketiga spektrum massa puncak No.2 pada media SMSSe kontrol, Mg-1 dan Mn-2 diduga adalah senyawa Trikosan(C23H42). Peak area pada media
Mg-1 sebesar 5,66% dan Mn-2 sebesar 5,57% mengalami peningkatan jika dibandingkan dengan media SMSSe kontrol sebesar 3,48%. Hal ini
menandakan bahwa trikosan mengalami
peningkatan jumlah atau kelimpahan senyawa trikosan bertambah yang disebabkan oleh biodegradasi senyawa hidrokarbon lain juga membentuk senyawa trikosan.
Puncak No.3 pada media SMSSe kontrol dengan waktu retensi 30,93 menit memberikan spektrum massa berikut :
Gambar 15. Spektrum Massa Puncak Ke-3 Media SMSSe Kontrol
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
Gambar 16. Pola Fragmentasi Heksakosan
Sedangkan pada media Mg-1 dengan waktu retensi 30,90 menit memberikan spektrum massa berikut :
Gambar 17. Spektrum Massa Puncak Ke-3 Mg-1
C H3
406080 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440
189 257 301 379 408429 449
40 6080 100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440
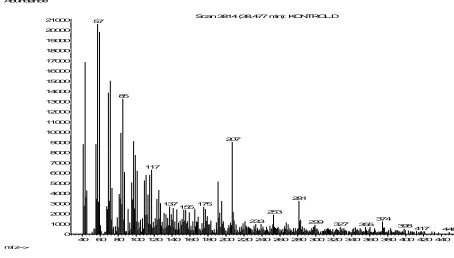
Scan 3814 (38.477 min): KONTROL.D 57 233 299 327 355 398417 448
4060 80100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440 233 299 327 355 398417 448 Berdasarkan spektrum massa di atas
menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 366 diduga adalah heksakosan (C26H54). Pola fragmentasinya pada
media ini sama dengan pola fragmentasi heksakosan pada media SMSSe kontrol.
Puncak No.3 pada media Mn-2 dengan waktu retensi 30,93 menit memberikan spektrum massa yang dapat dilihat pada gambar dibawah ini :
Gambar 18. Spektrum Massa Puncak Ke-3 Media Mn-2
Dari hasil analisa menunjukkan bahwa ketiga spektrum massa puncak No.3 diduga adalah senyawa Heksakosan (C26H54). Pada media Mg-1
memiliki peak area heksakosan yang lebih tinggi (5,78%) jika dibandingkan dengan media SMSSe Kontrol (4,85%). Hal ini menunjukkan bahwa heksakosan mengalami peningkatan kelimpahan yang disebabkan oleh biodegradasi senyawa hidrokarbon lain juga membentuk senyawa heksakosan. Sedangkan pada media Mn-2 memiliki
peak area heksakosan paling rendah (4,55%) dibandingkan Mg-1 dan SMSSe kontrol. mengalami peningkatan jika dibandingkan dengan media SMSSe kontrol sebesar 3,48%. Hal ini
menunjukkan bahwa eikosan mengalami
biodegradasi menjadi senyawa lain sehingga terjadi penurunan kelimpahan senyawa eikosan pada sampel yang dapat teramati dari penurunan peak area.
Puncak No.4 pada Media SMSSe kontrol dengan waktu retensi 38,48 menit memberikan spektrum massa yang dapat dilihat pada gambar di bawah ini :
Gambar 19. Spektrum Massa Puncak Ke-4 Media SMSSe Kontrol
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
Gambar 20. Pola Fragmentasi Nonakosan
Puncak No.4 pada media Mg-1 dengan waktu retensi 38,42 menit memberikan spektrum massa sebagai berikut :
Gambar 21. Spektrum Massa Puncak Ke-4 Media Mg-1
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan
C
H3
406080100 120 140 160 180 200 220 240 260 280 300 320 340 360 380 400 420 440 0
2000 4000 6000 8000 10000 12000 14000 16000 18000 20000 22000 24000 26000 28000 30000 32000 34000 36000 38000 40000
m/ z--> Abundance
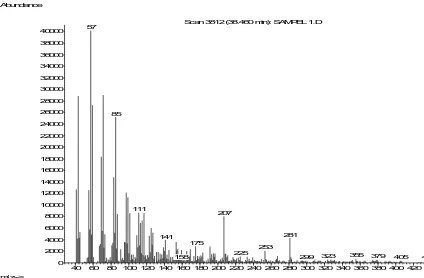
Scan 3812 (38.460 min): SAMPEL 1.D 57
85
111
207 281 141
175
253
225 323 355 379 436
158 299 405
C4H9 +
. Puncak ion m/z 408 diduga adalah nonakosan(C29H60).
Sedangkan puncak No.4 pada media Mn-2 dengan waktu retensi 38,45 menit memberikan spektrum massa sebagai berikut :
Gambar 22. Spektrum Massa Puncak Ke-4 Media Mn-2
Berdasarkan spektrum massa di atas menunjukkan bahwa senyawa tersebut memiliki puncak dasar pada m/z 57 yang merupakan puncak khas n-alkana. Puncak ini diperoleh dari pemutusan C4H9
+
. Puncak ion m/z 408 diduga adalah nonakosan(C29H60).
Dari hasil analisa menunjukkan bahwa ketiga spektrum massa puncak No.4 diduga adalah senyawa nonakosan(C29H60). Pada media SMSSe
Kontrol (7,98%) memiliki peak area heksakosan yang lebih tinggi jika dibandingkan dengan media Mg-1 (4,85%) dan Mn-2 (3,38%). Hal ini menunjukkan bahwa nonakosan mengalami biodegradasi menjadi senyawa lain sehingga terjadi penurunan kelimpahan senyawa nonakosan pada media Mg-1 dan Mn-2 yang dapat teramati dari penurunan peak area.
Dari ke empat puncak kromatogram serta pola fragmentasi masing-masing media di atas menunjukkan dugaan senyawa yang terkandung dalam media SMSSe kontrol, Mg-1 dan Mn-2 ada yang memiliki kesamaan pola fragmentasi pada waktu retensi yang hampir sama. Hal ini menandakan bahwa media Mg-1 dan Mn-2 mengalami biodegradasi oleh isolat bakteri DM-5 menghasilkan senyawa intermediet dilihat dari peak area yang menurun (senyawa No.1 dan 4) dan bertambahnya kelimpahan senyawa pada senyawa No.2 dan 4. Dengan demikian diperlukan uji lanjutan dengan menggunakan spike matrix untuk membandingkan spektrum massa suatu senyawa pada sampel dengan spektrum massa suatu senyawa murninya sehingga dapat dipastikan senyawa mana yang mengalami biodegradasi. Selain itu perlu dilakukan analisa NMR untuk mengetahui posisi karbon dan hidrogen untuk memastikan
senyawa-senyawa hasil biodegradasi pada masing-masing media perlakuan.
4. Kesimpulan
Dari hasil penelitian yang telah dilakukan mengenai pengaruh ion logam Mg2+ dan Mn2+ terhadap aktivitas enzim ekstraseluler bakteri hidrokarbonoklastik, maka dapat disimpulkan sebagai berikut :
1. Perlakuan terbaik pada media dengan penambahan ion magnesium adalah media Mg-1 dengan penurunan pH sebesar dari 6,85 menjadi 6,08 dan kadar minyak tersisa sebesar 0.1509% (b/v) dengan persentase degradasi 69,37%.
2. Perlakuan terbaik pada media dengan penambahan ion mangan adalah media Mn-2 dengan penurunan pH sebesar dari 6,57 menjadi 5,63 dan kadar minyak tersisa sebesar 0.0466% (b/v) dengan persentase degradasi 90,54%.
3. Hasil analisa GC-MS menunjukan bahwa laju biodegradasi dan aktivitas isolat DM-5 pada media Mn-2, dan Mg-1 lebih tinggi jika dibandingkan dengan media SMSSe kontrol yang dapat dilihat dari penurunan peak area
senyawa intermediet no. 1 dan 4 serta terjadi penambahan kelimpahan senyawa intermediet no. 2 dan 3 dari hidrokarbon lain yang membentuk senyawa yang sama.
DAFTAR PUSTAKA
Aisaka & Terada. 1979. Production of Lipoprotein Lipase and Lipase by Rhizopus japonicu..
Agricultural and Biological Chemistry. 43: hal.2125.
Atlas, RM, & Bartha R. 1992. Fundamentalis and Aplications, Third Ed. Microbial Ecology. Redwood City. California. The Benjamin/Cumming Pub. Co., Inc : 11-13. Atlas, RM, & Bartha R. 1981. Microbiology Ecology, Fundamentals and Applications. Addison Wesley Publishing Company, Budiarti & Burhan. 2009. Karakterisasi Biomarka
Hidrokarbon Alifatik dari Batubara Coklat (brown coal) Samarinda, Kalimantan Timur. Prosiding Kimia FMIPA – ITS. SK – 02.
Irianto, A. 2000. Bioremediasi In Vitro Tanah Tercemar Toluena dengan Penambahan Bacillus Galur Lokal. Jurnal Mikrobiologi Indonesia Vol. 5 No. 2 : 43-47.
Jamilah. 2005. Potensi Bakteri Pendegradasi Hidrokarbon Minyak Bumi pada Tanah Terkontaminasi Minyak Bumi dengan Penambahan Surfaktan. Bogor : FMIPA-IPB.
Juknis Balai Penelitian Tanah. 2005. Analisis Kimia Tanah, Tanaman, Air, dan Pupuk. Bogor.
Karwati. 2009. Degradasi Hidrokarbon pada Tanah Tercemari Minyak Bumi dengan Isolat A10 dan D8. Departemen
Kimia.FMIPA.Bogor
Madigan, Martlako, & Parker. 1997. Brock’s Biology of Microorganisms. Ed. 8th. Englewood Cliffs:Prentice Hall.
Nababan, B. 2008. Isolasi dan Uji Potensi Bakteri Pendegradasi Minyak Solar dari Laut Belawan. Universitas Sumatra Utara. Notodarmojo. 2005. Pencemaran Air dan Tanah.
Bandung : ITB-Press.
Nugroho, A. 2009. Produksi Gas Hasil Biodegradasi Minyak Bumi : Kajian Awal Aplikasinya dalam Microbial Enhanced Oil Recovery (MEOR). Makara Sains Vol. 13 No. 2 : 111-116.
Nugroho, A. 2007. Dinamika Populasi Konsorsium Bakteri Hidrokarbonoklastik. Jurnal Ilmu Dasar. Vol.8 No.1 : F3-23.
Pelczar MJJr, Chan ECS. 1986. Dasar-dasar Mikrobiologi. Hadioetomo RS, Imas T, Tjitrosomo SS, dan Angka SL,
penerjemah; Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Rani, D.S & Kadarwati S. 2009. Stone Mineral Salt Solution as a Potential Nutrient for Biosurfactant and Biosolvent Production
on MEOR Application. LEMIGAS,
Research and Development Division for Program And Affiliation.Vol.32, No. 1. Stumn & Morgan. 1970. Evaluation of
bioremediation effectiveness on crude oil-contaminated sand. ChemoSphere. 59 : 845-852.
Styani, E. 2008. Bioremediasi Tanah
Terkontaminasi Minyak Bumi
Menggunakan Bakteri Bacillus sp dan
Pseudomonas sp. Bogor : Wartaakab No. 19.
LAMPIRAN
Lampiran 1. Komposisi Media NA
Bahan Jumlah
Pepton 5 g
Beef Extract 3 g
Agar 15 g
H2O 1 L
Lampiran 2. Komposisi Media NB
Bahan Jumlah
Pepton 5 g
Beef Extract 3 g
H2O 1 L
Lampiran 3. Komposisi Media SMSSe
Jumlah No Nama Bahan
Gram ppm
1 CaCO3 0.250 5000
2 NH4NO3 0.125 2500
3 Na2HPO4 0.050 1000
4 KH2PO4 0.025 500
5 MgSO4.7H2O 0.025 500
6 MnCl2.7 H2O 0.010 200
7 Ektrak Ragi 0.05%