Lampiran 3. Gambar simplisiadan serbuk sponge Chalinula sp
Gambar simplisiasponge Chalinula sp
Lampiran 4.Gambar mikroskopik serbuk simplisia sponge Chalinula sp
Keterangan gambar:
a. Spikula mikrosklera monoaxon tipe microxea.
Lampiran 5. Bagan kerja penelitian
SpongeChalinula sp
Berat spongeChalinula sp = 2,8 kg
Serbuk spongeChalinula sp - kadar sari larut etanol - kadar abu total
- kadar abu tidak larut asam
dipisahkan dari pengotor dicuci dengan air kran mengalir ditiriskan
ditimbang
dihaluskan dengan blender dipotong dadu
dikeringkan dalam lemari pengering dengan suhu 40-50oC selama 6 hari
ditimbang
Lampiran 6. Bagan pembuatan ekstrakn-heksan simplisia sponge Chalinula sp
Serbuk sponge(300 g)
dimasukkan kedalam bejana tertutup direndam dengan n-heksan selama 3 jam dimasukkan ke dalam perkolator
dituangkan pelarut n-heksan secukupnya sampai semua serbuk simplisia terendam dan terdapat selapis cairan penyari di atas serbuk simplisia
ditutup mulut perkolator dengan plastik dan aluminium foil dan dibiarkan selama 24 jam
dibuka kran perkolator setelah 24 jam
dibiarkan perkolat menetes dengan kecepatan 1 mL/menit
ditambahkan berulang-ulang cairan penyari secukupnya sehingga selalu terdapat selapis cairan penyari di atas simplisia, dihentikan perkolasi ketika hasil 500 mg perkolat diuapkan di atas penangas air tidak meninggalkan sisa.
Lampiran 7. Perhitungan hasil penetapan kadar
a. Perhitungan hasil penetapan kadar air
Kadar air = volume air (mL)
berat sampel (g)� 100%
1. Sampel 1
Berat sampel = 5,00 g
Volume air = 0,2mL
Kadar air =0,2 mL
5,00 g x100%
= 4% v b�
2. Sampel 2
Berat sampel = 5,00 g
Volume air = 0,2mL
Kadar air =0,2 mL
5,00 g x100% = 4% v b�
3. Sampel 3
Berat sampel =5,00 g
Volume air = 0,1mL
Kadar air =0,1 mL
5,00 g x100%
= 2% v b�
Kadar air rata – rata =4% + 4% + 2% 3
Lampiran 7.(Lanjutan)
b. Perhitungan hasil penetapan kadar sari larut air
Kadar sari larut air = berat sari
berat simplisia x 100
3. Kadar sari larut air III
c. Perhitungan hasil penetapan kadar sari larut etanol
1. Kadar sarilarut etanol I
Berat Cawan =48,6174 g
Berat Cawan + Berat Sari =48,4211 g
Berat Sampel = 5,0023 g
Berat sari =0,1963 g
Kadar sari larut etanol
=
0,1963g 5,0023 gx3. Kadar sari larut etanol III
Berat Cawan =48,6175 g
Berat Cawan + Berat Sari =48,8117 g
Berat Sampel = 5,0021 g
Berat sari =0,1942 g
Kadar sari larut etanol=0,1942 g 5,0021 gx
100
20 x 100%
= 19,4118%
Kadar sarilarut etanol rata-rata=19,6209%+19,0243%+19,4118%
3
= 19,35%
Lampiran 7.(Lanjutan)
Kadar sari larut etanol
=
berat sariberat simplisia
x
100d. Perhitungan hasil penetapan kadar abu total
1. Sampel I
Berat simplisia =2,0015 g
Berat abu =0,6107 g
Kadar abu total =0,6107 g
2,0015 g x100%
=30,5121%
2. Sampel II
Berat simplisia =2,0022 g
Berat abu =0,6271 g
Kadar abu total =0,6271 g
2,0022 gx100% = 31,3205%
3.Sampel III
Berat simplisia =2,0004 g
Berat abu =0,6159 g
Kadar abu total=0,6159 g
2,0004 g x100%
= 30,7889%
Kadarabu total rata-rata
=
30,5121% + 31,3205% + 30,7889% 3=30,87%
Lampiran 7.(Lanjutan)
e. Perhitungan hasil penetapan kadar abu tidaklarut asam Kadar abu total
=
berat abu1. Sampel I
Berat simplisia =2,0015 g
Berat abu =0,0972 g
Kadar abu tidak larut asam
=
0,0972 g2,0015 g
x
100%= 4,8563%
2. Sampel II
Berat simplisia = 2,0022 g
Berat abu = 0,1043 g
Kadar abu tidak larut asam
=
0,1043 g2,0022 g
x
100%=5,2092%
3.Sampel III
Berat simplisia =2,0004 g
Berat abu = 0,1026 g
Kadar abu tidak larut asam
=
0,1026 g2,0004 g
x
100%=
5,1289%Kadarabu tidak larut asam rata-rata
=
4,8563% + 5,2092 % + 5,1289%3
=
5,06%Kadar abu tidak larut asam
=
berat abuDAFTAR PUSTAKA
Amir, I., dan Bidiyanto, A. (1996). Mengenal Spons Laut (Demospongia) secara Umum. Jurnal Oseana. 21 (2): 15-23.
Dachriyanus. (2004). Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press. Hal. 7-21.
Day, A.R., dan Underwood, A.L. (2002). Analisis KimiaKuantitatif. Edisi Keenam. Jakarta: Erlangga. Hal. 383-387
Depkes RI. (1995). Materia Medika Indonesia. Jilid VI. Jakarta: Departemen Kesehatan RI. Hal. 322-337, 516, 518, 522.
Depkes RI. (2000). Parameter Standar Umum Ekstrak Tumbuhan Obat. Cetakan Pertama. Jakarta: Departemen Kesehatan RI. Hal. 10-17.
Ditjen POM RI. (1979). Farmakope Indonesia. Edisi Ketiga. Jakarta: Departemen Kesehatan RI. Hal. 33.
Farnsworth, N.R. (1966). Biological and Phytochemical Screening of Plants.
Journal of Pharmaceuticals Science. 55(3): 247-268.
Gandjar, I.G., dan Rohman, A. (2007). Analisis Obat Secara Spektrofotometri
Dan Kromatografi. Yogyakarta: Pustaka Pelajar. Hal. 349-351.
Gritter, R.J., Bobbitt, J., dan Schwarting, A.E. (1991). Pengantar Kromatografi Penerjemah: Kokasih Padmawinata. Edisi Kedua. Bandung: ITB. Hal. 107-109.
Harborne, J.B. (1987). MetodeFitokimia. Terjemahan: KosasihPadmawinata, danIwang Soediro. Edisikedua. Bandung: Penerbit ITB. Hal.147-151, 234
Hostettmann, K., Hostettmann, M., dan Marston, A. (1995). Cara Kromatografi
Preparatif: Penggunaan pada Isolasi Senyawa Alam. Penerjemah Kosasih
Padmawinata. Bandung: Penerbit ITB. Hal. 9-11.
Ilan, M., dan Loya, Y. (1990). Sexual Reproduction And Settlement Of The Coral Reef SpongeChalinula Sp. From The Red Sea. Marine Biology. 105: 25-31
Joseph, B., dan Sujatha, S. (2011). Pharmacologically Important Natural Products From Marine Sponges. Journal Of Natural Products. 4: 5-12.
Murniasih, T. (2003). Metabolit Sekunder Dari Sponge Sebagai Bahan Obat-Obatan. Jurnal Oseana. 28(3): 27-33.
Pechenik, A.J. (2005). Biology Of The Invertebrates. Edisi Kelima. New York: Mc Graw Hill. Hal. 82-85.
Robinson, T. (1995).KandunganOrganikTumbuhanTinggi. Edisi Keenam. Bandung: Penerbit ITB.Hal. 139, 154.
Sastrohamidjojo, H. (1985).Kromatografi. Yogyakarta: Penerbit Liberty. Hal. 22-36.
Silverstein, R.M., Bassler, G.C., dan Morrill, T.C. (1986). Penyidikan
Spektrometrik Senyawa Organik. Edisi Keempat. Jakarta: Penerbit
Erlangga. Hal. 112-115.
Stahl, E. (1985).Analisis Obat Secara Kromatografi dan Mikroskopi. Penerjemah: Kosasih Padmawinata dan Iwany Soediro. Bandung: ITB. Hal. 3-18.
Suparno. (2005). Kajian Bioaktif Spons Laut (porifera: Demospongiae) Suatu Peluang Alternatif Pemanfaatan Ekosistem Karang Indonesia Dalam Dibidang Farmasi.Jurnal Perikanan Indonesia. 24(21): 41-45.
Suriani., Usman, H., dan Ahmad, A. (2012). Isolasi, Karakterisasi, Dan Uji Bioaktifitas Metabolit Sekunder Dari Sponge Callyspongia sp. Marina
Chimica Acta. 12(1): 2-7
Suwignyo, S., Bambang, W., Yusli, W., dan Majariana, K. (2005). Avertebrata
Air. Jakarta: Penebar Swadaya. Hal. 34-40.
Teta, R., Renga, B., Mangoni, A., Fiorucci, S., dan Costantino, V. (2012). Chalinusterol, a chlorinated Steroid Disulfate From The Caribbean Sponge
Chalinula molitba. Evaluation Of Its Role As PXR Receptor Modulator. Marine Drugs. 10: 1383-1390.
BAB III
METODE PENELITIAN
Metode yang digunakan adalah metode eksperimental meliputi
pengumpulan dan pengolahan sponge, karakterisasi simplisia, pemeriksaan
golongan senyawa kimia, pembuatan ekstrak n-heksan, analisis ekstrak secara
kromatografi lapis tipis (KLT), dilanjutkan isolasi secara KLT preparatif. Isolat
yang diperoleh diuji kemurniannya secara KLT dua arah lalu diidentifikasi secara
spektrofotometri ultraviolet dan inframerah. Penelitian dilakukan di Laboratorium
Fitokimia dan Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera
Utara.
3.1Alat Dan Bahan 3.1.1 Alat yang digunakan
Mikroskop (Olympus), neraca kasar (Saherand), lemari pengering, blender
(Panasonic), eksikator, alat-alat gelas laboratorium (Pyrex, Iwaki), seperangkat
alat destilasi, seperangkat alat penetapan kadar air, oven listrik (Stork), hair dryer
(Maspion), neraca analitik (Vibra AJ), rotary evaporator(penguap vakum putar),
penangas air (Yenaco), seperangkat alat kromatografi lapis tipis preparatif,
spektrofotometer ultraviolet (Shimadzu) dan spektrofotometer inframerah
(Shimadzu).
3.1.2Bahan yang digunakan
Bahan yang digunakan adalah Sponge Chalinula sp dan bahan kimia yang
digunakan kecuali dinyatakan lain adalah berkualitas pro analisa yaitu n-heksan
asam asetat anhidrida (Merck), asam sulfat pekat (Merck), toluen (Merck), asam
klorida pekat (Merck), silika gel 60 GF254 (Merck), metanol (Merck) dan
kloroform (Merck).
3.2Penyiapan Sponge 3.2.1Pengumpulan sponge
Pengumpulan sponge dilakukan dengan cara purposif yaitu tanpa
membandingkan dengan sponge yang sama dari daerah lain. sponge yang
digunakan adalah sponge jenis Chalinula sp yang diambil dari perairan Teluk
Tapian Nauli Sibolga, Jalan Barus, Kecamatan Paruiaha, Kabupaten Tapanuli
Tengah, Provinsi Sumatera Utara.
3.2.2Identifikasi sponge
Identifikasi sponge dilakukan di Pusat Penelitian Oseanografi - Lembaga
Ilmu Pengetahuan Indonesia, Jakarta.
3.2.3Pengolahan sponge
Sponge yang telah dikumpulkan, disortasi basah yaitu memisahkan sponge
dari pengotornya, kemudian sponge dicuci dengan air mengalir untuk
menghilangkan pengotor yang masih melekat, ditiriskan dan ditimbang berat
sponge Chalinula sp adalah 2,80 kg. Sponge dipotong-potong, kemudian
dimasukkan ke dalam lemari pengering pada suhu 40-50oC selama 6 hari. Berat
simplisia sponge Chalinula sp adalah 420 g. Simplisia dihaluskan dengan
menggunakan blender. Serbuk simplisia disimpan dalam kantung plastik untuk
3.3Pembuatan Larutan Pereaksi 3.3.1 Larutan pereaksi asam klorida 2 N
Sebanyak 17 mlasam klorida pekat diencerkan dengan air suling
hingga 100 ml (Depkes RI, 1995).
3.3.2 Larutan pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air
suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling
hingga 100 ml (Depkes RI, 1995).
3.3.3 Larutan pereaksi Mayer
Sebanyak 1,359 g raksa (II) klorida dilarutkan dalam air suling hingga 60
ml, pada wadah lain dilarutkan 5 g kalium iodida dalam 10 ml air suling,
kemudian keduanya dicampurkan dan ditambahkan air suling hingga diperoleh
larutan 100 ml (Depkes RI, 1995).
3.3.4 Larutan pereaksi Dragendorff
Sebanyak 8 g bismut (III) nitrat ditimbang, kemudian dilarutkan dalam 20
ml asam nitrat pekat, pada wadah lain dilarutkan 27,2 g kalium iodida dalam 50
ml air suling. Kedua larutan dicampurkan sama banyak dan didiamkan sampai
memisah sempurna. Larutan yang jernih diambil dan diencerkan dengan air
suling hingga 100 ml (Depkes RI, 1995).
3.3.5 Larutan pereaksi Molisch
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.6 Larutan pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100 ml
3.3.7 Larutan pereaksi Liebermann-Burchard
Sebanyak 5 bagian asam sulfat pekat dicampur dengan 50 bagian etanol
95%, kemudian ditambahkan dengan hati-hati 5 bagian asam asetat anhidrida ke
dalam campuran tersebut, didinginkan (Depkes RI, 1995).
3.3.8 Larutan air-kloroform
Sebanyak 2,5 ml kloroform dikocok dengan 900 mlair suling, diencerkan
dengan air suling hingga 1000 ml (Depkes RI, 1995).
3.3.9 Larutan pereaksi timbal (II) asetat 0,4 N
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air suling bebas
karbon dioksida secukupnya hingga 100 ml (Depkes RI, 1995).
3.3.10Larutan kloralhidrat
Sebanyak 50 g kloralhidrat ditimbang dan dilarutkan dalam 20 ml air
suling (Depkes RI, 1995).
3.4 Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik dan
mikroskopik, penetapan kadar air, penetapan kadar sari larut air, penetapan kadar
sari larut etanol, penetapan kadar abu total dan penetapan kadar abu tidak larut
asam.
3.4.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan mengamati bentuk,
konsistensi dan warna.
3.4.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia dengan
kloralhidrat dan ditutup dengan cover glass (kaca penutup) kemudian dilihat di
bawah mikroskop.
3.4.3 Penetapan kadar air
Penetapan kadar air dilakukan dengan metode Azeotropi (destilasi toluen).
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat,
didestilasi selama 2 jam, kemudian toluen didinginkan selama 30 menit dan
volume air pada tabung penerima dibaca dengan ketelitian 0,05 ml. Sebanyak 5 g
serbuk simplisia yang telah ditimbang seksama dimasukkan ke dalam labu yang
berisi toluen tersebut, lalu dipanaskan hati-hati selama 15 menit, setelah toluen
mulai mendidih kecepatan tetesan diatur 2 tetes tiap detik sampai sebagian besar
air terdestilasi, kemudian kecepatan tetesan ditingkatkan hingga 4 tetes tiap detik,
setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen yang
telah dijenuhkan. Destilasi dilanjutkan selama 5 menit, kemudian tabung
penerima dibiarkan dingin sampai suhu kamar, setelah air dan toluen memisah
sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air
dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa.
Kadar air dihitung dalam persen terhadap bahan yang telah dikeringkan(Depkes
RI, 1995).
3.4.4Penetapan kadar sari larut air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama
24 jam dengan 100 ml air-kloroform P, menggunakan labu bersumbat sambil
berkali-kali dikocok selama 6 jam pertama dan dibiarkan selama 18 jam, disaring.
Sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan datar berdasar rata
yang telah ditara. Sisa dipanaskan pada suhu 105oC hingga bobot tetap (Depkes
3.4.5Penetapan kadar sari larut etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama
24 jam dengan 100 ml etanol (95%), menggunakan labu bersumbat sambil
berkali-kali dikocok selama 6 jam pertama dan dibiarkan selama 18 jam, disaring
cepat dengan menghindarkan penguapan etanol (95%).Sejumlah 20 ml filtrat
diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa
dipanaskan pada suhu 105oC hingga bobot tetap. Kadar sari larut etanol dihitung
dalam persen terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.6Penetapan kadar abu total
Sebanyak 2 g serbuk ditimbang seksama, dimasukkan ke dalam krus
porselen yang telah dipijar dan ditara. Krus dipijarkan perlahan-lahan hingga
arang habis, kemudian didinginkan dan ditimbang sampai diperoleh bobot tetap.
Hitung kadar abu terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.4.7Penetapan kadar abu tidak larut asam
Abu yang diperoleh pada penetapan kadar abu total, dididihkan dengan 25
ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring dengan kertas saring bebas abu, dicuci dengan air panas,
dipijarkan hingga bobot tetap, kemudian didinginkan dan ditimbang. Hitung kadar
abu tidak larut asam terhadap bahan yang telah dikeringkan (Depkes RI, 1995).
3.5Pemeriksaan Golongan Senyawa Kimia
Pemeriksaan golongan senyawakimia serbuk simplisia sponge meliputi
pemeriksaan senyawa alkaloid, flavonoid, glikosida, saponin, tanin dan
3.5.1Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air
selama2menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Mayer
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Bouchardat
− Diambil 3 tetes filtrat, lalu ditambahkan 2 tetes pereaksi Dragendorff
Alkaloid disebut positif jika terjadi endapan pada paling sedikit 2 tabung
reaksi dari percobaan di atas (Depkes RI, 1995).
3.5.2Pemeriksaan flavonoid
Sebanyak 10 g serbuk simplisia ditambah 10 ml air panas, dididihkan
selama 5 menit dan disaring dalam keadaan panas, kedalam 5 ml filtrat
ditambahkan serbuk magnesium, 1 ml asam klorida pekat dan 2 ml amil alkohol,
dikocok kuat dan dibiarkan memisah. Positif flavonoid ditunjukkan dengan
timbulnya warna merah, kuning atau jingga pada lapisan amil alkohol
(Farnsworth, 1966).
3.5.3Pemeriksaan saponin
Sebanyak 0,5 g serbuk dimasukkan ke dalam tabung reaksi, ditambahkan 10
ml air panas, didinginkan dan kemudian dikocok kuat-kuat selama 10 detik,
terbentuk buih yang mantap selama tidak kurang dari 10 menit, setinggi 1 cm
sampai 10 cm, pada penambahan 1 tetes asam klorida 2 N, buih tidak hilang
menunjukkan adanya saponin (Depkes RI, 1995).
3.5.4Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia, disari dengan 10 ml air suling lalu
diambil sebanyak 2 ml dan ditambahkan 1-2 tetes pereaksi besi (III) klorida 1%.
Jika terjadi warna biru atau hijau kehitaman menunjukkan adanya tanin (Depkes
RI, 1995).
3.5.5Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volume air suling ditambah
dengan 10 ml asam klorida 2 N, direfluks selama 30 menit, didinginkan dan
disaring. Sebanyak 20 ml fitrat, ditambahkan 25 ml air suling dan 25 ml timbal
(II) asetat 0,4 M, kemudian dikocok lalu didiamkan selama 5 menit, kemudian
disaring. Filtrat disari dengan 20 ml campuran 3 bagian kloroform dan 2 bagian
isopropanol dilakukan berulang sebanyak 3 kali. Kumpulan sari air diuapkan pada
suhu tidak lebih dari 50oC. Sisa penguapan dilarutkan dalam 2 ml metanol.
Larutan ini digunakan untuk percobaan berikut: larutan sisa dimasukkan ke dalam
tabung reaksi, diuapkan di atas penangas air, pada sisa ditambahkan 2 ml air dan 5
tetes pereaksi Molisch kemudian ditambahkan hati-hati 2 ml asam sulfat pekat
melalui dinding tabung. Terbentuk cincin ungu pada batas kedua cairan
menunjukkan adanya gula (Depkes RI, 1995).
3.5.6Pemeriksaan steroid/triterpenoid
Sebanyak 1 g serbuk simplisia dimaserasi dengan 20 ml n-heksan selama
2 jam, disaring, filtrat diuapkan dalam cawan penguap dan pada sisanya
ditambahkan 2 tetes Liebermann-Burchard. Terbentuknya warna merah ungu atau
3.6Pembuatan Ekstrak
Ekstraksidilakukan dengan cara perkolasi. Sebanyak 300 g serbuk
simplisia dimasukkan ke dalam sebuah bejana tertutup, direndam dengan
n-heksan selama 3 jam, lalu setelah 3 jam, dimasukkan ke dalam perkolator,
dituangkan pelarut n-heksan secukupnya sampai semua serbuk simplisia terendam
dan terdapat selapis cairan penyari (n-heksan) di atas serbuk simplisia, ditutup
mulut perkolator dengan plastik dan aluminium foil lalu biarkan selama 24 jam.
Kran perkolator dibuka setelah 24 jam, dibiarkan perkolat menetes dengan
kecepatan 1 ml/menit, tambahkan berulang-ulang cairan penyari (n-heksan)
secukupnya hingga selalu terdapat selapis cairan penyari di atas simplisia.
Perkolasi dihentikan dengan cara 500 mg hasil perkolat terakhir diuapkan di atas
penangas air tidak meninggalkan sisa. Perkolat dipekatkan dengan alat rotary
evaporator pada temperatur 40-50˚C sampai diperoleh ekstrak kental(Ditjen POM
RI, 1979).
3.7Analisis Ekstrak n-heksan Secara KLT
Ekstrak n-heksan dianalisis secara KLT menggunakan fase diam plat lapis
silika gel 60 F254 dan fase gerak campuran n-heksan-etilasetat dengan
perbandingan (90:10), (80:20), (70:30), (60:40) dan (50:50) penampak bercak
digunakan pereaksi Liebermann-Burchard.
Cara kerja :
Ekstrak ditotolkan pada plat lapis silika gel 60 F254, kemudian dimasukkan
ke dalam chamber yang telah jenuh dengan uap fase gerak. Setelah proses
pengembangan selesai plat dikeluarkan dan dikeringkan, plat disemprot dengan
3.8Isolasi Senyawa Steroid/Triterpenoid Secara KLT Preparatif
Ekstrak n-heksan selanjutnya diisolasi secara KLT preparatif, sebagai fase
diam silika gel 60 GF254, fase gerak digunakan n-heksan-etilasetat (80:20) dan
sebagai penampak bercak digunakan pereaksi Liebermann-Burchard.
Cara kerja:
Ekstrak diencerkan dengan n-heksan, ditotolkan berupa pita pada jarak 2
cm daritepibawahplatKLT berukuran 20 x 20 cm yangtelahdiaktifkan.Plat KLT
dimasukkan ke dalam bejana yang telahjenuh dengan uap fase
gerakn-heksan-etilasetat (80:20), pengembang dibiarkan naik membawa komponen yang ada,
kemudian setelah mencapai batas pengembanganplat dikeluarkan dari bejana lalu
dikeringkan. Bagian sisi kanan dan kiri plat disemprot dengan penampak bercak
Liebermann-Burchard, kemudian dipanaskan di dalam oven pada suhu 105oC.
Bercak senyawa steroid/triterpenoid yang berwarna merahungu pada sisi kanan
dan kiri dihubungkan, bagian tengah plat yang tidak disemprot dikerok,
dikumpulkan, dimasukkan ke dalam vial ditambahkan metanol dan direndam
selama satu malam lalu disaring, kemudian pelarutnya diuapkan sampai kering
dengan bantuan hair dryer ditambahkan sedikit metanol dingin dan dimasukkan
ke dalam lemari pendingin. Isolat yang terbentuk dikromatografi lapis tipis,
selanjutnya diuji kemurniannya secara KLT dua arah (Gritter, 1991).
3.9Uji Kemurnian Isolat
3.9.1Uji kemurnian isolat secara KLT dua arah
Isolat hasil isolasi secara KLT preparatif dilakukan uji kemurnian secara
KLT dua arah menggunakan dua sistem pengembang yang berbeda kepolarannya.
digunakan benzen-etilasetat (80:20), sebagai penampak bercak digunakan
pereaksi Liebermann-Burchard.
Isolat ditotolkan pada plat lapis silika gel 60 F254 berukuran 10x10 cm,
kemudian dielusi menggunakan fase gerak I yaitu n-heksan-etilasetat (80:20)
hingga mencapai batas pengembangan, lalu plat dikeluarkan dari bejana dan
dikeringkan. Plat yang telah kering diputar 90o dan diletakkan ke dalam bejana
kromatografi yang telah jenuh menggunakan fase gerak II yaitu benzen-etilasetat
(80:20) hingga mencapai batas pengembangan, dikeringkan dan disemprot dengan
penampak bercak pereaksi Liebermann-Burchard. Plat dipanaskan di dalam oven
pada suhu 105oCselama 10 menit, diamati warna noda yang terjadi dan dihitung
harga Rf-nya (Gandjar dan Rohman, 2012).
3.10 Identifikasi Isolat
3.10.1Identifikasi isolat secara spektrofotometri ultraviolet
Identifikasi isolat secara spektrofotometri ultraviolet dilakukan dengan
cara melarutkan isolat dalam pelarut metanol, dimasukkan ke dalam kuvet yang
telah dibilas dengan larutan sampel, selanjutnya absorbansi larutan sampel diukur
pada panjang gelombang 200-400 nm (Khopkar, 1990).
3.10.2Identifikasi isolat secara spektrofotometri inframerah
Identifikasi isolat secara spektrofotometri inframerah dilakukan dengan
cara mencampurkan isolat dengan KBr, dicetak menjadi pelet, kemudian diukur
menggunakan spektrofotometer inframerah pada frekuensi 4000-400cm-1
BAB IV
HASIL DAN PEMBAHASAN
4.1 Identifikasi Sponge
Hasil identifikasi sponge dilakukan di Pusat Penelitian Oseanografi-
Lembaga Ilmu Pengetahuan Indonesia, Jakarta adalah jenis Chalinula sp, marga
Chalinula, suku Chalinidae, bangsa Haplosclerida dan kelas Demospongiae. Hasil
identifikasi dapat dilihat pada Lampiran 1, halaman 44.
4.2 Karakterisasi Simplisia 4.2.1 Pemeriksaan makroskopik
Pemeriksaansponge segar secara makroskopik dilakukan untuk memperoleh
identitas hewan yang diteliti. Hasil pemeriksaan makroskopik sponge Chalinula
sp yaitu bercabang, berpori, konsistensi lunak dan berwarna ungu kecoklatan.
Hasil pemeriksaan makroskopik simplisia sponge Chalinula sp yaitu berwarna
coklat muda.Gambar makroskopik sponge Chalinula sp dapat dilihat pada
Lampiran 2, halaman 45.
4.2.2 Pemeriksaan mikroskopik
Pemeriksaan serbuk simplisia sponge secara mikroskopik dilakukan untuk
memperoleh identitas simplisia hewan yang diteliti. Hasil pemeriksaan
mikroskopik serbuk simplisia sponge Chalinula sp terlihat adanya spikula
mikrosklera monoaxon tipe microxea.Gambar mikroskopik serbuk simplisia
4.2.3 Pemeriksaan karakterisasi simplisia
Pemeriksaan karakterisasisimplisia meliputi penetapan kadar air,
penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan kadar
abu total dan penetapan kadar abu tidak larut asam. Hasil pemeriksaan
karakterisasi simplisia spongeChalinula spdapatdilihat pada Tabel 4.1.
Tabel 4.1 Hasil pemeriksaan karakterisasi simplisia sponge Chalinula sp
No Karakterisasi simplisia Hasil (%)
1 Kadar air 3,33
2 Kadar sari larut air 14,51
3 Kadar sari larut etanol 19,35
4 Kadar abu total 30,87
5 Kadar abu tidak larut asam 5,06
Hasil pemeriksaan karakterisasi simplisia sponge Chalinula sp diperoleh
kadar air 3,33%, kadar sari larut air 14,51%, kadar sari larut etanol 19,35%, kadar
abu total 30,87% dan kadar abu tidak larut asam 5,06%. Penetapan kadar air
dilakukan untuk memberikan batasan minimum kandungan air yang masih dapat
ditolerir di dalam simplisia.
Penetapan kadar sari yang larut air dilakukan untuk mengetahui senyawa
yang larut dalam air. Senyawa yang dapat larut dalam air seperti karbohidrat,
protein, tanin, flavonoid, glikosida dan saponin.Penetapan kadar sari larut etanol
dilakukan untuk mengetahui senyawa yang larut dalam etanol seperti senyawa
metabolit sekunder yaitu alkaloid, glikosida, flavonoid, tanin, steroid/triterpenoid
dan saponin.
Penetapan kadar abu total dilakukan untuk mengetahui kandungan
logamdan mineral seperti natrium, kalsium, dan kalium dalam
simplisia.Penetapan kadar abu tidak larut asam dilakukan untuk mengetahui
4.3 Pemeriksaan Golongan Senyawa Kimia
Hasil pemeriksaan golongan senyawa kimia terhadap sponge Chalinula sp
dapat dilihat pada Tabel 4.2.
Tabel 4.2 Hasil pemeriksaan golongan senyawa kimia dari sponge Chalinula sp.
No Senyawa golongan kimia Hasil
1 Alkaloid +
2 Flavonoid -
3 Tanin -
4 Glikosida +
5 Saponin +
6 Steroid/Triterpenoid +
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Hasil pemeriksaan golongan senyawakimia dari simplisia sponge
Chalinulasp menunjukkan adanya golongan senyawa alkaloid, glikosida, saponin
dan steroid/triterpenoid.Pemeriksaan golongan senyawa alkaloid dengan pereaksi
Dragendorff terbentuk endapan berwarna kuning jingga, pereaksi Bouchardat
terbentuk endapan warna coklat dan pereaksi Mayer terbentuk endapan putih, ini
menunjukkan adanya senyawa alkaloid pada sponge Chalinula sp(Depkes RI,
1995).
Pemeriksaan golongan senyawa steroid/triterpenoid dengan penambahan
pereaksi Liebermann-Burchard memberikan warna merah ungu yang
menunjukkan adanya golongan senyawa triterpenoidpada sponge Chalinula sp
(Farnsworth, 1966).Hasil ini didukung dengan penelitian yang dilakukan (Teta,
etal., 2012) bahwa sponge jenis Chalinula molitbayang berasal dari suku yang
sama dengan sponge jenis Chalinula sp yaitu suku Chalinidae, menunjukkan
adanya senyawa alkaloid dan steroid yang berkhasiat sebagai anti kanker dan
4.4 Ekstraksi Serbuk Simplisia
Ekstraksi dilakukan secara perkolasi dari 300 g serbuk simplisiadiperoleh
ekstrak kental sebanyak 2,95 g.Bagan pembuatan ekstrak n-heksan serbuk
simplisia sponge Chalinula sp dapat dilihat pada Lampiran 6, halaman 49.
4.5 Analisis Ekstrak n-heksan Secara KLT
Terhadap ekstrakn-heksan dilakukan analisis secara KLT
denganmenggunakan fase diam silika gel 60 F254 dan fase gerak campuran
n-heksan-etilasetat dengan perbandingan (90:10), (80:20), (70:30), (60:40), (50:50)
dengan penampak bercak pereaksi LB (Liebermann-Burchard).
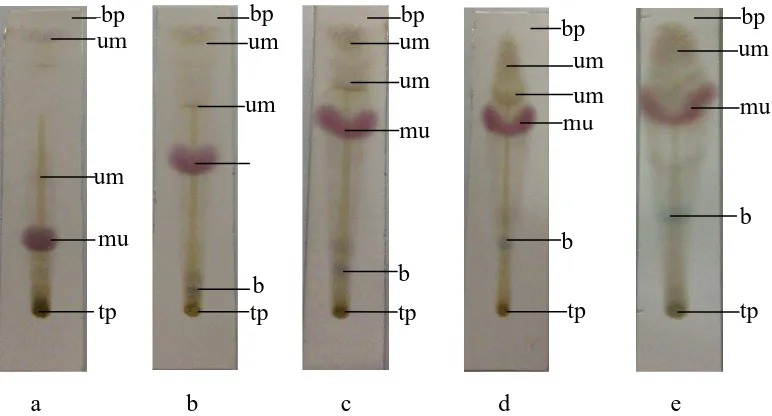
Fase gerak terbaik adalahn-heksan-etilasetat (80:20) karena memberikan
pemisahanpaling baik. Gambar kromatogram KLT ekstrak n-heksan Chalinula sp
dengan fase gerak n-heksan-etilasetat dilihat pada Gambar 4.1.
Gambar 4.1 kromatogram KLT ekstrak n-heksan Chalinula sp dengan fase gerak
n-heksan-etilasetat.
Keterangan:Fasediam: silika gel 60 F254, fasegerak: n-heksan-etilasetat, a.
(90:10); b. (80:20); c. (70:30); d; (60:40); e. (50:50), penampak bercak Liebermann-Burchard, tp = titik penotolan, bp = batas pengembang, mu=merah ungu, b = biru, um =ungu muda.
4.6 Isolasi Senyawa Steroid/Triterpenoid
Isolasisenyawa steroid/triterpenoid dilakukansecara KLT preparatif
menggunakan fase gerak n-heksan-etilasetat (80:20) dan sebagai penampak
bercak pereaksi Liebermann-Burchard. Kromatogram hasilKLT preparatif
dapat dilihat pada Gambar 4.2.
Gambar 4.2 Kromatogram hasilKLT preparatif
Keterangan: Fasediam: silika gel 60 GF254, fasegerak: n-heksan-etilasetat
(80:20), penampak bercak Liebermann-Burchard, tp=titik penotolan, bp=batas pengembangan.
Isolat yang dihasilkan menunjukkan noda tunggal berwarna merah ungu
dengan penambak bercak pereaksi Liebermann-Burchard yang merupakan
golongan senyawa triterpenoid dengan harga Rf 0,60.
Kromatogram isolat hasilKLT preparatif dapat dilihat pada Gambar 4.3.
Gambar 4.3 Kromatogram isolat hasilKLT preparatif
Keterangan: Fasediam: silika gel 60 F254, fasegerak: n-heksan-etilasetat
(80:20),penampak bercak Liebermann-Burchard, tp = titik penotolan,bp=batas pengembangan.
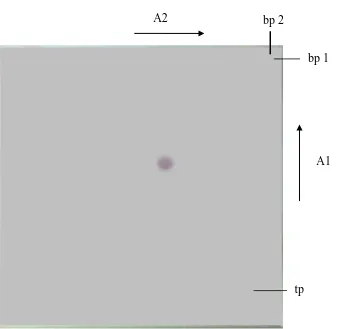
4.7Uji Kemurnian Isolat Secara KLT Dua Arah
Isolat yang diperoleh diuji kemurniannya secara KLT dua arah. Uji
kemurnian isolat secara KLT dua arah menggunakan dua sistem pengembang
(fase gerak) yang berbeda sifat kepolarannya. Fase gerak I digunakan
n-heksan-etilasetat (80:20) dan fase gerak II digunakan benzen-n-heksan-etilasetat (80:20) dengan
penampak bercak digunakan pereaksi LB(Liebermann-Burchard). Hasil KLT dua
arah menunjukkan satu noda berwarna merah ungu dengan harga Rf 0,55. Hasil
ini menunjukkan bahwa senyawa triterpenoidyang diperoleh sudah
murni.Kromatogram hasil KLT dua arah dapat dilihat pada Gambar 4.4. tp
Gambar 4.4 Kromatogram hasil KLT dua arah dari isolat murni
Keterangan: Fase diam silika gel 60 F254, fase gerak I = n-heksana-etilasetat
(80:20), fase gerak II = benzen-etilasetat (80:20) , penampak bercak Liebermann–Burchard, tp = titik pentotolan, bp1 = batas pengembangan 1, bp2 = batas pengembangan 2, A1= arah pengembangan pertama, A2 = arah pengembangan kedua.
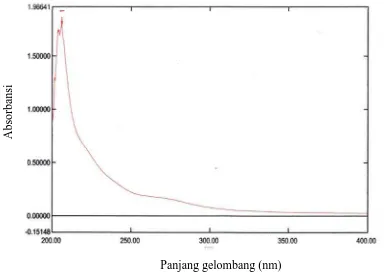
4.8 Identifikasi Isolat Secara Spektrofotometri Ultraviolet
Isolat murni diidentifikasi secara spektrofotometri ultraviolet dan hasil
spektrofotometri ultraviolet isolat menunjukkan absorbsi pada panjang gelombang
maksimum 206,2 nm yang disebabkan oleh adanya gugus kromofor.
Spektrofotometri ultraviolet dapat memberikan keterangan mengenai gugus
kromofor, yaitu semua gugus atau atom dalam senyawa organik yang mampu
menyerap sinar ultraviolet dan sinar tampak (Gandjar, 2007).Spektrum ultraviolet tp
A1 bp 1 bp 2
dari isolat murni spongeChalinula spdapat dilihat pada Gambar 4.5.
Gambar 4.5Spektrum ultraviolet dari isolat murni sponge Chalinula sp
4.9 Identifikasi Isolat Secara Spektrofotometri Inframerah
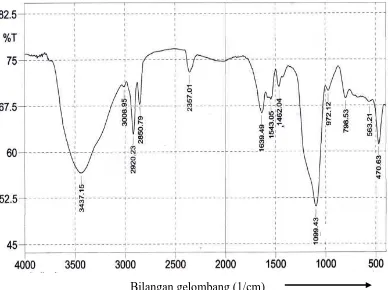
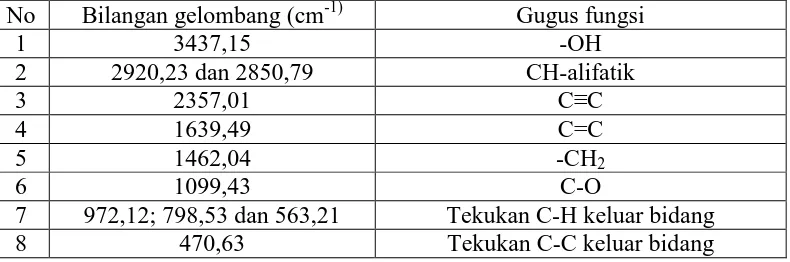
Hasil spektrofotometriinframerah isolat menunjukkan pita serapan yang
melebar pada bilangan gelombang 3437,15 cm-1 menunjukkan adanya gugus -OH,
bilangan gelombang 2920,23 cm-1dan 2850,79 cm-1menunjukkan adanya gugus
C-H alifatik, bilangan gelombang 2357,01 cm-1 menunjukkan adanya gugus C≡Cdan
bilangan gelombang 1639,49 cm-1 menunjukkan adanya gugus C=C. Serapan pada
bilangan gelombang 1462,04 cm-1 menunjukkan adanya gugus metilen (CH2) dan
bilangangelombang 1099,43 cm-1 menunjukkan adanya gugus C-O (Day dan
Underwood, 2002). Serapan pada bilangan gelombang 972,12 cm-1, 798,53 cm-1
dan 563,21 cm-1adalah serapan tekukan C-H keluar bidang dan bilangan
gelombang 470,63 cm-1 adalah tekukan C-C keluar bidang yang digolongkan
A
bs
or
ba
ns
i
dalam daerah sidik jari (Silverstein, dkk., 1986).
Berdasarkan data spektrum inframerah tersebut, adanya serapan pada
bilangan gelombang > 3000 cm-1 menunjukkan adanya gugus –OH, serapan pada
bilangan gelombang 2920,23 cm-1dan 2850,79 cm-1menunjukkan adanya gugus
C-H alifatikdan serapan pada bilangan gelombang 1462,04 cm-1 menunjukkan
adanya gugus metilen (CH2) yang khas untuk golongan senyawa triterpenoid
(Suriani, dkk., 2012). Berdasarkan data diatas dan hasil studi literatur golongan
senyawa triterpenoid maka diduga isolat tersebut adalah golongan senyawa
triterpenoid. Spektrum Inframerahdari isolat murni sponge Chalinula sp dapat
dilihat pada Gambar 4.6.
Bilangan gelombang (1/cm)
Hasil identifikasi isolat secara spektrofotometer inframerah dapat dilihat pada
Tabel 4.3.
Tabel 4.3Hasil analisis spektrum inframerah
No Bilangan gelombang (cm-1) Gugus fungsi
1 3437,15 -OH
2 2920,23 dan 2850,79 CH-alifatik
3 2357,01 C≡C
4 1639,49 C=C
5 1462,04 -CH2
6 1099,43 C-O
7 972,12; 798,53 dan 563,21 Tekukan C-H keluar bidang
8 470,63 Tekukan C-C keluar bidang
Isolat yang diperoleh merupakan golongan senyawa kimia triterpenoid
yang diidentifikasi secara spektrofotometri ultraviolet untuk mengetahui panjang
gelombang maksimum dan spektrofotometri inframerah untuk mengetahui gugus
fungsi dan daerah sidik jari (finger print),maka agar dapat menentukan struktur
kimianya perlu dilakukan elusidasi struktur secara spektrometri massa dan
spektrometri NMR dari golongan senyawa triterpenoid yang terdapat didalam
ekstrak n-heksan sponge Chalinula sp dan dapat dilakukan uji aktivitas
BAB V
KESIMPULAN DAN SARAN
5.1Kesimpulan
a. Karakterisasi simplisia sponge Chalinula sp dapat dilakukan sesuai yang
tercantum pada Materia Medika Indonesia dan hasil yang diperoleh yaitu
kadar air 3,33%, kadar sari larut air 14,51%, kadar sari larut etanol
19,35%,kadar abu total30,87% dan kadar abu tidak larut asam5,06%.
b. Golongan senyawa kimia yang terdapat di dalam sponge Chalinula sp
adalah steroid/triterpenoid, alkaloid, glikosida dan saponin.
c. Senyawa steroid/triterpenoid di dalam sponge Chalinula sp dapat diisolasi
dan diidentifikasi secara spektrofometri ultraviolet dan inframerah. Isolat
diidentifikasi secara spektrofotometri ultraviolet memberikan panjang
gelombang maksimum 206,2 nm dan hasil pengukuran secara
spektrofotometri inframerah menunjukkan adanya gugus fungsi -OH,
CH-alifatik, C≡C, C=C, -CH2, C-O, tekukan C-H keluar bidang dan tekukan
C-C keluar bidang, maka isolat yang diperoleh termasuk golongan
senyawa triterpenoid.
5.2 Saran
Disarankan kepada peneliti selanjutnya untuk melakukan elusidasi struktur
senyawa steroid/triterpenoid secara spektrometri massa dan spektrometri NMR
serta menguji aktivitas farmakologis dari ekstrak n-heksan sponge Chalinula sp
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Hewan 2.1.1 Habitat Sponge
Sponge merupakan biota laut dari filum porifera yang hidup pada
ekosistem terumbu karang. Habitat sponge umumnya menempel pada pasir,
batu-batuan dan karang-karang mati (Amir dan Budiyanto, 1996). Sponge kelas
Demospongiae dari bangsa Haplosclerida seperti sponge marga Chalinula tersebar
di seluruh dunia, dari Indo-Pasifik sampai Karibia (Suparno, 2005). Sponge jenis
Chalinula sp terdapat di Indonesia salah satunya di daerah Sibolga, Tapanuli
Tengah provinsi Sumatera Utara. Sponge jenis Chalinula sp hidup pada
kedalaman 1-6 m dari permukaan laut (Ilan dan Loya, 1990).
2.1.2 Morfologi Sponge
Bentuk luar sponge sangat dipengaruhi oleh faktor lingkungannya. Sponge
yang berada pada lingkungan terbuka, berombak besar, dangkal dan terkena sinar
matahari cenderung berukuran pendek, merambat dan memiliki kisaran warna
yang gelap hingga terang seperti coklat, abu-abu, ungu, biru, jingga dan kuning.
Sponge yang hidup pada perairan yang lebih dalam, berarus tenang dan tidak
terkena sinar matahari pertumbuhannya cenderung tegak dan tinggi serta
warnanya pucat (Amir dan Budiyanto, 1996).
Sponge Chalinula sp dari bangsa Haplosclerida yang terdapat di daerah
Sibolga, Tapanuli Tengah provinsi Sumatera Utara memiliki bentuk tubuh
bercabang, berpori, konsistensi lunak dan berwarna ungu kecoklatan. Morfologi
sponge Chalinula sp ini hampir sama dengan morfologi sponge Chalinula molitba
Salvador yaitu memiliki bentuk tubuh bercabang, berpori tetapi berwarna ungu
menyala. Jenis sponge lainnya yang juga berasal dari bangsa Haplosclerida adalah
Haliclona Grant, 1836 yang diperoleh dari daerah Sulawesi. Sponge Haliclona
Grant memiliki bentuk tubuh bercabang, pipih, berpori, konsistensi lunak dan
berwarna jingga (Ilan dan Loya, 1990).
Di dalam tubuh sponge terdapat rongga yang disebut spongocoel. Pada
permukaan tubuh terdapat lubang-lubang atau pori-pori yang merupakan lubang
air masuk ke spongocoel, untuk akhirnya keluar melalui osculum (Suwignyo,
dkk., 2005).
Pada dasarnya dinding tubuh sponge terdiri atas tiga lapisan (Suwignyo,
dkk., 2005) yaitu:
1. Pinacocyte atau pinacoderm
Pinacocyte berfungsi untuk melindungi tubuh bagian dalam. Bagian sel
pinacocyte dapat berkontraksi atau berkerut sehingga seluruh tubuh hewan dapat
membesar dan mengecil.
2. Mesohyl atau Mesoglea
Mesohyl terdiri dari zat semacam agar (gelatinous protein matrix) dan
mengandung sel amebocyte. Sel amebocyte mempunyai banyak fungsi, antara lain
sebagai cadangan makanan, membuang partikel sisa metabolisme dan berperan
dalam proses reproduksi yaitu sebagai pembawa sperma menuju sel telur dalam
mesohyl.
3. Choanocyte
Choanocyte yang melapisi spongocoel. Bentuk choanocyte agak lonjong,
Berdasarkan sistem aliran air, bentuk tubuh porifera dibagi menjadi
tigatipe (Suwignyo, dkk., 2005)yaitu:
1. Asconoid
Asconoid merupakan bentuk yang paling primitif, menyerupai vas bunga.
Pori-pori atau lubang air masuk merupakan saluran yang berbentuk tabung,
memanjang dari permukaan tubuh sampai spongocoel keluar melalui osculum.
2. Syconoid
Dinding tubuh melipat secara horizontal sehingga potongan melintangnya
seperti jari-jari. Lipatan dalam menghasilkan sejumlah besar kantung yang dilapisi
coanocyte, sedangkan lipatan luar sebagai saluran air masuk.
3. Tipe Leuconoid
Tipe ini merupakan tipe saluran air yang rumit/kompleks, memiliki banyak
lipatan-lipatan membentuk rongga kecil sehingga menyebabkan bentuknya
menjadi tak beraturan, banyak terdapat choanocyte-choanocyte pada rongga.
Air masuk melalui pori yang bercabang-cabang dan keluar melalui osculum.
Tubuh sponge yang lunak dapat berdiri karena ditunjang oleh sejumlah
besar spikula kecil serta serat organik yang berfungsi sebagai kerangka. Spikula
berasal dari CaCO3 dan silikat. Bentuk spikula bermacam-macam, seperti
monaxon berbentuk seperti jarum, lurus atau melengkung, tetraxon berbentuk
empat percabangan, polyaxon berbentuk banyak percabangan dan berbentuk serat
atau benang-benang spongin (Suwignyo, dkk.,2005).
Sponge umumnya memilki satu atau lebih dari satu bentuk spikula, sehingga
perlu adanya pengamatan yang rinci tentang bentuk-bentuk mikroskopis dari
setiap spikula yang dikandungnya. Untuk pengujian spikula tertentu dapat
Tipe spikula dapat dilihat pada Gambar 2.1.
Gambar 2.1 Tipe spikula
Keterangan: 1 dan 7. Monaxon; 2. Triod; 3 dan 6. Polyaxon; 4. Tetraxon; 5. Anchor ; 8. Benang-benang spongin.
(Sumber: Amir dan Budiyanto, 1996).
Berdasarkan ukuran, spikula dibedakan menjadi mikrosklera yang
berukuran kecil dan megasklera yang berukuran empat sampai lima kali ukuran
mikrosklera (Suwignyo, dkk.,2005).
Megasklera berperan untuk membentuk tubuh sponge dan perkembangan
struktur internal. Mikrosklera berperan dalam membentuk kelompok antara
kumpulan megaklera yang tersebar pada permukaan atau membran internal.
Ukuran, bentuk dan susunan dari masing-masing spikula yang dikandung oleh
hewan sponge sangat berguna untuk menentukan klasifikasi, bentuk dan nama
dari megasklera dan mikrosklera (Amir dan Budiyanto, 1996).
2.1.3 Reproduksi Sponge
Reproduksi sponge dapat dilakukan secara aseksual dan seksual.
Reproduksi secara aseksual terjadi dengan cara pembentukan tunas atau gamul
(gammules). Gamul terbentuk dari sekumpulan archeocyte berisi cadangan
makanan dikelilingi amebocyte yang membentuklapisan luar yang keras berupa
cangkang yang mengandung spikula yang akan melakukan diferensiasi menjadi
beberapa tipe sel yang diperlukan untuk tumbuh menjadi sponge kecil (Suwignyo,
dkk., 2005).
Reproduksi secara seksual terjadi pada sponge yang hermaprodit maupun
gonokoris. Kebanyakan porifera adalah hermaprodit, namun sel telur dan sperma
diproduksi dalam waktu yang berbeda. Sperma dan sel telur dihasilkan oleh
amebocyte. Sperma keluar dari tubuh induk melalui osculum bersama dengan
aliran air dan masuk ke sponge lain melalui ostium juga bersama aliran air. Dalam
spongocoel, sperma akan masuk ke amebocyte. Sel amebocyte berfungsi sebagai
pembawa sperma menuju sel telur dalam mesohyl, kemudian sperma dan sel telur
akan melebur dan terjadilah pembuahan (fertilisasi). Perkembangan embrio
sampai menjadi larva berflagela masih di dalam mesohyl. Larva berflagela keluar
dari mesohyl dan bersama dengan aliran air keluar dari tubuh induk melalui
osculum. Larva berflagela berenang bebas lalu menempel pada substrat dan
berkembang menjadi sponge muda yang akhirnya tumbuh menjadi sponge dewasa
(Suwignyo, dkk., 2005). Reproduksi sponge jenis Chalinula sp terjadi secara
seksual yaitu hermaprodit (Ilan dan Loya, 1990).
2.1.4 Klasifikasi sponge
Filum Porifera yang dibagi dalam 3 kelas (Pechenik, 2005) yaitu:
1. Kelas Hexactinellida
Sponge ini dikenal sebagai sponge gelas, memiliki tipe aliran air syconoid.
Spikula terdiri dari silikat dan tidak mengandung spongin. Spikulanya berbentuk
bidang triaxon, dimana masing-masing bidang terdapat dua jari-jari. Sponge dari
2. Kelas Calcarea
Spikula sponge ini hanya tersusun dari kalsium karbonat dan tidak
mengandung spongin, memiliki tipe aliran air asconoid, syconoid dan leuconoid,
tetapi pada akhirnya hanya tipe aliran asconoid yang banyak ditemukan pada
sponge kelas calcarea. Sebagian besar dari kelas ini bentuknya kecil-kecil dan
berwarna keabu-abuan dan ada beberapa jenis yang berwarna kuning, pink atau
hijau. Beberapa jenis sponge ini yang umum adalah Sycon gelatinosum (berbentuk
silinder berwarna coklat muda).
3. Kelas Demospongiae
Demospongiae merupakan kelas terluas (setidaknya terdapat 80% dari
semua jenis sponge), memiliki tipe aliran air leuconoid. Spikula jenis sponge
kelas ini mengandung serat spongin atau silikat tetapi tidak mengandung kalsium
karbonat. Pada umumnya spikula berbentuk monoakson atau tetraxon.
2.1.5 Sistematika sponge Chalinula sp
Sistematikasponge Chalinula sp (Ilan dan Loya, 1990) sebagai berikut:
Kingdom : Animalia
Filum : Porifera
Kelas : Demospongiae
Ordo : Haplosclerida
Famili : Chalinidae
Genus : Chalinula
2.2 Metode Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut tertentu.
Beberapa metode ekstraksi dengan menggunakan pelarut (Depkes RI,
2000) yaitu:
A. Cara dingin
1. Maserasi
Maserasiadalah proses penyarian simplisia dengan cara perendaman
menggunakanpelarutdengan sesekali pengadukanpadatemperaturkamar.
Remaserasi berarti dilakukanpengulangan penambahan pelarut setelah dilakukan
penyaringanmaseratpertamadanseterusnya.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia menggunakan alat perkolator
dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang
umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap
pengembangan bahan, tahap maserasi antara, tahap perkolasi sebenarnya
(penetesan/penampungan ekstrak), terus-menerus sampai diperoleh perkolat.
B. Cara panas
1. Refluks
Refluksadalah proses penyariansimplisiadenganpelarut pada temperatur
titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas yang relatif
konstan dengan adanya pendingin balik.
2. Digesti
Digesti adalah proses penyarian simplisia dengan pengadukankontinu pada
3. Sokletasi
Sokletasiadalah proses penyarian menggunakanpelarut yang selalubaru
yang umumnya dilakukandenganmenggunakanalatsokletsehingga terjadi ekstraksi
kontinudengan jumlah pelarutrelatif konstandenganadanyapendinginbalik.
4. Infudasi
Infudasiadalah proses penyarian denganpelarut air padatemperatur 90°C
selama 15 menit.
5. Dekoktasi
Dekoktasi adalah proses penyarian dengan pelarut air pada
temperatur90°C selama 30 menit.
2.3 Uraian Kimia 2.3.1 Alkaloid
Alkaloid adalah senyawa bersifat basa yang mengandung satu atau lebih
atom nitrogen yang terletak dalam sistem siklik yang mempunyai aktivitas
fisiologi yang dapat digunakan dalam bidang pengobatan. Alkaloid biasanya
tidak berwarna, sering sekali bersifat optis aktif, kebanyakan berbentuk kristal
tetapi hanya sedikit yang berupa cairan pada suhu kamar (Harborne, 1987).
Ada tiga pereaksi yang sering digunakan dalam pemeriksaan senyawa
kimia untuk mendeteksi golongan senyawa alkaloid sebagai pereaksi
pengendapan adalah pereaksi Mayer, Bouchardat dan Dragendorff (Depkes RI,
2.3.2 Glikosida
Glikosida adalah senyawa organik yang bila dihidrolisis menghasilkan
satu atau lebih gula yang disebut glikon dan bagian bukan gula yang disebut
aglikon. Gula yang paling sering dijumpai dalam glikosida adalah glukosa. Secara
kimia dan fisiologi, glikosida alam cenderung dibedakan berdasarkan bagian
aglikonnya (Robinson, 1995).
Menurut Farnsworth (1996), berdasarkan hubungan ikatan antara aglikon
dan glikon, glikosida dapat dibagi menjadi empat yaitu:
1. Tipe O-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom O,
contoh: salicin.
2. Tipe S-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom S,
contoh: sinigrin.
3. Tipe N-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom N,
contoh: visin dan krotonosid.
4. Tipe C-glikosida, ikatan antara bagian glikon dengan aglikon melalui atom C,
contoh: aloin.
2.3.3 Saponin
Saponin adalah glikosida triterpenoid dan sterol (Harborne, 1987).
Saponin mula-mula diberi nama demikian karena sifatnya yang menyerupai sabun
(bahasa Latin sapo berarti sabun). Saponin merupakan senyawa aktif permukaan
yang kuat yang menimbulkan busa jika dikocok dalam air dan pada konsentrasi
yang rendah sering menyebabkan hemolisis sel darah merah, dalam larutan yang
sangat encer saponin sangat beracun untuk ikan. Beberapa saponin bekerja
sebagai antimikroba. Saponin merupakan senyawa berasa pahit dan
2.3.4 Steroid/Triterpenoid
Steroid adalah triterpen yang kerangka dasarnya sistem cincin
siklopentana perhidrofenantren. Senyawa steroid dahulu dianggap sebagai
senyawa satwa yaitu sebagai hormon kelamin, asam empedu dan lain-lain. Salah
satu estrogen hewan adalah esteron. Triterpenoid adalah senyawa yang kerangka
karbonnya berasal dari enam satuan isoprena dan secara biosintetis diturunkan
dari hidrokarbon C30 asiklik, yaitu skualen. Senyawa ini berstruktur siklik yang
relatif rumit, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Mereka
berupa senyawa tanpa warna, berbentuk kristal, seringkali bertitik leleh tinggi dan
aktif optik. Triterpenoid dapat dibagi atas 4 golongan senyawa yaitu triterpen
sebenarnya, steroid, saponin dan glikosida jantung (Harborne, 1987).
Pembagian triterpenoid berdasarkan jumlah cincin yang terdapat pada
struktur molekulnya (Robinson, 1995) yaitu:
a. Triterpenoid asiklik, yaitu triterpenoid yang tidak mempunyai cincin tertutup
dalam cincin molekulnya, contoh: skualen.
b. Triterpenoid trisiklik, yaitu triterpenoid yang mempunyai tiga cincin tertutup
dalam cincin molekulnya, contoh: ambrein.
c. Triterpenoid tetrasiklik, yaitu triterpenoid yang mempunyai empat cincin
tertutup dalam cincin molekulnya, contoh: lanosterol.
d. Triterpenoid pentasiklik, yaitu triterpenoid yang mempunyai lima cincin
tertutup dalam cincin molekulnya, contoh: α –amirin.Struktur steroid dan
Gambar 2.2Struktur dasar steroid
(Sumber : Robinson, 1995)
2.4Kromatografi
Kromatografi adalah suatu proses pemisahan berdasarkan perbedaan
perpindahan dari komponen-komponen senyawa di antara dua fase yaitu fase
diam (dapat berupa zat cair atau zat padat) dan fase gerak (dapat berupa gas atau
zat cair). Kromatografi serapan dikenal jika fase diam berupa zat padat, jika zat
cair dikenal sebagai kromatografi partisi (Sastrohamidjojo, 1985). Semua
pemisahan dengan kromatografi tergantung pada kenyataan bahwa
senyawa-senyawa yang dipisahkan terdistribusi sendiri di antara fase gerak dan fase diam
dalam perbandingan yang sangat berbeda-beda dari satu senyawa terhadap
senyawa yang lain (Sastrohamidjojo, 1985).
2.4.1 Kromatografi lapis tipis
Kromatografi lapis tipis (KLT) merupakan bentuk kromatografi planar,
dimana fase diamnnya berupa lapisan yang seragam pada permukaan bidang datar
yang didukung oleh lempeng kaca, lempeng aluminium atau lempeng plastik
(Gandjar dan Rohman, 2007). Campuran yang akan dipisah berupa larutan yang
ditotolkan baik berupa bercak ataupun pita. Setelah plat atau lapisan dimasukkan
gerak), pemisahan terjadi selama perambatan kapiler (pengembangan).
Selanjutnya senyawa yang tidak berwarna harus ditampakkan (Stahl, 1985).
a. Penyerap/Fase diam KLT
Fase diam yang digunakan dalam KLT merupakan Penyerap berukuran
kecil dengan diameter partikel antara 10-30 µm. Semakin kecil ukuran rata-rata
partikel fase diam dan semakin sempit kisaran ukuran fase diam maka semakin
baik kinerja KLT. Penyerap yang paling sering digunakan adalah silika dan
serbuk selulosa (Gandjar dan Rohman, 2007).
b. Fase gerak pada KLT
Fase gerak yang digunakan pada KLT dapat dipilih dari pustaka, tetapi
lebih sering dengan mencoba-coba. Biasanya fase gerak yang digunakan berisi
dua campuran pelarut organik karena daya elusi campuran kedua pelarut ini dapat
mudah diatur sedemikian rupa sehingga pemisahan dapat terjadi secara optimal.
Fase gerak yang digunakan harus memiliki tingkat kemurnian yang tinggi
sehingga dapat memberikan pemisahan yang baik (Gandjar dan Rohman, 2007).
c. Harga Rf
Rf atau faktor retardasi didefinisikan sebagai perbandingan antara jarak
yang ditempuh solut dengan jarak yang ditempuh oleh fase gerak. Nilai Rf ini
terkait dengan faktor perlambatan dan nilai ini bukanlah suatu nilai fisika absolut
untuk suatu komponen, meskipun demikian dengan pengendalian kondisi KLT
secara hati-hati, nilai Rf dapat digunakan sebagai cara identifikasi untuk kualitatif.
Nilai maksimum Rf adalah 1 dan nilai minimumnya adalah 0 (Sastrohamidjojo,
1985).
Faktor-faktor yang mempengaruhi harga Rf yaitu struktur kimia dari
senyawa yang dipisahkan, sifat dari penyerap dan derajat aktifitasnya, tebal dan
keterataan dari lapisan penyerap, pelarut dan derajat kemurniannya, derajat
kejenuhan uap pengembang dalam bejana, teknik percobaan, jumlah cuplikan
yang digunakan, suhu dan kesetimbangan (Sastrohamidjojo, 1985).
2.4.2 Kromatografi lapis tipis preparatif
Kromatografi lapis tipis (KLT) preparatif merupakan salah satu
metodepemisahan dengan menggunakan peralatan sederhana. Ketebalan Penyerap
yangsering dipakai adalah 0,5-2 mm. Plat kromatografi biasanya berukuran 20 x
20 cm. Pembatasan ketebalan lapisan dan ukuran plat sudah tentu mengurangi
jumlah bahan yang dapat dipisahkan dengan KLT preparatif. Penyerapyang paling
umumdigunakan adalah silika gel. Penotolan cuplikan dilakukan dengan
melarutkancuplikan dalam sedikit pelarut.Cuplikan ditotolkan berupa pita dengan
jarak sesempit mungkin karena pemisahan tergantung pada lebar pita.Penotolan
dapat dilakukan dengan pipet tetapi lebih baik dengan penotol otomatis.
Pengembangan plat KLT preparatif dilakukan dalam bejana kaca yang dapat
menampung beberapa plat. Bejana dijaga tetap jenuh dengan pelarut pengembang
dengan bantuan kertas saring yang diletakkan berdiri disekeliling permukaan
bagian dalam bejana (Hostettmann, dkk., 1995).
2.4.3 KLT dua arah
KLT duaarahatau KLT
duadimensiinibertujuanuntukmeningkatkanresolusisampelketikakomponen-komponensolutmempunyaikarakteristikkimiayang hampirsama,
sangatberbedadapatdigunakansecaraberurutanpadasuatucampurantertentusehingga
memungkinkanuntukmelakukanpemisahananalit yang
mempunyaitingkatpolaritas yang hampirsama (Gandjar dan Rohman, 2007).
Cuplikan ditotolkan pada satu sudut lapisan yang berbentuk bujur sangkar
dan dikembangkan dengan satu sistem pelarut sehingga campuran terpisah
menurut jalur yang sejajar dengan salah satu sisi. Plat diangkat, dikeringkan,
diputar 90 derajat, lalu diletakkan di dalam sistem pelarut yang kedua sehingga
bercak yang terpisah pada pengembangan pertama terdapat di sepanjang bagian
bawah plat. Komponen yang terpisah (bercak) biasanya terdapat dimana saja pada
lapisan (Gritter, dkk., 1991).
2.5 Spektrofotometri
2.5.1 Spektrofotometri sinar ultraviolet (UV)
Spektrofotometri ultraviolet adalah pengukuran serapan cahaya di daerah
ultraviolet (200-400 nm) oleh suatu senyawa. Semua metode spektrofotometri
berdasarkan pada serapan sinar oleh senyawa yang ditentukan, sinar yang
digunakan adalah sinar monokromatis (Day dan Underwood, 2002).
Prinsip spektrofotometri ultraviolet adalah interaksi yang terjadi antara
energi yang berupa sinar monokromatis dari sumber sinar dengan materi yang
berupa molekul. Prinsip kerja spektrofotometri ultraviolet berdasarkan hukum
Lambert-Beer, bila cahaya/sinar monokromatis melalui suatu media (larutan),
maka sebagian cahaya tersebut diserap, sebagian dipantulkan dan sebagian lagi
dipancarkan ((Dachriyanus, 2004).
Spektrum ultraviolet adalah suatu gambaran yang menyatakan hubungan
(absorbansi).Sinar ultraviolet mempunyai panjang gelombang antara 200-400
nm.Serapan cahayaoleh molekul dalam daerah spektrum ultraviolet tergantung
pada
struktur elektronik dari molekul yang bersangkutan (Sastrohamidjojo, 1985).
Terdapat berbagai faktor yang mengatur pengukuran serapan (absorbansi)
UV (Gandjar dan Rohman, 2007) yaitu :
1. Adanya gugus-gugus penyerap (kromofor)
Kromofor merupakan semua gugus atau atom dalam senyawa organik
yang mampu menyerap sinar ultraviolet dan sinar tampak.
2. Pengaruh pelarut yang digunakan untuk melarutkan sampel
Spektrofotometer ultraviolet padaumumnya digunakanuntuk
(Sastrohamidjojo, 1991):
1. Menentukan jenis kromofor, ikatan rangkap terkonjugasi dan auksokrom dari
suatu senyawa organik.
2. Menjelaskan informasi dari struktur berdasarkan panjang gelombang
maksimum suatu senyawa.
3. Mampu menganalisis senyawa organik secara kuantitatif dengan menggunakan
hukum Lambert-Beer.
2.5.2 Spektrofotometri inframerah
Spektrofotometri inframerah pada umumnya digunakan untuk:
1. Menentukan gugus fungsi suatu senyawa organik
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan
daerah sidik jarinya.
Prinsip kerja spektrofotometri inframerah yaitu interaksi energi dengan
pada rentang frekuensi 4000-200 cm-1(Khopkar, 1990). Bentuk spektrum
inframerah yang dihasilkan berupa grafik yang menunjukkan persentase
transmitan yang bervariasi pada setiap frekuensi radiasi inframerah. Satuan
frekuensi yang digunakan pada garis horizontal yang dinyatakan dalam bilangan
gelombang yang didefinisikan sebagai banyaknya gelombang dalam tiap satuan
panjang. Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya
inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2,5–50 �m atau
bilangan gelombang 4000–200 cm-1. Energi yang dihasilkan oleh radiasi ini akan
menyebabkan vibrasi atau getaran pada molekul. Pita absorpsi sinar inframerah
sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi
(Dachriyanus, 2004).
Daerah spektra spektroskopi inframerah dibagi dalam tiga kisaran yaitu
inframerah dekat (12.500-4000 cm-1), inframerah tengah (4000-400 cm-1) dan
inframerah jauh (400-100 cm-1). Daerah inframerah tengah merupakan daerah
yang digunakan untuk penentuan gugus fungsi (Gandjar dan Rohman, 2007).
Identifikasi setiap ikatan yang khas dari setiap gugus fungsi merupakan
basis dari interpretasi spektrum inframerah. Ada beberapa syarat yang harus
dipenuhi dalam menginterpretasikan spektrum (Dachriyanus, 2004) yaitu:
1. Spektrum harus tajam dan jelas.
2. Spektrum harus berasal dari senyawa yang murni.
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilakn pita atau
serapan pada bilangan gelombang yang tepat.
Sinar inframerah yang dilewatkan melalui cuplikan senyawa-senyawa
organik, maka sejumlah frekuensi diserap sedang frekuensi yang lain
BAB I PENDAHULUAN
1.1Latar Belakang
Perairan Indonesia memiliki tingkat keragaman hayati yang tinggi, di
dalamnya terdapat berbagai jenis biota laut, seperti sponge. Sponge merupakan
hewan dari filum porifera yang hidup pada ekosistem terumbu karang. Sponge
mengandung senyawa metabolit sekunder aktif sehingga berpotensi untuk
dikembangkan dalam bidang pengobatan. Senyawa metabolit sekunder yang
umumnya terdapat di dalam sponge yaitu alkaloid dan steroid/triterpenoid
(Murniasih, 2003). Senyawa steroid digunakan untuk pembuatan obat kontrasepsi
oral dan antiinflamasi (Tyler, etal., 1977) serta senyawa triterpenoid digunakan
untuk penyakit diabetes, gangguan kulit dan kerusakan hati (Robinson, 1995).
Sponge diketahui mengandung senyawa bioaktif yang memiliki aktivitas
farmakologis sebagai antivirus, antimikroba, antiinflamasi dan antikanker (Joseph
dan Sujatha, 2011). Senyawa bioaktif tersebut kebanyakan diperoleh dari sponge
kelas Demospongiae terutama dari bangsa Haplosclerida seperti sponge marga
Chalinulayang tersebar di seluruh dunia, dari Indo-Pasifik sampai Karibia
(Suparno, 2005).
Penelitian yang dilakukan (Teta, etal., 2012) terhadap sponge jenis
Chalinula molitba, marga Chalinula,suku Chalinidae yang berasal dari Kepulauan
Bahamas Karibia, San Salvador menunjukkan adanya kandungan senyawa
steroid yang memiliki aktivitas antikanker dan antiinflamasi. Sponge jenis
Chalinula molitba ini bentuknya becabang, konsistensi tubuh lunak dan berwarna
Salah satu jenis sponge yang terdapat di perairan Teluk Tapian Nauli
Sibolga, Kecamatan Paruiaha, Tapanuli Tengah provinsi Sumatera Utara adalah
sponge jenis Chalinula sp, marga Chalinula, suku Chalinidae yang keberadaannya
tidak banyak dimanfaatkan oleh masyarakat sekitar dan belum ada dilakukan
penelitian sehingga belum diketahui golongan senyawa kimia yang terkandung
didalamnya serta belum ada literatur yang mencantumkan karakteristik simplisia
dari sponge jenis Chalinula sp tersebut. Berdasarkan uraian di atas, penulis
melakukan penelitian meliputi pemeriksaan golongan senyawa kimia,
karakterisasi simplisia, isolasi senyawa steroid/triterpenoid dari sponge Chalinula
sp dan identifikasi isolat yang diperoleh secara spektrofotometri ultraviolet dan
inframerah.
1.2Perumusan Masalah
a. Apakah karakterisasi simplisia spongeChalinula sp dapat dilakukan sesuai
yang tercantumpada Materia Medika Indonesia?
b. Apakah golongan senyawa kimia yang terdapat di dalam simplisia
spongeChalinula sp?
c. Apakah senyawa steroid/triterpenoid di dalam spongeChalinula sp dapat
diisolasi dan diidentifikasi secara spektrofotometri ultraviolet dan
inframerah?
1.3 Hipotesis
a. Karakterisasi simplisia spongeChalinula spdapat dilakukan sesuai yang
tercantum pada Materia Medika Indonesia.
Chalinula sp adalah golongan alkaloid, tanin, saponin, glikosida, flavonoid
dan steroid/triterpenoid.
c. Senyawa steroid/triterpenoid dapat diisolasi dan diidentifikasi secara
spektrofotometri ultraviolet dan inframerah.
1.4 Tujuan Penelitian
a. Mengetahui karakterisasi simplisia spongeChalinula sp sesuai yang
tercantum pada Materia Medika Indonesia.
b. Mengetahui golongan senyawa kimia yang terdapat di dalam simplisia
spongeChalinula sp.
c. Mengisolasi dan mengidentifikasi senyawa steroid/triterpenoid hasil isolasi
secara spektrofotometri ultraviolet dan spektrofotometri inframerah.
1.5 Manfaat Penelitian
Manfaat penelitian ini untuk memberikan informasi tentang golongan
senyawa steroid/triterpenoid yang diperoleh dari ekstrak n-heksan sponge
ISOLASI STEROID/TRITERPENOID DARI SPONGE Chalinula sp DAN IDENTIFIKASI SECARA SPEKTROFOTOMETRI ULTRAVIOLET DAN
INFRAMERAH ABSTRAK
Sponge merupakan biota laut yang mengandung senyawa metabolit sekunder aktif sehingga berpotensi untuk dikembangkan dalam bidang pengobatan. Senyawa metabolit sekunder yang umumnya terdapat di dalam sponge yaitu alkaloid dan steroid/triterpenoid. Sponge mempunyai aktivitas sitotoksik, antitumor, antivirus, antimikroba, antiinflamasi dan antikanker. Sponge jenis Chalinula sp yang digunakan terdapat di Teluk Tapian Nauli Sibolga, Kecamatan Paruiaha, Tapanuli Tengah provinsi Sumatera Utara. Tujuan penelitian untuk mengetahui karakteristik simplisia, pemeriksaan golongan senyawa kimia, isolasi dan identifikasi senyawa steroid/triterpenoid dari sponge
Chalinula sp.
Ekstraksi dilakukan secara perkolasi menggunakan pelarut n-heksan. Ekstrak yang diperoleh dianalisis secara kromatografi lapis tipis (KLT) dengan berbagai perbandingan fasegerakn-heksan-etilasetat dan sebagai penampak bercak pereaksi Liebermann-Burchard (LB), dilanjutkan isolasi secara KLT preparatif. Isolat yang diperoleh diuji kemurniannya secara KLT dua arah dan diidentifikasi secara spektrofotometri UV dan IR.
Hasil karakteristik simplisia sponge diperoleh kadar air 3,33%, kadar sari larut air 14,51%, kadar sari larut etanol 19,35%, kadar abu total 30,87% dan kadar abu tidak larut asam 5,06%. Hasil pemeriksaan golongan senyawa kimia menunjukkan adanya senyawa steroid/triterpenoid, alkaloid, glikosida dan saponin. Hasil KLT preparatif dengan fase gerak (80:20) diperoleh isolat berwarna merah ungu dan diuji kemurniannya secara KLT dua arah dengan harga Rf 0,55. Hasil identifikasi isolat secara spektrofotometri UV diperoleh absorbansi maksimum pada panjang gelombang 206,2 nm dan secara spektrofotometri IR menunjukkan adanya gugus fungsi -OH, CH-alifatik, C≡C, C=C, -CH2 dan C-O.
Isolat yang diperoleh termasuk golongan senyawa triterpenoid.
Kata kunci: Sponge Chalinula sp, steroid/triterpenoid, spektrofotometri
ISOLATIONOF STEROIDS/TRITERPENOIDS COMPOUNDS OFChalinula sp SPONGE AND IDENTIFICATION WITH ULTRAVIOLET
AND INFRARED SPECTROPHOTOMETRY ABSTRACT
Sponge is marine life contains active secondary metabolites that could be developed in the medical. Secondary metabolites compounds of sponge are alkaloids and steroids/triterpenoids. Sponge have activities of cytotoxic, antitumour, antiviral, antimicrobial, antiinflamatory and anticancer. Chalinula sp sponge can be found in coastal waters in gulf of Tapian Nauli Sibolga, Kecamatan Paruiaha, Tapanuli Tengah of North Sumatera. The aim of this research was to do determined the characterization of dried materials, examination of chemical compounds, isolation and identification of steroid/triterpenoid compounds of sponge Chalinula sp.
Extraction was percolated with n-hexane solvent. Extracts were analyzed by thin layer chromatography (TLC) withvariouscomparisons of mobile phase of
n-hexane-ethylacetate and used as reagent Liebermann- Burchard (LB), then
isolated using preparative TLC.Isolates tasted of purity with two wayTLC and identified with UV and IR spectrophotometry.
The characterization results of Chalinula sp sponge dried materials exhibited the water value 3.33%, water solubleextract value 14.51%, ethanolsoluble extract value 19.35%,totalash value 30.87% and in acid insoluble ash value 5.06%. The results of screening for chemical compounds containsteroids/triterpenoids, alkaloids, glycosides and saponins presences. The results of preparative TLC using mobile phase(80:20) obtained scarlet isolates and tested purity with two way TLC obtained Rf 0.55. The results of isolates identification obtained with UV spectrophotometry exhibited a maximumabsorbanceat wavelength 206.2 nmand IR spectrophotometry exhibited the presences OH, CH-aliphatic, C≡C, C=C,CH2, andC-O. These isolates was
triterpenoids compounds.
Key words: Chalinula sp sponge, steroid/triterpenoid, ultraviolet and infrared