SINTESIS DAN UJI AKTIVITAS KATALITIK Fe
3O
4DARI
CAMPURAN LIMBAH WIRE PLATING SLUDGE DAN
FeSO
4PADA EFISIENSI PEMBAKARAN BATU BARA
ZELFI TRALANATA YULLAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Sintesis dan Uji Aktivitas Katalitik Fe3O4 dari Campuran Limbah Wire Plating Sludge dan FeSO4
pada Efisiensi Pembakaran Batu Bara adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2013
Zelfi Tralanata Yullah NIM G44104029
ABSTRAK
ZELFI TRALANATA YULLAH. Sintesis dan Uji Aktivitas Katalitik Fe3O4 dari
Campuran Limbah Wire Plating Sludge dan FeSO4 pada Efisiensi Pembakaran Batu
Bara. Dibimbing oleh ARMI WULANAWATI dan MOHAMMAD KHOTIB.
Katalis pembakaran merupakan bahan aditif yang ditambahkan pada bahan bakar sehingga energi kalor yang dihasilkan meningkat. Katalis pembakaran yang digunakan dalam penelitian ini berupa Fe3O4 yang disintesis dari limbah wire plating
sludge PT Sumiden Cibinong dengan cara kopresipitasi antara FeCl3 dari wire
plating sludge dan FeSO4. Fe3O4 hasil sintesis dicirikan dengan menggunakan
spektrofotometer inframerah transformasi Fourier, difraktometer sinar-X, dan spektrofotometer serapan atom. Katalis Fe2O3, Fe2O3 + Fe3O4, dan Fe3O4,
masing-masing didispersikan dengan minyak, surfaktan, dan air. Katalis dicampurkan ke dalam batu bara yang memiliki nilai kalor 4596 kal/g, dengan konsentrasi keseluruhan campuran katalis di dalam batu bara adalah 0.01% (b/b). Aktivitas pembakaran yang dihasilkan dengan menggunakan penganalisi termal diferensial menunjukkan peningkatan efisiensi pembakaran dengan katalis Fe2O3 sebesar 91.0%,
sedangkan penambahan katalis Fe3O4 menurunkan efisiensi tersebut sebesar 55.6%.
Kata kunci: batu bara, Fe3O4, katalis, wire plating sludge.
ABSTRACT
ZELFI TRALANATA YULLAH. Synthesis and Catalytic Activity of Fe3O4 from
Mixture of Wire Plating Sludge waste and FeSO4 on Coal Combustion Efficiency.
Supervised by ARMI WULANAWATI and MOHAMMAD KHOTIB.
Combustion catalyst is an additive added to the fuel to increase the heat energy released. Fe3O4 was the combustion catalyst used in this study, synthesized from PT
Sumiden Cibinong wire plating sludge waste by coprecipitation between FeCl3 from
wire plating sludge and FeSO4. Synthetic Fe3O4 was characterized by using Faurier
transform infrared spectrophotometer, X-ray diffractometer, and atomic absorption spectrophotometer. The Fe2O3, Fe2O3+Fe3O4, and Fe3O4 catalysts were dispersed
separately with oil, surfactant, and water. The catalyst mixed into coal having 4596 cal/g calorific value, with overall concentration of catalyst mixture in the coal was 0.01%(w/w). The combustion activity resulted by differential thermal analyzer showed an increase of combustion fficiency of 91.0% with Fe2O3 catalist, whereas
addition of Fe3O4 catalyst decreased the efficiency of 55.6%.
ZELFI TRALANATA YULLAH
Skripsi
sebagai salah satu syarat memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2013
SINTESIS DAN UJI AKTIVITAS KATALITIK Fe
3O
4DARI
CAMPURAN LIMBAH WIRE PLATING SLUDGE DAN
Judul Skripsi : Sintesis dan Uji Aktivitas Katalitik Fe3O4 dari Campuran Limbah Wire
Plating Sludge dan FeSO4 pada Efisiensi Pembakaran Batu Bara
Nama : Zelfi Tralanata Yullah NIM : G44104029
Disetujui oleh
Armi Wulanawati, SSi, MSi Pembimbing I
Mohammad Khotib, SSi, MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Tun Tedja Irawadi, MS Ketua Departemen Kimia
PRAKATA
Segala puji dan syukur penulis panjatkan kepada Allah SWT yang telah melimpahkan begitu banyak nikmat sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Sintesis dan Uji Aktivitas Katalitik Fe3O4 dari Campuran
Limbah Wire Plating Sludge dan FeSO4 pada Efisiensi Pembakaran Batu Bara”.
Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Juli 2012 hingga Februari 2013 di Laboratorium Kimia Fisik, Departemen Kimia, Kampus IPB Dramaga, Bogor.
Penulis mengucapkan terima kasih kepada Ibu Armi Wulanawati, SSi, MSi dan Bapak Mohammad Khotib, SSi, MSi selaku pembimbing yang senantiasa memberikan arahan, dorongan semangat, dan doa kepada penulis selama melaksanakan penelitian dan penulisan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Ibu Ai dan Bapak Mail yang telah memberikan fasilitas, bantuan, serta masukan selama melakukan penelitian.
Ucapan terima kasih penulis sampaikan kepada kedua orang tua, dan Nana atas dukungan moral, doa, dan material, kepada teman seperjuangan Hendri, Bagus, dan teman-teman selama melakukan penelitian di Laboratorium Kimia Fisik, serta kepada rekan-rekan Alih Jenis Kimia atas bantuan selama penelitian.
Akhir kata penulis berharap semoga karya ilmiah ini bermanfaat bagi ilmu pengetahuan.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
METODE 1
Alat dan Bahan 1
Ruang Lingkup Penelitian 2
Pencirian Batu bara 2
Pembuatan Fe3O4 2
Pencirian Fe3O4 3
Preparasi Katalis 3
HASIL DAN PEMBAHASAN 4
Fe3O4 dari Campuran Wire plating sludge dan FeSO4 4
Difraktogram Sinar-X 6
Spektrum FTIR 6
Aktivitas Katalitik 7
SIMPULAN DAN SARAN 9
Simpulan 9
Saran 9
DAFTAR GAMBAR
1 Fe3O4 dari campuran wire plating sludge dengan FeSO4 5
2 Tipe penjajaran spin bahan ferimagnetik 5
3 Kisi Fe3O4 5
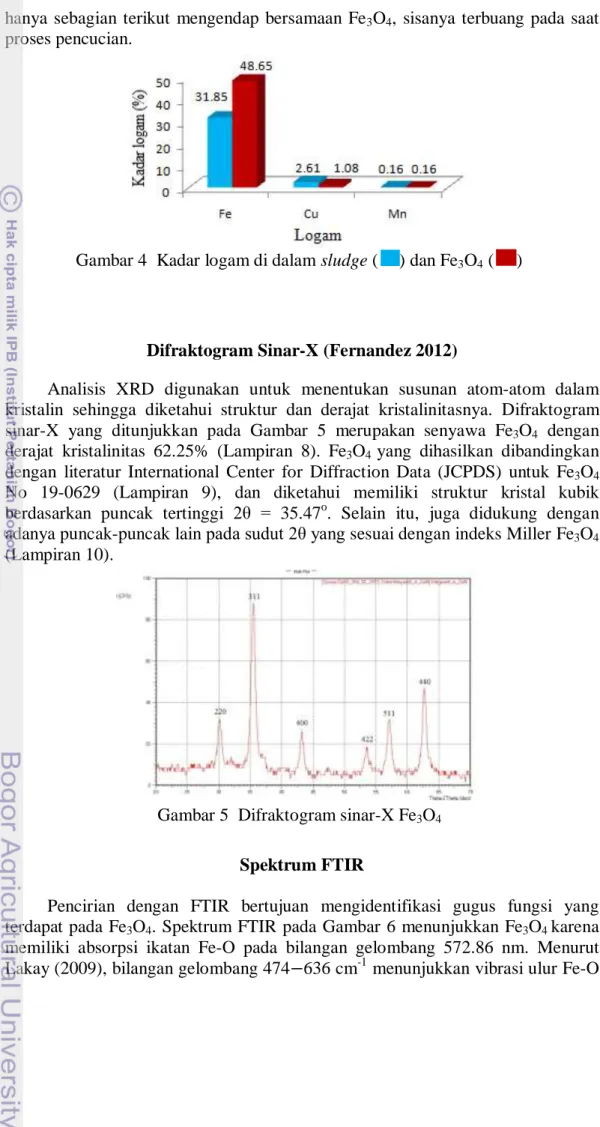
4 Kadar logam di dalam sludge ( ) dan Fe3O4 ( ) 6
5 Difraktogram sinar-X Fe3O4 6
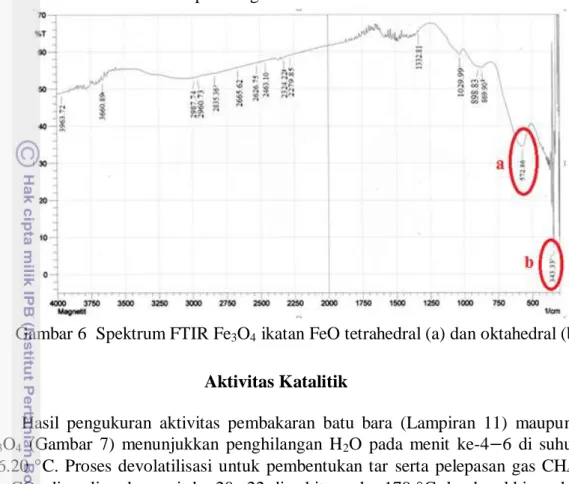
6 Spektrum FTIR Fe3O4 ikatan FeO tetrahedral (a) dan oktahedral (b) 7
7 Kurva DTA hasil pembakaran batu bara dengan katalis (Fe3O4). 7
9 Efisiensi energi pembakaran batu bara dengan berbagai katalis 9
8 Reaksi pembakaran besi oksida 8
DAFTAR LAMPIRAN
1 Bagan alir penelitian 12
2 Kadar Fe3+ dari endapan elektroplating ( maks 480 nm) 13 3 Penyiapan larutan Fe3+, Fe2O3, dan Fe3O4 15
4 Karakteristik batu bara 15
5 Kadar air batu bara 16
6 Kadar abu batu bara 17
7 Data kadar logam Fe3O4 17
8 Data kristalinitas Fe3O4 18
9 Standar Fe3O4 (JCPDS No: 19-0629) 19
10 Data indeks Miller magnetit 20
11 Kurva DTA 23
12 Efisiensi energi pembakaran batu bara 24
PENDAHULUAN
Batu bara merupakan salah satu sumber energi alternatif disamping minyak dan gas bumi, dipilih sebagai sumber energi karena relatif lebih murah dibandingkan dengan minyak bumi. Penggunaan batu bara di Indonesia meningkat pesat setiap tahunnya, terutama sebagai pembangkit listrik. Data tahun 2003 menunjukkan bahwa penggunaan batu bara di Indonesia mencapai 14.1% dari total penggunaan energi lain, dan diperkirakan akan terus meningkat hingga 34.6% pada tahun 2025 (Juniawan et al. 2011).
Batu bara sebagai bahan bakar memerlukan 3 unsur dasar, yaitu hidrogen, karbon, dan oksigen. Proses pembakaran batu bara akan menghasilkan 3 bentuk cemaran utama, yaitu oksida nitrogen (NOx), oksida sulfur (SOx), dan partikulat (Muchjidin 2006). Emisi NOx dan SOx selama pembakaran dapat menyebabkan hujan asam dan kabut fotokimia (Guan et al. 2003). Pencemaran lingkungan hasil pembakaran batu bara ini menurut Zhou et al. (2010) dapat dikurangi dengan menambahkan logam alkali, alkali tanah, dan logam transisi. Penambahan logam ini berperan sebagai katalis pembakaran yang akan menurunkan jumlah NOx sehingga tidak melebihi 10 ppm. Tanpa katalis pembakaran, jumlah NOx yang dihasilkan dapat mencapai 25−30 ppm (Ovez 2007). Katalis oksida logam transisi seperti Co3O4, CuO, Fe2O3, NiO, LaCoO3, LaFeO3, dan LaNiO3 juga dapat
meningkatkan aktivitas katalitik dengan mengoksidasi CO menjadi CO2 (Onggo
dan Fansuri 1999).
Limbah wire plating sludge mengandung logam Fe, Ca, Cu, Al, dan Mn dengan kandungan terbanyak ialah logam Fe, yaitu 55.98%, yang pada kondisi asam akan berbentuk ion Fe3+. Apabila limbah ini dicampurkan dengan batu bara, efisiensi energi maksimum pembakaran batu bara mencapai 97 − 98% (Febryanwar 2012). Pasir besi dapat dikonversi menjadi magnetit (Fe3O4) (Wu et
al. 2011). Fe3O4 hasil sintesis dengan menggunakan nisbah ion Fe3+ dan Fe2+ 2:1
akan memiliki sifat paramagnetik dan juga dapat bersifat katalis (Bakar 2011). Stoikiometri kimia dalam reaksi pembentukan Fe3O4, yaitu nisbah ion Fe3+ dan
Fe2+ sangat memengaruhi hasil akhir Fe3O4 (Malik et al. 2009). Dalam penelitian
ini, Fe3O4 disintesis dari campuran limbah wire plating sludge sebagai sumber
Fe3+ dan FeSO4 serta diuji aktivitas katalitiknya pada efisiensi energi pembakaran
batu bara.
METODE
Alat dan Bahan
Alat-alat yang digunakan adalah alat-alat kaca, saringan 100 mesh, cawan porselen, desikator, sentrifuga, neraca analitik, oven, tanur, spektrofotometer serapan atom (SSA) Shimadzu AA 6300, Spectronic 20D, penganalisis termal diferensial (DTA) DTG-60 H Simultaneous DTA-TG Apparatus, difraktometer sinar-X (XRD) Shimadzu XRD 7000, kalorimeter bom 6200, dan
2 spektrofotometer inframerah tranformasi Fourier (FTIR) IR Prastige-21Shimadzu. Bahan-bahan yang digunakan adalah limbah wire plating sludge PT Sumiden, Cibinong, Bogor, batu bara dari Lahat, Sumatera Selatan, minyak nabati, surfaktan Berol 226, HNO3, HCl (teknis), H2O2 50%, NaOH (teknis), FeSO4,
etanol 95%, H2SO4 (teknis), K2S2O8 (jenuh), KSCN 3 N, dan akuades.
Ruang Lingkup Penelitian
Tahap penelitian ini diawali dengan pencirian batu bara yang meliputi kadar abu, kadar air, dan nilai kalor. Pembuatan Fe3O4 dilakukan dengan metode
kopresipitasi kemudian produk diidentifikasi dengan menggunakan FTIR, XRD, dan SSA. Katalis dibuat dengan beberapa nisbah antara Fe3O4 dan Fe2O3,
kemudian didispersikan dengan minyak, air, dan surfaktan. Katalis yang dihasilkan dicampur dengan batu bara sehingga konsentrasi menjadi 0.01%. Campuran tersebut diuji aktivitas pembakarannya menggunakan DTA. Diagram alir penelitian disajikan dalam Lampiran 1.
Pencirian Batu bara
Kadar Abu (AOAC 2005)
Cawan porselen dikeringkan dalam oven pada suhu 105 oC selama 1 jam, kemudian dimasukkan ke dalam desikator selama 15 menit dan ditimbang hingga bobot konstan. Batu bara dimasukkan ke dalam cawan tersebut sebanyak 5 g, lalu dipijarkan di atas nyala api hingga asap putih yang dihasilkan hilang. Cawan berisi sampel hasil pemijaran dimasukkan ke dalam tanur dengan suhu 600 oC selama 5 jam. Cawan dikeluarkan dari tanur dan dibiarkan mendingin. Setelah tidak terlalu panas, cawan dimasukkan ke dalam desikator dan ditimbang hingga bobot konstan.
Kadar Air (BSN 2004)
Cawan porselen dikeringkan dalam oven pada suhu 105 oC selama 1 jam, lalu dimasukkan ke dalam desikator selama 15 menit dan ditimbang hingga bobot konstan. Batu bara dimasukkan ke dalam cawan tersebut sebanyak 5 g. Cawan berisi sampel dimasukkan ke dalam oven dengan suhu 105 oC selama 2 jam, kemudian dikeluarkan dari oven. Setelah tidak terlalu panas, cawan dimasukkan ke dalam desikator dan ditimbang hingga bobot konstan.
Nilai kalor (ASTM 1996)
Batu bara yang telah dihaluskan menjadi 100 mesh ditimbang sebanyak 0.3 g, dan diukur nilai kalornya dengan menggunakan kalorimeter bom Parr 6200.
Pembuatan Fe3O4 (Wu et al. 2011)
Padatan FeSO4 ditimbang sebanyak 18.6352 g sesuai dengan nisbah mol 2:1
antara kadar Fe3+dalam 1 L limbah wire plating sludge hasil pengukuran dengan menggunakan Spectronic 20D dan Fe2+ dalam FeSO4 (Lampiran 2). Kopresipitasi
3
campuran dilakukan dengan menggunakan 400 mL NaOH 5 M di dalam penangas ultrasonik 70 oC selama 30 menit. Senyawa Fe3O4 yang terbentuk dipisahkan dari
filtratnya menggunakan sentrifuga dengan kecepatan 3500 rpm selama 5 menit, kemudian dicuci dengan akuades dan etanol 95% sampai pH 7. Partikel dikeringkan dalam oven pada suhu 45 oC selama 2 jam.
Pencirian Fe3O4
Identifikasi Kadar Logam Fe, Cu, dan Mn (Gunawan 2011)
Senyawa Fe3O4 sebanyak 0.1295 g dilarutkan dengan 10 mL HCl dan
10 mL HNO3 kemudian dipanaskan pada suhu 150 oC. Larutan ditera dalam labu
100 mL kemudian diukur menggunakan SSA. Identifikasi XRD (modifikasi Tristao et al. 2011)
Senyawa Fe3O4 dicetak di dalam pelat kemudian diidentifikasi
menggunakan XRD. Parameter yang digunakan ialah radiasi Cu-K dan pemayaran dari 20 sampai 70 (2) dengan kecepatan 2 menit-1
. Hasil yang diperoleh dibandingkan dengan standar (JCPDS No 19-0629).
Identifikasi FTIR (modifikasi Senthil dan Ramesh 2012)
Senyawa Fe3O4 dan KBr dihaluskan menggunakan mortar agat. Campuran
tersebut diukur spektrum FTIR-nya pada 300–4000 cm-1 dengan resolusi 4 cm-1.
Preparasi Katalis (modifikasi Febrianwar 2012)
Minyak nabati sebanyak 80 mL dimasukkan ke dalam gelas piala 100 mL, kemudian ditambahkan surfaktan Berol 226 sebanyak 8 mL, akuades sebanyak 12 mL, dan campuran Fe2O3-Fe3O4 (100:0, 50:50, 0:100)% masing-masing total 3 g
pada gelas piala berbeda. Campuran diaduk hingga terdispersi, menghasilkan berturut-turut katalis (Fe2O3, Fe2O3:Fe3O4, dan Fe3O4).
Uji Aktivitas Katalitik (Onggo dan Fansuri 1999)
Katalis (Fe2O3, Fe2O3:Fe3O4, dan Fe3O4) yang telah dibuat dicampurkan
dengan batu bara. Nisbah katalis dengan batu bara ialah 1:10000. Campuran ini masing-masing dihomogenkan dengan menggunakan mortar selama ±1.5 jam kemudian ditimbang ±25 mg ke dalam krus platinum dan diuji menggunakan DTA dengan dialiri gas nitrogen. Suhu dinaikkan secara bertahap hingga mencapai 1000 oC dalam 50 menit. Batu bara tanpa katalis juga diukur menggunakan DTA.
4
HASIL DAN PEMBAHASAN
Ciri-ciri Batu Bara
Batu bara dicirikan dengan tujuan mengelompokkannya sebagai jenis bahan bakar dengan tingkat kalori rendah, sedang, atau tinggi (Lampiran 4). Berdasarkan hasil pencirian yang meliputi kadar air (Lampiran 5), kadar abu (Lampiran 6), dan nilai kalor (Tabel 1), batu bara yang digunakan termasuk jenis subbitumin dengan tingkat kalor rendah (Anam 2008).
Tabel 1 Ciri-ciri batu bara
Parameter Hasil Standar Batu Bara Subbitumin*
Kadar Air (%b/b) 26.23 10–45
Kadar Abu (%b/b) 3.93 <10
Nilai Kalor (kal/g) 4596.45 3000–6300 *Anam (2008)
Fe3O4 dari Campuran Wire plating sludge dan FeSO4
Fe3O4 dengan nisbah mol Fe3+ dan Fe2+ 2:1 berturut-turut dari campuran
wire plating sludge dan FeSO4 telah berhasil disintesis. Nisbah mol tersebut
merupakan stoikiometri yang dibutuhkan untuk membentuk oksida besi menjadi fase Fe3O4 (Ajay et al. 2002). Reaksi yang terjadi ialah sebagai berikut:
FeSO4 + 2FeCl3 + 8NaOH Fe3O4 + Na2SO4 + 6NaCl + 4H2O
(Wardiyati et al. 2007)
Pembentukan Fe3O4 dalam penelitian ini terjadi pada pH 12 karena Fe3O4
terbentuk di antara pH 8 dan 14 tanpa adanya pengaruh oksidasi dari lingkungan. Bila terjadi proses oksidasi, maka terbentuk maghemit (γ-Fe2O3) yang memiliki
sifat magnet sama seperti Fe3O4,tetapiterdapat kekosongan Fe2+ pada strukturnya
(Laurent et al. 2008). Reaksi pembentukan Fe3O4 ini dipercepat dengan
pengadukan ultrasonik (Grabis et al. 2008). Selain itu, pemanasan pada suhu 70 oC menyebabkan proses pelepasan air atau dehidrasi pada hidroksida besi sehingga terbentuk oksida besinya (Aryani 2012). Menurut Roonasi (2007), besi oksida di dalam sistem larutan berfungsi sebagai asam Lewis terhadap air atau gugus hidroksil. Gugus hidroksil ini dapat berikatan hidrogen dengan satu atau lebih atom Fe. Sludge yang telah membentuk Fe3O4 memperlihatkan sifat magnet
5
Senyawa Fe3O4 dapat tertarik magnet karena bersifat ferimagnetik.
Susunan spin terjajar secara antiparalel (Gambar 2), tetapi besarnya momen magnet ke berbagai arah tidak sama sehingga menghasilkan resultan momen magnet.
Momen ion-ion Fe magnetit yang menempati oktahedral (subkisi A) dan tetrahedral (subkisi B) dalam setiap kisi akan saling berpasangan (Gambar 3). Setiap subkisi B yang memiliki satu ion Fe2+ dan Fe3+ berpasangan dengan subkisi A yang ditempati oleh satu ion Fe3+ (Lakay 2009).
Kadar Logam Fe, Cu, dan Mn di dalam Fe3O4
Identifikasi logam pada Fe3O4 dilakukan untuk menentukan jenis dan
jumlah logam yang terkandung di dalamnya. Hasil pengukuran kadar logam Fe, Cu, dan Mn dalam Fe3O4 ditunjukkan pada Lampiran 7. Dibandingkan dengan
dalam sludge, kadar logam Fe meningkat setelah dikonversi menjadi Fe3O4
(Gambar 4). Hal ini disebabkan oleh penambahan FeSO4 pada proses
kopresipitasi. Fe3O4 yang terbentuk masih mengandung logam Cu dan Mn. Kedua
logam ini teradsorpsi pada analit dan tidak dapat dilepaskan atau teroklusi pada saat kristal tumbuh dengan cepat (Harjadi 1986). Namun, kadar logam Cu juga berkurang dalam Fe3O4 karena logam Cu memiliki nilai Ksp lebih besar dibandingkan dengan logam Fe sehingga pada saat proses presipitasi logam Cu
Gambar 1 Fe3O4 dari campuran wire plating sludge dengan FeSO4
Gambar 2 Tipe penjajaran spin bahan ferimagnetik
6 hanya sebagian terikut mengendap bersamaan Fe3O4, sisanya terbuang pada saat
proses pencucian.
Difraktogram Sinar-X (Fernandez 2012)
Analisis XRD digunakan untuk menentukan susunan atom-atom dalam kristalin sehingga diketahui struktur dan derajat kristalinitasnya. Difraktogram sinar-X yang ditunjukkan pada Gambar 5 merupakan senyawa Fe3O4 dengan
derajat kristalinitas 62.25% (Lampiran 8). Fe3O4 yang dihasilkan dibandingkan
dengan literatur International Center for Diffraction Data (JCPDS) untuk Fe3O4
No 19-0629 (Lampiran 9), dan diketahui memiliki struktur kristal kubik berdasarkan puncak tertinggi 2θ = 35.47o. Selain itu, juga didukung dengan adanya puncak-puncak lain pada sudut 2θ yang sesuai dengan indeks Miller Fe3O4
(Lampiran 10).
Spektrum FTIR
Pencirian dengan FTIR bertujuan mengidentifikasi gugus fungsi yang terdapat pada Fe3O4. Spektrum FTIR pada Gambar 6 menunjukkan Fe3O4 karena
memiliki absorpsi ikatan Fe-O pada bilangan gelombang 572.86 nm. Menurut Lakay (2009), bilangan gelombang 474−636 cm-1 menunjukkan vibrasi ulur Fe-O
Gambar 5 Difraktogram sinar-X Fe3O4
7
pada bagian tetrahedral dari Fe3O4, sedangkan bilangan gelombang <400 cm-1
berasal dari vibrasi ulur Fe-O pada bagian oktahedral.
Aktivitas Katalitik
Hasil pengukuran aktivitas pembakaran batu bara (Lampiran 11) maupun Fe3O4 (Gambar 7) menunjukkan penghilangan H2O pada menit ke-4−6 di suhu
116.20 C. Proses devolatilisasi untuk pembentukan tar serta pelepasan gas CH4
dan CO2 diawali pada menit ke-20−22 di sekitar suhu 170 C dan berakhir pada
suhu 467.45 C (Nukman 2008).
Partikel batu bara berinteraksi dengan besi oksida melalui proses reduksi. Proses ini sangat lambat akibat kurangnya kontak langsung di antara partikel-partikel tersebut. Oleh karena itu, proses reduksi sesungguhnya terjadi antara gas karbon monoksida (CO) dan padatan besi oksida (Baliarsingh dan Mishra 2008). Hasil penelitian Tristao et al. (2011) menunjukkan bahwa metana (CH4) pada
Gambar 6 Spektrum FTIR Fe3O4 ikatan FeO tetrahedral (a) dan oktahedral (b)
8 suhu 600 C akan mengalami gasifikasi karbon menjadi CO yang berperan sebagai reduktor besi oksida. Nilai energi aktivasi reaksi gasifikasi ini tinggi karena berjalan endotermik (Perry 1984). Reaksi gasifikasi karbon dengan gas CO2 berjalan mengikuti persamaan berikut:
C + O2 CO2
C + CO2 2CO
Laju gasifikasi karbon dipengaruhi oleh laju perpindahan massa gas oksida (CO2
dan O2) untuk mengoksidasi karbon. Semakin tinggi suhu, laju difusi dan
konveksi gas oksida semakin tinggi sehingga laju gasifikasi karbon juga meningkat.
Penambahan katalis Fe2O3 meningkatkan efisiensi energi pembakaran
karena dengan adanya karbon monoksida (CO) di sekitar suhu 700−900 C, Fe2O3 akan tereduksi dalam 2 tahap membentuk FeO dan CO2 (Gambar 8 tahap 1
dan 2). Menurut Gong et al. (2010), penggunaan katalis Fe2O3 dan CeO2 pada
pembakaran batu bara bitumin, antrasit, dan grafit dapat meningkatkan aktivitas pembakaran dengan mempercepat pembakaran karbon terikat. Salah satu logam transisi yang dominan di dalam sludge ialah logam Fe, yang dapat meningkatkan pembakaran karena memiliki valensi Fe0, Fe2+, dan Fe3+ dengan orbital d terisi sebagian. Orbital d yang masih kekurangan elektron tersebut dapat menangkap elektron dari reaktan dan membentuk ikatan kuat sehingga mengaktifkan senyawa yang bereaksi (May dan Hirs 2005).
.
Nilai efisiensi energi pembakaran dapat dihitung dari besarnya bobot hilang pada saat proses pembakaran (Lampiran 12). Nilai efisiensi pembakaran didapati menurun dengan penambahan katalis Fe3O4 dibandingkan dengan katalis Fe2O3
(Gambar 9). Hal ini disebabkan proses pembakaran langsung terjadi pada tahap 2. Selain itu, menurut Zhang et al. (1999), penggunaan Fe3O4 yang direaksikan
dengan gas H2/N2 pada pemanasan 300 C akan membentuk Fe3O4- yang
kekurangan oksigen dan terjadi loncatan elektron antara Fe2+ dan Fe3+ di dalam struktur Fe3O4-. Adsorpsi CO2 oleh Fe3O4- memudahkan elektron dari Fe3O4-
didonorkan ke atom C dari CO2. Oksigen dari CO2 akan berada dalam bentuk O2
Gambar 8 Reaksi pembakaran besi oksida (Zhang et al. 1999, Ishizaki et al. 2010)
3Fe2O3 2Fe3O4 + CO/CO2
2C + 3Fe + 3O2 Fe3O4- + C C/CO CO2 N2/H2 O2 O2 (tahap 1) (tahap 3) 6FeO + 3CO/CO2 (tahap 2) 2C/CO
9
dan dipindahkan ke dalam kisi Fe3O4- yang kosong oksigen sehingga
menghasilkan C (tahap 3). Hal ini yang dapat meningkatkan bobot hilang pada penggunaan katalis Fe3O4 bila dibandingkan dengan pembakaran batu bara tanpa
katalis (Lampiran 12).
Gambar 9 Efisiensi energi pembakaran batu bara dengan berbagai katalis
SIMPULAN DAN SARAN
Simpulan
Fe3O4 dapat dibuat dari campuran limbah wire plating sludge dan FeSO4
dengan menggunakan metode kopresipitasi. Katalis Fe3O4 memiliki efisiensi
energi pembakaran sebesar 55.68%. Hal ini menunjukkan bahwa Fe3O4
menurunkan efisiensi energi pembakaran dibandingkan dengan katalis Fe2O3.
Saran
Uji aktivitas energi pembakaran menggunakan DTA dilakukan dengan meminimumkan pengaruh gas N2 melalui kondisi oksigen berlebih yang
meningkatkan aktivitas pembakaran.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2005. Official Method of Analysis
of The Association of Official Analytical Chemists. Ed ke-15, Vol ke-2. Arlington
(US): AOAC.
[ASTM] American Society for Testing and Materials. 1996. Standard Test Method for
Gross Calorific Value of Solid Fuel by the Adiabatic Bomb Calorimeter. ASTM
D2015. Washington DC (US): ASTM.
Ajay K Gupta, Curtis A. 2002. Surface modification of superparamagnetic iron oxide nanoparticles and their intracellular uptake. Eur Cell and Mater. 4(2):101-102.
10
Anam A. 2008. Dimethyl ether (DME) dari batu bara sebagai bahan bakar gas alternatif selain LPG. J Ilm Tek Energi. 4(1):37-57.
Aryani A. 2012. Pembuatan komposit magnet oksida besi karbon aktif sebagai adsorben Cs dan Sr [skripsi]. Bogor (ID): Institut Pertanian Bogor.
[BSN] Badan Standardisasi Nasional. 2004. Cara Uji Mangan (Mn) Secara Destruksi
Asam dengan Spektrofotometer Serapan Atom (SSA). SNI 06-6992.7-2004. Jakarta
(ID): BSN.
Bakar A. 2011. Perbedaan kerentangan magnet antara emas (Au) dan magnetit (Fe3O4)
untuk pemisahan emas dari konsentrat akhir pendulangan emas. J Ind Soc Integ
Chem. 7(3):1-11.
Baliarsingh KS, Mishra B. 2008. Kinetics of iron ore reduction by coal and charcoal [tesis]. Rourkela (IN): National Institute of Technology.
Bowen BH, Irwin MW. 2008. Coal Characteristics. Lafayete (IN): Purdue University. Febryanwar E. 2012. Limbah sludge wire electroplating sebagai katalis efisiensi
pembakaran batu bara [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Fernandez BR. 2012. Sintesis, pelapisan dan stabilitas senyawa oksida besi oleh silika dan aplikasinya untuk amobilisasi protein [disertasi]. Padang (ID): Universitas Andalas.
Grabis J, Heidemane G, Rasmane D. Preparation of Fe3O4 and -Fe2O3 nanoparticles by
liquid and gas phase processes. Mater Sci. 14(4):292-295.
Guan R, Li W, Chen H, Li B. 2003. The release of nitrogen species during pyrolysis of model chars loaded with different additives.Fuel Process Technol. 85:1025-1037. Gunawan D. 2011. Petunjuk Pelatihan Instrumentasi. Semarang (ID): FMIPA UNNES. Harjadi W. 1986. Ilmu Kimia Analitik Dasar. Jakarta (ID): Gramedia
Ishizaki K, Nagata K, Hayashi T. 2007. Localized heating and reduction of magnetite ore with coal in composite pellets using microwave irradiation. ISI J Int. 47(6):817-822. Juniawan S, Ulfin I, Widiastuti N. 2011. Adsorpsi ion logam Cu(II) dalam larutan pada
abu dasar batu bara menggunakan metode kolom [skripsi]. Surabaya (ID): Institut Teknologi Sepuluh November.
Lakay EM. 2009. Superparamagnetic iron-oxide based nanoparticles for the separation and recovery of precious metals from solution [tesis]. Matieland (ZA): University of Stellenbosch.
Laurent S, Forge D, Port M, Roch A, Robic C, Elst LV, Muller RN. 2008. Magnetic iron oxide nanoparticles: synthesis, stabilization, vectorization, physicochemical characterizations, and biological applications. Chem Rev. 108:2064-2110.
Malik A, Baqiya, Darmanto. 2009. Penggunaan polietilen glikol-400 pada sintesis nanopartikel Fe3O4 dan karakterisasi struktur serta kemagnetannya. J Ind Mater Sci.
74-77.
May WR, Hirs EA. 2005. Catalyst for improving the combustion efficiency of petroleum fuels in diesel engines. Di dalam: Edward A. The 11th Diesel Engine Emissions Reduction Conference II; 2005 Agu 21-25; Chicago, Amerika Serikat. Chicago
(US): SFA International. hlm 1-16.
Muchjidin. 2006. Pengendalian Mutu dalam Industri Batu Bara. Bandung (ID): Institut Teknologi Bandung.
Nukman. 2008. Dekomposisi volatile matter dari batu bara Tanjung Enim dengan menggunakan alat thermogravimetry analyzer (TGA). J Mak Tek. 12(2):65-69. Onggo D, Fansuri H. 1999. Penggunaan differential thermal analysis (DTA) pada
penentuan aktivitas dan reaktivitas katalis Fe2O3, Co3O4, NiO, CuO, dan LaMO3
(M = Fe, Co, dan Ni) untuk oksidasi CO menjadi CO2. J Mat Sci. 4:13-19.
Ovez ON. 2007. The removal of carbon monoxide by iron oxide nanoparticle in car exhaust [tesis]. Turki (TK): Dokuz Eylul University.
Perry RH. 1984. Perry’s Chemical Engineering Hand Book. International Student Edition. Ed ke-6. Tokyo (JP): Mc-Graw-Hill.
11
Roonasi P. 2007. Adsorption and surface reaction properties of synthesized magnetite nano-particles [tesis]. Sweden (SE): Lulea University of Technology.
Senthil M, Ramesh C. Biogenic synthesis of Fe3O4 nanoparticles using Tridax
procumbens leaf extract and its antibacterial activity on pseudomonas aeruginosa. J Nano Mat Biostruc. 3(7):1655-1660
Tristao JC, Oliveira AS, Ardisson JD, Dias A, Lago RM. 2011. Facile preparation of carbon coated magnetic Fe3O4 particles by a combined reduction/CVD process. J
Mat Res Bull. 46:748-754
Wardiyati S, Yusuf S, Handayani A. 2007. Sintesis nanopartikel oksida besi dengan metode emulsi menggunakan surfaktan cetyl trimethyl ammonium bromide (CTAB). J Ind Mat Sci. 151-155.
Wu S, Sun A, Zhai F, Wang J, Xu W, Zhang Q, Volinsky A. 2011. Fe3O4 magnetic
nanoparticles synthesis from tailings by ultrasonic chemical co-precipitation. J Mat
Lat. 65:1882-1884.
Zhang CL, Li S, Wang LJ, Wu TH, Peng SY. 1999. Studies on the decomposing carbon dioxide into carbon with oxygen-deficient magnetite II. The effects of properties of magnetite on activity of decomposition CO2 and mechanism of the reaction. J
Chem Phys. 62:52-61.
Zhou B, Sukesh P, Hare J, Harding S, Black S, Johnson K, penemu; Headwaters Technology Innovation LLC. 2008 Apr 15. Method for reducing NOx during
combustion of coal in a burner. US Patent 7 357 903 B2.
Zhou B, Wu Z, Fransson M, penemu; Headwaters Technology Innovation LLC. 2010 Jul 20. Crystalline nanocatalyst combustion properties of fuel and fuel compositions incorporating such catalysts. US Patent 7 758 660 B2.
Zhao Z, Li W, Li B. 2001. Catalytic reduction of NO by coal char loaded with Ca and Fe in various atmospheres. J Fuel. 81:1559-1564.
12 Lampiran 1 Bagan alir penelitian
Uji DTA Preparasi
Fe2O3
Wire plating sludge
Pembuatan katalis 3% (100:0; 50:50; 0:100%) Kandungan logam menggunakan AAS Katalis 0.01% FTIR Pencirian Batu Bara Preparasi Fe3O4 SSA Pencirian XRD
13
Lampiran 2 Kadar Fe3+ dari endapan elektroplating ( maks 480 nm) Konsentrasi Standar Fe3+ (ppm) Absorbans 2 0.024 4 0.031 6 0.050 8 0.054 10 0.073 Sampel 0.034
Regresi linear yang diperoleh:
𝑦 = 0.0101 + 6.05 × 10−3𝑥 r = 0.9823
Absorbans sampel yang diperoleh: 0.034 Jadi konsentrasi Fe3+ di dalam sampel adalah 0.034 = 0.0101 + 6.05 × 10−3𝑥
𝑥 = 3.9504 ppm
Faktor pengenceran = 10000× Konsentrasi sampel sebenarnya: 3.9504 ppm × 10000 = 39504 ppm Konsentrasi Fe3+ dalam M adalah: Fe3+ =39504 mg L × 1 mol 161 g× 1 g 1000 mg= 0.2453 M mol = 0.2453 M × 1 L = 0.2453 mol 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08 0 2 4 6 8 10 12 A b so rb an s Kurva standar Fe3+ Konsentrasi standar Fe3+ (ppm)
14 lanjutan Lampiran 2
Stoikiometri pembuatan oksida besi Fe3O4
2Fe3+ + Fe2+ FeO·Fe2O3 atau Fe3O4
0.2453 mol 1 2 0.2453 mol 1 2 0.2453 mol Perhitungannya ialah FeSO4 mol = 1 2× 0.2453 = 0.1226 mol g = 0.1226 mol × 152 g mol = 18.6352 g
Dengan kandungan mol Fe3+ dari wire plating sludge sebesar 0.2453 mol, diperlukan bobot FeSO4 sebanyak 18.6352 g untuk membentuk Fe3O4 dengan
15
Lampiran 3 Penyiapan larutan Fe3+, Fe2O3, dan Fe3O4
Pembuatan Larutan Fe3+ Sludge (Wu et al. 2011)
Sludge sebanyak 10.0087 g dilarutkan dengan 500 mL HCl teknis 37% dengan pemanasan pada suhu 70 C, kemudian disaring dan diambil filtratnya. Filtrat hasil penyaringan ditambahkan 10 mL H2O2 50% sehingga semua ion besi
berada dalam bentuk Fe3+. Larutan Fe3+ ditambahkan NaOH 5 M sampai terbentuk endapan Fe(OH)3 berwarna cokelat. Endapan disaring kemudian
dilarutkan dengan 30 mL HCl teknis 35% dan ditera dengan akuades pada labu takar 1 L.
Pengukuran Kadar Fe3+
Larutan stok FeCl3 3000 ppm dibuat dengan cara melarutkan FeCl3
sebanyak 3 g dengan akuades kemudian ditera dalam labu 1 L. Larutan standar dibuat dari larutan stok Fe3+ dengan deret 0, 2, 4, 6, 8, dan 10 ppm masing-masing dalam labu 50 mL. Setiap larutan standar tersebut ditambahkan 2 mL H2SO4 pekat
dan 3 mL K2S2O8 jenuh kemudian ditera dengan akuades. Campuran ini diambil
sebanyak 10 mL, dimasukkan ke dalam gelas piala 50 mL, kemudian ditambahkan 10 mL akuades, 1 mL K2S2O8, dan 4 mL KSCN 3 M. Absorbans
diukur menggunakan Spectronic 20D pada 480 nm (Lampiran 13). Larutan Fe3+
sludge perlakukan sama seperti larutan standar, hanya dilakukan pengenceran 10000×.
Pembuatan Fe2O3
Wire plating sludge dihaluskan menggunakan mortar kemudian disaring menggunakan saringan 100 mesh. Sludge ini diabukan pada suhu 600 C sehingga besi yang terkandung di dalam sludge menjadi Fe2O3 (sampel B).
Lampiran 4 Karakteristik batu bara (Bowen dan Irwin 2008)
Parameter Antrasit Bituminus Subbituminus Lignit Nilai kalor (btu/lb) 1300015000 1100015000 850013000 40008300
Kadar air (%) < 15 215 1045 3060
Karbon terikat (%) 8598 4585 3545 2535
Kadar abu (%) 1020 312 10 1050
Kadar sulfur (%) 0.60.8 0.74.0 <2.0 0.41.0 Kadar klorin (ppm) 340 ± 40 ± 340 120 ± 20 120 ± 20
16 Lampiran 5 Kadar air batu bara
Bobot (g)
No Cawan
kosong Batu bara
Batu bara + cawan setelah dioven Kadar air (%) 1 26.8582 5.0321 30.5694 26.24 2 17.8600 5.0411 21.5774 26.25 3 17.1693 5.0334 20.8838 26.20 Rerata 26.23
Contoh perhitungan kadar air no 1
% Kadar air = Cawan kosong + Batu bara − (Batu bara setelah di oven) Batu bara
= 26.8582 + 5.0321 g − 30.5694 g
5.0321 g × 100%
17
Lampiran 6 Kadar abu batu bara
Sampel Bobot (g) Kadar abu
(%) Cawan kosong Sampel Abu + cawan
1 2 3 28.4672 30.7146 38.3875 5.0055 5.0197 5.0021 28.7101 30.8984 38.5524 4.85 3.66 3.29 Rerata 3.93
Contoh perhitungan batu bara no 1
% Kadar abu = Abu + Cawan − (Cawan Kosong) Sampel
= 28.7101 − 28.4672 g
5.0055 g × 100%
% Kadar abu = 4.85%
Lampiran 7 Data kadar logam Fe3O4
Logam Abs Konsentrasi Volume (mL) Faktor pengenceran Kadar ppm %b/v Fe 0.16 1.2601 100 500 486514.9597 48.65 Cu 0.2454 1.3987 100 10 10800.4385 1.08 Mn 0.5863 2.118 100 - 1635.0923 0.16
Contoh perhitungan logam Fe Diketahui bobot sampel 0.1295 g
% b v Fe =486514.9597 mg 1L × IL 1000mL× 1 g 1000 mg× 100% = 48.65% b v
18 Lampiran 8 Data kristalinitas Fe3O4
19
20 Lampiran 10 Data indeks Miller magnetit
* Calculate Condition
X-Ray Wavelength : 1.54060 (A) Crystal System : Cubic
* Lattice Constants a = 8.39494 (A) b = 8.39494 (A) c = 8.39494 (A) alpha = 90.0000 (deg) beta = 90.0000 (deg) gamma = 90.0000 (deg) No d 2 h k l 1 8.39494 10.5295 1 0 0 2 5.93612 14.912 1 1 0 3 4.84682 18.2895 1 1 1 4 4.19747 21.1492 2 0 0 5 3.75433 23.6796 2 1 0 6 3.42722 25.9775 2 1 1 7 2.96806 30.0843 2 2 0 8 2.79831 31.9565 3 0 0 9 2.65471 33.7354 3 1 0 10 2.53117 35.4352 3 1 1 11 2.42341 37.0668 2 2 2 12 2.32834 38.6391 3 2 0 13 2.24364 40.1592 3 2 1 14 2.09874 43.0652 4 0 0 15 2.03607 44.4601 4 1 0 16 1.97871 45.8212 3 3 0 17 1.92593 47.1516 3 3 1 18 1.87717 48.454 4 2 0 19 1.83193 49.7306 4 2 1 20 1.78981 50.9835 3 3 2 21 1.71361 53.4256 4 2 2 22 1.67899 54.6179 4 3 0 23 1.64638 55.7927 5 1 0 24 1.61561 56.9515 5 1 1 25 11.5589 59.2248 5 2 0 26 1.5327 60.3413 5 2 1 27 1.48403 62.5384 4 4 0 28 1.46137 63.6204 4 4 1 29 1.43972 64.6925 5 3 0
21 lanjutan Lampiran 10 No d 2 h k l 30 1.419 65.7551 5 3 1 31 1.39916 66.8089 6 0 0 32 1.38012 67.8545 6 1 0 33 1.36184 68.8924 6 1 1 34 1.32736 70.947 6 2 0 35 1.31107 71.9646 5 4 0 36 1.29537 72.9764 5 4 1 37 1.28022 73.9828 5 3 3 38 1.26559 74.9841 6 2 2 39 1.25144 75.9807 6 3 0 40 1.23777 76.973 6 3 1 41 1.21171 78.9461 4 4 4 42 1.19928 79.9276 7 0 0 43 1.18722 80.906 5 5 0 44 1.17553 81.8818 5 5 1 45 1.16417 82.8553 6 4 0 46 1.15313 83.8266 7 2 0 48 1.12182 86.7312 6 4 2 49 1.11194 87.6971 7 2 2 50 1.10231 88.6624 7 3 0 51 1.09293 89.6274 7 3 1 52 1.07486 91.5572 6 5 0 53 1.06616 92.5226 6 5 1 54 1.04937 94.4558 8 0 0 55 1.04126 95.4243 7 4 0 56 1.03335 96.3942 8 1 1 57 1.02561 97.366 7 3 3 58 1.01804 98.34 8 2 0 59 1.01063 99.3164 8 2 1 60 1.00339 100.2955 6 5 3 61 0.98935 102.2632 6 6 0 62 0.98255 103.2524 8 3 0 63 0.97589 104.2457 7 5 0 64 0.96936 105.2433 7 5 1 65 0.96297 106.2458 6 6 2 66 0.95669 107.2533 8 3 2 67 0.95054 108.2664 7 5 2 68 0.93858 110.3109 8 4 0 69 0.93277 111.3431 9 0 0
22 lanjutan Lampiran 10 No d 2 h k l 70 0.92707 112.3827 9 1 0 71 0.92146 113.4301 9 1 1 72 0.91596 114.4859 8 4 2 73 0.91056 115.5506 7 6 0 74 0.90525 116.6249 7 6 1 75 0.8949 118.8047 6 6 4 76 0.88986 119.9117 8 5 0
23
Lampiran 11 Kurva DTA
(a) Hasil pembakaran batu bara
(b) Hasil pembakaran batu bara + katalis Fe2O3 100%
24 Lampiran 12 Efisiensi energi pembakaran batu bara
Bobot hilang Sampel Kadar air
(%) Bobot hilang (%) Energi yang terpakai (kal/g) Efisiensi energi (%) A 26.23 68.02 2750.36 59.83 B 89.79 4183.13 91.00 C 83.75 3785.62 82.35 D 65.09 2557.53 55.64
Ket : A :Batu bara
B :Batu bara + katalis Fe2O3
C :Batu bara + katalis Fe2O3 + Fe3O4
D :Batu bara + katalis Fe3O4
Contoh perhitungan untuk batu bara: Diketahui:
Nilai kalor batu bara: 4596.45 kal/g Kalor yang terpakai
Kalor = Bobot hilang % − Kadar air %
(100 % − Kadar abu % − kadar air %)× Nilai kalor batu bara
= 68.02 − 26.23
(100 − 3.93 − 26.23)× 4596.45 kal/g Kalor (energi yang terpakai) = 2750.36 kal/g
Efisiensi energi =Kalor batu bara yang terpakai
Kalor batu bara × 100% =2748.39 kal/g
4596.45 kal/g× 100% Efisiensi energi = 59.79%
25
Lampiran 13 Penentuan panjang gelombang maksimum Fe3+ Panjang gelombang (nm) Absorbans (A) 450 0.142 452 0.162 454 0.183 456 0.201 458 0.219 460 0.243 462 0.260 464 0.279 466 0.293 468 0.312 470 0.320 472 0.333 474 0.339 476 0.342 478 0.344 480 0.347 482 0.342 484 0.339 486 0.332 488 0.316 490 0.309 492 0.294 494 0.282 496 0.264 498 0.245 500 0.230
26
RIWAYAT HIDUP
Penulis dilahirkan di Bandung pada tanggal 19 Juli 1989 dari Ayah Ipik Gandamanah (Alm) dan Ibu Elah. Penulis adalah putra kedua dari 3 bersaudara. Tahun 2007 penulis lulus dari SMA Islam Cipasung, Tasikmalaya, dan pada tahun yang sama diterima di Institut Pertanian Bogor (IPB) melalui jalur PMDK pada Program Diploma Analisis Kimia. Penulis menyelesaikan pendidikan diploma pada tahun 2010 dan pada tahun yang sama melanjutkan pendidikan S1 melalui Program Alih Jenis Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Selama mengikuti perkuliahan, penulis mengikuti kegiatan seminar Safety in Laboratory Trainning, Seminar Nasional Teknologi Kimia Aplikatif, seminar peduli lingkungan save our world from global warming, wisata industri PT Djojonegoro C-1000, kegiatan talkshow Pendidikan, seminar Journalism Line – One Step to be a Great Journalist. Penulis juga melakukan kerja mandiri di PT Multi Nitrotama Kimia, Boehringer Ingelheim Indonesia, PT Era Vareasi Intertika, dan PT SGS. Penulis melakukan praktik kerja lapangan di Pusat Penelitian dan Pengembangan Teknologi Mineral dan Batu Bara (Puslitbang Tekmira) dengan judul laporan Penentuan Komposisi Batu Besi.