UJI VIABILITAS FORMULASI BAKTERI A8
SEBAGAI AGENS HAYATI DAN APLIKASINYA
PADA TANAMAN PADI
ULFAH NOPIYANTI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2013
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Uji Viabilitas Formulasi Bakteri A8 dan Aplikasinya pada Tanaman Padi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2013
Ulfah Nopiyanti
NIM G34090035
ABSTRAK
ULFAH NOPIYANTI. Uji Viabilitas Formulasi Bakteri A8 sebagai Agens Hayati dan Aplikasinya pada Tanaman Padi. Dibimbing oleh NISA RACHMANIA MUBARIK dan YADI SURYADI.
Penurunan produksi padi yang utama terjadi di Indonesia dilaporkan antara lain disebabkan oleh penyakit blas oleh cendawan Pyricularia oryzae (PO), hawar pelepah daun oleh Rhizoctonia solani (RS), dan hawar daun bakteri oleh bakteri patogen Xanthomonas oryzae pv. oryzae (Xoo). Beberapa bakteri dapat digunakan sebagai agens hayati dalam menekan gejala penyakit pada tanaman. Penelitian ini bertujuan mengetahui viabilitas formulasi A8 sebagai agens hayati dan menguji aplikasi keefektifannya dalam mengendalikan penyakit blas, hawar pelepah daun (HPD), dan hawar daun bakteri (HDB) pada tanaman padi Inpari 13 sesudah masa penyimpanan satu bulan formulasi. Viabilitas konsorsium A8 dalam media pembawa talk cenderung stabil dari bulan ke-0 sampai ke-2. Berdasarkan uji in vivo, pemberian formulasi A8 pada padi Inpari 13 secara preventif dapat menekan pertumbuhan penyakit blas, HDB, dan HPD. Intensitas penghambatan formulasi A8 paling besar didapatkan terhadap penyakit blas yaitu sebesar 75.957%.
Kata kunci: blas, formulasi A8, hawar daun bakteri, hawar pelepah daun
ABSTRACT
ULFAH NOPIYANTI. Viability test of A8 Bacterial Formulations as Biological Agents and Its Application in Rice Plant. Supervised by NISA RACHMANIA MUBARIK and YADI SURYADI.
Major decline of rice production in Indonesia, was decreases caused by blast (Pyricularia oryzae), sheath blight (SHB) caused by Rhizoctonia solani, and bacterial leaf blight (BLB) caused by a bacterial pathogen Xanthomonas oryzae pv. oryzae (Xoo). Several bacteria can be used as biological agents in suppressing plant disease. The objectives of this research are to know the viability of A8 bacterial formulation as biological agents and its effectiveness in controlling blast disease, sheath blight, and bacterial leaf blight in rice cv. Inpari 13 after one month formulation storage period. Viability of consortium A8 in talcum powder was stable from 0 to 2 month. Based on in vivo test, preventive application of A8 bacterial formulation to Inpari 13 rice plant suppressed the growth of blast, SHB, and BLB. The highest inhibition of A8 bacterial formulation against the blast reached 75.957%.
Key words: blast, A8 bacterial formulation, bacterial leaf blight, sheath blight
UJI VIABILITAS FORMULASI BAKTERI A8
SEBAGAI AGENS HAYATI DAN APLIKASINYA
PADA TANAMAN PADI
ULFAH NOPIYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTAIAN BOGOR
BOGOR 2013
Judul Skripsi : Uji Viabilitas Formulasi Bakteri A8 sebagai Agens Hayati dan Aplikasinya pada Tanaman Padi
Nama : Ulfah Nopiyanti NIM : G34090035
Disetujui oleh
Dr Nisa Rachmania Mubarik, MSi Ir Yadi Suryadi, MSc Pembimbing I Pembimbing II
Diketahui oleh
Dr Ir Iman Rusmana, MSi Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2013 sampai Juni 2013 ini ialah
biocontrol, dengan judul Uji Viabilitas Formulasi Bakteri A8 sebagai Agens
Hayati dan Aplikasinya pada Tanaman Padi.
Terima kasih penulis ucapkan kepada Ibu Dr Nisa Rachmania Mubarik dan Bapak Ir Yadi Suryadi selaku pembimbing atas bimbingan dan pengarahan yang diberikan. Demikian pula kepada Dr Nunik Sri Ariyanti, MSi sebagai dosen penguji dan wakil komisi pendidikan atas saran dan masukan yang diberikan. Terimakasih kepada Ibu Aminah, Bapak Jajang, Bapak Wawan, Ibu Susi, Mas Alam, dan Mas Ugi di Laboratorium Konservasi Mikrob BB Biogen atas segala bantuan dan saran yang diberikan selama melakukan penelitian. Di samping itu, ungkapan terima kasih penulis sampaikan atas dukungan dana yang diberikan oleh program KKP3N 2013 melalui Dr Nisa Rachmania Mubarik, MSi dan tim untuk penelitian ini.
Terima kasih kepada bapak, mamah (alm), ibu, teteh, ade, dan keluarga besar atas do’a, dukungan, dan kasih sayangnya. Penulis juga mengucapkan terimakasih kepada Icha, Yani, Baher, Lilia, Dini, Routh, Dhyah, dan Agustinus, serta teman-teman biologi 46 atas semangat yang telah diberikan, kepada keluarga WBA Kak Lintang, Dea, Kak Dina, Kak Dian, Vina, Kak Ida, Kak Wastu, Irna, dan Kak Kiki atas semangat dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, November 2013
Ulfah Nopiyanti
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN Latar Belakang 1 Tujuan Penelitian 1BAHAN DAN METODE
Bahan 2
Peremajaan Isolat Bakteri dan Cendawan 2
Uji Antagonisme Konsorsium A8 terhadap Cendawan dan Bakteri Patogen 2 Pembuatan Formulasi A8 dengan Bahan Pembawa Talk 3
Pengujian Viabilitas Formulasi 3
Aplikasi Formulasi Bakteri A8 terhadap P. oryzae, R. solani, dan Xoo secara
in vivo 3
HASIL
Peremajaan Isolat Bakteri dan Cendawan Patogen 4 Uji Antagonisme Konsorsium A8 terhadap Cendawan dan Bakteri Patogen 4
Pengujian Viabilitas Formulasi Bakteri A8 5
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap
P. oryzae secara in vivo 6
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap
R. solani secara in vivo 7
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap Xoo
secara in vivo 8 PEMBAHASAN 8 SIMPULAN 11 DAFTAR PUSTAKA 12 LAMPIRAN 15 RIWAYAT HIDUP 22
DAFTAR TABEL
1 Persentase penghambatan konsorsium A8 terhadap P. oryzae, R. solani,
dan Xoo 5
2 Viabilitas masing-masing isolat bakteri sebelum formulasi 6 3 Viabilitas konsorsium A8 setelah formulasi 6 4 Pengaruh aplikasi formulasi A8 terhadap intensitas penyakit blas
berdasarkan penilaian IRRI (1988) 6
5 Pengaruh aplikasi formulasi A8 terhadap penyakit hawar pelepah daun 7
6 Perkembangan penghambatan HPD 8
7 Penghambatan formulasi A8 terhadap hawar daun bakteri (HDB) 8
DAFTAR GAMBAR
1 Hasil uji antagonis konsorsium A8 terhadap cendawan patogen (a) P.
oryzae (b) R. solani (c) Xoo 5 2 Persentase TLR penyakit hawar pelepah daun (HPD) pada kontrol ( )
dan formulasi ( ) dari minggu ke-0 sampai minggu ke-3 7
DAFTAR LAMPIRAN
1 Sifat varietas unggul padi Inpari 13 15 2 Komposisi media tumbuh bakteri dan cendawan 15
3 Peremajaan bakteri dan cendawan 16
4 Formulasi bakteri A8 dengan bahan pembawa talk 17
5 Spora P. oryzae 17
6 Gejala penyakit blas pada padi Inpari 13 17 7 Penilaian pengaruh aplikasi formulasi A8 terhadap penyakit blas
berdasarkan IRRI (1988) 18
8 Penyakit hawar pelepah daun (HPD) pada padi Inpari 13 di rumah kaca 18 9 Penilaian pengaruh aplikasi formulasi A8 terhadap penyakit hawar
pelepah daun (HPD) berdasarkan IRRI (1998) 19 10 Penyakit hawar daun bakteri (HDB) pada padi Inpari 13 21
PENDAHULUAN
Latar Belakang
Pertanian di Indonesia berperan sebagai penunjang kehidupan masyarakat Indonesia, khususnya di bidang pangan. Permasalahan utama produksi padi di Indonesia antara lain penyakit yang menyerang tanaman padi, seperti penyakit hawar pelepah daun (HPD) yang disebabkan cendawan Rhizoctonia solani (Prayudi 2000), penyakit blas karena terserang oleh Pyricularia oryzae, dan penyakit hawar daun bakteri (HDB) oleh bakteri patogen Xanthomonas oryzae pv.
oryzae. Ketiga penyakit tersebut telah menyebabkan terjadinya penurunan
produksi padi yang cukup parah di Indonesia, baik dari kualitas maupun kuantitas. Pengendalian penyakit-penyakit tersebut melalui pemberian fungisida dengan dosis yang berlebihan dapat memberikan dampak negatif pada jangka panjang seperti masalah lingkungan, kesehatan, dan meningkatkan perkembangan populasi jasad pengganggu tanaman, sehingga perlu dilakukan upaya pemanfaatan dan pengelolaan bahan organik untuk peningkatan kualitas tanaman, di antaranya dengan menggunakan pengendali hayati. Pengendali hayati lebih aman dari pada penggunaan bahan kimia.
Bakteri dapat digunakan sebagai agens hayati pengendali penyakit tanaman, antara lain: Pseudomonas flourescens (Ashofteh et al. 2009), P.
aeruginosa (Saikia et al. 2006), dan Bacillus spp. (Kim et al. 2009). Spesies
bakteri dari genus Bacillus dan Pseudomonas yang tergolong plant growth
promoting rhizobacteria (PGRP) selain memicu pertumbuhan tanaman juga dapat
meningkatkan ketahanan terhadap penyakit. Berdasarkan penelitian sebelumnya, formulasi konsorsium A8 dilaporkan mampu menekan penyakit blas dan HPD pada tanaman padi (Syachroni 2011; Zaffan 2012).
Bahan pembawa atau media untuk formulasi harus mengandung komponen penting yang mendukung daya viabilitas dan pertumbuhan mikrob yang diinokulasi ke dalamnya. Beberapa bahan pembawa yang dapat digunakan untuk formulasi inokulan antara lain bentuk padat (granul), tepung (talk dan bentonit), dan suspensi. Bahan pembawa talk memiliki penampakan berupa bubuk yang halus, ringan, dan memiliki kemampuan untuk menyerap cairan. Penggunaan agens pengendali hayati dapat memberikan manfaat ganda memacu pertumbuhan tanaman (biofertilizer) dan mengendalikan patogen tanaman (biopesticide) (Kumar et al. 2005), sehingga permasalahan mengenai viabilitas sel bakteri yang terkandung di dalamnya menarik untuk dikembangkan.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui viabilitas konsorsium A8 sebagai agens hayati dengan bahan pembawa talk dan menguji aplikasi keefektifannya dalam mengendalikan penyakit blas, hawar pelepah daun (HPD), dan hawar daun bakteri (HDB) pada tanaman padi setelah 1 bulan masa penyimpanan formulasi.
2
BAHAN DAN METODE
Bahan
Bahan yang digunakan ialah konsorsium bakteri A8 (Bacillus firmus E65,
Pseudomonas aeruginosa C32b, Serratia marcescens E.31 yang berasal dari
koleksi Laboratorium Konservasi Mikrobiologi BB Biogen, dan Bacillus cereus II.14 yang berasal dari koleksi Laboratorium Mikrobiologi, Departemen Biologi FMIPA IPB), bakteri patogen Xanthomonas oryzae pv. oryzae (Xoo) 23D, cendawan Pyricularia oryzae, Rhizoctonia solani, bibit padi Inpari 13 (inbrida padi irigasi) (Lampiran 1), dan talk.
Peremajaan Isolat Bakteri dan Cendawan
Semua jenis isolat bakteri A8 (B. firmus, B. cereus, S. marcescens, dan P.
aeruginosa) diremajakan dan diperiksa terlebih dahulu kemurniannya dengan
menggunakan metode kuadran. Biakan yang telah murni kemudian diperbanyak dan dipindahkan pada medium nutrient agar (NA). Bakteri patogen Xoo diperbanyak dengan memindahkan kultur pada medium wakimoto agar (WA) (Lampiran 2). Cendawan P. oryzae dan R. solani diremajakan pada cawan petri berisi media potato dextrose agar (PDA), diinkubasi pada suhu ruang selama 15 hari untuk P. oryzae dan 3 hari untuk R. solani. Masing-masing peremajaan dilakukan sebanyak 5 kali ulangan (Lampiran 3).
Uji Antagonisme Konsorsium A8 terhadap Cendawan dan Bakteri Patogen Masing-masing isolat bakteri ditumbuhkan pada medium nutrient broth (NB) 25 mL di dalam erlenmeyer hingga populasi mencapai 108 cfu mL-1. Uji daya hambat secara in vitro terhadap P. oryzae dan R. solani dilakukan dengan metode dual culture test dengan menggunakan media PDA, dan dilakukan 3 kali ulangan. Pengamatan daya hambat dilakukan 15 hari setelah inkubasi untuk uji antagonis terhadap P. oryzae dan 3 hari untuk R. solani pada suhu ruang. Pengamatan dilakukan terhadap ada tidaknya zona hambat dengan pengukuran persentase zona hambat mengikuti formula Fokkema (1983), yaitu:
M% = (M0 – M1)/M0 x 100%
Keterangan: M%: persentase penghambatan; M0: diameter miselia cendawan tanpa kehadiran bakteri antagonis; M1: diameter miselia cendawan dengan kehadiran bakteri antagonis
Uji daya hambat konsorsium A8 terhadap Xoo dilakukan menggunakan metode double layer (Lisboa et al. 2006). Uji daya hambat terhadap Xoo secara in
3
biokontrol. Sebanyak 800 μL (107
cfu mL-1) kultur cair bakteri patogen Xoo diinokulasi ke dalam 80 mL WA semipadat lalu dituang pada permukaan cawan WA padat masing-masing sebanyak 10 mL. Setelah permukaan media WA double
layer memadat, potongan kertas saring Whatman No.2 (diameter 0.5 cm) yang
telah direndam dalam larutan yang mengandung konsorsium bakteri A8 yang berumur 24 jam, kertas cakram dikeringanginkan kemudian diletakkan di tengah cawan petri yang berisi biakan bakteri Xoo. Indeks aktivitas antimikrob dihitung dengan cara Patra et al. (2009):
Indeks aktivitas antimikrob = Nilai penghambatan perlakuan x 100% Nilai penghambatan kontrol
Pembuatan Formulasi Bakteri A8 dengan Bahan Pembawa Talk Talk disterilkan dengan autoklaf selama 90 menit pada suhu 121°C dengan tekanan 1 atm. Inokulasi formulasi bakteri dilakukan dengan mencampurkan talk sebanyak 1 Kg dengan 300 mL suspensi konsorsium A8 yang berumur 24 jam dengan jumlah sel awal sebesar 108 cfu mL-1 lalu ditambah dengan 10 gram karboksi metil selulosa (CMC), serta 15 gram CaCO3. Campuran tersebut dibuat untuk formulasi A8 (Lampiran 4). Setelah diinokulasi, campuran diaduk hingga homogen dan disimpan pada suhu ruang.
Pengujian Viabilitas Formulasi
Uji viabilitas konsorsium A8 dilakukan dengan mengencerkan 1 gram formulasi talk dengan 9 mL NaCl steril 0.85%, kemudian dilakukan pengenceran serial dari 10-1 sampai 10-7. Perhitungan populasi sel dilakukan dengan metode cawan sebar atau total plate count (TPC). Uji viabilitas dilakukan pada minggu ke-0 (sebelum formulasi) dan setelah formulasi yaitu pada bulan ke-0, ke-1, sampai bulan ke-2.
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap
P. oryzae, R. solani, dan Xoo secara in vivo
Benih padi Inpari 13 disterilkan dengan menggunakan alkohol kemudian direndam dan dibersihkan dengan akuades steril, kemudian dikecambahkan selama ± 4 hari sampai berkecambah. Benih yang sudah berkecambah kemudian ditanam di dalam pot kecil berisi tanah sawah. Formulasi A8 sebanyak 3 gram dicairkan di dalam 100 mL akuades steril kemudian disemprotkan secara preventif pada tanaman padi sebelum inokulasi spora P. oryzae, R. solani, dan Xoo.
Tanaman diberi penilaian penyakit blas berdasarkan sistem evaluasi standar IRRI (1988), kemudian intensitas blas dihitung dengan menggunakan rumus:
4
IS = Ʃn x v x 100% N x V
Keterangan:
IS : intensitas serangan
n : jumlah daun yang terkena blas v : nilai skor serangan
N : jumlah semua daun yang diamati V : nilai skor serangan tertinggi.
Pengamatan intensitas penyakit HPD dengan mengukur tinggi lesio relatif (TLR) (Suryadi et al. 1991):
TLR = panjang lesio x 100% tinggi tanaman
Selanjutnya dilakukan penghitungan area under disease progress curve (AUDPC). Luasan area di bawah kurva perkembangan penyakit ini ditentukan untuk mengetahui hubungan antara intensitas penyakit terhadap respon waktu (Shaner dan Finney 1977):
n
AUDPC =
Σ
(yi+ yi+ 1) (ti + 1 – ti)i =1 2
Keterangan:
n : jumlah pengamatan ti : waktu pengamatan yi : intensitas penyakit HDB
Pengamatan terhadap gejala penyakit HDB dilakukan pada 7 hari setelah inokulasi (hsi) dan 14 hari setelah inokulasi (hsi) melalui pengukuran panjang lesio (lesion length) HDB, tinggi daun, dan jumlah anakan. Selanjutnya dilakukan perhitungan panjang lesio kontrol dan formulasi untuk mendapatkan persentase indeks penghambatan formulasi A8 terhadap penyakit HDB.
HASIL
Peremajaan Isolat Bakteri dan Cendawan
Isolat bakteri yang tergabung ke dalam konsorsium A8 berhasil diremajakan dan mampu tumbuh dalam waktu 24 jam pada media nutrient agar (NA). Bacillus firmus membentuk koloni dengan ciri memiliki bentuk tidak beraturan dan menyebar, tepian berombak, dan elevasi timbul. Bacillus cereus, S.
marcescens, dan P. aeruginosa tumbuh dengan ciri yang hampir sama, yaitu
bentuk bundar, tepian licin, dan elevasi cembung. Isolat bakteri patogen mampu tumbuh pada media wakimoto agar (WA) dalam 24 jam dengan membentuk
5
koloni bulat, halus dan mengkilap serta berwarna kuning berlendir. Cendawan patogen P. oryzae mampu tumbuh setelah diinkubasi 15 hari, dan R. solani 3 hari pada media potato dextrose agar (PDA).
Uji Antagonisme Konsorsium A8 terhadap Cendawan dan Bakteri Patogen Pengujian antagonis menunjukkan adanya aktivitas penghambatan konsorsium A8 terhadap cendawan dan bakteri patogen Xoo (Gambar 1). Perlakuan konsorsium A8 terhadap seluruh cendawan dan bakteri patogen memiliki persentase penghambatan tertinggi secara berturut-turut terhadap P.
oryzae, Xoo, dan R. solani yaitu sebesar 44.444%, 32.137%, dan 25.555%. Hasil
tersebut menunjukkan bahwa secara in vitro, konsorsium A8 paling efektif dalam menghambat cendawan P. oryzae dibandingkan R. solani dan Xoo (Tabel 1).
(a) (b) (c)
Gambar 1 Hasil uji antagonis konsorsium A8 terhadap cendawan patogen (a) P. oryzae , (b) R. oryzae, dan (c) Xoo
Tabel 1 Persentase penghambatan konsorsium A8 terhadap P. oryzae, R. solani, dan Xoo
Perlakuan
Rata-rata diameter pertumbuhan cendawan (cm) dan zona hambat
Persentase penghambatan (%)*
P. oryzae R. solani Xoo P. oryzae R. solani Xoo A8 5.000±1.981 6.700±1.159 0.600±0.029 44.444 25.555 32.137 Kontrol** 8.667±0.058 9.000±0 0 ± 0 3.700 0 0 CuSO4 - - 1.867±0.115 - - 100
Keterangan: * persentase penghambatan dihitung menurut Fokkema (1983) ** akuades steril
- tidak dilakukan
Pengujian Viabilitas Formulasi Bakteri A8
Pengamatan viabilitas bakteri dilakukan sebelum formulasi dan setelah formulasi pada bulan ke-0, ke-1, dan ke-2 (Tabel 2, Tabel 3). Jumlah log sel
6
sebelum formulasi mengalami penurunan setelah berada dalam bentuk formulasi, namun setelah formulasi jumlah log sel tersebut mengalami kenaikan dari bulan ke-0 sampai ke-2. Persentase kenaikan jumlah log sel hanya 2.962%.
Tabel 2 Viabilitas masing-masing isolat bakteri sebelum formulasi
Isolat Jumlah Log sel
B. firmus E.65 8.585
B. cereus II.14 8.672
S. marcescens E.31 8.744
P. aeruginosa C.32b 8.978
Rata-rata 8.745
Tabel 3 Viabilitas konsorsium A8 setelah formulasi
Formulasi
Jumlah Log sel
Pertambahan Log sel Persentase kenaikan Log sel (%) Bulan ke-0 Bulan ke-1 Bulan ke-2 A8 8.068 8.236 8.307 0.239 2.962
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap
P. oryzae secara in vivo
Formulasi A8 diberikan secara preventif, dan inokulasi spora P. oryzae (Lampiran 5) dengan kerapatan 4.95x107 cfu mL-1 disemprotkan pada padi Inpari 13 setelah perlakuan preventif tersebut. Gejala awal penyakit blas sudah terlihat pada 4 hsi, ditandai dengan timbulnya bercak dengan tepi berwarna coklat dan pusat bercak berwarna putih atau keabu-abuan. Penyakit blas semakin terlihat pada 7 hsi dengan semakin banyak dan melebarnya bercak coklat di sepanjang daun (Lampiran 6). Penilaian aktivitas formulasi A8 berupa penekanan terhadap intensitas penyakit blas berdasarkan IRRI (1988) (Tabel 4, Lampiran 7).
Tabel 4 Pengaruh aplikasi formulasi A8 terhadap intensitas penyakit blas berdasarkan penilaian IRRI (1988)
Perlakuan Rata-rata intensitas blas (%) Persentase penghambatan (%)
Kontrol 58.933 ± 0.994 0
Formulasi A8 13.280 ± 1.842 75.957 %
Berdasarkan uji in vivo, terlihat adanya aktivitas penekanan formulasi A8 terhadap penyakit blas. Persentase penghambatan tersebut bahkan mencapai 75.957%, mengindikasikan bahwa pemberian formulasi A8 secara preventif cocok dilakukan untuk menekan pertumbuhan penyakit blas pada padi.
7
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap R. solani secara in vivo
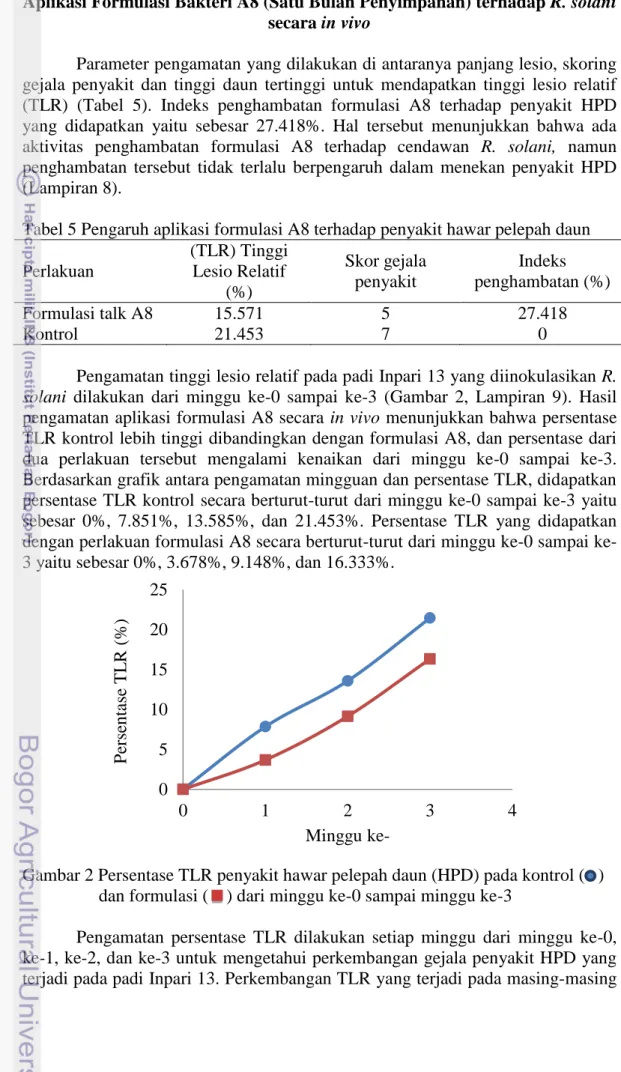
Parameter pengamatan yang dilakukan di antaranya panjang lesio, skoring gejala penyakit dan tinggi daun tertinggi untuk mendapatkan tinggi lesio relatif (TLR) (Tabel 5). Indeks penghambatan formulasi A8 terhadap penyakit HPD yang didapatkan yaitu sebesar 27.418%. Hal tersebut menunjukkan bahwa ada aktivitas penghambatan formulasi A8 terhadap cendawan R. solani, namun penghambatan tersebut tidak terlalu berpengaruh dalam menekan penyakit HPD (Lampiran 8).
Tabel 5 Pengaruh aplikasi formulasi A8 terhadap penyakit hawar pelepah daun
Perlakuan (TLR) Tinggi Lesio Relatif (%) Skor gejala penyakit Indeks penghambatan (%) Formulasi talk A8 15.571 5 27.418 Kontrol 21.453 7 0
Pengamatan tinggi lesio relatif pada padi Inpari 13 yang diinokulasikan R.
solani dilakukan dari minggu ke-0 sampai ke-3 (Gambar 2, Lampiran 9). Hasil
pengamatan aplikasi formulasi A8 secara in vivo menunjukkan bahwa persentase TLR kontrol lebih tinggi dibandingkan dengan formulasi A8, dan persentase dari dua perlakuan tersebut mengalami kenaikan dari minggu ke-0 sampai ke-3. Berdasarkan grafik antara pengamatan mingguan dan persentase TLR, didapatkan persentase TLR kontrol secara berturut-turut dari minggu ke-0 sampai ke-3 yaitu sebesar 0%, 7.851%, 13.585%, dan 21.453%. Persentase TLR yang didapatkan dengan perlakuan formulasi A8 secara berturut-turut dari minggu 0 sampai ke-3 yaitu sebesar 0%, ke-3.678%, 9.148%, dan 16.ke-3ke-3ke-3%.
Gambar 2 Persentase TLR penyakit hawar pelepah daun (HPD) pada kontrol ( ) dan formulasi ( ) dari minggu ke-0 sampai minggu ke-3
Pengamatan persentase TLR dilakukan setiap minggu dari minggu ke-0, ke-1, ke-2, dan ke-3 untuk mengetahui perkembangan gejala penyakit HPD yang terjadi pada padi Inpari 13. Perkembangan TLR yang terjadi pada masing-masing
0 5 10 15 20 25 0 1 2 3 4 P erse ntase TL R (% ) Minggu ke-
8
perlakuan diduga karena adanya aktivitas penetrasi apresorium yang terbentuk dari cendawan R. solani sehingga penyakit HPD semakin berkembang pada padi. Luasan area di bawah kurva perkembangan penyakit HPD dihitung dengan AUDPC (Tabel 6) dan ditentukan untuk mengetahui hubungan antara intensitas penyakit terhadap respon waktu.
Tabel 6 Perkembangan penghambatan HPD
Perlakuan AUDPC
Formulasi talk A8 147.012
Kontrol 225.138
Padi dengan perlakuan formulasi A8 menunjukkan indeks penghambatan sebesar 78.571% dengan nilai AUDPC hingga 147.012, lebih rendah dari kontrol yaitu sebesar 225.138.
Aplikasi Formulasi Bakteri A8 (Satu Bulan Penyimpanan) terhadap Xoo secara in vivo
Pengamatan hasil aplikasi formulasi A8 terhadap HDB secara in vivo menunjukkan indeks penghambatan sebesar 32.015% (Tabel 7). Nilai tersebut menunjukkan adanya aktivitas penekanan terhadap Xoo walaupun aktivitas tersebut tidak berpengaruh besar dalam menekan penyakit HDB. Pengamatan minggu pertama gejala penyakit HDB pada padi Inpari 13 sudah terlihat walaupun sedikit, ditandai dengan terbentuknya warna kuning kecoklatan di sekitar daerah inokulasi (Lampiran 10).
Tabel 7 Penghambatan Formulasi A8 terhadap hawar daun bakteri (HDB)
Perlakuan Panjang lesio (cm) Indeks Penghambatan (%)
Formulasi Talk A8 8.286 ± 3,420 32.015
Kontrol 12.188 ± 4,584 0
PEMBAHASAN
Pengujian antagonisme konsorsium A8 dilakukan terhadap cendawan P.
oryzae dan R. solani serta bakteri patogen Xoo. Hasil uji antagonisme konsorsium
A8 menunjukkan adanya penghambatan konsorsium tersebut terhadap kedua cendawan dan juga bakteri patogen. Berdasarkan uji antagonisme, konsorsium A8 paling berpotensi menekan pertumbuhan penyakit blas. Beberapa penelitian telah banyak melaporkan mikrob yang berpotensi sebagai biokontrol terhadap penyakit blas yang disebabkan oleh cendawan P. oryzae. Hal tersebut didukung oleh penelitian yang pernah dilakukan oleh Gnanamanickam dan Mew (1992), menunjukkan bakteri dari genus Pseudomonas memiliki aktivitas penghambatan terhadap pertumbuhan P. oryzae dengan persentase 59% dan 47%.
9
Mekanisme kerja dari agens pengendali hayati pada umumnya digolongkan sebagai aktivitas kompetisi zat makanan, parasitisme, dan antibiosis (Fravel 1988). Penghambatan konsorsium A8 terhadap cendawan dan bakteri patogen diduga karena adanya aktivitas metabolit sekunder berupa senyawa antibiotik yang dihasilkan oleh masing-masing bakteri yang berada dalam suatu konsorsium tersebut. Senyawa antimikrob adalah senyawa yang dapat membunuh atau menghambat pertumbuhan mikrob lain (Rachman 2011). Antibiotik yang dihasilkan bakteri konsorsium A8 antara lain seperti zwittermicin-A (He et al. 1994), kanomisin (Stabb et al. 1994), dan atibiotik dalam bentuk lipopeptida berupa iturin, surfaktin, dan fengycin (Romero et al. 2007) yang dihasilkan oleh
Bacillus. Menurut Mubarik et al. (2010), B. cereus juga memiliki aktivitas
kitinolitik. Senyawa antimikrob yang dihasilkan oleh bakteri antara lain, iturin yang dihasilkan oleh Bacillus (Asaka dan Shoda 1996), pyrrolnitrin oleh P.
aeruginosa (Howell dan Stipanovic 1979), dilaporkan memiliki kemampuan
untuk menekan pertumbuhan R. solani. Bakteri S. marcescens menghasilkan enzim kitinolitik yang mampu mendegradasi kitin yang merupakan komponen dinding sel dari R. solani (Someya et al. 2000).
Kehidupan bakteri dalam bentuk konsorsium dapat didukung dengan adanya media pembawa yang dapat membantu bakteri tersebut bertahan hidup, yaitu dapat diproduksi dalam bentuk formulasi. Aktivitas regulasi biosintesis metabolit sekunder yang terjadi pada konsorsium bakteri tersebut diduga merupakan proses quorum-sensing (QS). Quorum-sensing adalah regulasi ekspresi gen yang tergantung pada densitas sel (Nofiani 2008). Media yang digunakan sebagai penunjang kehidupan konsorsium A8 ialah nutrient broth (NB) yang sebelumnya menjadi media tumbuh cair konsorsium dan dimasukan ke dalam talk yang dicampurkan dengan CMC (Carboxylmethyl cellulose) dan CaCO3. Media pembawa talk memiliki penampakan fisik berupa bubuk yang halus, ringan, dan memiliki kemampuan untuk menyerap cairan (Riana 2011).
Viabilitas konsorsium A8 diuji sebelum formulasi dan setelah formulasi. Formulasi A8 dengan bahan pembawa talk yang sudah diproduksi di uji viabilitasnya 3 kali, yaitu pada bulan ke-0, ke-1, dan ke-2 setelah masa penyimpanan. Hasil uji viabilitas bakteri antara sebelum formulasi dan setelah formulasi menunjukkan adanya penurunan jumlah log sel. Kondisi tersebut diduga karena adanya proses perubahan media tumbuh bakteri. Menurut Pelczar dan Chan (1986), bertahan hidupnya suatu spesies dan kelangsungan pertumbuhannya di dalam komunitas biologi membutuhkan suatu kemampuan untuk menyesuaikan diri terhadap perubahan keadaan lingkungan. Adaptasi fenotipik merupakan respons mikrob terhadap perubahan terbatas yang bersifat sementara, misalnya, banyak spesies mikrob dapat tumbuh dalam selang suhu yang luas, namun aktivitas metaboliknya tidak selalu sama pada suhu-suhu ekstrim di dalam selang tersebut.
Di sisi lain, viabilitas bakteri setelah formulasi justru menunjukkan hal yang berbanding terbalik dari mulai bulan ke-0 sampai bulan ke-2 setelah masa penyimpanan formulasi, yang menunjukkan adanya peningkatan jumlah log sel. Hal tersebut menunjukkan bahwa konsorsium A8 yang berada dalam media pembawa talk dapat bertahan hidup dan memanfaatkan sumber nutrisi yang berasal dari media sebelumnya, yaitu NB yang dicampurkan saat pembuatan formulasi. Genus Bacillus seperti yang digunakan dalam penelitian ini akan
10
membentuk endospora sehingga resisten terhadap kondisi yang ekstrim sekalipun, dan menyebabkan dapat bertahan hidup lama. Kondisi jumlah sel pada formulasi membuktikan bahwa talk dapat dijadikan media pembawa yang cukup baik untuk menjaga viabilitas bakteri.
Hasil aplikasi formulasi A8 menunjukkan bahwa pemberian formulasi A8 secara preventif pada tanaman padi Inpari 13 sangat berpengaruh dalam menekan pertumbuhan penyakit blas pada padi, dan memiliki persentase penghambatan mencapai 75.957%. Selain bakteri, mikrob yang dapat digunakan sebagai antimikrob adalah cendawan, seperti yang pernah dilaporkan Tsukamoto et al. (1999) bahwa cendawan Exserohilum monoceras memiliki kemampuan menghambat pertumbuhan cendawan P. oryzae sebesar 61.8% - 71% pada daun padi yang terserang blas.
Mekanisme infeksi penyakit diawali dengan sebuah spora (konidia) yang akan menempel dipermukaan luar tanaman padi dan akan melekat sampai terjadi perkecambahan (Koga dan Nakayachi 2004). Konidia akan membentuk apresorium yang melekat erat karena adanya lapisan lendir. Penempelan konidia, perkecambahan dan pembentukan apresorium merupakan interaksi pasif hubungan antara tanaman padi dan P. oryzae (Arase et al. 1994). Jika interaksi berjalan lancar maka apresorium akan membentuk hifa infeksi yang akan menembus sel-sel epidermis dan akan menyebar ke seluruh jaringan tanaman (Howard dan Valent 1996).
Berdasarkan hasil uji in vivo, aplikasi formulasi A8 terhadap R. solani menunjukkan adanya aktivitas penghambatan terhadap penyakit HPD sebesar 27.418%. Grafik TLR menunjukkan bahwa persentase TLR dari minggu ke-0 sampai ke-3 semakin meningkat, dan nilai TLR pada kontrol lebih tinggi dibandingkan dengan nilai TLR pada perlakuan formulasi A8. Hal ini menunjukkan adanya pengaruh dari pemberian formulasi A8 secara preventif pada tanaman padi walaupun tidak terlalu berpengaruh seperti pada penekanan terhadap penyakit blas. Mekanisme serangan cendawan R. solani dimulai karena R. solani tertarik dengan simultan yang dikeluarkan oleh tanaman, hifa R. solani melekat pada permukaan luar tanaman, setelah melekat R. solani membentuk apresorium dan melakukan penetrasi terhadap dinding sel tanaman. Penetrasi pada dinding sel tanaman juga dibantu dengan adanya enzim ekstraseluler yang mendegradasi beberapa komponen penyusun dinding sel tanaman antara lain selulosa, kutin, dan pektin. Penelitian mengenai agens antagonis untuk menekan pertumbuhan R.
solani pernah dilakukan oleh Soenartiningsih et al. (2011) yang melaporkan
bahwa cendawan Trichoderma dan Gliocladium memiliki persentase penghambatan terhadap pertumbuhan R. solani pada jagung masing-masing sebesar 65.67% dan 50.75%.
Aplikasi formulasi A8 terhadap penyakit HDB secara in vivo menunjukkan hasil indeks penghambatan sebesar 32.015%. Aplikasi bakteri biokontrol yang bersifat antagonis akan lebih efektif menekan pertumbuhan Xoo. Penelitian sebelumnya dilakukan Zuraidah (2012) yang menyatakan bahwa P.
aeruginosa memiliki potensi lebih baik dibandingkan tembaga sulfat sebagai
pembanding kimia dalam menghambat pertumbuhan Xoo. Ismail et al. (2011) juga pernah melaporkan bahwa Corynebacterium dapat menekan gejala HDB sebesar 28%. Daur penyakit HDB oleh Xoo adalah melalui hidatoda, kemudian bakteri berkembang biak di dalam epitheme dan menyerang jaringan pembuluh
11
hingga menimbulkan penyakit. Pada tanaman muda, bakteri sering dapat masuk ke dalam daun melalui stomata dan berkembang di dalam ruang intraselular dari parenkim tanpa menimbulkan gejala. Cara masuk lainnya adalah melalui luka mekanis yang sering terjadi pada daun dan akar (Ou 1985).
Aplikasi formulasi bakteri A8 terhadap penyakit blas, HPD, dan HDB secara preventif menunjukkan adanya kemampuan penekanan penyakit. Hal tersebut dapat diinterpretasikan bahwa konsorsium bakteri A8 merupakan kelompok bakteri PGPR (Plant Growth Promoting Rhizobacteria). PGPR mampu mensistesis senyawa metabolit yang merangsang pembentukan fitohormon seperti
indole acetic acid (IAA), atau dengan meningkatkan pengambilan nutrisi. PGPR
juga memiliki kemampuan dalam mempengaruhi pertumbuhan tanaman seperti menekan pertumbuhan fitopatogen (Shishido et al. 1996). PGPR menghambat pertumbuhan fitopatogen melalui produksi senyawa antimikrob, kompetisi dalam mengkelat besi dengan dihasilkannya senyawa siderofor, kompetisi ruang dan nutrisi yang dikeluarkan oleh akar, degradasi faktor patogenesitas fitopatogen seperti racun, memproduksi enzim ekstraseluler pendegradasi dinding sel seperti kitinase, β-1,3 glukanase, dan penginduksian resistensi (Crawford et al.1993).
Berdasarkan persentase penghambatan, dapat diketahui bahwa formulasi bakteri A8 paling efektif dalam menekan pertumbuhan cendawan P. oryzae penyebab penyakit blas pada padi Inpari 13, baik secara in vitro maupun in vivo. Hal tersebut diduga terjadi karena adanya induksi ketahanan sistemik (induced
systemic resistance) atau ISR. ISR merupakan suatu mekanisme yang secara
normal berfungsi membatasi pertumbuhan dan penyebaran patogen dan efektivitas mekanisme ini ditingkatkan oleh infeksi primer dan agen penginduksi berupa mikroorganisme patogen, non-patogen, metabolit mikrob, ekstrak tumbuhan atau senyawa sintetik seperti asam salisilat (Agrios 1997).
Menurut Desmawati (2006), pada prinsipnya ketahanan tanaman sudah terbentuk sebelum patogen menyerang tanaman (pre-exiting) atau ketahanan tanaman terinduksi oleh suatu agens (induced resistance). Ketahanan pre-exiting akan patah ketika terinfeksi patogen yang bersifat virulen. Namun, bila mekanisme pertahanan dipicu oleh PGPR sebelum terjadi infeksi oleh patogen, maka keparahan serangan penyakit akan menurun.
SIMPULAN
Viabilitas konsorsium A8 di dalam bahan pembawa talk dari bulan ke-0 sampai ke-2 memiliki jumlah sel yang cenderung stabil. Konsorsium A8 berpotensi menekan pertumbuhan cendawan P. oryzae, R. solani, dan bakteri patogen Xoo dengan persentase penghambatan konsorsium A8 paling tinggi didapatkan terhadap P. oryzae. Formulasi talk sangat efisien digunakan dan diproduksi, serta cukup efektif karena memiliki kemampuan penyerapan yang baik. Intensitas penghambatan secara in vivo membuktikan bahwa pemberian formulasi A8 secara preventif pada padi Inpari 13 yang diinokulasi P. oryzae, R.
solani, dan Xoo memberikan pengaruh penekanan yang cukup besar, terutama
terhadap penyakit blas yang memiliki persentase penghambatan mencapai 75.957%.
12
DAFTAR PUSTAKA
Agrios GN. 1997. Plant Pathology. New York (US): Academi Pr.
Arase S, Miyahara K, Honda Y, Nozu M. 1994. Preinfectional interactions between Magnaporthe grisea spores and rice plants. Bull Fac Agric
Shimane Univ. 28(22):45-51.
Asaka O, Shoda M. 1996. Biocontrol of Rhizoctonia solani damping-off of tomato with Bacillus subtilis RB14. Appl Environ Microbiol. 62(11):4081–4085. Ashofteh F, Ahmadzadeh M, Magmaghani VF. 2009. Effect of mineral
components of the medium used to grow biocontrol strain UTPF61 of
Pseudomonas fluorescens on its antagonistic activity against Sclerotinia sp.
Wilt of sunflowers and its survival during and after the formulation process.
J Plant Pathol. 91(1):607-613.
Crawford DL, Lynch JM, Whipps JM, Ousley MA. 1993. Isolation and characterization of actinomycete antagonists of a fungal root pathogen. Appl
Environ Microbiol. 59(11):3899-3905.
Desmawati. 2006. Pemanfaatan Plant Growth Promoting Rhizobacteria (PGPR) Prospek yang Menjanjikan dalam Berusahatani Tanaman Holtikultura [tesis]. Bogor (ID): Institut Pertanian Bogor.
Fokkema NJ. 1983. Naturally-occurring biological control in the phyllosphere.
Coloq INRA. 18(1):71-79.
Fravel DR. 1988. Role of antibiosis in the biocontrol of plant disease. Ann Rev
Phytopathol. 26(3):75-91.
Gnanamanickam SS, Mew TW. 1992. Biological control of blast disease of rice (Oryza sativa L.) with antagonistic bacteria and its mediation by a
Pseudomonas antibiotic. Ann Phytopathol Soc Jpn. 58(3):380-385.
He HLA, Laura ASS, Handelsman J, Clardy J. 1994. Zwittermicin A: an antifungal and plat protection agent from Bacillus cereus. Tetrahedron Lett. 35(1):2499.
Howard RJ, Valent B. 1996. Breaking and entering: host penetration by the fungal rice blast pathogen Magnaporthe grisea. Rev de Microbiol. 50(2):491-512. Howell CR, Stipanovic RD. 1979. Control of Rhizoctonia solani on cotton
seedling with Pseudomonas fluorescens and with an antibiotic produced by the bacterium. Phytopathol. 69(1):480-482.
[IRRI] International Rice Research Institute. 1988. Standard Evaluation System
for Rice. Los Banos (PH): IRRI.
Ismail N, Taulu LA, Bahtiar. 2012. Potensi Corynebacterium sebagai pengendali penyakit hawar daun bakteri pada tanaman padi. Inovasi Teknologi
Mendukung Swasembada Jagung dan Diversifikasi Pangan. Seminar Nasional Serealia; 2011 Okt 3-4; Maros, Indonesia. Maros (ID): Balai
Pengkajian Teknologi Pertanian. hlm 459-465; [diunduh 2013 Agustus 20]. Tersedia pada: http://balitsereal.litbang.deptan.go.id/ind/images/stories/ 12hpros11.pdf.
Kim GH, Lim MT, Hur JS, Yum KJ, Koh YJ. 2009. Biological control of tea anthracnose using an antagonistic bacterium of Bacillus subtillis isolated from tea leaves. J Plant Pathol. 25(1): 99-102.
13
Koga H, Nakayachi O. 2004. Morphological studies on attachment of
Magnaporthe grisea to leaf surface of rice. J General Plant Pathol. 70(22):
11-15.
Kumar RS, Ayyadurai N, Pandiaraja P, Reddy AV, Venkateswaru Y, Prakash O. 2005. Characterization of fungal metabolite produced by a new strain
Pseudomonas aeruginosa PUPa3 that exhibits broad-spectrum antifungal
activity and biofertilizing traits. J Appl Microbiol. 98(1):145-154.
Lisboa MP, Bonatto D, Bizani D, Henriques JAP, Brandelli A. 2006. Characterization of a bakteriosin-like substance produced by Bacillus
amyloliquefaciens islolated from the Brazilian Atlantic forest. Int Microbiol.
9(1):111-118.
Mubarik NR, Mahagiani I, Putri AA, Santoso S, Rusmana I. 2010. Chitinolytic bacteria isolated from chili rhizosphere: chitinase characterization and application as biocontrol for whitefly (Bemisia tabaci Genn.). Am J Agric
Biol Sci. 5(4):430-535.
Nofiani R. 2008. Urgensi dan Mekanisme Biosintesis Metabolit Sekunder Mikroba Laut. Natur Ind. 10(2):120-125.
Ou SH. 1985. Rice Disease. Ed. Ke-2. Kew Surrey (UK): Commonwealth Mycological Institut.
Patra et al. 2009. Antimicrobial activity of organic solvent extracts of three marine macroalgae from Chilika Lake, Orissa, India. Malay J Microbiol. 5(2):128-131.
Pelczar MJ Jr, Chan ECS. 1986. Dasar-Dasar Mikrobiologi. Volume ke-1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Pr. Terjemahan dari: Elements of Microbiology.
Prayudi B. 2000. Toleransi padi lokal rawa pasang surut terhadap penyakit hawar pelepah daun padi (Rhizoctonia solani). J Bul Agron. 28(1):37-40.
Rachman SI. 2011. Potensi Bacillus sp. Galur G3, Bacillus firmus E65, dan bakteri metanotrof sebagai penghambat pertumbuhan patogen
Xanthomonasoryzae pv. oryzae dan Rhizoctonia solani [skripsi]. Bogor
(ID): Institut Pertanian Bogor.
Romero D, de Vicente A, Rakotoaly RH, Dufour SE, Veening JW, Arrebola E, Cazorla FM, Kuipers OP, Paquot M, Perez GA. 2007. The iturin and fengycin families of lipopeptides are key factors in antagonism of Bacillus
subtilis toward Podosphaera fusca. Am Phytopathol Soc. 20(1):430-440.
Riana E. 2011. Seleksi dan formulasi konsorsium bakteri untuk mengendalikan penyakit blas (Pyricularia oryzae) pada tanaman padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Saikia R, Kumar R, Arora DK, Gogoi DK, Azad P. 2006. Pseudomonas
aeruginosa inducing rice resistance against Rhizoctonia solani production of
salicylic acid and peroxidases. J Folia Microbiol. 51(1):375-380.
Shaner G, Finney RE. 1977. The effect of nitrogen fertilization on the expression of slow-mildewing resistance in knox wheat. J Phytopathol. 67(1):1051-1056.
Shishido M, Massicotte HB, Chanway CP. 1996. Effect of plant growth promoting Bacillus strains on pine and spruce seedling growth and mycorrhizal infection. Annals Bot. 77(1):433-441.
14
Soenartiningsih, Pabbage MS, Djaenuddin N. 2012. Penggunaan inokulum antagonis (Trichoderma dan Gliocladium) dalam menekan penyakit busuk pelepah pada jagung. Inovasi Teknologi Mendukung Swasembada Jagung
dan Diversifikasi Pangan. Seminar Nasional Serealia; 2011 Okt 3-4; Maros,
Indonesia. Maros (ID): Balai Penelitian Tanaman Serealia. hlm 478-484; [diunduh 2013 Agustus 30]. Tersedia pada: http://balitsereal.litbang. deptan.go.id/ind/images/stories/14hpros11.pdf.
Someya N, Kataoka N, Komagata T, Hirayae K, Hibi T, Akutsu K. 2000. Biological control of cyclamen soilborne diseases by Serratia marcescens strain B2. J AmPhyto Soc. 84(3):334-340.
Stabb EVLM, Jacobson J, Handelsman L. 1994. Zwittermicin A-Producing strains of Bacillus cereus from diversion soils. Appl Environ Microbiol. 60(1): 4404.
Suryadi Y, Triny, Kadir S, Daradjat AA. 1991. Pengendalian penyakit blast dan hawar pelepah daun padi dengan fungisida. Bul Pertan. 10(1):13-17.
Syachroni FA. 2011. Efektivitas formulasi konsosrsium bakteri sebagai pengendali penyakit hawar pelepah daun tanaman padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Tsukamoto H, Tsutsumi F, Onodera K, Yamada M, Fujimori T. 1999. Biological control of rice leaf blast with Exserohilum monoceras, a pathogen of pathogen of Echinochloa species. Ann Phytopathol Soc Jpn. 65(5):543-548. Zaffan ZR. 2012. Pengujian formulasi konsorsium bakteri terhadap penyakit blas
leher (Neck Blast) pada tanaman padi [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Zuraidah. 2012. Potensi beberapa bakteri penghambat pertumbuhan Xanthomonas
oryzae pv. oryzae penyebab penyakit hawar daun bakteri pada tanaman padi
15
Lampiran 1 Sifat varietas unggul Inpari 13
Nama varietas : Inbrida Padi Irigasi (Inpari 13)
Nomor galur : OM1490
Asal persilangan : OM606/IR 1834-36-3-3 Bentuk beras : Panjang dan ramping
Bentuk tanaman : Tegak
Tekstur Nasi : Pulen
Kadar amilosa : 22,40%
Rata-rata hasil : 6,59 t/ha Potensi hasil : 8,0 t/ha Umur tanaman : 99-103 hari Tinggi tanaman : ±101 cm Jumlah anakan produktif : 17 batang
Ketahanan terhadap hama wereng : Tahan hama wereng cokelat biotipe 1, 2, dan 3
Ketahanan terhadap penyakit : Agak rentan terhadap Hawar Daun Bakteri (HDB) II, IV, VIII, tahan terhadap penyakit blas ras 033, agak tahan terhadap ras 133, 073, dan 173
Tahun dilepas : 2009
Keterangan : Cocok ditanam di ekosistem sawah tadah hujan dataran rendah sampai dengan 600 dpl
Lampiran 2 Komposisi media tumbuh bakteri dan cendawan
Media nutrient agar (NA)
Komposisi Jumlah
Nutrient broth (NB) 13 gram
Agar 30 gram
Akuades 1000 mL
Media nutrient broth (NB)
Komposisi Jumlah
Nutrient broth 13 gram
Akuades 1000 mL
Media potato dextrose agar (PDA)
Komposisi Jumlah
Kentang 300 gram
Dekstrosa 20 gram
Agar 20 gram
16
Lampiran 2 (lanjutan) Media oatmeal agar (OMA)
Komposisi Jumlah
Oatmeal 50 gram
Sukrosa 5 gram
Agar 20 gram
Akuades 1000 mL
Media wakimoto agar (WA)
Komposisi Jumlah Ca(NO3)2·4H2O 0,5 gram Na2HPO4·2H2O 2 gram Peptone 5 gram Sukrosa 20 gram Kentang 300 gram FeSO4·7H2O 0,5 gram Agar 17 gram Akuades 1000 mL
Lampiran 3 Peremajaan bakteri dan cendawan
Konsorsium A8 Xoo
17
Lampiran 4 Formulasi bakteri A8 dengan bahan pembawa talk
Lampiran 5 Spora P. oryzae
Perbesaran 400x
Lampiran 6 Gejala penyakit blas pada padi Inpari 13
4 hsi 7 hsi 14 hsi
Spora P. oryzae
18
Lampiran 7 Penilaian pengaruh aplikasi formulasi A8 terhadap penyakit blas berdasarkan IRRI (1998)
Pengamatan Daun
ke- Kontrol 1 Kontrol 2 Kontrol 3 Kontrol 4 Kontrol 5
Skoring i 5 5 3 7 7 ii 5 5 5 7 7 iii 5 5 3 5 3 iv 3 3 5 3 5 v 5 3 3 5 5 Jumlah daun 16 16 18 15 18 Pengamatan Daun ke- Formulasi A8 (1) Formulasi A8 (2) Formulasi A8 (3) Formulasi A8 (4) Formulasi A8 (5) Skoring i 3 1 3 3 1 ii 3 1 3 1 1 iii 3 3 3 3 1 iv 0 1 1 1 1 v 0 1 1 1 0 Jumlah daun 17 19 19 19 20
Lampiran 8 Penyakit hawar pelepah daun (HPD) pada padi Inpari 13 di rumah kaca
A. Perlakuan Kontrol
7 hsi 14 hsi 21 hsi
19
B. Perlakuan Formulasi
7 hsi 14 hsi 21 hs
Lampiran 9 Penilaian pengaruh aplikasi formulasi A8 terhadap penyakit hawar pelepah daun (HPD) berdasarkan IRRI (1988)
1. Penilaian penyaki hawar pelepah daun 7 hsi
Perlakuan Rumpun
ke-
Skoring pada pelepah ke-
i ii iii Iv v Vi Kontrol 1 R1 0 0 0 R2 0 0 0 Kontrol 2 R1 3 0 3 3 R2 0 0 3 0 Kontrol 3 R1 0 0 0 R2 3 0 0 Kontrol 4 R1 3 3 3 3 R2 3 0 Kontrol 5 R1 3 3 3 0 R2 3 3 3 0 0 3 Formulasi A8 (1) R1 0 0 0 0 R2 0 0 Formulasi A8 (2) R1 0 3 0 0 0 3 R2 0 3 0 0 0 0 Formulasi A8 (3) R1 0 0 0 0 R2 0 0 0 0 Formulasi A8 (4) R1 0 3 0 3 0 R2 0 0 3 0 0 Formulasi A8 (5) R1 0 0 0 R2 0 0 0 Gejala HPD
20
2. Penilaian penyakit hawar pelepah daun 14 hsi
Perlakuan Rumpun
ke-
Skoring pada pelepah ke-
i Ii iii Iv V Vi Kontrol 1 R1 3 3 3 R2 3 3 3 Kontrol 2 R1 3 0 3 3 R2 3 3 3 3 Kontrol 3 R1 0 3 0 R2 3 0 0 Kontrol 4 R1 3 3 3 3 R2 3 3 Kontrol 5 R1 5 5 3 5 R2 3 3 3 3 5 5 Formulasi A8 (1) R1 0 3 0 0 R2 0 3 Formulasi A8 (2) R1 0 0 0 0 0 3 R2 0 0 0 0 0 3 Formulasi A8 (3) R1 0 0 0 3 R2 0 0 0 0 Formulasi A8 (4) R1 3 5 3 5 3 R2 3 5 3 3 3 Formulasi A8 (5) R1 3 5 3 R2 3 5 5
3. Penilaian penyakit hawar pelepah daun 21 hsi
Perlakuan Rumpun
ke-
Skoring pada pelepah ke-
i Ii iii Iv v Vi Kontrol 1 R1 5 7 5 R2 5 5 7 Kontrol 2 R1 7 7 7 7 R2 7 7 7 5 Kontrol 3 R1 7 5 7 R2 7 7 7 Kontrol 4 R1 5 7 7 7 R2 5 7 Kontrol 5 R1 7 5 5 5 R2 7 7 5 7 5 7 Formulasi A8 (1) R1 0 0 0 5 R2 0 0 Formulasi A8 (2) R1 3 3 0 0 3 5 R2 0 0 3 3 3 5 Formulasi A8 (3) R1 5 5 5 5 R2 5 5 5 5 Formulasi A8 (4) R1 3 5 3 5 3 R2 3 5 3 3 3 Formulasi A8 (5) R1 3 5 3 R2 3 5 5
21
Lampiran 10 Penyakit hawar daun bakteri (HDB) pada padi Inpari 13
7 hsi 14 hsi 21 hsi
22
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang pada tanggal 30 November 1990 dari ayah Endang Juhana dan ibu Enih (alm). Penulis adalah putri kedua dari tiga bersaudara. Penulis menyelesaikan pendidikan dasar dan menengah di SDN Sindangraja Sumedang pada tahun 2003, SMPN 1 Sumedang pada tahun 2006, dan SMAN 3 Sumedang pada tahun 2009. Setelah itu, penulis melanjutkan pendidikan tinggi pada Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB.
Selama mengikuti perkuliahan, penulis menjadi asisten praktikum Mikrobiologi Dasar pada tahun ajaran 2012/2013 dan 2013/2014. Penulis juga pernah aktif dalam Himpunan Mahasiswa Biologi (Himabio) sebagai bendahara dan sekretaris divisi Pengembangan Sumber Daya Manusia (PSDM) tahun 2011 dan 2012, Ketua Tim Laboratorium dan Sekretaris I dalam Acara MORFOLOGI 47 (Masa Orientasi dan Informasi Biologi angkatan 47) dan MORFOLOGI 48, serta berpartisipasi dalam berbagai aktivitas keorganisasian di Departemen Biologi dan di FMIPA IPB. Selama kuliah S1, penulis mendapatkan beasiswa pendidikan yaitu beasiswa PPA tahun 2009-2010 dan beasiswa BUMN tahun 2011-2013.
Penulis juga pernah melakukan penelitian dalam studi lapang dengan judul “Isolasi dan Identifikasi Bakteri Potensial Tanah dari Sekitar Perakaran Tanaman Legum di Hutan Pendidikan Gunung Walat” pada tahun 2011 dan lolos dalam PKM AI yang diselenggarakan DIKTI dengan judul yang sama. Penulis melakukan praktik lapangan di PT. Aldepos Salaca dengan judul “Pemeliharaan dan Budidaya Ikan Nila Merah (Oreochromis sp.) di PT. Aldepos Salaca Desa Tapos Kecamatan Tenjolaya Kabupaten Bogor” pada tahun 2012. Tahun 2013 penulis menyampaikan presentasi oral yang berjudul “Viability test of A8 bacterial formulation as biological agents and its application on rice cv. Inpari 13” pada International Seminar on Sciences 2013 di IPB ICC, Bogor.