MODIFIKASI KITOSAN-SULFAT SEBAGAI KATALIS HETEROGEN PADA PRODUKSI BIODIESEL DARI MINYAK KELAPA SAWIT
SKRIPSI
AMALIA PUTRI PURNAMASARI
DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
MODIFIKASI KITOSAN-SULFAT SEBAGAI KATALIS HETEROGEN PADA PRODUKSI BIODIESEL DARI MINYAK KELAPA SAWIT
SKRIPSI
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Bidang Kimia pada Fakultas Sains dan Teknologi
Universitas Airlangga
Oleh :
AMALIA PUTRI PURNAMASARI NIM 080915044
Tanggal Lulus : 30 Juli 2013
Disetujui Oleh:
Pembimbing I,
Drs. Handoko Darmakoesoemo, DEA NIP. 1962 1102 198810 1 001
Pembimbing II,
LEMBAR PENGESAHAN NASKAH SKRIPSI
Judul : Modifikasi Kitosan-Sulfat sebagai Katalis Heterogen pada Produksi Biodiesel dari Minyak Kelapa Sawit.
Penyusun : Amalia Putri Purnamasari
NIM : 080915044
Tanggal Ujian : 30 Juli 2013
Disetujui oleh:
Pembimbing I,
Drs. Handoko Darmakoesoemo, DEA NIP. 1962 1102 198810 1 001
Pembimbing II,
Dr. Pratiwi Pudjiastuti, M.Si NIP. 1961 0205 198601 2 001
Mengetahui, Ketua Departemen Kimia Fakultas Sains dan Teknologi
Universitas Airlangga
PEDOMAN PENGGUNAAN SKRIPSI
Skripsi ini tidak dipublikasikan, namun tersedia diperpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seijin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
Purnamasari, A.P., 2013. Modifikasi Kitosan-Sulfat sebagai Katalis Heterogen pada Produksi Biodiesel dari Minyak Kelapa Sawit. Skripsi dibawah bimbingan Drs. Handoko Darmakoesoemo, DEA dan Dr. Pratiwi Pudjiastuti, M.Si. Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga, Surabaya.
ABSTRAK
Sintesis biodiesel menggunakan katalis heterogen kitosan-sulfat pada proses transesterifikasi minyak kelapa sawit (Crude Palm Oil/CPO) dengan metanol telah dipelajari. Modifikasi kitosan sulfat dilakukan dengan mereaksikan kitosan yang telah dilarutkan pada asam asetat 2% dan H2SO4 pada perbandingan
1:1. Reaksi transesterifikasi dilakukan pada suhu 65-70ºC selama 3 jam. Hasil analisis menggunakan FTIR menunjukkan bahwa kitosan yang disulfonasi memiliki pita serapan baru yang muncul pada bilangan gelombang 1149,50 cm-1. Gugus –SO4 memberikan pita serapan yang khas yaitu pada bilangan gelombang
Purnamasari, A.P., 2013. Modification of Chitosan-Sulphate as Heterogeneous Catalyst in Biodiesel Production from Palm Oil. Script were counseled by Drs. Handoko Darmakoesoemo, DEA and Dr. Pratiwi Pudjiastuti, M.Si. Department of Chemistry, Faculty Science and Technology, Airlangga University.
ABSTRACT
Synthesis of biodiesel using heterogeneous catalysts chitosan-sulphate in the transesterification process of palm oil (Crude Palm Oil/CPO) with methanol has been studied. Modification of chitosan sulfate is done by reacting chitosan which has been dissolved in 2% acetic acid and H2SO4 in the ratio of 1:1.
Transesterification reaction is done in the temperature of 65-70ºC for 3 hours. The analysis using FTIR show that chitosan sulphonated has a new absorption band appeared at wave number 1149.50 cm-1. The functional group SO4 provide a
typical absorption band at wave number 1130-1080 cm-1. It indicates that there is an interaction between chitosan and sulphate. The results of biodiesel conversion are analyzed using Gas Chromatography-Mass Spectrometry (GC-MS). Methyl-ester formed is compared to the treatment without catalyst, the chitosan catalyst and chitosan sulphate, the result of biodiesel conversion are 57,3108%, 64,0021%, and 42,2080%.
KATA PENGANTAR
Segala puji syukur senantiasa penulis curahkan kepada Allah SWT yang telah melimpahkan rahmat, taufik serta hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi dengan judul “Modifikasi Kitosan-Sulfat sebagai Katalis Heterogen pada Produksi Biodiesel dari Minyak Kelapa Sawit” dengan tepat waktu. Dalam kesempatan ini, penulis menyampaikan terima kasih yang sebesar-besarnya kepada :
1. Bapak Drs. Handoko Darmakoesoemo, DEA selaku dosen pembimbing I dan Ibu Pratiwi Pudjiastuti, M.Si selaku pembimbing II yang telah meluangkan waktu, tenaga, pikiran, bimbingan serta arahannya dalam menyusun skripsi ini.
2. Ibu Dr. Nanik Siti Aminah, M.Si selaku dosen penguji I yang telah memberikan masukan, arahan dan ilmu yang bermanfaat bagi penulis.
3. Ibu Dr. Sri Sumarsih, M.Si selaku dosen penguji II yang telah memberikan masukan, arahan dan ilmu yang bermanfaat bagi penulis.
4. Ibu Dr. Alfinda Novi Kristanti, DEA selaku ketua Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga.
5. Bapak Drs. Hamami, M.Si selaku dosen wali yang selalu senantiasa membimbing dan memberikan masukan selama penulis menempuh kuliah. 6. Seluruh dosen dan staf pengajar Departemen kimia yang telah mendidik dan
memberikan pelajaran yang berharga, selama penulis menuntut ilmu di Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga. 7. Seluruh laboran dan staff administrasi Departemen Kimia Fakultas Sains dan
8. Kedua orang tua dan keluarga penulis yang telah memberikan doa, kasih sayang, nasihat dan dukungan baik moril maupun materil hingga dapat terselesaikannya skripsi ini.
9. Sahabat-sahabat terbaik penulis yang selalu memberi motivasi dan berbagi ilmu, seluruh teman-teman S1 Kimia angkatan 2009 Universitas Airlangga khususnya Putri Novita W., Lia Khusnia A., Fairya Muqita A., Gama Prakoso B., Eviomitta Rizky A., Kiky Rizky A, dan Priska Kristiana serta teman-teman lain yang tidak dapat disebutkan satu persatu, terima kasih atas kebersamaan selama 4 tahun yang berkesan ini. Serta semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu terselesaikannya skripsi ini.
Penyusun menyadari bahwa penulisan skripsi ini masih jauh dari sempurna, oleh karena itu penulis mengharapkan kritik dan saran yang membangun demi kesempurnaan penulisan skripsi ini agar bermanfaat bagi semua pihak. Aamiin.
Surabaya, Juli 2013 Penyusun
DAFTAR ISI
Halaman
LEMBAR JUDUL ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
PEDOMAN MENGGUNAKAN SKRIPSI ... iv
ABSTRAK ... v
3.4.2 Pembuatan larutan baku asam oksalat 0,1 N ... 14
3.5 Prosedur Penelitian ... 14
3.5.1 Karakterisasi kitosan ... 14
3.5.2 Karakteristik CPO ... 17
3.5.2.1 Penentuan kadar air CPO ... 17
3.5.2.2 Penentuan bilangan asam CPO ... 18
3.5.3 Penentuan berat molekul CPO ... 19
3.5.3.1 Esterifikasi CPO ... 19
3.5.3.2 Transterifikasi CPO ... 19
3.5.4 Pembuatan katalis heterogen (modifikasi kitosan dengan asam sulfat) ... 19
3.5.5 Karakterisasi katalis heterogen kitosan-sulfat dengan Fourier Transform Infrared Spectroscopy (FTIR) ... 20
3.5.6 Sintesis biodiesel ... 20
3.5.6.1 Sintesis biodiesel tanpa katalis ... 21
3.5.6.3 Sintesis biodiesel katalis kitosan-sulfat ... 21
3.5.7 Analisa senyawa biodiesel ... 22
BAB IV HASIL DAN PEMBAHASAN ... 23
4.1 Karakterisasi kitosan ... 29
4.2 Karakteristik CPO ... 29
4.2.1 Penentuan kadar air ... 29
4.2.2 Penetuan bilangan asam CPO ... 29
4.2.3 Penentuan berat molekul (BM) CPO ... 30
4.2.3.1 Esterifikasi CPO ... 30
4.2.3.2 Transesterifikasi CPO ... 32
4.3 Pembuatan Katalis Kitosan-Sulfat ... 34
4.4 Karakterisasi Katalis Heterogen Kitosan-Sulfat dengan Fourier Transform Infrared Spectroscopy (FTIR) ... 35
4.5 Sintesis Biodiesel ... 37
BAB V KESIMPULAN DAN SARAN ... 45
5.1 Kesimpulan ... 45
5.2 Saran ... 45
DAFTAR TABEL
No Judul Halaman
DAFTAR GAMBAR
No Judul Halaman
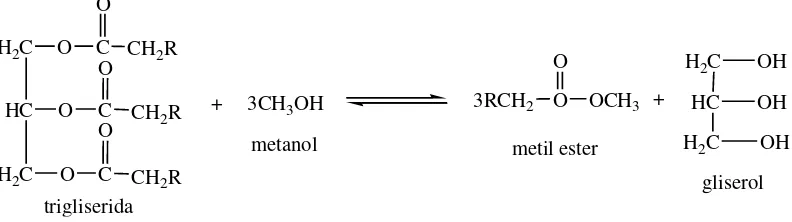
2.1 Transesterifikasi biodiesel menggunakan metanol ... 8
4.1 Spektrum FTIR kitosan ... 28
4.2 Transesterifikasi biodiesel menggunakan metanol (Liu et al., 2007) ... 32
4.3 Tahapan reaksi transesterifikasi (Mao et al., 2004) ... 32
4.4 Mekanisme transesterifikasi dengan katalis basa (Schuchardt, 1998) ... 33
4.5 Penambahan gugus SO3H pada C-6 kitosan ... 34
4.6 Masuknya gugus SO4 pada gugus NH2 ... 35
4.7 Spektrum FTIR kitosan-sulfat ... 36
4.8 Kromatogram GC-MS biodiesel tanpa katalis ... 39
4.9 Kromatogram GC-MS biodiesel dengan katalis kitosan ... 39
4.10 Kromatogram GC-MS biodiesel dengan katalis kitosan-sulfat ... 40
4.11 Spektrum massa senyawa metil heksadekanoat ... 41
4.12 Fragmentasi metil heksadekanoat ... 42
4.13 Spektrum massa senyawa metil heptadekanoat ... 43
4.14 Fragmentasi metil heptadekanoat ... 43
4.15 Spektrum massa senyawa metil cis-9-oktadekenoat ... 44
DAFTAR LAMPIRAN
No Judul
1. Pembuatan larutan KOH 0,1 N 2. Hasil penentuan BM kitosan
3. Hasil penentuan kadar air Crude Palm Oil (CPO)
4. Hasil penentuan bilangan asam Crude Palm Oil (CPO) sebelum esterifikasi 5. Hasil penentuan bilangan asam Crude Palm Oil (CPO) setelah
6. Hasil perhitungan berat molekul rata-rata CPO
7. Hasil perhitungan rasio molar 1:60 CPO terhadap metanol pada sintesis biodiesel
BAB I
PENDAHULUAN
1.1 Latar Belakang Permasalahan
Indonesia merupakan salah satu negara yang mempunyai sumber daya alam yang melimpah, termasuk sumber daya mineralnya. Untuk banyak sumber daya alam tak terbarukan (untuk selanjutnya disebut mineral), Indonesia menjadi pengekspor netto. Khususnya minyak bumi, Indonesia mulai mengekspor sejak tahun 1950 (Barnes, 1995).
pengimpor bahan bakar minyak. Kenaikan harga minyak bumi cukup membebani anggaran pemerintah terutama dalam hal penyediaan subsidi untuk bahan bakar minyak. Pada tahun 2008, dengan harga minyak bumi rata-rata US$ 101,31 per barel, realisasi subsidi bahan bakar minyak mencapai Rp 139,1 triliun. Harga minyak bumi yang cenderung terus meningkat dikhawatirkan dapat mengganggu kinerja indikator makroekonomi Indonesia (Kementerian Keuangan, 2009).
Dengan permasalahan saat ini yaitu meningkatnya harga minyak yang sedemikian tingginya, perlu ada upaya global melalui berbagai organisasi internasional untuk melakukan upaya penyeimbangan supply dan demand, konservasi energi, dan diversifikasi energi untuk mengurangi ketergantungan terhadap minyak bumi yang merupakan sumber daya alam tak terbarukan (non renewable). Permasalahan ini tidak hanya berdampak kepada suatu negara namun merupakan mata rantai yang dapat berakibat kepada menurunnya perekonomian dunia secara umum.
pangan (minyak goreng dan margarin), industri sabun (bahan penghasil busa), industri tekstil, kosmetik, dan sebagai bahan bakar alternatif (Sastrosayono, 2003). Warna orange atau kuning pada CPO disebabkan adanya pigmen karoten yang larut dalam minyak. Sedangkan bau khas CPO ditimbulkan oleh senyawa betaionone (Ketaren, 1986).
dalam memproduksi biodiesel. Umumnya katalis yang digunakan ialah katalis basa homogen, namun beberapa katalis heterogen telah digunakan untuk menghasilkan biodiesel antara lain: ZnO-Al2O3/ZSM-5 dengan hasil 99,00%
(Kim et al., 2009), K3PO4 dengan hasil 97,30% (Guan et al., 2009), KF/Ca-Al
hidrotalsit dengan hasil 97,14% (Gao et al., 2010), CaO-ZnO dengan hasil 96,00% (Ngamcharussrivichai et al., 2008), Mg/MCM-41 dengan konversi 85,00% (Georgogianni et al., 2009). Pada penelitian ini kami menggunakan katalis heterogen karena memberikan banyak keuntungan dikarenakan katalis ini dapat dengan mudah dipisahkan dari produknya dengan filtrasi karena fasanya berbeda dengan produknya, mudah diregenerasi, dapat digunakan kembali, lebih ramah lingkungan, lebih murah dan tidak bersifat korosif (Guan et al., 2009). Pada hal ini yang digunakan ialah katalis kitosan yang telah dimodifikasi strukturnya, selain itu juga diupayakan penggunaan katalis dari sisa alam, salah satunya seperti yang kami gunakan yaitu kitosan-sulfat.
merupakan suatu polisakarida hasil proses deasetilasi kitin. Senyawa ini merupakan biopolimer alam yang penting dan bersifat polikationik sehingga dapat diaplikasikan dalam berbagai bidang seperti adsorben logam, penyerap zat warna tekstil, bahan pembuatan kosmetik serta agen antibakteri (Bhuvana, 2006). Sifat biokompatibel, biodegradable dan non-toksik yang dimiliki kitosan, merekomendasikan penggunaan senyawa ini dalam industri ramah lingkungan.
Dari beberapa pemaparan diatas, dapat dilihat bahwa sangat pentingnya keberadaan bahan bakar. Pemikiran tentang penggunaan bahan bakar berasal dari minyak bumi yang lama kelamaan berkurang jumlahnya sangat perlu dipertimbangkan kembali. Salah satu solusi yang ada ialah dengan memanfaatkan bahan baku yang terbarukan (renewable). Biodiesel berbahan baku CPO diharapkan mampu menjadi salah satu solusi yang dapat mengatasi permasalahan ini.
1.2 Rumusan Masalah
1. Apakah dapat dilakukan modifikasi antara kitosan dengan sulfat sebagai katalis heterogen untuk menghasilkan biodiesel berbahan baku CPO? 2. Berapakah konversi biodiesel yang dihasilkan dari CPO yang direaksikan
dengan metanol dan dikatalisis menggunakan kitosan-sulfat?
1.3 Tujuan Penelitian
1. Memodifikasi kitosan sebagai katalis heterogen untuk menghasilkan biodiesel dari CPO.
1.4 Manfaat Penelitian
1. Meningkatkan nilai guna kitosan-sulfat sebagai polimer yang dapat digunakan sebagai katalis dalam proses produksi biodiesel dari CPO. 2. Mengembangkan bahan bakar dari CPO yang ramah lingkungan dan
BAB II
KERANGKA KONSEPTUAL
Biodiesel adalah bahan bakar pengganti diesel yang memiliki emisi rendah dan terbuat dari sumber daya terbarukan. Cara yang paling umum untuk memproduksi biodiesel adalah melalui transesterifikasi menggunakan katalis basa. Ketika bahan baku (minyak atau lemak) memiliki persentase yang tinggi dari asam lemak bebas atau air, katalis basa akan bereaksi dengan asam lemak bebas untuk membentuk sabun. Air dapat menghidrolisis trigliserida ke digliserida dan terbentuk lebih asam lemak bebas. Pada hal ini, reaksi terbentuknya sabun dan asam lemak bebas tidak diinginkan karena mengurangi hasil dari produk biodiesel. Untuk menghindari hal tersebut, harus dilakukan perlakuan dengan asam untuk menghambat reaksi saponifikasi (Leung et al., 2009).
H2C O C CH2R
Gambar 2.1. Transesterifikasi biodiesel menggunakan metanol
Ada tiga jenis katalis yang digunakan untuk membuat biodiesel dari trigliserida dengan alkohol, yaitu katalis asam dan katalis basa baik berupa katalis homogen maupun heterogen, serta enzim (Murugesan et al., 2009). Umumnya, katalis homogen yang digunakan untuk menghasilkan biodiesel adalah NaOH, KOH, atau metoksidanya, H2SO4 dan HCl. Namun katalis ini sulit dipisahkan
setelah reaksi, dapat merusak lingkungan, bersifat korosif dan menghasilkan limbah beracun (Guan et al., 2009, Helwani et al., 2009).
Penggunaan katalis heterogen memberikan banyak keuntungan dikarenakan katalis ini dapat dengan mudah dipisahkan dari produknya dengan filtrasi karena fasanya berbeda dengan produknya, mudah diregenerasi, dapat digunakan kembali, lebih ramah lingkungan, lebih murah dan tidak bersifat korosif (Guan et al., 2009). Penggunaan katalis asam tidak menghasilkan produk samping berupa sabun jika bereaksi dengan asam lemak bebas atau Free Fatty Acid (FFA) (Lam et al., 2010).
menggunakan katalis basa 4000 kali lebih cepat dari pada menggunakan katalis asam. Tetapi kelemahan penggunaan katalis basa yaitu dapat menghasilkan sabun jika bereaksi dengan FFA. Kelemahan pemanfaatan enzim sebagai katalis dalam pembuatan biodiesel adalah biaya yang tinggi, laju reaksi yang lambat dan deaktivasi enzim (Lam et al., 2010). Jadi dalam memproduksi biodiesel, pemanfaatan katalis basa heterogen lebih baik dari pada katalis asam dan enzim khususnya untuk bahan dasar biodiesel (minyak nabati/lemak hewan) dengan kandungan FFA yang rendah (dengan batasan antara kurang dari 0,5% sampai kurang dari 2%). Sedangkan untuk minyak dengan kandungan FFA yang tinggi lebih baik menggunakan katalis asam atau enzim (Lam et al., 2010).
Beberapa katalis heterogen yang digunakan untuk menghasilkan biodiesel antara lain: ZnO-Al2O3/ZSM-5 dengan hasil 99,00% (Kim et al., 2009), K3PO4
dengan hasil 97,30% (Guan et al., 2009), KF/Ca-Al hidrotalsit dengan hasil 97,14% (Gao et al., 2010), CaO-ZnO dengan hasil 96,00% (Ngamcharussrivichai
et al., 2008), Mg/MCM-41 dengan konversi 85,00% (Georgogianni et al., 2009). Metode pembuatan biodiesel yang umum digunakan saat ini adalah melalui proses transesterifikasi minyak nabati menggunakan katalis basa. Dalam reaksi ini, alkohol dalam bentuk metanol dan etanol, ditambahkan ke dalam trigliserida menggunakan katalis basa homogen seperti NaOH, KOH, NaOCH3,
atau KOCH3. Proses ini berjalan cepat dan efisien pada temperatur yang relatif
rendah. Meskipun demikian, biaya produksi biodiesel masih mahal dan menjadi
proses. Sebagai contoh, saat ini mulai digunakan minyak jelantah dan minyak non-pangan seperti minyak jarak (Jatropha curcas) sebagai bahan baku. Efisiensi produk juga dapat dilakukan dengan mengganti katalis basa homogen dengan katalis basa heterogen. Pada proses homogen, katalis basa akan hilang oleh pencucian. Hal ini menyebabkan berkurangnya efisiensi bertambahnya biaya produksi. Salah satu cara untuk meningkatkan efisiensi adalah dengan menggunakan katalis heterogen. Pada prinsipnya dengan katalis heterogen, maka material katalis dapat diambil kembali dan dapat digunakan kembali sebagi proses pembuatan biodiesel menjadi lebih sederhana. Sejumlah penelitian untuk memanfaatkan katalis heterogen untuk proses transesterifikasi. Salah satu polimer yang berpotensi sebagai katalis basa heterogen adalah kitosan (Huda, 2009).
Kitosan merupakan salah satu polisakarida yang terdiri atas unit N-asetil-D-glukosamin dan N-asetil-D-glukosamin yang dihasilkan dari proses N-deasetilasi polimer alamiah kitin, yaitu polimer yang diperoleh dari cangkang hewan laut, atau fungi. Reaktivitas yang tinggi dari gugus amino bebas menjadikan kitosan mempunyai potensi sebagai basa Lewis. Makin panjang rantai kitosan, makin banyak kandungan gugus amino bebasnya, makin tinggi sifat kebasaan. Sifat basa ini dapat diharapkan dapat menggantikan katalis basa homogen yang biasa digunakan dalam proses transesterifikasi seperti NaOH dan KOH.
Modifikasi kitosan-sulfat yang dimaksudkan dalam penelitian kali ini diharapkan dapat meningkatkan konduktivitas sebagai katalis. Pada penelitian yang telah dilakukan sebelumnya menunjukkan analisis termal cross-linked
BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini akan dilaksanakan di Laboratorium Kimia Organik dan Kimia Fisik Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya. Penelitian ini dimulai pada bulan Februari sampai dengan Juni 2013.
3.2 Bahan dan Alat Penelitian 3.2.1 Bahan Penelitian
Bahan-bahan yang digunakan dalam penelitian ini adalah minyak kelapa sawit Crude Palm Oil (CPO) dari Dinas Perkebunan Kelapa Sawit Palembang, Sumatera Selatan. Kitosan, metanol, etanol 96%, asam sulfat, natrium hidroksida, asam asetat, asam oksalat, kalium hidroksida, n-heptana, n-heksana, indikator phenolftalein, metil heptadekanoat, kertas saring Whatman 42, akuadem. Semua bahan yang digunakan pada peneltian ini memiliki derajat kemurnian pro analisis. 3.2.2 Alat Penelitian
Alat-alat yang digunakan dalam penelitian ini adalah Gas Chromatography-Mass Spectrometry (GC-MS) Shimadzu Library Wiley, Fourier Transform Infrared Spectroscopy (FTIR) Shimadzu 8400S, hot plate, magnetic stirer, sentrifuge, freeze dryer, neraca analitik, gelas ukur, buret, erlenmeyer,
pisah, krus porselen, mortar, corong buchner, dan alat-alat yang biasa digunakan di laboratorium.
3.3 Diagram Alir Penelitian
3.4 Pembuatan Pereaksi
3.4.1 Pembuatan Larutan KOH 0,1 N
Menimbang sebanyak 6,6012 g kalium hidroksida dengan kemurnian 85% kemudian melarutkan dengan akuadem sebanyak 1 L. Setelah itu mengaduk campuran hingga terbentuk larutan yang homogen (Vogel, 1994).
Kitosan
3.4.2 Pembuatan Larutan Baku Asam Oksalat 0,1 N
Menimbang sebanyak 0,6300 g asam oksalat, kemudian dilarutkan dengan akuadem, selanjutnya memindahkan ke dalam labu ukur 100 mL dan ditambahkan akuadem hingga tanda batas, campuran dikocok hingga terbentuk larutan yang homogen (Vogel, 1994).
3.5 Prosedur Penelitian 3.5.1 Karakterisasi kitosan
Karakterisasi kitosan meliputi uji kelarutan, menentukan derajat deasetilasi kitosan dengan menggunakan metode FTIR dan menentukan berat molekul dari kitosan dengan metode viscometerOstwald.
1. Uji kelarutan kitosan
Uji kelarutan kitosan dapat dianalisis dengan melarutkan sampel kitosan dengan larutan asam asetat 2%. Jika sampel larut dalam asam maka sampel tersebut kitosan, apabila tidak larut sampel tersebut masih berupa kitin (Emma et al., 2010).
2. Penentuan berat molekul rata-rata kitosan
Penentuan berat molekul rata-rata kitosan (Mv) dengan menggunakan
waktu alir pelarut (t0). Menentukan nilai berat molekul rata-rata Mv dengan
menggunakan persamaan Mark Houwink-Sakurada dengan nilai K dan a berturut-turut untuk kitosan adalah 1,46 x 10-4 dan 0,83 (Atkin, 2006). Persamaannya ialah sebagai berikut :
Keterangan :
[ ] : viskositas instrinsik
K : konstanta pelarut (1,46 x 10-4 L/g) : konstanta (0,83)
Viskositas intrinsik dapat ditentukan dengan viskositas spesifik yang diperoleh dari persamaan Huggins:
Keterangan :
: viskositas spesifik
[ ] : viskositas intrinsik C : konsentrasi
K : konstanta
Viskositas spesifik ditentukan dengan menggunakan persamaan berikut :
Keterangan :
1 : viskositas larutan 2 : viskositas pelarut
t0 : waktu alir pelarut (s)
t1 : waktu alir larutan (s)
3. Penentuan derajat deasetilasi kitosan
Pada penelitian ini derajat deasetilasi kitosan diperoleh dengan perhitungan menggunakan software “DDKProject”. Derajat deasetilasi kitosan ditentukan dengan menggunakan persamaan berikut :
A1655 adalah pita serapan (band) pada bilangan gelombang 1655 cm-1 untuk
serapan gugus amida dan A3450 adalah pita serapan (band) pada bilangan
gelombang 3450 cm-1 untuk serapan gugus hidroksi. Penentuan derajat deasetilasi kitosan menggunakan spektroskopi FTIR, ditentukan dengan menggunakan metode baseline, yaitu perbandingan nilai pita serapan antara pita serapan (band) gugus hidroksil sekitar 3450 cm-1 dengan pita serapan (band) karbonil dari gugus amida pada daerah sekitar 1655 cm-1. 4. Penentuan gugus fungsi dengan Fourier Transform Infra Red
Spectroscopy (FTIR)
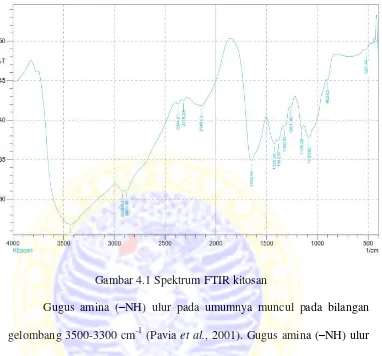
Diharapkan muncul pita serapan gugus amina (–NH) ulur yang umumnya muncul pada bilangan gelombang 3500-3300 cm-1 (Pavia et al., 2001). Gugus amina (–NH) ulur memiliki dua vibrasi ulur yaitu simetris dan asimetris yang menunjukkan pira serapan pada bilangan gelombang 3400 dan 3500 cm-1 (Silverstein, 2005). Gugus hidroksi (–OH) pada umumnya juga muncul pada bilangan gelombang 3400-3300 cm-1 (Pavia et al., 2001). Gugus amina primer (–NH) vibrasi tekuk yang pada bilangan gelombang sekitar 1640-1560 cm-1 (Pavia et al., 2001). Dan pada bilangan gelombang 1300-1000 cm-1 menunjukkan adanya ikatan C–O–C (Pavia et al., 2001).
3.5.2 Karakteristik CPO
3.5.2.1 Penentuan kadar air CPO
Kadar air ditentukan dengan memanaskan ±5 g CPO dalam cawan porselen yang telah ditimbang sebelumnya. Pemanasan dilakukan pada suhu ±150˚C selama 15 menit, dilanjutkan dengan penimbangan setelah cawan dingin.
Memanaskan cawan kembali selama 5 menit dan melakukan penimbangan sampai beratnya konstan. Jika penimbangan yang kedua berbeda 0,003 g dari penimbangan pertama, pemanasan dilakukan pemanasan kembali hingga beratnya konstan. Kadar air dalam minyak adalah jumlah komponen yang menguap (SNI 01-5009.12-2001). Kadar air dapat ditentukan melalui persamaan:
Keterangan :
W : berat cawan kosong (g)
W1 : berat cawan dan sampel minyak (g)
W2 : berat cawan dan sampel setelah dipanaskan (g) 3.5.2.2 Penentuan bilangan asam CPO
Menimbang sebanyak 1 g sampel dan mencampur dengan 5 mL etanol 96% dan 5 mL n-heksana. Kemudian menambahkan 3 tetes indikator fenolftalein dan melakukan titrasi dengan KOH 0,1 N. Sebelumnya, KOH telah dibakukan dengan asam oksalat 0,1 N. Menghentikan titrasi ketika warna larutan berubah menjadi merah jambu yang dapat bertahan sampai 30 detik (Sudarmadji et al., 2007). Selanjutnya angka asam dapat diketahui dengan memasukkan data ke dalam persamaan (Ladd et al., 1986).
Keterangan :
mL KOH : volume KOH untuk titrasi (mL) N KOH : normalitas KOH (0,10050251 N) Mr KOH : massa molekul KOH (56,11 g/mol) w sampel : berat sampel yang ditimbang (g)
3.5.3 Penentuan berat molekul (BM) CPO 3.5.3.1 Esterifikasi CPO
Esterifikasi dapat dilakukan dengan cara menimbang sejumlah mol CPO dan metanol dengan perbandingan 1:6 dan katalis H2SO4 1% terhadap berat
minyak (Berchmans and Hirata, 2008). Merefluks campuran selama 5 jam pada suhu 65-70˚C hingga terbentuk 2 lapisan. Lapisan bawah ialah fasa minyak yang akan digunakan. Melakukan evaporasi fasa minyak pada 65˚C selama 20 menit untuk menguapkan sisa metanol, kemudian mencuci kelebihan asam dengan akuadem sebanyak dua kali menggunakan corong pisah. Melalui tahap esterifikasi ini diharapkan bilangan asam CPO akan turun kurang dari 2 mg KOH/g sehingga dapat digunakan untuk reaksi transesterifikasi selanjutnya.
3.5.3.2 Transesterifikasi CPO
Mereaksikan sebanyak 10 mL minyak kelapa sawit dengan 60 mL metanol dengan katalis KOH 1% dari berat CPO. Merefluks campuran selama 5 jam pada suhu 65-70˚C hingga terbentuk cairan dengan 2 lapisan. Lapisan atas ialah fasa biodiesel yang terbentuk. Kemudian fasa atas dievaporasi pada suhu 65˚C selama 20 menit untuk menguapkan sisa metanol. Larutan tersebut dianalisis menggunakan GC-MS untuk menentukan berat molekul CPO. Setelah mengetahui berat molekul CPO, dapat ditentukan rasio molar CPO terhadap metanol.
tahap akhir menambahkan NaOH 60% untuk mengendapkan kitosan kembali. Kitosan yang mengendap ialah kitosan-sulfat yang telah termodifikasi. Setelah kitosan-sulfat kering, melakukan karakterisasi FTIR untuk mengetahui adanya gugus SO4 yang terikat dengan kitosan.
3.5.5 Karakterisasi katalis heterogen kitosan-sulfat dengan Fourier Transform Infrared Spectroscopy (FTIR)
Uji FTIR bertujuan untuk mengidentifikasi adanya gugus sulfat (–SO4)
yang berikatan dengan kitosan. Diharapkan muncul pita serapan (band) gugus sulfat pada bilangan gelombang 1350-1175 cm-1 (Pavia et al., 2001) atau pada bilangan gelombang sekitar 1130-1080 cm-1 (Fleming et al., 1995). Serta gugus ammonium pada bilangan gelombang sekitar 3300-3030 cm-1 (Fleming et al., 1995).
3.5.6 Sintesis biodiesel
3.5.6.1 Sintesis biodiesel tanpa katalis
Crude Palm Oil (CPO) yang telah diesterifikasi direaksikan dengan metanol dengan perbandingan rasio molar CPO dengan metanol yang digunakan yaitu 1:60 (sebanyak 14,7652 g CPO dan 33,8015 g metanol). Pertama-tama memanaskan metanol pada suhu 65-70˚C dan diaduk dengan kecepatan 1000 rpm selama 15 menit, kemudian memasukkan CPO. Campuran tersebut direfluks
selama 3 jam. Cairan yang terbentuk dipisahkan dengan corong pisah, fasa atas merupakan biodiesel yang terbentuk.
3.5.6.2 Sintesis biodiesel dengan katalis kitosan
Crude Palm Oil (CPO) yang telah diesterifikasi direaksikan dengan metanol dengan perbandingan rasio molar CPO dengan metanol yang digunakan yaitu 1:60 (sebanyak 11,5227 g CPO dan 26,4830 g metanol) dan sejumlah katalis yaitu 10% b/b berat minyak (1,1536 g). Pertama-tama mereaksikan metanol dan kitosan pada suhu 65-70˚C dan diaduk dengan kecepatan 1000 rpm selama 15
menit, kemudian memasukkan CPO. Campuran tersebut direfluks selama 3 jam. Cairan yang terbentuk dipisahkan dengan corong pisah dan fasa atas merupakan biodiesel.
3.5.6.3 Sintesis biodiesel dengan katalis kitosan-sulfat
selama 15 menit, kemudian memasukkan CPO. Campuran tersebut direfluks
selama 3 jam. Cairan yang terbentuk dipisahkan dengan corong pisah, fasa atas merupakan biodiesel yang terbentuk.
3.5.7 Analisis senyawa biodiesel
Analisis senyawa biodiesel dapat dilakukan dengan GC-MS. Dari GC-MS kandungan senyawa dan konversi minyak menjadi biodiesel dari hasil reaksi dapat diketahui.
Tahap preparasi dilakukan dengan menimbang sampel biodiesel sebanyak 250 mg dan standar internal metil heptadekanoat 50 mg. Kemudian menambahkan sebanyak 5 mL n-heksana sebagai pelarut. Konversi biodiesel dapat ditentukan melalui persamaan:
Keterangan :
ΣA : total area puncak metil ester
As : area puncak standar internal (metil heptadekanoat) Cs : konsentrasi larutan standar (10 mg/mL)
BAB IV
HASIL DAN PEMBAHASAN
4.1 Karakterisasi Kitosan
Karakterisasi kitin dan kitosan meliputi uji kelarutan, menentukan derajat deasetilasi kitosan dengan menggunakan metode FTIR dan menentukan berat molekul dari kitosan dengan metode viscometer Ostwald.
1. Uji kelarutan kitosan
Uji kelarutan kitosan dapat dianalisis dengan melarutkan sampel kitosan dengan larutan asam asetat 2%. Jika sampel larut dalam asam maka sampel tersebut kitosan, apabila tidak larut sampel tersebut masih berupa kitin (Emma et al., 2010). Dan hasil yang didapat ialah kitosan yang digunakan dapat larut sempurna dalam asam asetat 2%. Sifat kitosan dapat larut dalam asam organik encer, seperti asam asetat dimungkinkan karena adanya ikatan kimia yaitu interaksi asam-basa antara pelarut dengan kitosan. Sifat asam dapat dilihat melalui gugus karboksil pada asam asetat yang bersifat asam karena mudah melepaskan H+. Sedangkan sifat basa kitosan dilihat dari gugus amina sebagai donor pasangan elektron bebas (PEB).
2. Penentuan berat molekul rata-rata kitosan
kemudahan suatu molekul bergerak karena adanya gesekan antar lapisan material. Karena itu viskositas menunjukkan tingkat ketahanan suatu cairan untuk mengalir. Semakin besar viskositas maka aliran akan semakin lambat. Besarnya viskositas dipengaruhi oleh beberapa faktor seperti temperatur, gaya tarik antar molekul dan ukuran serta jumlah molekul terlarut. Fluida, baik zat cair maupun zat gas yang jenisnya berbeda memiliki tingkat kekentalan yang berbeda. Pada zat cair, viskositas disebabkan karena adanya gaya kohesi (gaya tarik menarik antara molekul sejenis). Sedangkan dalam zat gas, viskositas disebabkan oleh tumbukan antara molekul.
Perbandingan antara viskositas larutan polimer terhadap viskositas pelarut murni dapat dipakai untuk menentukan massa molekul nisbi polimer. Keunggulan dari metode viscometer Ostwald ini adalah lebih cepat, lebih mudah, alatnya murah serta perhitungannya lebih sederhana. Yang diukur adalah waktu alir yaitu waktu yang diperlukan pelarut atau larutan polimer untuk mengalir diantara 2 tanda disekitar pipa kapiler. Suatu jenis cairan yang mudah mengalir dapat dikatakan memiliki viskositas yang rendah, dan sebaliknya bahan-bahan yang sulit mengalir dikatakan memiliki viskositas yang tinggi. Misalnya pada kitosan dalam berbagai macam konsentrasi yang berbeda yaitu 0,015; 0,03; 0,045; 0,06 g/100 mL.
-D-glukopiranosa) atau glukosamin hasil deasetilasi kitin atau poli (N-asetil-amino-2-deoksi-β-D-glukopiranosa) dan juga asam asetat sebagai pelarut.
Pada percobaan ini sebelum sampel diukur waktu alirnya, dilakukan pengukuran waktu alir rata-rata dari pelarut yaitu asam asetat 2% yaitu sebesar 3,67 detik. Pengukuran waktu alir sampel dilakukan sebanyak tiga kali (triplo). Dari pengukuran waktu alir sampel dengan berbagai konsentrasi didapatkan waktu rata-rata alir yaitu kitosan dengan konsentrasi 0,005; 0,0122; 0,02; 0,05 g/100 mL berturut-turut sebesar 3,67; 3,81; 4,10; 4,60; 6,50 detik. Dari hasil yang didapatkan dapat dilihat bahwa semakin tinggi konsentrasi dari larutan kitosan maka semakin lama pula waktu yang dibutuhkan untuk mengalir (berbanding lurus) karena konsentrasi larutan menyatakan banyaknya partikel zat yang terlarut tiap satuan volume. Semakin banyak partikel yang terlarut, gesekan antar partikel semakin tinggi dan viskositasnya semakin tinggi pula.
Dari data yang diperoleh dapat ditentukan nilai viskositas spesifik yang nantinya digunakan untuk mendapatkan nilai viskositas reduksi. Persamaan Huggins menyatakan bahwa viskositas intrinsik diperoleh dari
ektrapolasi konsentrasi larutan terhadap ηsp dimana konsentrasi larutan
mendekati nol.
viskositas intrinsik dengan massa molekul relatif dapat dinyatakan dengan persamaan Mark Houwink Sakurada berikut:
Dimana nilai K = 1,46.10-4 dan nilai a = 0,83 untuk konstanta pelarut dan polomer kitosan (Atkin, 2006), sehingga massa molekul kitosan dapat ditentukan. Berdasarkan percobaan didapatkan hasil perhitungan berat molekul rata-rata kitosan sebesar 477081,1228 g/mol atau 477,0811228 kg/mol (lampiran 2). Berat molekul rata-rata kitosan menurut Khor 2011, yaitu 190000-700000 g/mol. Sehingga dapat dikatakan bahwa BM kitosan yang kami gunakan masuk dalam rentang BM rata-rata kitosan.
3. Penentuan derajat deasetilasi kitosan
Salah satu parameter utama yang berpengaruh pada karakteristik kitosan adalah derajat deasetilasi (DD). Derajat deasetilasi menunjukkan berkurangnya gugus asetil dari kitin menjadi gugus amino pada kitosan. Penentuan DD dapat dilakukan dengan beberapa metode, seperti titrimetri HBr, spektroskopi IR, X-Ray Diffraction dan spektroskopi 1H NMR. Penentuan DD dengan spektroskopi IR dilakukan dengan metode baseline. Dalam penelitian ini, perhitungan DD dilakukan dengan baseline metode Sabnis dan Block (Khan et al., 2002):
Domzy, Baxter dan Sabnis. Dari ketiga rumusan yang digunakan, hasil perhitungan DD yang dirumuskan oleh Sabnis memiliki nilai DD yang mendekati nilai DD kitosan standar Sigma-Aldric. Dari penentuan melalui
software “DDKProject” didapatkan DD kitosan yang digunakan pada penelitian ini sebesar 82,23%. Kitosan dengan derajat deasetilasi besar menunjukkan semakin banyaknya gugus asetil kitin yang diubah menjadi gugus amino. Gugus aktif kitosan ini baik dalam bentuk NH2 ataupun
dalam keadaan terprotonasi NH3+ yang diharapkan mampu berperan
sebagai katalis.
4. Penentuan gugus fungsi dengan Fourier Transform Infra Red Spectroscopy (FTIR)
Gambar 4.1 Spektrum FTIR kitosan
1640-1560 cm-1 (Pavia et al., 2001) dan berdasarkan hasil yang diperoleh didapatkan pita serapan pada bilangan gelombang 1650,95 cm-1. Pada bilangan gelombang 1300-1000 cm-1 menunjukkan adanya ikatan C–O–C (Pavia et al., 2001) yang merupakan ikatan glikosidik antar rantai monomer. Berdasarkan hasil yang diperoleh dapat diamati terdapat pita serapan pada daerah 1083,92 cm-1 yang membuktikan bahwa adanya ikatan glikosidik pada kitosan yang dianalisis.
4.2 Karakteristik CPO
Pada penelitan ini karakterisktik CPO Dinas Perkebunan Kelapa Sawit Palembang, Sumatera Selatan yang diamati meliputi kadar air, kadar FFA atau sama dengan ½ x bilangan asam (Berrios et al., 2007), dan berat molekul.
4.2.1 Penentuan kadar air CPO
Salah satu faktor yang mempengaruhi mutu minyak kelapa sawit atau CPO adalah kadar air. Kadar air adalah banyaknya kandungan air yang terdapat di dalam sampel. Kadar air dapat mempengaruhi mutu CPO, semakin tinggi kadar air, maka semakin rendah mutu CPO. Kadar air yang tinggi dapat menyebabkan hidrolisis yang akan merubah minyak menjadi asam-asam lemak bebas sehingga menyebabkan ketengikan (Ketaren, 1986). Dari hasil percobaan didapatkan kadar air CPO sebesar 0,3025% (lampiran 3).
4.2.2 Penentuan bilangan asam CPO
perubahan aroma dan cita rasa selama penyimpanan. Perubahan ini disertai dengan terbentuknya senyawa-senyawa yang dapat menyebabkan kerusakan minyak (Ketaren, 1986).
Bilangan asam adalah ukuran jumlah asam bebas yang dihitung berdasarkan bobot molekul asam lemak atau campuran asam lemak. Bilangan asam dinyatakan sebagai jumlah miligram KOH 0,1 N yang dibutuhkan untuk menetralkan asam lemak bebas yang terdapat dalam 1 g minyak. Bilangan asam ini menyatakan jumlah asam lemak bebas yang terkandung dalam minyak, dan biasanya dihubungkan dengan terjadinya hidrolisis minyak yang mana berkaitan dengan mutu minyak. Dari hasil percobaan didapatkan bilangan asam CPO sebesar 18,4235 mg KOH/g atau setara dengan kadar FFA 9,2118% (lampiran 4). 4.2.3 Penentuan berat molekul (BM) CPO
Berat molekul (BM) CPO dapat ditentukan melalui analisis GC-MS metil ester hasil reaksi transesterifikasi CPO dan metanol menggunakan katalis homogen KOH. Namun sebelum melakukan reaksi transesterifikasi, CPO harus diesterifikasi terlebih dahulu untuk menurunkan bilangan asamnya.
4.2.3.1 Esterifikasi CPO
RCOOH + CH3OH RCOOCH3 + H2O
Esterifikasi biasa dilakukan untuk membuat biodiesel dari minyak yang berkadar asam lemak bebas tinggi (berangka-asam ≥ 5 mg KOH/g). Pada tahap ini, asam lemak bebas akan dikonversikan menjadi metil ester. Tahap esterifikasi biasa diikuti dengan tahap transesterifikasi. Namun sebelum produk esterifikasi dilanjutkan ke tahap transesterifikasi, air dan katalis asam yang masih tersisa harus dihilangkan terlebih dahulu. Maka dari itu dilakukan pencucian dengan akuadem setelah dilakukan esterifikasi.
Tahapan esterifikasi sangat penting dilakukan karena bilangan asam CPO karena masih terlalu tinggi yaitu 18,4235 mg KOH/g (lampiran 4). Minyak yang memiliki keasaman yang tinggi, jika dilakukan reaksi transesterifikasi akan terjadi reaksi penyabunan yang dapat menghambat pembentukan metil ester dan pemisahannya dengan gliserol. Perbandingan rasio molar minyak terhadap
metanol 1:40 dapat menurunkan bilangan asam hingga
bilangan asam awal (Canakci, 2001). Pada tahap esterifikasi ini digunakan rasio molar CPO terhadap metanol 1:60 dengan harapan dapat menurunkan bilangan asam lebih rendah dari
bilangan asam awal. Setelah reaksi esterifikasi dilakukan, bilangan asam dari CPO ditentukan kembali untuk menentukan apakah terjadi penurunan bilangan asam. Dari hasil percobaan, didapatkan penurunan bilangan asam CPO setelah dilakukan reaksi esterifikasi, yaitu dari bilangan asam yang semula 18,4235 mg KOH/g menjadi 0,5604 mg KOH/g (lampiran 5). Penurunan bilangan asam yang
4.2.3.2 Transesterifikasi CPO
Transesterifikasi biasa disebut dengan alkoholisis adalah tahap konversi dari trigliserida (minyak nabati) menjadi metil ester melalui reaksi dengan alkohol, dan menghasilkan produk samping yaitu gliserol. Di antara alkohol yang menjadi sumber gugus alkil, metanol adalah yang paling umum digunakan, karena disamping harganya murah, reaktivitasnya paling tinggi sehingga reaksi ini disebut metanolisis.
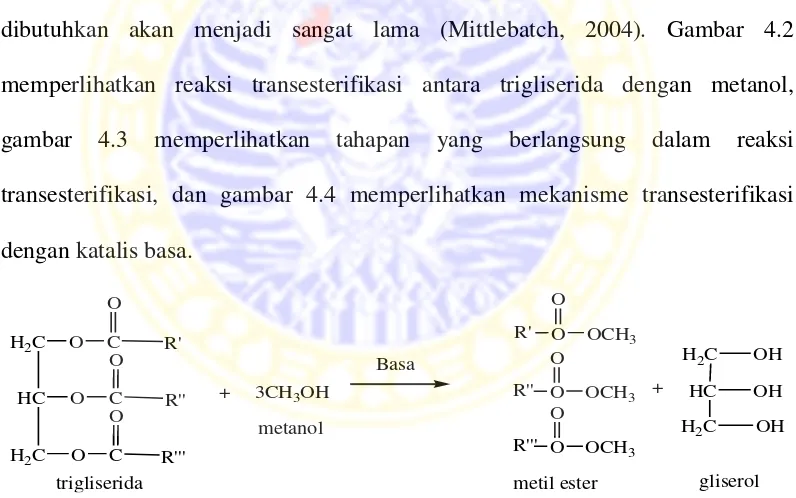
Transesterifikasi juga menggunakan katalis dalam reaksinya. Tanpa adanya katalis, reaksi dapat berjalan dengan sempurna, namun waktu yang dibutuhkan akan menjadi sangat lama (Mittlebatch, 2004). Gambar 4.2 memperlihatkan reaksi transesterifikasi antara trigliserida dengan metanol, gambar 4.3 memperlihatkan tahapan yang berlangsung dalam reaksi transesterifikasi, dan gambar 4.4 memperlihatkan mekanisme transesterifikasi dengan katalis basa. Gambar 4.2 Transesterifikasi biodiesel menggunakan metanol (Liu et al., 2007)
Trigliserida (TG) + CH3OH
katalis
Digliserida (DG) + R1COOCH3
Digliserida (DG) + CH3OH Monogliserida (MG) + R2COOCH3
Monogliserida (MG) + CH3OH Gliserol (GL) + R3COOCH3
katalis
katalis
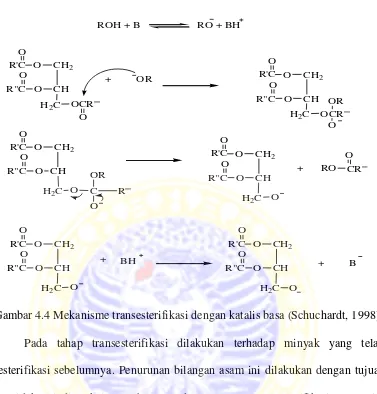
ROH + B RO + BH
Gambar 4.4 Mekanisme transesterifikasi dengan katalis basa (Schuchardt, 1998) Pada tahap transesterifikasi dilakukan terhadap minyak yang telah diesterifikasi sebelumnya. Penurunan bilangan asam ini dilakukan dengan tujuan agar tidak terjadi reaksi penyabunan pada saat proses transesterifikasi. Proses ini dilakukan dengan menggunakan katalis KOH. Pada reaksi ini diasumsikan bahwa semua trigliserida CPO terkonversi 100% menjadi metil ester sehingga dari hasil tersebut dapat ditentukan Berat Molekul (BM) dari CPO.
4.3 Pembuatan Katalis Kitosan-Sulfat
Pada penelitian ini kitosan dimodifikasi menjadi kitosan-sulfat dengan harapan dapat meningkatkan konduktivitas termal dari kitosan sehingga dapat digunakan sebagai katalis dalam reaksi transesterifikasi pada proses sintesis biodiesel. Proses pembuatan katalis kitosan-sulfat dilakukan dengan cara melarutkan kitosan dalam larutan asam asetat 2% dilanjutkan mereaksikan dengan H2SO4 selama 5 jam. Setelah itu larutan kitosan-sulfat dapat diendapkan dengan
larutan NaOH 60%. Kemudian didapatkan slurry sehingga perlu dilakukan penyaringan untuk memisahkan dengan slurry dengan larutan. Endapan disaring dengan menggunakan kertas saring Whatman dan dipanaskan pada suhu 100˚C selama 24 jam untuk menguapkan air yang masih terkandung pada katalis. Setelah itu kitosan-sulfat dikeringkan dengan freeze-dryer dan kemudian dihaluskan dengan mortar sehingga didapatkan katalis kitosan-sulfat berupa serbuk berwarna putih.
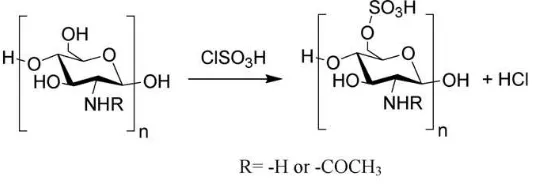
Kitosan-sulfat dapat dibuat dengan dua cara yaitu dengan penambahan ClSO3H atau dengan H2SO4. Menurut Xiang et al., penambahan ClSO3H pada
kitosan dapat menyebabkan masuknya gugus SO3H pada atom C-6 seperti yang
dijelaskan pada gambar berikut:
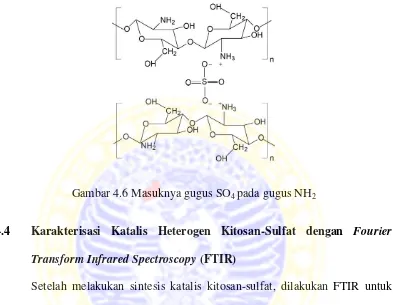
Sedangkan penambahan H2SO4 pada kitosan dapat menyebabkan masuknya gugus
SO4 pada gugus NH2 (Wang et al., 2007).
Gambar 4.6 Masuknya gugus SO4 pada gugus NH2
4.4 Karakterisasi Katalis Heterogen Kitosan-Sulfat dengan Fourier Transform Infrared Spectroscopy (FTIR)
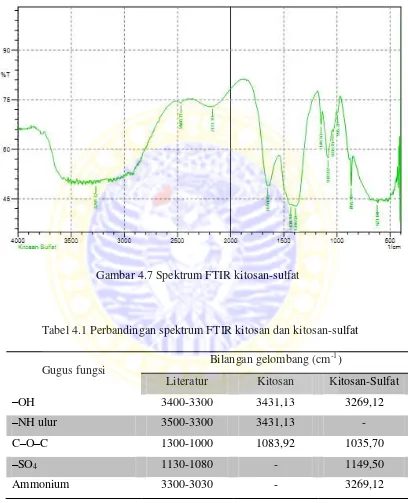
Setelah melakukan sintesis katalis kitosan-sulfat, dilakukan FTIR untuk menginformasikan gugus fungsi apa saja yang muncul pada katalis hasil sintesis. Hasil tersebut juga dibandingkan dengan bilangan gelombang yang terdapat pada literatur dan pita serapan spesifik pada kitosan. Dari perbandingan ini didapatkan pita serapan baru yang muncul pada kitosan-sulfat yaitu pada bilangan gelombang 1390,58 cm-1 dan 1149,50 cm-1. Gugus –SO4 asimetris dan simetris berturut-turut
yaitu 3300-3030 cm-1 (Fleming et al., 1995) berdasarkan spektrum yang didapat terdapat pita serapan pada 3269,12 cm-1.
Gambar 4.7 Spektrum FTIR kitosan-sulfat
Tabel 4.1 Perbandingan spektrum FTIR kitosan dan kitosan-sulfat
Gugus fungsi Bilangan gelombang (cm
-1
)
Literatur Kitosan Kitosan-Sulfat
–OH 3400-3300 3431,13 3269,12
–NH ulur 3500-3300 3431,13 -
C–O–C 1300-1000 1083,92 1035,70
–SO4 1130-1080 - 1149,50
4.5 Sintesis Biodiesel
Pada tahap sintesis biodiesel ini dilakukan sebanyak tiga perlakuan, yaitu sintesis biodiesel tanpa katalis, katalis kitosan, dan katalis kitosan-sulfat. Hal ini dilakukan dengan tujuan mengamati seberapa banyak hasil konversi biodiesel yang terbentuk pada masing-masing perlakuan. Sehingga dari hasil tersebut dapat diketahui seberapa besar katalis yang digunakan dapat bekerja.
proses ini adalah 10% terhadap berat minyak. Proses sintesis biodiesel dilakukan selama 3 jam pada suhu 65-70˚C menggunakan refluks yang dialiri oleh air dingin hal ini bertujuan agar metanol yang menguap agar semakin cepat mengalami kondensasi menjadi cair karena terjadi perbedaan temperatur antara labu alas bulat dan refluks. Setelah bereaksi selama 3 jam, campuran dibiarkan selama semalam untuk memisahkan antara fasa katalis, minyak, dan biodiesel yang dihasilkan. Pemisahan dilakukan dua cara, yaitu secara dekantasi dan menggunakan corong pisah. Pemisahan dekantasi digunakan untuk memisahkan antara fasa minyak-biodiesel dengan katalis. Setelah itu corong pisah digunakan untuk memisahkan fasa minyak dengan biodiesel yang terbentuk pada lapisan atas.
Gambar 4.8 Kromatogram GC-MS biodiesel tanpa katalis
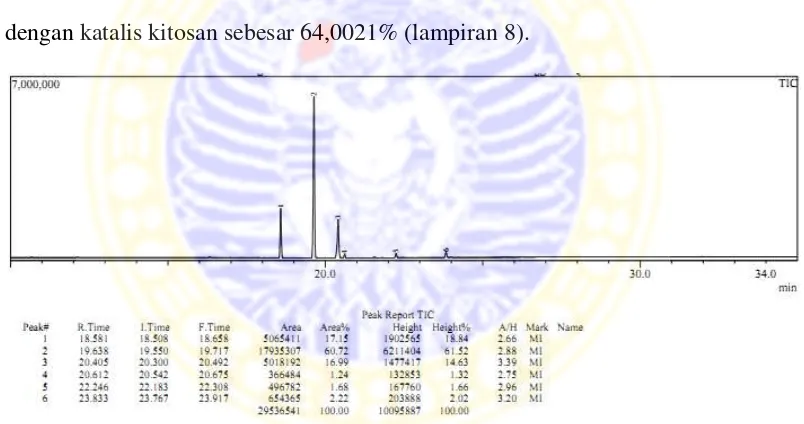
Hasil analisis menggunakan GC-MS didapatkan konversi biodiesel yang terbentuk dengan katalis kitosan sebesar 64,0021% (lampiran 8).
Gambar 4.9 Kromatogram GC-MS biodiesel dengan katalis kitosan
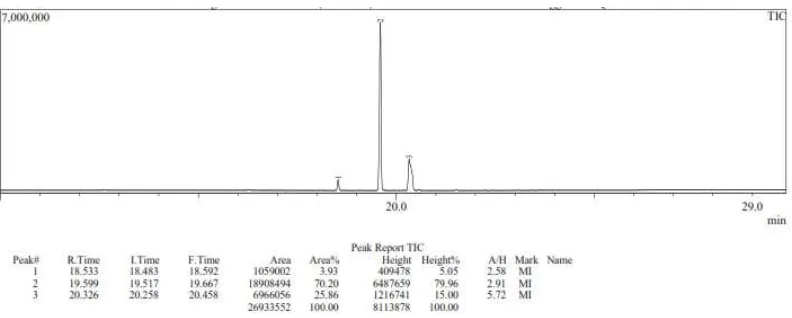
Gambar 4.10 Kromatogram GC-MS biodiesel dengan katalis kitosan-sulfat Hasil konversi biodiesel penelitian pada minyak berkandungan asam lemak tinggi seperti CPO dapat mencapai konversi metil ester 85-98% (Rachmaniah, 2004). Komponen trigliserida sedikit larut dalam fasa metanol dan trigliserida tidak mudah bereaksi membentuk metil ester pada reaksi transesterifikasi berkatalis asam (Freedman et al., 1984) akibat reaksi transesterifikasi berjalan berantai (Noureddini et al., 1997). Adanya pengaruh tersebut dapat dimungkinkan terjadi karena substituen yang masuk pada kitosan yaitu SO42- adalah anion dari asam
1. Senyawa metil heksadekanoat (metil palmitat)
Spektra massa dari senyawa metil ester dengan waktu retensi pada hasil tanpa katalis, katalis kitosan, dan kitosan-sulfat berturut-turut sebesar 18,566; 18,581; 18,568 menit ditampilkan pada gambar 4.11 dan fragmentasi senyawa dengan penataan ulang Mc Lafferty akan dijelaskan pada gambar 4.12.
Gambar 4.11 Spektrum massa senyawa metil heksadekanoat
Molekul senyawa metil heksadekanoat ditembak oleh elektron berenergi tinggi sebesar 70 eV menghasilkan ion molekuler m/z=270, dengan terlepasnya radikal C14H28 menghasilkan puncak dengan m/z=74
(100%) yang merupakan puncak dasar disebabkan karena ion ini distabilkan oleh adanya penataan ulang Mc Lafferty. Pemecahan selanjutnya dengan lepasnya radikal C13H27 menghasilkan puncak dengan
CH3(CH2)11CH
m/z 227, 213,199, 185, 171, 157, 143, 129, 115, 107, 87 m/z 270
Gambar 4.12 Fragmentasi metil heksadekanoat 2. Senyawa metil heptadekanoat
Spektra massa dari senyawa metil ester dengan waktu retensi pada hasil tanpa katalis, katalis kitosan, dan kitosan-sulfat berturut-turut sebesar 19,626; 19,638; 19,624 ditampilkan pada gambar 4.13 dan fragmentasi senyawa dengan penataan ulang Mc Lafferty akan dijelaskan pada gambar 4.14.
CH3(CH2)12 CH
Gambar 4.14 Fragmentasi metil heptadekanoat
Molekul senyawa metil heptadekanoat ditembak oleh elektron berenergi tinggi sebesar 70 eV menghasilkan ion molekuler m/z=284, dengan terlepasnya radikal C15H30 menghasilkan puncak dengan m/z=74
(100%) yang merupakan puncak dasar disebabkan karena ion ini distabilkan oleh adanya penataan ulang Mc Lafferty.
3. Senyawa metil cis-9-oktadekenoat (metil oleat)
Gambar 4.15 Spektrum massa senyawa metil cis-9-oktadekenoat
Gambar 4.16 Fragmentasi metil cis-9-oktadekenoat
Molekul senyawa metil cis-9-oktadekenoat ditembak oleh elektron berenergi tinggi sebesar 70 eV menghasilkan ion molekuler m/z=296. Dengan terlepasnya radikal C(O)OCH3 menghasilkan puncak dengan
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Berdasarkan penelitian yang telah dilakukan, dapat diperoleh kesimpulan sebagai berikut :
1. Modifikasi antara kitosan dengan sulfat dapat dilakukan dan dimanfaatkan sebagai katalis heterogen pada produksi biodiesel berbahan baku CPO namun menghasilkan biodiesel dengan konversi kecil.
2. Berdasarkan hasil analisis GC-MS diperoleh konversi biodiesel yang dihasilkan dari CPO tanpa katalis sebesar 57,3108%, dengan katalis kitosan sebesar 64,0021%, dengan katalis kitosan-sulfat sebesar 42,2080%. 5.2 Saran
1. Menggunakan substituen dari asam lemah karena pengaruh substituen yang masuk pada kitosan yaitu SO42- adalah anion dari asam kuat sehingga
karakter asam tersebut mengganggu jalannya reaksi transesterifikasi. 2. Menentukan berat molekul kitosan-sulfat sehingga dapat diketahui berapa
banyak substituen gugus SO4 yang masuk pada kitosan.
DAFTAR PUSTAKA Edible Oil and Fat Products: Edible Oils, Vol.2 Pages: 333-429.
Berchmans, H.J., Hirata, S., 2008, Biodiesel Production from Crude Jatropha curcas L. Seed Oil with a High Content of Free Fatty Acids. Bioresour. Technol, Vol.99 Pages:1716-1721.
Berrios, M., Siles, J., Martin, M.A., Martin, A., 2007, A Kinetic Study of the Esterification of Free Fatty Acids (FFA) in Sunflower Oil. Fuel, Vol.88 Pages:2383-2388.
Bhuvana, 2006, Studies on Frictional Behaviour of Chitosan-Coated Fabrics. Aux. Res. J., Vol.6(4) Pages:123-130.
Bradshaw., George B., Meuly, Wlater C., 1944, Preparation of Detergent, US Patent Office 2,360,844.
Canakci, M., Gerpen, J.V., 2001, Biodiesel Production from Oils and Fats with High Free Fatty Acids. American Society of Agricultural Engineers ISSN 0001-2351, Vol.44(6) Pages:1429-1436.
Demirbas, A., 2009, Biodiesel from Waste Cooking Oil via Base-Catalytic and Supercritical Methanol Transesterification. Energy Conversion and Management, Vol.50 Pages:923-927.
Emma, S., Natalia, S., Tokok, A., 2010, Sintesis Kitosan, Poli (2-amino-2-deoksi-D-Glukosa), Skala Pilot Project dari Limbah Kulit Udang sebagai Bahan Baku Alternatif Pembuatan Biopolimer. Yogyakarta. Freedman, B., Pryde, E.H., Mounts, T.H., 1984, Variable Affecting the Yield of
Fatty Ester from Transesterified Vegetable Oil. JAOCS, Vol.61 Pages:1638-1643.
Gao Lijing., Teng Guangyuan., Xiao Guomin., Wei Ruiping., 2010, Biodiesel from Palm Oil Via Loading KF/Ca-Al Hydrotalcite Catalyst. Biomass and Bioenergy, Vol.34 Pages:1283-1288.
Georgogianni, K.G., Katsoulidis, A.P., Pomonis, P.J., Kontominas, 2009, Transesterification of Soybean Frying Oil to Biodiesel Using Heteregeneous Catalysts, Fuel Processing Technology, Vol.90 Pages:671-676.
Guan Guoqing., Kusakabe Katsuki., Sakurai Nozomi., 2009, Transesterification of Vegetable Oil to Biodiesel Fuel Using Acid Catalysts in the Presence of Dimethyl Ether, Fuel, Vol.88 Pages:81-86.
Helwani, Z., Othman, M.R., Fernando, W.J.N., Kim, J., 2009, Technologies for Production of Biodiesel Focusing on Green Catalytic Techniques: A Review. Fuel Processing Technology, Vol.90 Pages:1502-1514.
Hikmah, M.N., Zuliyana, 2010, Pembuatan Metil Ester (Biodiesel) dari Minyak Dedak dan Metanol dengan Proses Esterifikasi dan Transesterifikasi, skripsi. Jurusan Teknik Kimia, Fakultas Teknik, Universitas Diponegoro, Semarang.
Huda Thorikul., 2009., Tesis: Potensi Chitosan sebagai Katalis pada Produksi Biodiesel Berbahan Baku Minyak Jelantah.
Kementrian Keuangan Republik Indonesia, 2009, Nota Keuangan dan Rncangan Anggaran Pendapatan dan Belanja Negara Tahun Anggaran 2009.
Ketaren, S., 1986, Pengantar Teknologi Minyak dan Lemak Pangan, Jakarta: Penerbit Universitas Indonesia, halaman 26-255.
Khan, T.A., Peh, K.K., Chang, H.S., 2002, Reporting Degree of Deacetylation Values of Chitosan; The Influence of Analytical Methods. J. Pharm. Sci, Vol 5(3) Pages:205-212
Khor, E., 2001, Chitin: Fulfilling a Biomaterial Promise, (ed) Chitin Handbook, Singapore.
Kim Manhoe., Yan Shuli., Salley, O.S., Ng Simon, K.Y., 2009, The Effect of Sodium on the Catalytic Activity of ZnO-Al2O3/ZSM-5 and SnO-Al2O3/ZSM-5 for the Transesterification of Vegetable Oil with Methanol. National Biofuels Energy, Wayne State University.
Ladd, M.F.C., Lee, W.H., 1986, Introduction to Physical Chemistry, New York: Cambridge University Press.
Lam, M.K., Lee T.K., Mohamed, A.R., 2010, Homogeneous, Heterogeneous and Enzymatic Catalysis for Transesterification of High Free Fatty Acid Oil (Waste Cooking Oil) to Biodiesel: A Review. Biotechnology Advances,Vol.28 Pages:500–518.
Leung Dennis, Y.C., Xuan Wu, Leung, M.K.H., 2010, A Review on Biodiesel Production Using Catalyzed Transesterification. Applied Energy, Vol.87 Pages:1083-1095.
Mao, V.S., K. Konar, D.G.B. Boocock, 2004, The Pseudo Single Phase Base Catalyzed Transmethylation of Soybean Oil. JAOCS, Vol.8 Pages:803-808.
Mittelbach, M., P. Tritthart., H. Junek, 1985, Diesel Fuel Derived from Vegetable Oils, II: Emission Tests Using Rape Oil Methyl Ester.
Energy Agricul. Vol.4 Pages:207–215.
Murugesan, A., Umarani, C., Chinnusamy, T.R., Krishnan, M., Subramanian, R., Neduzchezhain,N.,2009. Production and Analysis of Bio-Diesel from Non-Edible Oils—A Review. Renewable and Sustainable Energy Reviews, Vol.13 Pages:825–834.
Ngamcharussrivichai, C., Nunthasanti, P., Tanachai, S., Banyakiat, K., 2010, Biodiesel Production Through Transesterifikasi over Natural Calciums, Fuel Prossesing Techonology, Vol.91 Pages:1409-1419.
No, H.K., Lee, S.H., Park, N.Y., Meyers, S.P., 2003, Comparison of Phsycochemical, Binding and Antibacterial Properties of Chitosans Prepared Without and With Deproteinization Process. J. Agric. Food. Chem, Vol 51 Pages:7659-7663.
Noureddini, H., Zhu, D., 1997, Kinetics of Transesterification of Soybean Oil. J. Am. Oil Chem. Soc., Vol.74 Pages: 1457-63.
Pavia, D.L., Lampman, G.M., Kriz, G.S., 2001, Introduction to Spectroscopy. Departement of Chemistry, Western Washington University, Bellingham, Washington.
Prihandana, R., Hendroko, R., 2007,Energi Hijau Pilihan Bijak Menuju Negeri Mandiri Energi. Jakarta : Penebar Swadaya.
Sastrosayono, S., 2003, Budidaya Kelapa Sawit, Penerbit Agromedia Pustaka, Purwokerto, halaman 1-10.
Schuchardt Ulf., Serchelia Ricardo., Vargas Rogério Matheus.,1998, Transesterification of Vegetable Oils: A Review, J. Braz. Chem. Soc.,
Vol.9 Pages:199-210.
Sharma, Y.C., Singh, B., 2008, Development of Biodiesel from Karanja, a Tree Found in Rural India. Fuel,Vol.87 Pages:1740-1742.
Silverstein, R.M., Webster, F.X., Kiemle, D.J., 2005, Spectrometric Identification of Organic Compounds. State University of New York, Collage of Environmental Science and Forestry.
Soerawidjaja, Tatang H., 2005, Minyak-lemak dan produk-produk kimia lain dari kelapa, Handout kuliah Proses Industri Kimia, Program Studi Teknik Kimia, Institut Teknologi Bandung.
Sudarmadji, S., 1997, Prosedur Analisis Bahan Makanan dan Pertanian, Liberty, Yogyakarta, halaman 20-25.
Vogel, 1994, Buku Teks Analisis Anorganik Kualitatif Makro dan Semimakro. Jakarta: PT. Kalman Media Pusaka.
Wang, J., Zheng, X., Wu, H., Zheng, B., Jiang, Z., Hao, X., Wang, B., 2007, Effect of Zeolites on Chitosan/Zeolite Hybrid Membranes for Direct Methanol Fuel Cell. Power Sources, Vol.178 Pages:9-19.
Xiang Yan., Yang Meng., Guo Zhibin., Cui Zheng., 2009, Alternatively Chitosan Sulfate Blending Membrane as Methanol-Blocking Polymer Electrolyte Membrane for Direct Methanol Fuel Cell. Journal of Membrane Science, Vol.337 Pages:318–323.
Lampiran 1. Pembuatan larutan KOH 0,1 N Diketahui :
Normalitas KOH : 0,1 N Normalitas H2C2O4 : 0,1 N
Mr KOH : 56,11 g/mol Volume larutan : 1000 mL Mr H2C2O4 : 126,07 g/mol
N KOH = M.valensi
M KOH =
M KOH = 0,1 M
M =
0,1=
m= 5,611 g
Kemurnian KOH yang digunakan yaitu 85% sehingga
m KOH =
x 5,611
m KOH = 6,6012 g (hasil penimbangan 6,6074 g)
N H2C2O4 = M.valensi
M H2C2O4 =
M =
0,05=
m = 0,6303 g (hasil penimbangan 0,6300 g)
(V.M)oksalat = (V.M)KOH
10.0,01 = 9,95.MKOH
MKOH = 0,10050251 M
NKOH = 0,10050251.1
Lampiran 2. Hasil penentuan BM kitosan
Penentuan waktu alir
Konsentrasi sampel (g/100mL) t1 t2 t3 trata-rata
Pelarut 3,65 3,71 3,66 3,67
0,004 3,81 3,80 3,83 3,81
0,01 4,09 4,10 4,11 4,10
0,02 4,59 4,59 4,62 4,60
0,05 6,49 6,51 6,51 6,50
Menentukan viskositas relatif (ηr)
Larutan kitosan dengan konsentrasi 0,004 g/100 mL (0,0050 g/100 mL); 0,01 g/100 mL (0,0122 g/100 mL); 0,02 g/100 mL (0,0217 g/100 mL); dan 0,05 g/100 mL (0,0512 g/100 mL).
Diketahui : t0 = 3,67 sekon
Viskositas relatif (ηr) larutan kitosan dengan konsentrasi 0,004 g/100 mL
η
r=
=
=
= 1,0381Viskositas relatif (ηr) larutan kitosan dengan konsentrasi 0,01 g/100 mL
η
r=
ηη=
=
= 1,1172
Viskositas relatif (ηr) larutan kitosan dengan konsentrasi 0,02 g/100 mL
η
r=
=
=
= 1,2534Viskositas relatif (ηr) larutan kitosan dengan konsentrasi 0,05 g/100 mL
Menentukan viskositas spesifik (ηsp) larutan kitosan dengan konsentrasi 0,004
g/100 mL (0,0050 g/100 mL); 0,01 g/100 mL (0,0122 g/100 mL); 0,02 g/100 mL (0,0217 g/100 mL); dan 0,05 g/100 mL (0,0512 g/100 mL).
Viskositas spesifik (ηsp) larutan kitosan dengan konsentrasi 0,004 g/100 mL
η
sp=
=
=
= 0,0381
Viskositas spesifik (ηsp) larutan kitosan dengan konsentrasi 0,01 g/100 mL
η
sp=
=
=
= 0,1172Viskositas spesifik (ηsp) larutan kitosan dengan konsentrasi 0,02 g/100 mL
η
sp=
=
=
= 0,2534Viskositas spesifik (ηsp) larutan kitosan dengan konsentrasi 0,05 g/100 mL
η
sp=
=
=
= 0,7711Data yang didapatkan dari hasil perhitungan:
C (g / 100 mL) trata-rata (s) ηsp
(100 mL / g)
0,0050 3,90 0,0381 7,6294
0,0122 4,10 0,1172 9,6038
0,0217 4,60 0,2534 11,6777
Dari grafik diatas didapat persamaan regresi y = 153,1x + 7,5437 Sehingga nilai viskositas intrinsik dapat diketahui melalui persamaan:
y = 7,5437 + 153,1x
Dari data viskositas intrinsik dapat diperoleh massa molekul relatif. Hubungan viskositas intrinsik dengan massa molekul relatif dapat dinyatakan dengan persamaan Mark Houwink Sakurada berikut:
Dimana nilai K=1,46.10-4 dan nilai a = 0,83 untuk konstanta pelarut dan polimer kitosan. Sehingga massa molekul kitosan dapat dihitung sebagai berikut:
[η] = K. Mva
Mv=
√
Mv = 477081,1228 g/mol atau 477,0811228 kg/mol
Lampiran 3. Hasil penentuan kadar air Crude Palm Oil (CPO)
No. Cawan
kosong (g)
Cawan dan CPO awal (g)
Cawan dan CPO akhir (g)
Kadar air (%)
1. 33,3898 38,4080 38,3975 0,2092
2. 33,8031 33,8229 33,8060 0,3367
3. 36,0025 41,0338 41,0156 0,3617
Rata-rata 0,3025
Contoh perhitungan penentuan kadar air Crude Palm Oil (CPO)
Kadar air =
x 100%
Kadar air =
x 100%
Lampiran 4. Hasil penentuan bilangan asam Crude Palm Oil (CPO) sebelum esterifikasi
No. CPO
(g)
Etanol dan n-heksana 1:1 (mL)
Volume KOH 0,1005 N (mL)
Bilangan asam (mg KOH/g)
1. 1,0001 10 3,2 18,0267
2. 1,0286 10 3,35 18,3656
3. 1,0156 10 3,4 18,8783
Rata-rata 18,4235
Contoh perhitungan penentuan bilangan asam Crude Palm Oil (CPO)
Bilangan asam =
Bilangan asam =
Bilangan asam = 18,0267 mg KOH/g
Kadar FFA = ½ x bilangan asam
Kadar FFA = ½ x 18,0267
Lampiran 5. Hasil penentuan bilangan asam Crude Palm Oil (CPO) setelah esterifikasi
No. CPO
(g)
Etanol dan n-heksana 1:1 (mL)
Volume KOH 0,1005 N (mL)
Bilangan asam (mg KOH/g)
1. 1,0098 10 0,1 0,5584
2. 1,0054 10 0,1 0,5609
3. 1,0032 10 0,1 0,5621
Rata-rata 0,5604
Contoh perhitungan penentuan bilangan asam Crude Palm Oil (CPO)
Bilangan asam =
Bilangan asam =
Bilangan asam = 0,5584 mg KOH/g
Kadar FFA = ½ x bilangan asam
Kadar FFA = ½ x 0,5584
Lampiran 6. Hasil perhitungan berat molekul rata-rata CPO
Berat molekul rata-rata CPO 843,4086
Diketahui :
Perhitungan komponen trigliserida
( )
e metil palmitat = ( )
= 421,5388
e metil palmitat = ( )
= 391,8136
e metil palmitat = ( )
= 30,0562
BM CPO = e metil palmitat + e metil oleat + e metil stearat = 421,5388 + 391,8136 + 30,0562
Lampiran 7. Hasil perhitungan rasio molar 1:60 CPO terhadap metanol pada sintesis biodiesel
Tanpa katalis
Diketahui :
m CPO : 14,7652 g Mr CPO : 843,4086 g/mol Mr metanol : 32 g/mol
m metanol =
x Mr metanol x 60
=
x 32 x 60
= 33,6065 g (33,8015 g)
Katalis kitosan
Diketahui :
m CPO : 11,5227 g Mr CPO : 843,4086 g/mol Mr metanol : 32 g/mol
m metanol =
x Mr metanol x 60
=
x 32 x 60
= 26,2312 g (26,4830 g)
Katalis kitosan-sulfat
Diketahui :
Mr metanol : 32 g/mol
m metanol =
x Mr metanol x 60
=
x 32 x 60
ΣA : 26933552
As : 18908494 Cs : 50,6 mg/5 mL Vs : 5 mL
m : 254,4 mg
Biodiesel (%) =
x
x 100%