Bab II Tinjauan Pustaka
II.1 Monasit
Monasit merupakan salah satu mineral berharga karena mengandung unsur LTJ dan unsur-unsur radioaktif seperti thorium dan uranium. Keberadaan pasir monasit cukup tersedia di Indonesia, terutama di pesisir pantai kepulauan Bangka, Belitung dan Singkep. Hal ini merupakan tantangan bagi peneliti Indonesia khususnya di bidang penelitian dasar untuk dapat mengusai dan meningkatkan teknik pemisahan dan pemurnian LTJ tersebut.
Di alam telah ditemukan lebih dari 200 jenis mineral yang mengandung LTJ (Kanazawa dan Kamitani, 2006). Mineral-mineral tersebut dikelompokkan menjadi beberapa jenis, tetapi sumber utama LTJ yang banyak dieksplorasi berasal dari lima jenis mineral saja, yaitu monasit, basnesit, senotim, loparit dan Longnan clay. Komposisi LTJ di dalam mineral-mineral tersebut di setiap daerah berbeda satu sama lainnya.
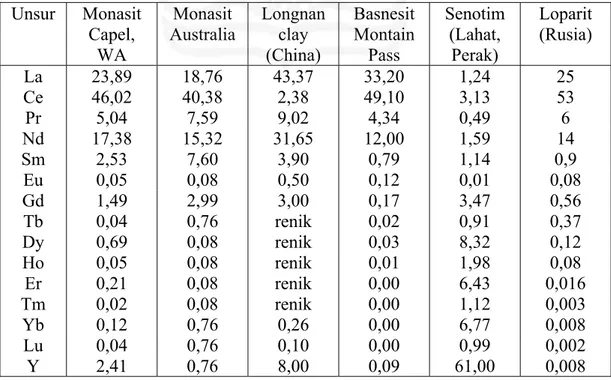
Tabel II.1. Komposisi (%) unsur LTJ dalam beberapa mineral (Harben dan Kuzvart, 1996) Unsur Monasit Capel, WA Monasit Australia Longnan clay (China) Basnesit Montain Pass Senotim (Lahat, Perak) Loparit (Rusia) La 23,89 18,76 43,37 33,20 1,24 25 Ce 46,02 40,38 2,38 49,10 3,13 53 Pr 5,04 7,59 9,02 4,34 0,49 6 Nd 17,38 15,32 31,65 12,00 1,59 14 Sm 2,53 7,60 3,90 0,79 1,14 0,9 Eu 0,05 0,08 0,50 0,12 0,01 0,08 Gd 1,49 2,99 3,00 0,17 3,47 0,56 Tb 0,04 0,76 renik 0,02 0,91 0,37 Dy 0,69 0,08 renik 0,03 8,32 0,12 Ho 0,05 0,08 renik 0,01 1,98 0,08 Er 0,21 0,08 renik 0,00 6,43 0,016 Tm 0,02 0,08 renik 0,00 1,12 0,003 Yb 0,12 0,76 0,26 0,00 6,77 0,008 Lu 0,04 0,76 0,10 0,00 0,99 0,002 Y 2,41 0,76 8,00 0,09 61,00 0,008
Tabel II.2. Pengelompokan mineral LTJ di alam (Kanazawa dan Kamitani, 2006)
Mineral Nama dan rumus kimia
Halida Fluocerite-(F), CeF3
Karbonat Basnaesite, (Ce,La)CO3)F
Ancylite, (Ce,Sr,Ca)(CO3)(OH,H2O)
Borat Braistschite, (Ca,Na2)7CeB22O43.7H2O
Oksida dan hidrat
Jenis AO2 Cerianite, (Ce,Th)O2
Jenis ABO3 Perovskite, (Ca,Ce,Na,Sr)(Ti,Nb,Ta)O3
Jenis ABO4 Fergusonite-Formanite, Y(Nb,Ta)O4-Y(Ta,Nb)O4
Jenis AB2(O,OH)6 Euxenite, (Y,Ca,Ce,U,Th)(Nb,Ta,Ti)2O6
Jenis A2BB2O6(O,OHF) Pyrochlorite, (Na,RE,K,U)2(Nb,Ta,Ti)2(O,OH,F)
Jenis lainnya Hibonite, (Ca,Ce)(Al,Ti,Mg)12O29
Fosfat, arsenat, vanadat Apatite, (Ca,RE,Sr,Na,K)3Ca2(PO4)3(F,OH)
Monazite, (Ce,La,Nd,Th)PO4
Xenotime, YPO4
Silikat Cerite,
(Ce,La,Ca)9(Fe3+,Mg)(SrO4)6[SiO3(OH)](OH)3
Garnet,
(Ca,Fe,Mg,Mn,Y)3(Al,Cr,Fe,Mn,Ti,V,Zr)2(Si,Al)3O12
Allanite, Ca(Ce,Y,Ca)Al(Al,Fe)(Fe,Al)(SiO4)3(OH)
Eudialyte, (Na,Ca,Ce)6(Zr,Fe)2Si7(O,OH,Cl)22
Gadolinite, (Y,Ce)2Fe2+Be2Si2O10
Kainosite, Ca2(Y,RE)2(Si4O12)CO3·H2O
Iimoriite, Y2(SiO4)(CO3)
China merupakan salah satu negara yang paling banyak memproduksi LTJ (± 90 %) yang berasal dari daerah Bayan Obo, yaitu mineral basnesit dan monasit. Beberapa negara lainnya yang juga penghasil LTJ, yaitu India, Malaysia, Srilanka, Amerika Serikat, Australia, Kanada, Afrika Selatan, dan Brazil. Mineral monasit, basnesit, Longnan clay dan loparit sebagian besar mengandung unsur La, Ce, Pr dan Nd, sedangkan senotim kaya akan unsur yttrium (Y).
II.2 Logam Tanah Jarang
Logam tanah jarang (LTJ) atau “Rare Earth Elements” (REE’s) terdiri atas 15 unsur dari golongan lantanida dengan nomor atom 57-71 yang berada dalam grup IIIA pada tabel periodik. Tiga unsur lainnya, yaitu skandium (Sc), yttrium (Y) dan thorium (Th) meskipun bukan dari golongan lantanida tetapi juga termasuk ke dalam kelompok LTJ, karena ketiga unsur tersebut selalu menyatu di dalam mineral yang sama dan memiliki sifat kimia dan fisika yang hampir sama. Adanya kemiripan sifat dari LTJ ini menyebabkan proses pemisahan masing-masing unsurnya sangat sulit dilakukan.
Sifat-sifat unsur lantanida secara umum adalah:
a) Ukuran jari-jari ion hampir sama akibat efek kontraksi lantanida.
b) Secara umum bilangan oksidasi lantanida 3+, kecuali Eu (2+ dan 3+) dan Ce (3+ dan 4+).
c) Bilangan koordinasinya > 6, biasanya 8,9 sampai 12.
Dengan metode ekstraksi pelarut, masing-masing unsur LTJ dapat dipisahkan dengan faktor pemisahan yang berbeda-beda, tetapi perbedaan faktor pemisahan terbesar terjadi antara Nd-Sm dan Gd-Tb. Berdasarkan faktor pemisahan tersebut maka unsur-unsur LTJ dikelompokkan menjadi 3 bagian, yaitu LTJ ringan (La, Ce, Pr, Nd), LTJ sedang (Sm, Eu, Gd) dan LTJ berat (Tb, Dy, Ho, Er, Tu, Yb, Lu, dan Sc, Y) (Morais dan Ciminelli, 2004).
II.2.1 Pemisahan Unsur LTJ
Unsur LTJ dapat dipisahkan dengan berbagai metode seperti: reaksi pengendapan, reaksi termal, kristalisasi berfraksi, ekstraksi pelarut dan resin penukar ion. Pemisahan unsur LTJ dengan metode ekstraksi pelarut memiliki beberapa keterbatasan dan keunggulan. Keterbatasan dari ekstraksi pelarut, yaitu prosesnya rumit (multi-tahap), waktu operasionalnya lama, kehilangan ekstraktan sulit dihindari dan banyak mengkonsumsi pelarut organik yang sebagian besar bersifat
racun. Sementara itu, metode ekstraksi pelarut memiliki beberapa keunggulan, yaitu banyak pilihan jenis ekstraktan komersial tersedia dipasaran dan bersifat selektif terhadap unsur tertentu. Resin penukar ion juga memiliki keterbatasan, yaitu laju transfer massa lambat sehingga waktu operasionalnya lama, tetapi selama proses pemisahan tidak mengalami kehilangan ekstraktan (Tavlaride dkk., 1987).
Pemisahan unsur LTJ dapat juga dilakukan dengan metode membran cair berpendukung (supported liquid membrane, SLM). Dari beberapa penelitian yang telah dilakukan ternyata faktor pemisahan LTJ yang diperoleh cenderung lebih baik dari pada metode ekstraksi pelarut dengan jenis ekstraktan yang sama seperti
TBP dan D2EHPA (Chitra dkk., 1997, Sulaeman, 2002). Meskipun faktor
pemisahan unsur LTJ dengan metode SLM lebih baik dibandingkan dengan metode ekstraksi pelarut, tetapi metode SLM ini belum dapat diaplikasikan pada skala industri, karena sulit dibuat untuk proses multi-tahap (Tavlaride dkk., 1987). Oleh karena itu, para ahli berusaha mencari metode pemisahan lainnya yang lebih baik dari beberapa metode sebelumnya. Salah satu metode baru yang dianggap lebih potensial dari pada ekstraksi pelarut dan resin penukar ion untuk diaplikasikan pada proses pemisahan, yaitu metode solvent impregnated resin (SIR) yang pertama sekali dikembangkan oleh Warshawsky (1974).
II.2.2 Kegunaan Unsur LTJ
Unsur-unsur LTJ telah banyak diaplikasikan dalam berbagai bidang industri berteknologi tinggi seperti industri optik, elektronik, magnetik, keramik, gelas, metalurgi dan katalis. Hingga saat ini penelitian tentang penggunaan unsur LTJ dalam berbagai bidang teknologi meningkat sangat pesat, diantaranya yaitu: katalis (Nakayama dan Yasuda, 2004), serat optik (Heo, 2003), bahan feromagnetik (Tsuchiya dkk., 2004), optoelektronik (Ma dkk., 2005), laser (Kato dkk., 2005), keramik (Baldacim dkk., 2004), superkonduktor (Chen dkk., 2006) dan transistor (Leskela dan Ritala, 2003).
II.3 Solvent Impregnated Resin (SIR)
SIR adalah metode pemisahan yang menggabungkan antara proses adsorpsi dan ekstraksi pelarut. Pemisahan ion-ion logam dengan metode SIR lebih mudah dilakukan dari pada metode ekstraksi pelarut dan lebih murah dibandingkan dengan resin pengkelat. SIR dibuat dengan cara mengamobilkan suatu larutan ekstraktan ke dalam resin polimer berpori-pori besar. Impregnasi resin tersebut lebih didasarkan pada interaksi Van der Waals antara ekstraktan dengan permukaan resin dibandingkan dengan ikatan kimia yang kuat seperti pada resin
pengkelat (Gonzalez dkk., 2001).
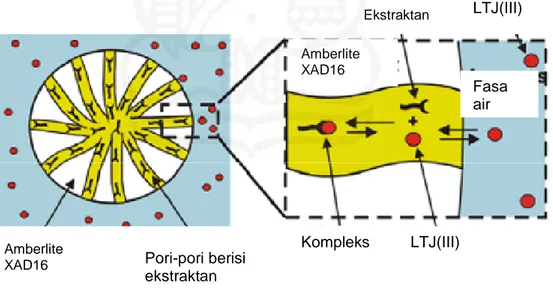
Konsep dari SIR (Gambar II.1) didasarkan kepada penggabungan (incorporation) suatu ekstraktan selektif ke dalam pori-pori partikel melalui impregnasi secara fisik. Ketika terjadi kontak dengan larutan air, ekstraktan membentuk senyawa komplek dengan ion-ion logam (solute). Ekstraktan dan senyawa kompleknya tertahan di dalam fasa resin karena kedua-duanya tidak larut dalam fasa air.
Amberlite XAD16 Fasa air Ekstraktan Amberlite XAD16 LTJ(III) Kompleks Pori-pori berisi ekstraktan LTJ(III)
Gambar II.1. Mekanisme adsorpsi ion-ion LTJ(III) dalam SIR (Babic dkk., 2006)
Faktor-faktor yang harus terpenuhi pada proses impregnasi diantaranya: (1) ekstraktan harus dapat larut dalam pelarut yang digunakan, (2) kelarutan
ekstraktan dalam fasa air sangat sedikit atau dapat diabaikan, (3) polimer pendukung (resin) harus dapat mengembang secara sempurna selama proses impregnasi dan stabil, (4) proses impregnasi tidak boleh merusak karakteristik ekstraktan dan polimer, (5) struktur polimer pendukung harus inert secara kimia, supaya tidak bereaksi dengan ekstraktan, dan (6) struktur polimer pendukung memiliki stabilitas mekanik yang baik (Mendoza dkk., 2000).
Dalam dekade ini, penelitian mengenai penggunaan metode SIR untuk proses pemisahan berkembang sangat pesat dan telah terbukti dapat diaplikasikan untuk proses pemisahan ion-ion logam seperti unsur-unsur transisi (Gonzalez dkk., 2001), unsur logam mulia (Saitoh dkk., 2005), unsur-unsur LTJ (Matsunaga dkk., 2001, Murakami dkk., 2005), pemisahan uranium-thorium (Metwally dkk., 2005). Selain itu metode SIR juga dapat digunakan untuk memisahkan senyawa-senyawa organik seperti asam amino (Ruiz dkk., 2004, Traving dan Bart, 2002).
Keterbatasan ataupun kendala yang mungkin terjadi pada metode SIR ketika proses ekstraksi berlangsung ialah stabilitas ekstraktan dalam pori-pori resin kadang-kadang kurang stabil. Untuk mengatasi masalah ini perlu diperhatikan kesesuaian antara sifat kimia dan sifat fisik dari ekstraktan dengan bahan polimer pendukung (resin) yang digunakan serta metode preparasi SIR (Alexandratos dan Smith, 2004).
II.3.1 Ekstraktan
Ekstraktan merupakan ligan yang berfungsi untuk mengekstraksi ion logam dari fasa air ke fasa organik atau ke fasa resin dalam bentuk senyawa kompleks. Keberhasilan suatu ekstraksi dipengaruhi oleh sifat basa ligan (ekstraktan) dan sifat asam ion logam yang akan diekstraksi. Berdasarkan prinsip Hard Soft Acid Base (Pearson, 1988), ligan basa keras membentuk kompleks lebih stabil bila bereaksi dengan ion logam yang bersifat asam keras seperti ion-ion LTJ(III). Oleh karena itu, ekstraktan komersial yang banyak digunakan pada pemisahan ion-ion logam seperti LTJ dengan metode ekstraksi pelarut pada umumnya bersifat basa
keras seperti D2EHPA, TBP (Kraikaew, 2001), 2-ethylhexyl hydrogen
2-ethylhexyl phosphonate (PC-88A) (Matsunaga dkk., 2001) dan 2-ethylhexyl 2-ethylhexylphosphonic acid (EHEHPA) (Sato, 1989), bis(2,4,4-trimethylpentyl)phosphinic acid (Cyanex-272) (Sun dkk., 2006).
II.3.2 Ligan D2EHPA dan TBP
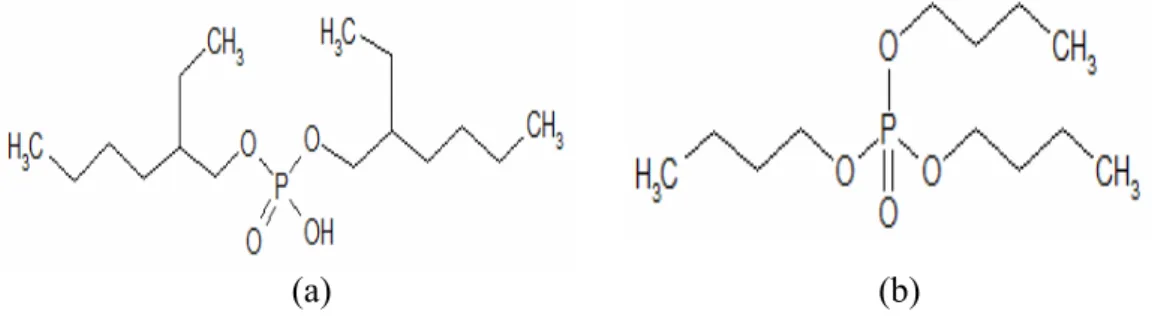
Senyawa D2EHPA dan TBP merupakan ligan yang berasal dari senyawa
organofosfor (Gambar II.2). Kedua ligan ini telah banyak dipakai sebagai ekstraktan untuk memisahkan unsur-unsur LTJ secara ekstraksi pelarut. Senyawa
D2EHPA di dalam pelarut non-polar (cyclohexane) berbentuk dimer akibat dari
adanya ikatan hidrogen antar molekul D2EHPA, sedangkan di dalam pelarut polar
(chloroform, dichloromethane dan 1,2-dichloroethane), molekul D2EHPA
berbentuk monomer (Zamani dan Yaftian, 2004). Oleh karena itu, ada dua
kemungkinan reaksi yang terjadi antara ion-ion LTJ(III) dengan D2EHPA pada
saat tercapai kesetimbangan, yaitu:
Ln3+ + 3 HL
)
(aq (org) ⇄ LnL3(org) + 3 H+(aq)... (1)
Ln3+ + 3 (HL)
)
(aq 2(org) ⇄ LnL3(HL)3(org) + 3 H+(aq)...(2)
Dimana Ln adalah lantanida, HL adalah D2EHPA, (aq) adalah fasa air dan (org)
adalah fasa organik.
Hasil ekstraksi menggunakan ekstraktan D2EHPA semakin meningkat dengan
meningkatnya nomor atom LTJ. Hal yang sama juga diperoleh bila D2EHPA
digunakan sebagai pengemban (carrier) untuk transpor ion-ion LTJ(III) dengan metode emulsi membran cair (Chitra dkk., 1997).
Senyawa D2EHPA merupakan asam lemah yang dapat terdistribusi dalam fasa
HL(aq) ⇄ HL(org) ; ) ( ) ( ] [ ] [ aq org D HL HL K = ... 3) 2 [HL](org) ⇄ [(HL)2](org); 2 ) ( ) ( 2 2 ] [ ] ) [( org org HL HL K = ... 4)
[HL](aq) ⇄ [H+](aq) + [L-](aq);
) ( ) ( ) ( ] [ ] [ ] [ aq aq aq a HL L H K − + = ... 5)
Tetapan kesetimbangan untuk distribusi molekul D2EHPA antara fasa resin
XAD2 dan fasa air pada Persamaan (3), Persamaan (4), dan Persamaan (5)
berturut-turut adalah log KD = 4,72; log K2 = -0,52 dan pKa = 2,90. Harga tetapan
kesetimbangan Ka untuk SIR D2EHPA-XAD2 identik dengan harga Ka pada
sistem ekstraksi pelarut, tetapi harga konstanta KD pada SIR D2EHPA-XAD2
lebih besar dibandingkan dengan harga KD pada ekstraksi pelarut. Hal ini
menunjukkan bahwa antara molekul D2EHPA dan molekul resin XAD2 terjadi
interaksi yang lebih kuat dibandingkan dengan interaksi D2EHPA dengan pelarut
organik pada sistem ekstraksi pelarut.
TBP merupakan ligan yang bersifat netral dan relatif kurang selektif untuk
pemisahan ion-ion logam dibandingkan dengan D2EHPA. Ekstraksi biasanya
dilakukan dalam suasana konsentrasi nitrat yang tinggi. Reaksi antara ion-ion LTJ(III) dengan molekul TBP seperti Persamaan (6) berikut.
Ln3+ + 3 NO + 3 TBP
)
(aq −3 aq( ) (org) ⇄ Ln(NO3)3(TBP)3(org) ... 6)
Apabila molekul D2EHPA dan TBP dicampurkan dengan perbandingan mol
tertentu, dapat menimbulkan efek sinergis pada pemisahan ion-ion LTJ(III) (Kraikaew, 2001).
(a) (b)
Gambar II.2. Struktur kimia senyawa (a) D2EHPA dan (b) TBP.
II.3.3 Bahan Polimer Pendukung
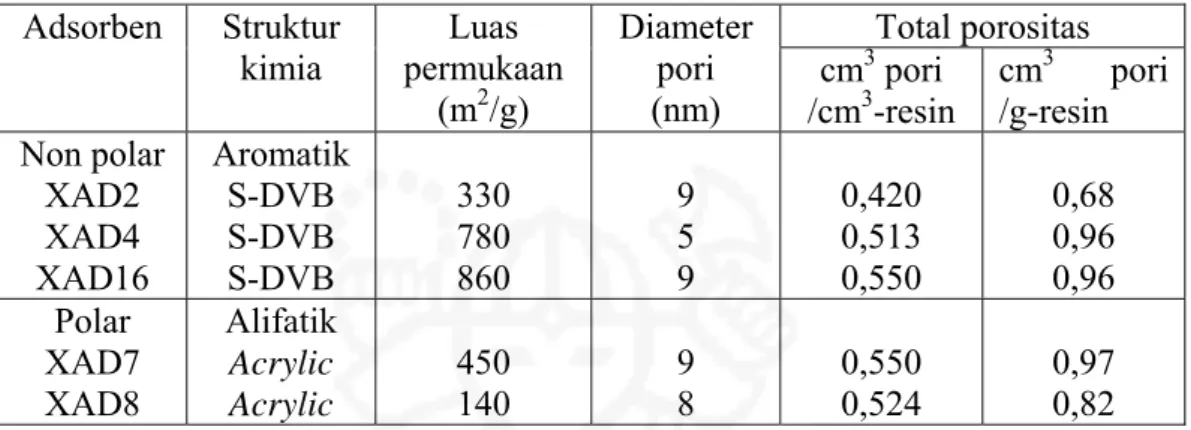
Salah satu resin polimer berpori besar (macroporous) komersial yang banyak digunakan sebagai bahan pendukung pada metode SIR untuk skala industri, yaitu Amberlite-XAD (Xu dkk., 2005). Resin Amberlite-XAD terdiri atas beberapa jenis (Tabel II.3), tetapi secara umum merupakan senyawa aromatik atau senyawa alifatik. Pada penelitian ini yang dijadikan sebagai polimer pendukung, yaitu Amberlite-XAD16 yang bersifat non-polar. Resin ini memiliki porositas, volume pori dan luas permukaan lebih besar dari Amberlite-XAD yang lainnya sehingga kapasitasnya untuk mengadsorpsi ekstraktan menjadi lebih besar (Merdivan dkk., 2001). Amberlite-XAD16 tersusun dari struktur polystyrene divinylbenzene (Gambar II.3), berupa butiran putih dengan ukuran antara 0,56-0,71 mm. Resin ini dapat mengembang (swelling) di dalam beberapa pelarut organik seperti metanol, 2-propanol, aseton dan p-xylene berturut-turut sebesar 15%, 15%, 20% dan 25% (Rohm and Haas Company, 2003).
Gambar II.3. Struktur kimia Amberlite-XAD16 (Rohm dan Haas Company, 2003).
Sifat non-polar dari Amberlite-XAD16 diharapkan dapat memperkuat ikatan (gaya) Van der Walls antara gugus styrene divinylbenzene (S-DVB) dari
Amberlite-XAD16 tersebut dengan gugus metil dari molekul D2EHPA dan TBP
yang digunakan, sehingga SIR yang dibuat lebih stabil dan dapat dipakai berulang-ulang.
Tabel II.3. Struktur dan karakteristik adsorben polimer Amberlite-XAD (Juang, 1999). Total porositas Adsorben Struktur kimia Luas permukaan (m2/g) Diameter pori (nm) cm 3 pori /cm3-resin cm3 pori /g-resin Non polar XAD2 XAD4 XAD16 Aromatik S-DVB S-DVB S-DVB 330 780 860 9 5 9 0,420 0,513 0,550 0,68 0,96 0,96 Polar XAD7 XAD8 Alifatik Acrylic Acrylic 450 140 9 8 0,550 0,524 0,97 0,82
II.4 Metode Preparasi SIR
Telah dikenal ada empat cara yang dapat digunakan untuk mengimpregnasikan ekstraktan ke dalam resin, yaitu metode kering, metode basah, metode adisi termodifikasi dan metode kolom dinamik (Juang, 1999).
II.4.1 Metode Kering
Pada metode ini ekstraktan mula-mula dilarutkan dengan pelarut organik yang sesuai, kemudian dicampurkan dengan resin sambil diaduk dengan kecepatan tertentu selama beberapa jam. Pelarut organik kemudian diuapkan secara lambat menggunakan vakum hingga resin menjadi kering. Metode ini biasanya digunakan untuk ekstraktan yang bersifat hidrofilik seperti amina, eter, keton, dan ester.
II.4.2 Metode Basah
Pada metode ini ekstraktan mula-mula dilarutkan dengan pelarut organik yang sesuai, kemudian dicampurkan dengan resin sambil diaduk dengan kecepatan tertentu selama beberapa jam. Selanjutnya resin disaring dan direndam atau dibilas dengan air. Setelah itu resin dikeringkan secara lambat menggunakan vakum hingga resin menjadi kering.
II.4.3 Metode Adisi Termodifikasi
Metode ini menggunakan suatu zat pemodifikasi seperti dibutilpolipropilen glikol yang berfungsi untuk menginisiasikan penetrasi air ke dalam polimer. Pelarutnya kemudian dievaporasi seperti pada metode kering. Metode ini adalah kombinasi dari metode basah dan metode kering.
II.4.4 Metode Kolom Dinamik
Seperti pada kromatografi pada umumnya, polimer dimasukkan ke dalam kolom setelah diimpregnasi dengan pelarut. Kemudian larutan ekstraktan dimasukkan ke dalam kolom. Konsentrasi ekstraktan yang keluar dari kolom harus sama dengan konsentrasi ekstraktan yang dimasukkan. Hasil impregnasi kemudian dicuci dengan air.
Efisiensi impregnasi ekstraktan ke dalam pori-pori resin tidak dipengaruhi oleh perbedaan ukuran butiran resin (Rovira dkk., 1998), tetapi berpengaruh terhadap kecepatan laju alir eluate yang keluar dari kolom. Oleh karena itu, pada penelitian ini, ukuran butiran resin yang digunakan terlebih dahulu dihomogenkan melalui pengayakan dengan ukuran antara 30 – 40 mesh.
II.5 Adsorpsi Ion-ion Logam dalam SIR
Distribusi konsentrasi ion-ion logam (D) antara fasa organik dan fasa air pada ekstraksi pelarut didefinisikan sebagai berikut:
e (org)
C C
D= ... 7)
Koefisien distribusi (D) pada proses adsorpsi menggunakan SIR dapat diekspresikan sebagai berikut:
m V C C D e e i ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − = ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ = C m V C C e SIR (L/g) atau (L/kg) ... 8) Kapasitas adsorpsi resin (q) terhadap ion-ion logam dihitung dengan persamaan
berikut: m V ) (C q= i −Ce (mg/g) atau (mol/kg) ... 9)
Dengan mensubstitusikan Persamaan (9) ke Persamaan (8) maka diperoleh Persamaan (10) berikut:
e
C q
D= (L/g) atau (L/kg) ... 10)
Persen adsorpsi (% Ads.) ion-ion logam yang teradsorpsi ke dalam resin dihitung berdasarkan Persamaan (11) berikut ini (Juang dan Chen, 1997).
( )
( )
100 D 1 D %Ads. x V m V m + = atau x100 D D %Ads. mV + = ... 11)Notasi Ci, CSIR dan Ce secara berturut-turut adalah konsentrasi (mg/L) atau
(mol/L) ion logam mula-mula, konsentrasi ion logam dalam fasa resin dan konsentrasi ion logam pada saat tercapai kesetimbangan dalam fasa air, V adalah volume larutan (L) dan m adalah berat resin kering (g) atau (kg).
II.5.1 Faktor Pemisahan
Faktor pemisahan (α) masing-masing unsur LTJ ditentukan berdasarkan perbandingan koefisien distribusi (D) antara satu unsur dengan unsur yang lainnya pada pH yang sama seperti Persamaan (12) berikut (Cortina dkk., 1995).
1 2 12 D D α = ... 12)
α12 adalah faktor pemisahan antara unsur 1 dan unsur 2, D1 adalah koefisien
distribusi unsur 1 dan D2 adalah koefisien distribusi unsur 2 yang diukur secara
terpisah pada kondisi yang sama. Semakin besar faktor pemisahan maka semakin mudah kedua unsur tersebut dapat dipisahkan.
II.5.2 Efek Sinergis
Ekstraksi sinergis unsur-unsur LTJ dengan cara mencampurkan ligan pengkelat dan ligan netral dengan perbandingan tertentu telah banyak dilakukan secara ekstraksi pelarut. Ligan pengkelat atau ligan netral komersial yang biasa digunakan, yaitu bis(2,4,4-trimethylpentyl)phosphinic acid (Cyanex 272), di(2-ethylhexyl)phosphoric acid (D2EHPA) dan 2-ethylhexyl-2-ethylhexylphosphonate
(EHEHPA), sedangkan ligan netral yang banyak digunakan, yaitu trioctylphosphin oxide (TOPO) dan tributylphosphate (TBP) (Sun dkk., 2006). Besarnya efek sinergis (β) yang dihasilkan dari kombinasi campuran ekstraktan didefinisikan seperti Persamaan (13) berikut (Cortina dkk., 1995).
2 1 12 D D D β + = ... 13)
D12 adalah koefisien distribusi ekstraksi yang menggunakan ekstraktan campuran
ligan 1 dan ligan 2, D1 adalah koefisien distribusi ekstraksi yang menggunakan
yang diukur secara terpisah pada kondisi yang sama. Campuran antara ligan
D2EHPA dan TBP dengan perbandingan mol (3:1) dapat menghasilkan efek
sinergis yang optimal pada pemisahan unsur-unsur LTJ secara membran cair berpendukung (Sulaeman, 2002), hal yang sama juga telah dibuktikan oleh Kraikaew (2001) dengan metode ekstraksi pelarut dalam pelarut kerosen, namun dengan metode solvent impregnated resin belum pernah dilaporkan. Jika harga β > 0 menunjukkan adanya efek sinergis dan jika harga β < 0 menunjukkan adanya efek antagonis.
II.6 Isoterm Adsorpsi
Isoterm adsorpsi adalah hubungan yang menunjukkan distribusi masing-masing ion logam (adsorbat) antara fasa cair-padat pada saat tercapai kesetimbangan. Untuk menjelaskan isoterm adsorpsi dapat digunakan hubungan matematik berdasarkan model isoterm Freundlich dan isoterm Langmuir.
II.6.1 Isoterm Freundlich
Isoterm Freundlich berdasarkan asumsi bahwa adsorben mempunyai permukaan yang heterogen dan masing-masing molekul mempunyai potensi penyerapan yang berbeda-beda. Persamaan matematika isoterm Freundlich bentuk non-linear (Persamaan 14) dan bentuk linear (Persamaan 15) dituliskan sebagai berikut (Raouf dan El-Kamash, 2006).
n 1 e f e K C q = ... 14)
qe = banyaknya ion logam yang teradsorpsi per unit massa adsorben (mg/g),
Ce = konsentrasi ion logam pada saat tercapai kesetimbangan dalam fasa ruah
(mg/L).
Kf = konstanta kapasitas adsorpsi relatif adsorben (mg/g)
log qe = 1n log Ce + log Kf ...15)
Jika konsentrasi ion logam pada saat tercapai kesetimbangan (Ce) dialurkan
sebagai ordinat dan konsentrasi ion logam (adsorbat) dalam adsorben (qe)
dialurkan sebagai absis pada koordinat logaritmik, akan diperoleh kemiringan
garis (slope) 1/n dan titik potong (intercept) log Kf. Dari isoterm ini, akan
diketahui kapasitas adsorben (resin) dalam menyerap ion logam.
II.6.2 Isoterm Langmuir
Isoterm Langmuir berdasarkan kepada asumsi bahwa: (i) adsorben mempunyai permukaan yang homogen dan hanya mengadsorpsi satu molekul adsorbat untuk setiap molekul adsorbennya, (ii) tidak ada interaksi antara molekul-molekul yang terserap, (iii) semua proses adsorpsi dilakukan dengan mekanisme yang sama, dan (iv) hanya terbentuk satu lapisan tunggal saat adsorpsi maksimum. Namun, biasanya asumsi-asumsi tersebut sulit diterapkan karena hal-hal berikut, yaitu selalu ada ketidaksempurnaan pada permukaan resin, molekul teradsorpsi tidak inert dan mekanisme adsorpsi pada molekul pertama sangat berbeda dengan mekanisme pada molekul terakhir yang teradsorpsi.
Persamaan matematika isoterm Langmuir bentuk non-linear (Persamaan 16) dan bentuk linear (Persamaan 17) dituliskan sebagai berikut (Raouf dan El-Kamash, 2006). e e e bC 1 QbC q + = ... 16)
qe = banyaknya logam yang teradsorpsi per unit massa adsorben (mg/g),
Ce = konsentrasi ion logam dalam larutan pada saat kesetimbangan (mg/L),
Q = kapasitas adsorpsi lapisan tunggal (mg/g) b = tetapan energi ikatan adsorpsi (L/mg)
e e e C Q 1 Qb 1 q C ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ = ... 17)
II.7 Kinetika Sorpsi LTJ dalam SIR
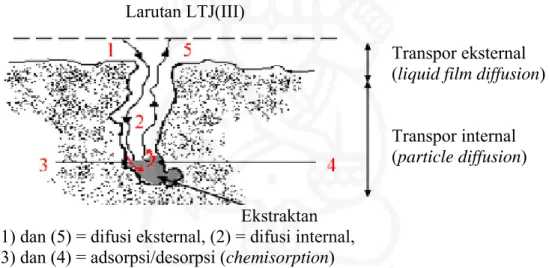
Proses adsorpsi ion-ion logam di dalam matriks SIR (resin) dapat terjadi melalui tiga cara : (1) transpor eksternal, yaitu difusi ion-ion melalui film cair (liquid film diffusion) di sekitar partikel resin, (2) transpor internal, yaitu difusi ion-ion melalui pori-pori matrik polimer resin (particle diffusion), dan (3) adsorpsi dan desorpsi melalui reaksi kimia antara ion-ion logam dengan gugus fungsional ekstraktan yang terimpregnasi pada matrik polimer resin (chemisorption).
Larutan LTJ(III)
Transpor eksternal (liquid film diffusion) Transpor internal (particle diffusion) Ekstraktan
(1) dan (5) = difusi eksternal, (2) = difusi internal, (3) dan (4) = adsorpsi/desorpsi (chemisorption)
Gambar II.4. Proses sorpsi ion-ion logam dalam SIR (Benamor dkk., 2008) Berdasarkan penelitian yang telah banyak dilaporkan, untuk sorpsi ion-ion logam menggunakan SIR, terjadi melalui reaksi kimia antara ion-ion logam dengan ekstraktan yang terimpregnasi di dalam pori-pori resin (Benamor dkk., 2008). Untuk membuktikan apakah sorpsi ion-ion LTJ(III) pada SIR yang mengandung
D2EHPA berlangsung secara kimia, maka dalam penelitian ini digunakan model
II.7.1 Reaksi orde pseudo-satu
Persamaan reaksi orde pseudo-satu Lagergren yang dipublikasikan pada 1898 didasarkan kepada kapasitas adsorben untuk sistem adsorpsi cair-padat. Secara matematika dapat diungkapkan sebagai berikut (Ho, 2004).
x) k(X dt
dx = −
... 18)
X = kapasitas adsorpsi pada saat kesetimbangan (mg/g). x = kapasitas adsorpsi pada waktu t (mg/g).
k = tetapan adsorpsi orde pseudo-satu (menit-1).
Bila Persamaan (18) diintegrasikan pada kondisi t = 0 ke t = t dan x = 0 ke x = x, akan diperoleh Persamaan (19) berikut ini:
kt ) x X X ln( = − ... 19) dan
(
1 e kt)
X x= − − ... 20)Persamaan (19) dapat diubah kebentuk linear, yaitu:
(
)
t 2,303 k log(X) x X log − = − ... 21)Bentuk persamaan reaksi orde pseudo-satu Lagergren yang paling umum digunakan, yaitu:
t 2,303 k ) log(q ) q log(q 1 e t e − = − ... 22)
k1 = tetapan laju adsorpsi orde pseudo-satu (menit-1),
qe = kapasitas adsorpsi pada saat kesetimbangan (mg/g),
qt = kapasitas adsorpsi pada waktu t (mg/g).
II.7.2 Reaksi orde pseudo-dua
Persamaan reaksi orde pseudo-dua Lagergren didasarkan kepada kapasitas sorpsi ion-ion logam pada saat tercapai kesetimbangan di permukaan fasa resin. Persamaan orde pseudo-dua ini diturunkan oleh Coleman (1956) berdasarkan reaksi antara ion Cu(II) dengan adsorben (peat) sebagai berikut (Ho dan McKay, 1999). 2P- + Cu2+⇄ CuP2 ... 23) atau 2HP + Cu2+⇄ CuP 2 + 2H+ ... 24) PP
- dan HP adalah sisi polar dari permukaan adsorben (peat).
Berdasarkan Persamaan (23) dan Persamaan (24), maka hukum laju kedua reaksi tersebut dituliskan sebagai berikut:
2 t 0 t k[(P) (P) ] dt d(P) − = ... 25) 2 t 0 t k[(HP) (HP) ] dt d(HP) − = ... 26)
(P)t dan (HP)t adalah jumlah sisi aktif sorben yang dapat ditempati pada waktu t.
(P)0 dan (HP)0 adalah jumlah sisi aktif sorben pada saat kesetimbangan.
Bila diasumsikan kapasitas adsorpsi adalah proporsional terhadap jumlah sisi aktif (gugus fungsional) dalam resin, maka hukum laju kinetika Lagergren dapat dituliskan sebagai berikut:
2 t e 2 t k (q q ) dt dq − = ... 27) t .d k ) q (q dq 2 2 t e t = − ... 28)
Bila Persamaan (28) diintegrasikan pada kondisi t = 0 ke t=t dan qt=0 ke qt=qt,
diperoleh: t k q 1 ) q (q 1 2 e t e + = − ... 29) Persamaan laju reaksi orde pseudo-dua Lagergren dapat disederhanakan menjadi bentuk linear (El-Sofany, 2008).
t e 2 e 2 t q 1 q k 1 q t = + ... 30)
k2 = tetapan laju adsorpsi orde pseudo-kedua (g/mg.menit),
qe = konsentrasi ion maksimum yang diadsorpsi pada saat kesetimbangan (mg/g),
qt = konsentrasi ion yang diadsorpsi pada waktu t (mg/g).
Bila kurva t/qt terhadap t menghasilkan persamaan garis lurus, maka dapat
orde pseudo-dua dan semua laju reaksi mengikuti proses sorpsi kimia (chemisorption).
Tabel II.4. Kinetika beberapa ion logam yang mengikuti model Lagergren
Sorben Ekstraktan Ion logam Model
XAD4 Aliquat 336 La(III), Gd(III) Orde dua (a)
Egy-sorb TBP U(VI), Th(IV) Orde satu (b)
XAD4 TDA U(VI), Th(IV),
Co(II) Orde satu
(c)
TVEX–PHOR - Pr(III), Ho(III),
Co(II)
Orde satu (d)
(a) El-Sofany (2008), (b) Raouf dan El-Kamash (2006), (c) Metwally dkk., (2005),