stUDI PENGGUNaaN PaNGKaL tUNas tEBU
(
Saccharum officinarum
L.)
IN-VITRO
sEBaGaI EKsPLaN
traNsfOrMasI DNa DENGaN VEKtOr
Agrobacterium tumefaciens
Muhammad Hazmi,* Iskandar,** sutiman Bambang sumitro,*** dan Bambang sugiharto****
*Mahasiswa S3 PPS Fakultas Pertanian Universitas Brawijaya dan ** Fakultas Pertanian Universitas Muhammadiyah Jember
***Fakultas MIPA Universitas Brawijaya
****Pusat Penelitian Biologi Molekuler dan Fakultas MIPA Universitas Jember e-mail: mhazmi.hazmi@gmail.com
ABSTRACT
The efficiency of sugarcane Agrobacterium-mediumted transformation is low due to the explant weakness. The in-vitro sugarcane shoot and sugarcane spindle leave are two prospectives of the genetic transformation explant resouces. The research objective was to compare the three type explants of sugarcane A. tumefaciens transformation method, that is in-vitro sugarcane basal shoot, the portion of spindle leaf, and spindle leaf calus. The in-vitro sugarcane shoot was induced by the sugarcane meristem apical in the Laminar Air Flow Cabinet. Three type explants were inoculed by A. tumefaciens strain EHA105::pCL4, GV3101::pCL4, and GV310::pCAMBIA. GUS gene driven by rice ubiquitin RUBQ2 (pCL4) or CaMV35S (pCAMBIA) promoters. The transient gus expression was observed by histochemical staining method. Histochemical observation of infected materials after co-cultivation showed that almost all of the infected materials partially exhibited blue color in the basal region. Shoot initiation of infected in-vitro basal shoot eksplant was faster than two others. This explant rapidly grow and multiplied in the selection medium, thus the method provided an excellent system for the transformation in sugarcane. The results suggest that in-vitro sugarcane basal shoot need further investigation to be used as target tissues for Agrobacterium-mediated transformation in sugarcane. To avoid the somaclonal variation, the transformation was conducted using in-vitro sugarcane basal shoot without intervening callus phase.
Key words: DNA transformation, Agrobacterium tumefaciens, rice ubiquitin promoter, CaMV35S promoter, in-vitro sugarcane basal shoot
PENGaNtar
Tebu (Saccharum officinarum L.) merupakan tanaman industri penting di dunia. Produksi gula Indonesia hampir seluruhnya berbahan dasar tebu dan lebih dari 60% gula dunia juga berbahan dasar tebu (Guimarces and Sobral, 1998). Perakitan varietas tebu berproduktivitas tinggi masih mengandalkan teknik pemuliaan konvensional, walaupun sering mengalami kesulitan karena sifat tebu yang berploidi tinggi, fertilitas rendah, genom besar dan interaksinya dengan lingkungan kompleks (Gallo-Meagher dan Irvine, 1996). Teknik lain sangat diperlukan untuk menciptakan varietas tebu berproduktivitas tinggi.
Perkembangan bioteknologi dan teknik kultur jaringan menawarkan transformasi gen untuk memperbaiki genetik tebu. Transformasi gen melalui Agrobacteriumtumefaciens
pada beberapa tanaman monokotil yang bukan inangnya telah berhasil, seperti padi, gandum, barley, dan jagung (Shrawat, 2007). Arencibia et al. (1998) membuat tebu transforman dengan A. tumefaciens sebagai vektornya. Metode ini tekniknya sederhana, tidak banyak mengubah genom tanaman target, jumlah salinan DNA-nya sedikit,
dan mampu mentransfer untaian DNA lebih panjang (Manickavasagam, et al., 2004), integrasi DNA ke dalam genom tanaman target lebih tepat dan tingkat stabilitas genetik tanaman transforman tinggi (Shrawat, 2007).
Efisiensi transformasi melalui A. tumefaciens pada tanaman tebu rendah. Keberhasilannya ditentukan oleh genotipe tanaman, jenis dan umur eksplan, strain A. tumefaciens, promoter, konsentrasi asetosiringon, pH, kerapatan sel bakteri, lama dan suhu kokultivasi, antibiotik penyeleksi, dan komposisi medium kultur (Rahmawati, 2006). Jenis eksplan berpeluang lebih besar menjadi penyebab rendahnya keberhasilan transformasi pada tebu dibanding faktor lain. Sejumlah besar peneliti melakukan transformasi gen melalui A. tumefaciens pada tanaman tebu menggunakan eksplan kalus atau melalui pengkalusan. Regenerasi tebu melalui kalus rentan terhadap variasi somaklonal (Nadar and Heinz, 1977). Induksi tunas tebu harus menghindari pengkalusan karena menimbulkan variasi somaklonal (Frison and Putter, 1993). Potongan gulungan daun muda tebu (spindle leaf) hanya 45% dari 100 eksplan membentuk kalus dan 73,3% dari kalus yang
terbentuk menghasilkan tunas albino (Miswar, 2007). Hasil yang sama dengan Miswar (2007) juga dilaporkan oleh �kviandari (2004) dan Setyati (2005). Penggunaan jenis eksplan baru dalam transformasi DNA dengan vektor A. tumefaciens pada tanaman tebu sangat diperlukan untuk menghindari variasi somaklonal.
Pada tulisan ini dilaporkan hasil penelitian penggunaan pangkal tunas tebu in-vitro yang diinisiasi dari tunas apikal sebagai eksplan transformasi gen gus yang dikendalikan oleh CaMV35S dan ubiquitin padi RUBQ2 (Liu et al., 2003).
BaHaN DaN Cara KErJa Bahan tanaman
Tunas apikal dan gulungan daun muda diisolasi dari pucuk tebu varietas BL di ruang aseptik (Laminar Air Flow Cabinet/LAFC). Pucuk tebu panjang 30 cm disterilkan dengan alkohol 70%. Gulungan pelepah daun dan daun muda dikelupas sampai terlihat tunas apikal. Tunas apikal, panjang 5 mm dan diameter 2 sampai 3 mm ditanam pada medium MS dengan agar 10 g/L, sukrosa 50 g/L, dan AgNo3 5 mg/L, dikultur 3 hari dalam gelap. Hari ke 4 dipindahkan ke ruang cahaya berintensitas 2000 lux, penyinaran 16 jam sehari, suhu 27oC. Setelah 4 hari di dalam terang, tunas apikal disubkultur ke medium MS 10 g/L agar, 50 g/L sukrosa, 0.1 ppm 6-benzylaminopurine (BA), dan 0.2 ppm kinetin. Induksi tunas selama 12 minggu disubkultur setiap 4 minggu ke medium baru.
Kalus diinduksi dari potongan gulungan daun muda, diameter 10 mm dan tinggi 5 mm. Kalus dipropagasi pada medium Murashige-Skoog (MS) ditambah 3 mg/L 2,4-D (MS1) dalam gelap, suhu 27° C, dan setiap 3 minggu disubkultur pada medium baru.
Persiapan Eksplan
Eksplan transformasi adalah pangkal tunas tebu
in-vitro, potongan gulungan daun muda, dan kalus dari gulungan daun muda. Eksplan pangkal tunas diisolasi dari tunas tebu in-vitro yang berukuran tinggi minimum 2 cm dan diameter pangkal tunas minimum 2 mm. Pangkal tunas tebu in-vitro untuk eksplan transformasi berukuran tinggi 3 mm dan diameter 2 sampai 3 mm.
Eskplan kedua adalah potongan gulungan daun muda. Pucuk tebu dikelupas sampai diperoleh gulungan daun muda, berwarna putih, diameter 1 cm, dan panjang 9 cm. Kemudian gulungan daun muda ini dipotong dengan panjang 5 mm.
Kalus disubkultur pada medium MS1 baru dan diinkubasi dengan kondisi yang sama dengan interval 3 minggu. Kalus embriogenik (EC) diperoleh dengan menyeleksi kalus dengan ciri-ciri nodular, kompak, dan menunjukkan warna kekuningan (Matsuoka et al., 2002).
transformasi Gen GUS Biakan inokulum
Transformasi gen gus dilakukan melalui A. tumefaciens
EHA105::pCL4 dan GV3101::pCL4, promoter rice ubiquitin
(RUBQ2) (Liu et al., 2003) dan GV3101::pCAMBIA, promoter CaMV35S (Toyobo Inc.). Koloni tunggal A. tumefaciens dibiakkan dalam 3 ml medium YEP cair dengan 50 mg/L kanamycin dan 100 mg/L rifamphicine, diinkubasi 48 jam dalam shaker, 150 rpm, suhu 28° C. Larutan starter 1 ml ditambahkan pada 50 ml YEP cair dengan 50 mg/L
kanamycin dan 100 mg/L rifamphicine, diinkubasi 8 sampai 10 jam dalam shaker 150 rpm, suhu 28° C. Diukur kerapatan optiknya (optical density/�D) pada panjang gelombang 600 nm. Biakan disentrifus 5000 rpm, 10 menit, 4° C. Pellet biakan dilarutkan dalam 2 ml MS cair dan digunakan sebagai inokulum pada �D600=1,0.
Inokulasi dan kokultivasi
Pangkal tunas tebu in-vitro dan kalus masing-masing 40 eksplan diinfeksi, 20 eksplan untuk uji gus setelah kokultivasi dan 20 lainnya dikultur. Potongan gulungan daun muda berjumlah 20 eksplan diinfeksi dan dikokultivasi. Eksplan dilukai dan dimasukkan ke dalam MS cair 50 ml yang berisi inokulum A. tumefaciens dengan �D(600)infeksi) = 1,0. Prakultur dilakukan 30 menit di shaker 150 rpm, 28° C. Kemudian larutan disaring, dikering anginkan di atas kertas saring steril dalam LAFC, ditanam pada medium MS padat dengan acetosyringone 100 ppm untuk eksplan pangkal tunas tebu in-vitro dan ditambah 3 mg/L 2,4-D untuk eksplan potongan gulungan daun muda dan kalus, dikokultivasi 3 hari di dalam gelap.
Eliminasi Agrobacterium dan seleksi ketahananeleksi ketahananketahanan terhadap antibiotik
Setelah kokultivasi, eksplan dicuci dengan MS cair ditambah 500 ppm cefotaxime, dibilas dengan aquabidest 3 kali. Dikering anginkan dalam LAFC dan dikultur pada medium MS padat dengan cefotaxime 500 ppm, 14 hari dalam cahaya 2000 lux, 16 jam penyinaran tiap hari untuk eksplan pangkal tunas tebu in-vitro, dan ditambah 3 mg/L 2,4-D untuk eksplan potongan gulungan daun muda dan kalus. Selanjutnya disubkultur ke medium MS padat dengan cefotaxime 500 ppm, geneticine 50 ppm (pCL4) atau
hygromicine 25 ppm (pCAMBIA) untuk seleksi ketahanan terhadap antibiotik selama 5 siklus, 14 hari tiap siklus.
Uji GUs
Uji gus dilakukan terhadap 20 eksplan pangkal tunas tebu in-vitro dan 20 kalus setelah dikokultivasi 3 hari dalam gelap, sesuai dengan prosedur histochemical oleh Jefferson et al. (1987) dengan beberapa perubahan. Sample dicuci satu kali dengan larutan buffer 0,1 M potassium phosphate, pH 7,0. Kemudian diinkubasi dalam larutan buffer 2% methanol, 0,3% Triton X-100, 0,5 mM potassium ferricyanide, 0,5 mM potassium ferrocyanide dan 0,5 mg/ mL 5-bromo-4-chloro-3-indolyl-�-D�-D-glucoronide, suhu 37oC, di shaker 85 rpm. Setelah 48 jam, sampel dicuci dengan ethanol 70%, dan diamati di bawah mikroskop terhadap ekspresi gen gus berupa spot berwarna biru di dalam jaringan eksplan.
HasIL
Induksi dan regenerasi tunas tebu
Eksplan tunas apikal tebu yang dikultur pada medium MS mampu membentuk tunas (Gambar 1). Tunas pada eksplan mulai terbentuk pada minggu ke-4 setelah kultur. Jumlah tunas apikal tebu varietas BL yang bertunas sekitar 60%. Tingkat inisiasi tunasnya sekitar 3 sampai 4 tunas per eksplan. Regenerasi tunas dilakukan setelah tunas berumur 70 sampai 90 hari setelah kultur (hsk). Tingkat regenerasi tunas sekitar 3 sampai 4 tunas per tunas (Tabel 1).
Gambar 1. Induksi tunas dari tunas apikal tebu secara in-vitro. A. (1) Pucuk tebu, (2) pucuk dengan gulungan daun muda, (3) tunas apikal pada pangkal pucuk tebu. B. Tunas apikal (G0) (Perbesaran 10 kali). C. Inisiasi tunas dari G0 pada medium MS. D. Tunas dari tunas apikal (G1) (42 hari setelah kultur/hsk). E. Tunas tebuTunas tebu in-vitro (G1) siap diregenerasi (70 sampai 90 hsk). F. Tunas tebu in-vitro hasil regenerasi awal (G2) G. Hasil multiplikasi tunas G2 (G3).
tabel 1. Induksi dan regenarasi tunas tebu varietas BL.
Induksi tunas Hasil
Tunas apikal bertunas (%) Inisiasi tunas (tunas/eksplan) Regenerasi (tunas/tunas)
60 ± 10 3,81 ± 0,32 3,64 ± 0,26 Keterangan: jumlah eksplan untuk inisiasi tunas adalah 30
(n = 30)
Eksplan transformasi
Tunas tebu in-vitro yang dijadikan sebagai sumber eksplan adalah tunas generasi ke 3 (Gambar 1G). Tunas tebu
in-vitro dengan tinggi lebih dari 2 cm, rata-rata diameter pangkal tunasnya sudah mencapai 2 mm, sehingga sudah dapat digunakan sebagai sumber eksplan transformasi (Gambar 2). Sebagai pembanding, transformasi juga dilakukan terhadap eksplan potongan gulungan daun muda dan kalus.
Gambar 2. Eksplan transformasi gen gus. A. Tebu in-vitro B. Batang tebu in-vitro. C. Pangkal batang tebu in-vitro. D. Potongan gulungan daun muda. E. Kalus.
Uji Gus dan regenerasi tunas
Secara keseluruhan ekspresi gen gus (Gambar 3) yang ditransformasi melalui strain A. tumrfaciens
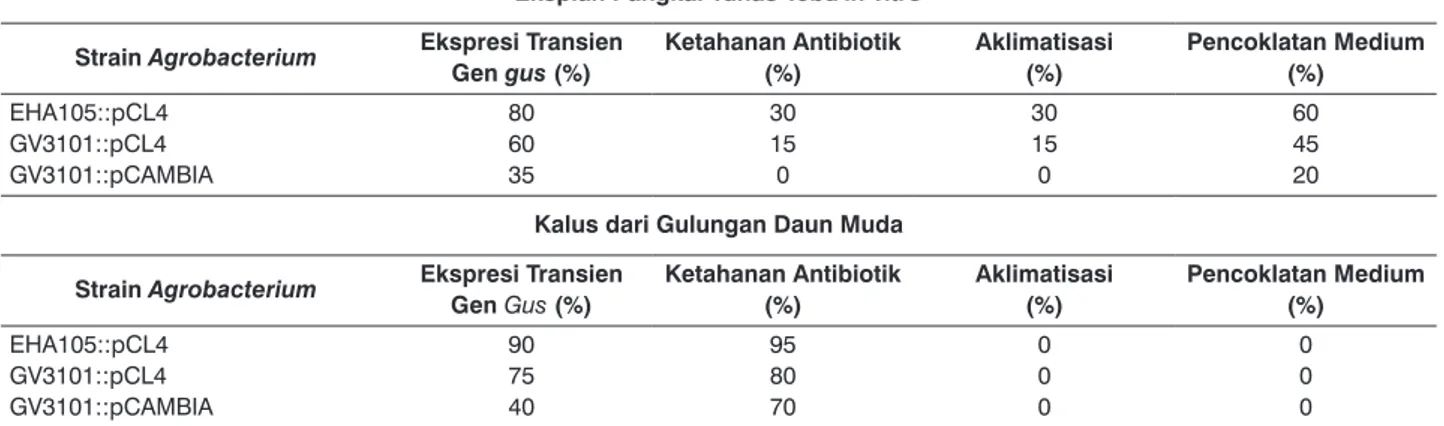
EHA105::pCL4, GV3101::pCL4, dan GV3101::pCAMBIA pada eksplan pangkal tunas tebu in-vitro lebih rendah dibandingkan dengan ekspresinya pada eksplan kalus (Tabel 2). Ekspresi gen gus pada pangkal tunas tebu in-vitro berturut-turut adalah 80, 60, dan 35%, sedangkan pada eksplan kalus, berturut-turut adalah 90, 75, dan 40%. Setelah ditransformasi gen gus, eksplan pangkal tunas tebu
in-vitro mampu beregenerasi menginisiasi tunas. Sedangkan eksplan kalus tidak mampu menginisiasi tunas meskipun
sudah melampaui 5 siklus seleksi ketahanan antibiotik (Gambar 4).
Gambar 3. Ekspresi transien gen gus (tanda panah) hasil transformasi melalui A. tumefaciens. A. Ekspresi gen gus pada eksplan pangkal tunas tebu in-vitro. B. Ekspresi gen gus pada eksplan kalus.
Gambar 4. Pengaruh jenis eksplan terhadap pertunasannya setelah ditransformasi gen gus melalui A. tumefaciens sebagai vektor. A. Pangkal tunas tebu in-vitro. B. Kalus. C. Potongan gulungan daun muda. D. Umur eksplan, hari setelah infeksi (hsi).
PEMBaHasaN
Inisasi tunas dari tunas apikal relatif mudah dilakukan. Tunas tebu in-vitro dapat diperoleh dalam jumlah banyak dalam waktu sekitar 12 minggu awal. Selanjutnya setiap
tabel 2. Hasil transformasi gen gus melalui A. tumefaciens pada eksplan pangkal tunas tebu in-vitro dan kalus gulungan daun muda tebu varietas BL.
Eksplan Pangkal tunas tebu in-vitro
strain Agrobacterium Ekspresi transien
Gen gus (%) Ketahanan antibiotik (%) aklimatisasi (%) Pencoklatan Medium (%) EHA105::pCL4 GV3101::pCL4 GV3101::pCAMBIA 80 60 35 30 15 0 30 15 0 60 45 20
Kalus dari Gulungan Daun Muda
strain Agrobacterium Ekspresi transien Gen Gus (%) Ketahanan antibiotik (%) aklimatisasi (%) Pencoklatan Medium (%)
EHA105::pCL4 GV3101::pCL4 GV3101::pCAMBIA 90 75 40 95 80 70 0 0 0 0 0 0
28 hari tunas tebu in-vitro dapat diproduksi secara berkala dan pangkal tunasnya dapat digunakan sebagai eksplan transformasi gen. Kultur in-vitro tunas selama 3 tahun tidak menimbulkan gejala albino pada tunas meskipun mengalami regenerasi berulang-ulang. Hasil ini menunjukkan bahwa variasi soma- klonal dapat dihindari sesuai dengan saran dari Nadar and Heinz (1977), demikian juda saran dari Frison and Putter (1993).
Uji gus menunjukkan bahwa gen gus yang dikendali oleh promoter RUBQ2 dan CaMV35S terekspresi pada eksplan pangkal tunas tebu in-vitro. Meskipun secara keseluruhan persentase ekspresinya lebih rendah bila dibandingkan dengan ekspresi gen gus pada eksplan kalus. Eksplan pangkal tunas tebu in-vitro memiliki prospek pertunasan lebih cepat dan lebih baik dari eksplan kalus dan potongan gulungan daun muda (Gambar 4).
Uji ketahanan terhadap antibiotik menunjukkan bahwa persentase ketahanan tunas dari eksplan pangkal tunas tebu in-vitro lebih rendah dari ketahanan eksplan kalus (Tabel 2). Ketahanan tersebut terjadi pada kondisi eksplan pangkal batang tunas tebu in-vitro sudah menginisiasi tunas, sedangkan potongan gulungan daun muda dan kalus masih dalam kondisi kalus (belum menginisiasi tunas). Jadi meskipun persentase ketahanan terhadap antibiotiknya lebih rendah, tetapi sudah berupa tunas, bahkan ada yang mampu tumbuh setelah melalui 5 siklus uji antibiotik dan dapat diaklimatisai. Meskipun sebagian besar planlet mengalami masalah pencoklatan pada pangkal planlet dan medium yang mungkin menyebabkan gangguan pada metabolismenya, sehingga sebagian planlet mati pada seleksi antibiotik.
Hasil penelitian ini mengisyaratkan bahwa eksplan pangkal tunas dari tunas tebu in-vitro lebih berpotensi dijadikan sebagai eksplan transformasi gen dengan A.
tumefaciens sebagai vektor daripada eksplan potongan gulungan daun muda dan kalus. Hasil ini sesuai dengan Setyati (2005) yang mengemukakan bahwa secara keseluruhan pengembangan metode transformasi menggunakan eksplan tanaman in-vitro ini perlu disempurnakan karena lebih sederhana, pertumbuhan eksplan lebih cepat, dapat mengurangi risiko variasi somaklonal.
UCaPaN tErIMa KasIH
Peneliti menyampaikan terima kasih kepada DP2M DIRJEN DIKTI DEPDIKNAS RI yang telah membiayai penelitian ini dan Pusat Penelitian Biologi Molekuler Universitas Jember yang telah memperkenankan peneliti menggunakan fasilitas yang diperlukan.
KEPUstaKaaN
Arencibia AD, Carmona ER, Tellez P, Chan MT, Yu SM, Trujillo LE, and �ramas P, 1998. An Efficient Protocol for Sugarcane (Saccharum spp. L.) Transformation Mediated by Agrobacterium tumefaciens. Transgenic Research 7: 213–222.
Frison EA and Putter CAJ (eds.), 1993. FAO/IBPGR Technical Guidelines for the Safe Movement of Sugarcane Germplasm. Food and Agriculture �rganization of the United Nations, Rome/International Board for Plant Genetic Resources, Rome. p. 45.
Gallo-Meagher M dan Irvine, 1996. Herbicide Resistant Sugarcane Containing the Bar Gene. Crop Scinces 36: 1367–1374. Guimarces CT and Sobral WS (1998). The Saccharum Complex:
Relation to �ther Pndropogoneae. Plant Breeding Review 16: 269–288.
Jefferson RA, Kavanagh TA, Bevan NW, 1987. GUS Fusions:GUS Fusions: b-glucuronidase as a Sensitive and Versatile Gene Fusion Marker in Higher Plants. EMBO Journal 6: 3901–3907
Liu D, SV �ard, and JH �ard, 2003. High Transgene Expression Levels in Sugarcane (Saccharum officinarum L.) Driven by the Rice Ubiquitin Promoter RUBQ2. Plant Science 165: 743–750.
Manickavasagam M, A Ganapathi, VR Anbazhagan, B Sudhakar, N Selvaraj, A Vasudevan, and S Kasthurirengan, 2004. Agrobacterium-mediated Genetic Transformation and Development of Herbicide-Resistant Sugarcane (Saccharum species hybrids) Using Axillary buds. Plant Cell Rep 23: 134–143.
Matsuoka M, Arifin S, Terauchi T, Tamura Y, Tanio M, Hayakawa A, Miwa H, 2002. Transformation of Sugarcane Cell mediated by Agrobacterium and Subsequent Shoot Regeneration. Japanese Journal of Tropical Agriculture 46: 11–12.
Miswar, 2007. Peningkatan Biosintesis Sukrosa Tanaman Tebu (Saccharum officinarum L.) Melalui Over Ekspresi Gen Sucrose Phosphate Synthase (SPS). Disertasi Doktor. Ilmu Bioteknologi, UGM Yogyakarta, Indonesia. pp. 119. Nadar HM and DJ Heinz, 1977. Root and Shoot Development from
Sugarcane Callus Tissue. Crop Science 17: 814–816. �kviandari P, 2004. Transformasi gen Sucrose Phosphate Synthase
pada Tanaman Tebu (Saccharum officinarum L.) dengan Bantuan Agrobacterium tumefaciens. Tesis. Program Pasca Sarjana. Universitas Jember. Jember, Indonesia. pp. 43. Setyati S, 2005. �ptimasi Transformasi Gen Sucrose Phosphate
Synthase pada Tanaman Tebu (Saccharum officinarum L.) dengan Bantuan Agrobacterium tumefaciens. Tesis. Program Pascasarjana. Universitas Jember. Jember, Indonesia. pp. 39.
Rahmawati S, 2006. Status Perkembangan Perbaikan Sifat Genetik Padi Menggunakan Transformasi Agrobacterium. Jurnal AgroBiogen 2(1): 36–44.
Shrawat AK, 2007. Genetic Transformation of Cereals Mediated by Agrobacterium: Potential and Problems. ISB News Report February 2007.