1 BAB I PENDAHULUAN
A. Latar Belakang
Peningkatan kecepatan disolusi merupakan salah satu masalah pokok dalam pengembangan produksi di industri farmasi untuk obat yang kelarutannya sangat kecil. Obat yang memiliki kecepatan disolusi yang rendah menjadikan kecepatan disolusinya sebagai langkah penentu dalam proses absorbsinya (Kaplan, 1973). Dengan meningkatkan kecepatan disolusi suatu bahan obat, maka kecepatan absorbsinya akan meningkat. Sudah banyak peneliti yang membuktikan adanya korelasi antara kecepatan disolusi dengan kecepatan absorbsi untuk obat yang memiliki sifat demikian (Shargel dkk, 2007).
Obat-obat oral yang memiliki tujuan sistemik harus dapat diabsorbsi dalam saluran pencernaan, kemudian baru melewati efek lintas pertama kemudian masuk dalam sirkulasi sistemik tubuh. Sebelum dapat diabsorbsi, obat-obat oral harus dapat terdisolusi dengan baik dalam cairan saluran pencernaan, terutama untuk obat-obat dalam bentuk partikel padat (Soemardi, 1999).
Obat-obat yang memiliki karakter disolusi yang kurang baik seringkali menjadi masalah tersendiri dan berpengaruh langsung pada jumlah kadar obat yang sampai di dalam sirkulasi sistemik. Hal ini menjadi permasalahan tersendiri dalam perkembangan obat, terutama obat-obat yang diharapkan dapat bereaksi dalam waktu singkat. Permasalahan ini dapat diatasi salah satunya dengan pembentukan
dispersi padat dengan menambah bahan pembawa yang mudah larut dalam air. Nifedipin merupakan obat anti-angina vasolidator, termasuk di golongan penghambat kanal kalsium, dan berkhasiat sebagai obat antihipertensi (tekanan darah tinggi) dan anti angina. Nifedipin berbentuk serbuk kristalin berwarna kuning, memiliki titik lebur pada 172oC-174oC. Nifedipin memiliki karakter yang praktis tidak larut dalam air, sukar larut dalam etanol, larut dalam aseton dan kloroform. Nifedipin memiliki koefisien partisi 2,2, yang menandakan permeabilitasnya cukup baik (Moffat dkk., 2011).
Dispersi padat hadir sebagai salah satu metode alternatif untuk meningkatkan kecepatan disolusi terutama untuk obat yang sukar larut dalam air. Metode dispersi padat pertama kali dikerjakan oleh Sekiguchi dan Obi. Metode dispersi padat waktu itu dikerjakan dengan cara membentuk campuran eutektik antara bahan obat dengan bahan pembawa yang sesuai dan memiliki sifat mudah menguap. Kemudiaan diikuti dengan penguapan bahan pembawa secara cepat (Chiou dan Riegelman, 1971).
Untuk tujuan di atas, pada penelitian ini dilakukan percobaan untuk mengetahui karakter fisik dari nifedipin khususnya pada kecepatan disolusinya setelah dimodifikasi partikelnya dengan menggunakan metode dispersi padat. Dispersi padat nifedipin dibuat dengan menggunakan metode kopresipitasi. Hasil dispersi padat kemudian dibuat dalam bentuk pellet untuk selanjutnya diuji kecepatan disolusinya.
Disolusi intrinsik merupakan salah satu teknik uji disolusi in vitro yang digunakan khususnya pada pengembangan zat aktif pada tahap preformulasi. Hal
ini disebabkan disolusi intrinsik hanya membutuhkan jumlah sampel yang sedikit. Selain itu, dari hasil uji disolusi, diharapkan dapat memberi gambaran kepada peneliti mengenai masalah apa yang mungkin muncul pada pengembangan zat aktif tersebut (Issa dan Ferraz, 2011).
Hasil uji disolusi kemudian diungkapkan dengan melakukan plotting hubungan bobot solid terlarut persatuan luas terhadap fungsi waktu dan hubungan 𝑙𝑛 𝑤∞
(𝑤∞−𝑤) dari persamaan Kitazawa terhadap fungsi waktu. Plotting kurva ini
didasarkan pada persamaan yang diturunkan dari persamaan Noyes-Whitney. Melalui kedua kurva ini, akan didapatkan harga slope yaitu tetapan kecepatan disolusi intrinsik (G) dan tetapan kecepatan disolusi k dari persamaan Kitazawa. Dengan membandingkan harga G dan harga k maka akan didapatkan informasi apakah sistem dispersi padat nifedipin-PVP K-30 dapat meningkatkan kecepatan disolusi atau tidak.
Hasil penelitian ini diharapkan dapat memberikan kontribusi pada pengembangan dan pengaplikasian pembuatan dispersi padat khususnya pada obat-obat yang memiliki karakter disolusi yang buruk. Sekaligus dapat memberikan sumbangsih bagi kemajuan ilmu pengetahuan di bidang teknologi kefarmasian dan peningkatan aspek klinis dari nifedipin.
B. Rumusan Masalah
1. Apakah pembentukan dispersi padat nifedipin dan polovinil pirolidon K-30 dengan metode kopresipitasi dapat meningkatkan kecepatan disolusi dari nifedipin murni?
2. Apakah peningkatan konsentrasi polivinil pirolidon K-30 dalam dispersi padat nifedipin-polivinil pirolidon K-30 dapat meningkatkan kecepatan disolusi dispersi padat nifedipin-polivinil pirolidon K-30?
C. Pentingnya Penelitian Diusulkan 1. Bagi Ilmu Pengetahuan
Penelitian ini dapat membuktikan bahwa sistem dispersi padat dapat meningkatkan kecepatan disolusi nifedipin. Melalui dispersi padat, kecepatan disolusi nifedipin akan meningkatkan efektifitas nifedipin sebagai sediaan oral. 2. Bagi Peneliti
Melalui penelitian ini, peneliti dapat menerapkan teori dalam kenyataan penelitan dengan mengaplikasikan sistem dispersi padat pada nifedipin. Selain itu penelitian ini dilakukan sebagai salah satu syarat meraih gelar strata satu bagi peneliti.
3. Bagi Masyarakat
Sistem dispersi padat yang diaplikasikan pada bentuk sediaan nifedipin akan sangat membantu masyarakat yang akan mengkonsumsi nifedipin. Hal ini dikarenakan dengan profil disolusi yang lebih baik, akan meningkatkan efektifitas penggunaan bentuk sediaan nifedipin.
D. Tujuan Penelitian
1. Membuktikan bahwa pembentukan dispersi padat nifedipin-polivinil pirolidon K-30 dengan metode kopresipitasi dapat meningkatkan kecepatan disolusi nifedipin secara signifikan bila dibandingkan dengan kecepatan disolusi nifedipin murni.
2. Membuktikan bahwa peningkatan konsentrasi polivinil pirolidon K-30 dalam dispersi padat nifedipin-polivinil pirolidon K-30 akan meningkatkan kecepatan disolusi dispersi padat nifedipin-polivinil pirolidon K-30.
E. Tinjauan Pustaka 1. Disolusi Obat
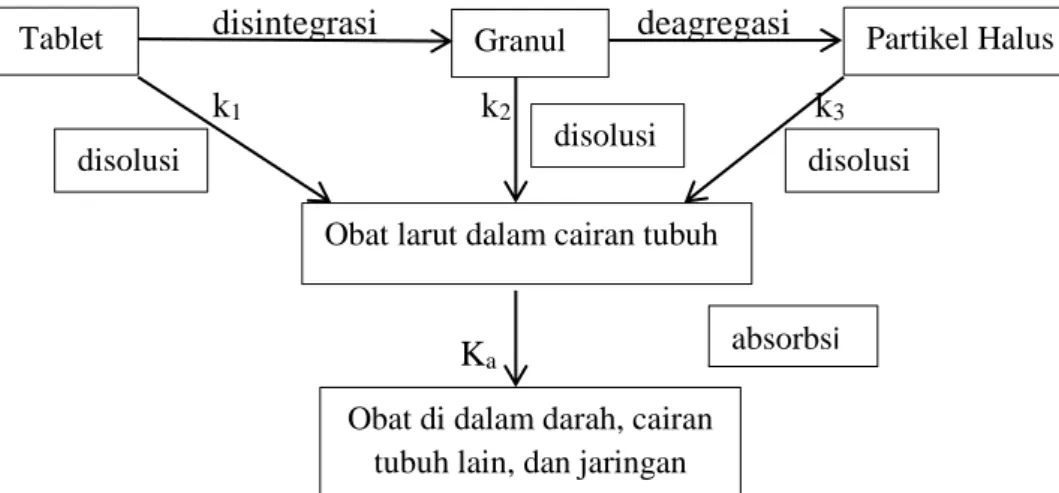
Pada umumnya produk obat mengalami absorbsi sistemik melalui suatu rangkaian proses liberasi, disolusi dan absorbsi. Secara skematis proses tersebut ditunjukan pada gambar 1.
disintegrasi deagregasi
k1 k2 k3
Ka
Gambar 1. Skema disintegrasi dan disolusi (Wagner, 1971).
Tablet Granul Partikel Halus
Obat larut dalam cairan tubuh
disolusi
Obat di dalam darah, cairan tubuh lain, dan jaringan
absorbsi disolusi
Obat dalam bentuk tablet ketika digunakan secara per oral akan masuk ke dalam saluran pencernaan dan mengalami kontak dengan medium. Tablet kemudian akan terdisintegrasi menjadi granul-granul. Granul-granul ini kemudian akan terdeagregasi menjadi partikel halus. Tablet, granul, dan partikel halus masing-masing akan terdisolusi dengan kecepatan tertentu. Di sini dinyatakan dalam k1, k2, dan k3. Dalam hal ini k1<<k2<<k3 karena perbedaan luas permukaan efektifnya.
Setelah terdisolusi, obat akan berada dalam bentuk larutan yang terdisolusi dalam cairan tubuh (di dalam saluran pencernaan). Kemudian obat akan terabsorpsi dengan tetapan kecepatan absorpsi (Ka). Apabila ka>>>k1+k2+k3, maka kecepatan disolusi obat tersebut menjadi langkah penentu dalam proses absorpsinya (Gibaldi dan Feldman, 1970).
Mekanisme masuknya obat ke dalam saluran sistemik adalah melalui mekanisme difusi pasif. Mekanisme difusi pasif memiliki karakteristik dimana kecepatan absorpsi sebanding dengam gradien kadar yang ada. Apabila obat yang berada di dalam tubuh kita dapat mencapai sirkulasi sistemik dengan cepat, maka otomatis kadar obat dalam sirkulasi sistemik akan cepat mencapai jendela terapi dan efek obat akan semakin cepat tercapai. Kecepatan absorpsi obat juga turut berperan pada efektifitas obat dalam mencapai efek yang diinginkan. Apabila suatu obat memiliki kecepatan eliminasi yang tinggi, bahkan lebih tinggi daripada kecepatan absorpsinya, maka akan mengakibatkan kadar obat dalam darah tidak dapat mencapai kadar optimum. Selain itu, apabila kadar obat tidak dapat mencapai
KEM, maka obat tersebut tidak akan memberikan efek seperti yang kita kehendaki (Shargel dkk, 2007).
Karakter kecepatan disolusi dari suatu active pharmaceutical ingredient (API) dari suatu bentuk sediaan sangat tergantung dari kelarutannya (Ali, 2005). Hampir 40% dari API dan new chemical entity (NCE) memiliki kelarutan dalam air yang buruk dan mengakibatkan kecepatan disolusi bentuk sediaan yang buruk. Kondisi ini mengakibatkan waktu absorpsi yang dibutuhkan oleh bahan obat menjadi lebih lama (Kavitha dkk, 2011). Mengacu pada data tersebut, kecepatan disolusi yang buruk merupakan masalah yang umum dihadapi dalam formulasi bentuk sediaan. Berbagai strategi telah dilakukan oleh banyak peneliti untuk mengatasi masalah ini, seperti: sintesis bentuk garam, pengecilan ukuran partikel, kompleksasi, dispersi padat, spray dry, dan mikroenkapsulasi (Kumar dkk, 2010).
Uji disolusi biasanya dilaksanakan di industri farmasi. Pelaksanaan uji disolusi, disesuaikan dengan tujuan uji itu sendiri. Tujuan pertama dari uji disolusi adalah untuk optimasi formula. Uji ini dilakukan di bagian Riset dan Pengembangan dan bertujuan untuk memperoleh suatu formula obat yang paling baik. Tujuan lainnya adalah untuk kontrol rutin setelah fabrikasi. Uji ini dilakukan di bagian Kontrol Kualitas dan bertujuan untuk jaminan kesamaan kualitas produksi antar bets dan jaminan kualitas ketersediaan farmasetis secara in-vivo (Fudholi, 2013).
2. Teori Disolusi
Kecepatan disolusi bisa didefinisikan sebagai kecepatan melarut suatu obat dari sediaan farmasi, granul, atau partikel halus sebagai hasil terdisintegrasinya
bentuk sediaan farmasi obat tersebut setelah terjadi kontak fisik dengan pelarut (Carstensen, 1974).
Noyes dan Whitney telah merumuskan suatu persamaan yang dapat menyatakan hubungan antara kecepatan disolusi dengan kadar obat dalam persamaan (1) (Wagner, 1971):
𝑑𝐶
𝑑𝑡 = 𝑘(𝐶𝑠 − 𝐶𝑏)...(1)
dimana dC/dt adalah kecepatan disolusi suatu bahan obat, k adalah tetapan kecepatan disolusi, Cs adalah kelarutan jenuh obat dalam medium, sedangkan Cb adalah kadar obat terlarut dalam medium pelarut pada waktu tertentu (t). Dari persamaan Noyes-Whitney di atas dapat ditarik suatu kesimpulan bahwa yang paling berperan dalam menentukan kecepatan disolusi suatu obat adalah kelarutan bahan obat tersebut dalam medium disolusi.
Terdapat tiga macam teori disolusi. Teori ini adalah teori film, teori pembaharuan permukaan, dan teori kecepatan solvatasi terbatas (Carstensen, 1974). Pada ketiga teori di atas, ada dua faktor yang dapat dikembangkan dalam memformulasikan suatu obat supaya dapat memperbaiki karakter disolusinya. Kedua faktor ini adalah luas permukaan efektif obat dan kelarutan bahan obat. Meningkatkan luas permukaan efektif obat dan meningkatkan kelarutan bahan obat dapat memperbaiki karakter disolusi obat tersebut.
Ada beberapa metode yang dapat kita lakukan dalam hal meningkatkan luas permukaan efektif bahan obat. Beberapa metode ini adalah pengecilan ukuran partikel bahan obat, pemberian surfaktan untuk mempercepat pembasahan (Finholt, 1974), dan pembentukan dispersi padat (Goldberg dkk, 1965).
Luas permuakaan efektif berbanding langsung dan proporsional dengan kecepatan disolusi. Luas permukaan efektif dapat ditingkatkan dengan menurunkan ukuran partikel dari obat atau dengan mengoptimasi karakteristik pembasahan. Reduksi ukuran partikel, pembentukan garam, kompleksasi, dan solubilisasi obat dalam solven juga berguna untuk meningkatkan disolusi, akan tetapi ada beberapa batasan untuk teknik-teknik di atas. Penggunaan obat dalam keadaan perut penuh (setelah makan) juga bisa menjadi salah satu pilihan untuk meningkatkan kecepatan disolusi dengan meningkatkan waktu yg dibutuhkan untuk disolusi itu sendiri (Patil dkk, 2011).
3. Disolusi Intrinsik
Disolusi intrinsik merupakan salah satu cara pengungkapan data uji disolusi yang digunakan untuk menguji kecepatan disolusi zat aktif murni atau pengembangan dari zat aktif murni. Karena hanya dibutuhkan jumlah yang sedikit, sangat memungkinkan untuk melakukan penghitungan disolusi intrinsik dan memprediksi problem disolusi yang mungkin terjadi (Issa dan Ferraz, 2011).
Kecepatan disolusi intrinsik didefinisikan sebagai kecepatan disolusi zat aktif murni persatuan luas permukaan kontak. Dengan mengetahui kecepatan disolusi intrinsik, kita dapat mengetahui secara lebih dalam mengenai bagaimana kecepatan disolusi suatu obat dalam kondisi fisiologis (Hadžiabdić dkk, 2013).
Kecepatan disolusi intrinsik dapat diperoleh dengan menggunakan peralatan tertentu yang telah didesain sedemikian rupa (disesuaikan dengan kondisi fisiologis yang diinginkan). Bahan obat dikempa hingga berbentuk pellet, lalu dimasukan ke dalam die. Selanjutnya pellet obat dicelupkan ke dalam larutan
medium dengan luas area kontak yang konstan. Nilai kecepatan disolusi intrinsik dinyatakan dalam mg cm-2 s-1 (Anonim, 2009; Viegas dkk, 2001)..
4. Dispersi Padat
Metode dispersi padat pertama kali dikerjakan oleh Sekiguchi dan Obi. Metode ini memiliki tujuan untuk meningkatkan kecepatan disolusi dan absorpsi suatu obat yang sukar larut dalam air. Metode dispersi padat waktu itu dikerjakan dengan cara membentuk campuran eutektik antara bahan obat dengan bahan pembawa yang sesuai dan memiliki sifat mudah menguap. Kemudiaan diikuti dengan penguapan bahan pembawa secara cepat (Chiou dan Riegelman, 1971).
Dispersi padat merupakan suatu campuran dari satu atau lebih bahan obat dalam suatu bahan pembawa yang inert atau berupa matriks padat. Dalam perkembangannya, metode pembuatan dispersi padat dapat dibagi-bagi menjadi beberapa metode, yaitu dilakukan dengan metode peleburan, metode pelarutan, metode pelarutan-peleburan, serta metode campuran fisik (Chiou dan Riegelman, 1971).
Pionir dalam bidang dispersi padat adalah Sekiguchi dan Obi, dimana kedua peneliti ini menggunakan metode peleburan atau dalam istilah asing disebut sebagai
melt/fusion method. Metode ini dikerjakan dengan memanaskan campuran fisik dari
obat dan bahan pembawa secara langsung hingga terjadi. Campuran yang terlebur ini kemudian disolidifikasi menggunakan penangas es. Massa yang telah dingin kemudian diiris dan diayak. Produk-produk yang telah diadministrasikan terbukti meningkatkan absorpsi obat. Hingga kini, masih banyak sekali variasi-variasi yang dikembangkan untuk memperbaiki metode ini (Parikh, 2005).
Tachibana dan Nakamura memperkenalkan konsep preparasi dispersi padat dengan menggunakan metode pelarutan. Metode yang diusulkan meliputi pelarutan obat dan bahan pembawa di dalam suatu solven dan diikuti evaporasi dari solven tersebut dalam kondisi vakum. Dispersi padat yang dihasilkan dari metode ini secara umum disebut sebagai koevaporat (coevaporates) (Parikh, 2005).
Metode pelarutan termasuk dalam salah satu metode pembuatan sistem dispersi padat telah umum dilakukan. Pada metode ini, dekomposisi termal (penguapan, oksidasi, dan degradasi zat aktif) bahan obat dan bahan pembawa dapat dicegah karena metode ini menggunakan pelarut organik dengan temperatur penguapan yang relatif rendah. Akan tetapi, metode ini juga memiliki beberapa kelemahan yaitu kemungkinan pelarut memengaruhi stabilitas kimia bahan obat, sulit untuk menguapkan pelarut secara sempurna, pemilihan pelarut yang sesuai dan adanya kemungkinan pelarut memengaruhi stabilitas bahan obat (Fudholi, 2013).
Metode peleburan-pelarutan merupakan metode campuran/gabungan dari metode peleburan dan metode pelarutan. Bahan obat dilarutkan dalam pelarut organik yang sesuai dan digabungkan secara langsung dalam bahan pembawa yang telah dileburkan. Kemudian pelarut organik tersebut dievaporasi (Parikh, 2005).
Setidaknya sudah ada tiga macam teknik pembuatan dispersi padat yang telah sukses digunakan dalam produksi komersil. Metode-metode ini adalah metode
melt extrusion, yang dapat digunakan pada obat-obat dengan titil leleh yang tidak
terlalu tinggi, spray drying, yang berguna untuk obat-obat yang larut setidaknya pada satu solven yang mudah menguap, dan kopresipitasi, yang berguna untuk obat
dengan titik leleh yang tinggi dan memiliki solubilitas yang rendah pada solven organik yang umum (Huang dan Dai, 2014).
Kesuksesan dari suatu sistem dispersi padat ditentukan dari kemampuannya untuk terdisolusi setelah administrasi secara per oral. Untuk dispersi padat, obat harus terdisolusi bersamaan dengan matriks polimer untuk menghasilkan sebuah campuran supersaturasi. Keadaan supersaturasi harus bisa dipertahankan cukup lama supaya proses absorpsi obat bisa berjalan (Huang dan Dai, 2014).
Ketika suatu sistem dispersi padat drug loading-nya rendah, obat dan polimer dalam sistem dispersi padat dapat terdisolusi secara cepat. Setelah itu, obat dapat diabsorpsi secara kontinyu dan mengalami presipitasi karena kehadiran polimer dan komponen endogen seperti empedu, fosfolipid, dan mucin. Berbagai macam bentuk struktur bisa terbentuk, seperti obat bebas atau obat terdapat di dalam empedu/misel fosfolipid, nanoprecipitate amorf, atau nanocrystal yang distabilkan oleh polimer. Bentuk-bentuk nanopartikel tersebut memiliki kelarutan yang tinggi. Dengan pemilihan polimer yang tepat, konsentrasi obat bebas bisa dibuat dengan menyesuaikan kelarutannya (Friesen dkk, 2008).
Sistem dispersi padat menghasilkan suatu larutan obat pada kondisi supersaturasi ketika ada di dalam lingkungan cair pada jalur gastrointestinal. Obat pada kondisi ini memiliki tendensi untuk terpresipitasi secara cepat sebelum diabsorbsi dan mengakibatkan bioavailabilitasnya rendah. Banyak macam polimer yang telah diteliti untuk memperpanjang kondisi supersaturasi dan menghambat presipitasi obat. Untungnya, polimer yang biasanya digunakan dalam formulasi dispersi padat juga dapat digunakan untuk menghambat presipitasi obat, khususnya
derivat selulosa seperti hidroksipropilmetilselulosa (HPMC) dan polimer vinil seperti polivinil pirolidon (PVP). (Huang dan Dai, 2014)
Interaksi antara polimer dan bahan obat kemungkinan disebabkan karena formasi ikatan hidrogen dan/atau interaksi hidrofobik (Huang dan Dai, 2014). Selain itu, dalam penelitian sebelumnya telah ditunjukkan bahwa semakin tinggi lipofilisitas suatu polimer akan meningkatkan pula kekutan interaksi antara polimer dan bahan obat. Tetapi, ada suatu batasan dimana lipofilisitas polimer tidak lagi berpengaruh pada interaksi antara polimer dan bahan obat (Ilevbare dkk, 2012).
Kecepatan disolusi suatu obat yang meningkat karena sistem dispersi padat terjadi melalui 2 mekanisme, yaitu mekanisme penarikan (dragging mechanism) dan mekanisme pembasahan (wetting mechanism). Polimer bahan pembawa yang lebih mudah larut dalam medium akan berinteraksi dengan bahan obat dan mengelilingi bahan obat dalam medium. Setelah sistem kontak dengan medium, polimer bahan pembawa akan terlarut secara cepat dengan membawa serta (menarik) bahan obat. Peristiwa inilah yang disebut sebagai mekanisme penarikan. Selain mekanisme ini,ada pula kemungkinan terjadinya mekanisme pembasahan. Mekanisme pembasahan terjadi setelah interaksi terjadi antara bahan obat dan polimer bahan pembawa. Senyawa hasil interaksi tersebut akan membentuk suatu ikatan hidrogen dan/atau ikatan van der Waals dengan medium dalam larutan yang menyebabkan senyawa tersebut melarut di dalam medium (Moechtar, 1992).
Mekanisme penarikan dan mekanisme pembasahan bisa terjadi secara tunggal dan/atau sinergis tergantung pada interaksi yang terjadi antara polimer bahan pembawa dan bahan obat. Contohnya pada PVP yang mengandung 2 unsur
yang dapat mengadakan ikatan hidrogen (Nitrogen dan Oksigen) dan 3 unsur yang dapat mengadakan ikatan van der Waals (C3, C4, dan C5). Hal ini memungkinkan terjadinya mekanisme penarikan dan mekanisme pembasahan yang bekerja sinergis. Contoh lain pada PEG yang hanya memiliki 1 unsur yang dapat mengadakan ikatan hidrogen (oksigen) dan tidak memiliki unsur yang dapat menyebabkan ikatan van der Waals. Hal ini mengakibatkan mekanisme pembasahan tidak dapat terjadi secara maksimal (Moechtar, 1992).
5. Kopresipitasi
Kopresipitasi termasuk salah satu metode pembuatan sistem dispersi zat padat di dalam zat padat. Suatu dispersi bahan obat dengan bahan pembawa yang dapat dibuat dengan cara pelelehan pada titik leburnya atau dilarutkan dengan pelarut yang cocok, dapat pula dibuat dengan metode pelarutan-pelelehan (Ritschel, 1976).
Pada metode pelelehan biasa, digunakan bahan pembawa derifat selulosa, manitol, atau campuran manitol dengan karbohidrat lain (Ritchel, 1976). Metode pelarutan yang menghasilkan kopresipitat dilakukan dengan melarutkan bahan obat dengan bahan pembawa pada pelarut yang cocok, kemudian pelarutnya diuapkan. Bila hal ini tidak mungkin/sukar dilakukan dapat ditambahkan zat lain sehingga terjadi pembentukan kristal yang merupakan dispersi padat molekuler antara bahan obat dengan bahan pembawa. Padatan yang diperoleh bila belum dalam bentuk serbuk halus perlu digerus dan diayak terlebih dahulu (Fudholi, 2013).
Pembentukan kopresipitat telah banyak diteliti, antara lain: kopresipitasi reserpin-PVP (Stupak dan Bates, 1972); digitoksin-PVP (Stupak dan Bates, 1972);
dan sulfatiazol-PVP (Simonelli dkk, 1969). Dari hasil penelitian-penelitian tersebut ternyata pembentukan kopresipitat dapat meningkatkan kecepatan disolusi obat yang sukar larut dalam air.
6. Nifedipin
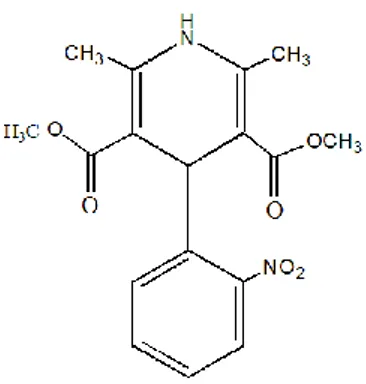
Gambar 2. Struktur kimia nifedipin (Moffat dkk, 2011)
Nifedipin mengandung tidak kurang 98,0% dan tidak lebih dari 102,0% C17H18N2O6 dihitung dalam keadaan kering. Nifedipin mempunyai nama kimia, 1,4-dihidro-2,6-dimetil-4-(O-nitrofenil)-3,5-piridin karboksilat. Nifedipin mempunyai berat molekul 346,3 (Anonim, 1995). Nifedipin berupa serbuk berwarna kuning, tidak berbau, tidak berasa, dan tidak higroskopis. Titik leleh nifedipin antara 171-175oC (Sweetman, 2009).
Nifedipin merupakan obat yang sukar larut dalam air (5,6 µg/mL pada pH 7) (Ali, 1989), disolusi obat dari fase kristalin stabil dilaporkan merupakan langkah yang paling lambat dalam absorpsi obat dan menyebabkan bioavailabilitas yang rendah (Benita dkk, 1990). Ditambah lagi, nifedipin juga memiliki kecepatan klirens yang tinggi. Hal ini menyebabkan bentuk sediaan nifedipin konvensional per oral harus diadministrasikan tiga kali sehari, yang menyebabkan fluktuasi kadar obat dalam darah yang signifikan dan efek samping obat yang lebih tinggi. Oleh
karena itu, pengembangan bentuk sediaan nifedipin dalam bentuk lepas terkontrol sangat dibutuhkan untuk mereduksi efek samping dan meningkatkan kepatuhan pasien dan kenyamanan pasien dalam mengkonsumsi nifedipin (Huang dkk, 2006). Nifedipin merupakan senyawa yang sensitif terhadap cahaya. Nifedipin akan segera berubah menjadi turunan nitrosofenil piridin jika terpapar sinar matahari atau sinar artifisial pada panjang gelombang tertentu. Studi degradasi lerutan nifedipin dalam metilen klorida yang terpapar sinar pada panjang gelombang UV 366 nm dan sinar tampak menghasilkan senyawa 2,6-dimetil-3,5-dikarbometoksi-4-(2’-nitrosofenil)-piridin. Dalam isopropil alkohol, metilen klorida, serta karbon tetraklorida, hasil degradasi nifedipin memberikan fluoresensi pada panjang gelombang 425 nm (Shim dkk, 1988). Untuk mencegah degradasi nifedipin, maka serbuk nifedipin harus dikemas dalam wadah tertutup rapat dan terlindung dari cahaya (Anonim, 1995).
Nifedipin merupakan obat golongan dihidropiridin sebagai penghambat kanal kalsium yang sering digunakan sebagai terapi hipertensi dan angina. Mekanisme kerja nifedipin adalah menghambat masuknya ion Ca2+ sehingga menghambat terjadinya kontraksi pada otot jantung dan otot polos vaskuler. Nifedipin akan menimbulkan vasodilatasi pada otot polos pembuluh darah, sehingga terjadi penurunan tekanan darah. Untuk pengobatan jangka panjang pada angina stabil dan kronik, sering digunakan antagonis kalsium sebagai obat pilihan pertama (Sweetman, 2009).
Bioavailabilitas sediaan nifedipin oral adalah 40-60% dari dosis yang diberikan. Sebanyak 92-98% dari dosis yang diberikan berikatan dengan protein
plasma. Nifedipin memiliki waktu paruh relatif pendek yakni 2-5 jam, volume distribusi 0,8 L/kg dan kliren plasma 7 mL/menit/kg. Nifedipin diabsorpsi dengan cepat secara hampir sempura (90%) dalam lambung (Moffat dkk, 2011).
7. Polivinil Pirolidon
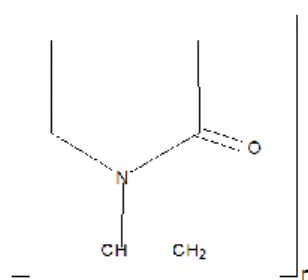
Gambar 3. Struktur kimia PVP (Rowe dkk, 2009)
Polivinil Pirolidon, dengan nama kimia 1-etenil-2-pirolidon homopolimer dan mempunyai rumus molekul (C6H9NO)n, merupakan serbuk halus, berwarna putih sampai putih krem, tidak berbau, bersifat higroskopis. Beberapa kegunaan PVP dalam formulasi farmasetik adalah sebagai pensuspensi dan pengikat tablet, baik sebagai pengikat kering (serbuk) atau sebagai pengikat dalam granulasi basah (larutan); agen peningkat viskositas pada beberapa sediaan topikal, suspensi maupun larutan oral. PVP juga dapat meningkatkan kelarutan obat-obat yang suka larut dalam air (Rowe dkk, 2009).
Spesifikasi PVP adalah sebagai berikut: pH 3,0-7,0 (5% b/v dalam air), kandungan nirogen 11,2-12,3%, kerapatan 1,17-1,18 g/cm3, bulk density 0,31 g/cm3 untuk PVP K-30 tapped density 0,40 g/cm3 untuk PVP K-30, dan pada suhu 150oC padatan mulai melunak. PVP larut dalam asam,kloroform, etanol, keton, metanol, dan air. Praktis tidak larut dalam eter, hidrokarbon, dan minyak mineral. PVP akan
menjadi lebih gelap pada pemanasan di atas suhu 150oC dan dapat menurunkan kelarutannya dalam air (Rowe dkk, 2009).
PVP, adalah suatu polimer hidrofilik dari n-vinyl pyrrolidone (povidon) yang umum digunakan sebagai bahan pembawa (carrier) dalam sistem dispersi padat. PVP memiliki berbagai jenis bobot molekul yang mempengaruhi viskositasnya. Secara umum, yang digunakan sebagai bahan pembawa dalam formulasi dispersi padat adalah dari PVP K-12 (bobot molekulnya 2400 Da) hingga PVP K-90 (bobot molekulnya 100kDa). PVP K-90 memiliki viskositas yang sangat tinggi dalam berbagai jenis solven, sehingga sulit digunakan untuk formulasi dispersi padat. Dalam pemilihan PVP pada nilai bobot molekul tertentu harus berhati-hat, karena pada PVP dengan nilai K yang sama pun dapat memiliki distribusi bobot molekuler yang berbeda dan end group dari PVP juga berbeda. Hal ini akan mempengaruhi prosedur manufakturnya (Raith dkk, 2002). PVP K-30 sendiri memiliki bobot molekul 50.000 Da (Rowe dkk, 2009).
Penanganan PVP, terkait dengan kondisi penyimpanan dan pemrosesan dalam pembuatan dispersi padat perlu diperhatikan. Hal ini karena sifat PVP yang higroskopis. Sifat higroskopis ini dipengaruhi oleh bobot molekul PVP (harga K). Misalnya pada PVP K-12 yang mmiliki bobot molekul kecil dapat menyerap lembab sebanyak bobot molekulnya dalam kelembaban tinggi (Paudel dkk, 2013). Obat-obat dengan sifat disolusi yang buruk telah banyak yang sukses diformulasikan sebagai dispersi padat dengan fisik yang stabil dengan PVP dan PVP-VA. Obat-obat ini juga menunjukan sifat fisikokimia, kecepatan disolusi in
8. Tetapan Kecepatan Disolusi Intrinsik
Tetapan kecepatan disolusi intrinsik dihitung melalui hasil plotting antara jumlah kumulatif dari komponen obat yang terdisolusi persatuan luas terhadap fungsi waktu. Jumlah kumulatif dari komponen obat yang terdisolusi merupakan hasil perhitungan dari kadar obat yang sudah terkoreksi dengan volume medium, volume pengambilan, serta luas permukaan kontak. Hal ini dikarenakan ada bobot sampel yang hilang dalam medium disolusi selama uji disolusi karena terambil ketika dilakukan sampling (Viegas dkk, 2001)
Persamaan kecepatan disolusi intrinsik diturunkan dari persamaan Noyes-Whitney. Bentuk sederhana dari persamaan kecepatan disolusi intrinsik adalah:
𝑤
𝑠 = 𝐺. 𝑡...(2)
dimana harga G adalah tetapan kecepatan disolusi intrinsik, 𝑤
𝑠 adalah bobot terlarut persatuan luas pada saat waktu t. Bobot terlarut adalah bobot kumulatif terkoreksi berdasarkan volume sampling dan volume medium total. Sedangkan t adalah waktu
sampling. Persamaan ini berlaku apabila uji disolusi berjalan dalam kondisi sink
sehingga Cs>>>C, dan luas permukaan kontak yang konstan (Fudholi, 2013). Sehingga, apabila dilakukan plotting antara bobot terdisolusi persatuan luas terhadap fungsi waktu, akan didapatkan persamaan garis lurus dengan slope sebagai harga G. Harga G adalah tetapan kecepatan disolusi intrinsik (Fudholi, 2013).
9. Tetapan Kecepatan Disolusi Kitazawa
Teori disolusi Kitazawa didasarkan pada beberapa kondisi sebagai berikut: a. Luas permukaan solid konstan.
b. Volume medium cukup besar untuk menjaga uji penelitian dalam kondisi sink.
c. Kecepatan pelarutan proporsional dengan perbedaan konsentrasi saturasi dari konsentrasi dalam larutan (Kitazawa dkk., 1975).
Dalam persamaannya dipakai C∞ yaitu konsentrasi total zat aktif larut dalam medium atau w∞ yaitu bobot total zat aktif larut dalam medium. Persamaan kecepatan disolusi Kitazawa adalah:
ln 𝑤∞
(𝑤∞−𝑤)= 𝑘. 𝑡...(3)
dimana w adalah bobot zat aktif terlarut, t adalah fungsi waktu, dan k adalah tetapan kecepatan disolusi Kitazawa (Kitazawa dkk., 1975).
F. Landasan Teori
Agar suatu obat dapat diabsorpsi, pertama sekali obat tersebut harus dapat terlarut dalam cairan dimana obat tersebut akan diabsorpsi. Hal ini terutama berlaku bagi obat-obat yang memiliki bentuk sediaan padat seperti tablet dan kapsul yang digunakan secara per oral. Setelah terdisolusi, obat tersebut akan terabsorpsi dan masuk ke dalam saluran sistemik. Apabila kecepatan absorpsinya jauh lebih besar dari kecepatan disolusinya, maka kecepatan disolusi obat tersebut menjadi langkah penentu dalam proses absorpsinya.
Hampir 40% dari keseluruhan active pharmaceutical ingredient (API) dan
new chemical entity (NCE) memiliki karakter disolusi yang buruk. Hal ini
menunjukkan bahwa kecepatan disolusi yang buruk merupakan masalah yang umum dihadapi dalam formulasi bentuk sediaan. Untuk itu, dilakukan berbagai pendekatan untuk mengatasi masalah ini seperti: pengecilan ukuran partikel, kompleksasi, dispersi padat, dan mikroenkapsulasi.
Dari teori disolusi yang telah dijelaskan di atas, didapatkan kesimpulan bahwa ada dua faktor yang dapat dikembangkan dalam memformulasikan suatu obat supaya dapat memperbaiki karakter disolusinya. Faktor ini adalah luas permukaan efektif obat dan meningkatkan kelarutan bahan obat.
Kecepatan disolusi intrinsik digunakan untuk menganalisis kecepatan disolusi zat aktif murni dan pengembangan dari zat aktif murni. Disolusi intrinsik terutama berguna untuk mempreduksi problem disolusi yang mungkin terjadi karena hanya dibutuhkan sampel yang sedikit.
Uji disolusi dilakukan secara luas untuk keperluan preformulasi pada kandidat obat baru ataupun pengembangan obat yang sudah ada. Kecepatan disolusi intrinsik didefinisikan sebagai kecepatan disolusi zat aktif murni persatuan luas permukaan kontak. Dengan menggunakan data kecepatan disolusi intrinsik, dapat diprediksi bagaimana kecepatan disolusi suatu obat dalam kondisi fisiologis.
Salah satu strategi untuk meningkatkan karakter disolusi obat adalah dengan pembentukan dispersi padat. Dispersi padat merupakan suatu campuran dari satu atau lebih bahan obat dalam suatu bahan pembawa yang inert atau berupa matriks
padat. Dalam perkembangannya, ada tiga metode pembuatan dispersi padat, yaitu: metode peleburan, metode pelarutan, dan metode pelarutan-peleburan.
Karakter disolusi obat yang meningkat karena pembentukan dispersi padat terjadi melalui dua mekanisme yaitu mekanisme penarikan dan mekanisme pembasahan. Polimer bahan pembawa yang lebih mudah larut dalam medium akan berinteraksi dengan bahan obat dan mengelilingi bahan obat dalam medium. Setelah sistem kontak dengan medium, polimer bahan pembawa akan terlarut secara cepat dengan membawa serta (menarik) bahan obat. Peristiwa inilah yang disebut sebagai mekanisme penarikan. Selain mekanisme ini,ada pula kemungkinan terjadinya mekanisme pembasahan. Mekanisme pembasahan terjadi setelah interaksi terjadi antara bahan obat dan polimer bahan pembawa. Senyawa hasil interaksi tersebut akan membentuk suatu ikatan hidrogen dan/atau ikatan van der Waals dengan medium dalam larutan yang menyebabkan senyawa tersebut melarut di dalam medium. Mekanisme penarikan dan mekanisme pembasahan dapat terjadi secara tunggal dan/atau sinergis, tergantung pada bahan pembawa dan bahan obat dalam sistem dispersi padat tersebut.
Salah satu metode pembuatan dispersi padat yang cukup sederhana adalah dengan menggunakan metode kopresipitasi. Metode kopresipitasi dapat dilakukan dengan cara melarutkan bahan obat dengan bahan pembawa pada pelarut yang sesuai, kemudian pelarutnya diuapkan. Bila hal ini sukar dilakukan, dapat ditambahkan bahan lain supaya terjadi pembentukan kristal. Padatan yang diperoleh kemudian digerus dan diayak hingga didapatkan serbuk halus. Cara lainnya adalah dengan melelehkan bahan obat dengan bahan pembawanya pada
titik leburnya. Setelah itu dapat didinginkan kembali sehingga didapatkan padatan, Padatan yang didapat kemudian digerus dan diayak hingga didapatkan serbuk yang halus.
Nifedipin merupakan obat yang memiliki karakter disolusi yang buruk. Selain itu, disolusi nifedipin dari fase kristalin stabil dilaporkan merupakan langkah yang paling lambat dalam absorpsi dan menyebabkan bioavailabilitas yang rendah. Ditambah lagi, nifedipin memiliki kecepatan klirens yang tinggi. Hal ini menyebabkan bentuk sediaan konvensional nifedipin per oral perlu diadministrasikan tiga kali sehari, yang menyebabkan fluktuasi kadar obat dalam darah dan efek samping obat yang lebih tinggi.
Berbagai jenis polimer telah banyak digunakan sebagai bahan pembawa dalam formulasi sistem dispersi padat dengan berbagai metode. Salah satu polimer yang umum digunakan adalah polivinil pirolidon. Polivinil pirolidon atau PVP adalah suatu polimer hidrofilik dari n-vinyl pyrrolidone (povidon) yang umum digunakan sebagai bahan pembawa (carrier) dalam sistem dispersi padat. PVP sendiri memiliki berbagai jenis bobot molekul yang mempengaruhi viskositasnya. Secara umum, yang digunakan sebagai bahan pembawa dalam formulasi dispersi padat adalah dari PVP K-12 (bobot molekulnya 2400 Da) hingga PVP K-90 (bobot molekulnya 100kDa). Semakin tinggi harga K, maka viskositas PVP akan semakin tinggi dalam berbagai jenis solven. Viskositas yang terlalu tinggi akan menyulitkan formulasi dispersi padat. Selain itu, harga K yang terlalu kecil akan meningkatkan sifat higroskopisnya. Hal ini perlu diperhatikan terutama untuk menentukan kondisi penyimpanan dan pemrosesan dalam formulasi dispersi padat.
Obat-obat yang karakter disolusi yang buruk telah banyak yang sukses diformulasikan sebagai dispersi padat dengan fisik yang stabil dengan PVP K-30 dengan berbagai metode. Obat-obat ini juga menunjukan sifat fisikokimia, kecepatan disolusi in vitro maupun in vivo yang baik. Sehingga, dapat disimpulkan bahwa PVP K-30 merupakan salah satu bahan pembawa terbaik yang digunakan dalam formulasi dispersi padat.
G. Hipotesis
1. Dispersi padat nifedipin dengan bahan pembawa polivinil pirolidon K-30 dengan metode kopresipitasi akan memiliki kecepatan disolusi yang berbeda signifikan jika dibandingkan dengan kecepatan disolusi nifedipin murni
2. Peningkatan konsentrasi polivinil pirolidon dalam dispersi padat nifedipin-polivinil pirolidon K-30 akan meningkatkan kecepatan disolusi dispersi padat nifedipin-polivinil pirolidon K-30.
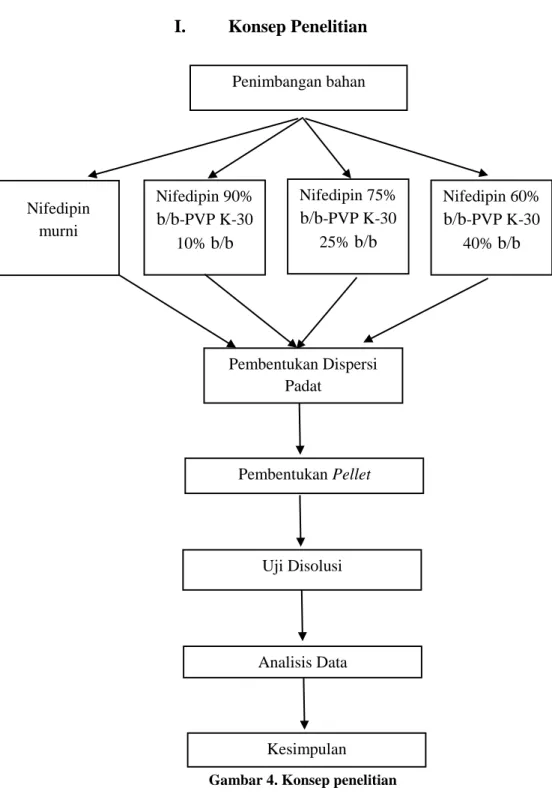
H. Rencana Penelitian Penelitian ini bisa dibagi dalam beberapa tahap, yaitu:
1. Pembuatan dispersi padat nifedipin-PVP K-30. 2. Pembuatan kurva baku nifedipin.
3. Uji disolusi dispersi padat nifedipin-polivinil pirolidon K-30.
4. Analisis data dengan melihat tetapan kecepatan disolusi intrinsik dan tetapan kecepatan disolusi k masing-masing campuran dispersi padat dan nifedipin murni.
I. Konsep Penelitian
Gambar 4. Konsep penelitian Nifedipin 90% b/b-PVP K-30 10% b/b Nifedipin 75% b/b-PVP K-30 25% b/b Nifedipin 60% b/b-PVP K-30 40% b/b Pembentukan Pellet Penimbangan bahan Pembentukan Dispersi Padat Kesimpulan Nifedipin murni Uji Disolusi Analisis Data