2. TINJAUAN PUSTAKA
2.1 Klasifikasi dan Deskripsi Ikan Lele
Klasifikasi ikan lele menurut Beaufort (1965) dalam Suyanto (1999) adalah sebagai berikut:
Filum : Chordata Subfilum : Vertebrata Kelas : Pisces Subkelas : Teleostei Ordo : Ostariophysi Subordo : Siluroidea Famili : Clariidae Genus : Clarias
Ikan lele merupakan jenis ikan konsumsi air tawar dengan tubuh memanjang dan kulit licin. Ikan lele dapat hidup pada suhu 20 °C, dengan suhu optimal antara 25-28 °C. Untuk pertumbuhan larva diperlukan kisaran suhu antara 26-30 °C dan untuk pemijahan 24-28 °C. Apabila suhu tempat hidupnya
terlalu dingin, misalnya di bawah 20 oC, pertumbuhannya agak lambat. Di Indonesia, ada beberapa jenis (spesies) ikan lele, yaitu Clarias batrachus dan
Clarias gariepinus, jenis ini yang paling banyak dijumpai dan umumnya
dibudayakan, disamping terdapat di alam; Clarias leiacanthus; Clarias nieuwhofi; Clarias teesmanii. Ketiga jenis ini terdapat di perairan Indonesia tetapi jarang ditemukan dan diduga sudah langka (Suyanto 1999).
Ikan lele bersifat nokturnal, artinya aktif pada malam hari atau lebih menyukai tempat yang gelap. Pada siang hari yang cerah, ikan lele lebih suka berdiam di dalam lubang-lubang atau tempat yang tenang dan aliran air yang tidak terlalu deras. Habitat atau lingkungan hidup ikan lele ialah semua perairan air tawar. Di sungai yang airnya tidak terlalu deras atau di perairan yang tenang seperti danau, waduk, telaga, rawa serta genangan-genangan kecil seperti kolam, merupakan lingkungan hidup ikan lele (Suyanto 1999).
Ikan lele dumbo (Clarias gariepinus) merupakan jenis ikan yang termasuk dalam famili Claridae dan genus Clarias. Ikan lele dumbo ini merupakan ikan air
tawar yang menyenangi air tenang. Spesies ini merupakan saudara dekat lele lokal (Clarias batrachus) yang selama ini dikenal, sehingga ciri-ciri morfologinya hampir sama. Ikan ini merupakan hasil perkawinan silang antara lele Afrika dan lele Taiwan (Khairuman dan Amri 2002 dalam Margolang 2009). Ikan lele dumbo memiliki kecepatan tumbuh yang relatif cepat yaitu pada umur 3 bulan pemeliharaan sudah layak untuk panen, rasanya enak dan kandungan gizinya cukup tinggi. Ikan lele dumbo meskipun badannya besar, patilnya tidak memiliki racun tidak seperti lele lokal. Foto ikan lele dumbo dapat dilihat pada Gambar 1.
Sumber: www. cdserver2.ru.ac
Gambar 1. Ikan lele dumbo (Clariasgariepinus)
Bentuk tubuh memanjang, agak bulat, kepala gepeng, tidak bersisik, mempunyai 4 pasang kumis, mulut besar, warna kelabu sampai hitam. Lele dumbo banyak ditemukan di rawa-rawa dan sungai di Afrika, terutama di dataran rendah sampai sedikit payau. Ikan ini mempunyai alat pernapasan tambahan yang disebut abrorescent, sehingga mampu hidup dalam air yang oksigennya rendah. Lele dumbo termasuk ikan karnivora, namun pada usia benih lebih bersifat omnivora. Induk lele dumbo sudah dapat dipijahkan setelah berumur 2 tahun dan dapat memijah sepanjang tahun (Margolang 2009).
Menurut Suyanto (1999), ikan lele tahan hidup di perairan yang airnya mengandung sedikit oksigen. Ikan lele ini relatif tahan terhadap pencemaran bahan-bahan organik. Oleh karena itu, ikan lele tahan hidup di comberan yang airnya kotor. Ikan lele hidup dengan baik di dataran rendah sampai daerah perbukitan yang tidak terlalu tinggi. Di daerah pegunungan dengan ketinggian
diatas 700 meter, pertumbuhan lele kurang begitu baik. Lele tidak pernah ditemukan hidup di air payau atau asin. Komposisi kimia ikan lele dapat dilihat pada Tabel 1.
Tabel 1. Komposisi kimia ikan lele (Clarias sp.)
Senyawa kimia Jumlah (%)
Air 76
Protein 17,7
Karbohidrat 0,3
Lemak 4,8
Mineral 1,2
Sumber: Vaas (1956) dalam Astawan (2008)
2.2 Klasifikasi dan Deskripsi Ikan Nila
Ikan nila merupakan jenis ikan yang diintroduksi dari luar negeri. Bibit ini didatangkan ke Indonesia secara resmi oleh Balai Penelitian Perikanan Air Tawar pada tahun 1969. Melalui beberapa penelitian dan masa adaptasi, barulah ikan ini disebarluaskan kepada petani di seluruh Indonesia. Klasifikasi ikan nila menurut Trewavas (1982) dalam Suyanto (1994) adalah sebagai berikut:
Filum : Chordata Subfilum : Vertebrata Kelas : Osteichtyes Subkelas : Acanthopterigii Ordo : Percomorphi Famili : Cichlidae Genus : Oreochromis
Spesies : Oreochromisniloticus
Ikan nila hitam merupakan jenis ikan air tawar yang mudah dikembangbiakan dan memiliki toleransi tinggi terhadap perubahan lingkungan serta mudah dalam pemeliharaannya. Karena memiliki berbagai kelebihan dibanding jenis ikan lainnya, menjadikan ikan nila hitam mudah sekali diterima masyarakat. Selain kelebihan tersebut, ikan nila hitam relatif tahan dari serangan penyakit serta ikan ini termasuk hewan pemakan segala (omnivora) (Margolang 2009). Foto ikan Nila Hitam ditunjukkan pada Gambar 2.
Sumber: www.globefish.org Gambar 2.
Ikan nila mempunyai sirip punggung, sirip dubur dan sirip perut yang masing-masing mempunyai
duri. Sirip punggung mempunyai lima belas jari lunak, sedangkan sirip ekor mempunyai dua jari lunak. Sirip punggung berwarna hitam dan s terdapat enam buah jari
Tabel 2.
Tabel 2. Komposisi kimia ikan Senyawa kimia Air Protein Karbohidrat Lemak Abu Sumber: Suyanto (1994)
Ikan nila hidup di sungai, rawa, danau, waduk dan sawah. Pada daerah tropis ikan nila dapat hidup dan tumbuh dengan baik sepanjang tahun pada lokasi sampai ketinggian 500 m diatas permukaan laut. Ikan
kepadatan yang lebih tinggi dibandingkan ikan seperti ikan mas (Direktorat Jenderal
Sumber: www.globefish.org
Gambar 2. Ikan nila hitam (Oreochromisniloticus)
ila mempunyai sirip punggung, sirip dubur dan sirip perut yang masing mempunyai jari-jari keras dan jari-jari lunak yang tajam seperti duri. Sirip punggung mempunyai lima belas jari-jari keras dan sepuluh jari lunak, sedangkan sirip ekor mempunyai dua jari-jari keras dan enam jari lunak. Sirip punggung berwarna hitam dan sirip dada menghitam, sirip pada ekor
i-jari tegak. Komposisi kimia ikan nila dapat dilihat pada
. Komposisi kimia ikan nila (Oreochromis sp.)
Senyawa kimia Jumlah (%)
79,44 12,52 4,21 2,57 1,26 Sumber: Suyanto (1994)
ila hidup di sungai, rawa, danau, waduk dan sawah. Pada daerah ila dapat hidup dan tumbuh dengan baik sepanjang tahun pada lokasi sampai ketinggian 500 m diatas permukaan laut. Ikan nila dipelihara dengan kepadatan yang lebih tinggi dibandingkan ikan-ikan dari golongan cyprinidae
(Direktorat Jenderal Perikanan 1991).
ila mempunyai sirip punggung, sirip dubur dan sirip perut yang jari lunak yang tajam seperti jari keras dan sepuluh jari-jari jari keras dan enam jari-jari irip dada menghitam, sirip pada ekor ila dapat dilihat pada
ila hidup di sungai, rawa, danau, waduk dan sawah. Pada daerah ila dapat hidup dan tumbuh dengan baik sepanjang tahun pada lokasi dipelihara dengan an cyprinidae
Keunggulan yang dimiliki oleh ikan nila antara lain: toleran terhadap lingkungan (hidup di air tawar dan payau pada kisaran pH 5-11), pertumbuhannya cepat yaitu dalam jangka waktu 6 bulan benih berukuran 30 g dapat tumbuh mencapai berat 300-500 g, dapat dipijahkan setelah umur 5-6 bulan dan dapat dipijahkan kembali setelah 1-1,5 bulan kemudian, serta tahan terhadap kekurangan oksigen dalam air (Suyanto 1994).
2.3 Komposisi Kimia Ikan
Ikan mempunyai kandungan gizi yang tinggi, komponen kimia ikan secara umum mengandung: 15-24 % protein; 0,1-22 % lemak; 1-3 % karbohidrat; 0,8-2 % substansi anorganik dan 66-84 % air (Suzuki 1981). Priestley (1979) menyebutkan bahwa protein ikan terdiri dari tiga tipe, yaitu: miofibril, sarkoplasma dan jaringan ikat (stroma). Persentase protein stroma dalam daging ikan lebih sedikit dibandingkan protein ikan lainnya. Hal inilah yang menyebabkan daging ikan lebih lembut dibandingkan daging lainnya.
2.3.1 Protein ikan
Menurut deMan (1997), protein daging ikan dapat dibagi menjadi tiga golongan berdasarkan kelarutannya. Otot kerangka ikan terdiri atas serat pendek disusun di antara lembaran-lembaran jaringan ikat, meskipun jumlah jaringan ikat dalam otot ikan lebih kecil daripada jumlah jaringan ikat dalam mamalia dan seratnya lebih pendek. Tabel 3 menunjukkan penggolongan protein daging ikan berdasarkan kelarutan.
Tabel 3. Penggolongan protein daging ikan berdasarkan kelarutan Kekuatan ion pada saat
pelarutan
Nama golongan Lokasi
Sama dengan atau lebih besar dari nol
’Myogen’ mudah larut Terutama sarkoplasma cairan sel otot
Lebih besar dari sekitar 0,3
’Struktur’ kurang larut Terutama myiofibril, unsur kontraktil
Tidak larut ’Stroma’ Terutama jaringan ikat,
dinding sel, dsb. Sumber: deMan (1997)
Komponen utama dari protein adalah aktin dan miosin, yang berfungsi untuk kontraksi dan relaksasi otot. Protein dibentuk oleh satuan-satuan asam amino yang membentuk polimer sehingga merupakan senyawa yang panjang. Molekul asam amino mempunyai gugus amino (NH2) yang bersifat basa dan
gugus karboksil (COOH) yang bersifat asam. Keadaan tersebut memungkinkan asam amino dapat bereaksi dengan asam dan basa serta pereaksi lainnya (Winarno
et al. 1980).
a) Protein miofibril
Protein miofibril ini berperan penting dalam penggumpalan dan pembentukan gel pada saat pengolahan. Protein ini terdiri dari miosin, aktin dan protein regulasi (tropomiosin, troponin, dan aktinin) (Suzuki 1981).
Penyusun terbesar protein miofibril ikan adalah miosin, yaitu 50-60 %, (miosin merupakan komponen miofibril terbanyak di dalam jaringan otot) dan penyusun kedua terbesar adalah aktin. Aktin tersusun hampir 20 % dari total miofibril dan merupakan filamen tipis. Protein ini mempunyai dua bentuk, yaitu globular (G-aktin) dan fibrous (F-aktin). Gabungan aktin dan miosin membentuk aktomiosin. Protein miofibril sangat berperan dalam pembentukan gel, terutama dari fraksi aktomiosin (Suzuki 1981).
Menurut Nakai dan Modler (1999), protein miofibril meliputi 11 % dari total berat otot dan sekitar 55 % dari total protein otot. Secara fisiologis dan struktur ikatan, protein miofibril dibagi menjadi 3 subkelompok:
1. Protein kontraktil, mencakup tropomiosin dan aktin yang bertanggung jawab secara langsung untuk kontraksi otot dan merupakan bagian terpenting dari miofibril.
2. Protein pengatur, mencakup tropomiosin, kompleks troponin dan beberapa protein pelengkap lainnya, yang dilibatkan di dalam inisiasi dan mengontrol kontraksi.
3. Sitoskletal atau protein scaffold, mencakup connectin, C-protein, desmin dan sejumlah komponen pelengkap lainnya yang berfungsi memberi dukungan dan memelihara struktur miofibril.
b) Protein sarkoplasma
Protein sarkoplasma mengandung berbagai macam protein larut air yang disebut sebagai miogen. Protein tersebut terdiri dari mioglobin, enzim dan albumin lainnya. Kandungan protein sarkoplasma pada daging ikan bervariasi berdasarkan spesies ikan, tetapi terdapat dalam jumlah besar pada ikan-ikan pelagis seperti pada sardine dan mackerel, serta terdapat dalam jumlah kecil pada ikan-ikan demersal (Suzuki 1981). Protein sarkoplasma merupakan protein yang larut dalam air, secara normal ditemukan dalam plasma sel dan berperan sebagai enzim yang diperlukan untuk metabolisme anaerob sel otot. Protein sarkoplasma meliputi 30 % dari total protein otot (Mackie 1992).
Protein sarkoplasma menghambat pembentukan gel surimi. Menurut Smith (1991) yang dikutip oleh Haard et al. (1994) bahwa protein sarkoplasma akan mengganggu cross-linking miosin selama pembentukan matriks gel karena protein ini tidak dapat membentuk gel dan mempunyai kapasitas pengikatan air rendah.
c) Protein stroma
Menurut Suzuki (1981), protein stroma adalah bagian protein otot yang paling sedikit, membentuk jaringan ikat dan tidak dapat diekstrak dengan air, larutan asam, larutan alkali atau larutan garam netral pada konsentrasi 0,01-0,1 M. Protein stroma merupakan protein yang terdapat pada bagian luar sel otot.
Protein stroma ini tidak dapat diekstrak menggunakan larutan asam, alkali atau garam berkekuatan ion tinggi. Pada pengolahan surimi, protein stroma tidak dihilangkan karena mudah larut oleh panas dan merupakan komponen netral (Hall dan Ahmad 1992).
2.3.2 Lemak ikan
Kandungan lemak ikan umumnya merupakan asam-asam lemak esensial yaitu asam lemak linoleat dan linolenat. Lemak ikan banyak terdapat asam lemak dengan rantai C20-C22 dengan 5 dan 6 ikatan rangkap yang termasuk ke dalam
kelompok asam lemak omega 3. Eicosa Pentaenoic Acid (EPA), Docosa Hexaenoic Acid (DHA) dan asam α-linoleat merupakan jenis asam lemak yang termasuk ke dalam kelompok asam lemak omega 3. Jumlah asam lemak tidak jenuh sebesar 79-83 % dan asam lemak jenuh sebesar 17-21 % dari seluruh asam lemak yang terdapat pada daging ikan (Hadiwiyoto 1993). Menurut Priestley (1979), lemak pada ikan adalah lemak tidak jenuh, yaitu fosfolipida dan trigliserida yang mengandung sejumlah besar asam lemak tak jenuh
Polyunsaturated Fatty Acid (PUFA) yang mudah teroksidasi oleh oksigen selama
penanganan dan proses pengolahan. Proses oksidasi menghasilkan hidroperoksida dan akan pecah menjadi karbonil yang menyebabkan bau busuk dan rasa tengik.
Irawan (1995) menyatakan bahwa pengaruh musim biasanya yang paling banyak mempengaruhi kandungan air dan lemak pada daging ikan. Pada musim dimana sulit mendapatkan makanan, kandungan lemak menurun, sedangkan kandungan air meningkat, juga sebaliknya.
2.3.3 Komponen volatil
Cita rasa adalah gabungan antara rasa dan aroma. Di dalam mulut, rasa dapat dikenali jika senyawa-senyawa dapat larut dalam air liur, sedangkan aroma dapat dikenali jika senyawa-senyawa penyusunnya berbentuk uap dan molekul-molekul komponen bau tersebut harus menyentuh silia sel olfaktori (Winarno
et al. 1980). Menurut Whistler dan Daniel (1985), aroma dikaitkan dengan gabungan dari beberapa komponen volatil. Komponen volatil ini mengandung sejumlah gugus karbonil (aldehida dan keton) dan turunan asam karboksilik, terutama ester. Aroma yang ditimbulkan oleh bahan pangan sebelum diolah sudah terdapat dari awal (dalam bahan baku), sedangkan lainnya terbentuk selama pengolahan dan penyimpanan makanan.
Pada waktu proses pembusukan ikan terjadi umumnya komponen-komponen penyusun aroma ikan akan hilang. Pada saat pembusukan ini, amonia lebih banyak dibentuk sehingga baunya akan mendominasi. Volatil nitrogen hampir seluruhnya terdiri atas amonia. Pada ikan-ikan air tawar, kandungan trimetilamin oksida (TMAO) sedikit sekali atau bahkan tidak ada, sedangkan pada
ikan-ikan laut kandungan TMAO berfungsi sebagai bagian dari sisi buffer. Trimetilamin ini dikenal sebagai salah satu komponen pembentuk bau ikan dan sudah dapat dideteksi pada ikan yang masih segar. Pengukuran Total Volatile
Base Nitrogen (TVBN) menentukan jumlah seluruh volatil amin terutama amonia
dan trimetilamin. Ikan dapat dikatakan segar bila memiliki kadar TVBN 20-30 mg N/100 g dan dikatakan busuk bila memiliki kadar TVBN > 30 mg N/100 g (Ozogul dan Ozogul 2000).
2.4 Pengaruh Penyimpanan Suhu Dingin terhadap Mutu Ikan
Pada produk pangan yang cepat membusuk seperti ikan basah, mutu ikan selalu identik dengan kesegaran. Kualitas dari bahan baku hingga memasuki proses pengolahan adalah faktor yang sangat penting bagi konsumen. Oleh karena itu, ikan harus ditangani dengan serius untuk mempertahankan daya tahan ikan tersebut. Ikan yang disimpan dingin (chilled) setelah ditangkap dan ditangani dengan benar akan memiliki daya tahan selama 15 hari penyimpanan dingin pada supermarket (Alasalvar et al. 2002).
Eskin (1990) menyatakan bahwa segera setelah ikan mati akan mengalami perubahan-perubahan yang mengarah pada pembusukan yang disebabkan oleh aktivitas biokimia dan fisikokimia. Proses yang terjadi pada kondisi ini dapat dibagi menjadi 3 tahap, yaitu prerigor, rigormortis dan postrigor. Pada tahap prerigor, tubuh ikan menjadi lunak melalui karakterisasi biokimia yang ditandai dengan turunnya ATP dan kandungan creatine phosphate yang dikenal dengan glikolisis. Pada tahap rigormortis, kondisi tubuh ikan menjadi kaku, dimana rigormortis terjadi sekitar 1-7 jam setelah ikan mati, tergantung dari banyak faktor yang mempengaruhi, dan tahap terakhir adalah postrigor dimana ikan berada dalam kondisi lembek.
Penguraian tingkat lanjut oleh enzim terjadi setelah proses rigormortis selesai yang dimulai dengan meningkatnya nilai pH (Connell 1980). Menurut Amlacher (1961) dalam Santoso et al. (2008), nilai pH bagi ikan segar berada pada kisaran pH di bawah netral hingga pH netral dan enzim proteolisis aktif setelah proses rigor terjadi. Enzim ini akan menguraikan protein. Beberapa enzim yang terlibat dalam proses ini antara lain: katepsin (dalam daging), tripsin,
kimotripsin dan pepsin (dalam organ pencernaan) serta enzim dari mikroorganisme yang terdapat dalam tubuh ikan. Enzim-enzim yang dapat menguraikan protein berperan penting dalam proses penurunan mutu ikan (Moeljanto 1992). Tingkat akhir dari hasil penguraian ini adalah terbentuknya senyawa amonia.
Sikorski dan Pan (1994) menyatakan bahwa kualitas daging ikan yang disimpan pada suhu dingin secara umum dipengaruhi oleh degradasi senyawa kimia dan biokimia yang dipengaruhi oleh aktivitas mikrobiologis dan enzimatis yang secara alami terjadi sesaat setelah ikan mati. Selain itu, karakteristik biologi, kondisi ikan saat ditangkap dan penanganan ikan setelah ditangkap juga dapat mempengaruhi laju kemunduran mutu ikan selama penyimpanan suhu dingin. Menurut Ilyas (1993), teknik penurunan suhu ikan melalui cara pendinginan dan pembekuan dilakukan untuk menghilangkan panas dari tubuh ikan, menghablurkan komponen air, memperlambat laju denaturasi protein, menghambat laju oksidasi lemak ikan dan memperlambat penguraian enzimatis oleh enzim tubuh ikan dan enzim bakteri.
Menurut Clucas dan Ward (1996), pada suhu di bawah 4 ºC proses kemunduran mutu ikan dapat dihambat. Pada suhu tersebut penguraian tubuh ikan oleh mikroorganisme dan enzim berlangsung dengan lambat. Kemunduran mutu ikan akan menyebabkan perubahan mutu terhadap flavor, aroma, warna dan penampakan daging ikan yang dapat mempengaruhi daya terima menjadi rendah. Pernyataan tersebut didukung oleh Karvinen et al. (1982) dalam Sikorski dan Anna (1990), kecepatan perubahan bervariasi tergantung dari cara penanganan dan cara pengesan. Ikan yang disimpan terlalu lama dalam suhu rendah, setelah mengalami pemasakan akan menjadi liat, elastis, alot, berserabut dan fibrous. Hal ini berkaitan dengan hilangnya karaktersitik fungsional dari protein otot, terutama kelarutan, kandungan air, kemampuan pembentukan gel dan sifat pengemulsi lemak.
2.5 Surimi
Kata surimi berasal dari Jepang yang telah diterima secara internasional untuk menggambarkan hancuran daging ikan yang telah mengalami berbagai
proses yang diperlukan untuk mengawetkannya. Salah satu keunggulan dari surimi adalah kemampuannya untuk diolah menjadi berbagai macam variasi produk-produk lanjutannya dalam berbagai bentuk dan ukuran (Okada 1992) dan kandungan nilai gizi yang menyehatkan (Guenneugues dan Morrissey 2005 dalam Martin-Sanchez et al. 2009).
2.5.1 Pengertian dan karakteristik surimi
Menurut Suzuki (1981), surimi merupakan produk antara yang terbuat dari daging ikan yang dilumatkan setelah mengalami proses penggilingan dan pencucian. Kriteria paling penting untuk menentukan kualitas surimi adalah kekuatan gel yang dibentuknya. Kekuatan gel ini dipengaruhi oleh beberapa faktor antara lain jenis ikan, tingkat kesegaran, pH dan kadar air, pencucian, umur, tingkat kematangan gonad, konsentrasi dan jenis penambahan zat antidenaturasi serta suhu dan waktu pemasakan.
Secara teknis semua jenis ikan dapat dijadikan surimi. Namun, ikan yang berdaging putih, tidak berbau lumpur dan tidak terlalu amis serta mempunyai kemampuan membentuk gel yang bagus akan memberikan hasil (surimi) yang lebih baik. Beberapa jenis ikan yang baik untuk dijadikan surimi antara lain ikan Cunang/ Remang, Tenggiri, Kakap, Tigawaja, Beloso, Cucut dan lain-lain. Ikan air tawar seperti Lele, Tawes, Nilam dan lain-lain juga dapat diolah menjadi surimi. Biasanya untuk jenis-jenis ikan air tawar, sebelum diolah ikan-ikan ini terlebih dahulu dilakukan pemberokan agar bau lumpur pada produk akhir dapat dikurangi. Mutu kesegaran ikan yang digunakan harus benar-benar sangat segar. Penggunaan ikan yang kurang segar maupun ikan yang telah dibekukan akan menurunkan mutu surimi. Demikian pula ikan yang berdaging merah akan menghasilkan surimi yang lebih berat dan baunya lebih amis, sehingga hanya dapat digunakan untuk produk yang warnanya tidak harus putih. Daging merah biasanya mengandung lemak lebih banyak dibandingkan daging putih, sehingga surimi dan produk surimi yang dihasilkan lebih cepat tengik (Paranginangin et al.
1999).
Berdasarkan kandungan garamnya, surimi beku dibedakan menjadi dua yaitu mu-en surimi (surimi tanpa garam) dan ka-en surimi (surimi dengan garam).
Mu-en surimi dibuat dengan penggilingan daging lumat yang sudah dicuci dengan air, dicampur dengan gula dan polyphosphate. Ka-en surimidiolah dengan cara yang sama dengan penambahan garam dan gula ke dalam daging lumat. Selain surimi beku, jenis lain dari surimi yang telah dihasilkan walaupun dalam skala terbatas diberi nama “surimi na-ma” (surimi mentah) (Suzuki 1981).
Kualitas dari surimi beku dinilai dari kekuatan gelnya dan warna dari surimi tersebut. Menurut Winarno (1993), kualitas surimi yang baik adalah yang berwarna putih kuat dan dapat membentuk gel. Kesegaran dari bahan baku merupakan prasyarat yang paling penting dalam pengolahan surimi, dan untuk memperoleh mutu produk yang tinggi maka proses pembusukan pasca kematian ikan harus diperkecil (Wasson 1992; Seymour et al. 1994; Choi et al. 2005; Martin-Sanchez et al. 2009). Faktor-faktor yang dapat mempengaruhi hilangnya kesegaran ikan adalah denaturasi protein miofibril, tingkat proteolisis dan pH (Hamann dan MacDonald 1992 dalam Martin-Sanchez et al. 2009). Tingkat kesegaran juga menentukan kemampuan pembentukan gel dan daya ikat air dari surimi yang dihasilkan (Hall dan Ahmad 1997; Carvajal et al. 2005; Martin-Sanchez et al. 2009).
Lee (1984) menyatakan bahwa faktor penting yang mempengaruhi proses pembuatan surimi yang berkualitas baik antara lain: cara penyiangan (pemotongan kepala, fillet), besarnya partikel dari daging lumat, kualitas air, temperatur ikan, peralatan yang digunakan dan cara pencucian. Menurut Bertak dan Karahadian (1995), faktor utama yang harus diperhatikan selama proses pembuatan surimi adalah suhu air pencuci dan suhu pada saat penggilingan daging ikan. Suhu air yang lebih tinggi akan lebih banyak melarutkan protein larut garam. Kekuatan gel terbaik diperoleh jika daging ikan dicuci dengan air yang bersuhu 10-15 ºC.
Pencucian adalah tahap kritis dalam proses pembuatan surimi. Pencucian dapat menghilangkan materi yang dapat larut air seperti darah, protein sarkoplasma, enzim pencernaan, garam inorganik dan senyawa organik bermolekul rendah seperti trimetilamin oksida (Benjakul et al. 1996). Menurut Lee dan Kim (1986), pencucian juga dapat meningkatkan kualitas warna dan aroma, serta meningkatkan kekuatan gel surimi. Komponen utama yang larut dalam air akan hilang dalam jumlah yang banyak pada siklus pencucian pertama
kali. Secara umum agitasi selama lima menit dalam setiap kali pencucian untuk pencucian sebanyak dua kali dengan rasio air dan daging 3:1 telah dinilai cukup. Lin et al. (1996) dalam Benjakul et al. (1996)melaporkan bahwa 27 % dan 38 % protein hilang berturut-turut pada pencucian sebanyak dua kali dan tiga kali dalam proses pengolahan surimi.
2.5.2 Syarat mutu surimi beku
Mutu bahan baku yang digunakan dalam pembuatan surimi yaitu bahan baku harus bersih, bebas dari setiap bau yang menandakan pembusukan, bebas dari tanda komposisi dan pemalsuan, bebas dari sifat-sifat alamiah lain yang dapat menurunkan mutu serta tidak membahayakan kesehatan. Secara organoleptik, bahan baku harus mempunyai karakteristik kesegaran menurut SNI 01-2694-1992 sekurang-kurangnya sebagai berikut:
(a) rupa dan warna : bersih, warna daging spesifik jenis ikan (b)aroma : segar spesifik jenis
(c) daging : elastis, padat dan kompak
(d)rasa : netral agak manis
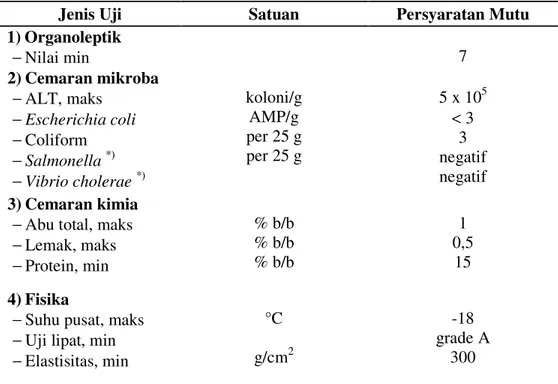
Untuk mempertahankan mutu surimi beku, bahan baku harus segera diolah. Apabila harus terpaksa menunggu proses lebih lanjut maka ikan harus disimpan dengan es atau air dingin (0-5 ºC), kondisi saniter dan higienis (SNI 01-2694-1992). Tabel 4 menunjukkan syarat mutu surimi beku berdasarkan SNI 01-2693-1992.
2.5.3 Bahan tambahan dalam pembuatan surimi
Bahan tambahan adalah bahan yang sengaja ditambahkan dengan tujuan tertentu, misalnya untuk meningkatkan konsistensi nilai gizi, cita rasa, mengendalikan keasaman dan kebasaan serta bentuk, tekstur dan rupa produk (Winarno et al. 1980). Dalam proses pembuatan surimi sering digunakan bahan-bahan tambahan-bahan tertentu. Bahan tambahan-bahan yang ditambahkan dalam proses pembuatan surimi bertujuan untuk meningkatkan kualitas surimi. Bahan tambahan yang digunakan dalam pembuatan surimi antara lain adalah garam dan
Tabel 4. Syarat mutu surimi beku (SNI 01-2693-1992)
Jenis Uji Satuan Persyaratan Mutu
1) Organoleptik −Nilai min 7 2) Cemaran mikroba −ALT, maks −Escherichia coli −Coliform −Salmonella *) −Vibrio cholerae*) koloni/g AMP/g per 25 g per 25 g 5 x 105 < 3 3 negatif negatif 3) Cemaran kimia
−Abu total, maks −Lemak, maks −Protein, min % b/b % b/b % b/b 1 0,5 15 4) Fisika
−Suhu pusat, maks −Uji lipat, min −Elastisitas, min °C g/cm2 -18 grade A 300 *) jika diperlukan
Keterangan: ALT = Alat Lempeng Total, AMP = Angka Paling memungkinkan
a) Garam
Garam merupakan bahan pengawet yang utama. Penambahan garam pada pembuatan surimi berfungsi sebagai pengawet karena dapat mencegah kerusakan dan meningkatkan daya simpan. Peranan garam NaCl adalah pada konsentrasi yang rendah sebagai pembentuk rasa, sedangkan pada konsentrasi yang tinggi berperanan sebagai pencegah terhadap pertumbuhan bakteri (bakteriostatik). Pada konsentrasi 2-5 % yang dikombinasikan pada suhu rendah, dapat mencegah pertumbuhan mikroorganisme, sedangkan pada konsentrasi 10-15 % sebagian besar bakteri terbunuh (kecuali beberapa bakteri halofilik) (Damayanthi dan Mudjajanto 1994).
Menurut Damayanthi dan Mudjajanto (1994), garam mempunyai sifat higroskopis sehingga menarik air keluar jaringan akibatnya aw akan menjadi
rendah dan garam juga mempunyai tekanan osmotik yang tinggi sehingga memecahkan (plasmolisis) membran sel mikroba. Vaclavik dan Christian (2000)
menyatakan bahwa beberapa peran garam pada makanan yaitu berfungsi sebagai pemisah untuk mencegah pembentukan saus tepung, mengurangi gelatinisasi tepung, menstabilkan busa putih telur, dan meningkatkan suhu koagulasi pencampuran protein.
b) Cryoprotectant
Bahan umum yang biasa digunakan sebagai cryoprotectant adalah jenis gula, misalnya sukrosa. Pada tahap awal ditambahkan 8 % sukrosa. Akan tetapi, penambahan ini menjadikan surimi terasa manis dan warna berubah selama pembekuan. Oleh karena itu, sukrosa yang ditambahkan pada tahap awal diubah menjadi 4 % sukrosa dan 4 % sorbitol. Penambahan cryoprotectant dapat meningkatkan kadar N-aktomiosin dari 350 mg % menjadi 520 mg % dan meningkatkan kekuatan gel dari 400 g menjadi 489 g, artinya sama dengan meningkatkan nilai pelipatan (folding score) (Peranginangin et al. 1999).
Cryoprotectant adalah bahan yang biasa ditambahkan dalam pembuatan
surimi yang tidak langsung diolah menjadi produk lanjutan, melainkan akan disimpan terlebih dahulu pada suhu beku dalam waktu yang lama. Fungsi
cryoprotectant adalah sebagai zat antidenaturasi. Penyimpanan surimi dalam waktu yang lama bertujuan untuk menjaga stok daging ikan di pasaran. Penambahan cryoprotectant dalam pembuatan surimi dapat mencegah denaturasi protein selama masa pembekuan (Nielsen dan Piegott 1994). Sukrosa dan sorbitol sering digunakan bersamaan dengan 0,3 % sodium tripolifosfat, masing-masing dengan konsentrasi 4 % dan 4-5 % (Pipattasatayanuwong et al. 1995).
Polifosfat akan memisahkan aktomiosin dan berikatan dengan miosin. Miosin dan polifosfat akan berikatan dengan air dan menahan mineral dan vitamin. Pada proses pemasakan, miosin akan membentuk gel dan polifosfat membantu menahan air dengan menutup pori-pori mikroskopis dan kapiler. Polifosfat dapat menambah nilai kelembutan dan memperbaiki sifat surimi, terutama sifat elastisitas dan kelembutan. Polifosfat dapat memperbaiki daya ikat air (water holding capacity) dan memberikan sifat pasta yang lebih lembut pada produk-produk olahan surimi (Peranginangin et al. 1999). Matsumoto dan Noguchi (1992) melaporkan dari beberapa studi bahwa aktivitas utama polifosfat
adalah untuk meningkatkan efek cryoprotective dari gula, dengan efek buffer dari polifosfat pada pH otot dan dengan mengkelatkan ion metal.
Nielsen dan Piegott (1994) menyatakan bahwa gula mempunyai grup polihidroksi yang dapat bereaksi dengan molekul air oleh ikatan hidrogen, sehingga dapat meningkatkan tegangan permukaan dan mencegah keluarnya molekul air dari protein dan stabilitas protein tetap terjaga. Dalam pembuatan surimi digunakan sukrosa sebagai pelindung protein karena dapat mencegah denaturasi protein selama masa pembekuan.
2.5.4 Mekanisme pembentukan gel
Ada empat tipe ikatan utama yang berkontribusi terhadap pembentukan struktur jaringan selama proses gelasi dari pasta surimi yaitu ikatan garam, ikatan hidrogen, ikatan disulfida dan interaksi hidrofobik. Asam-asam amino tirosin, serin, hidroksiprolin dan treonin tergabung dalam grup hidroksil dan prolin serta hidroksiprolin yang tergabung dalam grup imino, keduanya bertindak sebagai donor dan akseptor proton, sedangkan glutamin dan aspargin yang keduanya mengandung grup karbonil bertindak sebagai akseptor proton. Ikatan intermolekul hidrogen terbentuk diantara grup imino dan karbonil. Ikatan garam bertanggung jawab terhadap peningkatan energi yang memisahkan molekul air. Ikatan hidrogen akan melemah ketika dipanaskan (Niwa 1992).
Menurut Hudson (1992), proses gelasi terbagi menjadi tiga bagian yang diawali dengan proses denaturasi protein utuh dari bentuk berlipat menjadi tidak berlipat. Tahap pertama adalah pembentukan turbiditas yang terjadi pada 3-10 menit pemanasan pertama. Pada tahap ini terjadi interaksi hidrofobik. Menurut Niwa (1992), ketika suhu naik, maka ikatan hidrogen menjadi tidak stabil dan interaksi hidrofobik akan berlangsung lebih kuat. Pembentukan interaksi hidrofobik diketahui sebagai akibat keberadaan beberapa poliol dan asam amino, seperti gliserin, sukrosa, sorbitol, asam glutamat dan lisin. Interaksi hidrofobik terjadi ketika tahap inkubasi surimi pada suhu mendekati 40 ºC. Menurut Jaczynski dan Park (2004), interaksi hidrofobik berfungsi untuk melepaskan energi bebas yang dapat menstabilisasikan sistem protein.
Tahap kedua adalah oksidasi sulfhidril. Pada tahap ini pasta surimi akan mengeras, dimana ikatan intermolekul disulfida (SS) terbentuk melalui oksidasi dari dua residu sistein. Ikatan disulfida lebih intensif terjadi pada suhu pemanasan yang lebih tinggi (di atas 80 ºC) (Niwa 1992). Tahap ketiga adalah peningkatan elastisitas gel yang terjadi ketika pendinginan. Peningkatan elastisitas ini terjadi karena pembentukan ikatan hidrogen kembali yang menyebabkan peningkatan terhadap kekerasan gel (Hudson 1992).
Apabila daging ikan mentah digiling dan dilakukan penambahan garam, maka miosin (aktomiosin, miosin dan aktin) akan larut dalam larutan garam, larutan yang keluar dari daging ikan akan membentuk “sol” yang sangat adhesif. Jika “sol” dipanaskan akan terbentuk “gel” dengan konstruksi jaringan seperti jala dan memberikan sifat elastis pada daging ikan. Daging ikan yang terkoagulasi karena panas ini disebut pasta ikan (kamoboko). Sifat elastis pasta ikan disebut “ashi”. Kekuatan “ashi” berbeda untuk setiap jenis ikan dan penambahan berbagai faktor (Tanikawa 1985).
Tanikawa (1985) menyatakan bahwa bila daging ikan giling yang ditambahkan garam (untuk melarutkan miosin) dibiarkan pada suhu kamar tanpa pemanasan, maka daging ikan giling tersebut akan menjadi jelly yang elastis tetapi kehilangan daya rekatnya. Fenomena seperti ini disebut “suwari” (setting). Fenomena “suwari” ini disebabkan oleh perubahan formasi konstruksi jaringan seperti pada fenomena “ashi”. Lanier (1992) menyatakan bahwa setting time
adalah waktu yang diperlukan untuk membentuk gel sejak ditambahkan bahan-bahan pembentuk gel. Kecepatan pembentukan gel mempengaruhi mutu gel. Bila gel telah terbentuk sebelum penambahan komponen, maka akan terbentuk gel yang tidak rata. Setting dapat terjadi pada suhu rendah, sedang dan tinggi. Setting
pada suhu rendah terjadi pada suhu 0-4 ºC (selama 12-18 jam), pada suhu sedang (25 ºC) selama 3 jam atau pada suhu 40 ºC selama 30 menit. Setting pada suhu tinggi akan menghasilkan gel yang memiliki tekstur yang kuat jika dibandingkan dengan pemasakan langsung dalam keadaan mentah. Suwari dapat terjadi dengan cepat, atau dapat lambat atau bahkan tidak terjadi sama sekali tergantung pada spesies ikan.
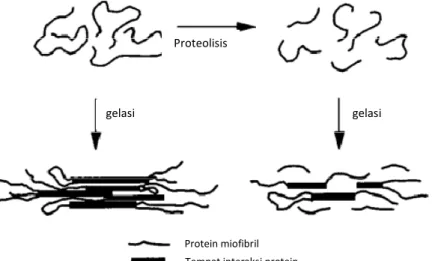
Lebih lanjut Tanikawa (1985) melaporkan bahwa konstruksi jala dapat terbentuk dari konjugasi molekul-molekul protein yang diikat oleh suatu jembatan seperti garam, atau ikatan antara karbonil dengan radikal amino pada peptida oleh hidrogen atau oleh radikal disulfida yang terbentuk dari radikal sulfhidril. Apabila pasta ikan dibiarkan pada suhu kamar dalam waktu lama, maka sifat elastis akan hilang dan daging menjadi mudah patah dan fenomena ini dikenal dengan modori. Fenomena modori ini juga dapat terjadi apabila daging dipanaskan pada suhu rendah dalam jangka waktu lama. Pembentukan gel surimi dan proteolisis protein miofibril ditunjukkan pada Gambar 3.
Sumber: Venugopal (2005)
Gambar 3. Pembentukan gel surimi dan proteolisis protein miofibril
Proteolisis
Protein miofibril Tempat interaksi protein
gelasi gelasi