LAPORAN TETAP
PRAKTIKUM KIMIA ANORGANIK 1
I. NOMOR PERCOBAAN : 1
II. TANGGAL PRAKTIKUM : 25 Agustus 2015
III. JUDUL PERCOBAAN : STRUKTUR ATOM
IV. TUJUAN
Tujuan Umum
Mahasiswa memahami struktur atom hidrogen model Bohr.
Tujuan Khusus
1. Diberikan model diagram tingkat energi, mahasiswa dapat menggambarkan transisi (elektronik) emisi.
2. Atas diagram tingkat energy, mahasiswa dapat menuliskan rumusan yang menyatakan hubungan antara suatu transisi emisi dengan perbedaan antara dua transisi emisi yang lain.
3. Diberikan data panjang gelombang (λ) ketiga deret Lyman, Balmer, dan Paschen, mahasiswa dapat mengidentifikasi ada tidaknya hubungan yang bermakna (a) antar data numerik λ dan (b) antar data numeric perbedaan λ.
4. Diberikan rumusan hubungan antara panjang gelombang λ, dengan bilangan gelombang, v, mahasiswa dapat mengubah data numerik λ menjadi v.
5. Dengan data numerik bilangan gelombang mahasiswa dapat menarik kesimpulan bahwa setiap perbedaan bilangan gelombang (∆v) terhadap v terpendek dalam suatu deret merupakan anggota v bagi deret berikutnya.
6. Dengan data numerik bilangan gelombang, v , mahasiswa dapat menarik kesimpulan bahwa numerik perbedaan bilangan gelombang (∆v) setiap dua garis spektrum terdekat dalam suatu deret muncul kembali sebagai perbedaan yang sama dalam deret berikutnya.
8. Atas dasar data v dan bilangan kuantum n yang sesuai, mahasiswa
dapat melukiskan grafik hubungan antara v dengan 1/n2 untuk deret
(a) Lyman, (b) Balmer, dan (c) Paschen.
9. Atas dasar grafik hubungan antara v dengan 1/n2 untuk setiap deret,
mahasiswa dapat membandingkan nilai titik-titik ekstrapolasi (n= ) dengan v terpendek batas yang teramati bagi masing-masing deret Lyman, Balmer, dan Paschen.
10. Atas dasar data v bagi ketiga deret Lyman, Balmer, dan Paschen,
mahasiswa dapat menghitung tingkatan energi rerata, E1, E2, E3, …,
E, untuk atom hidrogen dan kemudian melukiskan secara kuantitatif diagram transisi emisi atom hidrogen untuk ketiga deret Lyman, Balmer, dan Paschen.
11. Atas dasar perhitungan energi transisi emisi, mahasiswa dapat memperoleh rumusan untuk tetapan Rydberg dan energi ionisasi bagi atom hidrogen.
V. DASAR TEORI
Atom merupakan partikel paling kecil yang masih mempunyai sifat
unsur. Menurut para ahli fisika, jari-jari atom sekitar 3-5 nm (1 nm = 10-9
meter ). Sampai sekarang belum ada alat yang dapat memperbesar atom sehingga dapat diamati secara jelas. Walaupun atom tidak tidak dapat dilihat dengan jelas, para ahli dapat membuat perkiraan gambaran mengenai aom berdasarkan data eksperimen dan kajian teoritis yang dilakukannya. Perkiraan tentang gambaran atom tersebut dinamakan model atom. Itulah sebabnya mengapa model atom telah beberapa kali mengalami perubahan sesuai dengan perkembangan ilmu pengetahuan.
negatif dan merupakan ion. Atom dikelompokkan berdasarkan jumlah proton dan neutron pada inti atom tersebut. Jumlah proton pada atom menentukan unsur kimia atom tersebut, dan jumlah neutron menentukan isotop unsur tersebut.
Radiasi dari suatu atom dapat digolongkan ke dalam spektra kontinu dan spektra diskret (garis). Pada spektra kontinu, terdapat hampir semua panjang gelombang mulai dari mendekati nol sampai mendekati tak hingga. Contoh spektra kontinu adalah radiasi yang dihasilkan dari logam yang dipijarkan.
Umumnya, spektra garis yang ditimbulkan oleh atom-atom kompleks sangat rumit, sehingga pembahasan lebih diarahkan pada spektrum atom hidrogen yang paling sederhana. Spektrum hidrogen sangat sederhana sebab dihasilkan dari atom dengan satu elektron. Jika tabung berisi gas atau uap dari unsur tertentu seperti raksa, natrium, atau neon dialiri listrik bertegangan tinggi, maka cahaya akan dipancarkan pada beberapa panjang gelombang diskret membentuk garis spektra yang dihasilkan dari uap natrium sangat pada 590 nm.
Untuk menjelaskan garis-garis spektra yang ditimbulkan oleh atom dapat diterapkan metode ilmiah terbaik. Metode ilmiah terbaik dapat dipakai apabila tidak ada teori yang dapat menerangkan data, maka dicoba menemukan fungsi yang cocok dengan data, dan selanjutnya mencoba menyusun teori yang daapat menerangkan fungsi itu,. Seorang guru sekolah bernama Johannes balmer mencatat bahwa panjang gelombang kelompok garis-garis yang dipancarkan atom hidrogen dalam daerah tampak sangat cocok dengan rumus berikut ini.
Dengan lamda adalah panjang gelombang (dalam nm) dan n adalah bilangan bulat di mulai dari n+3. Contoh : untuk n=3 , lamda = 656,1 nm. Rumusan ini sekarang dikenal sebagai rumus Balmer dan deret garis yang cocok dinamakan deret Balmer. Panjang gelombang 364,5 nm berhubungan dengan n → ∞ dinamakan limit deret.
n adalah bilangan bulat dari n0+1, yaitu untuk : n0=1 dinamakan deret
lyman ; n0=4 , deret Brackett dan n0=5 deret fund.
Atom hidrogen merupakan atom atom yang paling sederhana, hanya tersusun oleh satu proton dan satu elektron. Karena spektrum atom bersifat khas bagi atom yang bersangkutan, adalah beralasan jika muncul dugaan adanya hubungan yang mendasar antara spektrum atom dengan distribusi elektron di sekeliling inti atom hidrogen yang merupakan suatu langkah awal yang paling fundamental dalam usaha elusidasi struktur elektronik suatu atom. Spektrum emisi atom hidrogen bebas dalam keadaan tereksitasi terdiri atas garis-garis spektrum yaitu satu set dalam daerah uv (ultra violet), satu set dalam daerah tampak (visible, artinya tampak oleh mata manusia) dan beberapa set dalam inframerah (IR, infrared) dari spektrum elektromagnetik seperti ditunjukkan oleh gambar berikut. Spektrum ini diperoleh jika cahaya pucat kebiruan dari gas hidrogen yang dipijarkan (artinya teratomisasi) dilewatkan pada sebuah prisma gelas.
Bertahun-tahun para ilmuwan berusaha mendapatkan suatu pola formula yang melukiskan hubungan antar panjang gelombang garis-garis spektrum atom hidrogen dan akhirnya pada tahun 1885 J. Balmer (Swiss) berhasil menunjukkan bahwa grafik hubungan antara frekuensi (v) dengan
1/n2 ternyata berupa garis lurus. Balmer juga meramalkan adanya sejumlah
garis-garis spektrum yang pada waktu itu belum ditemukan, garis-garis spektrum yang memenuhi persamaan disebut deret Balmer. Dalam kurun waktu kira-kira 40 tahun kemudian akhirnya ditemukan beberapa deret garis lain yang mirip dengan deret Balmer. Deret baru ini kemudian diberi nama sesuai dengan penemunya yaitu Lyman (1906) yang terpencar pada daerah ultraviolet , Paschen (1908) yang terpencar pada daerah inframerah-dekat, Brackett (1922) yang terpencar pada daerah inframerah dan deret Pfund (1923) yang terpencar pada daerah inframerah-jauh. Pada dasarnya, sebaran garis-garis cenderung konvergen dan melemah sejalan dengan makin pendeknya panjang gelombang atau naiknya energi.
VI. PROSEDUR PERCOBAAN
2. Kerjakan secara sama untuk energi transisi-emisi yang lain, yaitu (E4-E3), (E3-E2) dan (E4-E2).
3. Lengkapi tabel 1 kolom 2 dan 3 kemudian periksa dengan teliti dengan cermat. Ada atau tidak adakah suatu hubungan yang bermakna antara data numeric (λ dan atau ∆λ) satu terhadap yang lain baik dalam satu deret maupun dengan deret yang lain ?
4. Ubahlah data panjang gelombang (Tabel 1) menjadi data bilangan gelombang (sebenarnya dapat juga frekuensi) dan masukkan kedalam tabel 1-kolom5. Dua-tiga diantaranya untuk masing-masing deret telah dikerjakan.
5. Untuk menjawab atau menyelesaikan masalah tersebut, secara sama hitung harga setiap percobaan (∆v) antara garis terdekat tersebut, secara sama hitung harga setiap percobaan (∆v) antara garis terdekat bagi masing-masing deret, kemudian selidikilah hubungannya dengan nilai v bagi deret yang lain. Demikian juga hitung harga setiap (∆v) terhadap vterpendek bagi masing-masing
deret.
6. Untuk menjawab atau menyelesaikan masalah tersebut gunakan data tabel 1 kolom 6 untuk mengidentifikasi hubungan numeric dalam satu deret dengan deret lain.
7. (7a) Tidak peduli besarnya E1 (tingkat energi terendah tempat berakhirnya transisi elektronik), secara sama diperoleh :
Ec-Ea=…..
Lebih informatif, hubungan-hubungan tersebut dapat disusun sebagai berikut :
Eb-Ea(deret 1) = Ed (deret II) Ec-Ea(deret 1) = Ee (deret II)
(7b) Oleh karena setiap harga E berbanding lurus terhadap v (maupun v) sebagaimana dirumuskan oleh Einstein tersebut, maka tentukanlah :
Vb-Va=…..? Vc-Va=…..?
(7c) Tambahan pula Diagram-2 menunjukan bahwa : Ec-Eb=………atau
Vc-Vb=……..
Hubungan ini tentulah berlaku umum, yaitu bahwa perbedaan bilangan gelombang , v, bagi setiap dua garis spektrum terdekat pada satu deret dapat dinyatakan oleh perbedaan tersebut pada deret lain, bila konsep Diagram-2 diperbanyak tingkat-tingkat energinya. Tidak diragukan lagi bahwa hal ini sesuai dengan data menurut tugas-6 atau Tabel 1 kolom
8. Gambar grafik hubungan antara v (sebagai ordinat) dan 1
n2 (sebagai absis)
a. Untuk deret Lyman:
n : 2,3,…,7,….; sesuai dengan v = L(1), L(2),…,L(6),…L( )
b. Untuk deret Balmer :
n : 3,4, …, 10,…., ; sesuai dengan v = B(1), B(2),…,B(8),…B( )
c. Untuk deret Paschen :
n : 4,5, …,9,…., ; sesuai dengan v = P(1), P(2),…,P(6),…P( )
sungguh ajaib bahwa ketiga grafik tersebut berupa garis lurus. Hal ini berarti bahwa v bagi L( ), B( ), dan P( ) tentulah
merupakan ekstrapolasi masing-masing garis tersebut pada
1
n2 = 0 (atau n= ).
9. (a) masukkan data diatas (E1-E) , ……, (E3-E), kedalam Tabel 2,
demikian juga untuk tingkatan energi yang lain hingga E10, dan
kemudian tentukan rata-rata masing-masing harga.
(b) tentukan kedudukan tiap-tiap energi tersebut (Tabel 2 kolom 5)
untuk E1 hingga E10 dalam suatu gambar dan kemudian lukiskan
dengan tanda anak panah diagram transisi emisi untuk ke tiga deret tersebut yang mencerminkan data Tabel 1.10 (1) Dengan data Tabel
2 (kolom 5), hitung nilai parameter E1−E
En−E untuk n=1-10,
kemudian masukkan hasilnya kedalam Tabel 2 kolom 6, dan tentukan pula nilai pembulatannya (kolom 7).
10. Selidiki numeri-numerik tersebut adakah hubungan tertentu antara
bilangan kuantum n dengan parameter EEn1−E
nyatakan hubungan ini; selanjutnya dapatkan harga tetapan tertentu (sebagai tetapan Rayberg) !
11. Hitung energi ionisasi atom hidrogen, dan tentukan dua tingkatan
energi manakah yang terlibat (1cm-1=11,9566 J.mol-1)
VII. HASIL PENGAMATAN
1. Tugas 1 : Melengkapi diagram transisi elektronik emisi :
Energi, E
E4
E3
E2
E1
Diagram 1. Transisi (elektronik) emisi
2. Tugas 2
Energi transisi emisi pada pada Diagram 1, yaitu : E4-E3 = (E4-E1) – (E3-E1)
Atau = (E4-E2) – (E4-E2)
E3-E2 = (E3-E1) – (E2-E1)
Atau = (E4-E1) – (E4-E1)
E4-E2 = (E4-E1) – (E2-E1)
Atau = (E5-E1) – (E3-E1)
3. Tugas 3
Lingkari dan atau lengkapi jawaban yang benar berikut ini.
Data numerik λ dan ∆λ pada Tabel 1 kolom 2 dan 3 ternyata :
b. Menunjukkan adanya hubungan yang bermakna yaitu bahwa : Angka 18,995 pada data numerik ∆λ pada tabel 1 kolom 1 diperoleh dengan mengurangkan data numerik λ pada kolom 2 yaitu 121.567-102.572 ( L(1)-L(2)).
4. Tugas 4 : Melengkapi Tabel 1 kolom 5, yaitu data ṽ
Tabel 1. Data panjang gelombang spektrum garis atom hidrogen .
∆λ / (nm) Deret λ / (nm) V / cm-1 V / cm-1
λ 1 – λn λn – λ(n+1) V (n+1) – v
n Vn-V1 Deret Lyman 13677 3038 1086 489 18.995 5.318 2280 1194 705 L(1) L(2) L(3) L(4) L(5) L(6)
L( )
121.567 102.572 97.254 94.974 93.780 93.075 82259 97492 102823 105291 106632 107440 109679 15233 5331 2468 1341 808 15233 20564 23032 24373 25181 Deret Balmer 118059 28213 10706 5065 2736 1617 170.145 52.086 23873 13167 8102 5366 7349 B(1) B(2) B(3) B(4) B(5) B(6) B(7) B(8)
B( )
405309 99125 38530 18646 593305 187996 88871 50341 31695 P(1) P(2) P(3) P(4) P(5) P(6)
P( )
1875.110 1281.80 5 1093.89 1004.93 8 954.597 922.902 5333 7801 9142 9950 10475 10835 12190 2468 1341 808 525 360 2468 3809 4617 5142 5502
5. Tugas 5 :
(a) Melengkapi Tabel 1 kolom 6.
(b) Hubungan antara ∆ (terhadap ṽ ṽterpendek) dalam satu deret (Tabel
1 kolom 7) dengan sebagai anggota deret lain yang lebihṽ
rendah ( Tabel 1 kolom 5) yaitu sebagai berikut :
B(1) = L(2)-L(1), sebab:97492-82259 = 15233 B(1) = 15237
B(2) = L(3)-L(1), sebab:102823-82259 = 20564 B(2) = 20570
B(3) = L(4)-L(1), sebab:105291-82259 = 23032 B(3) = 23038
B(4) = L(5)-L(1), sebab:106632-82259 = 24373 B(4) = 24379
P(1) = L(3)-L(2), sebab:102823-97492 = 5331 P(1) = 5333
Juga= B(2)-B(1), sebab:20571-15237 = 5334 P(1) = 5333
P(2) = L(4)-L(2), sebab:105291-97492 = 7799 P(2) = 7801
=B(3)-B(1), sebab:23038 - 15237 = 7801 P(2) = 7801
P(3) = L(5)-L(2), sebab:106632-97492 = 9140 P(3) = 9142
=B(4)-B(1), sebab:24379 - 15237 = 9142 P(3) = 9142
P(4) = L(6)-L(2), sebab:107440-97492 = 9948 P(4) = 9950
=B(5)-B(1), sebab:25188 - 15237 = 9951 P(4) = 9950
P(5) = L( )-L( ), sebab:…….. - …….. = …… P(5) = 10476
=B(6)-B1 ), sebab:25713 - 15237 = 10476P(5) = 10476
P(6) = L( )-L( ), sebab:……..-………. = …… P(6) = 10835
=B(7)-B(1), sebab:26072 - 15237 = 10835P(6) = 10835
Jadi secara umum : B(n) = L(n+1) – L (1), dan
P(n) = L(n+2) – L (2)
= B(n+1) – B (1)
6. Tugas-6
b. Hubungan ∆ untuk setiap garis spektrum terdekat antaraṽ
masing-masing deret dapat diperoleh melalui perhitungan-perhitungan berikut.
L(3)-L(2) = B(2) - B(1)
L(4)-L(3) = B(3) - B(2) =P(2) - P(1)
L(4)-L(3) = B(4 ) - B(3) =P(3) - P(2)
L(4)-L(3) = B(5) - B(4) =P(4) - P(3)
= B(6) - B(5) =P(5) - P(4)
= B(7) - B(6) =P(6) - P(5)
Jadi, secara umum diperoleh hubungan : L(n+2) – L(n+1) = B(n+1) – B(n) = P(n) – P(n-1)
7. Tugas-7 Energi E
Deret 1 deret II
E4
E3
∆Eb ∆Ec ∆Ed ∆Ee E2
∆Ea E1
Diagram-2. Transisi (elektronik) emisi
Hubungan perbedaan tingkat energi menurut Diagram 2 yaitu : (a) ∆Eb-∆Ea = (E3-E1) – (E2-E1) = ∆Ed
∆Ec-∆Ea = (E4-E1) – (E2-E1) = ∆Ee
(b) Deret I Deret II
Vb - Va = ∆Vd
Vc - Va = ∆Ve
(c) Deret I Deret II
Vc - Vb = ∆Ef
Vc - Vb = ∆Vf Simpulan
(1) Hubungan antara ∆v antara dua garis terdekat dalam suatu deret
dengan bagi deret yang lain yaitu bahwa : Perbedaan bilanganṽ
gelombang ∆ bagi setiap dua garis spektrum terdekat padaṽ
satu deret dapat dinyatakan oleh perbedaan pada deret lain. (2) Hubungan ∆v antar deret (tugas 6) dengan Diagram 2 yaitu
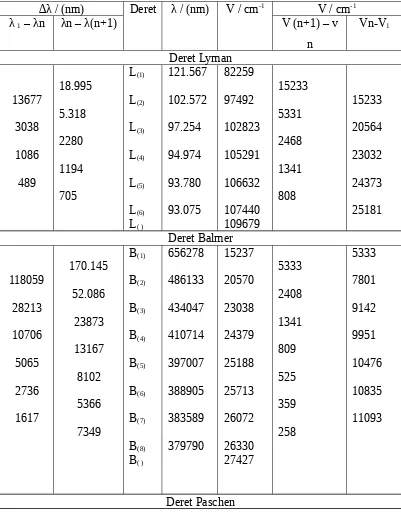
8. Tugas-8 : Grafik hubungan antara dengan ṽ n12 untuk deret
Lyman, Balmer, dan Paschen, dapat dilukiskan sebagai berikut :
Grafik hubungan antara dengan ṽ 1
n2 untuk deret Lyman
/10
ṽ 3 cm-1
0 0.05 0.1 0.15 0.2 0.25 0.3 80
85 90 95 100 105 110 115 120
Y-Values
a. Persamaaan garis lurus : y = ax + b
b. Titik ekstrapolasi, L∞= 82259 cm-1
c. Harga batas deret, L∞= 109679 cm-1
Grafik hubungan antara v dengan 1/n2 untuk deret Balmer
V / 103 cm-1
0 0.02 0.04 0.06 0.08 0.1 0.12 14
16 18 20 22 24 26 28
Y-Values
a. Persamaan garis lurus : y = ax+b
b. Titik ekstrapolasi, B∞= 15237 cm-1
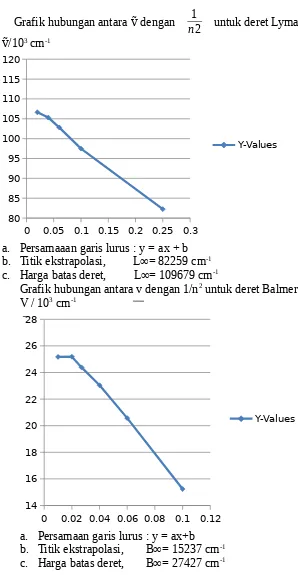
Grafik hubungan antara v dengan 1/n2 untuk deret Paschen
V / 103 cm-1
0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0
2 4 6 8 10 12
Y-Values
a. Persamaan garis lurus : y = ax+b
b. Titik ekstrapolasi, P∞= 53330 cm-1
c. Harga batas deret, P∞= 12190 cm-1
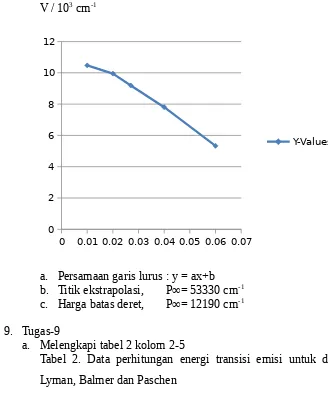
9. Tugas-9
a. Melengkapi tabel 2 kolom 2-5
Tabel 2. Data perhitungan energi transisi emisi untuk deret Lyman, Balmer dan Paschen
n
(En-E)/cm-1 untuk Nilai
Dari garis Lyman
Dari garis Balmer
Dari garis Paschen
Numerik rerata
E1−E En−E
Dan Pembulatan
1 -109679 - - -109679 1 1
2 -27420 -27427 - -27673,5 3,99 4
3 -12187 -12190 -12190 -12189 8,99 9
4 -6855 -6856 -6857 -6856 15,99 16
5 -4387 -4388 -4389 -4388 24,99 25
6 -3046 -3047 -3049 -3047,3 35,99 36
7 - -2239 -2240 -2239,5 48,97 49
8 - -1714 -1715 -1714,5 63,97 64
9 - -1354 -1355 -1354,5 80,97 81
b. Diagram transisi (elektronik) emisi untuk deret Lyman, Balmer, dan Paschen secara kuantitatif menurut data tabel 2 kolom 5 dapat dilukiskan sebagai berikut.
E/103 cm-1
(E∞) 0,00 -15,00
-30,00
-60,00
-90,00
-120,00
Deret Lyman Deret Balmer Deret Paschen
10. Tugas-10 : Melengkapi tabel 2 kolom 6 dan 7 Dari data tersebut ternyata diperoleh rumusan bahwa :
E1−E En−E
¿
=E1 – E dimana n .=1,2,3,4…
Atau −109679Cm
−1
109679 = E-En
Harga konstan, 16-36 cm-1, inilah yang disebut sebagai tetapan Rydberg
yang sering diberi notasi RH, sehingga hubungan tersebut dapat ditulis
ulang sebagai berikut :
a. RH
h(n)2=E−En demikian juga
b. RH
h(n)2=E−Em
Maka gabungan (a) dan (b) menghasilkan : RH(E - E) - Em-En, tu lebih
informatif dinyatakan dalam bentuk hubungan (Rumus Ritz):
= R
ṽ H (Em – En) dimana Em > En
selanjutnya untuk bilangan-bilangan diskrit ini ada hubungannya dengan nama deret sebagai berikut:
1 2,3,4,5,6,7 Lyman
2 3,4,5,6,7,8,9,10 Balmer
3 4,5,6,7,8,9 Pascen
Tugas-11
Energi ionitas atom hidrogen yaitu energy yang dibutuhkan untuk mengeluarkan elektron dari tingkat energy dasar n = 1 untuk atom
hidrogen ketingkat energy tidak terhingga besarnya yaitu 98,990 cm-1
atau 1195,42 . 10-3 kj. Mol-1 (1 cm-1 = 11,9566 J. mol-1)
Adapun dua tingkat energy yang terlibat yaitu : 1 dan 10.
VIII. PEMBAHASAN
Konsep atom pertama kali dinyatakan oleh filsuf Yunani Democritus pada abad ke-5 masehi, yang mengungkapkan keyakinannya bahwa semua materi terdiri dari atas partikel yang sangat kecil dan tidak dapat dibagi lagi, yang ia namakan atomos. Bukti percobaan yang diperbolehkan dari penyelidikan ilmiah pada waktu itu mendukung konsep atomisme dan menghasilkan definisi modern tentang unsur dan senyawa. Teori ini didukung oleh seorang ilmuwan Inggris, John Dalton yang presisi tentang blok penyusun materi yang tidak dapat dibagi lagi yang disebut atom.
dari zat yang memancarkan sinar dengan gelombang tertentu, dan tampak berupa garis-garis terpisah, seperti spektrum hidrogen. Spektrum arbsorpsi adalah spektrum sinar yang pada bagian-bagian tertentu tidak terisi atau kosong. Spektrum ini dapat terjadi bila seberkas cahaya yang mengandung berbagai panjang gelombang dilewatkan kedalam zat yang hanya menyerap beberapa gelombang dengan panjang tertentu.
Atom hidrogen merupakan unsur yang mempunyai satu elektron sehingga spektrumnya paling sederhana dibandingkan spektrum unsur yang lain. Pada daerah sinar tampak terdapat empat garis dengan masing-masing 410,432,486 dan 656 nm. Dan juga terdapat garis-garis didaerah UV dan IR. Garis-garis yang berdekatan disebut deret, yaitu : deret Lyman, deret Balmer, Paschen, Brackett, dan Pfund. Pancaran radiasi dari atom berenergi, dapat dihubungkan dengan jatuhnya elektron dari orbit berenergi tinggi keorbit yang berenergi lebih rendah, dan memberikan satu kuantum energy (foton) dalam bentuk cahaya. Dengan menggunakan argumen yang didasarkan interaksi elektrostatik dan hokum Newton tentang gerak, Bohr menunjukkan bahwa elektron dalam atom hidrogen dapat memiliki energy yang diperoleh dari rumus.
Proses pemancaran dalam atom hidrogen yang tereksitasi, menurut Bohr sebuah elektron yang awalnya dalam orbit dengan energi lebih tinggi (n=3) jatuh kembali ke orbit berenergi lebih rendah (n=2). Akibatnya, foton dengan energi hv dilepaskan.
Dimana adalah konstanta Rydberg (2,18x10-18 J), n adalah bilangan
kuantum utama (n=1,2,3,…) Tanda negatif menunjukkan bahwa energi elektron dalam atom lebih rendah dari energi elektron bebas, atom elektron yang berada pada jarak tak hingga dari inti atom. Semakin dekat elektron ke inti (semakin kecil nilai n), En menjadi lebih besar dalam nilai mutlaknya, tetapi juga semakin negatif. Nilai paling negatif didapat bila n=1, yang berkaitan dengan orbit yang paling stabil.
Kestabilan elektron berkurang untuk n=2,3,… dan keadaan ini disebut keadaan tereksitasi yakni keadaan berenergi lebih tinggi dari keadaan dasar. Elektron dalam hidrogen yang menempati orbit dengan n lebih besar dari 1 disebut dalam keadaan tereksitasi. Jari-jari tiap orbit melingkar bergantung
meningkat dengan cepat. Semakin tinggi keadaan tereksitasi, semakin jauh
elektron dari inti (semakin lemah elektron diikat oleh inti). Nilai n1 dan n2
didapat dari perhitungan semat dan bukan dari hokum atau teori, maka persamaan Rydberg disebut persamaan empiris. Dan jumlah garis tiap deret selalu kurang satu dari deret sebelumnya.
Bohr mempertahankan beberapa ciri model planet arti ia membayangkan atom sebagai suatu inti positif yang dikitari oleh satu elektron atau lebih yang bergerak dalam suatu lintasan bulat tertentu. Namun ia melontarkan dua pengandaian umum yang diterapkan pada atom-atom meskipun prilaku semacam itu tidak dikenal dalam sistem skala besar. Pengandaian ini diringkaskan sebagai berikut :
a. Selama sebuah elektron tetap tinggal dalam lintasannya, atau keadaan stasioner, elektron itu tidak bertambah ataupun berkurang energinya. b. Bila sebuah elektron meloncat dari satu lintasan (keadaan stasioner)
kelintasan yang lain, maka transisi semacam itu disertai dengan penyerapan atau pemancaran sejumlah tertentu energi yang sama dengan selisih energi antara kedua keadaan transisi itu.
Keadaan-keadaan stasioner, atau tingkat energi, yang biasanya dihuni oleh elektron, ialah keadaan yang berenergi relatif rendah, yang
disebut keadaan dasar. Bila atom itu dinaikkan temperaturnya, atau
dieksitasi dengan cara-cara lain, seperti dalam busur listrik, maka elektron-elektron, terutama yang terletak diluar dalam atom-atom tereksitasi, menyerap energi dan dipaksa meloncat ketingkatan dengan energi yang
lebih tinggi, yang disebut keadaan eksitasi. Bila suatu elektron tereksitasi
jatuh kembali ke tingkatan energi yang rendah, akan dipancarkan sejumlah tertentu energi radiasi, dan jumlah energi ini akan menentukan panjang gelombang dari radiasi yang dipancarkan itu.
IX. KESIMPULAN
1. Atom merupakan partikel yang sangat kecil.
3. Model atom Bohr menunjukkan bahwa elektron-elektron didalam atom berada didalam garis-garis lingkaran (orbit) dengan tingkat energi yang berbeda mengelilingi inti.
4. Model atom mekanika gelombang (model atom modern) menyatakan bahwa elektron tidak dapat dipastikan keberadaannya, hanya dapat ditentukan kebolehjadian terbesar elektron (orbital).
5. Konfigurasi elektron, yaitu penyebaran elektron dalam orbital-orbital atom. Pengisian orbital tersebut mengikuti aturan yang disebut prinsip aufbau dimana elektron-elektron dalam atom sedapat mungkin memiliki energi terendah.
6. Data numerik λ dan ∆λ pada tabel 1 kolom 2 dan 3 tidak menunjukkan adanya hubungan yang jelas dalam satu deret maupun antar deret. 7. Hubungan antara ∆ antara dua garis terdekat dalam suatu deretṽ
dengan bagi deret yang lain yaitu bahwa: perbedaan bilanganṽ
gelombang ∆ bagi, setiap dua garis spektrum terdekat pada suatuṽ
deret dapat dinyatakan oleh perbedaan pada deret lain.
8. Hubungan ∆ antar deret (tugas 6) dengan Diagram 2 yaitu bahwa :ṽ
DAFTAR PUSTAKA
Anonim.2014.Struktur Atom. http://id.wikipedia.org/wiki/struktur_atom.html diakses tanggal 02 September 2015
M.Hadeli L.2014.Petunjuk Praktikum Kimia Anorganik 1.Indralaya:Unsri.
Winarto,Dwi.2013.Spektrum Atom Hidrogen.