JURNAL PRAKTIKUM
KIMIA ANORGANIK 2
“ Pembuatan Kompleks Cu ”
Tanggal Praktikum : 24 April 2014
DISUSUN OLEH :
RIZKY HARRY SETIAWAN
1112016200069
PROGRAM STUDI PENDIDIKAN KIMIA
JURUSAN PENDIDIKAN ILMU PENGETAHUAN ALAM
FAKULTAS ILMU TARBIYAH DAN KEGURUAN
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PEMBUATAN KOMPLEKS Cu
Oleh : Rizky Harry Setiawan (1112016200069)
Program Studi Pendidikan Kimia, Fakultas Ilmu Tarbiyah dan Keguruan, Universitas Islam Negeri Syarif Hidayatullah Jakarta, Jl. Ir. H. Juanda no. 95 Ciputat 15412
Tujuan :membuat Kompleks Cu dengan cara pembuatan garam cupri ammonium sulfat dan kedua pembuatan garam tetraamina coper (II) sulfat monohidrat..
ABSTRAK
Telah dilakukan percobaan pembuatan Kompleks Cu dengan Pembuatan garam cupri amonium Sulfat dan garam tetraamintembaga(II)sulfat monohidrat dengan menggunakan metode pemanasan serta menggunakan beberapa bahan antara lain 4.9 gram CuSO4 pentahidrat, 2.6
gram aluminium sulfat, dilarutkan dengan , aquades 100ml sementara pembuatan garam tetraamintembaga (II)sulfat monohidrat menggunakan 8 ml amoniak 15M, a ir 5 ml, 4. 3 gram CuSO4, ethanol. Didapatkan larutan berwarna biru dan larutan putih tanpa Kristal. Pada
praktikum kali ini praktikan dianggap gagal dalam praktikum karena tidak dapat
menghasilkan garam atau Kristal pada kedua percobaan.
.
INTRODUCTION
Suatu ion (atau molekul) kompleks terdiri dari satu atom ion pusat dan sejumlah ligan yang terikat erat dengan atom ion pusat itu. Atom pusat ini ditandai oleh bilangan koordinasi, bilangan koordinasi menyatakan jumlah ruang yang tersedia sekitar atom atau ion pusat dalam apa yang disebut bulatan koordinasi, yang masing masingnya dapat dihuni satu ligan (monodentat)( Vogel ,1985 : 95).
Logam tembaga merupakan logam merah muda yang lunak, dapat ditempa dan liat. Tembaga dapat melebur pada suhu 1038oC. Karena potensial elektrodanya positif (+ 0,34 V) untuk pasangan Cu / Cu2+ tembaga tidak larut dalam asam klorida dan asam sulfat encer, meskipun dengan adanya oksigen tembaga bisa larut sedikit (Vogel,1985: 229).
Garam-garam tembaga(II) umumnya berwarna biru, baik dalam bentuk hidrat, padat, maupun dalam larutan-air; warna ini benar-benar khas hanya untuk ion
tetraakuokuprat(II) [Cu(H2O)4]2+saja.Garam-garam tembaga(II) anhidrat, seperti tembaga(II) sulfat anhidrat CuSO4, berwarna putih (atau sedikit kuning) (Vogel,1985: 230).
Larutan ammonia bila ditambahkan dalam jumlah yang sangat sedikit maka akan terbentuk endapan biru suatu garam basa (tembaga sulfat basa):
2 Cu2+ + SO42-+ 2 NH3 + 2 H2O → Cu(OH)2.CuSO4 ↓ + 2NH4+
yang larut dalam reagensia berlebihan, pada mana terjadi warna biru tua, yang disebabkan oleh terbentuknya ion kompleks tetraaminokuprat(II)
Cu(OH)2.CuSO4 ↓ + 8 NH3 → 2 [Cu(NH3)4]2+ + SO42-+ 2 OH
-jika larutan mengandung garam ammonium (atau larutan itu sangat asam dan ammonia yang dipakai untuk menetralkannya sangat banyak) maka pengendapan tak terjadi-sama sekali, tetapi warna biru langsung terbentuk (Vogel, 1985 : 231).
Ion logam tembaga di alam digunakan dalam banyak reaksi-reaksi kimia termasuk penggunaan oksigen. Tembaga dapat dengan mudah mengalami reaksi redoks dengan satu elektron dan mampu menghasilkan sebuah kation donor π,Cu+, yang mana tidak radikal. Oleh karena itu, tembaga sangat penting dalam pengikatan dioksigen juga dalam aktivasidioksigen. Tingkat oksidasi Cu lebih tinggi tidak dapat dimanfaatkan, hanya tingkat oksidasi Cu+dan Cu2+yang penting dalam sistem biologi. Tembaga dalam metalloprotein dan metaloenzim memegang peranan dalam protein hanya melalui ligan rantai sampingnya (ligan donor N, O, atau S). Tembaga dalam sistem biologi muncul relatif lambat dalam evolusi darikehidupan. Dengan berjalannya waktu,organism menggabungkan tembaga dalam sistemnya, dengan telah mengembangkan sistem protein tersebut menjadi kompleks (Hidayati,2010pdf 1).
Tembaga(II) merupakan salah satu ion logam transisi deret pertama yang mempunyai orbital d yang terisi sebagian atau belum terisi penuh. Tembaga(II) mempunyai konfigurasi
electron 3d 9
MATERIALS & METHODS Materials
1) Gelas Ukur 1) Padatan CuSO4.5H2O
2) Gelas Kimia 100mL 2) Padatan Ammonium sulfat (NH4)2SO4
3) Pipet Tetes 3) Larutan NH3 15 M
4) Neraca Analitik 4) Larutan etanol
5) Corong gelas 5) Akuades
6) Statif 6) Es Batu
7) kertas saring 8) klem & Ring 9) Batang Pengaduk
10) Tang krus (Penjepit besi) 11) Kaca Arloji
A. Pembuatan Garam Cupri Ammonium Sulfat
1. Timbang padatan CuSO4.5H2O sebanyak 4,9 gram
2. Timbang padatan Ammonium sulfat (NH4)2SO4 sebanyak 2,6 gram
3. Larutkan kedua padatan yang sudah ditimbang tadi dengan akuades sebanyak 100 ml
4. Panaskan larutan tersebut secara perlahan sampai semua padatan larut sempurna
5. Letakkan larutan yang sudah dipanaskan tadi pada suhu ruangan hingga terbentuk
Kristal
6. Saring larutan yang sudah mengkristal tadi dan keringkan selama 15 menit (jangan lupa kertas saring di timbang terlebih dahulu)
B. Pembuatan Garam Tetraamina Coper(II) Sulfat Monohidrat
1. Masukkan larutan NH315 M sebanyak 8 ml kedalam gelas kimia
2. Tambahkan dengan akuades sebanyak 5 ml
3. Biarkan sampai larutan tersebut mengkristal
4. Timbang kristal CuSO4sebanyak 4,3 gram
5. Kristal tersebut masukkan ke dalam Kristal NH3
6. Tambahkan etanol sebanyak 8 ml pada Kristal-kristal tersebut secara perlahan lahan dan jangan di aduk, akan tetapi di goyang- goyang tutup kaca arlojinya
7. Dinginkan dengan es batu, lalu diamkan
8. Setelah didiamkan, lalu di aduk, maka nanti akan terbentuk kristal lagi
9. Setelah terbentuk Kristal lagi maka di pisahkan, dan cuci dengan NH3 sebanyak 5 ml, tambah cuci dengan etanol sebanyak 5 ml, tambah cuci lagi dengan etanol lagi 5 ml
10. Setelah itu saring Kristal tersebut (jangan lupa timbang kertas saringnya), lalu keringkan selama 15 menit dan kemudian di timbang Kristal tersebut.
RESULT & DISCUSSION
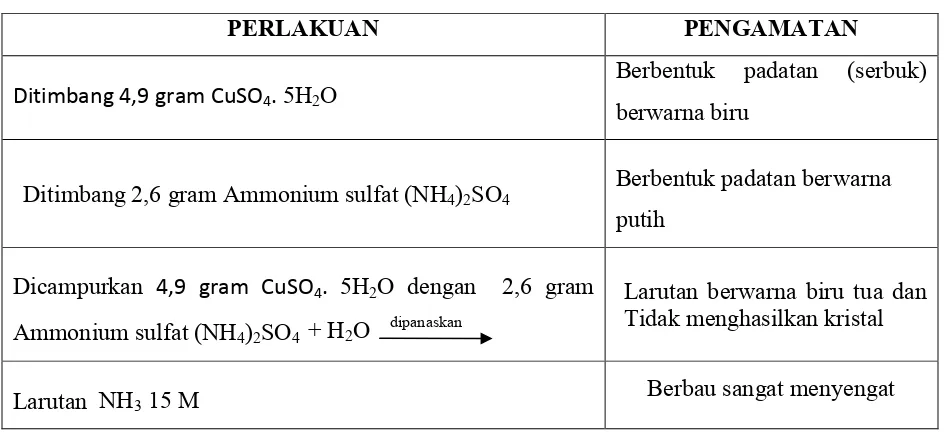
Tabel Hasil Pengamatan
PERLAKUAN PENGAMATAN
Ditimbang 4,9 gram CuSO4.5H2O
Berbentuk padatan (serbuk)
berwarna biru
Ditimbang 2,6 gram Ammonium sulfat (NH4)2SO4 Berbentuk padatan berwarna putih
Dicampurkan 4,9 gram CuSO4. 5H2O dengan 2,6 gram
Ammonium sulfat (NH4)2SO4 + H2O dipanaskan
Larutan berwarna biru tua dan Tidak menghasilkan kristal
Larutan NH315 M Berbau sangat menyengat
Persamaan Reaksi
CuSO4.5H2O(s)+ (NH4)2SO4 (s)+ H2O(l)
dipanaskan
[Cu(NH4)2(SO4)2] + 6 H2O(aq)
NH3 (aq)+ H2O(l) NH4OH(aq)
PEMBAHASAN
Percobaan dilakukan kali ini telah dilakukan percobaan mengenai pembuatan komplek Cu. Pembuatan kompleks Cu dibuat dengan melakukan dua langkah pembuatan garam yaitu pertama pembuatan garam cupri ammonium sulfat dan kedua pembuatan garam tetraamina coper (II) sulfat monohidrat.Pada langkah pembuatan garam pertama yaitu garam cupri ammonium sulfat, saat padatan 4,9 gram CuSO4.5H2O ditambah 2,6 gram padatan ammonium sulfat, lalu ditambah akuades dan dipanaskan maka yang terjadi larutan menjadi berwarna biru tua yang larut sempurna. Larutan yang berwarna biru tua ini menandakan bahwa di dalam larutan tersebut mengandung kompleks dari Cu, dimana pancaran warna dari larutan yang mengandung kompleks Cu akan menyerap warna lain dan memancarkan warna biru tua. Akan tetapi, setelah didiamkan selama 2 hari larutan ini tidak membentuk Kristal cupri ammonium sulfat, maka dari itu untuk percobaan kali ini praktikan dianggap gagal.
Meskipun dilakukan pemanasan sampai larutan setengahnya namun masih tidak dapat endapan diduga karena pada penambahan air yang lebih banyak sehingga mngganggu terbentuknya kompleks . Bilangan koordinasi untuk ion tembaga dalam [Cu(NH3)4]2+adalah 4. Kristal CuCl2. 6H2O dan kristal CuSO4. 5H2O adalah kristal yang berhidrat atau mengikat air,
sehingga jika dilarutkan dalam pelarut air akan menyebabkan kristal Cu2+ berhidrat menjadi lebih banyak dilingkupi oleh air (proses sulvasi), sehingga pembentukan senyawa kompleks Cu (II) akan sulit dan berlangsung lambat. Namun apabila kristal berhidrat tersebut dilarutkan dalam pelarut yang mengikat hidrat..
Pada langkah pembuatan garam kedua yaitu garam tetraamina coper(II) sulfat monohidrat, saat larutan amoniak yang sangat pekat yaitu dengna konsentrasi sebesar 15 M dimasukkan ke gelas kimia sebanyak 8 ml ditambah dengan akuades sebanyak 5 ml maka larutan akan berbau sangat menyengat larutan tidak beerwarna. Saat larutan ini di tunggu selama 2 hari juga, maka yang terjadi larutan tersebut tidak membentuk Kristal juga. Karena pada larutan ini tidak terbentuk Kristal juga dan pada percobaan pertama tidak membentuk Kristal juga dimana seharusnya Kristal yang didapat pada percobaan pertama tersebut akan dicampur dengan Kristal pada percobaan kedua ini, setelah itu kedua Kristal ini akan membentuk Kristal baru. Akan tetapi, pada percobaan ini praktikan dianggap gagal.
CONCLUSION
Berdasarkan hasil praktikum mengenai Pembuatan Kompleks Cu ,maka praktikan dapat menyimpulkan bahwa :
1) Dalam percobaan ini praktikan dianggap telah gagal dalam melakukan praktikum karena praktikan tidak berhasil membentuk Kristal pada semua percobaan.
2) Kegagalan percobaan kompleks Cu baik garam cupri ammonium Sulfat maupun tetraamin tembaga(II)sulfat monohidrat dikarenakan penambahan air yang
terlalu banyak dimana kristal Cu2+ berhidrat menjadi lebih banyak dilingkupi oleh air (proses sulvasi), sehingga pembentukan senyawa kompleks Cu (II) akan sulit dan berlangsung lambat.
3) Kristal yang seharusnya terbentuk pada percobaan pertama yaitu cupri ammonium sulfat [Cu(NH4)2(SO4)2].
REFERENSI
G .Svehla ,Vogel. 1985. Analisis Anorganik Kualitatif Makro dan Semimikro Bagian I Edisi ke Lima. Jakarta: PT.Kalman Media Pusaka.
Agustina,L.,dkk.2013.Sintesis dan Karakterisasi Senyawa Kompleks Cu(II)-8-Hidroksikuinolin
dan Co (II)-8-Hidroksikuinolin. .
http://download.portalgaruda.org/article.php?captcha=marrano&article=74285&val=4709& title=&yt0=Download%2FOpen.( Diakses pada tanggal 3 Mei 2014 Pukul 21:40 WIB)
Hidayati,Nurlisa.dkk.2010.Karakterisasi Kompleks Senyawa Cu (Ii) Glisin Dengan Menggunakan Spketrokopi U.V-Vis Dan Ft-Ir.http://fmipa.unmul.ac.id/pdf/103 (Diakses pada tanggal 3 Mei 2014 pada pukul 20:42 WIB.)
Suciningrum,Endah.2011.Sintesis Karakterisasi Kompleks Tembaga(II) dengan Difenilamin.