i
LAPORAN PRAKTIKUM
KIMIA ANORGANIK
OLEH :
KELOMPOK I
Alfonsus Rodriques Tampung (201220001)
Alverawati Yoja (201220002)
Anggi Kusuma Wardani (201220003)
Eduardus Dimas Satyo P (201220004)
Jefrianus Antonius Jawa G (201220005)
Maria Christina Sarkhol (201220006)
FAKULTAS PERTANIAN
UNIVERSITAS KATOLIK WIDYA KARYA
MALANG
ii
KATA PENGANTAR
Puji Syukur Kepada Tuhan Yang Maha Esa karena telah melimpahkan Rahmat dan
PenyertaanNya, Sehingga penulis dapat menyelesaikan laporan praktikum Kimia Anorganik
dengan lancar.
Laporan ini disusun sebagai tugas akhir sebelum Ujian Akhir Semester (UAS)
dilaksanakan dan sebagai bukti penulis bahwa selama ini telah mengikuti praktikum Kimia
Anorganik.
Dalam penyusunan laporan ini penulis menyadari akan adanya kekurangan-kekurangan
dalam laporan ini, sehingga demi sempurnanya laporan ini penulis sangat berterimakasih atas
saran-saran ataupun koreksi yang akan datang.
Akhirnya penulis berharap semoga laporan yang sederhana ini dapat bermanfaat bagi
pemakainya.
iii
Halaman Judul ... i
Kata Pengantar ... ii
Daftar Isi ... iii
Bab I PENGENALAN ALAT-ALAT 1.1 Pendahuluan ... 1
1.2 Alat-Alat ... 1
1.3 Hasil Pengamatan ... 2
Bab II ACIDIMETRI 2.1 Pendahuluan ... 9
2.2 Alat dan Bahan ... 9
2.3 Cara Kerja ... 10
2.4 Hasil Pengamatan ... 10
2.4.1 Titrasi H2C2O4 dengan NaOH ... 10
2.4.2 Reaksi ... 10
2.4.3 Perhitungan ... 11
2.5 Pembahasan ... 11
2.6 Kesimpulan ... 13
Bab III ALKALIMETRI 3.1 Pendahuluan ... 14
3.2 Alat dan Bahan ... 14
3.3 Cara Kerja ... 15
3.4 Hasil Pengamatan ... 15
3.4.1 Titrasi CH3COOH dengan NaOH ... 15
3.4.2 Reaksi ... 15
3.4.3 Perhitungan ... 15
3.5 Pembahasan ... 16
3.6 Kesimpulan ... 17
Bab IV PERMANGANOMETRI 4.1 Pendahuluan ... 19
4.2 Alat dan Bahan ... 19
4.3 Cara Kerja ... 20
iv
4.4.2 Volume KMnO4 dalam Reaksi FeSO4 + H2SO4 ... 20
4.4.3 Reaksi ... 21
4.4.4 Perhitungan ... 21
4.5 Pembahasan ... 22
4.6 Kesimpulan ... 25
Bab V IODOMETRI DAN IODIMETRI 5.1 Pendahuluan ... 26
5.2 Alat dan Bahan ... 26
5.3 Cara Kerja ... 26
5.4 Hasil Pengamatan ... 27
5.4.1 Standarisasi Na Thiosulfat dengan KIO3 0,1 N ... 27
5.4.2 Reaksi ... 27
5.4.3 Perhitungan ... 28
5.5 Pembahasan ... 29
5.6 Kesimpulan ... 31
Bab VI ANALISIS KUANTITATIF CAMPURAN Pb DAN Cu 6.1 Pendahuluan ... 32
6.2 Alat dan Bahan ... 32
6.3 Cara Kerja ... 33
6.4 Hasil Pengamatan ... 34
6.4.1 Penentuan Kadar Pb dalam Cuplikan ... 34
6.4.2 Penentuan Kadar Cu dalam Cuplikan ... 34
6.4.3 Reaksi ... 34
6.4.4 Perhitungan ... 34
6.5 Pembahasan ... 36
6.6 Kesimpulan ... 39
Bab VII ARGENTOMETRI 7.1 Pendahuluan ... 40
7.2 Alat dan Bahan ... 40
7.3 Cara Kerja ... 40
7.4 Hasil Pengamatan ... 41
7.4.1 Standarisasi AgNO3 0,01 N dengan NaCl 0,01 N ... 41
7.4.2 Reaksi ... 41
v
7.6 Kesimpulan ... 45
Bab VIII ANALISA KOLORIMETRI 8.1 Pendahuluan ... 47
8.2 Alat dan Bahan ... 47
8.3 Cara Kerja ... 48
8.4 Hasil Pengamatan ... 49
8.4.1 Pengenceran Larutan Standart FeCl + KCNS (5ml) ... 49
8.4.2 Penetapan Konsentrasi Fe3+ dalam Cuplikan Fe2+ + KCNS (5ml) ... 49
8.4.3 Reaksi ... 49
8.4.4 Perhitungan ... 49
8.5 Pembahasan ... 51
8.6 Kesimpulan ... 52
1 BAB I
PENGENALAN ALAT-ALAT
1.1 Pendahuluan
Dalam memahami ilmu kimia, praktikum sangat perlu dilakukan sebagai penunjang /
pelengkap dari semua teori yang dipelajari. Karena ilmu kimia merupakan suatu ilmu yang
didasarkan pada percobaan dan pengalaman di laboratorium.
Sebelum praktikan melakukan percobaan atau eksperimen, praktikan diwajibkan
mengetahui kegunaan bermacam-macam alat. Masing-masing alat mempunyai bentuk, bahan,
ukuran serta fungsi yang khusus sehingga setiap peralatan harus digunakan dengan tepat dan
benar.
Dan praktikan tidak akan canggung bila akan melakukan praktikum, karena sudah
mengetahui segala alat-alat yang ada di laboratorium yang digunakan alat-alat praktikum
dengan benar dan sesuai dengan fungsinya, karena apabila penggunaannya kurang tepat dapat
menyebabkan kerusakan pada alat.
1.2 Alat - alat
1. Tabung Reaksi
2. Rak Tabung Reaksi
3. Penjepit
4. Corong (funnel glass)
5. Mortal dan Postele
6. Gelas Arloji
7. Gelas Ukur
8. Beaker Glass
9. Erlenmeyer
10. Labu Ukur
11. Pipet Tetes
12. Pipet Volume
13. Pipet Ukur
14. Buret
15. Statif dan Klemp
16. Lampu Bunsen / Lampu Spiritus
18. Penangas air / Waterbath
19. Petridish
20. Timbangan
21. Oven
22. Eksikator
23. Pengaduk Kaca
24. Spectrophotometer
25. Autoklaf
26. Sentrifuse
27. Kuvet Sentrifuse
28. Soklet
29. Colony Counter
30. Inkubator
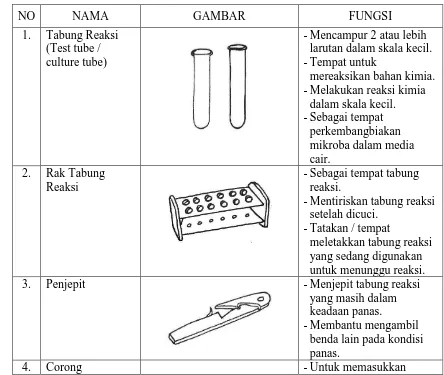
1.3 Hasil Pengamatan
NO NAMA GAMBAR FUNGSI
1. Tabung Reaksi
(Test tube / culture tube)
-Mencampur 2 atau lebih larutan dalam skala kecil. -Tempat untuk
mereaksikan bahan kimia. -Melakukan reaksi kimia
dalam skala kecil. -Sebagai tempat
perkembangbiakan mikroba dalam media cair.
2. Rak Tabung
Reaksi
-Sebagai tempat tabung reaksi.
-Mentiriskan tabung reaksi setelah dicuci.
-Tatakan / tempat
meletakkan tabung reaksi yang sedang digunakan untuk menunggu reaksi.
3. Penjepit -Menjepit tabung reaksi
yang masih dalam keadaan panas.
-Membantu mengambil
benda lain pada kondisi panas.
(Funnel glass) cairan atau larutan kedalam tabung reaksi / gelas ukur.
-Alat untuk menyaring, biasanya dikombinasi dengan kertas saring (proses penyaringan).
5. Mortal dan
Postele
-Menghaluskan zat / bahan yang masih bersifat padat / kristal menjadi bahan yang berukuran kecil.
-Menghancurkan dan
mencampur padatan kimia.
6. Gelas Arloji -Wadah untuk menimbang
zat padat
-Menutup labu pada saat proses pemanasan
-Untuk mengeringkan
suatu bahan dalam desikator.
-Untuk menempatkan
bahan yang ukurannya kecil (bubuk).
7. Gelas Ukur -Untuk mengukur larutan
dalam jumlah / ukuran tertentu.
-Melarutkan zat dengan volume tertentu.
-Merendam pipet dalam
cairan asam pencuci.
8. Beaker Glass -Untuk mencampur 2 atau
lebih larutan dalam jumlah yang lebih besar (dalam ukuran tertentu) dibanding tabung reaksi. -Melarutkan dan
memanaskan zat kimia. -Menguapkan solven /
pelarut.
-Menampung bahan
sementara.
9. Erlenmeyer -Untuk mencampur 2 /
lebih larutan dalam ukuran tertentu.
memanaskan larutan. -Menampung filtrat hasil
penyaringan. -Menampung titran
(larutan yang di titrasi) pada proses titrasi. -Kultivasi mikroba dalam
kultur cair.
-Kegunaan leher sempit untuk mengurangi penguapan pada saat pemanasan dan pada saat diaduk larutan tidak mudah tumpah.
10. Labu Ukur -Untuk mencampur 2 /
lebih larutan dan
mengencerkan suatu zat dengan ketelitian tinggi.
-Untuk mengukur volume
zat kimia dalam bentuk cair pada proses preparasi larutan.
-Melarutkan padatan dalam pembuatan larutan standar pada analisis volumetri,
spektrofotometri, dll.
11. Pipet Tetes -Untuk mengambil larutan
dalam jumlah / ukuran yang diinginkan dan memindahkan ke alat atau wadah lain.
-Memindahkan zat cair dalam jumlah kecil.
12. Pipet Volume -Untuk mengambil /
memindahkan larutan dalam jumlah / ukuran tertentu.
-Memindahkan dan
mengambil larutan
dengan ketelitian tertentu.
13. Pipet Ukur -Untuk mengambil /
memindahkan larutan dalam jumlah atau ukuran tertentu.
-Mengukur volume larutan dengan tingkat ketelitian yang tinggi (0,01 mm).
14. Buret -Untuk mengalirkan
untuk titrasi) ke wadah atau alat praktikum lain.
-Untuk mengukur volume
suatu larutan.
15. Statif dan Klemp -Untuk menyangga /
mendirikan alat berupa buret.
-Untuk menjepit soklet pada proses ektraksi. -Untuk menjepit
kondensor pada proses distilasi.
16. Lampu Bunsen / Lampu Spiritus
-Memanaskan bahan kimia
/ sumber panas pada saat melakukan pembakaran. -Untuk praktikum
bakteriologi agar tercipta tempat yang steril. -Biasanya diletakkan di
atas kaki tiga. 17. Segitiga / Kaki
Tiga
-Untuk menyangga /
menahan pembakar spiritus / lampu Bunsen -Sebagai penopang kawat
kasa saat melakukan pembakaran.
18. Water bath (Penangas Air)
-Untuk menciptakan suhu yang konstan.
-Untuk melebur basis, penguapan ekstrak / tingtur.
-Untuk menyimpan media
yang masih akan digunakan.
19. Petridish -Untuk meletakkan larutan bisa dalam bentuk cairan atau bubuk.
-Wadah untuk menimbang
dan menyimpan bahan kimia.
-Untuk membiakan sel. -Untuk mengkultur bakteri,
khamir spora / biji-bijian. 20. Timbangan
Analitik
-Untuk mengukur berat suatu bahan yang diletakkan di petridish dalam jumlah / ukuran tertentu.
-Menimbang dengan
ketelitian tinggi.
21. Oven -Untuk memanaskan /
menurunkan berat bahan / kandungan air bahan dengan suhu tertentu.
-Untuk mengeringkan
bahan / alat - alat dalam keadaan basah sebelum digunakan.
22. Eksikator -Untuk mendinginkan,
menurunkan suhu dari bahan yang sudah di oven / menurunkan suhu bahan dari ovennya.
-Menyimpan zat / bahan yang harus dilindungi terhadap pengaruh kelembapan udara.
-Menyimpan bahan -bahan
/ sampel yang harus bebas air.
23. Pengaduk Kaca -Untuk mencampur 2 /
lebih larutan dalam beaker glass.
-Mengaduk suatu campuran pada waktu melakukan reaksi – reaksi kimia.
gelombang.
-Membaca kekeruhan
kultur dengan melewatkan suatu berkas cahaya kemudian persentase cahaya yang melewatinya dihitung.
25. Autoklaf -Untuk mensterilkan alat
praktikum dan bahan yang digunakan dalam
mikrobiologi
menggunakan uap air panas bertekanan.
26. Sentrifuse -Memisahkan cairan dan
padatan dalam suatu larutan sehingga
dihasilkan endapan yang dapat di analisis
-Untuk memekatkan sel mikroorganisme sehingga dapat dipisahkan anatara medium (supernatan) dan selnya yang mengendap (natan).
27. Kuvet sentrifuse -Mewadahi larutan yang
telah dipisahkan melalui sentrifuse.
-Untuk tempat / wadah sampel yang akan diputar dalam sentrifuse.
28. Soklet -Untuk mengekstraksi
lemak dalam minyak. -Untuk menghasilkan
ektraksi lemak kasar dalam bahan - bahan kimia. (fosfolipida, sterol, asam lemak bebas,
karotenoid, dan pigmen - pigmen).
29. Colony counter -Untuk menghitung jumlah
bakteri yang tumbuh setelah diinkubasi di dalam cawan.
pertumbuhan bakteri.
30. Inkubator -Alat untuk proses
inkubasi / memeram suatu bakteri pada suhu yang terkontrol.
-Menumbuhkan media
9 ACIDIMETRI
2.1 Pendahuluan
Acidimetri adalah analisis kuantitatif volumetrik yang berdasarkan reaksi netralisasi
dengan larutan standart asam. Larutan standart dibedakan menjadi dua macam yaitu larutan
standart primer dan larutan standart sekunder. Suatu larutan yang akan dipakai menjadi
larutan standart primer harus memenuhi kriteria : memiliki kemurnian yang tinggi, tidak
bersifat higroskopis, memiliki rumus molekul yang pasti dan ditimbang, berat ekivalen tinggi,
cepat bereaksi dengan zat yang ditentukan dan larutannya harus bersifat cukup stabil. Zat-zat
yang memenuhi kriteria tersebut adalah Na borax, asam oksalat, natrium thiosulfat. Larutan
lain yang tidak memenuhi syarat-syarat diatas maka disebut larutan standart sekunder.
Dalam titrasi ini diperlukan indikator phenilpthalin untuk mempercepat titrasi dan
mencapai titik egivalensi yaitu titik akhir terjadinya titrasi yang ditandai dengan adanya
perubahan baik warna maupun adanya endapan dalam larutan tersebut setelah dititrasi.
Tujuan dari praktikum adalah untuk mengetahui konsentrasi larutan standart sekunder
dengan menggunakan larutan standart primer.
2.2 Alat dan Bahan
Alat :
- Timbangan
- Erlenmeyer 250 ml
- Pipet Tetes
- Buret dan Statif
- Gelas Ukur 10 ml
- Sendok
Bahan :
- NaOH
- Asam Oksalat
- Aquades
2.3 Cara Kerja
a. Membuat Larutan Standart NaOH 0,1 N :
- Menimbang 1 gram NaOH larutkan dalam beaker glass dengan Aquades 100 ml.
- Masukkan dalam labu ukur 250 ml, kocoklah sampai homogen dan tambahkan
aquades sampai tanda batas.
b. Membuat Larutan Asam Oksalat 0,1 N :
- Menimbang 1,5758 gram Asam Oksalat larutkan dalam beaker glass dengan aquades
100 ml.
- Masukkan dalam labu ukur 250 ml, kocoklah sampai homogen dan tambah hingga
tanda batas
c. Membuat Standarisasi NaOH 0,1 N dengan Asam Oksalat 0,1 N :
- Menyiapkan perangkat buret, kita bilas dengan Aquades kemudian dikeringkan, dan
dibilas dengan NaOH.
- Memipet 10 ml Asam Oksalat dengan pipet volume, kita masukkan dalam Erlenmeyer
dan menambahkan 2-3 tetes Indikator PP.
- Melakukan titrasi Asam Oksalat dengan NaOH sampai terjadi perubahan warna
menjadi merah muda.
- Mengulangi titrasi sampai 3 kali ulangan.
- Menghitung normalitasnya.
2.4 Hasil Pengamatan
2.4.1 Titrasi H2C2O4 dengan NaOH
ULANGAN ml NaOH WARNA
I 22,55 ml Pink Muda
II 9,4 ml Pink Tua
III 5,8 ml Pink Muda ++
2.4.2 Reaksi
NaOH Na+ + OH
-NaCl H+ + C2O4
2.4.3 Perhitungan
Larutan Standar NaOH 0,1 NMassa NaOH =
=
=
=
= 1 gr
Larutan Asam Oksalat 0,1 NMassa Asam Oksalat =
=
=
= 0,9 gr
NormalitasN NaOH =
Ulangan I
N NaOH =
= 0,04 N Ulangan II
N NaOH =
= 0,10 N
Ulangan III
N NaOH =
= 0,17 N
Rata - rata NaOH = = = 0,10 N
2.5 Pembahasan
Acidimetri adalah pengukuran konsentrasi asam dengan menggunakan larutan baku
basa. Acidimetri merupakan penetapan kadar secara kuantitatif terhadap senyawa – senyawa
yang bersifat basa dengan menggunakan baku asam. Contoh analisis acidimetri adalah
menentukan kandungan ion bikarbonat dalam air sadah. Praktikum acidimetri bertujuan untuk
mengetahui konsentrasi larutan standar sekunder (NaOH) dengan menggunakan larutan
standar primer (Asam Oksalat) dan untuk mengenal cara analisa kuantitatif dengan metode
Adapun sifat masing - masing larutan (NaOH dan Asam Oksalat). Larutan NaOH
mempunyai ciri - ciri yaitu berwarna putih, massa melebur, berbentuk pelet, serpihan atau
batang atau bentuk lain. Bersifat sangat basa, keras, rapuh, dan menunjukkan pecahan hablur.
Bila dibiarkan di udara akan menyerap CO2 dan lembab. Kelarutannya sangat tinggi sehingga
mudah larut dalam air dan etanol tetapi tidak larut dalam eter dan pelarut non-polar lain. Titik
lelehnya 318o C dan titik didihnya 1390o C.NaOH membentuk basa kuat bila dilarutkan dalam
air. NaOH mudah terionisasi membentuk ion natrium dan hidroksida. Asam Oksalat dalam
keadaan murni berupa senyawa kristal, larut dalam air (8% pada 10o C) dan larutan ini larut
dalam alkohol. H2C2O4 membentuk garam netral dengan logam alkali (Nak) yang larut di
dalam air (5 - 25%) sementara dengan logam alkali tanah. Larutan ini termasuk logam berat
yang mempunyai kelarutan yang sangat kecil di dalam air. Asam Oksalat digunakan untuk
menentukan jumlah kalsium H2C2O4 terionisasi dalam media asam kuat. H2C2O4 bisa
ditemukan dalam bentuk bebas / bentuk garam. H2C2O4 adalah asam dikarboksilat yang hanya
terdiri dari 2 atom C pada masing - masing molekul sehingga 2 gugus karboksilat berada
berdampingan. Setelah mengenal sifat masing - masing larutan, maka dilakukan titrasi
asidimetri dengan menggunakan 3 kali ulangan dengan menggunakan indikator Phenolptelein
(PP). dari 3 kali ulangan tersebut masing-masing di dapat volume (ml) titrasi yang
berbeda-beda 1 sama lain yaitu pada ulangan yang pertama di dapat 22,55 ml dengan warna titrasi
yang dihasilkan pink muda, pada ulangan kedua di dapat 9,4 ml dengan warna titrasi yang
dihasilkan pink tua dan ulangan yang ketiga 5,8 ml dengan warna titrasi yang dihasilkan yaitu
pink muda ++ dengan normalitas setiap ulangan yang berbeda-beda pula. Ulangan pertama
menghasilkan normalitas 0,04 N, ulangan kedua normalitasnya 0,10 N, dan pada ulangan
ketiga menghasilkan normalitas 0,17 N. dan rata-rata normalitas yang diperoleh dari ketiga
ulangan tersebut adalah 0,10 N. dilihat dari hasil ulangan, ulangan pertama tidak memiliki
kesamaan dengan ulangan kedua dan ketiga, warna yang dihasilkan juga sangat berbeda. Dari
hal itu dapat disimpulkan ada faktor - faktor lain yang mempengaruhi yaitu, kurang
tercampurnya larutan Asam Oksalat dengan aquades, kurangnya aquades yang harus
dicampurkan, peralatan yang digunakan kurang bersih / steril., dan terjadi hal - hal lain
sehingga hasil dari masing-masing ulangan sangat berbeda, sehingga terjadi perbedaan yang
2.6 Kesimpulan
Titrasi Acidimetri merupakan titrasi volumetrik yang dilakukan dengan menggunakan
larutan standart asam. Titrasi ini menggunakan indikator PP untuk mengukur kadar asam basa
dalam suatu larutan.
Dari hasil praktikum yang dilakukan, dari ketiga percobaan didapatkan hasil yang
berbeda - beda. Titrasi yang dilakukan berdasarkan pentitrasian terhadap Asam Oksalat dan
NaOH. Dari hasil titrasi tersebut didapat rata - rata normalitas NaOH yaitu 0,10 N.
Adapun kesalahan-kesalahan yang terjadi sehingga hasil dari ketiga percobaan tersebut
berbeda-beda, kesalahan tersebut antara lain :
kurang tercampurnya larutan Asam Oksalat dengan aquades.
Kurangnya aquades yang harus dicampurkan
Peralatan yang digunakan kurang bersih / steril
Ketidakseimbangan pencampuran larutan sehingga warna yang dihasilkan ada yang lebih tua dan ada yang lebih muda.
Kesalahan yang terjadi sangat mungkin terjadi pada setiap percobaan walaupun volume
14 ALKALIMETRI
3.1 Pendahuluan
Yang dimaksud alkalimetri adalah analisa kuantitatif volumetri dimana larutan asam
dan garam dari basa lemah dititrasi dengan larutan basa baku. Titrasi asidi-alkalimetri
menyangkut reaksi asam atau basa. Dalam titrasi alkalimetri ini menggunakan indikator
phenolpthalin yang berfungsi untuk mempercepat terjadinya titrasi hingga mencapai titik
egivalensi dan dapat dipergunakan juga untuk memperjelas atau mempertajam perubahan
warna yang terjadi.
Perubahan warna yang terjadi disebabkan karena adanya beberapa sifat yang berubah
salah satunya adalah Ph larutan. Ph larutan yang telah berbeda membuat perubahan warna
juga berubah titrasi akan diulang sampai beberapa kali dimaksudkan agar dapat mengurangi
kesalahan titrasi. Karena titik akhir yang didapatkan tidak selalu sama dengan titik ekuivalen.
Tujuan praktikum adalah untuk menetapkan kadar asam cuka perdagangan dengan
metode alkalimetri.
3.2 Alat dan Bahan
Alat :
- Perangkat Titrasi
- Erlenmeyer 250 ml
- Beaker Glass
- Corong
- Labu Ukur 250 ml
- Pipet Volume
- Pipet Tetes
Bahan :
- NaOH 0,1 N
- Indikator PP
- Asam Cuka Perdagangan
3.3 Cara Kerja
a. Membuat Larutan Standart NaOH 0,1 N
- Bersihkan semua alat yang akan digunakan dengan aquades dan keringkan.
- Timbang 1 gram NaOH, larutkan dalam beaker glass dengan aquades 100 ml.
- Masukkan dalam labu ukur 250 ml, kocok sampai homogen.
- Tambahkan aquades sampai tanda batas.
b. Persiapan asam cuka perdagangan
- Ambil 25 ml asam cuka perdagangan, masukkan dalam labu ukur 250 ml dan
tambahkan aquades sampai tanda batas.
- Ambil 10 ml asam cuka hasil pengenceran dan masukkan dalam Erlenmeyer,
tambahkan indikator PP 3 - 4 tetes.
c. Persiapan titrasi
- Isi buret dengan NaOH 0,1 N.
- Titrasi asam cuka hasil pengenceran dengan NaOH sampai terjadi perubahan warna
merah muda dan catatlah volume NaOH.
- Ulangi percobaan sampai 3 kali.
3.4 Hasil Pengamatan
3.4.1 Titrasi CH3COOH dengan NaOH
ULANGAN ml TTRASI WARNA
I 14,9 ml Pink Muda
II 15,3 ml Pink Tua
III 14,3 ml Pink Muda ++
3.4.2 Reaksi
NaOH Na+ + OH
-CH3COOH CH3COO- + H+
NaOH + CH3COOH.2H2O CH3COONa + 3H2O
3.4.3 Perhitungan
Massa NaOH =
=
=
=
= 1 gr
Kadar CH3COOHCH3COOH =
x 100%
Ulangan I
CH3COOH =
x 100%
=
x 100% =
x 100%
=
8,51% Ulangan II
CH3COOH =
x 100%
=
x 100% =
x 100%
= 8,74%
Ulangan III
CH3COOH =
x 100%
=
x 100% =
x 100%
= 8,17%
Rata - rata CH3COOH = = = 8,47%
3.5 Pembahasan
Alkalimetri adalah analisis volumetrik yang menggunakan larutan baku basa untuk
menentukan jumlah asam yang ada. Alkalimetri adalah titrasi terhadap larutan asam bebas dan
harga pH tertentu. Perjalanan titrasi dengan penambahan titran akan menyebabkan perubahan
pH. Titrasi alkalimetri bertujuan untuk menentukan kadar asam dalam suatu larutan dan
mengetahui tingkat pH di dalam suatu larutan ( > 7 bersifat basa dan < 7 bersifat asam).
Asam cuka yang ditetapkan 25 ml, diencerkan dalam labu ukur 225 ml. saat asam cuka
di titrasi dengan larutan NaOH, saat mencapai titik akhir warna larutan berubah menjadi
merah muda karena [OH-] menyebabkan [H+] berkurang dan keseimbangan bergeser ke
kanan, sehingga warna larutan berubah menjadi merah muda yang disebut basa indikator.
Volume titran yang digunakan sampai tercapainya titik akhir titrasi adalah 14,9 ml, 15,3 ml,
dan 14,3 ml pada ketiga ulangan dengan masing - masing ulangan diperoleh kadar asam
sebesar 8,51%, 8,74%, dan 8,17% dengan rata - rata kadar asam sebesar 8,47%. pH akhir
titrasi berada di atas 7 ( > 7 ) yang berarti larutan ini bersifat basa. Proses titrasi ini
melibatkan basa kuat sebagai larutan standar dan asam lemah sebagai analit yang akan
dititrasi. Adapun kesalahan yang terjadi sehingga warna setiap ulangan berbeda, yaitu :
Peralatan praktikum yang kurang steril
Larutan kurang tercampur
Kesalahan dalam pembuatan larutan
Pencampuran titran yang terlalu banyak sehingga warna berbeda jauh.
Setelah memperoleh hasil dari setiap ulangan, kini membandingkan dengan hasil
praktikum dari pustaka. Dari hasil praktikum dalam pustaka, normalitas asam cuka yang
diperoleh 0,1086 N dan kadar asam cuka yang diperoleh 6,516%, setelah dibandingkan antara
percobaan yang dilakukan dengan percobaan yang diperoleh dari pustaka sangatlah berbeda.
Faktor-faktor yang menyebabkan perbedaan tersebut adalah :
Jumlah larutan yang digunakan berbeda
Rumus penghitungan berbeda tetapi masih bisa digunakan dalam menentukan kadar larutan
3.6 Kesimpulan
Alkalimetri adalah analisa kuantitatif volumetri dimana larutan asam dan garam dari
basa lemah dititrasi dengan larutan basa baku. Titrasi alkalimetri ini menggunakan indikator
phenolpthalin yang berfungsi untuk mempercepat terjadinya titrasi hingga mencapai titik
egivalensi dan dapat dipergunakan juga untuk memperjelas atau mempertajam perubahan
Dari ketiga hasil percobaan yang telah dilakukan, diperoleh volume titrasi yang berbeda
dan warna yang dihasilkan juga berbeda. Tiap - tiap ulangan diperoleh kadar asam cuka
sebesar 8,51%, 8,74%, dan 8,17% dengan rata-rata kadar yang diperoleh 8,47%.
Selama praktikum berlangsung adapun kesalahan - kesalahan yang dilakukan sehingga
hasil yang didapat berbeda-beda, seperti :
Peralatan praktikum yang kurang steril
Larutan kurang tercampur
Kesalahan dalam pembuatan larutan
19
PERMANGANOMETRI
4.1 Pendahuluan
Dalam analisis volumetri yang dimaksud titrasi oksidometri adalah titrasi dengan
menggunakan larutan standart zat pengoksidasi tetapi apabila yang dipakai sebagai larutan
standart zat pereduksi maka disebut titrasi reduksimetri. Titrasi permanganometri adalah
titrasi oksidometri dengan menggunakan larutan standart kalium permanganat. Dalam titrasi
ini tidak perlu menggunakan indikator untuk mempercepat terjadinya titik egivalensi atau titik
akhir titrasi. Apabila disebabkan warna yang dihasilkan nantinya akan jelas sekali. Pada
penentuan kadar besi volume yang dibutuhkan hanya sedikit karena titrasi sudah mencapai
titik egivalensi karena apabila volume terlalu banyak warna akan berubah.
Tujuan praktikum ini adalah menentukan kadar konsentrasi KMnO4 dan kadar besi (Fe2+) dalam cuplikan.
4.2 Alat dan Bahan
Alat :
- Pipet volume
- Pipet ukur
- Erlenmeyer
- Perangkat titrasi
- Timbangan analitis
- Pipet tetes
- Labu ukur
- Beaker glass
- Gelas arloji
- Corong
- Botol semprot
Bahan :
- Kalium permanganat (KMnO4)
- Natrium oksalat (Na2C2O4)
- H2SO4 2 N
- Cuplikan Fe2+
4.3 Cara Kerja
a. Membuat larutan KMnO4.
b. Membuat larutan Natrium Oksalat 0,1 N.
c. Membuat larutan H2SO4 2 N.
d. Standarisasi KMnO4 dengan Na Oksalat.
- Siapkan perangkat buret yang telah dibersihkan.
- Ambil 10 ml larutan Na Oksalat dan masukkan dalam erlenmeyer dan tambahkan 10
ml H2SO4 2 N.
- Titrasi dengan larutan KMnO4 dalam keadaan panas (50o - 60o C) sampai terjadi
perubahan warna.
- Catatlah volume KMnO4.
- Ulangi titrasi sebanyak 3 kali dan hitung normalitasnya.
e. Penentuan kadar besi dalam cuplikan.
- Timbang 3 gram FeSO4 dilarutkan dalam labu ukur 100 ml (cuplikan).
- Ambil 10 ml larutan cuplikan dan masukkan dalam erlenmeyer dan tambahkan 7 ml
H2SO4 2 N.
- Titrasi dengan KMnO4 sampai terjadi perubahan warna.
- Catatlah volumenya dan ulangi percobaan sebanyak 3 kali.
- Hitung kadar Fe.
4.4 Hasil Pengamatan
4.4.1 Volume KMnO4 dalam reaksi Na2C2O4 + H2SO4
ULANGAN ml KMnO4 WARNA
I 2,65 ml Ungu Tua +
II 1,55 ml Ungu Tua ++
III 1,1 ml Ungu Tua
4.4.2 Volume KMnO4 dalam reaksi FeSO4 + H2SO4
ULANGAN ml KMnO4 WARNA
I 0,3 ml Ungu Tua
II 0,9 ml Ungu Tua +
4.4.3 Reaksi
KMnO4 K+ + MnO4
-Na2C2O4 2 Na+ + C2O4
2-H2SO4 2 H+ + SO4
2-FeSO4 Fe2+ + SO4
2-4.4.4 Perhitungan
Gram KMnO4 =
= = = =
Gram Na2C2O4 =
= = = =
Volume H2SO4 =
= = = ≈ 229 ml
Normalitas KMnO4N KMnO4 x V KMnO4 = N Na2C2O4 x V Na2C2O4
N KMnO4 =
Standarisasi KMnO4 dengan Na2C2O4 + H2SO4 Ulangan I
N KMnO4 =
= = 0,38 N
Ulangan II
N KMnO4 =
= = 0,65 N
Ulangan III
N KMnO4 =
Rata - rata N KMnO4 = = = 0,65 N
Standarisasi Fe dengan KMnO4N Fe x V Fe = N KMnO4 x V KMnO4
N Fe =
Ulangan I
N Fe =
= 0,003 N
Ulangan II
N Fe =
= 0,009 N
Ulangan III
N Fe =
= 0,006 N
Rata - rata N Fe = = = 0,006 N
Berat Cuplikan = BE FeSO4 x V Fe x N Fe x P= (56 + 32 + 64) x 10 x 0,006 x 10
= 152 x 0,6
= 91,2 mg
Kadar Fe =x 100%
=
x 100% = 3,04%
4.5 Pembahasan
Permanganometri merupakan titrasi yang dilakukan berdasarkan reaksi oleh kalium
permanganat (KMnO4). Reaksi ini difokuskan pada reaksi oksidasi dan reduksi yang terjadi
antara KMnO4 dengan bahan baku tertentu. Permanganometri adalah titrasi yang didasarkan
pada reaksi redoks. Dalam reaksi ini, ion MnO4- bertindak sebagai oksidator. Ion MnO4- akan
berubah menjadi ion Mn2+ dalam suasana asam.
Reaksi redoks dapat diartikan sebagai reaksi yang didalamnya terjadi perpindahan
elektron secara berurutan dari satu senyawa kimia ke senyawa kimia lainnya (suatu serah
dari dua reaksi yang berbeda, yaitu Oksidasi dan Reduksi. Kedua reaksi tersebut yang menjadi
prinsip titrasi permanganometri. Oksidasi dan reduksi merupakan pasangan, sebab elektron
yang hilang pada reaksi oksidasi sama dengan elektron yang diperoleh pada reaksi reduksi.
Reaksi oksidasi sendiri diartikan sebagai suatu reaksi yang melibatkan oksigen dengan
pelepasan elektron dari satu atom atau senyawa. Sedangkan reaksi reduksi adalah suatu reaksi
yang melibatkan oksigen dengan penambahan elektron dari satu atom atau senyawa.
Contoh pembentukan reaksi oksidasi :
H2 2H+ + 2e-
Contoh pembentukan reaksi reduksi :
F2 + 2e- 2F
-Ketika reaksi oksidasi dan reduksi disatukan maka akan membentuk :
Dalam reaksi ini elektron - elektron yang terlibat saling mengurangi. Reaksi oksidasi dan
reaksi reduksi terjadi secara bersamaan (simultan), yang berarti jika elektron dipindahkan dari
molekul sebagai pemberi elektron maka aka nada molekul yang teroksidasi sedangkan
penerima menjadi molekul yang tereduksi. Keadaan suatu reaksi terjadi secara seimbang.
Keadaan oksidasi dalam reaksi redoks adalah suatu pengukuran derajat oksidasi sebuah
atom dalam suatau zat. Aturan - aturan reaksi oksidasi yaitu :
1. Keadaan oksidasi unsur bebas (unsur yang tidak bergabung dengan unsur lain) adalah
nol.
2. Untuk ion sederhana, keadaan oksidasinya adalah sama dengan muatan total pada ion.
3. Hidrogen memiliki keadaan oksidasi 1 dan oksigen memiliki keadaan oksidasi -2 ketika
mereka berada pada kebanyakan senyawa (kecuali pada hidrogen memiliki keadaan
oksidasi -1 pada hidrida logam aktif (LiH) dan oksigen memiliki keadaan oksidasi -1
pada peroksida (H2O2) ).
4. Penjumlahan keadaan oksidasi semua atom pada suatu molekul netral haruslah nol, jika
pada ion penjumlahan oksidasi atom-atom yang membentuk ion tersebut harus sama
dengan muatan ion.
Senyawa - senyawa oksidasi biasanya memiliki unsur - unsur dengan bilangan oksidasi yang
tinggi sepert : H2O2, MnO4-, CrO3, Cr2O72-, OsO4 atau senyawa-senyawa yang elektronegatif,
senyawa (seperti oksigen, fluorin, klorin, dan bromin) dan senyawa ini disebut sebagai
oksidatif. Sedangkan senyawa - senyawa yang memiliki kemampuan untuk mereduksi
senyawa lain disebut sebagai reduktif dan dikenal sebagai reduktor. Reduktor melepas
elektronnya ke senyawa lain, sehingga teroksidasi sendiri. Senyawa - senyawa reduktor yang
memiliki unsur-unsur logam seperti Li, Na, Mg, Fe, Zn, dan Al. logam - logam ini
memberikan elektronnya dengan mudah. Reduktor yang lain adalah reagen transfer hidrida,
misalnya NaBH4 dan LiAiH4. Metode yang lain juga melibatkan gas hidrogen (H2) dengan
katalis paladium, platinum, dan nikel. Pada umumnya jumlah elektron yang dilepaskan pada
reaksi oksidasi harus sama dengan jumlah yang diterima pada reaksi reduksi.
Titrasi redoks (titrasi dengan menggunakan reaksi redoks dengan melibatkan senyawa
reduktor dan oksidator) juga dapat diterapkan dalam berbagai macam jenis titrasi diantaranya
,ialah Permanganometri (titrasi redoks yang menggunakan KMnO4 sebagai titran),
Dikromatometri (titrasi redoks yang menggunakan senyawa dikromat sebagai oksidator),
Titrasi dengan Iodium (Iodometri dan Iodimetri), Cerimetri, dan Bromatometri. Jenis-jenis
titrasi ini ada karena tidak ada satu senyawa (titran) yang dapat bereaksi dengan semua
senyawa oksidator dan reduktor, sehingga diperlukan berbagai senyawa titran.
Percobaan dalam menentukan normalitas KMnO4 dalam reaksi Na2C2O4 + H2SO4
dilakukan dalam 3 kali ulangan yang masing-masing di dapat hasil yang berbeda., pada
ulangan I membutuhkan 2,65 ml KMnO4 dengan standarisasi yang di dapat 0,38 N, pada
ulangan II membutuhkan 1,55 ml KMnO4 dengan standarisasi yang di dapat 0,65 N, dan pada
ulangan III membutuhkan 1,1 ml KMnO4 dengan standarisasi yang di dapat 0,90 N. pada
masing-masing ulangan dihasilkan warna yang berbeda yaitu pada ulangan I menghasilkan
warna ungu tua +, ulangan II menghasilkan warna ungu tua ++, dan ulangan III menghasilkan
warna ungu muda. Dari percobaan ini dihasilkan rata-rata normalitas KMnO4 sebesar 0,64 N.
Dan Normalitas KMnO4 dalam reaksi FeSO4 + H2SO4 di dapat rata-rata normalitasnya 0,006
N dengan warna yang berbeda-beda pula pada tiap-tiap ulangan dan jumlah ml KMnO4 yang
dibutuhkan juga berbeda. Berat cuplikan Fe yang di dapat sebesar 91,2 mg dengan kadar
3,04%.
Dari kedua percobaan KMnO4 tersebut di dapat factor-faktor kesalahan yang mungkin
terjadi sehingga tiap-tiap ulangan menghasilkan warna yang berbeda dari ml KMnO4 yang
dibutuhkan, hal ini disebabkan karena,
1. Lamanya proses pencampuran larutan H2SO4 dengan Na2C2O4
2. Alat-alat praktikum yang digunakan kurang steril
3. Sukarnya pelarutan Fe dalam aquades
4.6 Kesimpulan
Permanganometri merupakan titrasi yang dilakukan berdasarkan reaksi oleh kalium
permanganat (KMnO4). Titrasi permanganometri adalah titrasi yang didasarkan pada reaksi
redoks. Reaksi redoks adalah reaksi yang didalamnya terjadi perpindahan elektron secara
berurutan dari satu senyawa kimia ke senyawa kimia lainnya (suatu serah terima elektron dan
reaksi yang disertai perubahan bilangan oksidasi). Reaksi redoks terdiri dari reaksi oksidasi
dan reaksi reduksi.
Dalam percobaan yang dilakukan, rata - rata normalitas KMnO4 dalam reaksi Na2C2O4
+ H2SO4 yang di dapat adalah 0,64 N dan dari hasil normalitas KMnO4 dalam reaksi FeSO4 +
H2SO4 di dapat rata - rata sebesar 0,006 N dengan warna dan volume yang berbeda - beda.
Berat cuplikan Fe adalah 91,2 mg dengan kadar 3,04%.
Kesalahan yang dapat terjadi ketika dilakukan praktikum sehingga memberikan hasil
yang berbeda - beda, yaitu :
Lamanya proses pencampuran larutan H2SO4 dengan Na2C2O4
Alat-alat praktikum yang digunakan kurang steril
Sukarnya pelarutan Fe dalam aquades
Larutan sudah terkontaminasi oleh debu (kotoran) karena tidak ditutup.
26
IODOMETRI DAN IODIMETRI
5.1 Pendahuluan
Iodometri dan iodimetri merupakan analisa volumetri yang berdasarkan reaksi redoks.
Iodimetri adalah titrasi langsung dengan larutan standart Iodin (I2), Iodometri adalah titrasi
direaksikan dulu dengan ion iodida. I2 yang dibebaskan dititrasi dengan larutan standart Na
thiosulfat.
Tujuan praktikum adalah untuk membuat larutan Na thiosulfat dan standarisasinya.
5.2 Alat dan Bahan
Alat :
- Labu ukur
- Pipet tetes
- Botol semprot
- Gelas arloji
- Pipet volume
- Erlenmeyer 250 ml
- Perangkat titrasi
- Timbangan
- Corong
- Beaker glass
- Pipet ukur
- Gelas ukur
Bahan :
- Na2S2O3.5H2O
- H2SO4
- Aquades
- KIO3
- KI
- Amilum 1%
5.3 Cara Kerja
b. Membuat larutan H2SO4 0,1 N
c. Membuat larutan amilum / pati 1%
d. Membuat larutan KIO3 0,1 N
- Timbang 0,445 gram KIO3 dan encerkan dengan aquades mendidih dalam labu ukur
125 ml.
- Tambahkan 12,5 ml H2SO4 0,1 N dan 6,25 gram KI.
- Tambahkan aquades hingga tanda batas, sampai V = 125 ml.
e. Standarisasi Na thiosulfat dengan KIO3 0,1 N
- Ambil 10 ml larutan KIO3 0,1 N tersebut dan masukkan dalam erlenmeyer.
- Titrasi dengan larutan Na thiosulfat hingga warna kuning pucat.
- Tambahkan 1 ml amilum 1 %
- Lanjutkan titrasi sampai warna biru hilang.
- Catatlah volumenya dan ulangi titrasi sebanyak 3 kali
- Hitung normalitasnya
5.4 Hasil Pengamatan
5.4.1 Standarisasi Na Thiosulfat dengan KIO3 0,1 N
Titrasi KIO3 dengan Na Thiosulfat
ULANGAN ml Na Thiosulfat WARNA
I 6,7 ml Kuning Pucat
II 5,9 ml Kuning Pucat
III 6,3 ml Kuning Pucat
Titrasi KIO3 dengan Na Thiosulfat ditambah 1% Amilum
ULANGAN ml Na Thiosulfat WARNA
I 2,2 ml Kuning Muda
II 4,1 ml Kuning Muda +
III 7,3 ml Kuning Muda ++
5.4.2 Reaksi
Na2C2O3 2 Na+ + C2O3
2-H2SO4 2 H+ + SO4
-5.4.3 Perhitungan
Na Thiosulfat =
=
=
=
=
Volume H2SO4 =
=
=
= ≈ 229 ml
H2SO4 yang digunakan hanya sebagian, jadi H2SO4 = = 114,5 ml
Standarisasi Na2S2O3 dengan KIO3 0,1 NN Na2S2O3 =
Ulangan I
N Na2S2O3 =
= = 0,15 N
Ulangan II
N Na2S2O3 =
= = 0,17 N
Ulangan III
N Na2S2O3 =
= = 0,16 N
Rata - rata N Na2S2O3 =
= = 0,16 N
Standarisasi Na2S2O3 dengan KIO3 ditambah 1% AmilumN Na2S2O3 =
Ulangan I
N Na2S2O3 =
= = 0,45 N
N Na2S2O3 =
= = 0,24 N
Ulangan III
N Na2S2O3 =
= = 0,14 N
Rata - rata N Na2S2O3 =
= = 0,28 N
5.5 Pembahasan
Iodometri dan Iodimetri merupakan reaksi kimia yang melibatkan oksidasi reduksi
dalam analisis titrimetrik. Iodometri adalaha analisa titrimetrik yang secara tidak langsung
untuk zat yang bersifat oksidator seperti besi (III), tembaga (II), kalium permanganat dimana
zat ini akan mengoksidasi iodida yang ditambahkan membentuk iodin. Iodin yang terbentuk
akan ditentukan dengan menggunakan larutan baku thiosulfat.
Contoh : oksidator + KI I2 + 2e
I2 + Na2S2O3 NaI + Na2S4O6
Iodimetri adalah analisis titrimetrik yang secara langsung digunakan untuk zat reduktor atau
natrium thiosulfat dengan menggunakan larutan iodin atau dengan penambahan larutan baku
berlebihan. Kelebihan iodin dititrasi kembali dengan larutan thiosulfat.
Contoh : Reduktor + I2 2I
-Na2S2O3 + I2 NaI + Na2S4O6
Dari pengertian iodometri dan iodimetri yang telah dibahas diatas adapun perbedaan antara
titrasi iodometri dan titrasi iodimetri, yaitu :
Titrasi iodimetri (cara langsung) : Sampelnya bersifat reduktor, larutan standarnya bersifat oksidator dan sampel secara langsung
direaksi dengan I2.
Itu berarti iodium digunakan untuk mentitrasi reduktor - reduktor yang dapat dioksidasi
secara kuantitatif pada titik ekivalensi reaksi oksidasi yang berlangsung dengan larutan
iodium diantaranya dengan H2S, H2SO4, H2AsO4, Sn2-, dan S2O32-.
Titrasi iodometri (cara tidak langsung) : Sampelnya bersifat oksidator, larutan standarnya bersifat reduktor, dan I2 yang diperoleh secara
tidak langsung dengan menambahkan larutan
yang mengandung ion iodida dalam sampel.
Oksidasi yang dianalisis direaksikan dengan iodida berlebih dalam suasana larutan yang
baku natrium thiosulfat. Cara iodometri dapat digunakan untuk menganalisa oksidator
yang kuat. Diantaranya, Cr2O72-, BrO3-, ClO3-, HNO3, Cu2+, dan HOCl.
Jenis - jenis iodimetri dan iodometri sangat berbeda. Kedua titrasi ini memiliki jenis - jenis
tersendiri tergantung pada kegunaan dan fungsinya.
Jenis-jenis titrasi iodimetri antara lain :
a. Penetapan vitamin C
Iodium dapat mentitrasi vitamin C (asam askorbat) secara langsung, iod mengoksidasi
gugus fungsional (OH) C = C (OH) menjadi gugus alfa diketon dalam dehidroaskorbat.
b. Penetapan kadar air menggunakan metode Karl Fischer
Metode ini adalah suatu titrasi air dengan larutan metal alkohol anhydrous yang
mengandung iod, belerang dioksida dan piridin berlebih. Hal yang perlu diperhatikan ialah
satu mol air bereaksi dengan satu mol iod.
c. Analitik terhadap Arsen (III) dengan reaksi HASO2 + I2 + 2H2O- H3AsO4 + 2H+ + 2I
-d. Analitik terhadap Ferosianida dengan reaksi 2Fe(CN)64- + I2 2Fe(CN)63- + 2I
-e. Analitik terhadap Belerang (sulfida) dengan reaksi H2S + I2- 2H+ + 2I- + S
f. Analitik terhadap Belerang (sulfit) dengan reaksi H2SO3 + I2 + H2O- H2SO4 + 2H+ +
2I
-Sedangkan jenis - jenis titrasi iodometri adalah
a. Penentuan lemak dan minyak
Menentukan bilangan iod lemak dan minyak, karena kemampuan mengoksidasi yang tidak
besar, tidak banyak zat yang dapat dititrasi.
b. Analit Bromat dengan reaksi BrO3- + 6H+ + 6I- Br- + 3I2 + 3H2O
c. Analit Klorin dengan reaksi CI2 + 2I- 2Cl- + I2
d. Analit Tembaga (II) dengan reaksi 2Cu2+ + 4I- 2CuI(s) +I2
e. Analit Dikromat dengan reaksi Cr2O72- + 6I- + 14H+ 2Cr3+ + 3I2 +7H2O
f. Analit Hidrogen Peroksida dengan reaksi H2O2 + 2H+ +2I- I2 + 2H2O
Dari ketiga ulangan yang telah dilakukan, titrasi KIO3 dengan Na Thiosulfat
membutuhkan 6,7 ml untuk ulangan I dengan warna yang dihasilkan kuning pucat, untuk
ulangan II dan III dibutuhkan 5,9 ml dan 6,3 ml untuk menghasilkan warna kuning pucat juga.
Sehingga rata - rata normalitas Na2S2O3 yang diperoleh yaitu 0,16 N dengan hasil
masing-masing ulangan 0,15 N, 0,17 N, dan 0,16 N. Ini membuktikan bahwa dapat terjadi perbedaan
ml yang berbeda untuk menghasilkan warna yang sama. Untuk titrasi KIO3 dengan Na
Thiosulfat ditambah 1% amilum didapatkan hasil yang berbeda pula dari ketiga ulangan.
Volume yang dibutuhkan setiap ulangan yaitu 2,2 ml, 4,1 ml, dan 7,3 ml dengan warna yang
warna kuning muda +, dan ulangan III menghasilkan warna kuning muda ++. Sedangkan rata
- rata normalitas Na2S2O3 yang didapat adalah 0,28 N dari setiap ulangan dengan normalitas
masing - masing ulangan, 0,45 N, 0,24 N, dan 0,14 N. ketika diteliti dan diulas kembali
ternyata ada faktor - faktor yang mempengaruhi perbedaan ml titrasi, warna, ataupun
normalitas setiap ulangan tersebut, antara lain :
- Larutan Amilum sukar larut dalam air sehingga diperlukan air mendidih untuk
melarutkannya.
- Dalam penitrasian, sampel tidak ditutup
- Pada titrasi KIO3 + Na2S2O3 + 1% Amilum ulangan III terlalu banyak dititrasi dengan
H2SO4 sehingga warna lebih muda. (Pencampuran H2SO4 yang terlalu banyak).
5.6 Kesimpulan
Iodometri adalaha analisa titrimetrik yang secara tidak langsung untuk zat yang bersifat
oksidator seperti besi (III), tembaga (II), kalium permanganat dimana zat ini akan
mengoksidasi iodida yang ditambahkan membentuk iodin. Iodimetri adalah analisis titrimetrik
yang secara langsung digunakan untuk zat reduktor atau natrium thiosulfat dengan
menggunakan larutan iodin atau dengan penambahan larutan baku berlebihan.
Rata - rata normalitas Na2S2O3 yang diperoleh sebelum ditambahkan amilum yaitu 0,16
N. Sedangkan rata - rata normalitas Na2S2O3 yang didapat setelah ditambahkan amilum
adalah 0,28 N. Ini menunjukan bahwa rata - rata normalitas Na2S2O3 sebelum dan setelah di
tambah amilum sangat berbeda jauh, rata-rata normalitas Na2S2O3 yang paling besar adalah
setelah ditambahkan amilum.
Kesalahan yang mungkin terjadi pada saat praktikum sehingga didapat hasil yang
berbeda adalah :
Larutan Amilum sukar larut dalam air sehingga diperlukan air mendidih untuk melarutkannya.
Dalam penitrasian, sampel tidak ditutup
Pada titrasi KIO3 + Na2S2O3 + 1% Amilum ulangan III terlalu banyak dititrasi dengan
32
ANALISA KUANTITATIF CAMPURAN Pb DAN Cu
6.1 Pendahuluan
Susunan suatu zat atau senyawa dapat dipelajari dengan kimia analisa. Dalam
menentukan susunan dan kadar unsur diperlukan kimia analisa yang berbeda sehingga kimia
analisa dibagi dua yaitu analisa kualitatif yang dipergunakan untuk mengetahui susunan unsur
atau senyawa yang terdapat dalam suatu bahan. Sedangkan analisa kuantitatif sederhana dapat
dikerjakan dengan metode gravimetri dan volumetri (titrasi).
Secara gravimetri ion Pb2+ diendapkan dan ditimbang sebagai PbSO4. Sehingga dapat
ditentukan prosentase Pb dalam cuplikan, sedangkan ion Cu2+ ditentukan dengan metode
volumetri (titrasi iodometri). Titrasi iodometri adalah titrasi tak langsung yaitu larutan yang
akan dititrasi direaksikan dulu dengan ion Iodida.
Dalam analisa ion Cu2+ dikerjakan dengan mereaksikan ion tersebut dengan ion Iodida
yang menghasilkan CuI2. Senyawa ini terurai menjadi Cu2I2, sambil melepaskan I2. I2 yang
dibebaskan dititrasi dengan larutan Na2S2O3.
Tujuan dari praktikum ini adalah untuk menentukan kadar Pb dan Cu dalam cuplikan.
6.2 Alat dan Bahan
Alat :
- Perangkat titrasi
- Erlenmeyer 250 ml
- Gelas ukur 25 ml
- Botol semprot
- Pipet volume
- Pipet ukur
- Pipet tetes
- Beaker glass 400 ml
- Pengaduk kaca
- Corong
- Kertas saring
- Oven
Bahan :
- Cuplikan Pb
- Cuplikan Cu
- H2SO4 2 N
- Alkohol 1 : 1
- KI 10%
- Na2S2O3 0,1 N
- Larutan pati 1% / amilum
6.3 Cara Kerja
a. Membuat larutan H2SO4 2 N
b. Membuat larutan alkohol 1 : 1 (50%)
c. Membuat larutan KI 10%
d. Membuat larutan Na2S2O3 0,1 N
e. Membuat larutan pati / amilum 1%
f. Membuat larutan cuplikan Pb
- Timbang 1 gram Pb asetat, encerkan hingga volume 100 ml
g. Membuat larutan cuplikan Cu
- Timbang 1 gram CuSO4, encerkan hingga volume 100 ml
h. Penentuan kadar Pb dalam cuplikan
- Ambil 10 ml larutan cuplikan Pb dan tambahkan 10 ml H2SO4 2 N
- Saring dengan kertas saring yang telah diketahui beratnya
- Endapan dicuci dengan alkohol sebanyak 15 ml
- Keringkan endapan pada suhu 100o - 115o C selama ± 15 menit
- Dinginkan dalam eksikator selama 15 menit kemudian ditimbang
i. Penentuan kadar Cu dalam cuplikan
- Ambil 10 ml larutan cuplikan Cu dan 10 ml KI 10% dan 10 ml H2SO4 2 N
- Titrasi dengan Na thiosulfat 0,1 N sampai warna kuning muda
- Tambahkan larutan kanji / amilum 3 tetes
6.4 Hasil Pengamatan
6.4.1 Penentuan kadar Pb dalam cuplikan
ULANGAN Berat Kertas
Saring Awal
Berat Kertas
Saring + Endapan ENDAPAN
I 0,51 gr 0,81 gr 0,3 gr
II 0,46 gr 0,018 gr -0,442 gr
III 0,50 gr 0,010 gr -0,490 gr
6.4.2 Penentuan kadar Cu dalam cuplikan
a. Sebelum ditambahkan amilum
ULANGAN ml Na2S2O3 WARNA
I 1,6 ml Coklat +
II 0,9 ml Coklat
III 2,5 ml Coklat ++
b. Sesudah ditambahkan amilum
ULANGAN ml Na2S2O3 WARNA
I 2,5 ml Coklat Muda +
II 2,5 ml Coklat Muda
III 1,8 ml Coklat Muda ++
6.4.3 Reaksi
H2SO4 2H+ + SO42-
Pb + H2SO4 PbSO4 + 2H+
CuI2 + H2SO4 CuSO4 + 2HI
PbSO4 Pb2+ + SO4
2-CuSO4 Cu2+ + SO4
2-Na2S2O3 2Na+ + S2O3
2-CuSO4 + Na2S2O3 CuS2O3 + Na2SO4
6.4.4 Perhitungan
Larutan Alkohol 1 : 1 (50%)50 ml alkohol : 50 ml aquades
Larutan KI 10%Berat Na2S2O3 =
= = = =
Larutan H2SO4 2 N ; 10 mlBerat H2SO4 =
= = = ≈ 46 ml
Kadar Pb dalam cuplikanKadar Pb =
x
x
x 100%
Ulangan I
Kadar Pb =
x
x
x 100%
= 10 x
x 0,0003 x 100%
= 0,68 x 0,3% = 0,204%
Ulangan II
Kadar Pb =
x
x
x 100%
= 10 x
x - 0,000442 x 100%
= 0,68 x - 0,442% = - 0,3%
Ulangan III
Kadar Pb =
x
x
x 100%
= 10 x
x - 0,00049 x 100%
= 0,68 x - 0,49% = - 0,33%
Rata - rata Kadar Pb = =
Kadar Cu dalam cuplikanKadar Cu =
x
x 100%
Ulangan I
Kadar Cu =
x
x100%
= 0,1 x
= 0,4%
Ulangan II
Kadar Cu =
x
x100%
= 0,1 x
= 0,4%
Ulangan III
Kadar Cu =
x
x100%
= 0,1 x
= 0,29%
Rata - rata Kadar Cu = =
= 0,36%
6.5 Pembahasan
Analisis Gravimetri adalah suatu bentuk analisis kuantitatif yang berupa penimbangan,
yaitu suatu proses pemisahan dan penimbangan suatu komponen dalam suatu zat dengan
jumlah tertentu dan dalam keadaan sesempurna mungkin. Gravimetri merupakan proses
isolasi dan pengukuran berat suatu unsur atau senyawa tertentu. Penimbangan dalam
gravimetri merupakan penimbangan hasil reaksi setelah zat yang dianalisis direaksikan. Hasil
reaksi dapat berupa sisa bahan / suatu gas yang terjadi atau suatu endapan yang dibentuk dari
bahan yang dianalisis.
a. Metode Pengendapan
Suatu sampel yang akan ditentukan secara gravimetri, mula - mula ditimbang secara
kuantitatif, dilarutkan dalam pelarut tertentu kemudian diendapkan kembali dengan
reagen tertentu. Senyawa yang dihasilkan harus memenuhi syarat yaitu memiliki
kelarutan sangat kecil sehingga bisa mengendap kembali dan dapat di analisis dengan
cara menimbang. Endapan yang terbentuk harus berukuran lebih besar daripada pori -
pori alat penyaring, kemudian endapan tersebut dicuci dengan larutan elektrolit yang
mengandung ion sejenis dengan ion endapan, hal ini dilakukan untuk melarutkan
pengotor yang terdapat dipermukaan endapan dan memaksimalkan endapan. Endapan
yang terbentuk dikeringkan pada suhu 100o - 130o C atau dipijarkan sampai 800o C
tergantung suhu dekomposisi dari analit.
Contoh pengendapan kation : Pengendapan sebagai garam sulfida, pengendapan nikel
dengan DMG, pengendapan perak dengan klorida atau
logam hidroksida dengan mengatur pH larutan.
Penambahan reagen secara berlebihan untuk memperkecil kelarutan produk yang
diinginkan.
Pembentukan endapan dibedakan menjadi 2 macam, yaitu :
1. Endapan di bentuk dengan reaksi antar analit dengan suatu pereaksi, biasanya
berupa senyawa baik kation meupun anion. Pengendapan dapat berupa anorganik
maupun organik.
2. Endapan di bentuk cara elektrokimia (analit dielektrolisa), sehingga terjadi logam
sebagai endapan, dengan sendiri kation diendapkan.
Untuk mendapatkan endapan yang sesuai dengan yang diinginkan maka perlu
ditentukan dulu keadaan optimumnya.
b. Metode Penguapan
Digunakan untuk menetapkan komponen - komponen daru suatu senyawa yang relatif
mudah menguap, dengan cara :
Pemanasan dalam udara atau gas tertentu.
Penambahan pereaksi sehingga mudah menguap.
Zat-zat yang relatif mudah menguap bisa diabsorpsi dengan suatu absorbsen yang sesuai
dan telah diketahui berat tetapnya. Untuk penentuan kadar air suatu kristal dalam
senyawa hidrat, dapat dilakukan dengan memanaskan senyawa pad suhu 110o - 130o C.
berat air kristalnya. Asal senyawa tidak terurai oleh pemanasan atau bisa menggunakan
zat pengering seperti CaCl dan Mg (ClO4)2
Contoh : Penentuan CO2 dalam senyawa karbonat dapat dilakukan dengan menambah
HCl berlebih, kemudian dipanaskan, gas CO2 yang sudah terjadi dialirkan
dalam larutan alkali yaitu KOH (25 - 20%) atau larutan CaOH2 yang telah
diketahui beratnya.
c. Metode Elektrolisis
Metode elektrolisis dilakukan dengan cara mereduksi ion-ion logam terlarut menjadi
endapan logam. Ion-ion logam berada dalam bentuk kation apabila dialiri dengan
arus listrik dengan besar tertentu dalam waktu tertentu maka akan terjadi reaksi
reduksi menjadi logam dengan bilangan oksidasi 0. Endapan yang terbentuk dapat
ditentukan berdasarkan beratnya, misalnya mengendapkan tembaga terlarut dalam
suatu sampel cair dengan cara mereduksi. Cara elektrolisis ini dapat diberlakukan
pada sampel yang mengandung kadar logam terlarut cukup besar seperti air limbah.
Analisis gravimetri dilakukan jika kadar analit yang terdapat dalam sampel relatif besar
sehingga dapat diendapkan dan ditimbang. Jika kadar analit dalam sampel hanya berupa unsur
pelarut, maka metode gravimetri tidak mendapat hasil yang teliti.
Setelah mengetahui tentang analisis gravimetri dan melakukan percobaan ternyata
percobaab yang dilakukan itu termasuk dalam analisis gravimetric dengan menggunakan
metode pengendapan karena tahapan-tahapan yang dilakukan selama praktikum sesuai dengan
cara-cara yang dilakukan pada metode pengendapan. Mula-mula sampel / larutan ditimbang
dan dilarutkan serta diendapkan kembali dengan reagen agar terbentuk endapan dalam
sampel.
Kadar Pb yang diperoleh dalam praktikum adalah pada ulangan I sebesar 0,204%, pada
ulangan II sebesar - 0,3% dan pada ulangan III sebesar - 0,33%. Pada ulangan II dan III itu
menunjukkan bahwa adanya pengurangan kadar Pb sebesar - 0,3% dan - 0,33%. Rata - rata
kadar Pb yang didapat adalah - 0,142%, itu berarti kadar Pb yang hilang sebesar - 0,142%.
Adapun kesalahan yang terjadi sehingga hasil dari tiap - tiap ulangan berbeda dikarenakan,
- Pada proses pembakaran atau pemijaran kadang terjadi pelepasan air yang tidak
sempurna atau sifat zat yang diendapkan yang mudah menguap.
- Adanya endapan yang mudah tereduksi oleh karbon bila disaring dengan kertas saring
Kadar Cu sebelum ditambahkan amilum dengan sesudah ditambahkan amilum ternyata
menghasilkan warna yang berbeda, volume Na2S2O3 yang dibutuhkan juga berbeda. Pada
ulangan yang belum ditambah amilum, volume Na2S2O3 yang dibutuhkan adalah 1,6 ml, 0,9
ml, dan 2,5 ml pada tiap - tiap ulangan, dengan warna yang dihasilkan adalah coklat +, coklat,
dan coklat ++. Setelah tiap - tiap ulangan ditambah amilum, volume Na2S2O3 yang
dibutuhkan adalah 2,5 ml dengan warna yang dihasilkan coklat muda +, dan pada ulangan II
dibutuhkan 2,5 ml dengan warna yang dihasilkan coklat muda, dan pada ulangan III
dibutuhkan 1,8 ml dengan warna yang dihasilkan coklat muda ++. Hal itu menunjukkan
bahwa ulangan sebelum ditambah amilum menghasilkan warna yang lebih pekat
dibandingkan ulangan yang sudah ditambah amilum. Pada ulangan yang sudah ditambahkan
amilum diperoleh kadar Cu sebesar 0,36%.
6.6 Kesimpulan
Analisis Gravimetri adalah suatu bentuk analisis kuantitatif yang berupa penimbangan,
yaitu suatu proses pemisahan dan penimbangan suatu komponen dalam suatu zat dengan
jumlah tertentu dan dalam keadaan sesempurna mungkin.
Dari hasil praktikum yang dilakukan, terjadi kehilangan kadar Pb sebesar - 0,142%.
Rata - rata kadar Cu yang dihasilkan sebesar 0,36%. Kadar Cu sebelum dan sesudah
ditambahkan amilum memberikan hasil yang sangat berbeda. Warna yang dihasilkan sebelum
ditambahkan amilum lebih pekat daripada warna yang dihasilkan sesudah ditambahkan
amilum.
Dari hasil yang didapat, adapun kesalahan dalam pelaksanaan praktikum sehingga hasil
yang didapat mengalami perbedaan, seperti :
Pada proses pembakaran atau pemijaran kadang terjadi pelepasan air yang tidak sempurna atau sifat zat yang diendapkan yang mudah menguap.
Adanya endapan yang mudah tereduksi oleh karbon bila disaring dengan kertas saring
40
ARGENTOMETRI
7.1 Pendahuluan
Salah satu titrasi yang terpenting dari titrasi pengendapan adalah titrasi ion halida (I-,Br-,
dan Cl-) dengan ion perak yang lebih dikenal dengan argentometri. Titrasi argentometri
menggunakan larutan standart perak nitrat. Dasar reaksi ini adalah :
Ag+ + X- AgX
Metode yang dipakai ialah Metode Mohr : pembentukan endapan berwarna merah
coklat, yaitu titrasi ion Cl- dengan AgNO3 dengan indikator K2CrO4.
Tujuan praktikum ini adalah untuk menentukan konsentrasi AgNO3 menganalisa kadar
NaCl dalam garam dapur dengan larutan AgNO3.
7.2 Alat dan Bahan
Alat :
- Gelas arloji
- Timbangan analitis
- Labu ukur 100 ml
- Sendok
- Corong
- Erlenmeyer
- Pipet volume
- Gelas ukur
- Beaker glass
- Perlengkapan titrasi
Bahan :
- AgNO3 0,01 N
- NaCl 0,01 N
- Indikator K2CrO4 5%
7.3 Cara Kerja
a. Membuat larutan AgNO3 0,01 N
c. Membuat larutan K2CrO4 5%
d. Standarisasi larutan AgNO3 dengan larutan standart NaCl
- Ambil 10 ml larutan NaCl 0,01 N, masukkan dalam erlenmeyer.
- Tambahkan 0,5 ml indikator K2CrO4 dalam erlenmeyer tersebut.
- Isi buret dengan larutan AgNO3.
- Titrasi larutan NaCl dengan larutan AgNO3.
- Amati perubahan warna yang terjadi.
- Ulangi titrasi 3 kali.
- Catatlah volume AgNO3 yang digunakan dan hitung normalitasnya.
e. Analisa kadar NaCl dalam garam dapur
- Timbang 2 gram garam dapur, encerkan dalam labu ukur 100 ml.
- Ambil 10 ml larutan garam, masukkan dalam erlenmeyer.
- Tambahkan 0,5 ml indikator K2CrO4 dalam erlenmeyer tersebut.
- Isi buret dengan larutan AgNO3.
- Titrasi larutan garam dengan larutan AgNO3.
- Amati perubahan warna yang terjadi.
- Ulangi titrasi 3 kali.
- Catatlah volume AgNO3 yang digunakan dan hitung kadar NaCl dalam garam dapur.
7.4 Hasil Pengamatan
7.4.1 Standarisasi AgNO3 0,01 N dengan NaCl 0,01 N
ULANGAN ml AgNO3 WARNA
I 2,5 ml Kuning Keruh ++
II 0,8 ml Kuning Keruh
III 3,6 ml Kuning Keruh +
Analisis kadar NaCl dalam garam dapur
ULANGAN ml AgNO3 WARNA
I 1,1 ml Kuning Keruh
II 1,3 ml Kuning Keruh +
III 4,2 ml Kuning Keruh ++
7.4.2 Reaksi
AgNO3 Ag+ + NO3
-AgNO3 + NaCl AgCl + NaNO3
K2CrO4 2K+ + CrO4
2-K2CrO4 + 2AgNO3 2KNO3 + AgCrO4
7.4.3 Perhitungan
Berat AgNO3 =
=
=
=
= 0,425 gr ≈ 0,43 gr
Berat NaCl =
=
= 0,174 gr
≈ 0,17 gr
K2CrO4 5% = 5 gram dalam 100 ml aquades
Standarisasi AgNO3 dengan NaCl
N AgNO3 =
Ulangan I
N AgNO3 =
=
= 0,04 N Ulangan II
N AgNO3 =
=
= 0,125 N ≈ 0,13 N
Ulangan III
N AgNO3 =
=
= 0,027 N ≈ 0,03 N
Rata - rata AgNO3 = = = 0,066 N ≈ 0,07 N
Kadar NaCl dalam garam dapur
Kadar NaCl =
Ulangan I
Kadar NaCl =
x 100% =
x 100% = 0,22%
Ulangan II
Kadar NaCl =
x 100% =
x 100% = 0,26%
Ulangan III
Kadar NaCl =
x 100% =
x 100% = 0,85%
Rata - rata Kadar NaCl = = = 0,44%
7.5 Pembahasan
Argentometri berasal dari kata Argentum (bahasa latin) yang berarti perak. Argentum adalah salah satu cara untuk menentukan kadar zat dalam suatu larutan yang dilakukan
dengan titrasi berdasarkan pembentukan endapan dengan ion Ag+. Argentometri merupakan
titrasi pengendapan sampel yang dianalisis dengan menggunakan ion perak, biasanya ion - ion
yang ditentukan dalam titrasi argentometri adalah ion halide (Cl-, Br-, I-).
Dasar titrasi argentometri adalah pembentukan endapan yang tidak mudah larut antara
titran dengan analit.
Contoh : Titran penetuan NaCl dimana ion Ag+ dari titran akan bereaksi dengan ion Cl- dari
analit membentuk garam yang tidak mudah larut AgCl.
Ag(NO3)(aq) + NaCl(aq) AgCl(s) + NaNO3(aq)
Setelah ion klorida dalam analit habis maka kelebihan ion perak akan bereaksi dengan
indikator. Berdasarkan jenis indikator dan teknik titrasi yang dipakai maka titrasi argentometri
dibagi menjadi 4 metode, yaitu :
1. Metode Mohr
Metode ini dapat digunakan untuk menetapkan kadar klorida dan bromida dalam
suasana netral dengan larutan baku perak nitrat dengan penambahan larutan kalium
kromat sebagai indikator. Pada awal titrasi akan terjadi endapan perak klorida dan
setelah titik ekuivalen, maka penambahan sedikit perak nitrat akan bereaksi dengan
2. Metode Volhard
Metode yang digunakan untuk menetapkan perak dalam suasana asam dengan larutan
baku kalium / ammonium thiosianat, kelebihan thiosianat dapat ditetapkan secara jelas
dengan garam besi (III) nitrat atau besi (III) ammonium sulfat sebagai indikator yang
membentuk warna merah dari kompleks besi (III) thiosianat dalam lingkungan asam
nitrat 0,5 - 1,5 N. Titrasi ini harus dilakukan dalam suasana asam, sebab ion besi (III)
akan diendapkan menjadi Fe(OH)3 jika suasananya asam, sehingga titik akhir tidak
dapat ditunjukkan.
3. Metode Fajans
Pada metode ini digunakan indikator absorbs, sebagai kenyataan bahwa pada titik
ekuivalen indikator terabsorbsi oleh endapan. Indikator ini tidak memberikan perubahan
warna kepada larutan, tetapi pada permukaan endapan. Endapan harus dijaga sedapat
mungkin dalam bentuk koloid.
4. Metode Leibig
Pada metode ini, titik akhir titrasinya tidak ditentukan dengan indikator. Akan tetapi
ditunjukkan dengan terjadinya kekeruhan. Ketika larutan perak nitrat ditambahkan pada
larutan alkali asianida akan terbentuk endapan putih. Tetapi pada penggojogan akan
larut kembali karena akan terbentuk kompleks sianida yang stabil dan larut.
Dalam titrasi argentometri, AgNO3 berfungsi sebagai pelarut dalam proses pengendapan unsur
- unsur halogen. Contoh unsur halogen yaitu, Iodin (I), Chlor (Cl), Fluorin (F), dan Bromin
(Br).
Prinsip metode mohr dalam titrasi argentometri, AgNO3 akan bereaksi dengan NaCl
membentuk endapan AgCl yang berwarna putih. Bila semua Cl- sudah habis bereaksi dengan
Ag+ dari AgNO3, maka kelebihan sedikit Ag+ akan bereaksi dengan CrO42- dari indikator
K2CrO4 yang ditambahkan, ini berarti titik akhir telah dicapai, yaitu bila terbentuk warna
merah bata dari endapan Ag2CrO4. Reaksi dari metode tersebut terhadap AgNO3 yaitu tingkat
keasaman (pH) larutan yang mengandung NaCl berpengaruh pada titrasi. Titrasi dengan
metode mohr dilakukan pada pH 8. Jika pH terlalu asam (pH < 6), sebagian indikator K2CrO4
akan berbentuk HCrO4-, sehingga larutan AgNO3 lebih banyak yang dibutuhkan untuk
membentuk endapan Ag2CrO4. Pada pH basa (pH > 8), sebagian Ag+ akan diendapkan
menjadi perak karbonat atau perak hidroksida, sehingga larutan AgNO3 sebagai penitrasi
Standarisasi AgNO3 dengan NaCl dengan menggunakan indikator K2CrO4 menurut
pustaka yang ditemukan. ml titrasi tiap-tiap ulangan didapat 27,9 ml, 27,5 ml, dan 27,5 ml dan
jika dirata - rata volume AgNO3 didapat hasil sebesar 27,67 ml. Dengan perhitungan N
AgNO3nya :
N AgNO3 x V AgNO3 = N NaCl x V NaCl
N AgNO3 =
=
= 0,09 N
dan kadar NaCl dalam garam dapur menurut pustaka, dari ketiga ulangan didapat ml titrasi
sebesar 7,1 ml, 6,9 ml, dan 7,0 ml. Setelah dirata - rata menjadi 7,0 ml. Dengan volume NaCl
yang digunakan 10 ml.
N AgNO3 = 0,09 N
Jadi, Berat NaCl = N AgNO3 x Mr NaCl x V AgNO3
= 0,09 x 58 x 7,0
= 36,54 mg
Kadar NaCl =
x 100% = 8,12%
Jika hasil dalam pustaka dibandingkan dengan hasil praktikum yang telah dilakukan, terdapat
perbedaan yang sangat besar. Normalitas AgNO3 yang didapat dari praktikum 0,04 N, 0,13 N,
dan 0,03 N dengan rata - rata yang dihasilkan 0,07 N. Sedangkan kadar yang didapat dari
hasil praktikum 0,44% (kadar NaCl) dengan warna yang dihasilkan berbeda pula. Dari
perbandingan kedua hasil tersebut adapun kesalahan - kesalahan yang terjadi selama
praktikum berlangsung sehingga hasil tiap-tiap ulangan berbeda, antara lain :
- Proses titrasi terlalu lama sehingga didapat warna yang berbeda - beda.
- Larutan yang kurang tercampur.
7.6 Kesimpulan
Argentometri merupakan titrasi pengendapan sampel yang dianalisis dengan
menggunakan ion perak. Titrasi argentometri dibagi m