BAB 2
TINJAUAN PUSTAKA
2.1. Minyak Kelapa Sawit
Minyak kelapa sawit berasal dari buah tanaman kelapa sawit yang didapat dengan
cara mengekstraksi buah tersebut. Kelapa sawit menghasilkan dua jenis minyak
yang berlainan sifatnya, yaitu minyak yang berasal dari sabut (mesokarp) yang
disebut dengan Crude Palm Oil atau CPO, dan minyak yang berasal dari inti (kernel) yang disebut Palm Kernel Oil atau PKO (Somaatmaja, 1981).
Perbedaan minyak sawit dengan minyak inti sawit adalah adanya pigmen
karotenoid yang berwarna kuning merah pada minyak sawit. Perbedaan lainnya
yaitu dalam kandungan asam lemaknya. Pada minyak inti sawit terdapat asam
kaproat dan asam kaprilat yang tidak terdapat pada minyak sawit (Muchtadi,
1992).
CPO mengandung lebih kurang 1% komponen minor yang terdiri dari
karotenoid, tokoferol, tokotrienol, sterol-sterol, fosfolipid dan glikolipid, terpen
dan gugus alifatik, serta elemen sisa (trace element) lainnya. Komponen terbesar
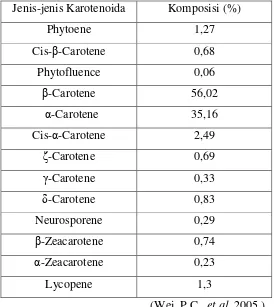
Tabel 2.1. Jenis-jenis karotenoida dan komposisinya dalam komponen minor
Jenis-jenis Karotenoida Komposisi (%)
Phytoene 1,27
Cis- -Carotene 0,68
Phytofluence 0,06
-Carotene 56,02
α-Carotene 35,16
Cis-α-Carotene 2,49
-Carotene 0,69
-Carotene 0,33
δ-Carotene 0,83
Neurosporene 0,29
-Zeacarotene 0,74
α-Zeacarotene 0,23
Lycopene 1,3
(Wei, P.C., et al, 2005 )
2.2. Karotenoida
Karotenoida merupakan kelompok pigmen yang berwarna kuning, jingga, merah
jingga, dan bersifat larut dalam minyak. Karotenoida terdapat dalam kloroplast
(0,5%) bersama-sama dengan klrorofil (9,3%) terutama pada bagian permukaan
atas daun, dekat dengan dinding sel palisade (Winarno, 1991).
Karotenoida dibagi atas empat golongan, yaitu; (1) karotenoida
hidrokarbon, C40H56 seperti α, , dan karoten dan likopen; (β) xantofil dan
derivate karoten yang mengan dung oksigen dan hidroksil antara lain kriptosantin,
C40H55OH dan lutein, C40H54(OH)2; (3) asam karotenoida yang mengandung
gugus karboksil; dan (4) ester xantofil asam lemak (Meyer, 1966).
Karotenoida termasuk senyawa lipida yang tidak tersabunkan, larut
terutama dalam pemisahan karotenoida dari bahan lain (Ranganna, 1979). Sifat
fisika dan kimia karotenoida adalah :
1. Larut dalam minyak dan tidak larut dalam air
2. Larut dalam kloroform, benzene, karbon disulfide dan petroleum eter
3. Tidak larut dalam etanol dan metanol dingin
4. Tahan terhadap panas apabila dalam keadaan vakum
5. Peka terhadap oksidasi, autooksidasi dan cahaya
6. Mempunyai ciri khas adsorpsi cahaya (Meyer 1966).
Adanya ikatan rangkap menyebabkan karotenoida peka terhadap oksidasi,
dan reaksinya akan lebih cepat dengan adanya sinar dan katalis logam, khususnya
tembaga, besi, dan mangan (Walfford, 1980). Oksidasi terjadi secara acak pada
ikatan rangkap rantai atom karbonnya. Kepekannya terhadap oksidasi membuat
karotenoida digunakan sebagai antioksidan yang kekuatannya menyamai
tokoferol dan askorbat. Reaksi oksidasi dapat menyebabkan hilangnya warna
karotenoida dalam makanan dan merupakan mekanisme degradasi utama yang
banyak menjadi perhatian (Fennema, 1996).
Karotenoida belum mengalami kerusakan oleh pemanasan pada suhu
60oC. Reaksi oksidasi karotenoida berjalan lebih cepat pada suhu yang relatif
tinggi terutama jika terdapat prooksidan (Worker, 1957). Karotenoida merupakan
sumber vitamin A yang berasal dari tanaman dalam bentuk α-karoten, -karoten
dan -karoten, sedangkan yang berasal dari hewan berbentuk vitamin A. Senyawa ini sering disebut antixerophtalmia, karena kekurangan senyawa tersebut dapat
menimbulkan gejala rabun mata. Senyawa -karoten dalam minyak sawit sebagai provitamin A bermanfaat untuk penanggulangan kebutaan karena xerophtalmia,
mengurangi peluang terjadinya kanker, mencegah proses menua yang teralu dini,
meningkatkan imunitas tubuh, dan mengurangi terjadinya penyakit degeneratif.
H2C
CHC CHC CHCH CCH CHCH CCH
CH3 CH3 CH CH3 CH3
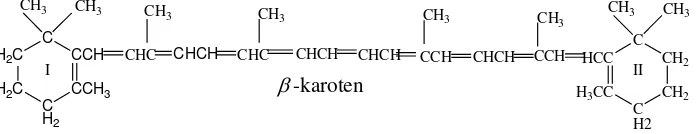
Gambar. β.1. Struktur -karoten
(Fennema, 1996)
Mengkonsumsi -karoten jauh lebih aman daripada mengkonsumsi vitamin A yang dibuat secara sintetis. Pendekatan yang terbaik untuk mencegah
defisiensi vitamin A adalah dengan menghimbau agar suplementasi -karoten dosis tinggi dilakukan pada diet intake. Tubuh manusia memiliki kemampuan
mengubah sejumlah besar -karoten menjadi vitamin A (retinol), sehingga
-karoten disebut provitamin A (Winarno, 1991). Sekitar β5% dari -karoten yang teradsorpsi pada mukosa usus tetap dalam bentuk utuh, sedangkan 75% sisanya
diubah menjadi retinol (vitamin A) dengan bantuan enzim 15, 15’ -karotenoksigenase (Fennema, 1996).
2.2.1. Metode-Metode Memperoleh Karotenoida
Berbagai metode untuk memperoleh karotenoida telah banyak dilakukan oleh para
peneliti, antara lain :
2.2.1.1. Metode Penyabunan
Proses penyabunan diawali dengan melarutkan minyak sawit kasar dengan
KOH/NaOH. Prinsip dari metode ini adalah memisahkan senyawa karotenoida
yang merupakan senyawa yang tidak tersabunkan dengan senyawa-senyawa yang
dapat disabunkan. Pemisahan selanjutnya adalah dengan mengekstraksi
karotenoida tersebut dengan menggunakan pelarut organik (Parker, 1992). Blaizot
(1956) menyabunkan CPO dengan NaOH metanolik selama beberapa jam pada
suhu 30-40oC. Gliserin yang terbentuk dipisahkan dengan cara dekantasi, bahan
bertekanan 0,001-0,0001 mmHg, diperoleh karotenoida bercampur dengan residu
dengan yield sebesar 5-6%. Suria (2015) menambahkan CPO kedalam KOH etanolik. Campuran tersebut didiamkan dalam pendingin selama 24 jam (untuk
mengeliminasi lipida dan mengendapkan poliphenol pada fase alkohol).
Campuran yang tersabunkan kemudian ditempatkan pada corong pisah dengan etil
eter dan fase ini dicuci dengan air, lapisan bawah yang terbentuk dibuang.
Campuran tersebut dikeringkan dengan sulfat anhidrat dan dievaporasi hingga
benar-benar kering, diperoleh peningkatan konsentrasi karotenoida sebesar 13%
dari konsentrasi awal 507 ppm.
2.2.1.2. Metode Ekstraksi Pelarut
Teknologi ekstraksi telah banyak dikembangkan untuk memperoleh karotenoida.
Ektraksi pelarut merupakan suatu proses transfer massa antara minyak sawit
dengan suatu pelarut yang sesuai, yang memiliki afinitas dan selektifitas yang
baik terhadap karotenoida (Othman, 2010). Ekstraksi pelarut pada kondisi normal
banyak menggunakan n-heksana sebagai pelarut untuk mengekstraksi karotenoida
dari minyak mentah sawit, akan tetapi n-heksana berpotensi mengakibatkan
kebakaran, berbahaya terhadap kesehatan dan lingkungan (Choo, et al., 1996). Kekurangan penggunaan pelarut n-heksana tersebut menyebabkan banyak usaha
untuk mengekstraksi karotenoid dari minyak sawit yang lebih aman, salah satunya
ialah ektraksi cair superkritis (SFE). Aplikasi ekstraksi cair superkritis adalah
dengan menggunakan karbondioksida superkritis (SC-CO2) sebagai pelarut, jika
dibandingkan dengan pelarut n-heksana atau aseton, karbondioksida lebih bersifat
inert, tidak beracun, tidak menimbulkan ledakan, tidak meninggalkan residu pada
produk (Watkins et al., 1994).
Ekstraksi karotenoida dari minyak sawit mentah dengan pelarut
karbondioksida superkritis (SC-CO2) telah dilakukan oleh (Wei et al., 2005). Proses ektraksi dilakukan dengan memasukkan CPO kedalam wadah ekstraksi
(extraction vessel), ekstraksi terbawa ke system dinamis (flow through).
Pada penelitian ini dilakukan variasi tekanan, suhu, laju alir, dan ukuran sampel.
Dibagian luar wadah dirangkai saringan untuk mencegah kotoran terbawa.
Ekstrak yang dihasilkan dikumpulkan pada suatu wadah yang ditutup dengan
alumunium foil, disimpan dalam ruangan gelap dengan suhu -10oC untuk
mencegah degradasi oleh panas, udara dan cahaya. Hasil yang diperoleh
menunjukkan kelarutan karotenoida dalam minyak sawit mentah terhadap
karbondioksida superkritis (SC-CO2) rendah yaitu antara 1,31 x 10-4 sampai 1,58
x 10-3 gkg-1 karbondioksida, pada kondisi suhu 40-80oC dan tekanan 14-30Mpa,
recovery karotenoida yang diperoleh sebesar 80-90%.
2.2.1.3. Adsorpsi
Adsorpsi adalah proses penyerapan molekul-molekul cair atau gas pada
permukaan zat padat atau cair yang terjadi karena adanya interaksi gaya
tarik-menarik antara molekul-molekul zat yang diadsorpsi dengan molekul-molekul zat
yang mengadsorpsi yang terjadi hanya pada permukaan adsorben (Sulaiman, H.
1997). Bahan yang dipakai untuk melakukan proses adsorpsi dinamakan
adsorben, sedangkan bahan yang dijerap disebut adsorbat (Kumar, K. et al., 2004). Kebanyakan adsorben adalah bahan yang mempunyai porositas tinggi
untuk menempatkan adsorbat pada dinding pori. Dalam proses penjerapan,
permukaan adsorben yang sifatnya polar akan mengikat molekul yang sifatnya
polar dan permukaan adsorben nonpolar akan mengikat molekul yang sifatnya
nonpolar (Sunarno, 2000)
Adsorpsi pada fase padat diklasifikasikan kedalam adsorpsi kimia
(kemisorpsi) dan adsorpsi fisika (Fisisorpsi). Dalam adsorpsi kimia, reaksi kimia
terjadi pada permukaan padatan dan gas tertahan pada permukaan padatan yang
relatif merupakan ikatan kimia yang kuat. Dalam adsorpsi fisika, molekul gas
tertahan pada permukaan padatan yang relatif lemah karena terjadi ikatan
Gaya Van der Waals merupakan salah satu jenis interaksi elektrostatis
yang kekuatan ikatannya sangat lemah dibandingkan ikatan kimia lainnya seperti
ikatan ionik, kovalen, kovalen koordinasi, dan ikatan logam. Berdasarkan
kepolaran molekul, ada tiga tipe gaya Van der Waals yang ditemukan oleh
ilmuwan sains yang berbeda-beda dimana tipe ini diberi nama sesuai dengan
nama penemunya, yaitu:
2.2.1.3.1. Gaya Keesom
Interaksi ini terjadi antara sesama molekul kovalen polar yang memiliki momen
dipol permanen. Momen dipol permanen ini terjadi karena adanya perbedaan
sebaran densitas elektron yang tidak merata pada semua bagian atom-atomnya
dimana elektron akan lebih banyak berkumpul pada atom yang lebih
elektronegatif dibandingkan atom lainnya. Ketika molekul-molekul polar ini
berdekatan satu dengan yang lainnya, maka kutub positif dari satu molekul akan
berikatan dengan kutub negatif molekul lain. Interaksi ini merupakan interaksi
yang lebih kuat diantara keempat tipe gaya Van der Waals.
Contoh: H3N----HCl
N
H H Cl
Atom N yang lebih elektronegatif akan cenderung menarik elektron ke arahnya
sehingga densitas elektron pada N lebih tinggi daripada H. Demikian juga pada
HCl, densitas elektron pada Cl lebih tinggi daripada H. Gaya intermolekul ini
terjadi antara atom N dari molekul NH3 dengan atom H dari molekul HCl.
2.2.1.3.2. Gaya Debye
Interaksi ini terjadi antara molekul kovalen polar dan molekul kovalen nonpolar.
Ketika molekul nonpolar berdekatan dengan molekul polar, maka kutub positif
dari molekul polar berinteraksi dengan elektron pada molekul nonpolar sehingga
Contoh: OH2---O2
+
-H2O
Kovalen Polar
O2
Kovalen Nonpolar
H2O O2
Dipol
Permanen DipolTerinduksi
- + - + - +
2.2.1.3.3. Gaya London
Interaksi ini terjadi antara sesama molekul kovalen nonpolar. Ketika sesama
molekul kovalen nonpolar saling berdekatan maka, masing-masing molekul
tersebut cenderung mengalami self-polarised membentuk dipol terinduksi akibat adanya osilasi awan-awan elektron yang akan menyebabkan densitas elektron
pada satu atom lebih besar daripada atom lainnya sehingga molekul tersebut
menjadi sedikit polar. Contohnya adalah interaksi N2, O2 . Interaksi ini merupakan
interaksi yang paling lemah diantara gaya Van der Waals (Madan, R.D. 2003).
2.2.1.4. Adsorpsi Menggunakan Polimer Sebagai Adsorben
Baharin (1998) telah mengadsorpsi karotenoida dari CPO dengan proses
kromatografi kolom menggunakan adsorben suatu resin berpori, yaitu kopolimer
stirena-divinil benzene. Proses tersebut dilakukan dengan menempatkan adsorben
yang telah dicuci dengan alkohol kedalam kolom, kondisi kolom dijaga pada suhu
40-60oC. CPO dilarutkan dalam 400 ml isopropil alkohol (IPA) atau etanol
kemudian dimasukkan kedalam kolom, dan larutan CPO dalam IPA atau etanol
ditampung, setelah itu kedalam kolom ditambahkan n-heksana sebanyak 300 ml,
larutan CPO dalam n-heksana ditampung. Pelarut dari kedua larutan tersebut
diuapkan dengan rotary-evaporator kemudian ditimbang padatan yang diperoleh.
Karotenoida yang diperoleh dianalisa dengan menggunakan spektrofotometer, dan
hasil tertinggi diperoleh sebesar 108.929 ppm menggunakan adsorben diaion
Karlina (2012) menggunakan adsorben polimer yaitu kalsium polistirena
sulfonat untuk mengadsorpsi karotenoida dari metil ester kasar. Kadar karotenoida
dalam metil ester kasar sebesar 601 ppm. Proses adsorpsi dilakukan dengan
mencampurkan metil ester kedalam etanol kemudian karotenoidanya diadsorpsi
dengan adsorben kalsium polistirena sulfonat, sambil diaduk untuk
menyempurnakan penyerapan, kemudian adsorben yang mengandung karotenoida
dipisahkan dari campuran metil ester dengan sentrifugasi. Karotenoida yang
terserap dalam adsorben kemudian didesorpsi dengan pelarut n-heksana, dan
setelah pelarutnya diuapkan diperoleh karotenoida dengan konsentrasi sebesar
116.000 ppm, telah terjadi pemekatan sebanyak 193 kali.
Lois (2014) mengadsorpsi tokoferol dan tokotrienol dari metil ester
minyak kemiri, dengan menggunakan 2 jenis adsorben, yaitu garam Ca dari
polistirena sulfonat ( derajat sulfonasi >30%, larut dalam air) dan garam Ca dari
polistirena sulfonat ( derajat sulfonasi <30%, larut dalam kloroform). Hasil
adsorpsi tertinggi dihasilkan dengan menggunakan adsorben berderajat sulfonasi
>30% terhadap tokotrienol yaitu sebesar 100%, hasil desorpsinya sebesar 1,1%,
sedangkan hasil desorpsi tertinggi diperoleh dengan menggunakan adsorben
berderajat sulfonasi <30% terhadap tokoferol yaitu sebesar 2,3%, hasil
adsorpsinya sebesar 99,1%.
Garam M-PSS (M= Na, Mg, Ca, Sr dan Ba; PSS = Polistirena Sulfonat )
juga telah digunakan Justaman (2014) untuk mengadsorpsi karotenoida dari CPO,
polistirena sulfonat yang digunakan berderajat sulfonasi 9,1%. Proses penyerapan
dilakukan dengan mencampurkan CPO dalam etanol kemudian ditambahkan
adsorben, dilakukan pengocokan untuk menyempurnakan penyerapan
karotenoida, kemudian adsorben yang mengandung karotenoida dipisahkan dari
larutan CPO dengan sentrifugasi. Karotenoida yang terserap pada adsorben
kemudian didesorpsi dengan pelarut n-heksana. Hasil tertinggi yang diperoleh
terlihat pada proses desorpsi dengan menggunakan garam Ca-PSS yaitu sebesar
84,53%, hasil adsorpsinya sebesar 75,78%.
2.3. Ikatan Hidrokarbon Tak Jenuh Dengan Orbital σ Logam
Hidrokarbon tak jenuh seperti alkena mengandung satu atau lebih ikatan rangkap
karbon-karbon. Alkena yang paling sederhana adalah etena dengan rumus C2H4.
Ikatan rangkap terkonjungasi adalah ikatan rangkap yang dipisahkan oleh
masing-masing satu ikatan tunggal. Adanya ikatan rangkap terkonjungasi dalam satu
molekul akan memberikan sifat fisik dan kimia yang khusus. Banyak molekul
yang mengandung sistem ikatan rangkap terkonjungasi mengadsorpsi panjang
gelombang spesifik dari sinar tampak (Stoker, H.S, 1991).
Alkena sederhana adalah ligan dihapto yang dapat mendonasikan densitas
elektron dari orbital π yang terisi ke orbital σ kosong dari logam (Gambar β.β. a )
dan selanjutnya orbital π* dari ligan akan menerima densitas elektron dari orbital d
logam yang terisi (Gambar 2.2. b ). Penjelasan ikatan logam-alkena karena donasi
densitas elektron dari orbital π alkena ke orbital σ kosong logam dan secara
bersamaan terjadi penerimaan densitas elektron oleh orbital π* alkena yang
kosong
dari orbital d logam yang terisi tersebut dikenal dengan model
Dewar-Chatt-Duncanson (DCD). Aliran desitas elektron dari orbital d logam yang terisi ke
orbital π* alkena disebut backdonation, dan ini terjadi pada logam-logam transisi
C
C H H
H H
C
C H H
H H
a
b
M
M
H
Gambar 2.2. Interaksi alkena dengan logam : (a) donasi densitas elektron dari
orbital π ligan alkena ke orbital σ kosong logam, (b) Backdonation densitas elektron dari orbital d logam yang terisi ke orbital π*
alkena yang kosong.
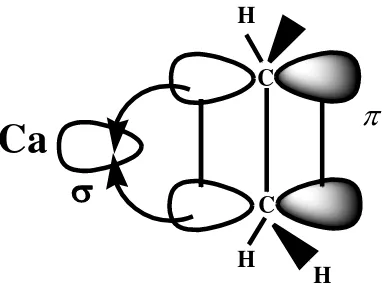
Dalam hal logam nontransisi seperti kalsium, yang terjadi hanya donasi
densitas elektron dari orbital π alkena ke orbital σ kosong logam kalsium seperti
terlihat pada Gambar 2.3 berikut.
Ca
C
C H
H
H
Gambar 2.3. Donasi densitas elektron dari orbital π ligan alkena ke orbital σ
2.4. Reaksi Sulfonasi
Sulfonasi merupakan reaksi substitusi untuk memasukkan gugus –SO3H kedalam
molekul organik melalui ikatan kimia pada atom karbon, sangat jarang pada atom
nitrogen. Reaksi sulfonasi ini adalah reaksi elektrofilik, sehingga sangat
bergantung pada jenis gugus yang terikat pada cincin aromatis. Agen pensulfonasi
yang umumnya digunakan adalah H2SO4 dan SO3. Pada umumnya, reaksi
sulfonasi ini digunakan untuk memodifikasi ahan polimer yang memiliki cincin
aromatis sebagai rantai utamanya. Sulfonasi polimer aromatic merupakan reaksi
yang sangat kompleks karena reversibilitasnya (Pinto, B.P., dkk, 2006).
Sulfonasi terhadap senyawa aromatis seperti benzena dengan asam sulfat
berasap (H2SO4) menghasilkan asam benzensulfonat dapat dilihat pada Gambar
berikut.
SO3 H2SO4
40 Co
SO3
H
SO3H
asam benzenasulfonat 50%
Gambar. 2.4. Reaksi pembuatan asam benzenasulfonat
Reaksi sulfonasi ini bersifat mudah balik (reversible) dan menunjukkan
efek isotop kinetik yang sedang, dimana ion benzenonium sebagai zat antara
dalam reaksi dapat kembali ke benzena atau terus ke asam benzenasulfonat
dengan hamper sama mudahnya. Gugus asam sulfonat mudah digantikan oleh
aneka ragam gugus lain. Oleh karena itu, pada reaksi sulfonasi, asam arilsulfonat
merupakan zat antara yang bermanfaat dalam sintesis (Fessenden dan Fessenden,
2.5. Polistirena Sulfonat
Polistirena sulfonat merupakan turunan dari polistirena yang dibuat melalui reaksi
sulfonasi polistirena dengan suatu agen pensulfonasi, baik dengan reaksi homogen
maupun heterogen. Agen pensulfonasi yang sering digunakan adalah H2SO4
pekat, SO3, campuran trietil fosfat dan SO3, serta larutan asetil sulfat dalam
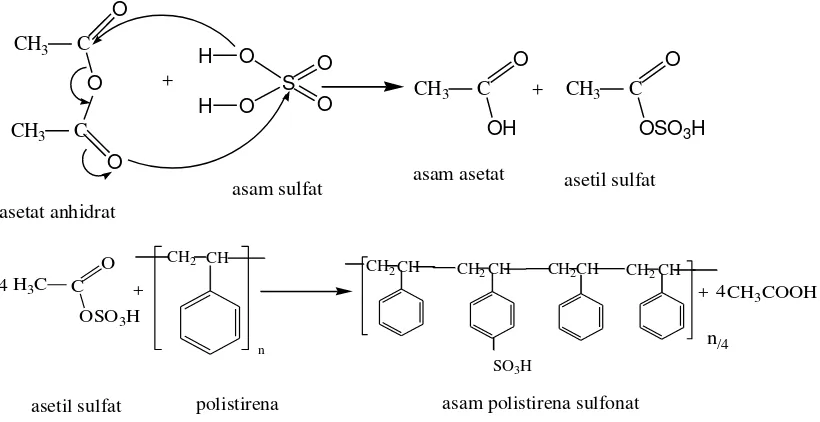
dikloroetana (Martins et al. 2003). Adapun reaksi polistirena dengan agen
pensulfonasi asetil sulfat adalah sebagai berikut.
+
Gambar 2.5. Reaksi sulfonasi polistirena dengan agen pensulfonasi asetilsulfat
Kelarutan dari polistirena sulfonat tergantung pada derajat sulfonasi dan
jenis pelarutnya. Asam polistirena sulfonat dengan derajat sulfonasi diatas 30 %
bersifat larut dalam air sedangkan, asam polistirena sulfonat dengan derajat
sulfonasi di bawah 30 % bersifat larut dalam pelarut organik, misalnya kloroform
2.6. Kalsium Polistirena Sulfonat
Polistirena disulfonasi dengan asetil sulfat yang dibuat dari asetat
anhidrida dan asam sulfat pekat dalam pelarut kloroform, akan menghasilkan
asam polistirena sulfonat. Asam polistirena sulfonat yang dihasilkan ada dua jenis
yaitu, asam polistirena sulfonat yang larut dalam air dan asam polistirena sulfonat
yang tidak larut dalam air namun larut dalam kloroform. Asam polistirena
sulfonat yang larut dalam kloroform kemudian ditambahkan dengan NaOH
hingga pH=7 menghasilkan garam natrium polistirena sulfonat. Adanya
kemungkinan asam sulfat yang tersisa dan asam asetat sebagai hasil samping,
menyebabkan terbentuknya garam Na2SO4 dan CH3COONa. Na2SO4 dan
CH3COONa ini akan dipisahkan dengan penambahan etanol, karena kedua garam
ini lebih larut dalam etanol sehingga natrium polistirena sulfonat yang diperoleh
lebih murni. Natrium polistirena sulfonat yang diperoleh selanjutnya dilarutkan
kembali dalam kloroform lalu ditambahkan dengan CaCl2 sehingga menghasilkan
kalsium polistirena sulfonat.
2.7. Desorpsi
Desorpsi adalah proses pelepasan molekul-molekul adsorbat dari permukaan
adsorben. Desorpsi dapat terjadi karena interaksi antara molekul adsorbat dengan
adsorben relatif lebih lemah sehingga dapat lebih mudah dilepaskan dari
permukaan adsorben
Untuk memperlemah interaksi antara adsorben dengan adsorbat dapat
dilakukan dengan beberapa cara, yaitu : (Sulaiman, A.H. 1997)
1. Menaikkan temperatur
Proses desorpsi membutuhkan energi panas (endotermik). Dengan
menaikkan temperatur sistem maka, interaksi molekul adsorbat dengan
adsorben akan menjadi lebih lemah sehingga molekul adsorbat menjadi
lebih mudah dilepaskan dari permukaan adsorben.
2. Menambahkan zat-zat kimia/pelarut
Dalam hal ini, molekul adsorbat yang teradsorpsi akan didesorpsi dengan
menambahkan zat-zat kimia (pelarut) yang sifatnya lebih kuat berinteraksi
dengan molekul adsorbat daripada interaksi antara adsorben dengan molekul
adsorbat.
Dalam penelitian ini, karotenoida yang teradsorpsi oleh kalsium
polistirena sulfonat akan didesorpsi dengan menambahkan pelarut etanol kering
secara berulang sebanyak empat kali sehingga dapat memutuskan ikatan antara