PEDOMAN PELAKSANAAN
PELAYANAN IZIN PRODUKSI KOSMETIKA
Direktorat Bina Produksi dan Distribusi Kefarmasian
Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan
i
KATA PENGANTAR
Puji syukur kami panjatkan ke hadirat Tuhan Yang Maha Esa atas karunia-Nya, sehingga penyusunan Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika dapat diselesaikan. Penyusunan buku ini dimaksudkan sebagai petunjuk pelaksanaan izin produksi kosmetik bagi pelaku usaha, dan juga merupakan upaya untuk menjamin pelaksanaan pelayanan prima kepada masyarakat sebagai wujud dari penerapan prinsip-prinsip clean government dan good governance secara universal.
Buku Pedoman ini disusun berdasarkan Peraturan Menteri Kesehatan Nomor 1175/Menkes/Per/VIII/2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika. Semoga pedoman ini dapat digunakan sebagai acuan bagi petugas kesehatan pusat dan daerah, pelaku usaha yang melaksanakan izin produksi kosmetika.
Kami mengharapkan kritik dan saran untuk perbaikan buku ini.
Jakarta, 2011
Direktur Bina Produksi dan Distribusi Kefarmasian
Drs. T. Bahdar J. Hamid, Apt, M.Pharm NIP 19560807 19860311001
ii
KATA SAMBUTAN
Assalamu’alaikum Wr.Wb.
Pertama-tama marilah kita memanjatkan puji syukur ke hadirat Allah SWT, bahwa atas rahmat dan hidayah-Nya, kita dapat menyelesaikan penyusunan buku Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika.
Dengan telah disusunnya pedoman ini, diharapkan tatacara izin produksi kosmetik menjadi lebih terarah dan dapat dijadikan dasar untuk menyamakan alur sistem dari proses perizinan tersebut, sehingga dapat menjamin ketepatan waktu yang efisien dan efektif.
Pedoman ini merupakan salah satu upaya merespon adanya perubahan dalam Izin Produksi Kosmetik, yaitu dengan adanya Peraturan Menteri Kesehatan Republik Indonesia Nomor 1175/Menkes/Per/VIII/2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika.
Kami berharap dengan diterbitkannya buku Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika ini dapat dijadikan acuan dalam pelaksanaan proses perizinan dan dapat memberi manfaat bagi pelaku usaha dalam melakukan pengajuan perijinan secara efektif, efisien dan transparan sehingga dapat menciptakan iklim yang kondusif dalam berusaha.
Akhirnya, kami menyampaikan penghargaan dan terima kasih kepada semua pihak atas bantuan dan perhatian yang telah diberikan dalam rangka penyusunan Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika.
Semoga Allah SWT senantiasa memberikan petunjuk dan kekuatan bagi kita sekalian.
Direktur Jenderal
Dra. Sri Indrawaty, Apt., M.Kes. NIP 19530621 1980122001
iii DAFTAR ISI
KATA PENGANTAR... i
KATA SAMBUTAN... ii
DAFTAR ISI... iii
SK DIRJEN TENTANG PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIKA... iv SK TIM PENYUSUNAN... vi DAFTAR LAMPIRAN... x BAB I PENDAHULUAN... 1 1. LATAR BELAKANG... 1 2. TUJUAN... 2 3. SASARAN... 2
BAB II RUANG LINGKUP IZIN PRODUKSI………... 3
1. GOLONGAN PRODUSEN………... 3 2. JENIS PERMOHONAN………...…... 3 a. IZIN BARU... 3 b. PERUBAHAN IZIN... 3 c. PERPANJANGAN IZIN... 4 3. PENCABUTAN IZIN... 4
4. MASA BERLAKU IZIN... 4
5. BENTUK DAN JENIS SEDIAAN KOSMETIKA...4
6. KATEGORI DAN SUB KATEGORI... 5
BAB III PELAYANAN PERIZINAN... 8
1. ALUR PELAYANAN... 8
2. PERSYARATAN PERIZINAN... 9
3. MONITORING DAN EVALUASI PELAYANAN... 10
3.1 STANDAR PROSEDUR OPERASIONAL... 11
a. STANDAR PROSEDUR OPERASIONAL PELAYANAN... 11
b. STANDAR PROSEDUR OPERASIONAL PENANGANAN KELUHAN... 11
c. STANDAR PROSEDUR OPERASIONAL PENILAIAN BERKAS... 11
d. STANDAR PROSEDUR OPERASIONAL PENYERAHAN IZIN... 11
3.2 KENDALI KERJA... 11 3.3 PELENGKAP INFORMASI... 11 3.4 EVALUASI... 11 BAB IV PENUTUP... 12 DAFTAR PUSTAKA... 13 LAMPIRAN
iv
KEPUTUSAN
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN NOMOR : HK.03.05/V/443.1/2011
TENTANG
PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIKA DENGAN RAHMAT TUHAN YANG MAHA ESA
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN,
Menimbang : a. bahwa dalam rangka menunjang pelayanan publik prima di bidang izin produksi kosmetika perlu dilakukan upaya peningkatan kualitas pelayanan secara administratif;
b. bahwa berdasarkan pertimbangan sebagaimana dimaksud pada huruf a perlu disusun pedoman pelaksanaan pelayanan izin produksi kosmetika yang ditetapkan dengan Keputusan Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan;
Mengingat : 1. Undang-Undang Nomor 5 Tahun 1984 tentang Perindustrian (Lembaran Negara Tahun 1984 Nomor 22, Tambahan Lembaran Negara RI Nomor 3274);
2. Undang-Undang Nomor 8 Tahun 1999 tentang Perlindungan Konsumen (Lembaran Negara Republik Indonesia Tahun 1999 Nomor 42, Tambahan Lembaran Negara Republik Indonesia Nomor 3821); 3. Undang-Undang Nomor 14 Tahun 2008 tentang Keterbukaan
Informasi Publik (Lembaran Negara Republik Indonesia Tahun 2008 Nomor 61, Tambahan Lembaran Negara Republik Indonesia Nomor 4846);
4. Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan (Lembaran Negara RI Tahun 2009 Nomor 144, Tambahan Lembaran Negara RI Tahun 2009 Nomor 5063);
5. Peraturan Pemerintah Nomor 17 Tahun 1986 tentang Kewenangan Pengaturan, Pembinaan dan Pengembangan Industri (Lembaran Negara Tahun 1996 Nomor 49, Tambahan Lembaran Negara Nomor 3637);
6. Peraturan Pemerintah Nomor 72 Tahun 1998 tentang Pengamanan Sediaan Farmasi dan Alat Kesehatan (Lembaran Negara RI Tahun
v
1998 Nomor 138, Tambahan Lembaran Negara RI Tahun 1998 Nomor 3781);
7. Peraturan Pemerintah Nomor 51 Tahun 2008 tentang Pekerjaan Kefarmasian (Lembaran Negara Republik Indonesia Tahun 2009 Nomor 124, Tambahan Lembaran Negara Republik Indonesia Nomor 5044);
8. Keputusan Menteri Kesehatan Republik Indonesia Nomor 1202/MENKES/SK/X/2004 tentang Pengamanan Kosmetika;
9. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1175/MENKES/PER/VIII/2010 tentang Izin Produksi Kosmetika; 10. Peraturan Menteri Kesehatan Republik Indonesia Nomor
1176/MENKES/PER/VIII/2010 tentang Notifikasi Kosmetika;
11. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1144/MENKES/PER/VIII/2010 tentang Organisasi dan Tata Kerja Kementerian Kesehatan;
MEMUTUSKAN: Menetapkan :
KESATU : KEPUTUSAN DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN TENTANG PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIK;
KEDUA : Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetik, sebagaimana dimaksud pada Diktum Kesatu sebagai landasan kerja pelaksanaan perizinan kosmetik;
KETIGA : Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetik, sebagaimana dimaksud pada Diktum Kedua agar digunakan sebagai pedoman oleh bagi semua pihak yang terkait dalam proses pelayanan izin produksi kosmetika di Direktorat Jenderal Bina Kefarmasian dan Alat Kesehatan; KEEMPAT : Keputusan ini mulai berlaku sejak tanggal ditetapkan.
Ditetapkan di Jakarta
pada tanggal 11 Agustus 2011
Direktur Jenderal,
Dra. Sri Indrawaty, Apt., M.Kes. NIP 19530621 1980122001
vi
KEPUTUSAN
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN NOMOR : HK.03.05/V/442.2/2011
TENTANG
TIM PENYUSUN PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIKA DENGAN RAHMAT TUHAN YANG MAHA ESA
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN,
Menimbang : bahwa dalam rangka mempersiapkan serta menyelenggarakan Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika perlu dibentuk Tim Penyusun Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika yang ditetapkan dengan Keputusan Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan;
Mengingat : 1. Keputusan Menteri Kesehatan Republik Indonesia Nomor 1202/ MENKES/SK/X/2004 tentang Pengamanan Kosmetika
2. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1175/MENKES/PER/VIII/2010 tentang Izin Produksi Kosmetika
3. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1176/MENKES/PER/VIII/2010 tentang Notifikasi Kosmetika
4. Peraturan Menteri Kesehatan Republik Indonesia Nomor 1144/MENKES/PER/VIII/2010 tentang Organisasi dan Tata Kerja Kementerian Kesehatan;
MEMUTUSKAN Menetapkan :
KESATU : KEPUTUSAN DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN TENTANG TIM PENYUSUN PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIKA;
KEDUA : Membentuk Tim Penyusun Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika dengan susunan keanggotaan sebagaimana tercantum dalam Lampiran Keputusan ini;
vii
KETIGA : Tugas Tim sebagaimana dimaksud dalam Diktum KEDUA sebagai berikut: 1. Mengadakan rapat-rapat persiapan dan koordinasi dengan pihak
terkait;
2. Menyusun Draft Pedoman Pelaksanaan Pelayanan Perizinan Produksi Kosmetika;
3. Melaksanakan pembahasan Draft Pedoman Pelaksanaan Pelayanan Perizinan Produksi Kosmetika; dan
4. Menyempurnakan draft setelah mendapat masukan dalam pembahasan.
KEEMPAT : Dalam melakukan tugasnya Tim bertanggung jawab kepada Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan;
KELIMA : Masa tugas Tim terhitung mulai tanggal ditetapkannya Keputusan ini sampai dengan akhir Tahun 2011;
KEENAM : Segala biaya yang timbul dalam pelaksanaan tugas Tim dibebankan pada DIPA Direktorat Bina Produksi dan Distribusi Kefarmasian Tahun 2011; KETUJUH : Keputusan ini mulai berlaku sejak tanggal ditetapkan.
Ditetapkan di Jakarta
pada tanggal 11 Agustus 2011
Direktur Jenderal,
Dra. Sri Indrawaty, Apt., M.Kes. NIP 19530621 1980122001
viii
Lampiran Keputusan Direktur Jenderal Bina
Kefarmasian dan Alat Kesehatan Nomor …
Tanggal … TIM PENYUSUN
PEDOMAN PELAKSANAAN PELAYANAN IZIN PRODUKSI KOSMETIKA
Penasehat : Direktur Jenderal Bina kefarmasian dan Alat Kesehatan Penanggung Jawab : Direktur Bina Produksi dan Distribusi Kefarmasian
Ketua : Kepala Sub Direktorat Produksi Kosmetika dan Makanan Sekretaris : Kepala Seksi Perizinan Sarana Produksi Kosmetika Anggota : 1. Kepala Sub Direktorat Farmasi Komunitas;
2. Kepala Sub Direktorat Inspeksi Alat kesehatan dan Perbekalan Kesehatan Rumah Tangga;
3. Kepala Bagian Hukum, Organisasi dan Humas;
4. Kepala Sub Direktorat Produksi dan Distribusi Obat dan Obat Tradisional
5. Kepala Sub Direktorat Produksi dan Distribusi Narkotika; 6. Kepala Seksi Standarisasi Produksi Kosmetika dan
Makanan;
7. Kepala Sub Bagian Tata Usaha Direktorat Bina Produksi dan Distribusi Kefarmasian;
8. Kepala Seksi Standarisasi Produksi dan Distribusi; 9. Kepala Seksi Perizinan Sarana Produksi dan Distribusi; 10. Kepala Seksi Sediaan Farmasi Khusus;
11. Kepala Seksi Kerjasama Produksi dan Distribusi; 12. Kepala Seksi Analisis Obat dan Bahan Baku Obat; 13. Kepala Sub Bagian Hukum;
14. Kepala Sub Bagian Tata Usaha Direktorat Bina Pelayanan Kefarmasian;
15. Kepala Seksi Evaluasi Program Obat Publik; 16. Ike Susanty;
17. Isnaeni Diniarti, S.Farm., Apt; 18. Diara Oktania;
ix
20. Yanto Eka Putera, S.Farm, Apt.; 21. Damaris Parrangan;
22. Sri Suratini, S.Si., Apt.;
23. Sandy Wifaqah, S. Farm., Apt.; 24. Nofiyanti;
25. Anwar Wahyudi, SE. Sekretariat : 1. Yulia Yuliati Barkah, SH.;
2. Helfi Yanti A.R, S. Si.;
x
DAFTAR LAMPIRAN
Lampiran 1 Permohonan Izin Produksi Kosmetika Lampiran 2 Rekomendasi Dinas Kesehatan
Lampiran 3 - Laporan Analisis Hasil Pemeriksaan Balai Besar / Balai POM - Berita Acara Pemeriksaan Setempat Balai Besar/ Balai POM
Lampiran 4 Rekomendasi BPOM
Lampiran 5 Surat Pernyataan Siap Berproduksi
Lampiran 6 SK Dirjen Tentang Izin Produksi Kosmetika Lampiran 7 Penundaan Izin Produksi Kosmetika Lampiran 8 Penolakan Izin Produksi Kosmetika
Lampiran 9 Permohonan Perubahan Golongan Izin Produksi Kosmetika
Lampiran 10 Permohonan Perubahan Nama Direktur / Pengurus / Penanggung Jawab Produksi Kosmetika / alamat tanpa pindah lokasi
Lampiran 11 Addendum Tentang Izin Produksi Kosmetika
Lampiran 12 Standar Prosedur Operasional Pelayanan Izin Produksi Kosmetika Lampiran 13 Standar Prosedur Operasional Penanganan Keluhan Izin Produksi
Kosmetika
Lampiran 14 Standar Prosedur Operasional Penilaian Berkas Izin Produksi Kosmetika
Lampiran 15 Standar Prosedur Operasional Penyerahan Izin Produksi Kosmetika Lampiran 16 Kendali Kerja
1 BAB I PENDAHULUAN 1. LATAR BELAKANG
Dalam rangka meningkatkan daya saing produk ASEAN di era pasar bebas ASEAN (AFTA), diupayakan adanya harmonisasi standar produk dalam harmonisasi ASEAN yang salah satu tujuannya adalah untuk meningkatkan kerja sama antar Negara-negara ASEAN dalam rangka menjamin mutu, keamanan dan klaim manfaat dari semua kosmetika yang dipasarkan di ASEAN. Maka untuk itu perlu meningkatkan persiapan dan kesiapan seluruh pemangku kepentingan, antara lain pemerintah, tenaga kesehatan maupun pelaku usaha.
Penerapan harmonisasi di bidang kosmetika di ASEAN sebenarnya sudah dimulai pada tanggal 1 Januari 2008. Namun melalui berbagai pertimbangan terutama terkait kesiapan industri kosmetika dalam Negeri yang juga wajib memenuhi persyaratan yang ditetapkan dalam HARMONISASI ASEAN di bidang kosmetika, Indonesia mulai menerapkan Notifikasi dan Izin Produksi Kosmetika pada tanggal 1 Januari 2008. Untuk mengawal penerapan tersebut telah dikeluarkan beberapa peraturan baru yaitu Peraturan Menteri Kesehatan No. 1175 Tahun 2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika dan Peraturan Menteri Kesehatan No. 1176 Tahun 2010 tanggal 20 Agustus 2010 tentang Notifikasi Kosmetika.
Kesiapan Industri Kosmetika di Indonesia juga patut didukung dan didorong untuk menjawab tantangan perubahan ini. Keseluruhan kesiapan ini, tentunya harus didukung dengan kesiapan sistem, perangkat regulasi dan pedoman pelaksanaannya.
Dengan telah ditetapkannya Peraturan Menteri Kesehatan RI, yaitu Peraturan Menteri Kesehatan No. 1175 Tahun 2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika dan beberapa peraturan teknis lainnya, menggantikan peraturan yang ada karena sudah tidak sesuai lagi dengan kebutuhan, kondisi dan perkembangan ilmu pengetahuan serta teknologi terkini. Terbitnya peraturan baru ini, Pemerintah dituntut untuk menerapkan prinsip-prinsip Clean Goverment dan Good Governance secara universal dan diyakini menjadi prinsip yang diperlukan untuk memberikan pelayanan publik prima kepada masyarakat. Kualitas pelayanan publik prima dapat dapat diukur dengan ada tidaknya suap, ada tidaknya SPO, kesesuaian proses pelayanan dengan SPO yang ada, keterbukaan informasi, keadilan dan kecepatan dalam pemberian pelayanan dan kemudahan masyarakat melakukan pengaduan.
Pemerintah wajib melaksanakan pembinaan, pengawasan dan pengendalian terhadap produksi dan distribusi kosmetika, terutama pada era perdagangan bebas dalam rangka melindungi masyarakat dari efek yang tidak diinginkan akibat penggunaan kosmetika dan
2
sekaligus dapat memberikan iklim yang kondusif bagi dunia usaha. Oleh karena itu, Direktorat Bina Produksi dan Distribusi Kefarmasian perlu menyusun pedoman pelaksanaan pelayanan perizinan produksi kosmetika sebagai acuan dalam pelaksanaan proses perizinan produksi kosmetika.
2. TUJUAN
a. Sebagai acuan pelaksanaan proses perizinan produksi kosmetika
b. Sebagai panduan bagi pelaku usaha dalam pengurusan perizinan produksi kosmetika
3. SASARAN
a. Petugas pelaksana pelayanan perizinan b. Pelaku usaha bidang kosmetika
3 BAB II
RUANG LINGKUP IZIN PRODUKSI
Dalam rangka meningkatkan mutu pelayanan perizinan di bidang kosmetika, perlu pengaturan izin produksi kosmetika sesuai dengan Peraturan Menteri Kesehatan No. 1175 Tahun 2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika. Adapun ruang lingkup ini meliputi :
1. GOLONGAN PRODUSEN
Izin produksi kosmetika diberikan sesuai bentuk dan jenis sediaan kosmetika yang akan dibuat yang dibedakan atas 2 (dua) golongan sebagai berikut, yaitu golongan A dan B.
a. Golongan A :
yaitu izin produksi untuk industri kosmetika yang dapat membuat semua bentuk dan jenis sediaan kosmetika.
b. Golongan B :
yaitu izin produksi untuk industri kosmetika yang dapat membuat bentuk dan jenis sediaan kosmetika tertentu dengan menggunakan teknologi sederhana, bentuk dan jenis sediaan kosmetika tertentu tersebut ditetapkan oleh Kepala Badan POM. 2. JENIS PERMOHONAN
a. IZIN BARU
Izin yang diberikan kepada pelaku usaha sebelum produksi berlangsung. b. PERUBAHAN IZIN
Perubahan izin produksi harus dilakukan apabila : 1. Perubahan golongan produsen
Perubahan golongan dari B ke A karena akan memperluas usaha, menambah jenis sediaan atau dari golongan A ke Golongan B karena akan memperkecil usaha atau mengurangi bentuk dan jenis sediaan.
2. Penambahan bentuk dan jenis sediaan
Penambahan Bentuk Sediaan
misalnya ; yang telah diproduksi sediaan kosmetika bentuk cairan, dan akan menambah sediaan kosmetika bentuk cairan kental, Cream dsb.
Penambahan Bentuk dan Jenis
misalnya ; yang telah diproduksi sediaan kosmetika bentuk padat (sabun), akan menambah sediaan kosmetika bentuk padat (Lipstik) dan Cairan dsb, maka produsen harus melakukan perubahan izin.
3. Pindah alamat/lokasi
Jika pelaku usaha akan pindah lokasi ke alamat yang baru.
4. Perubahan nama direktur/pengurus, penanggung jawab, pada alamat dan lokasi industri yang sama
4
Pelaku usaha atau pemohon tidak perlu mengajukan izin seperti perizinan baru, tetapi hanya membuat permohonan untuk Perubahan nama direktur/pengurus, penanggung jawab, pada alamat dan lokasi industri yang sama dan akan dibuatkan / diterbitkan Surat Keputusan dalam bentuk addendum.
c. PERPANJANGAN IZIN
Izin Produksi yang telah habis masa berlakunya harus diperpanjang. Persyaratan untuk perpanjangan sama dengan syarat Izin Produksi baru.
3. PENCABUTAN IZIN
Izin produksi kosmetika dapat dicabut apabila : a. Atas permohonan sendiri
b. Izin usaha industri atau tanda daftar industri habis masa berlakunya dan tidak diperpanjang
c. Izin produksi habis masa berlakunya dan tidak diperpanjang
d. Tidak berproduksi dalam jangka waktu 2 (dua) tahun berturut-turut e. Tidak memenuhi standar dan persyaratan untuk memproduksi kosmetika
4. MASA BERLAKU IZIN
Izin produksi berlaku selama 5 (lima) tahun dan dapat diperpanjang kembali. 5. BENTUK DAN JENIS SEDIAAN KOSMETIKA
BENTUK JENIS 1. Cair 2. Suspensi 3. Cairan Kental 4. Gel 5. Krim 6. Setengah Padat 7. Serbuk - Serbuk Tabur - Serbuk Compact 8. Padat - Sabun - Lipstick - Garam 9. Aerosol
5 6. KATEGORI DAN SUB KATEGORI
No Tipe Produk Kategori Sub Kategori
1 Krim, emulsi, cair, cairan kental, gel, minyak untuk kulit (wajah, tangan, kaki dan lain-lain)
Sediaan Bayi Baby oil
Baby lotion Baby cream Sediaan Kebersihan
Badan
Perawatan kaki Sediaan Perawatan kulit Penyegar kulit
Nutritive cream
Krim Malam (Night Cream) Pelembab (Moisturizer)
Krim untuk pijat (Message cream) Minyak untuk pijat (Message oil) Gel untuk pijat (Message gel) Anti jerawat
Perawatan kulit, badan, tangan Sediaan perawatan kulit lainnya Pelembab untuk mata (Eye moisturizer)
Krim untuk mata (Eye cream) 2 Masker wajah (kecuali
produk
peeling/pengelupasan kulit secara kimiawi)
Sediaan Perawatan Kulit Masker Peeling Masker mata 3 Alas bedak (cairan kental,
pasta, serbuk)
Sediaan Rias Wajah Dasar make up (Make up base) Vinishing cream
Alas bedak
Sediaan Rias Mata Alas bedak untuk mata (Eye foundation)
4 Bedak untuk rias wajah, bedak badan, bedak antiseptic dan lain-lain
Sediaan Kebersihan Badan
Bedak Badan
Bedak Badan Antiseptik
Sediaan Bayi Bedak Bayi
Sediaan Rias Wajah Bedak Wajah (face Powder) Bedak Cair (Liquid Powder) Sediaan Perawatan Kulit Bedak dingin
5 Sabun mandi, sabun mandi antiseptik, dan lain-lain
Sediaan Bayi Sabun mandi bayi, padat Sediaan Mandi Sabun mandi, padat
Sabun mandi antiseptic, padat 6 Sediaan wangi-wangian Sediaan bayi Baby cologne
Sediaan wangi-wangian Eau de toilet Eau de parfum Eau de cologne Pewangi badan Parfum
6 7 Sediaan mandi (garam
mandi, busa mandi, minyak gel dan lain-lain)
Sediaan mandi Sabun mandi cair
Sabun mandi antiseptik(cair) Busa mandi
Minyak mandi (Bath oil) Garam mandi (Bath salt)
Serbuk untuk mandi (Bath powder)
Sediaan untuk mandi lainnya Sediaan bayi Sabun mandi bayi, cair Sediaan Perawatan Kulit Lulur
Mangir 8 Sediaan Depilatori Sediaan rambut Depilatori 9 Deodoran dan
anti-perspiran Sediaan kebersihan badan Deodoran Antiperspiran Deodoran antiperspirant
10 Sediaan Rambut Sediaan pewarna
rambut
Pewarna rambut
Pemudar warna rambut (Hair lightener)
Aktivator
Tata rias rambut fantasi
Sediaan rambut Pengeriting rambut (Permanent wave)
Neutralizer
Pelurus rambut (Hair
straightener) Hair styling Sampo
Sampo ketombe
Pembersih rambut dan tubuh (Hair and body wash)
Pomade (Hair dressing) Kondisioner (Hair condisioner) Hair creambath
Tonik rambut(Hair tonic)
Sediaan Bayi Sampo bayi
11 Sediaan cukur (krim, busa, cair, cairan kental, dan lain-lain)
Sediaan Cukur Sediaan pra cukur Sediaan cukur Sediaan pasca cukur 12 Sediaan rias mata, rias
wajah, sediaan pembersih rias wajah dan mata
Sediaan Rias mata Pensil alis Bayangan mata Eye liner Mascara
Sediaan rias mata lainnya
Pembersih rias mata (Eye make-up remover)
Sediaan Rias wajah Bedak padat (Compact powder) Pemerah pipi (Blush on)
Tata rias “Panggung” Tata rias “Pengantin” Make-up kit
7
Sediaan Perawatan Kulit Pembersih kulit muka Penyegar kulit muka Astrigent
13 Sediaan Perawatan dan Rias Bibir
Sediaan Rias Wajah Lip Color Lip Liner Lip gloss Lip shine Lip care 14 Sediaan Perawatan Gigi dan
Mulut
Sediaan Hygiene Mulut Pasta gigi Mouth washes Penyegar mulut
Sediaan hygiene mulut lainnya 15 Sediaan untuk perawatan
dan rias kuku
Sediaan Kuku Base coat
Top coat Nail dryer
Nail extendernail elongator Nail strengthener
Nail hardener
Pewarna kuku (Nail color)
Pembersih pewarna kuku (Nail polish remover)
Cuticle removeri softener Sediaan kuku lainnya 16 Sediaan untuk organ
kewanitaan bagian luar
Sediaan Kebersihan Badan
Feminine hygiene 17 Sediaan mandi surya dan
tabir surya
Sediaan tabir surya Sediaan tabir surya Sediaan mandi surya Sediaan mandi surya
18 Sediaan untuk
menggelapkan kulit tanpa berjemur
Sediaan menggelapkan kulit
Sediaan untuk menggelapkan kulit tanpa berjemur
19 Sediaan Pencerah Kulit Sediaan Perawatan Kulit Krim Pencerah Kulit Sekitar Mata (Eye cream (Whitening))
20 Sediaan anti Wrinkle Sediaan Perawatan Kulit Wrinkle smoothinf remover Anti aging cream
Krim antiwrinkle kulit sekitar mata (Eye cream (antiwrinkle))
Jika tidak tercantum dalam kategori dan sub kategori di atas maka mengacu pada ACD (ASEAN Cosmetic Directive).
8 BAB III
PELAYANAN PERIZINAN
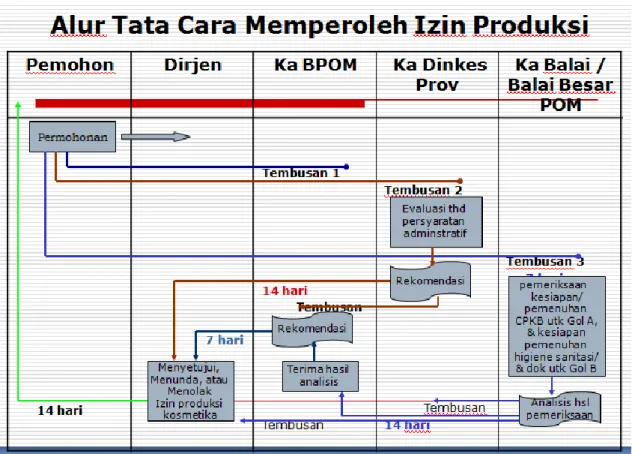
1. ALUR PELAYANAN
Dalam pelaksanaan pelayanan izin produksi kosmetika, pelaksana pelayanan perizinan dan pemohon harus mengikuti alur tata cara perizinan sebagai berikut :
a. Permohonan izin produksi diajukan oleh pemohon kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, Kepala Dinas, dan Kepala Balai/ Balai Besar setempat dengan menggunakan formulir 1 sebagaimana terlampir (lampiran 1)
b. Paling lama 7 (tujuh) hari kerja sejak menerima tembusan, Kepala Dinas setempat melakukan evaluasi terhadap pemenuhan persyaratan administratif
c. Paling lama 7 (tujuh) hari kerja sejak menerima tembusan, Kepala Balai/ Balai Besar setempat melakukan pemeriksaan terhadap kesiapan/ pemenuhan CPKB untuk izin produksi industri kosmetika Golongan A dan kesiapan pemenuhan higiene sanitasi dan dokumentasi sesuai CPKB untuk izin produksi industri kosmetika Golongan B
d. Paling lama 14 (empat belas) hari kerja setelah evaluasi terhadap pemenuhan persyaratan administratif dinyatakan lengkap, Kepala Dinas setempat wajib menyampaikan rekomendasi kepada Direktur Jenderal dengan tembusan Kepala Badan POM dengan menggunakan formulir 2 sebagaimana terlampir (lampiran 2)
e. Paling lama 14 (empat belas) hari kerja setelah pemeriksaan terhadap kesiapan/pemenuhan CPKB dinyatakan selesai, Kepala Balai setempat wajib menyampaikan analisis hasil pemeriksaan kepada Kepala Badan dengan tembusan kepada Kepala Dinas dan Direktur Jenderal dengan menggunakan formulir 3 sebagaimana terlampir (lampiran 3)
f. Paling lama 7 (Tujuh) hari setelah menerima analisis hasil pemeriksaan, Kepala Badan memberikan rekomendasi kepada Direktur Jenderal dengan menggunakan formulir 4 sebagaimana terlampir (lampiran 4)
g. Apabila dalam 30 (tiga puluh) hari kerja setelah tembusan surat permohonan diterima oleh Kepala Balai / Balai Besar dan Kepala Dinas setempat, tidak dilakukan pemeriksaan/evaluasi, pemohon dapat membuat surat pernyataan siap berproduksi kepada Direktur Jenderal dengan tembusan kepada Kepala Badan, Kepala Dinas setempat dan Kepala Balai / Balai Besar setempat dengan menggunakan formulir 5 sebagaimana terlampir (lampiran 5)
h. Dalam jangka waktu 14 (empat belas) hari kerja setelah menerima rekomendasi Kepala Dinas dan Kepala Badan, Direktur Jenderal menyetujui, menunda atau menolak Izin produksi dengan menggunakan formulir 6, formulir 7 atau formulir 8 sebagaimana terlampir (lampiran 6, 7, dan 8)
9
Gambar alur tatacara memperoleh izin produksi
2. PERSYARATAN PERIZINAN
(1) Permohonan izin produksi industri kosmetika golongan A. Kelengkapan persyaratan sebagai berikut :
a. Surat permohonan
b. Fotokopi izin usaha industri atau tanda daftar industri yang telah dilegalisir c. Nama direktur/pengurus
d. Fotokopi kartu tanda penduduk (KTP) direksi perusahaan/pengurus e. Susunan direksi/pengurus
f. Surat pernyataan direksi/pengurus tidak terlibat dalam pelanggaran peraturan perundang-undangan di bidang farmasi (dibuat di atas materai)
g. Fotokopi akta notaris pendirian perusahaan yang telah disahkan sesuai ketentuan peraturan perundang-undangan
h. Fotokopi Nomor Pokok Wajib Pajak (NPWP)
i. Denah bangunan yang disahkan oleh Kepala Badan j. Bentuk dan jenis sediaan kosmetika yang dibuat k. Daftar peralatan yang tersedia
l. Surat pernyataan kesediaan bekerja sebagai apoteker penanggung jawab (tidak bekerja di tempat lain)
m. Fotokopi ijazah dan Surat Tanda Registrasi Apoteker (STRA) penanggung jawab yang telah dilegalisir
10
Untuk izin produksi industri kosmetika golongan A diberikan apabila : a. Memiliki Apoteker sebagai penanggung jawab
b. Memiliki fasilitas produksi sesuai dengan produk yang akan dibuat c. Memiliki fasilitas laboratorium
d. Wajib menerapkan CPKB
(2) Permohonan izin produksi industri kosmetika golongan B. Kelengkapan persyaratan sebagai berikut :
a. Surat permohonan
b. Fotokopi izin usaha industri atau tanda daftar industri yang telah dilegalisir c. Nama direktur/pengurus
d. Fotokopi kartu tanda penduduk (KTP) direksi perusahaan/pengurus e. Susunan direksi/pengurus
f. Surat pernyataan direksi/pengurus tidak terlibat dalam pelanggaran peraturan perundang-undangan di bidang farmasi (dibuat di atas materai)
g. Fotokopi akta notaris pendirian perusahaan yang telah disahkan sesuai ketentuan peraturan perundang-undangan sepanjang pemohon berbentuk badan usaha
h. Fotokopi Nomor Pokok Wajib Pajak (NPWP)
i. Denah bangunan yang disahkan oleh Kepala Badan j. Bentuk dan jenis sediaan kosmetika yang dibuat k. Daftar peralatan yang tersedia
l. Surat pernyataan kesediaan bekerja penanggung jawab
m. Fotokopi ijazah dan Surat Tanda Registrasi penanggung jawab yang telah dilegalisir
n. Membayar PNBP ke Bank yang ditunjuk / ditentukan
Untuk izin produksi industri kosmetika golongan B diberikan apabila :
a. Memiliki sekurang-kurangnya tenaga teknis kefarmasian (Asisten Apoteker, D3 Farmasi, Analis Farmasi) sebagai penanggung jawab
b. Memiliki fasilitas produksi dengan teknologi sederhana sesuai produk yang akan dibuat
c. Mampu menerapkan higiene sanitasi dan dokumentasi sesuai CPKB 3. MONITORING DAN EVALUASI PELAYANAN
Untuk melakukan penilaian terhadap mutu pelayanan, dapat dilakukan monitoring dan evaluasi terhadap :
- Kesesuaian waktu layanan
- Berapa besar keluhan yang tidak terlayani - Berapa rata-rata waktu penanganan keluhan - Berapa persen kepatuhan pelaksanaan SPO
11 3.1 STANDAR PROSEDUR OPERASIONAL
a. STANDAR PROSEDUR OPERASIONAL PELAYANAN
Merupakan suatu petunjuk kerja yang menguraikan kegiatan yang dilakukan dalam perizinan produksi kosmetika. Alur yang dimulai dari pemohon sampai kembali lagi kepada pemohon. Dapat dilihat pada lampiran 12.
b. STANDAR PROSEDUR OPERASIONAL PENANGANAN KELUHAN
Merupakan suatu petunjuk kerja yang menguraikan kegiatan yang dilakukan dalam perizinan produksi kosmetika apabila ditemukan keluhan dari klien. Dapat dilihat pada lampiran 13.
c. STANDAR PROSEDUR OPERASIONAL PENILAIAN BERKAS
Merupakan suatu petunjuk kerja yang menguraikan kegiatan yang dilakukan dalam perizinan produksi kosmetika untuk penilaian terhadap seluruh berkas yang dipersyaratkan dalam perizinan kosmetika. Dapat dilihat pada lampiran lampiran 14.
d. STANDAR PROSEDUR OPERASIONAL PENYERAHAN IZIN
Merupakan suatu petunjuk kerja yang menguraikan kegiatan yang dilakukan dalam perizinan produksi kosmetika saat proses perizinan telah selesai dan diserahkan kepada pemohon. Dapat dilihat pada lampiran 15.
3.2 KENDALI KERJA
Merupakan suatu dokumen yang harus dikerjakan dalam proses pelayanan perizinan produksi kosmetika. (Terlampir)
3.3 PELENGKAP INFORMASI
Dalam rangka pelayanan publik prima, penyedia pelayanan harus membuat SOP, kendali Kerja dan bahan-bahan informasi seperti leaflet / brosur ( terlampir ) dan ada ruang konsultasi.
3.4 EVALUASI
Evaluasi pelayanan dapat dilakukan dengan melihat : a. berapa % pelayanan mengikuti SPO yang telah dibuat, b. berapa lama rata-rata keluhan ditangani,
12 BAB IV PENUTUP
Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika merupakan suatu panduan bagi pelaku usaha dalam pengurusan Izin dan sebagai acuan pelaksanaan serta sebagai standar prosedur operasional bagi setiap petugas yang bekerja melayanani perizinan sehingga dapat memberikan pelayanan yang sebaik-baiknya.
Dengan telah disusunnya Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika, diharapkan petugas dan pelaku usaha memahami semua terkait perizinan produksi kosmetika. sehingga pelayanan dapat berjalan lancar efektif dan efisien.
Mudah-mudahan buku Pedoman Pelaksanaan Pelayanan Izin Produksi Kosmetika ini dapat bermanfaat dalam melaksanakan proses perizinan.
13
DAFTAR PUSTAKA
Undang-Undang Nomor 36 Tahun 2009 tentang Kesehatan (Lembaran Negara RI Tahun 2009 Nomor 144, Tambahan Lembaran Negara RI Tahun 2009 Nomor 5063).
Peraturan Menteri Kesehatan Republik Indonesia Nomor 1175/Menkes/Per/VIII/2010 tanggal 20 Agustus 2010 tentang Izin Produksi Kosmetika.
Peraturan Menteri Kesehatan Republik Indonesia Nomor 1176/Menkes/Per/VIII/2010 tanggal 20 Agustus 2010 tentang Notifikasi Kosmetika.
Keputusan Menteri Kesehatan Republik Indonesia Nomor 1202.Menkes/SK/X/2004 tentang Pengamanan Kosmetika.
Anonim, 1995. Farmakope Indonesia edisi IV. Departemen Kesehatan Republik Indonesia. Jakarta.
14
LAMPIRAN 1
Nomor : Lampiran :
Perihal : Permohonan Izin Produksi Kosmetika Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat kesehatan di-
Jakarta
Dengan Hormat,
Bersama ini kami mengajukan permohonan untuk mendapatkan Izin Produksi Kosmetik Golongan ……….. , dengan data sebagai berikut :
I. UMUM : 1. Pemohon
a. Nama Pemohon/Direktur : ……… b. Alamat dan nomor telepon : ……… 2. Perusahaan
a. Nama Perusahaan : ………
b. Alamat kantor & No. Telepon : ………
c. Bidang Usaha : ………
d. Bentuk Perusahaan : ……… e. Akte pendirian yang telah disahkan
oleh Kementerian Kehakiman,
nomor & tanggal : ……… f. Nomor Pokok Wajib Pajak (NPWP) : ……… g. Pimpinan Perusahaan : ………
(Daftar Nama Direksi dan Dewan Komisaris dilampirkan)
3. Penanggung Jawab Produksi
a. Nama : ………
b. Pendidikan/Keahlian : ……… c. Nomor STRA / Penanggung Jawab : ……… 4. Nomor Izin Usaha Industri/
Tanda Daftar Industri : ……… II. PABRIK KOSMETIKA :
1. Lokasi dan luas tanah
a. Lokasi Pabrik * : ( ) Lahan Peruntukan ( ) Estate Industri ( ) Kompleks Industri
15
( ) Daerah lainnya
b. Alamat Pabrik : ………
c. Luas Tanah : ………
2. a. Izin Produksi pabrik Kosmetik : A / B** b. Bentuk dan jenis sediaan serta fasilitas diproduksi :
Bentuk/Jenis sediaan Kapasitas produksi per tahun Mesin dan peralatan Rencana Produksi
III. FASILITAS LAIN :
No Jenis Fasilitas Keterangan
1 Laboratorium Kimia-Fisika Ada / Tidak 2 Laboratorium Mikrobiologi Ada / Tidak
3 ……….. Ada / Tidak
4 ……….. Ada / Tidak
IV. TENAGA KERJA :
1. Jumlah Tenaga Kerja
a. Laki-laki : ………...……….…… Orang
b. Wanita : ……….… Orang
Jumlah : ………....……… Orang 2. Pendidikan Tenaga Kerja
a. S2 : ……… Orang
b. S1 : ……… Orang
c. SLTA : ……… Orang
d. SLTP : ……… Orang
Permohonan ini disertai dengan lampiran-lampiran yang diperlukan :
1. Fotokopi izin usaha industri atau tanda daftar industri yang telah dilegalisir 2. Nama direktur/pengurus
3. Fotokopi kartu tanda penduduk (KTP) direksi perusahaan/pengurus 4. Susunan direksi/pengurus
5. Pernyataan direksi/pengurus tidak terlibat dalam pelanggaran peraturan perundang-undangan di bidang farmasi
6. Fotokopi akta notaris pendirian perusahaan yang telah disahkan sesuai ketentuan peraturan perundang-undangan sepanjang pemohon berbentuk badan usaha
7. Fotokopi Nomor Pokok Wajib Pajak (NPWP)
16
9. Bentuk dan jenis sediaan kosmetika yang dibuat 10. Daftar peralatan yang tersedia
11. Surat pernyataan kesediaan bekerja penanggung jawab, dan
12. Fotokopi ijazah dan Surat Tanda Registrasi penanggung jawab yang telah dilegalisir
Demikian keterangan tersebut di atas dibuat dengan sebenarnya, atas perhatian dan persetujuan Bapak/Ibu kami sampaikan terima kasih.
……… , ………. Pas Foto Pemohon
Uk. 4 x6 Pemohon,
Tanda Tangan
Stempel Perusahaan Materai Rp. 6000,-
( ……… ) Nama Terang Direktur Tembusan :
1. Kepala Badan POM
2. Kepala Dinas Kesehatan Provinsi ……….. 3. Kepala Balai Besar / Balai POM di ……….
4. Kepala Dinas Kesehatan Kabupaten / Kota di ……….
* Di isi dengan tanda x **Pilih salah satu
17 LAMPIRAN 2 DINAS KESEHATAN PROVINSI ……….. Nomor : Lampiran : Perihal : Rekomendasi Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan di-
Jakarta
Sehubungan dengan surat permohonan dari ………. nomor ……….. tanggal ………. perihal Izin Produksi Kosmetika dan dengan mempertimbangkan hasil evaluasi terhadap pemenuhan persyaratan administratif untuk Izin Produksi Pabrik Kosmetika, maka dengan ini kami rekomendasikan bahwa :
1. Nama Perusahaan : ……… 2. Alamat Perusahaan : ……… 3. Pimpinan Perusahaan : ……… 4. Penanggung Jawab Teknis : ……… telah / tidak memenuhi *) persyaratan administratif berdasarkan Peraturan Menteri Kesehatan Nomor ……… tentang Izin Produksi Kosmetika.
Demikian, atas perhatiannya diucapkan terima kasih.
KEPALA DINAS KESEHATAN PROVINSI ………
( ……… )
NIP :
Tembusan kepada Yth. : 1. Kepala Badan POM
2. Kepala Balai Besar/ Balai POM di ………
18
LAMPIRAN 3
BALAI BESAR/ BALAI POM DI………...
Nomor : ...,...
Lampiran :
Perihal : Laporan Analisis Hasil Pemeriksaan Yang terhormat,
Kepala Badan Pengawas Obat dan Makanan di-
Jakarta
Dengan hormat,
Bersama ini kami sampaikan laporan analisis hasil pemeriksaan permohonan Izin Produksi Kosmetika : Nama Perusahaan : ……… Alamat : ……… Dengan hasil : ... ... ... Terlampir kami sampaikan pula Berita Acara Pemeriksaan Setempat oleh Balai Besar/ Balai POM ... dan denah bangunan yang sudah disetujui.
Demikianlah atas perhatian diucapkan terima kasih
KEPALA BALAI BESAR/BALAI di...………
( ……… )
NIP :
Tembusan :
1. Direktur Jenderal Bina Kefarmasian
dan Alat Kesehatan, Kementerian Kesehatan 2. Kepala Dinas Kesehatan Provinsi ………
19
BERITA ACARA PEMERIKSAAN SETEMPAT
BALAI BESAR/ BALAI POM di………...
Pada hari ini ... tanggal ... bulan ... tahun ... kami yang bertanda tangan di bawah ini, sesuai dengan Surat Perintah Kepala Badan Pengawas Obat dan Makanan Nomor ... telah melaksanakan pemeriksaan setempat terhadap :
Nama Perusahaan : ……….……….……… Nama Pimpinan Perusahaan : ...
Alamat Kantor : ……….….……
... Alamat Pabrik : ... Nomor Pokok Wajib Pajak (NPWP) : ... Nomor Izin Usaha Industri/
Tanda Daftar Industri : ...
Pemeriksaan ini dilakukan adalah sebagai persyaratan untuk memperoleh Izin Produksi Kosmetika dengan hasil sebagai berikut :
4. Bentuk dan Jenis Sediaan :
... ... ... 5. Kapasitas Produksi Terpasang :
... ... ... 6. Resume hasil pemeriksaan terhadap kesiapan pabrik kosmetika dan pemenuhan aspek
CPKB :
a. Sistem Manajemen Mutu : ... b. Personalia : ... c. Bangunan dan Fasilitas : ... d. Peralatan : ... e. Sanitasi dan Higiene : ... f. Produksi : ... g. Pengawasan Mutu : ... h. Dokumentasi : ... i. Inspeksi Diri : ... j. Penyimpanan : ... k. Kontrak Produksi & Pengujian : ... l. Penanganan Keluhan : ...
20
m. Penarikan Produk : ... 7. Kesimpulan
a. Kesimpulan secara umum : ... b. Kesimpulan secara khusus : ...
Demikianlah Berita Acara ini dibuat dengan sesungguhnya.
..., ...
Penanggung Jawab Perusahaan Pemeriksa
( ... ) ( ... ) Cap Perusahaan
Mengetahui :
Kepala Balai Besar / Balai POM di ...
( ... ) NIP :
21
LAMPIRAN 4
KEPALA BADAN PENGAWAS OBAT DAN MAKANAN Nomor :
Lampiran :
Perihal : Rekomendasi Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan di-
Jakarta
Sehubungan dengan surat permohonan dari ………. nomor ……….. tanggal ………. perihal Izin Produksi Kosmetika dan dengan mempertimbangkan Hasil Pemeriksaan Setempat oleh Balai Besar/ Balai POM pada tanggal..., maka dengan ini kami rekomendasikan bahwa :
1. Nama Perusahaan : ……… 2. Alamat Perusahaan : ……… 3. Pimpinan Perusahaan : ……… 4. Penanggung Jawab Teknis : ……… telah / tidak memenuhi *) persyaratan berdasarkan Peraturan Menteri Kesehatan Nomor ……… tentang Izin Produksi Kosmetika.
Demikian, atas perhatiannya diucapkan terima kasih.
KEPALA BADAN PENGAWAS OBAT DAN MAKANAN
( ……… )
NIP :
22
LAMPIRAN 5
Nomor : ..., ... Lampiran :
Perihal : Surat Pernyataan Siap Berproduksi Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat Kesehatan di-
Jakarta
Dengan hormat,
Sehubungan dengan surat permohonan kami, nomor ... tanggal ..., ... dengan alamat ... perihal Izin Produksi Kosmetika yang telah diterima oleh Kepala Balai dan Kepala Dinas Kesehatan Provinsi 30 hari kerja yang lalu, dan yang bersangkutan tidak melakukan pemeriksaan administrasi dan/atau pemeriksaan setempat terhadap permohonan yang kami ajukan.
Dengan ini kami menyatakan bahwa kami telah siap untuk melakukan kegiatan produksi kosmetika sebagaimana diterangkan dalam surat permohonan tersebut di atas.
Demikian pernyataan ini kami buat, untuk mendapat pertimbangan lebih lanjut.
..., ... Yang Menyatakan,
Nama : ... Jabatan : ... Tembusan kepada Yth. :
1. Kepala Badan POM
2. Kepala Balai Besar/Balai POM 3. Kepala Dinas Kesehatan Provinsi
23
LAMPIRAN 6
KEPUTUSAN DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
KEMENTERIAN KESEHATAN RI NOMOR : ... TENTANG IZIN PRODUKSI KOSMETIKA
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
Membaca : 1. Surat permohonan izin produksi dari ... tanggal... beserta lampirannya.
2. Surat rekomendasi Kepala Badan Pengawas Obat dan Makanan... tanggal...
3. Surat rekomendasi Kepala Dinas Kesehatan Provinsi... tanggal...
Menimbang : Bahwa permohonan dari... dengan surat permohonan tanggal ... dapat disetujui, dan oleh karena itu kepadanya dapat diberikan izin produksi.
Mengingat : Peraturan Menteri Kesehatan Nomor ... tentang Izin Produksi Kosmetika.
M E M U T U S K A N : Menetapkan :
Kesatu : Memberikan Izin Produksi Kosmetika kepada :
Nama Perusahaan : ... Alamat Perusahaan : ... Nama Direktur : ... Nama Penanggung Jawab Teknis : ... Alamat Pabrik : ... Alamat Gudang : ... Kedua : Izin Produksi Kosmetika yang dimaksud dalam diktum pertama
termasuk golongan ... dengan ketentuan sebagai berikut :
a. Memproduksi bentuk dan jenis kosmetika 1. ...
2. ... 3. ..., dst
24
b. Harus selalu diawasi oleh penanggung jawab teknis yang namanya tercantum pada Surat Keputusan ini.
c. Harus memenuhi peraturan perundang-undangan yang berlaku. d. Melaksanakan dokumentasi pengadaan, penyimpanan dan
penyaluran Kosmetika dengan sebaik- baiknya sesuai ketentuan yang berlaku.
Ketiga : Surat keputusan ini berlaku selama 5 (lima) tahun sejak tanggal ditetapkan dan dapat diperpanjang selama memenuhi persyaratan dengan catatan bahwa akan diadakan peninjauan atau perubahan sebagaimana mestinya apabila terdapat kekurangan atau kekeliruan dalam penetapan ini.
Ditetapkan di : ... Pada tanggal : ...
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
( ... )
Tembusan Kepada Yth. : 1. Menteri Kesehatan RI 2. Menteri Perindustrian RI 3. Menteri Perdagangan RI 4. Kepala Badan POM RI
5. Kepala Balai Besar / Balai POM ... 6. Kepala Dinas Kesehatan Provinsi ...
7. Kepala Dinas Kesehatan Kabupaten / Kota ... 8. Persatuan Pengusaha Kosmetika (PERKOSMI) di Jakarta
25
LAMPIRAN 7
KEMENTERIAN KESEHATAN RI
DIREKTORAT JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
Nomor : ..., ... Lampiran :
Perihal : Penundaan Izin Produksi Kosmetika Yang terhormat,
Direktur ... di-
Jakarta
Sehubungan dengan surat Saudara Nomor ……….. tanggal ………. perihal Permohonan Izin Produksi Kosmetika, maka dengan ini kami beritahukan bahwa kami belum dapat menyetujui permohonan tersebut karena :
1. ………... 2. ………... 3. ………... Selanjutnya kepada Saudara kami minta untuk melengkapi kekurangan tersebut selambat- lambatnya dalam waktu 3 (tiga) bulan sejak tanggal surat ini.
Demikian untuk diketahui.
Direktur Jenderal
Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan
( ... )
Tembusan Kepada Yth. : 1. Kepala Badan POM
2. Kepala Balai Besar / Balai POM di ... 3. Kepala Dinas Kesehatan Provinsi ...
26
LAMPIRAN 8
KEMENTERIAN KESEHATAN RI
DIREKTORAT JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
Nomor : Jakarta, ...
Lampiran :
Perihal : Penolakan Izin Kosmetika Yang terhormat,
Direktur ... di-
Jakarta
Sehubungan dengan surat Saudara Nomor ……….. tanggal ………. perihal Permohonan Izin Produksi Kosmetika, dengan ini kami beritahukan bahwa kami menolak permohonan tersebut dengan alasan :
1. ………...………... 2. ………...………... 3. ………... Demikian untuk diketahui.
Direktur Jenderal
Bina Kefarmasian dan Alat Kesehatan Kementerian Kesehatan
( ... )
Tembusan Kepada Yth. : 1. Kepala Badan POM
2. Kepala Balai Besar / Balai POM di ... 3. Kepala Dinas Kesehatan Provinsi ...
27
LAMPIRAN 9
Nomor : Lampiran :
Perihal : Permohonan Perubahan Golongan Izin Produksi Kosmetika
Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat kesehatan di-
Jakarta
Bersama ini kami mengajukan Izin Perubahan Golongan Produksi Kosmetika, dengan data sebagai berikut :
1. Nama Pemohon : ………
2. Alamat Pemohon : ………...………
3. Nama Perusahaan : ………
4. Alamat Perusahaan : ………...………
5. Bentuk Perusahaan : ………
6. Akte Notaris Pendirian Perusahaan : ... 7. Alamat Surat Menyurat dan
Nomor Telepon : ... 8. Bentuk dan Jenis yang telah
diproduksi *) : ... 9. Bentuk dan Jenis yang akan
diproduksi *) : ... 10. Nama Penanggung Jawab Teknis
Produksi : ... 11. Pendidikan Penanggung Jawab
Produksi : ………
Bersama permohonan ini kami sertakan dokumen- dokumen persyaratan sesuai Peraturan Menteri Kesehatan Nomor ... tentang Izin Produksi Kosmetika.
Demikian permohonan kami, atas perhatian dan persetujuan Bapak/Ibu kami sampaikan terima kasih.
……… , ………. Pas Foto Pemohon
Uk. 4 x6 Pemohon,
Tanda Tangan Stempel Perusahaan Materai Rp. 6000,- ( ……… ) Nama Terang Direktur Tembusan :
1. Kepala Badan POM
2. Kepala Dinas Kesehatan Provinsi ……….. 3. Kepala Balai Besar / Balai POM di ……….
4. Kepala Dinas Kesehatan Kabupaten / Kota di ………..
28
LAMPIRAN 10
Nomor :
Lampiran :
Perihal : Permohonan Perubahan Nama Direktur / Pengurus / Penanggung Jawab Produksi Kosmetika / alamat tanpa pindah lokasi *)
Yang terhormat,
Direktur Jenderal Bina Kefarmasian dan Alat kesehatan di-
Jakarta
Bersama ini kami mengajukan Izin Perubahan Nama Direktur / Pengurus / Penanggung Jawab Produksi Kosmetika / alamat tanpa pindah lokasi *) dengan data sebagai berikut :
1. Nama Pemohon : ………...
2. Alamat Pemohon : ………...
3. Nama Perusahaan : ………...
4. Alamat Perusahaan lama *) : ………...………... 5. Alamat Perusahaan baru *) : ...
6. Bentuk Perusahaan : ………...
7. Akte Notaris Pendirian Perusahaan : ... 8. Nama Direktur / Pengurus /
Penanggung Jawab lama *) : ... 9. Nama Direktur / Pengurus /
Penanggung Jawab baru *) : ... 10. Status Permodalan : ... 11. Alamat Surat Menyurat dan
Nomor Telepon : ... 12. Bentuk dan Jenis yang akan
Diproduksi : ... 13. Pendidikan Penanggung Jawab
Produksi : ………...
Bersama permohonan ini kami sertakan dokumen- dokumen persyaratan sesuai Peraturan Menteri Kesehatan Nomor ... tentang Izin Produksi Kosmetika.
Demikian permohonan kami, atas perhatian dan persetujuan Bapak/Ibu kami sampaikan terima kasih.
……… , ………. Pas Foto Pemohon
Uk. 4 x6 Pemohon,
Tanda Tangan Stempel Perusahaan Materai Rp. 6000,- (………... ) Nama Terang Direktur Tembusan :
1. Kepala Badan POM
2. Kepala Dinas Kesehatan Provinsi ……….. 3. Kepala Balai Besar / Balai POM ……….
4. Kepala Dinas Kesehatan Kabupaten / Kota ………..
29
LAMPIRAN 11
ADDENDUM
KEPUTUSAN DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
KEMENTERIAN KESEHATAN RI NOMOR : ... TENTANG IZIN PRODUKSI KOSMETIK
DIREKTUR JENDERAL BINA KEFARMASIAN DAN ALAT KESEHATAN
Membaca : 1. Surat permohonan nomor ... tanggal... Tentang Perubahan Nama Direktur / Pengurus / Penanggung Jawab Pabrik Kosmetika / Alamat tanpa pindah lokasi *)
2. Rekomendasi Dinas Kesehatan Provinsi ... Nomor ... tanggal ...
Menimbang : Bahwa permohonan ... tersebut dapat disetujui, oleh karena itu menganggap perlu menerbitkan Addendum Izin Produksi Kosmetika.
Mengingat : Peraturan Menteri Kesehatan Nomor ... tentang Izin Produksi Kosmetika.
M E M U T U S K A N : Menetapkan :
Kesatu : Addendum Perubahan Nama Direktur / Pengurus / Penanggung Jawab / Alamat tanpa pindah lokasi *), kepada :
Kedua : Izin Produksi Kosmetika yang dimaksud dalam diktum pertama merupakan satu kesatuan yang tidak terpisahkan dengan Keputusan Direktur Jenderal Bina Kefarmasian dan Alkes Nomor ... tanggal ... tentang Izin Produksi Kosmetika...
Nama Direktur / Pengurus / Penanggung Perusahaan Jawab / Alamat tanpa pindah lokasi *)
Semula Menjadi
30
Ketiga : Addendum Surat Keputusan ini berlaku sejak tanggal ditetapkan sampai dengan berakhirnya Izin Produksi Kosmetika dengan catatan bahwa akan diadakan peninjauan atau perubahan sebagaimana mestinya apabila terdapat kekurangan atau kekeliruan dalam penetapan ini.
Ditetapkan di : JAKARTA
Pada tanggal : ...
DIREKTUR JENDERAL
BINA KEFARMASIAN DAN ALAT KESEHATAN
( ... ) NIP . Tembusan : 1. Menteri Kesehatan RI 2. Menteri Perindustrian RI 3. Menteri Perdagangan RI 4. Kepala Badan POM RI
5. Kepala Balai Besar / Balai POM ... 6. Kepala Dinas Kesehatan Provinsi ...
7. Kepala Dinas Kesehatan Kabupaten / Kota ... 8. Persatuan Pengusaha Kosmetik (PERKOSMI) di Jakarta
31
LAMPIRAN 12
Standar Prosedur Operasional Pelayanan Izin Produksi Kosmetika 1. Berkas diterima dari pemohon
• dengan map berwarna merah muda.
• disusun sesuai persyaratan dan diberi penanda tiap persyaratan.
2. Lakukan pengecekan terhadap kelengkapan berkas dengan checklist sesuai golongan A/B.
3. Berkas lengkap diterima dengan tanda terima dan penomoran yang sesuai.
4. Berkas tidak lengkap ditolak (dikembalikan untuk dilengkapi dan diberikan informasi).
5. Berkas lengkap diagendakan di TU Direktorat.
6. Serahkan berkas ke Subdit, untuk didisposisi kepada Ka Sie. 7. Berkas dilimpahkan oleh Kasie kepada petugas penilai.
8. Lakukan analisa administrasi kelengkapan berkas sesuai persyaratan.
9. Buat draft izin produksi sambil menunggu 2 rekomendasi dari POM dan Dinkes. 10. Buat verbal sebagai pengantar izin produksi original untuk diparaf Kasie dan
Kasubdit.
11. Buat izin produksi original dan 2 copy untuk diparaf Direktur. 12. Berkas disampaikan kepada Dirjen melalui Sesditjen.
13. Kontrol waktu ke TU Dirjen.
14. Izin produksi yang telah selesai dari TU Dirjen disampaikan ke Direktorat.
15. Serahkan izin produksi ke produsen dengan tanda terima dan surat kuasa pengambilan.
Mengesahkan
Direktur Bina Produksi dan Distribusi Kefarmasian
Persyaratan Golongan A Golongan B
Penanggung jawab Apoteker Tenaga Teknis Kefarmasian (S1 Farmasi, D3 Farmasi, Asisten Apoteker, Analis Farmasi)
Jenis produk Semua Jenis Produk -
Peralatan produksi Teknologi tinggi Teknologi sederhana
32
LAMPIRAN 13
Standar Prosedur Operasional
Penanganan Keluhan Izin Produksi Kosmetika
1. Petugas loket menyelesaikan keluhan klien pada saat itu juga. 2. Petugas loket mendokumentasikan setiap keluhan.
3. Petugas loket merujuk kepada Kepala Seksi apabila tidak bisa menangani keluhan.
4. Kepala Seksi berkoordinasi dengan Kasubdit/Direktur dalam menyelesaikan keluhan yang tidak bisa ditangani.
5. Kepala seksi memonitor keluhan yang masuk.
6. Keluhan klien harus diselesaikan maksimum 2 hari kerja.
7. Setiap tahapan diproses menggunakan alamat dan telepon kantor.
Mengesahkan
Direktur Bina Produksi dan Distribusi Kefarmasian
33
LAMPIRAN 14
Standar Prosedur Operasional Penilaian Berkas Izin Produksi Kosmetika
1. Lakukan penilaian berkas sesuai dengan cheklist persyaratan izin produksi. 2. Lakukan penilaian surat permohonan sesuai dengan formulir 1 pada Permenkes
1175.
3. Lakukan penilaian fotokopi KTP direksi berdasarkan keabsahannya. 4. Lakukan penilaian susunan direksi berdasarkan kelengkapannya.
5. Lakukan penilaian surat pernyataan direksi dan anggota tidak terlibat pelanggaran peraturan di bidang farmasi berdasarkan keabsahannya.
6. Lakukan penilaian fotokopi akta notaris pendirian perusahaan berdasarkan keabsahannya.
7. Lakukan penilaian fotokopi NPWP berdasarkan kesesuaiannya.
8. Lakukan penilaian fotokopi izin usaha industri berdasarkan kesesuaiannya. 9. Lakukan penilaian denah bangunan yang disahkan BPOM berdasarkan
keabsahannya.
10. Lakukan penilaian daftar peralatan yang digunakan berdasarkan bentuk sediaan yang diproduksi.
11. Lakukan penilaian bentuk sediaan yang diproduksi berdasarkan peralatan produksi yang tersedia.
12. Lakukan penilaian surat pernyataan kesediaan bekerja sebagai penanggung jawab berdasarkan keabsahannya.
13. Lakukan penilaian fotokopi ijazah dan SP penanggung jawab berdasarkan keabsahannya.
Mengesahkan
Direktur Bina Produksi dan Distribusi Kefarmasian
34
LAMPIRAN 15
Standar Prosedur Operasional Penyerahan Izin Produksi Kosmetika
1. Berkas izin yang telah diagendakan, diserahkan kepada petugas loket. 2. Berkas izin hanya diberikan kepada Direktur perusahaan (pemohon).
3. Apabila diwakilkan, diwajibkan membawa surat kuasa bermaterai dari Direktur. 4. Penerima berkas diwajibkan melakukan pengecekan berkas.
5. Penerima berkas menanda tangani surat tanda terima. 6. Penerima berkas diwajibkan melakukan pengecekan berkas.
7. Tanda terima dan surat kuasa (apabila ada) diserahkan ke seksi perijinan kosmetik untuk diarsipkan.
8. Apabila ada kesalahan, dalam waktu 1 (satu) minggu segera ditindaklanjuti.
Mengesahkan
Direktur Bina Produksi dan Distribusi Kefarmasian
35
LAMPIRAN 16
Kendali Kerja
No Uraian Pelaksana Paraf Tanggal Keterangan
1 Penerimaan Berkas Loket Lengkap 2 Berkas diagendakan di TU
Direktorat
3 Berkas diterima di subdit Menunggu
Rekomendasi
- BPOM
Penghitungan 14 hari kerja dimulai sejak rekomendasi diterima
- Dinkes 4 Berkas diterima di seksi 5 Berkas diperiksa oleh penilai 6 Verbal dilampiri Berkas & Original
(diperiksa seksi dan paraf verbal) 7 Berkas diperiksa oleh subdit
(pemeriksaan akhir dan paraf verbal)
8 Berkas diserahkan ke TU (paraf original)
9 Berkas diserahkan ke Dirjen melalui Sesditjen (paraf original) 10 Kontrol waktu ke TU Dirjen 11 Izin produksi diantar ke Direktorat 12 Berkas diserahkan ke produsen
dengan tanda terima dan surat kuasa
Berkas Rampung
36
LAMPIRAN 17