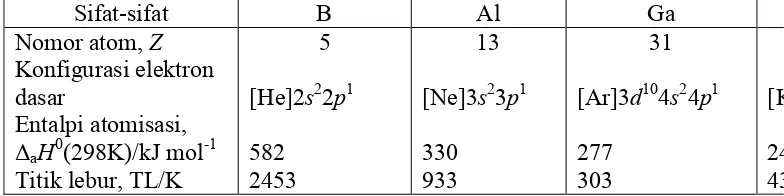BAB I
UNSUR-UNSUR GOLONGAN 1: LOGAM-LOGAM ALKALI
Cakupan Pokok Bahasan ini adalah: ■ Pendahuluan
■ Kelimpahan, Ekstraksi, dan Kegunaan ■ Sifat-sifat Fisika dan Kimia
■ Logam-logam Alkali ■ Halida-halida logam Alkali
■ Oksida dan Hidroksida Logam Alkali ■ Garam dari Asam-asam Okso: Karbonat dan Hidrogenkarbonat
■ Kimia Larutan Aqueous Termasuk Kompleks-kompleks Makrosiklik
1. 1. Pendahuluan
Logam-logam alkali: Li, Na, K, Rb, Cs, dan Fr adalah merupakan anggota unsur-unsur golongan 1 dalam SPU yang mana logam-logam ini mempunyai konfigurasi elektron valensi pada keadaan dasar ns1. Logam-logam ini cukup lunak sehingga dapat dipotong dengan mudah dengan menggunakan pisau atau spatula (walaupun litium menunjukkan ketahanan terhadap pemotongan). Tetapi perbedaan yang paling nyata adalah logam-logam ini berwarna keperakan (kecuali sesium yang ringan dan berwarna kuning keemasan). Tetapi, lapisan oksida yang terbentuk seketika bila permukaan yang baru terkena udara akan menyebabkan permukaan yang bersinar menjadi buram. Sama seperti logam-logam lainnya, logam-logam alkali memiliki konduktifitas listrik dan panas yang tinggi. Diskusi tentang logam-logam ini biasanya tidak melibatkan Fr karena hanya isotop buatan
dari Fr yang dikenal, yaitu 223Fr87 dengan waktu paruh paling panjang (t1/2 = 21,8 menit).
Walaupun berupa logam, density logam-logam ini termasuk rendah jika dibandingkan dengan density logam pada umumnya.
Tabel 1. 1. Titik Lebur, Titik Didih, dan Density Logam-logam Golongan 1
Pembuatan K, Rb, dan Cs dengan cara mengelektrolisis leburan garam-garamnya menghadapi kendala dan menyebabkan frustrasi karena titik lebur dan titik didih logamnya yang relatif rendah dan cenderung menguap pada temperatur reaksi. Tetapi, uap natrium dapat digunakan untuk mengatasi kendala tersebut
KCl(l) + Na(g) NaCl(l) + K(g)
Semua logam golongan alkali mempunyai titik lebur dan titik didih yang rendah yang secara umum menurun dari atas ke bawah. Oleh karena rendahnya titik lebur Na, maka natrium cair digunakan sebagai pendingin pada reaktor nuklir. Alloy dari logam ini juga menunjukkan titik lebur yang agak rendah dan beberapa dari alloy ini terdapat sebagai liquid pada temperatur kamar. Alloy dari Na-K mengandung 22,8% Na menunjukkan sifat eutektik
yang meleleh pada -12,30C dan telah diusulkan sebagai pengganti natrium murni sebagai fluida pendingin reaktor.
Semua logam golongan 1 larut dalam amonia yang sangat murni dan membentuk larutan biru cantik yang dapat menghantar listrik. Alasan yang paling dapat diterima untuk fenomena ini adalah bahwa logam-logam di dalam amonia cair terionisasi membentuk kation dan elektron. Contohnya, K(s) → K+ + e-Elektron yang dihasilkan pada reaksi ionisasi di atas terikat ke molekul-molekul pelarut NH3, yang menyebabkan terjadinya solvasi seperti ion-ion normal. Elektron-elektron
tersolvasi inilah yang memberikan warna biru cantik dari larutan dan yang juga menghasilkan daya hantar listrik.
Logam-logam golongan 1 bereaksi dengan unsur-unsur non-logam membentuk garam-garam ionik. Reaksi yang umum adalah:
● 2K(s) + Br2(l) → 2KBr(s)
● 2Rb(s) + I2(s) → 2RbI(s)
● 2 Na(s) + S(s) → Na2S(s)
● 3K(s) + P(s) → K3P(s)
● 2Na(s) + H2(g) → 2NaH(s)
1. 2. Kelimpahan, Ekstraksi, dan Kegunaan 1. 2. 1. Kelimpahan
Na dan K melimpah di biosfir bumi (masing-masing 2,6% dan 2,4%) tetapi tidak ditemukan di alam dalam keadaan unsur bebas. Sumber utama Na dan K adalah batuan garam (NaCl hampir murni), brine alami dan air laut, sylvite (KCl/NaCl), dan carnalite
(KCl.MgCl2.6H2O). Mineral-mineral lain yang mengandung Na dan K seperti boraks
(Na2[B4O5(OH)4].8H2O dan garam Chili (NaNO3) adalah merupakan sumber untuk unsur-unsur lain yang penting secara komersial, misalnya B dan N. Berbeda dari kebanyakan bahan-bahan Kimia Anorganik, NaCl tidak perlu dibuat karena terdapat deposit yang sangat besar di alam. Penguapan air laut menghasilkan campuran garam-garam, tetapi karena NaCl merepresentasikan komponen utama dari campuran tersebut, maka produksinya sangat dimungkinkan. Sebaliknya untuk Li, Rb, dan Cs,
kelimpahan unsur-unsur ini di alam sangat kecil (% kelimpahan Rb > Li > Cs), dimana logam-logam ini terdapat dalam berbagai mineral silikat seperti spodumene
(LiAlSi2O6). 1. 2. 2. Ekstraksi
Na adalah logam alkali yang paling penting secara ekonomi, yang diperoleh dengan proses Downs
operasi menjadi kira-kira 870K, karena titik lebur NaCl adalah 1073K. Rancangan sel elektrolisis dibuat khusus sehingga dapat dicegah pembentukan kembali NaCl oleh penggabungan Na dan Cl2. Skema proses Downs untuk produksi Cl2 dapat dilihat di bawah ini.
Pada katoda: Na+(l) + e- → Na(l)
Pada anoda: 2 Cl
-(l) → Cl2(g) + 2 e
-Reaksi keseluruhan: 2 Na+(l) + 2 Cl-(l) → 2 Na(l) + Cl2(g)
Litium diekstraksi dari LiCl dengan cara yang sama. Pertama-tama, ke dalam spodumene ditambahkan CaO lalu dipanaskan dan diperoleh LiOH. Kemudian ke dalam LiOH ditambahkan HCl sehingga diperoleh LiCl. Untuk memperoleh kalium dapat dilakukan dengan cara mengelektrolisis KCl, tetapi metode ekstraksi yang lebih efisien adalah dengan cara melewatkan uap Na ke dalam leburan KCl di dalam tower fraksinasi yang
menghasilkan alloy
Na-K yang kemudian dapat dipisahkan menjadi
komponen-komponennya dengan jalan destilasi. Dengan cara yang sama, Rb dan Cs dapat diperoleh dari RbCl dan CsCl. Atau sebagai produk samping ekstraksi Li dari
spodumene dalam jumlah kecil.
Sejumlah kecil Na, K, Rb, dan Cs dapat juga diperoleh dari peruraian termal azida-azidanya :
2 NaN3 2 Na + 3 N2
570K, vacum
bergabung kembali menghasilkan nitrida, Li3N (persamaan 6).
Pembuatan K, Rb, dan Cs dengan cara elektrolisis leburan garam-garamnya sangat sulit dilakukan karena rendahnya titik lebur dan titik didih logam-logam
tersebut, yang cenderung akan menguap pada temperatur reaksi. Namun demikian, uap natrium dapat digunakan untuk memperoleh K
KCl(l) + Na(g) NaCl(l) + K(g) 1. 2. 3. Kegunaan Utama Logam-logam Alkali dan Senyawa-senyawanya
Li mempunyai density yang paling rendah (0,53 gr cm-3) diantara logam-logam yang ada. Digunakan untuk pembuatan alloy, kaca dan keramik khusus. Litium karbonat digunakan pada pengobatan penyakit depressi, walaupun garam-garam litium dalam jumlah besar dapat merusak sistem syaraf pusat.
Natrium, kalium, dan senyawa-senyawanya mempunyai banyak kegunaan, antara lain: pada pembuatan alloy Na-K yang digunakan sebagai heat-exchange coolant pada reaktor nuklir. Kegunaan utama dari alloy Na-Pb adalah untuk produksi anti-knock PbEt4, tetapi dengan
meningkatnya permintaan bahan bakar tanpa timbal membuat alloy ini menjadi tidak begitu penting lagi. Berbagai penggunaan senyawa-senyawa Na termasuk kegunaannya pada industri kertas, kaca, detergen, industri kimia dan logam.
Catatan: Pada tahun 2000, produksi NaCl dunia mencapai 210 Mt ; 51,6 Mt digunakan di Amerika Serikat.
Penggunaan utama NaCl adalah pada pembuatan NaOH, Cl2, dan Na2CO3. Sejumlah fraksi besar garam-garam digunakan untuk road de-icing pada musim dingin/salju. Tetapi oleh karena efek korosif dari NaCl, issu
lingkungan menjadi salah satu fokus dari efek samping terhadap vegetasi di sisi jalan dan aliran air, sehingga Switzerland memberlakukan skema pengurangan garam.
Na dan K terlibat dalam berbagai fungsi elektrofisiologi dalam tubuh hewan tingkat tinggi, termasuk manusia. Perbandingan [Na+] : [K+] di dalam cairan intra selluler dan ekstra selluler berbeda, dan
Penggunaan Li dan Na dalam battere dan penggunaan KO2 dalam alat bantu pernafasan telah dikenal luas.
Banyak sintesis senyawa organik yang melibatkan Li, Na atau senyawa-senyawanya. Sebagai contoh,
pereaksi Na[BH4] dan Li[AlH4] telah digunakan secara luas. Namun demikian, senyawa-senyawa ini sangat sensitif terhadap udara, kelembaban, atau pereaksi-pereaksi lainnya. Senyawa-senyawa ini tidak larut dalam pelarut organik, oleh karena itu secara esensial, senyawa-senyawa ini adalah ionik. Logam-logam alkali dan beberapa senyawanya juga telah digunakan sebagai katalis, misalnya, pada pembuatan MeOH dari H2 dan CO. Jika ke dalam katalis ditambahkan Cs maka kerja katalis menjadi lebih efektif. Li, Na, dan K banyak digunakan sebagai katalis untuk berbagai reaksi alkena, misalnya pada dimerisasi propena menjadi 4-metil-1-pentena.
1. 3. Sifat-sifat Fisika dan Kimia Sifat-sifat Umum
Logam-logam alkali memberikan gambaran yang lebih jelas tentang pengaruh naiknya nomor atom dan ukuran ion terhadap sifat-sifat fisika dan kimia dibanding unsur-unsur golongan lain. Maka logam-logam golongan 1 sering digunakan untuk menggambarkan prinsip-prinsip umum. Beberapa sifat fisika logam-logam golongan 1 dapat dilihat pada tabel di bawah ini: (lihat di landscape) Beberapa poin penting timbul dari data di bawah ini, antara lain :
■dengan naiknya nomor atom, maka atom-atom menjadi lebih besar dan kekuatan ikatan atomnya menurun
■pengaruh naiknya ukuran menyebabkan naiknya muatan inti, karena itu energi ionisasi menurun dari Li ke Cs. Harga energi ionisasi pertama untuk logam-logam alkali
adalah tinggi sehingga pembentukan ion M2+ dibawah kondisi normal tidak bisa terjadi.
■Harga E0
M+/M berhubungan dengan perubahan energi yang menyertai proses:
M(s) → M(g) atomisasi M(g) → M+(g) ionisasi M+(g) → M+(aq) hidrasi
dan dari atas ke bawah, perbedaan perubahan energi hampir tidak nyata dan akibatnya harga-harga E0
M+/M sama. Rendahnya reaktifitas Li terhadap H2O adalah karena faktor kinetika, bukan karena faktor
termodinamika. Dibandingkan logam-logam lain dalam golongan 1, Li adalah logam yang lebih keras dan lebih tinggi titik leburnya, kurang cepat terdispersi, dan
bereaksi lebih lambat dibanding logam-logam yang lebih berat dalam golongannya.
Secara umum, kimiawi logam-logam golongan 1 didominasi oleh senyawa-senyawa yang mengandung ion-ion M+. Tetapi, sejumlah kecil senyawa yang
mengandung ion M- juga telah diketemukan (M = Na, K, Rb, atau Cs), dan kimiawi organologam golongan 1 terus berkembang.
Pertimbangan energi kisi yang dihitung dengan menggunakan suatu model elektrostatik menghasilkan suatu pemahaman yang memuaskan tentang fakta bahwa senyawa-senyawa ionik adalah merupakan pusat dari kimiawi Na, K, Rb, dan Cs. Bahwa Li menunjukkan suatu sifat anomali dan memunculkan suatu hubungan diagonal kepada Mg dapat dijelaskan dengan pemahaman pertimbangan energetika yang sama.
Logam-logam Li, Na, K, dan Rb berwarna putih keperakan, tetapi Cs berwarna kuning keemasan. Oleh karena hanya terdapat satu elektron valensi tiap atom logam, energi ikatan dalam kisi logam relatif rendah dan ini menyebabkan logam-logam tersebut lunak dengan titik leleh rendah. Catatan, aliasi Na-K dengan 77,2% K mempunyai titik leleh -12,3oC. Semua logam alkali lunak, Li adalah yang paling tidak lunak dan semakin ke bawah semakin lunak yang konsisten dengan titik lebur. Titik lebur yang rendah dari Cs secara khusus
memberikan pengertian bahwa logam tersebut dapat ditemukan dalam fase liquid pada temperatur ambient di beberapa negara.
Reaktifitas
Jika logam-logam alkali dimasukkan ke dalam amonia cair, maka akan terbentuk amida-amida logam alkali seperti LiNH2, NaNH2, dan KNH2 yang mana senyawa-senyawa ini merupakan pelarut-pelarut yang penting dalam sintesis organik. Pada wujud padat, amida-amida ini mengandung ion-ion yang menempati setengah dari lobang-lobang tetrahedral dalam struktur ccb.
Walaupun Li, Na, K disimpan di dalam pelarut hidrokarbon untuk mencegah reaksinya dengan O2 atmosfir dan uap air, tetapi logam-logam tersebut dapat juga ditangani di udara terbuka dengan cara
menghindarkannya dari terpaan udara. Rb dan Cs harus ditangani di dalam atmosfir yang inert. Li bereaksi dengan air secara cepat ; Na beraksi hebat dengan air, sedangkan K, Rb, dan Cs bereaksi dengan keras dan berbahaya karena H2 yang dihasilkan bisa terbakar.
2 Li + 2 H2O 2 LiOH + H2
Umumnya natrium digunakan sebagai drying agent untuk pelarut-pelarut hidrokarbon dan eter. Pembuangan
kelebihan Na harus dilakukan dengan sangat hati-hati dan biasanya melibatkan reaksi Na dengan propan-2-ol untuk menghasilkan H2 dan NaOCHMe2. Cara ini akan
menghasilkan reaksi yang kurang dahsyat sehingga lebih aman dibanding reaksi antara Na dan H2O atau dengan alkohol dengan Mr yang rendah. Metode alternatif
lainnya untuk pembuangan Na dalam jumlah kecil adalah melibatkan penambahan H2O ke suatu kontainer keramik yang berisi pasir. Pengubahan Na menjadi NaOH terjadi secara perlahan-lahan dimana NaOH bereaksi dengan pasir menghasilkan natrium silikat.
Semua logam alkali bereaksi dengan halogen dan dengan H2 bila dipanaskan.
2 M + X2 → 2 MX 2 M + H2 → 2 MH
Energetika pembentukan hidrida logam merupakan hal yang esensil seperti energetika pembentukan halida logam yang dinyatakan dalam siklus Habern – Born.
Litium bereaksi dengan N2 secara spontan pada 298K menghasilkan nitrida litium padat berwarna merah kecoklatan yang sensitif terhadap kelembaban
6 Li + N2 2 Li3N
Padatan Li3N memiliki struktur kisi yang menarik dan konduktifitas ionik yang tinggi. Percobaan untuk
disintesis di dalam satu ruang vakum dengan cara
mendepositkan atom natrium dan nitrogen ke dalam satu substrat safir dingin dan kemudian dipanaskan pada temperatur kamar. Struktur dari Na3N sangat bertolak belakang dengan struktur Li3N; Na3N mengadopsi struktur anti-ReO3 yang mana ion-ion Na+ adalah 2-koordinat dan ion-ion N3- adalah oktahedral. Asetilida, M2C2, dapat terbentuk bila Li atau Na dipanaskan dengan karbon; senyawa-senyawa ini dapat juga dibuat dengan jalan mereaksikan logam tersebut dengan C2H2 dalam amonia cair. Reaksi-reaksi antara grafit dan K, Rb atau Cs menghasilkan pembentukan senyawa-senyawa interkalasi, CnM (n = 8, 24, 36, 48, 60). Logam-logam alkali larut dalam Hg menghasilkan amalgam. Amalgam natrium (yang terdapat dalam keadaan cair hanya jika persentase Na rendah) sangat berguna sebagai reduktor dalam Kimia Anorganik dan Organik; dapat digunakan dalam media aqueous sebab ada overpotensial untuk pembebasan H2.
1. 5. Halida
Halida-halida MX dibuat dengan penggabungan langsung unsur-unsurnya
2M + X2 → 2MX (persamaan 4) dan semua halida mempunyai harga ΔfH0 yang sangat negatif. Namun demikian, tabel 2 menunjukkan bahwa untuk X = F, harga ΔfH0(MX) menjadi kurang negatif dari atas ke bawah, sementara kecenderungan sebaliknya, adalah benar untuk X = Cl, Br dan I. Untuk suatu logam tertentu, ΔfH0(MX) selalu menjadi kurang negatif dari MF ke MI. Generalisasi ini dapat dijelaskan dengan siklus Haber-Born. Perhatikan pembentukan MX dari persamaan berikut:
ΔfH0(MX)={ ΔaH0(M)+IE1(M)
}+{1/2D(X2)+ΔEAH(X)}+ΔkisiH0(MX)
untuk MF, kuantitas variabel adalah ΔaH0(M), IE1(M) dan ΔkisiH0(MF), dan dengan cara yang sama untuk MCl, MBr, dan MI. Jumlah ΔaH0(M) dan IE1(M) menghasilkan pembentukan Li+ 681, Na+ 604, K+ 509, Rb+ 485, dan Cs+ 454 kJ mol-1. Untuk fluorida-fluorida, kecenderungan harga ΔfH0(MF) tergantung pada harga relatif dari { ΔaH0(M) + IE1(M)} dan ΔkisiH0(MF) (tabel 2), dan dengan cara yang sama untuk klorida, bromida, dan iodida. Dari pemeriksaan data menunjukkan bahwa variasi dalam{ ΔaH0(M) + IE1(M)} adalah lebih kecil dari variasi dalam ΔkisiH0(MF), tetapi lebih besar daripada variasi dalam ΔkisiH0(MX) untuk X = Cl, Br, dan I. Hal ini dikarenakan energi kisi proporsional dengan 1/(r+ + r-) dan demikian juga variasi dalam ΔkisiH0(MX) untuk halida tertentu adalah paling besar bila r- adalah paling kecil (untuk F-) dan kecil bila r
- adalah paling besar (untuk I-). Perkirakan untuk halida-halida logam tertentu (persamaan 7), perubahan kecil dalam {1/2D(X2) + ΔEAH(X)} (-249, -228, -213, -188 kJ mol-1 untuk masing-masing F, Cl, Br, I adalah makin besar dengan
menurunnya ΔkisiH0(MX). Dalam tabel 2, tercatat bahwa perbedaan antara harga-harga ΔfH0(MF) dan ΔfH0(MI) turun secara signifikan dengan naiknya ukuran ion M+.
oksigen, misalnya, LiCl larut dalam THF dan MeOH; kompleksasi ion Li+ atau ion Na+ oleh pelarut donor-O adalah sama dalam semua kasus. LiI dan NaI sangat larut dalam NH3, membentuk kompleks; kompleks yang tak stabil [Na(NH3)4]I telah diisolasi dan mengandung ion Na yang terkoordinasi secara tetrahedral.
Dalam keadan uap, halida-halida logam alkali terutama terdapat sebagai pasangan ion, tetapi
pengukuran jarak ikatan M – X dan momen dipol listrik menyiratkan bahwa kontribusi kovalen terhadap ikatan adalah penting, khususnya dalam halida-halida litium. (Tabel lihat di landscape)
1. 6. Oksida dan Hidroksida
1. 6. 1. Oksida, Peroksida, Superoksida, Suboksida, dan Ozonida
Bila logam-logam golongan 1 dipanaskan dalam udara atau dalam O2berlebih, produk utama dapat diperoleh tergantung pada logamnya, misalnya, litium oxida, Li2O, natrium peroksida, Na2O2, dan superoksida, KO2, RbO2, dan CsO2
pembentukan oksida 4 Li + O2 → 2 Li2O pembentukan peroksida 2 Na + O2 → Na2O2
pembentukan superoksida K + O2 → KO2
Oksida-oksida Na2O, K2O, Rb2O, dan Cs2O yang tidak murni dapat diperoleh dengan menggunakan udara terbatas, tetapi lebih baik dibuat dengan cara peruraian termal peroksida atau superoksida. Warna oksida-oksida bervariasi mulai dari putih hingga oranye; Li2O dan Na2O
membentuk kristal berwarna putih, sementara K2O
berwarna kuning pucat, Rb2O berwarna kuning, dan Cs2O berwarna oranye. Semua oksida adalah basa kuat;
kebasaan meningkat dari Li2O ke Cs2O. Peroksida dari litium dapat diperoleh dengan aksi H2O2 pada larutan etanolik LiOH, tetapi akan terurai pada pemanasan. Natrium peroksida (digunakan secara luas sebagai oksidator) dibuat dengan cara pemanasan logam Na di atas wadah Al di udara, bila murni akan terbentuk Na2O2 yang tak berwarna dan warna kuning biasanya muncul dikarenakan adanya sejumlah kecil NaO2. Superoksida dan peroksida mengandung ion paramagnetik [O2]- dan ion diamagnetik [O2]2-. Superoksida mempunyai momen magnetik ≈ 1,73 µB konsisten dengan adanya satu elektron tak berpasangan.
Oksidasi sebagian dari Rb dan Cs pada temperatur rendah menghasilkan suboksida seperti Rb6O, Rb9O2, Cs7O, dan Cs11O3. Struktur senyawa-senyawa ini mengandung unit-unit oktahedral dari ion-ion logam dengan oksigen berada di pusat. Rumus suboksida tidak sesuai dengan bilangan oksidasi. Tiap-tiap senyawa mengandung ion M+ dan ion O2-, dan rumus Rb
6O lebih baik ditulis sebagai (Rb+)
6(O2-).4e-, yang menunjukkan adanya elektron bebas.
Oksida, peroksida, dan superoksida logam alkali bereaksi dengan air sesuai dengan persamaan-persamaan reaksi berikut:
M2O + H2O 2 MOH
Salah satu penggunaan KO2 adalah dalam masker
pernafasan dimana KO2 menyerap H2O dan menghasilkan O2 untuk pernafasan dan KOH untuk menyerap CO2 yang dikeluarkan ketika kita bernafas
KOH + CO2 KHCO3
Natrium peroksida bereaksi dengan CO2 menghasilkan Na2CO3, menyebabkannya cocok digunakan untuk pembersihan/pemurnian udara di dalam ruang terisolasi, misalnya, di dalam kapal selam; KO2 beraksi dengan cara yang sama tetapi lebih efektif.
Walaupun semua peroksida logam alkali terurai pada pemanasan sesuai persamaan reaksi
M2O2(s) M2O(s) + ½ O2(g) kestabilan termalnya tergantung pada ukuran kation; Li2O2 adalah peroksida yang paling kurang stabil, sementara Cs2O2 adalah yang paling stabil. Kestabilan dari superoksida (dengan mengacu pada M2O2 dan O2) mengikuti kecenderungan yang sama.
Ozonida, MO3, mengandung ion [O3]- yang bersifat paramagnetik dan bentuk molekulnya bengkok, yang dikenal untuk semua logam alkali. Garam-garam KO3, RbO3, dan CsO3 dapat dibuat dari peroksida atau superoksida dengan mereaksikannya dengan ozon, tetapi metode ini gagal, atau menghasilkan produk reaksi rendah, untuk LiO3 dan NaO3. Ozonida-ozonida ini telah dapat dibuat baru-baru ini dalam amonia cair dengan cara interaksi CsO3 dengan resin penukar ion yang
dimasukkan dengan ion Li+ atau Na+. Ozonida bersifat eksplosif berbahaya. Resin penukar ion terdiri dari satu fase padat (misalnya, zeolite) yang mengandung gugus asam atau basa yang dapat mempertukarkan kation dan
anion dari larutan yang dibersihkan melalui resin; aplikasi yang penting adalah dalam pemurnian air.
1. 6. 2. Hidroksida
Pada tahun 2002, ≈45 Mt NaOH (caustic soda) digunakan di seluruh dunia dan kira-kira 1/3 dari jumlah tersebut dibuat di AS. NaOH digunakan dalam kimia organik dan anorganik dimanapun dibutuhkan alkali yang murah, dan penggunaan oleh industri dapat dilihat pada gambar 10.2b, hal 259. NaOH padat (TL=591K) sering ditangani sebagai flake atau pellet, dan larut dalam air dengan mengeluarkan panas yang lumayan besar. Pembuatan Natrium Hidroksida
Natrium hidroksida adalah merupakan padatan berwarna putih yang larut dalam air dan bersifat korosif terhadap kulit. Titik lebur 318,40C dan titik didih 13900C. Padatan NaOH cenderung membentuk kerak natrium karbonat pada permukaannya karena terjadi reaksi dengan CO2 di atmosfir. Peralatan utama pada produksi industry adalah proses klor-alkali. Proses ini melibatkan
penggunaan arus listrik untuk menjenuhkan larutan garam di dalam sel-sel yang paling umum adalah katoda merkuri atau sel diaphragm. Reaksinya adalah sebagai berikut: elektrolisis
2H2O(l) + 2NaCl(aq) 2NaOH(aq) + Cl2(g) H2(g)
pada industri netralisasi sebab adanya bahan kimia yang lebih murah, seperti lime (CaO).
Pembuatan NaCl
Padatan NaCl atau garam NaCl adalah merupakan kristal, transparent dengan titik lebur 8030C dan titik didih 14300C. NaCl secara luas terdistribusi di alam. Air laut mengandung 2,68% NaCl, deposit batuan garam ditemukan dalam jumlah yang sangat besar di Amerika Utara dan Eropa. NaCl biasanya diperoleh dengan salah satu dari tiga metode utama yang ada.
1. Shaft Method; menggunakan tehnik yang sama dengan tehnik yang
digunakan pada penambangan batubara yang melibatkan pemotongan, pembentukan, pengeboran, pembakaran, dan transportasi. 2. Penambangan larutan; peralatan memompa air ke dalam deposit batuan garam, pelarutan garam, dan membawa air laut ke permukaan. 3.
Penguapan dengan matahari; air laut ditempatkan pada lading yang sangat luas untuk menguapkan air dan
mengendapkan padatan garam. Metode ini adalah metode yang paling tua dan masih tetap digunakan untuk sekitar 50% produksi dunia. Kegunaan garam ini sangat luas, tetapi yang paling penting adalah penggunaannya sebagai bahan mentah untuk produksi bahan-bahan kimia lainnya.
Kalium hidroksida (TL=633K) sangat mirip dengan NaOH dalam pembuatan dan sifat-sifat. KOH lebih larut dibanding NaOH dalam EtOH, yang mana KOH menghasilkan ion etoksida konsentrasi rendah dan hal ini menyebabkan naiknya penggunaan KOH etanolik
dalam sintesis organik.
C2H5OH + [OH]- [C2H5O]- + H2O
Struktur kristal hidroksida-hidroksida golongan 1 biasanya rumit, tetapi bentuk KOH pada temperatur tinggi mempunyai kisi NaCl dengan ion [OH]
-mengalami rotasi yang membentuk pseudo-spherical. Reaksi-reaksi hidroksida logam alkali dengan asam dan oksida asam tidak memberikan hal yang khusus. Namun demikian, reaksi-reaksi dengan CO sangat menarik karena hidroksida-hidroksida ini menghasilkan bentuk logam (metanoat), seperti pada
reaksi berikut
450K
Banyak unsur-unsur non-logam mengalami
disproporsionasi bila direaksikan dengan alkali aqueous; P4 menghasilkan PH3 dan [H2PO2]-, S8 menghasilkan S 2-dan campuran oksoanion, 2-dan Cl2 bereaksi menghasilkan Cl- dan [OCl]- atau [ClO
3]-. Unsur-unsur non-logam tidak membentuk hidrida yang stabil, dan logam-logam
amfoter, bereaksi dengan MOH aqueous menghasilkan H2 dan anion-anion okso, misalnya, reaksi
2 Al + 2 NaOH + 6 H2O 2 Na[Al(OH)4] + 3 H2
1. 7. Garam dari Asam-asam Okso: Karbonat dan Hidrogenkarbonat
Sifat kebanyakan garam-garam dari asam-asam okso dari logam alkali tergantung pada ada atau tidak adanya anion okso pada kation; maka kita cenderung mendiskusikan tentang asam-asam okso dibawah asam yang tepat. Namun demikian, disini hanya ditelaah karbonat dan hidrogenkarbonat dengan alasan
kepentingannya. Sementara Li2CO3 sedikit larut dalam air, karbonat-karbonat lainnya dari logam-logam golongan 1 sangat larut.
Di banyak negara, natrium karbonat (soda ash) dan natrium hidrogenkarbonat (secara umum disebut
natrium bikarbonat) dibuat dengan proses Solvay
(gambar 10.5, hal 267), tetapi hal ini menjadi superseded
dimana sumber-sumber alami dari mineral-mineral trona, Na2CO3.NaHCO3.2H2O, tersedia dalam jumlah banyak, misalnya, di AS. Gambar di atas menunjukkan bahwa NH3 dapat didaur ulang, tetapi kebanyakan limbah CaCl2 dibuang (misalnya, ke laut) atau digunakan untuk
menyapu salju dari jalanan.
Natrium karbonat (Na2CO3) yang digunakan pada pembuatan kaca, dibuat dengan proses Solvay. Langkah pertama pada proses ini adalah reaksi yang terjadi pada temperatur 150C di dalam larutan aqueous natrium klorida jenuh, amonia, dan karbon dioksida.
Na+(aq) + NH3(aq) + H2O(l) + CO2(aq) NaHCO3(s) + NH4+(aq)
Reaksi ini dipromosikan oleh rendahnya kelarutan natrium hidrogen karbonat dibawah kondisi tersebut. Pemanasan padatan produk reaksi secara perlahan-lahan akan menghasilkan natrium karbonat
Natrium hidrogenkarbonat, walaupun merupakan produk langsung dari proses Solvay, juga dibuat dengan cara melewatkan CO2 melalui Na2CO3 aqueous atau dengan cara melarutkan trona dalam H2O yang dijenuhkan dengan CO2. Penggunaannya antara lain, sebagai pembuat foam (busa), zat additif makanan (misalnya,
baking powder), dan sebagai effervescent dalam produk-produk farmasi. Perusahaan Solvay kini telah
mengembangkan suatu proses untuk menggunakan NaHCO3 dalam mengontrol polusi, misalnya, dengan netralisasi SO2 atau HCl dalam emisi industri atau limbah lainnya.
Terdapat beberapa perbedaan yang bisa dicatat antara Na+ dan garam logam alkali lain [CO2]2- dan garam [HCO3]-. Sementara NaHCO3 dapat dipisahkan dalam proses Solvay dengan cara pengendapan, tapi tidak sama untuk KHCO3. Oleh karena itu, K2CO3 diproduksi tidak melalui KHCO3, tetapi dengan reaksi KOH dengan CO2. K2CO3 telah lama digunakan pada pembuatan kaca dan keramik tertentu. Diantara penggunaannya, KHCO3 digunakan sebagai buffer dalam pengolahan air dan pada produksi minuman anggur. Litium karbonat hanya sedikit larut dalam air, “LiHCO3” hingga kini belum dapat diisolasi. Kestabilan termal karbonat-karbonat logam
golongan 1 meningkat dari atas ke bawah dengan
naiknya rM+, energi kisi menjadi satu faktor yang krusial, dapat dilihat pada reaksi di bawah. Kecenderungan dalam kestabilan berlaku untuk semua seri dari garam-garam okso dari logam-logam alkali.
Δ
M2CO3 M2O + CO2
Struktur NaHCO3 dan KHCO3 dalam keadaan padat menunjukkan adanya ikatan hidrogen. Dalam KHCO3, anion-anion bergabung membentuk pasangan
(gambar a), sementara dalam NaHCO3 terdapat rantai yang infinite (gambar b). Dalam tiap kasus di atas, ikatan-ikatan hidrogen adalah asimetris. Natrium silikat juga merupakan produk komersial yang penting.
1. 8. Kimia Larutan Aqueous Termasuk Kompleks-kompleks Makrosiklik
Ion-ion Terhidrasi
Disini mulai diperkenalkan kation-kation logam alkali terhidrasi. Beberapa garam Li+ yang mengandung anion-anion kecil, misalnya, LiF, Li2CO3 sedikit larut dalam air, tetapi untuk anion-anion besar, garam-garam Li+ larut sementara banyak garam-garam K+, Rb+, dan Cs+ sedikit larut (misalnya, MClO
Dalam larutan encer, ion-ion logam alkali jarang membentuk kompleks, tetapi jikalau kompleks dapat terbentuk, misalnya, dengan [P2O7]4- dan [EDTA]4-, urutan konstanta kestabilan normal adalah Li+ > Na+ > K+ > Rb+ > Cs+. Sebaliknya, bila ion-ion aqueous teradsorbsi pada resin penukar ion, urutan kekuatan adsorbsi
biasanya adalah
Li+ < Na+ < K+ < Rb+ < Cs+, menyiratkan bahwa ion-ion terhidrasi teradsorbsi, sebab energi hidrasi menurun sepanjang seri ini dan total interaksi yang paling besar`adalah Li (hidrasi primer plus interaksi sekunder dengan molekul-molekul air yang lebih banyak). Box 10.2, Keeping time with caesium
Pada tahun 1993, the National Institute of
Standards and Technology (NIST) memperkenalkan jam atom berbasis sesium yang disebut NIST-7 yang menjaga standard waktu internasional ke dalam satu detik dalam 106 tahun. Sistemnya tergantung pada pengulangan transisi atom Cs dari keadaan dasar ke keadaan tereksitasi yang spesifik dan monitoring frekuensi emisi radiasi elektromagnetik.
Pada tahun 1995, jam atom Cs air mancur pertama dirancang di Paris Observatory, Perancis. Suatu jam air mancur, NIST-F1 diperkenalkan pada tahun 1999 di AS yang berfungsi sebagai waktu utama seluruh negeri dan standard frekuensi; NIST-F1 menunjukan keakuratan dalam satu detik selama 20 x 106 tahun. Sementara itu, jam atom Cs yang baru-baru ini diteliti pada temperatur ambient, menunjukkan bahwa jam air mancur Cs dengan menggunakan laser untuk memperlambat dan
menurunkan atom-atom ke temperatur mendekati 0K. Untuk suatu demonstrasi on-line tentang bagaimana cara kerja NIST-F1 dapat dilihat pada website: www.
Boulder.nist.gov/timefreq/cesium/fountain.htm. Box 10. 3. Battere Ion Logam Alkali
Battere Na/S beroperasi pada sekitar 570–620K dan terdiri dari anoda leburan Na dan katoda S cair yang dipisahkan oleh elektrolit padat alumina-ß. Reaksi sel adalah:
2 Na(l) + nS(l) Na2Sn(l) Esel = 2,0 V
dan reaksi balik akan terjadi bila battere diisi ulang dengan cara mengubah polaritas sel. Percobaan dengan battere natrium/belerang (atau battere beta) untuk peralatan elektronik adalah sesuatu yang menjanjikan, tetapi pengembangan lebih lanjut untuk pasar komersial masih dibutuhkan. Temperatur operasi yang tinggi adalah gambaran dari adanya suatu potensi keamanan berbahaya.
Beberapa sifat litium, termasuk potensial reduksinya yang sangat negatif, menyebabkan litium cocok digunakan untuk battere. Sebagai contoh, battere Li/Fe sulfida mengandung satu anoda litium dan katoda FeS2 (Esel = 1,5V) dan digunakan untuk kamera. Suatu keuntungan yang penting dalam tehnologi battere telah dikembangkan adalah battere ion-litium, yang untuk pertama kalinya diperkenalkan kepada pasar komersial pada tahun 1991. Battere ion litium memiliki potensial sel 3,6V dan terdiri dari elektroda positif LiCoO2 yang terpisah dari elektroda grafit oleh elektrolit padat melalui mana ion-ion Li+ dapat bermigrasi bila sel diisi. Ion-ion Li+ diinterkalasi oleh grafit dan kembali ke elektroda LiCoO2 bila sel digunakan. Reaksi sel dapat
direpresentasikan sebagai berikut:
charged
discharged
Faktor krusial dalam battere ini adalah bahwa kedua elektroda dapat bertindak sebagai host untuk ion-ion Li+ dan sistem telah dikenal sebagai sel ”kursi-berputar” untuk merefleksikan fakta bahwa ion-ion Li+ ”berputar” balik antara dua material host selama charging dan
discharging. Battere ion-litium mempunyai beberapa aplikasi, antara lain, laptop dan note book komputer, telepon genggam, dan player CD portabel, dan sangat potensial digunakan pada mobil listrik.
BAB II
LOGAM-LOGAM GOLONGAN 2
Cakupan Pokok Bahasan ini adalah: ■ Pendahuluan
■ Kelimpahan, Ekstraksi, dan Kegunaan ■ Sifat-sifat Fisika
■ Logam ■ Halida
■ Oksida dan Hidroksida
■ Garam-garam dari Asam-asam Okso ■ Ion Kompleks Dalam Larutan Aqueous 2. 1. Pendahuluan
kerapatan muatan yang tinggi dari ion Be2+, sangat bertentangan dengan pembentukan ion Be2+.
Logam-logam golongan IIA menunjukkan
kecenderungan yang sama dengan logam-logam golongan IA. Kecenderungan kimiawi dari logam-logam ini
ditunjukkan oleh dominasi kecenderungan hilangnya elektron-elektron valensi dari orbital terluar s membentuk ion-ion bermuatan +2. Sama seperti dalam logam-logam golongan IA, kecenderungan yang paling lemah terdapat pada logam paling atas dimana energi ionisasinya paling tinggi. Dalam golongan ini, dua unsur yang paling ringan, yaitu Be dan Mg cenderung membentuk
senyawa-senyawa kovalen. Mg sangat mirip dengan Li dan ini merupakan contoh yang tepat untuk menggambarkan hubungan (kemiripan) diagonal dari keduanya. Berilium memiliki energi ionisasi lebih tinggi dari magnesium dan oleh karena itu, hampir semua senyawanya adalah kovalen. Sebagai contoh, titik lebur dari BeCl2 hanya 4400C; yang sangat rendah untuk suatu halida logam. Hal ini menunjukkan karakter kovalen yang kuat bahkan dengan unsur yang se-elekteonegatif Cl. Titik lebur MgCl2 = 7080C dan titik lebur CaCl2 = 7720C.
Secara kolektif, logam-logam Ca, Sr, Ba, dan Ra dikenal sebagai logam-logam alkali tanah, yang mana unsur-unsur ini memiliki titik lebur dan titik didih lebih tinggi dari logam golongan IA. Selain itu, logam-logam golongan IIA lebih keras dibanding logam-logam-logam-logam golongan IA. Berilium dapat meng-etsa kaca dan barium sedikit lebih keras dibanding timah hitam.
Di bawah ini diberikan harga-harga titik lebur dan titik didih serta densitas logam-logam golongan IIA. Unsur Titik Lebur (0C) Titik Didih (0C)
Densitas (g/cm3)
Be 1278 2970
1,85
Mg 651 1107
1,74
Ca 850 1240
1,55
Sr 757 1150
2,6
Ba 850 1140
3,5
Ra 700 1140
5
Radium hanya sedikit dibicarakan karena Ra adalah unsur radioaktif dan terbentuk sebagai 226Ra
88 (pemancar α, t1/2 = 1622 tahun) dalam seri peluruhan 238U
92. Ra-226 telah lama digunakan pada pengobatan kanker melebihi radioisotop lainnya. Sifat-sifat radium dan senyawa-senyawanya dapat diinterpolasikan dengan sifat-sifat senyawa-senyawa Ca, Sr, dan Ba.
2. 2. Kelimpahan, Ekstraksi, dan Kegunaan 2. 2. 1. Kelimpahan
Berilium terdapat sebagai mineral silikat beryl, Be3Al2[Si6O18], juga ditemukan dalam mineral-mineral alam dan dalam bentuk batuan berharga seperti emerald dan aquamarine. Di dalam perut bumi, magnesium menempati urutan kedelapan dalam hal kelimpahan dan kalsium menempati urutan kelima, sedangkan di laut kelimpahan magnesium menempati urutan ketiga setelah natrium,logam. Unsur-unsur Mg, Ca, Sr, dan Ba
Beberapa mineral yang penting meliputi dolomite
(CaCO3.MgCO3), magnesite (MgCO3), olivine
((Mg,Fe)2SiO4), carnalite (KCl.MgCl2.6H2O), CaCO3 (dalam bentuk kapur, batukapur, dan marmer), gypsum
(CaSO4.2H2O), celestite (SrSO4), strontianite (SrCO3), dan baryte (BaSO4). Kelimpahan Be, Sr, dan Ba di alam jauh lebih sedikit dibanding kelimpahan Mg dan Ca. 2. 2. 2. Ekstraksi
Dari semua unsur golongan 2, hanya Mg yang dibuat dalam jumlah besar. Dolomite, CaCO3.MgCO3, diuraikan secara termal menjadi campuran MgO dan CaO, dan MgO direduksi oleh ferrosilikon di dalam pipa Ni
1450K
2 MgO + 2 CaO + FeSi 2 Mg + Ca2SiO4 + Fe
kemudian Mg dipisahkan dengan cara destilasi in vacuo. Ekstraksi Mg bisa juga dilakukan dengan cara
elektrolisis MgCl2 yang terkandung dalam air laut (air laut mengandung ion Mg2+ 1,3 g/L). Dalam ekstraksi ini ion-ion Mg2+ diendapkan sebagai hidroksida. Langkah pertama adalah penambahan Ca(OH)2 ke dalam air laut untuk mengendapkan Mg(OH)2,dikenal dengan reaksi pertukaran dikarenakan harga potensial redoks. Langkah selanjutnya adalah netralisasi dengan penambahan asam klorida,
2 HCl + Mg(OH)2 MgCl2 + 2 H2O
yang diikuti oleh penguapan air yang menghasilkan MgCl2.XH2O, yang mana setelah pemanasan pada 990K akan menghasilkan klorida anhidrat. Langkah terakhir
dari proses ini adalah elektrolisis larutan sangat pekat MgCl2 dan solidifikasi Mg
pada anoda: Mg2+(l) + 2e- → Mg(l)
pada katoda: 2 Cl
-(l) → Cl2(g) + 2e
Magnesium adalah merupakan logam yang kuat dengan densitas rendah. Logam ini digunakan untuk
menghasilkan alloy ringan yang penting dengan logam-logam seperti aluminium, seng, dan mangaan; yang banyak digunakan di industri pesawat terbang dan sebagai inang untuk applikasi lainnya. Dari senyawa-senyawa kovalen magnesium, yang paling penting adalah senyawa yang mengandung magnesium yang terikat dengan karbon, yang disebut pereaksi Grignard.
Logam golongan IIA yang dapat dihasilkan dengan cara mengelektrolisis leburan garamnya atau dengan cara mereaksikan kloridanya dengan natrium adalah kalsium.
CaCl2(s) + 2Na(s) 2NaCl(s) + Ca(l)
Biasanya, Ca(OH)2 (slaked lime) diperoleh dari CaCO3 (dapat diperoleh dalam berbagai bentuk deposit
calcareous)., misalnya, dalam cangkang kerang-kerangan dan dalam sedimen batuan seperti limestone dan kapur. Juga batuan metamorphik seperti marmer. Produksi Ca dengan cara elektrolisis larutan sangat pekat CaCl2 dan CaF2, sementara Sr dan Ba diekstraksi dengan cara reduksi oksida-oksida yang sesuai oleh Al, atau elektrolisis MCl2 (M = Sr, Ba).
Berilium diperoleh dengan cara memanaskan
beryl, Be3Al2(SiO3)6 (yang bila mengandung impuriti
sebagai batuan berharga emerald) dengan Na2SiF6
menghasilkan BeF2 yang tidak larut, kemudian
mengekstraksi BeF2, lalu diikuti oleh pengendapan
Be(OH)2. Langkah selanjutnya adalah reduksi BeF2 1550K
BeF2 + Mg Be + MgF2
atau elektrolisis BeCl2 dengan menggunakan larutan sangat pekat NaCl. Ikatan kovalen warna Be dan C dapat terbentuk dengan cepat. Contohnya, senyawa-senyawa organolitium seperti etil litium bereaksi dengan berilium klorida secara cepat.
2CH3CH2Li(l) + BeCl2(s) (CH3CH2)2Be(l) + 2LiCl(s)
Reaksi ini bisa berlangsung karena kecenderungan berilium membentuk ikatan kovalen adalah lebih kuat dibanding litium.
Dalam bentuk unsur, kalsium, stronsium, barium, dan radium bersifat sangat reaktif dan Ca, Sr, Ba bereaksi dengan air.
Ba(s) + 2H2O(l) Ba2+(aq) + 2OH-(aq) + H2(g)
Dengan unsur-unsur golongan VIIA dan juga dengan oksigen
Sr(s) + Br2(l) SrBr2(s)
Senyawa-senyawanya umumnya ditemukan dalam bentuk garam. Empat unsur golongan IIA yang lebih berat membentuk hidrida seperti garam
Ba(s) + H2(g) BaH2(s)
Hidrida dari Be dan Mg memiliki struktur kompleks dengan ikatan kovalen.
Oksida-oksida dari logam-logam golongan IIA biasanya dihasilkan dengan cara pemanasan karbonatnya.Kadar Mg yg tinggi menyebabkan bangunan cepat
retak,kecepatan reaksinya tinggi.
CaCO3(s) CaO(s) + CO2(g)
Reaksi ini berlangsung secara endotermik tetapi disukai oleh entropi karena adanya karbon dioksida. Hal ini dilakukan dalam skala industry dan produk yang dihasilkan dikenal sebagai lime atau quicklime. Quicklime bereaksi sangat eksotermik dengan air dan menghasilkan kalsium hidroksida
CaO(s) + H2O(l) Ca(OH)2(s)
2. 2. 3. Kegunaan Utama Unsur-unsur Golongan 2 dan Senyawa-senyawanya.
Perhatian! Be dan senyawa-senyawa Ba yang larut bersifat sangat toksik
Berilium adalah logam yang paling ringan yang dikenal, bersifat non-magnetik dan memiliki
konduktifitas termal yang tinggi dan titik lebur yang sangat tinggi (1560K). Bila sifat-sifat ini digabung dengan sifat ke-inert-annya terhadap oksidasi aerial, membuatnya menjadi penting dalam dunia industri. Sebagai contoh, Be banyak digunakan pada pembuatan bagian badan pesawat udara berkecepatan tinggi dan missil, dan pada satelit komunikasi. Oleh karena Be memiliki densitas elektron yang rendah maka unsur ini
dengan jumlah elektron atau nomor atom. Oleh karena itu, Be dengan hanya empat elektron tidak akan
mengabsorbsi sinar-X dengan sangat baik. Faktanya, Be adalah merupakan logam dengan nomor atom paling rendah yang tidak kuat secara fisik dan sedikit stabil secara kimia sehingga dapat dibentuk. Oleh karena itu Be dapat digunakan sebagai jendela untuk tabung vakum yang memproduksi sinar-X, sebab sinar tersebut dapat lewat melalui absorbsi minimum. Titik leburnya yang tinggi dan kemampuannya yang rendah menangkap elektron, membuat Be sangat berguna di dalam industri energi nuklir.
Sebaliknya, senyawa-senyawa barium
mengabsorbsi sinar-X dengan sangat baik. Barium sulfat digunakan pada sinar x untuk diagnosis lambung dan saluran intestinal. Pasien menelan BaSO4 yang sangat sedikit larut dan gambar sinar-X akan menunjukkan bayangan gelap dimana sinar diabsorbsi oleh
barium.Walaupun ion-ion barium pada konsentrasi yang signifikan bisa menjadi sangat toksik, tetapi kelarutan barium sulfat yang sangat rendah dapat mencegah problem yang mungkin timbul.
Gambar di bawah ini menunjukkan kegunaan utama Mg.
Disamping kegunaannya pada pembuatan alloy,
manesium digunakan juga pada produksi logam titanium TiCl4(l) + 2Mg(s) Ti(s) + 2MgCl2(s)
Adanya Mg di dalam alloy Mg/Al dapat memberikan kekuatan mekanikal yang sangat besar dan tahan korosi, dan juga meningkatkan sifat-sifat fabrikasi. Alloy Mg/Al digunakan pada bagian badan pesawat udara dan mobil dan juga pada peralatan-peralatan ringan. Berbagai kegunaan lainnya, antara lain pada lampu (mercu suar), kembang api(logam), lampu blitz kamera, dan pada bidang medis seperti obat sakit maag (milk of magnesia
atau susu magnesia, Mg(OH)2) dan obat cuci perut/pencahar (Epsom salt; garam Epsom,
MgSO4.7H2O). Ion Mg2+ dan Ca2+ digunakan sebagai katalis pada transformasi difosfat-trifosfat (siklus scrab ) dalam sistem biologi; Mg2+ adalah konstituen esensil dari klorofil tanaman hijau.
Penggunaan senyawa-senyawa kalsium jauh melebihi penggunaan logam-logam lainnya, yang mana produksi dunia dari CaO, Ca(OH)2, CaO.MgO,
Ca(OH)2.MgO, dan Ca(OH)2.Mg(OH)2 adalah ≈ 118.000 Mt pada tahun 2000. Kalsium oksida (quicklime atau
CaO(s) + H2O(l) Ca(OH)2(s) ΔfH0 = -65 Kj mol-1
quicklime slaked lime
Ca(OH)2(s) + CO2(g) CaCO3(s) + H2O(l)
Penggunaan penting lainnya dari lime adalah dalam industri baja, pulp dan kertas, dan untuk ekstraksi Mg. Kebutuhan akan kalsium karbonat sangat tinggi, misalnya pada pembuatan baja, kaca, semen dan tembok dan pada proses Solvay. Pemanfaatan CaCO3 dan Ca(OH)2 akhir-akhir ini yang berhubungan dengan lingkungan adalah pada proses desulfurisasi pada cerobong/terowongan. Ca(OH)2 dalam jumlah sangat besar digunakan pada pembuatan bleaching powder, Ca(OCl)2.Ca(OH)2.CaCl2.2H2O dan pada proses pengolahan air.
Mineral gypsum adalah bentuk dihidrat dari kalsium sulfat, CaSO4.2H2O. Bila gypsum dipanaskan, maka akan terbentuk hemihidrat, CaSO4.1/2H2O berupa bubuk berwarna putih. Bila ditambahkan air, maka akan dilepaskan sejumlah panas dan dihidrat dapat terbentuk kembali. Hemihidrat dikenal sebagai plaster of paris dan digunakan untuk dinding, plaster untuk keperluan
ortopedi dan untuk pembuatan patung.
Di alam, kalsium fluorida terdapat sebagai mineral fluorspar, dan penting secara komersial sebagai bahan mentah untuk pembuatan HF dan F2
CaF2 + 2 H2SO4(pekat) 2 HF + Ca(HSO4)2
Sejumlah kecil CaF2 digunakan sebagai suatu flux dalam industri baja, untuk pelapis elektroda solder, dan pada industri kaca; prisma dan sel yang terdapat pada spektrofotometer terbuat dari CaF2.
Ion-ion yang relatif kecil dengan muatan +2 seperti Mg2+ dan Ca2+ memiliki atraksi elektrostatik yang setara untuk air. Maka, garam-garamnya bersifat
higroskopis (dapat menarik air dari udara), dan klorida-klorida dari kedua logam ini larut dalam air bila
ditinggalkan di area terbuka yang relatif lembab. Kalsium klorida dan kalsium sulfat sering digunakan sebagai desikant untuk memberikan suatu atmosfir yang kering.
Barite adalah bentuk mineral BaSO4. Produksi dunia akan senyawa ini pada tahun 2001 adalah ≈ 6600 Mt, dimana Chili menyuplai setengahnya. Kegunaan utama dari barit adalah sebagai material pemberat pada
drilling fluida minyak dan gas (pd industri pertambangan minyak sbg pemberat). Untuk skala yang lebih kecil, BaSO4 digunakan sebagai barium meal pada radiology sebab kemampuannya menghambat jalannya sinar-X. Penggunaan Ba sebagai getter dalam tabung vakum adalah karena reaktifitasnya yang tinggi terhadap gas, termasuk O2 dan N2.
terang. Garam-garamnya digunakan untuk lampu jalan/lalulintas dan kembang api. Isotop radioaktif 90Sr adalah merupakan produk dari fisi senjata nuklir. Sebab kalsium dan stronsium secara kimiawi adalah sama, maka 90Sr terdapat juga dalam tanaman yang akan bergabung dengan kalsium ke dalam susu. Selanjutnya, radioisotop akan masuk ke dalam tulang dari orang yang meminum susu, dimana seterusnya akan dapat mengemisikan partikel-partikel beta yang bersifat destruktif secara biologi.
Radium radioaktif telah lama digunakan dalam pengobatan tumor. Oleh karena sel-sel tumor
direproduksi dengan cepat, maka sel-sel tersebut lebih rentan terhadap efek pengrusakan dari radiasi disbanding sel-sel normal. Sebotol kecil garam radium dapat
dimasukkan ke dalam jaringan yang memiliki tumor untuk menghancurkan sel-sel jahat.
3. 1. Sifat-sifat Fisika 3. 1. 1. Sifat-sifat Umum
Tabel 2. 1. di bawah ini memberikan beberapa sifat fisika dari unsur-unsur golongan 2. Intensitas radioaktifitas Ra tidak memungkinkan memperoleh semua data tentang unsur ini. Beberapa poin umum yang perlu dicatat dari tabel di bawah ini adalah:
● Kecenderungan umum turunnya harga IE1 dan IE2 dari atas ke bawah diputus oleh naiknya harga IE1 dan IE2 dari Ba ke Ra. Hal ini bisa terjadi karena adanya pengaruh termodinamika pasangan inert 6s.
● Tingginya harga IE3 menjadi faktor penghambat pembentukan ion M3+.
● Melihat harga rion untuk berilium dapat memberi asumsi bahwa ion Be2+ terdapat dalam BeF
2 dan BeO, tetap menjadi hal yang bisa dipertanyakan.
● Tidak ada penjelelasan yang sederhana untuk ketidak teraturan sifat-sifat dalam satu golongan seperti titik lebur dan ΔaH0.
● Harga-harga E0 untuk pasangan M2+/M relatif konstan (dengan perkecualian untuk Be), dan dapat dijelaskan dengan cara yang sama seperti pada logam-logam golongan 1. (tabel lihat di landscape)
3. 1. 2. Test Nyala
Sama seperti untuk logam alkali, emisi spektra untuk logam-logam golongan 2 dapat diamati dengan cepat dan test nyala dapat digunakan untuk membedakan senyawa-senyawa yang mengandung
Ca- : oranye-merah tetapi terlihat hijau muda melalui kaca warna biru
Sr- : krimson, tetapi terlihat violet melalui kaca warna biru
Ba- :
3. 1. 3. Isotop Radioaktif
Isotop 90Sr adalah emitter-ß (t1/2 = 29,1 tahun) dan merupakan hasil reaksi fisi dari uranium. Dalam hal terjadinya bencana reaktor nuklir atau dalam hal pembuangan limbah nuklir, terdapat bahaya terhadap tanaman (rumput) dan kemudian susu, yang mungkin terkontaminasi dengan 90Sr dan mungkin juga bergabung dengan kalsium fosfat masuk ke dalam tulang.
4. 1. Logam-logam 4. 1. 1. Penampakan
udara, permukaan logam yang berkilau (mengkilap) dengan cepat menjadi buram.
4. 1. 2. Reaktifitas
Berilium dan magnesium dapat mengalami
passifasi
2 Be + O2 2 BeO (lapisan pelindung pada
permukaan logam berupa oksida)
dan secara kinetik inert terhadap O2 dan H2O pada temperatur ambien. Tetapi, amalgam Mg dapat
membebaskan H2 dari air, karena tidak terjadi pelapisan dalam bentuk oksida pada permukaannya. Logam Mg bereaksi dengan uap panas atau air panas
Mg + 2 H2O Mg(OH)2 + H2
uap panas
Berilium dan magnesium dapat larut dengan cepat dalam asam-asam non-oksidator; magnesium dapat diserang oleh asam nitrat, sementara berilium bereaksi dengan HNO3 encer tetapi dengan asam nitrat pekat akan mengalami passivasi. Magnesium tidak bereaksi dengan alkali aqueous, sementara Be membentuk hidroksida amfoter.
Logam-logam Ca, Sr, dan Ba, menunjukkan sifat-sifat kimia yang sama, secara umum dapat dikatakan mirip, tetapi agak kurang reaktif dibanding Na. Logam-logam ini bereaksi dengan air dan asam-asam
menghasilkan H2, dan kesamaannya dengan Na adalah dapat larut dalam NH3 cair memberikan larutan biru cantik yang mengandung elektron-elektron tersolvasi. Dari larutan ini, dimungkinkan mengisolasi heksaamina,
[M(NH3)6] (M = Ca, Sr, Ba), tetapi akan terurai secara perlahan-lahan menjadi amida.
[M(NH3)6] [M(NH2)2] 4 NH3 + H2 M = Ca, Sr, Ba
Bila dipanaskan, semua logam golongan 2 bergabung dengan O2, N2, S, atau X
Δ
2 M + O2 → 2 MO Δ
3 M + N2 → M3N2 Δ
8 M + S8 → 8 MS Δ
M + X2 → MX2
Perbedaan antara unsur pertama dan unsur-unsur di bawahnya pada logam golongan 2 dapat digambarkan dengan pembentukan hidrida dan karbida. Bila
Be2C + 4 H2O 2 Be(OH)2 + CH4
dan karbida-karbida dari logam di bawahnya mengalami hidrolisis menghasilkan C2H2
MC2 + 2 H2O M(OH)2 + C2H2 M = Mg, Ca, Sr, Ba
CaH2 digunakan sebagai drying agent tetapi reaksinya dengan air sangat eksotermik. Karbida Mg2C3 (yang mengandung ion linear [C3]4-; [C = C = C]4- isoelektronik dengan CO2) dibuat dengan cara memanaskan MgC2 atau dengan reaksi abu Mg dengan uap pentana pada 950K. Reaksi Mg2C3 dengan air menghasilkan MeC≡CH. 5. 1. Halida
5. 1. 1. Halida Berilium
Halida berilium anhidrat adalah merupakan senyawa kovalen. Fluorida, BeF2, diperoleh sebagai kaca (titik sublimasi 1073K) dari peruraian termal
[NH4]2[BeF4]. Senyawa ini dibuat dari BeO dan NH3 dalam HF (sifat nature nya HF selalu dlm bentuk polimer,asam kuat akan mengalami ioniasasi
sempurna,padahal dlm keadadan polimer terionisasina susah ) aqueous berlebih. Leburan BeF2 adalah suatu non-konduktor listrik dan padatan BeF2 mengadopsi kisi kristobalit-ß yang konsisten dengan bentuknya yang padatan kovalen. Berilium difluorida bersifat sangat larut dalam air (ikatan hidrogen ) dan pembentukan
[Be(H2O)4]2+ secara termodinamik lebih disukai. BeCl2 anhidrat (TL = 688K, TD = 793K) dapat dibuat dari reaksi
1070K
2 BeO + CCl4 2 BeCl2 + CO2
yang adalah merupakan metode standard pembuatan klorida logam yang tidak dapat dibuat dengan cara dehidrasi hidrat-hidratnya yang diperoleh dari media aqueous. Dalam hal Be, pembuatan [Be(H2O)4]2+ dicoba dari dehidrasi [Be(H2O)4]Cl2 yang menghasilkan
hidroksida, bukan klorida Δ
[Be(H2O)4]Cl2 Be(OH)2 + 2 H2O + 2
HCl
Dalam keadaan uap diatas 1020K, BeCl2 adalah suatu monomer dan mempunyai struktur linear. BeCl2 membentuk kristal tak berwarna, deliquescent,
mengandung rantai tak beraturan; lingkungan koordinasi dari tiap-tiap Be pusat adalah tetrahedral dan jarak Be – Cl lebih panjang dari jarak dalam monomernya.
Pembentukan ikatan dalam monomer BeCl2 dapat dijelaskan dengan hibridisasi sp. Dalam bentuk polimernya, tiap atom Be dapat dianggap mengalami hibridisasi sp3 dan skema ikatan-σ yang terlokalisasi adalah cocok yang mana tiap atom Cl mendonasikan sepasang elektron bebas kepada orbital hibrid yang kosong di sekitar atom Be. Pembentukan rantai ini menunjukkan sifat asam Lewis dari berilium dihalida dimana BeCl2 bertindak sebagai katalis Friedel-Crafts dan pembentukan adduct digambarkan oleh [BeF4]2-,
[BeCl4]2-, dan BeCl2.2L (L = eter, aldehid, keton). 5. 1. 2. Halida-halida dari Mg, Ca, Sr, dan Ba
yang tinggi, agak larut dalam air yang mana kelarutannya meningkat sedikit dengan naiknya ukuran kation (Ksp untuk MgF2, CaF2, SrF2, dan BaF2 secara berturut-turut adalah7,42 x 10-11, 1,46 x 10-10, 4,33 x 10-9, dan 1,84 x 10-7. Sementara MgF
2 mengadopsi kisi rutil, CaF2, SrF2, dan BaF2 adalah kristal dengan struktur fluorite. Bebeda dari sifat-sifat BeF2, tak satupun dari fluorida-fluorida logam di bawahnya bersifat sebagai asam Lewis.
Struktur fluorida logam golongan 2 dalam fase gas dan molekul-molekul halida berikutnya dapat dilihat pada tabel 2. 2. di bawah ini.
Istilah quasilinear mengacu pada spesies yang mana perbedaan antara energi terhitung struktur linear dan bengkok (dengan perubahan sudut >200) kurang dari 4 Kj mol-1. Struktur yang paling bengkok dari dihalida adalah BaF2. Senyawa ini memiliki sudut ikatan pada area 110 – 1260 (harga ini berasal dari sejumlah teori dan data eksperimental) dan energi terhitung untuk mengubah BaF2 bengkok menjadi molekul linear adalah ≈ 21 Kj mol-1. Kelebih-sukaan struktur bengkok untuk logam-logam yang paling berat yang bergabung dengan F, Cl, atau Br dapat dijelaskan dalam hubungannya baik dengan “inverse polarisasi” maupun dengan partisipasi orbital atom d untuk Ca, Sr, dan Ba. Inverse polarisasi terjadi bila ion logam dapat dipolarisasi dan terpolarisasi oleh F
-atau Cl-, atau menjadi lebih kecil oleh Br-. Polarisasi yang mengacu pada “inverse” untuk membedakannya dari polarisasi anion besar yang dapat dipolarisasi oleh kation.
Penjelasan alternatif lainnya difokuskan pada partisipasi orbital d dalam ikatan yang terdapat pada CaX2, SrX2, dan BaX2. Tabel 2. 2 di atas menunjukkan bahwa Be dan Mg hanya membentuk dihalida gas yang linear. Kedua logam ini hanya mempunyai orbital atom s
dan p yang tersedia untuk ikatan dan orbital tumpang tindih M – X yang paling baik dapat dicapai untuk suatu molekul linear. Gambar 11.3, hal 282 menunjukkan suatu orbital np pada M dengan kombinasi out-of-phase dari orbital-orbital X….X. Orbital kosong yang tersedia untuk Ca adalah 3d, untuk Sr adalah 4d, dan untuk Ba adalah 5d, tetapi hanya dapat tumpang tindih secara efektif dengan orbital-orbital pada atom-atom X jika molekul MX2 bengkok. Kombinasi out-of-phase dari orbital-orbital X….X hanya tumpang tindih secara efisien dengan orbital dyz dari M jika molekul MX2 berbentuk bengkok. Pembukaan molekul hingga berbentuk linear adalh dengan “memutar” interaksi orbital ini. Walaupun interaksi antara orbital logam dz2 dan kombinasi in-phase orbital X….X adalah yang paling efisien bila MX2
berbentuk linear, namun demikian masih tetap efisien bila molekul berbentuk bengkok.
Magnesium klorida, bromida, dan iodida dapat diperoleh dalam bentuk kristal dari larutan aqueous sebagai hidrat yang mengalami hidrólisis parsial bila dipanaskan. Oleh karena itu, garam-garam anhidrat dapat dibuat dengan persamaan reaksi
Catatan, suatu padatan higroskopis dapat mengabsorbsi air dari udara sekitarnya tetapi tidak bisa menjadi liquid.
Anhidrat MCl2, MBr2, dan MI2 (M = Ca, Sr, dan Ba) dapat dibuat dengan cara dehidrasi garam-garam hidrat. Halida-halida anhidrat seperti ini adalah higroskopis dan CaCl2 (yang diperoleh sebagai hasil samping dari proses Solvay) digunakan sebagai drying-agent laboratorium dan juga untuk road de-icing. Dalam keadaan padat, banyak dari halida-halida anhidrat memiliki struktur lapisan yang kompleks seperti kisi CdI2. Kebanyakan dari halida-halida ini bisa larut dalam pelarut-pelarut polar seperti eter atau piridin, dan
sejumlah kristal kompleks telah berhasil diisolasi. Koordinasi oktahedral telah dikonfirmasi oleh studi diffraksi sinar-X dari senyawa-senyawa kompleks termasuk trans-[MgBr2(py)4], trans—[MgBr2(THF)4],
cis—[MgBr2(diglyme)(THF)], dan trans-[CaI2(THF)4]. Dalam [MgBr2(Pthf)2], koordinasi oktahedral dalam keadaan padat dapat dicapai dengan pembentukan suatu struktur rantai. Catatan, py = pyridine, THF =
tetrahidrofuran. Ukuran yang besar dari logam-logam yang lebih berat memungkinkan bilangan koordinasi yang lebih tinggi, misalnya, trans-[SrBr2(py)5] dan trans -[SrI2(THF)5]. Dalam kimia organik, MgBr2 digunakan sebagai katalis untuk reaksi-reaksi esterifikasi dan MgBr2.2Et2O dapat diperoleh secara komersial, yang digunakan sebagai katalis untuk konversi epoksida alifatik menjadi ketone.
6. Oksida dan Hidroksida 6. 1. Oksida
Berilium oksida, BeO, dapat dibuat dengan cara membakar Be atau senyawanya dalam O2. BeO adalah suatu padatan berwarna putih, tidak larut dalam air, yang mengadopsi kisi wurtzite. Oksida-oksida logam golongan 2 lainnya biasanya dibuat dengan peruraian termal
karbonatnya, temperatur T mengacu pada P(CO2) = 1 barr)
M = Mg
T = 813K
TK Ca
1173K
MCO3 MO + CO2 Sr 1563K
Ba 1633K
Gambar 11.5, hal 284 di bawah ini menunjukkan
Tingginya titik leleh dari MgO menyebabkan senyawa ini cocok untuk material-material refraktori. Catatan,
material refraktori cocok untuk penggunaan pada oven. Material seperti ini memiliki titik leleh yang tinggi, daya hantar listrik rendah, dan bersifat inert secara kimia pada temperatur operasi oven yang tinggi.
Aksi air terhadap MgO dapat mengubahnya menjadi Mg(OH)2 yang sedikit larut. Oksida-oksida Ca, Sr, dan Ba bereaksi dengan cepat dan eksoterm dengan air, dan mengabsorbsi CO2 dari atmosfir (persamaan 5). Pengubahan CaO menjadi kalsium karbida dan reaksi hidrolisis selanjutnya sangat penting di dunia industri, walaupun sebagai suatu prekursor, etuna dapat diperoleh dari etena.
2300K
CaO + 3 C CaC2 + CO CaC2 + 2 H2O → Ca(OH)2 + C2H2
Peroksida-peroksida logam golongan 2, MO2, yang dikenal antara lain adalah untuk M = Mg, Ca, Sr, dan Ba. Percobaan pembuatan BeO2 sejauh ini masih belum berhasil dan tidak adanya bukti eksperimental untuk senyawa berilium peroksida. Seperti peroksida logam golongan 1, kestabilan terhadap reaksi peruraian di bawah meningkat dengan naiknya ukuran ion M2+.
MO2 → MO + ½ O2 (M = Mg, Ca, Sr, Ba)
Kecenderungan ini sebagai akibat dari perbedaan energi kisi antara MO dan MO2 (untuk M tertentu) yang menjadi semakin kecil jika r+ semakin besar; ΔkisiH0(MO, padat) selalu lebih kecil dibanding ΔkisiH0(MO2, padat).
Semua peroksida adalah oksidator kuat.
Magnesium peroksida (yang digunakan untuk pasta gigi) dibuat dengan mereaksikan MgCO3 atau MgO dengan H2O2. Kalsium peroksida dibuat dengan dehidrasi hati-hati CaO2.8H2O, yang mana CaO2.8H2O dibuat dari reaksi:
Ca(OH)2 + H2O2 + 6 H2O → CaO2.8H2O
Reaksi SrO dan BaO dengan O2 (600K, 200 barr, dan 850K) menghasilkan SrO2 dan BaO2. BaO2 murni belum bisa diisolasi dan secara komersial dapat diperoleh senyawa yang mengandung BaO dan Ba(OH)2. Reaksi peroksida dengan asam-asam akan menghasilkan H2O2
SrO2 + 2 HCl → SrCl2 + H2O2 6. 2. Hidroksida
lainnya bersifat basa. Dalam keadaan [OH]- berlebih, Be(OH)2 bersifat sebagai asam Lewis
Be(OH)2 + 2 [OH]- → [Be(OH)4]2-
yang membentuk ion kompleks tetrahedral,
tetapi Be(OH)2 juga bereaksi dengan asam-asam Be(OH)2 + H2SO4 → BeSO4 + 2 H2O
Kelarutan M(OH)2 (M = Mg, Ca, Sr, Ba) dalam air meningkat dari atas ke bawah seperti halnya kestabilan termalnya untuk terurai menjadi MO dan H2O.
Magnesium hidroksida bertindak sebagai basa lemah, sementara Ca(OH)2, Sr(OH)2, dan Ba(OH)2 adalah basa kuat. Soda lime adalah merupakan campuran dari NaOH dan Ca(OH)2 dan dibuat dari CaO dan NaOH aqueous. Adalah lebih mudah menangani soda lime dibanding NaOH, dan secara komersial soda lime dapat diperoleh.
Soda lime banyak digunakan sebagai absorber untuk CO2. Dalam test kualititatif untuk garam-garam [NH4]+ ,
amida, imida, dan senyawa-senyawa yang sehubungan akan dilepaskan NH3 bila dipanaskan dengan soda lime. 6. 3. Garam-garam dari Asam-asam Okso
Pada bagian ini, akan diberikan beberapa garam dari asam-asam okso hanya untuk senyawa-senyawa yang khusus dan penting. Kebanyakan garam-garam berilium dari asam-asam okso kuat ditemukan dalam bentuk kristal sebagai hidrat yang dapat larut. Berilium karbonat
cenderung terhidrolisis menghasilkan garam yang mengandung [Be(H2O)4]2+. BeCO3 dapat diisolasi hanya dengan cara pengendapan dibawah atmosfir CO2.
Kecenderungan terhadap hidrólisis juga digambarkan oleh pembentukan basa berilium asetat, [Be4(µ4-O) (µ-O2CMe)6] (bukan Be(MeCO2)2) oleh aksi MeCO2H pada Be(OH)2. Gambar 11.6, hal 286 menunjukkan struktur [Be4(µ4-O) (µ-O2CMe)6]; atom oksigen sentral terikat kepada empat Be pusat yang terletak pada sudut-sudut tetrahedral. Struktur yang sama telah diobservasi pada basa nitrat [Be4(µ4-O) (µ-O2NO)6] yang terbentuk dengan urutan reaksi:
N2O4 323K BeCl2 [NO]2[Be(NO3)4] Be(NO3)2
398K
[Be4(µ4 -O)(µ-O2NO)6]
dari jenis “M(HCO3)2” belum dapat diisolasi. Air keras
(sadah) mengandung ion-ion Mg2+ dan Ca2+ yang dapat membentuk kompleks dengan ion-ion stearat di dalam sabun, menghasilkan “buih” yang tidak larut. Terjadinya
Kesadahan sementara adalah disebabkan adanya garam-garam hidrogenkarbonat dan ini dapat diatasi dengan pendidihan (yang menyebabkan pergeseran
kesetimbangan 27 di bawah ke kanan dan menghasilkan pengendapan CaCO3 atau MgCO3) atau dengan
penambahan sejumlah tertentu Ca(OH)2 ( menghasilkan endapan persamaan berikut)
Ca(HCO3)2(aq) == CaCO3(s) + CO2(g) + H2O(l)
Ca(HCO3)2(aq) + Ca(OH)2(aq) → 2 CaCO3(s) + 2 H2O(l)
Terjadinya Kesadahan tetap (permanen) adalah
disebabkan oleh garam-garam Mg2+ dan Ca2+ (misalnya, sulfat). Proses pelunakan air sadah melibatkan pelewatan
air keras(sadah) melalui resin penukar kation. Mesin pembersih-detergen mengandung “builder” yang
melepaskan ion-ion Mg2+ dan Ca2+ dari mesin air; untuk kepentingan ini digunakan polifosfat, tetapi oleh karena fosfat dapat merusak lingkungan, maka digunakanlah zeolit.
Kalsium karbonat terdapat di alam dalam dua bentuk kristal, yaitu calcite dan metastabil aragonite. Dalam calcite, ion-ion Ca2+ dan [CO3]2+ tersusun dengan susunan dimana tiap ion Ca2+ membentuk koordinasi-6 ke sisi-sisi atom-atom O karbonat, sementara dalam
aragonite, tiap ion Ca2+ dikelilingi oleh sembilan atom O. Perbedaan energi antara kedua karbonat ini adalah < 5 Kj mol-1 yang mana calcite adalah bentuk yang secara termodinamika lebih disukai. Namun demikian, aragonite stabil secara kinetik terhadap perubahan menjadi calcite.
Aragonite dapat dibuat di laboratorium dengan cara pengendapan CaCO3 dari larutan aqueous panas.
Sulfat dari Mg dan Ca mempunyai aplikasi yang penting. Kalsium sulfat hidrat (CaSO4.2H2O, gypsum) terdapat di alam dan juga sebagai produk proses desulfurisasi yang melibatkan Ca(OH)2 atau CaCO3. Kristal gypsum dapat pecah dengan mudah karena dalam kristal terdapat lapisan-lapisan yang saling terikat oleh ikatan hidrogen. Bila gypsum dipanaskan pada ≈ 400K, akan terbentuk hemihidrat CaSO4.1/2H2O (plaster of
Paris) dan jika plaster ini dicampur dengan air maka material ini akan mengembang sedikit sebagai akibat dihasilkannya dihidrat.
Barium sulfat adalah garam yang agak larut (Ksp = 1,07 x 10-10) dan pembentukan endapan putih BaSO
4 digunakan sebagai test kualitatif untuk melihat adanya ion-ion sulfat dalam larutan aqueous.
BaCl2(aq) + [SO4]2-(aq) → BaSO4(s) + 2 Cl-(aq)
Catatan, Suatu hidrat X.nH2O yang mana n = ½ disebut hemihidrat; jika n = 1,5 disebut sesquihidrat.
7. Hubungan Diagonal Antara Li dan Mg, dan Antara Be dan Al
Telah dijelaskan bahwa sifat-sifat Li dan senyawa-senyawanya sering diterima sebagai anomali bila dibandingkan dengan senyawa-senyawa logam-logam golongan 1 lainnya dan bahwa terdapat hubungan diagonal antara Li dan Mg. Dalam bagian ini, kita akan membahas hubungan ini lebih detail dan juga
Li Be B
Na Mg Al
K Ca Ga
Tabel 3 di bawah ini memberikan beberapa sifat fisik yang penting dari masing-masing tiga unsur-unsur pertama dalam golongan 1, 2, dan 3.
Sifat-sifat
Jari-jari logam, rlogam,/pm Jari-jari ion, rion,/pm Elektronegatifitas Pauling, XP
ΔatomH0(298K)/Kj mol-1
Golongan 1 Golongan 2 Golongan 3
Li Na K Be Mg Ca B Al Ga
Membandingkan sifat-sifat Li dengan sifat-sifat Na dan K, atau Li dengan Mg, dapat dilihat bahwa Li lebih mirip dengan Mg dibanding dengan Na dan K dan unsur-unsur di bawahnya. Perbandingan yang sama dapat dilihat antara Be, Mg, Ca, dan Al memberikan kesimpulan bahwa sifat-sifat fisik Be seperti pada tabel di atas lebih mirip dengan sifat-sifat Al dibanding dengan Mg dan Ca dan unsur-unsur di bawahnya. Satu faktor yang krusial adalah bahwa densitas muatan Li+ dan Mg2+ adalah sama karena dengan naiknya muatan diimbangi oleh naiknya ukuran ion. Begitu juga untuk Be2+ dan Al3+.
Hubungan diagonal ini menghasilkan
kemiripan/kesamaan antara kimiawi Li dan Mg dan antara Be dan Al dan menyebabkan adanya perbedaan sifat unsur pertama dengan unsur-unsur di bawahnya untuk tiap golongan. Kation-kation yang kecil seperti Li+, Mg2+, Be2+, dan Al3+ memiliki densitas muatan yang tinggi dan masing-masing kation tersebut memiliki daya polarisasi yang tinggi (high polarizing power).
7. 1. Litium dan magnesium
Yang membuat Li mirip secara diagonal dengan Mg, tetapi tidak mirip secara vertikal dengan unsur-unsur di bawahnya adalah sifat-sifat kimianya, antara lain: ●Litium dengan cepat dapat bergabung dengan N2 menghasilkan nitrida, Li3N; Mg bereaksi dengan N2 menghasilkan Mg3N2.
●Litium bergabung dengan O2 menghasilkan oksida Li2O bukan peroksida atau superoksida; Mg membentuk MgO. Peroksida dari kedua logam ini dapat dibuat dengan reaksi LiOH atau Mg(OH)2 dengan H2O2.
●Pada pemanasan, litium dan magnesium karbonat terurai dengan cepat menghasilkan Li2O dan CO2 , dan MgO dan CO2; dari atas ke bawah kestabilan akan peruraian termal dari karbonat-karbonat dari logam golongan 1 meningkat.
●Litium dan magnesium nitrat terurai pada pemanasan sesuai persamaan reaksi:
Δ
2 Mg(NO3)2 2 MgO + 2 N2O4 + O2
sementara NaNO3 dan nitrat-nitrat logam alkali lainnya terurai sesuai persamaan reaksi:
Δ
2 MNO3 2 MNO2 + O2 (M = Na, K,
Rb, Cs)
●Ion-ion Li+ dan Mg2+ lebih kuat terhidrasi di dalam larutan aqueous dibanding ion-ion logam-logam golongan 1 dan 2 lainnya.
●LiF dan MgF2 sedikit larut dalam air, sementara fluorida-fluorida logam-logam golongan 1 lainnya larut. ●LiOH jauh lebih sedikit larut dalam air dibanding hidroksida-hidroksida logam alkali lainnya; Mg(OH)2 sedikit larut.
●LiClO4 jauh lebih larut dalam air dibanding perklorat-perklorat logam alkali lainnya; Mg(ClO4)2 dan perklorat-perklorat logam alkali tanah lainnya sangat larut.
7. 2. Berilium dan Aluminium
Yang membuat Be mirip secara diagonal dengan Al, tetapi tidak mirip secara vertikal dengan unsur-unsur di bawahnya adalah sifat-sifat kimianya, antara lain: ●Dalam larutan aqueous, ion Be2+ terhidrasi membentuk [Be(H2O)4]2+ yang mana Be2+ pusat mempolarisasi ikatan polar O – H secara signifikan, menyebabkan kehilangan H+
[Be(H2O)4]2+ + H2O == [Be(H2O)3(OH)]+ + [H3O]+
dengan cara yang sama, kemampuan polarisasi Al+3 menyebabkan [Al(H2O)6]3+ bersifat asam (Pka = 5,0)
[Al(H2O)6]3+(aq) + H2O(l) == [Al(H2O)5(OH)]2+(aq) + [H3O]+(aq)
●Be dan Al bereaksi dengan alkali aqueous menghasilkan H2 tetapi Mg tidak bereaksi.
●Be(OH)2 dan Al(OH)3 adalah bersifat amfoter; dapat bereaksi baik dengan asam maupun dengan basa (persamaan 24 dan 25) dan persamaan berikut untuk Al(OH)3
Al(OH)3(s) + KOH(aq) → K[Al(OH)4](aq) Al(OH)3(s) + 3 HNO3(aq) → Al(NO3)3(aq) + 3 H2O(l)
hidroksida-hidroksida dari logam-logam golongan 2 lainnya adalah basa.
●BeCl2 dan AlCl3 berasap di kelembaban udara, bereaksi menghasilkan HCl
●Baik Be maupun Al dapat membentuk halida kompleks oelh karena kemampuan klorida bertindak sebagai katalis Friedel-Crafts.
Penggunaan Logam Be dan Alloy N. N. Greenwood dan A. Earnshaw
dalam instrumen presisi, relay control, dan alat-alat elektronik. Alloy ini juga non-sparking dan karena itu sangat baik digunakan untuk peralatan dalam industri petroleum. Alloy nikel dengan kandungan 2% Be digunakan untuk spring temperatur tinggi, clip, bellow, dan penghubung alat-alat elektronik. Kegunaan utama lainnya dari Be adalah dalam reaktor nuklir karena Be adalah merupakan salah satu moderator dan reflektor neutrón yang paling efektif. Penggunaan Be lainnya walaupun dalam jumlah kecil adalah sebagai material jendela dalam tabung sinar-X; Be dapat
mentransmissikan sinar-X 17 kali lebih baik dibanding Al dan 8 kali lebih baik dibanding kaca Lindemann.
Campuran dari senyawaa-senyawa radium dan berilium telah lama digunakan sebagai sumber neutrón di
laboratorium yang menghasilkan penemuan neutrón oleh J. Chadwick pada tahun 1932: 9Be(ά,n)12C.
Logam Mg dan Alloy
Keuntungan utama dari Mg sebagai logam struktural adalah densitynya yang rendah (1,74 g cm-3 bandingkan dengan 2,70 untuk Al dan 7,80 untuk baja)Untuk kekuatan yang sama, alloy Mg yang terbaik beratnya hanya seperempat dari baja dan alloy Al yang terbaik beratnya hanya sepertiga baja. Mg juga memiliki kemampuan mekanik yang sangat baik dan dapat di-cast atau dicetak dengan metode-metode metalurgi standard (rolling, extruding, drawing, forging, welding, brazing, atau riveting). Oleh karena itu, kegunaannya yang utama adalah sebagai logam konstruksi ringan, bukan hanya untuk pesawat terbang tetapi juga untuk barang-barang, fotografi, dan peralatan optik. Juga digunakan untuk proteksi katoda dari logam-logam lain terhadap korosi,
sebagai oksigen scavenger, dan sebagai reduktor dalam produksi Be, Ti, Zr, Hf, dan U. Produksi dunia melebihi 300.000 ton.
Tipikal alloy Mg mengandung > 90% Mg bersama-sama dengan 2-9% Al, 1-3% Zn, dan 0,2-1% Mn. Pengembangan retensi kekuatan pada temperatur tinggi (hingga 450oC) dicapai dengan meng-alloynya dengan logam-logam tanah jarang (misalnya, Pr/Nd) atau Th. Alloy-alloy ini dapat digunakan untuk casing mesin automóbil dan untuk fuselages pesawat terbang dan roda pendaratan. Maka tiap Volkswagen Beetle menggunakan 20 kg alloy Mg di dalam mesin block die-cast nya dan tiap Titan ICBM menggunakan hampir 1 ton alloy Mg. Kegunaan lainnya adalah dalam tread-plate ringan, dock-board, loading platform, gravity conveyor, dan shovel.
Hingga 5% Mg ditambahkan untuk kebanyakan Al komersial untuk meningkatkan sifat-sifat mekaniknya, ke-dapat-solder-annya, dan tahan korosinya.
Kegunaan Limestone dan Lime Dalam Dunia Industri
Batuan limestone adalah bentuk yang paling umum dari kalsium karbonat, yang juga terdapat sebagai kapur, marmer, koral, kalsite, argonite, dll, dan (dengan Mg) sebagai dolomite. Limestone dan dolomite telah digunakan secara luas sebagai material bangunan dan aggregat jalan raya dan keduanya dibutuhkan dalam skala besar di seluruh dunia. CaCO3 juga merupakan bahan kimia industri utama dan indispensable sebagai prekursor dari quick lime (CaO) dan slaked lime Ca(OH)2. Bahan-bahan kimia ini merupakan hal yang krusial untuk