LAPORAN PRAKTIKUM KIMIA DASAR I PERCOBAAN I SIFAT-SIFAT UNSUR NAMA : BAHRUN STAMBUK : H311 14 305 GOLONGAN/KELOMPOK : H5/1
HARI/TANGGAL PRAKTIKUM : 16 OKTOBER 2014
ASISTEN : NUR HASNI
LABORATURIUM KIMIA DASAR JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS HASANUDDIN
MAKASSAR 2014
BAB I PENDAHULUAN
I.1 Latar Belakang
Unsur-unsur alkali dalam sistem periodik merupakan golongan IA yang meliputi Litium, Natrium, Kalium, Rubidium, Cesium, dan Fransium. Yang paling banyak terdapat di alam adalah Natrium dan Kalium, masing-masing menempati peringkat ke-6 dan ke-7 sebagai atom terbanyak pada kulit bumi. Yang paling sedikit dijumpai adalah Fransium, sebab bersifat radioaktif sehingga mudah berubah menjadi unsur lain.
Unsur-unsur alkali tanah (golongan IIA) terdiri dari Berilium, Magesium, Kalsium,Stronsium, Barium, dan Radium. Yang terbanyak di alam adalah kalsium dan magnesium, yang menempati peringkat ke-5 dan ke-8 pada kulit bumi. Adapun radium yang bersifat radioaktif merupakan unsur alkali tanah yang paling sedikit didapatkan (Irfan,1986).
Dari pemaparan diatas mengenai unolongan unsur-unsur golongan IA dan golongan IIA, tentunya kita masih menerka-nerka mengenai bagaimana sifat-sifat yang dapat ditunjukkan dari masing-masing unsur dari golonhan alkali (I A) alkali tanah (II A). Melalui percobaan sifat-sifat unsur ini kita akan dapat mengetahui apa yang menjadi ciri khas dari setiap unsur sehingga kit dapat membedakannya, dan sekaligus kita dapat mengetahui dan mendapatkan informasi tentang beberapa sifat-sifat kimia maupun sifat-sifat fisika dari unsur-unsur tersebut.
Pengetahuan kita mengenai sifat-sifat unsur ini menjadi sangat penting karena dengan mengetahui sifat-sifat dari setiap unsur golongan IA dan golongan
IIA maka kita dapat memanfaatkan sifat-sifat tersebut dalam bereksperimen. Selain itu mengapa praktikum ini menjadi sangat penting karena dengan mengetahui apa yang menjadi sifat dari setiap unsur tersebut maka akan sangat membantu dalam mereaksikan suatu unsur.
I.2 Maksud danTujuan I.2.1 Maksud Percobaan
Maksud percobaaan dari percobaan ini adalah membandingkan kereaktifan dan kelarutan gaaram sulfat maupun kelarutan garam hidroksida dari unsur-unsur golongan alkali dan alkali tanah.
I.2.2 Tujuan Percobaan
Adapun tujuan yang ingin dicapai dari percobaan ini adalah untuk mempelajari beberapa sifat unsur golongan alkali (IA) dan alkali tanah (IIA).
I.3 Prinsip Percobaan
Adapun prinsip dari percobaan ini adalah mereaksikan unsur-unsur golongan alkali dan alkali tanah dengan air untuk mengetahui sekaligus membandingkan reaktifitas unsur-unsur tersebut. Serta mereaksikan senyawa garam dari unsur-unsur golongan alkali dan alkali tanah tersebut dengan asam (H2SO4) dan basa (NaOH) untuk mengetahui dan membandingkan sifat kelarutan garam sulfat dan garam hidroksida dari golongan unsur tesebut.
BAB II
TINJAUAN PUSTAKA
Unsur-unsur alkali dan alkali tanah merupakan logam-logam yang sangat reaktif, hal ini disebabkan karena alkali dan alkali tanah masing-masing mempunyai satu dan dua elektron di kulit terluar. Maka tidaklah aneh mengapa kemudian unsur-unsur golongan I A dan II A ini tidak ditemukan di alam dalam keadaan bebas. Pada kulit bumi mereka terdapat dalam wujud bijih-bijih oksida, karbonat atau sulfida (Irfan,1986).
Ketika Antonie Laurent Lavoiser (1743-1794) menysun unsur-unsur pada tahun 1789, bijih-bijih alkali dan alkali tanah masih dianggap sebagai ”unsur”, sebab pada saaat itu zat-zat tersebut memang tidak dapat diuraikan lebih lanjut menjadi zat lain yang lebih sederhana. Setelah cara elektrolisa ditemukan padaawal abad ke-19, barulah unsur alkali dan alkali tanah dibuat dari senyawa-senyawanya (Irfan,1986).
Sir Humphry Davy (1778-1829) adalah orang pertama yang berhasil memperoleh logam-logam I A dan II A. Pada tahun 1807-1808 ia mengelektrolisa lelehan beberapa beberapa zat yang saat itu bernama soda, kali, magnesia, calx, strontia, dan barit. Davy ternyata memperoleh unsur-unsur yang sebelumnya tidak pernah dikenal oleh manusia. Keenam unsur baru tersebut dinamai sodium (natrium), kalium, magnesium, kalsium, stronsium, dan barium (Irfan,1986).
Kemudian Johannes Afzelius Arvidson (1792-1841) dari Swedia menemukan Litium pada tahun 1817, dan disusul oleh penemu Berilium pada tahun 1828 oleh Vauquelin. Dua orang sarjana Jerman, Robert Wilhelm Bunsen
(1811-1899) dan Gustaf Robert KIrchoff (1824-1877) pada tahun 1861 menemukan Cessium, dan Rubidium. Lalu Pierre dan Merie Curie menambah perbendaharaan denga menemukan Radium pada tahun 1989. Akhirnya, unsur Fransium ditemukan oleh Maguerite Perey pada tahun 1939 (Irfan,1986).
Sekalipun logam alkali dan alkali tanah baru dikenal sejak abad ke-19, nama alkali sendiri berasal dari abad pertengahan. nama alkali berasal dari bahasa Arab, al-qali, yang artinya abu, sebab Abu Musa Jabir bin Hayyan (700-778) memperoleh soda dari abu tumbuhan laut (Irfan,1986).
Logam-logam alkali dikhususkan pada logam Li, Na, K, Rb dan Cs dengan konfigurasi elektron terluar (ns1, n≥2). Logam alkali mempunyai energi ionisasi rendah dan kecenderugannya kuat melepaskan elektron valensi tunggalnya, cukup reaktif sehingga jarang ditemukan secara bebas di alam. Logam alkali dapat bereaksi dengan air membentuk hidroksida logam alkali dengan melepaskan gas hidrogen, dapat membentuk oksida, peroksida, bahkan superoksida yang ketiganya menghilangkan bentuk kilapan logamnya. Selain Litium yang hanya dapat membentuk oksida, maka logam alkali yang lain dapat membentuk peroksida dan untuk K, Rb, dan Cs dapat pula membentuk superoksida logam alkali artinya reaktifitas logam alkali dengan oksigen meningkat dari atas ke bawah dalam golongannya (Tim Dosen Kimia, 2012).
Alasan bahwa perbedaan jenis oksida yang terbentuk adalah ketika logam alkali bereaksi dengan oksigen haruslah berkaitan kestabilan oksida tersebut dalam keadaan padat. Karena oksida ini seluruhnya adalah senyawa ionik, kestabilannya bergantung pada seberapa kuat kation dan anion saling tertarik satu sama lain. Litium cenderung untuk membentuk litium oksida yang demikian
karena senyawa ini lebih stabil dibandingkan litium peroksida. Pembentukan
oksida logam alkali yang lain dapat dijelaskan dengan cara yang sama (Chang, 2003).
Sifat kimia logam alkali tanah bermiripan dengan logam alkali, tetapi logam alkali tanah kurang reaktif dari logam alkali seperiode.Jadi, berilium kurang reaktif dibandingkan litium, magnesium kurang reaktif dibandingkan terhadap natrium, dan seterusnya.Hal itu disebabkan jari-jari atom logam alkali tanah lebih kecil sehingga energi pengionan lebih besar. Lagi pula logam alkali tanah hanya satu.Kereaktifan kalsium, stronsium,dan barium dan tidak terlalu
berbeda dari logam alkali, tetapi berilium dan magnesium jauh kurang aktif (Anonim, 2012).
Logam-logam alkali tanah adalah: Be, Mg, Ca, Sr, dan Ba, logam ini juga cukup reaktif namun tidak sereaktif jika dibandingkan dengan logam alkali. Konfigurasi elektron terluarnya adalah (ns2, ≥ 2), memiliki kecenderungan melepaskan kedua elektron terluarnya untuk membentuk ion M+ dengan bentuk konfigurasinya menyerupai konfigurasi gas mulia yang stabil dan karakter ini meningkat dari Berilium ke Barium dan khusus untuk Berilium di alam lebih cenderung berbentuk molekular dibanding berbentuk ionik terutama oksidanya
berbentuk oksida amfoter bukan oksida logam yang bersifat basa (Tim Dosen Kimia, 2012).
Berilium dan magnesium membentuk oksida (BeO dan MgO) hanya pada suhu tinggi, sedangkan CaO, SrO, dan BaO terbentuk pada suhu kamar. Kalsium, Strontium,dan Barium juga bereaksi dengan asam menghasilkan gas hidrogen. Tetapi, karena logam-logam ini juga menyerang air, dua reaksi yang berbeda akan
terjadi secara serentak (Chang,2003).
Sifat-sifat kalsium dan stronsium memeberi suatu contoh menarik tentang kemiripan golongan dalam tabel periodik Stronsium-90, suatu isotop radioaktif, adalah produk utama dari ledakan bom atom. Jika suatu bom atom diledakkan di atmosfer, Stronsium-90 yang terbentuk akan tercampur dengan tanah dan air, dan
masuk kedalam tubuh kita lewat rantai makanan yang relatif pendek (Chang,2003).
Unsur-unsur golongan II A tersebar di alam dalam bentuk batuan (Sri Wardhani, 2014):
1. Magnesium
Mineral utama yang mengandung magnesium adalah carnelitte, magnesite, dan dolomite. Kelimpahan magnesium terdapat pada urutan kedelapan pada kulit bumi.
2. Kalsium
Ditemukan dalam kalsium, limestone, gypsum, fluorite, stalaktit dan stalaknit, mengandung kalsium karbonat. Kelimpahan kalsium terletak pada urutan kelima pada kulit bumi.
BAB III
METODOLOGI PERCOBAAN
3.1 Alat dan Bahan 3.1.1 Alat
Alat-alat yang digunakan dalam praktikum adalah: tabung reaksi, pipet tetes, spiritus, pinset, korek, penjepit tabung, tissue roll dan rak tabung.
3.1.2 Bahan
Adapun bahan yang digunakan dalam praktikum ini adalah: logam Li, Na, Mg dan Ca, NaOH, indikator PP, larutan BaCl2 0,5 M, larutan CaCl2 0,5 M, larutan NaOH 0,5 M, larutan H2SO4 0,5 M, dan akuades.
3.2 Prosedur Percobaan 3.2.1 Reaktifitas Unsur
Menyiapkan 3 buah tabung reaksi yang berisi air 2 mL. Tabung reaksi(1) diisi logam Li, tabung (2) dengan logam Mg dan tabung (3) dengan tabung logam Ca. Mengamati dan memperhatikan reaksi yang terjadi, jika tidak terjadi reaksi, panaskan tabung hingga terjadi reaksi (terjadi reaksi ditandai adanya gelembung-gelembung gas). Teteskan indikator PP kedalam masing–masing tabung dan catat perubahan warnanya.
3.2.2 Kelarutan Garam Sulfat
Menyiapkan 4 tabung reaksi.Tabung reaksi (1) diisi dengan MgCl2, tabung reaksi (2) diisi dengan CaCl2, tabung reaksi (3) diisi dengan SrCl2 dan tabung reaksi (4) diisi dengan BaCl2, masing-masing 1 mL dengan konsentrasi 0,5 M.
Masing-masing tabung reaksi tersebut ditambahkan 1 mL H2SO4 0,5 M. Perhatikan endapan yang terbentuk.
3.2.3 Kelarutan garam hidroksida
Menyiapkan 4 tabung reaksi. Tabung reaksi (1) diisi dengan MgCl2, tabung reaksi (2) diisi dengan CaCl2, tabung reaksi (3) diisi dengan SrCl2 dan tabung reaksi (4) diisi dengan BaCl2, masing-masing 1 mL dengan konsentrasi 0,5 M. Masing-masing tabung reaksi tersebut ditambahkan 1 mL NaOH 0,5 M. Perhatikan endapan yang terbentuk.
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Pengamatan 4.1.1 Reaktifitas Unsur
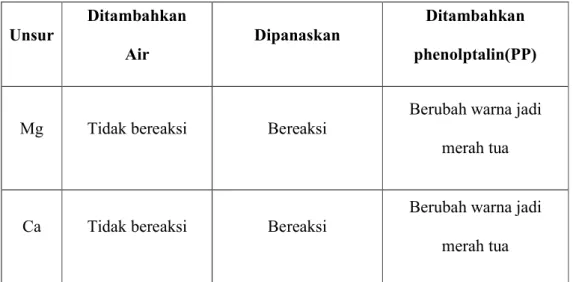
Tabel 1 : Hasil pengamatan reaktifitas unsur
Unsur Ditambahkan Air Dipanaskan Ditambahkan phenolptalin(PP)
Mg Tidak bereaksi Bereaksi
Berubah warna jadi merah tua
Ca Tidak bereaksi Bereaksi
Berubah warna jadi merah tua
Tabel 2 : Hasil pengamatan pengendapan garam sulfat
Larutan Ditambahkan H2SO4 0,5 M Keterangan MgCl2 0,5 M Tidak bereaksi Tidak terbentuk endapan
CaCl2 0,5 M Bereaksi Terbentuk endapan SrCl2 0,5 M Bereaksi Terbentuk endapan BaCl2 0,5 M Bereaksi Terbentuk endapan
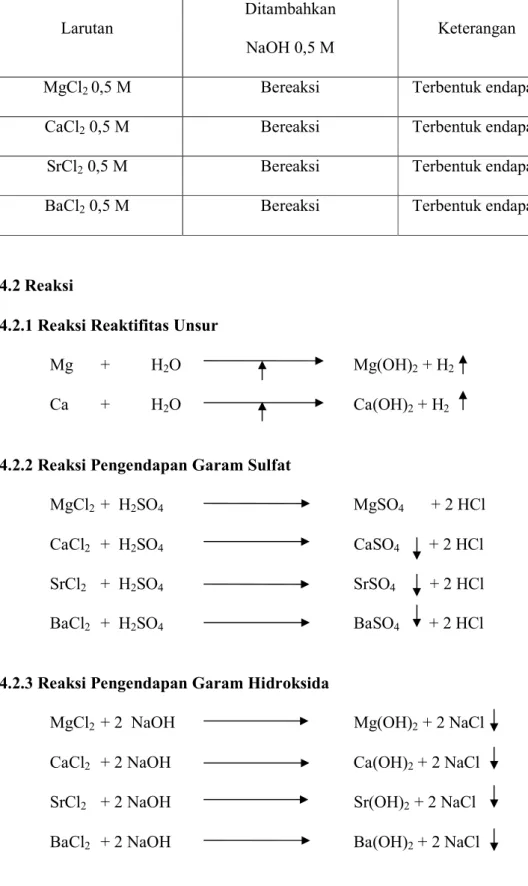
Tabel 3 : Hasil pengamatan pengendapan garam hidroksida
Larutan
Ditambahkan NaOH 0,5 M
Keterangan
MgCl2 0,5 M Bereaksi Terbentuk endapan CaCl2 0,5 M Bereaksi Terbentuk endapan SrCl2 0,5 M Bereaksi Terbentuk endapan BaCl2 0,5 M Bereaksi Terbentuk endapan
4.2 Reaksi
4.2.1 Reaksi Reaktifitas Unsur
Mg + H2O Mg(OH)2 + H2 Ca + H2O Ca(OH)2 + H2
4.2.2 Reaksi Pengendapan Garam Sulfat
MgCl2 + H2SO4 MgSO4 + 2 HCl CaCl2 + H2SO4 CaSO4 + 2 HCl SrCl2 + H2SO4 SrSO4 + 2 HCl BaCl2 + H2SO4 BaSO4 + 2 HCl
4.2.3 Reaksi Pengendapan Garam Hidroksida
MgCl2 + 2 NaOH Mg(OH)2 + 2 NaCl CaCl2 + 2 NaOH Ca(OH)2 + 2 NaCl SrCl2 + 2 NaOH Sr(OH)2 + 2 NaCl BaCl2 + 2 NaOH Ba(OH)2 + 2 NaCl
4.3 Pembahasan
Pada percobaan pertama ini bertujuan untuk mengetahui kereaktifan logam pada logam alkali dan alkali tanah dengan menggunakan logam Mg dan Ca. Pada saat kedua logam ini dimasukkan kedalam tabung reaksi yang masing-masing telah diisi air, logam ini tidak bereaksi. Setelah dipanaskan maka dari kedua tabung reaksi akan terbentuk gelembung yang merupakan gas H2, ini menunjukkan telah terjadi reaksi.Ketika dimasukkan indikator pp ke dalam larutan tersebut, larutan tersebut berwarna merah tua, hal ini menandakan bahwa larutan itu bersifat basa.
Akan tetapi hasil percobaan ini sedikit melenceng dari toeri yang ada, yaitu warna larutan yang terjadi setelah ditambahkan indikator PP yang berubah menjadi merah tua. Warna larutan yang seharusnya terjadi adalah warna merah lembayu. Hal ini terjadi karena indikator PP yang ditambahkan sedikit lebih banyak dari yang seharusnya.
Pada percobaan kedua ini bertujuan untuk mengetahui kelarutan garam sulfat pada golongan IIA, yang pertama dilakukan adalah menambahkan H2SO4 0,1 M pada BaCl2 0,1 M dan CaCl2 0,1 M. Pada BaCl2 yang telah ditambahkan H2SO4, terbentuk larutan yang keruh dan banyak terdapat endapan putih. Sedangkan pada CaCl2 yang telah ditambahkan H2SO4 larutannya sedikit agak keruh dan hanya terdapat sedikit endapan. Terbantuknya endapan manandakan bahwa kelarutan senyawa tersebut adalah lebih kecil. Dengan membandingkan banyaknya endapan yang terbentuk maka dapat diketahui bahwa kelarutan garam sulfat dari golongan IIA adalah cenderung akan berkurang atau menurun dari atas ke bawah.
Pada percobaan ketiga bertujuan untuk mengetahui kelarutan garam hidroksida pada golongan IIA, yang pertama dilakukan adalah menambahkan NaOH 1 M pada BaCl2 0,1 M dan CaCl2 0,1 M. Pada larutan BaCl2 yang telah ditambahkan NaOH, terbentuk larutan yang keruh namun endapan yang terbentuk tidak terlalu banyak. Sedangkan pada larutan CaCl2 yang ditambah NaOH larutan menjadi keruh dan terdapat lebih banyak endapan. Sehingga dari percobaan ini dapat diketahui bahwa kelarutan garam hidroksida pada golongan IIA adalah kelarutannya cenderung akan bertambah/meningkat dari atas ke bawah.
BAB V PENUTUP
5.1 Kesimpulan
Dari percobaan ini dapat disimpulkan bahwa unsur-unsur golongan alkali sedikit lebih reaktif jika dibandingkan dengan logam alkali tanah, selanjutnya sifat kelarutan garam sulfat dari golongan IIA adalah cenderung akan berkurang atau menurun dari atas ke bawah sementara sifat kelarutan garam hidroksidanya cenderung akan bertambah/meningkat dari atas ke bawah.
5.2 Saran
Sebaiknya dalam percobaan ini digunakan lebih banyak lagi unsur-unsur golongan IA maupun unsur-unsur golongan IIA agar tampak jelas perbedaan antara sifat-sifat unsur dari kedua golongan tersebut.
DAFTAR PUSTAKA
Wardhani,S.,2014, GolonganIIA,(httpskyoshiro67.files.wordpress.com201004gol- iia.pdf, diakses pada tanggal 26 Oktober 2014 pukul 19:58 WITA).
Anshory,I.,1986, Penuntun Pembelajaran Kimia, Bandung: Ganeca Exact Bandung.
Chang, R., 2003, Kimia Dasar Konsep Kimia Inti,Jakarta: Erlangga.
Saputra, A. D., Makalah Alkali dan Alkali tanah, 2014, (http://agusdiansaputr4.blogspot.com/2012/12/pembahasan-makalah-unsur-alkali-tanah_26.html, diakses pada tanggal 27 Oktober 2014 pukul 19:09 WITA).
LEMBAR PENGESAHAN
Makassar, 17 November 2014 Asisten, Praktikan,
NUR HASNI BAHRUN
LAMPIRAN I BAGAN KERJA
a. Reaktifitas Unsur
Logam Mg
Dimasukkan kedalam tabung reaksi yang telah diisi air 2 mL.
Diamati dan diperhatikan reaksi yang terjadi. Dipanaskan apabila tidak terjadi reaksi hingga
reaksi erjadi (munculnya gelembung menandakan reaksi telah terjadi).
Diteteskan indikator PP.
Diamati perubahan warna yang terjadi. Dilakukan hal yang sama pada logam Ca.
b. Kelarutan garam sulfat
1 mL MgCl2 0,5 M
Dimasukkan kedalam tabung reaksi Ditambahkan 1 mL H2SO4 0,5 M
Diamati endapan yang terbentuk pada tabung reaksi. Dilakukan hal yang sama pada CaCl2 , SrCl2, dan
BaCl2 Hasil
c. Kelarutan Garam Hidroksida
1 mL MgCl2 0,5 M
Dimasukkan kedalam tabung reaksi Ditambahkan 1 mL NaOH0,5 M
Diamati endapan yang terbentuk pada tabung reaksi. Dilakukan hal yang sama pada CaCl2 , SrCl2, dan
BaCl2