BAB 2 DAN REAKSI REDOKS
Teks penuh
Gambar

Garis besar
Dokumen terkait
Menurut George Simon Ohm menyatakan “Besarnya beda potensial listrik ujung-ujung penghantar yang berhambatan tetap sebanding dengan kuat arus listrik yang mengalir melalui
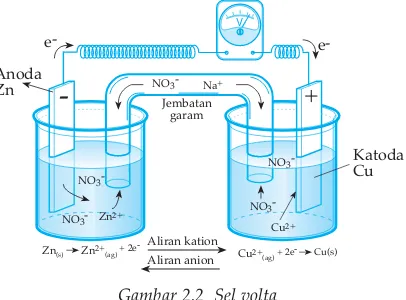
Reaksi sel adalah jumlah aljabar dari reaksi-reaksi yang terjadi pada elektrode-elektrode.. Setengah reaksi dari reaksi selnya sebagai berikut. Jika yang digunakan
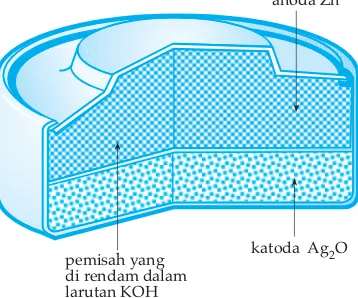
Pada logam seng terjadi pelepasan elektron (oksidasi) sehingga logam seng disebut sebagai anoda yang juga merupakan elektroda negatif, sedangkan pada logam tembaga terjadi reduksi Cu
→ Potensia l elektroda dikaitkan dengan reaksi reduksi sehingga elektroda yang lebih mudah mengalami reduksi dibandingkan terhadap hidrogen, potensial elektrodanya bertanda negatif
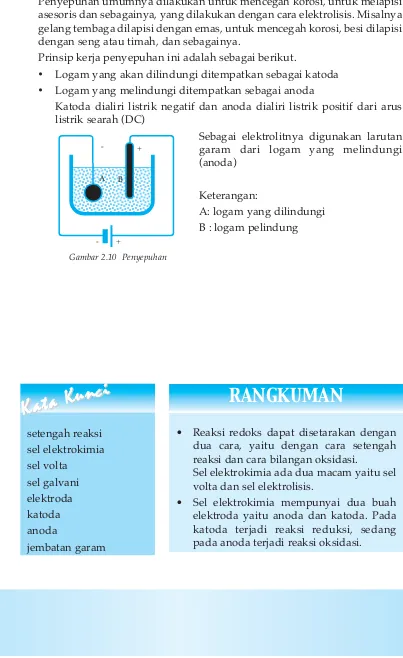
Suatu material elektrokimia dapat berfungsi baik sebagai elektroda anoda maupun katoda bergantung pada pemilihan material yang akan menentukan karakteristik perbedaan nilai
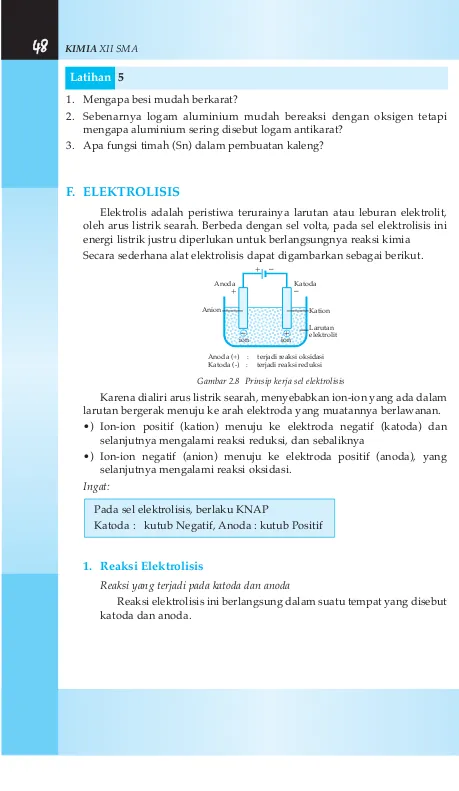
Anoda adalah elektroda negatif pada sel yang dihubungkan dengan reaksi.. kimia oksidasi yang melepaskan elektron sampai pada
Baterai terdiri dari beberapa sel elektrokimia dan setiap sel terutama mengandung elektroda negatif (anoda), elektroda positif (katoda), dan elektrolit (Mahmoud dan Xu, 2011). Di
Sel tersebut terdiri dari elektroda katoda dan anoda dan membran penukar ion kation dan anion, dimana air limbah akan masuk pada ruang anoda agar dapat dioksidasi oleh