BAB 2
TINJAUAN PUSTAKA
2.1 Baterai
Baterai merupakan unit mandiri yang menyimpan energi kimia, dan mengubah
langsung ke dalam energi listrik untuk daya berbagai aplikasi. Baterai
diklasifikasikan ke dalam tiga kelompok umum: baterai primer adalah baterai
yang hanya dipakai sekali dan dibuang; Baterai sekunder adalah baterai isi ulang
yang dapat di pakai dan dapat dikembalikan kekeadaan semula dengan
membalikkan aliran arus melalui sel, skematik dari aplikasi penggunaan baterai isi
ulang diilustrasikan pada (Gambar 2.1); Baterai khusus adalah baterai yang
di-design untuk tujuan tertentu. Terutama pada militer dan medis yang tidak menemukan penggunaan baterai komersial yang luas dengan alasan biaya,
masalah lingkungan, dan aplikasi pasar yang terbatas. Mereka umumnya tidak
memerlukan waktu start-up. Pada saluran air yang rendah, sampai dengan 95%
pada energi sangat mudah untuk dipakai bekerja (Martin and Ralph, 2004).
Saat ini, teknologi baterai canggih menjadi teknologi posisi terbaik dengan
upaya mengurangi dampak lingkungan yang berkelanjutan dan energi terbarukan
di berbagai aplikasi dari perangkat portabel elektronik (misalnya, ponsel,
komputer laptop) untuk kendaraan listrik dan penyimpanan listrik dalam skala
besar di grid pintar atau cerdas (Cheng.F, 2011).
▸ Baca selengkapnya: elektroda yang terdapat pada sel aki
(2)Berikut beberapa keuntungan dan kerugian dari penggunaan baterai, yaitu:
a. Keuntungan
1. Beroperasi pada rentang suhu yang luas.
2. Pilihan sistem kimia dan tegangan.
3. Operasi pada beberapa orientasi tidak membutuhkan pompa,
penyaring.
4. Ukuran variabel dan ukuran sel sama diseluruh dunia.
5. Dapat mengirim arus pulsa tinggi.
6. Dapat memilih baterai terbaik untuk spesifik tertentu (portable, ponsel,
dan aplikasi stasioner).
b. Kerugian
1. Kandungan energi rendah dibandingkan dengan bensin dan bahan
bakar yang lain.
2. Mahal dibandingkan dengan batu bara dan bensin.
Berikut definisi yang sering digunakan pada setiap rangkaian pelajaran mengenai
baterai, fuel cell, dan kapasitor elektrokimia.
Baterai khusus adalah baterai primer yang diproduksi terbatas untuk
penggunaan tertentu.
Anoda adalah elektroda negatif pada sel yang dihubungkan dengan reaksi
kimia oksidasi yang melepaskan elektron sampai pada circuit eksternal.
Katoda adalah elektroda positif pada sel yang dihubungkan dengan reaksi
kimia reduksi dimana gain elektron berasal dari circuit eksternal.
Elektrolit adalah sebuah material yang memberikan konduktifitas ionic
murni antara elektroda positif dan elektroda negatif pada sebuah sel.
Separator adalah penghalang antara elektroda positif dan elektroda negatif
tergabung ke dalam bentuk sel untuk mencegah korslet listrik. Separator dapat
berupa gel elektrolit atau film plastic mikro atau bahan inert berpori lainnya yang
diisi denga elektrolit. Separator harus dapat ditembus terhadap ion dan inert dalam
lingkungan baterai.
Charge adalah suatu operasi dimana sebuah baterai dikembalikan ke kondisi semula dibebankan oleh pembalikan aliran arus.
Resistansi dalam atau impedansi adalah resistansi atau impedansi dimana
baterai atau sel memberikan aliran arus.
Konstanta Faraday, F, adalah jumlah muatan transfer ketika reaksi massa aktif
setara 96.485,3 C/g-equiv, 26.8015 Ah/g-equiv (Martin and Ralph, 2004).
2.1.1 Cara Kerja Baterai
Banyak reaksi kimia yang melibatkan transfer elektron sehingga mengalami
perubahan dalam keadaan oksidasi; disebut reaksi redoks (Ronci.F, 2002).
Elektroda negatif adalah reduktor yang baik (transfer elektron) seperti lithium,
zinc, atau timah. Elektroda positif adalah penerima electron seperti lithium cobalt
oxide, mangan dioksida, atau timah oksida. Elektrolit adalah penghantar ion murni yang secara fisik memisahkan anoda dari katoda (Martin and Ralph, 2004). Dalam
reaksi redoks, satu spesies teroksidasi dengan memberikan elektron sehingga
oksidasi naik dan spesies yang lain berkurang dengan menerima elektron maka
dengan demikian akan mengurangi tingkat oksidasinya (Ronci.F, 2002). Setiap
reaksi redoks memiliki tegangan tertentu. Ada nilai praktis mutlak untuk potensi
ini, sehingga sistem pengukuran relative digunakan sebagai gantinya. Dalam
refrensi ini, potensi kesetimbangan dari reaksi antara proton dan gas hydrogen
diatur ke nol:
2H++ 2 e-H2 (g)
Secara umum, baterai dapat tersusun satu atau lebih sel elektrokimia yang
dihubungkan secara seri atau parallel untuk memberikan tegangan dan kapasitas
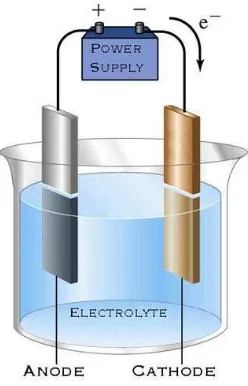
yang dibutuhkan (Tarascon.J, 2001). Setiap sel terdiri dari tiga komponen utama:
elektroda positif (katoda), elektroda negatif (anoda) dan elektrolit, seperti yang
Gambar 2.2 Skematik dari prinsip umum baterai
Elektrolit dapat berair atau tidak berair, dalam bentuk cair, pasta atau bentuk padat
(Linden.D, 2002; Song.J.Y, 1999). Elektrolit cair lebih disukai karena memiliki
konduktifitas ionic yang tinggi, tetapi cairan elektronik memiliki kekurangan
stabilitas mekanik untuk mencegah kontak antara elektroda (Winter.M, 2004).
Dalam praktek, listrik berpori bahan isolasi yang mengandung elektrolit sering
ditempatkan di antara anoda dan katoda untuk mencegah anoda dari kontak
langsung dengan katoda. Jika anoda dan katoda bersentuhan fisik, baterai akan
korsleting dan energi penuh pada baterai terlepas sebagai panas baterai (Martin
and Ralph, 2004).
2.2. Baterai Ion Lithium
Sejak komersialisasi baterai ion lithium yang dapat diisi ulang di awal
tahun 1990-an, bahan kimia berbasis lithium telah berkembang pesat di pasar
baterai global. Hal ini dikarenakan lithium memiliki banyak sifat kimia dan fisika.
Pertama, lithium adalah unsur yang paling elektronegatif pada standar tekanan
dan suhu (STP) memiliki potensial reduksi dengan potensial elektroda negatif
sebesar -3.05 V. Hal ini memungkinkan pembuatan baterai dengan tegangan
mencapai 6 V, meskipun 3-3.5 V adalah rentang tegangan yang paling umum
yang praktis. Untuk baterai skunder, sel isi ulang dikembangkan pada tahun
1970an. Penyisipan sel elektrokimia Li ke dalam sulfide berkontribusi pada
pengembangan baterai sekunder (Rouxel, 1971). Dibandingkan dengan baterai
sekunder lainnya, baterai isi ulang ion lithium menunjukkan kinerja elektrokimia
yang sangat baik, yang mengarah pada posisi dominan dalam industri baterai. Hal
ini juga menjelaskan mengapa baterai ion lithium mendapatkan perhatian yang
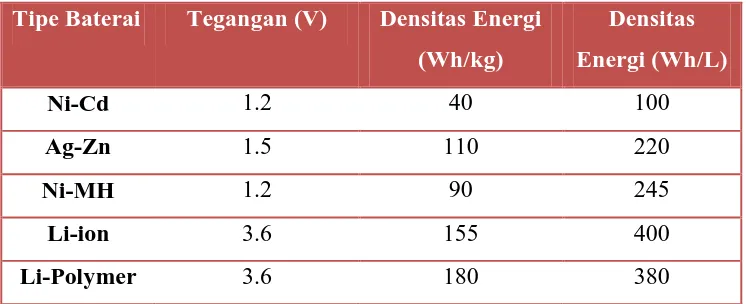
besar pada kedua fundamental dan tingkat penerapannya. Karakteristik
perbandingan kinera baterai sekunder ditunjukkan pada Tabel 2.1 (Patil.A;Patil.V,
2008).
Tabel 2.1 Karakteristik perbandingan kinerja baterai sekunder
Tipe Baterai Tegangan (V) Densitas Energi
(Wh/kg)
Secara umum, terdapat lima komponen yang termasuk dalam sel ion
lithum. Komponen tersebut adalah dua elektroda, elektrolit, dan dua arus kolektor.
Fungsi utama elektroda adalah mengurangi rentang potensial yang teroksidasi
lebih yang diukur dalam volt (V). elektrolit berfungsi sebagai konduktor ionik
antara elektroda dan isolasi ionik. Arus kolektor adalah bahan listrik, biasanya
logam yang langsung bersentuhan dengan masing-masing elektroda. Arus
kolektor ini akan melekat satu sama lain dengan sirkuit eksternal (Tarascon.J,
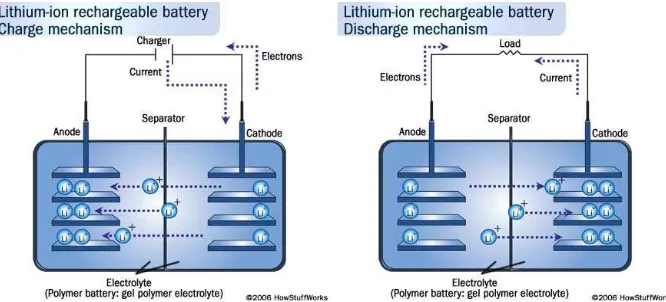
2001 ; Winter.M, 2004). Prinsip kerja umum pengisian / proses pemakaian baterai
ion lithium yang dapat diisi ulang diilustrasikan pada Gambar 2.3 (Wakihara.M,
Gambar 2.3 Prinsip kerja umum pengisian / proses pemakaian baterai ion lithium
yang dapat diisi ulang (Wakihara.M, 2001 ; Dunn.B, 2011).
2.3 Bagian-bagian Baterai
Terdapat beberapa bagian-bagian dari baterai yaitu:
2.3.1 Elektroda Positif (Katoda)
Katoda disusun dari campuran bahan elektroda (90%), aditif konduktif (6%),
bahan pengikat (4%), dan dilukis pada arus kolektor. Li-TMs dengan
konduktivitas elektron yang rendah umumnya digunakan sebagai bahan elektroda,
penurunan konduktivitas elektroda. Maka, beberapa karbon konduktif seperti
grafit, Acethylene Black (AB), Ketjen Black (KB) kembali ditambahkan untuk
meningkatkan sifat konduktif dari elektroda. Polimer fluorocarbon seperti
Polytetra Fluoroethylene (PTFE), Polyvinylidene-difluoride (PVdF), dan
Polyvinyl-fluoride (PVF) biasanya digunakan sebagai pengikat untuk
menghubungkan setiap partikel dari bahan elektroda. Foil biasanya digunakan
sebagai arus kolektor, karena harus bertahan dengan kondisi oksidasi yang tinggi
(~4V vs Li+/Li).
2.3.2 Elektroda negatif (Anoda)
Anoda tersusun oleh karbon (seperti grafit dan karbon berat) sebagai bahan dasar
2.3.3 Elektrolit
Elektrolit memiliki lebar potensial yang tidak bereaksi di bawah potensial reduksi
yang rendah seperti Li. Maka dari itu, elektrolit biasanya menggunakan solusi
organic. Garam Li dilarutkan pada larutan karbonat dengan metode non-air.
Karbonat ester dari konstanta dielektrik yang tinggi seperti elthylene carbonate
(EC, m.p.36.40C) atau prophylene carbonate (PC,m.p.-54.50C) yang dipakai
sebagai larutan. Meskipun sifat-sifat unggul pada daerah suhu yang besar, larutan
PC tidak dapat menerima elektroda grafit untuk reaksi pengelupasan (Dey 1970 ;
Inaba 1997). Garam Li seperti Lithium hexafluorophosphate (Li PF6) atau
Lithium pherclorate (LiClO4) biasanya digunakan sebagai zat terlarut pada
elektrolit. Garam Li ini tidak stabil dalam air dan mudah terurai, serta
menghasilkan jenis asam seperti HF atau HCL. Karena jenis asam ini membuat
bahan elektroda dan arus kolektor berkarat, maka jumlah air pada sel baterai harus
di bawah level ppm.
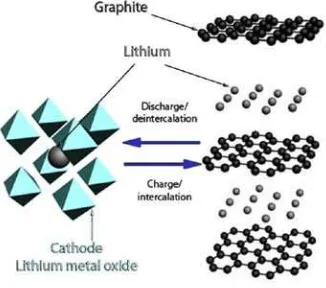
2.3.4 Anoda konvensional (Graphite)
Salah satu elektroda negatif yang paling umum digunakan dalam baterai saat ini
adalah grafit. Grafit sebagai anoda pada baterai ditunjukkan pada (Gambar 2.4).
Karbon atom dalam grafit yang disusun dalam lapisan halus yang diterapkan
bersama oleh ikatan van der Waals . atom lithium dapat bergerak di antara lapisan
dan disimpan pada pusat cincin karbon, sehingga memungkinkan satu lithium
disimpan pada setiap enam karbon; yaitu, membentuk LiC6. Bahan interkalasi
umumnya tidak mengalami pembentukan dendrite, tetapi energi dan spesifik daya
diabaikan pada solusi ini. Baterai ion lithium yang umum memiliki grafit sebagai
anoda, yang bekerja pada -2.5 V vs elektroda hydrogen standar, dan bahan
interkalasi yang lain umumnya, logam transisi oksida sebagai katoda bekerja di
Gambar 2.4 Skematik material elektroda pada baterai ion Li, menggunakan
katoda litium metal oxide dan anoda grafit
2.4 Li4Ti5O12 (LTO)
Standar sintesis solid-state secara umum membutuhkan suhu 8000 C atau suhu
yang lebih tinggi untuk mendapatkan produk yang murni. Suhu yang tinggi akan
menyebabkan pertumbuhan partikel dan dengan demikian akan menurunkan
tingkat kemampuan bahan aktif (Kataoka, 2008; Julien and Zaghib, 2004).
Potensial elektrokimia yang relatif lebih tinggi dengan kapasitas teoritis
lebih rendah (1,55 V vs Li+/Li dengan 175 mAh g-1) dibanding dengan grafit
(0,1-0,3 V vs Li+/Li dengan 372 mAh g-1), densitas energi dari sel ion Li dengan
Li4Ti5O12 berdasarkan elektrodanya menurun dibandingkan pemakaian sel grafit.
Di sisi lain, elektroda Li4Ti5O12 memiliki banyak keuntungan. Beberapa
keuntungan Li4Ti5O12 adalah :
1. Stabilitas siklus hidup yang panjang
Regangan nol menyebabkan stabilitas mekanik material elektroda.
2. Penggunaan kepadatan arus besar
Potensial elektrokimia yang relatif tinggi menyebabkan tidak adanya
deposisi logam Li atau pembentukan dendrit pada permukaan elektroda di
kolektor Al, dan dapat membantu untuk merancang biaya rendah, kinerja
tinggi dan keselamatan aplikasi sel dengan daya tinggi.
Dengan keuntungan ini elektroda baru yang didasarkan Li4Ti5O12 adalah yang
paling menjanjikan pada skala besar dan aplikasi daya tinggi untuk baterai ion
litium.
2.5 Li4Ti5O12 (LTO) doping Al
Li4Ti5O12 memiliki nilai konduktifitas ionik yang rendah sehingga membatasi
tingkat kemampuan elektronik (Rho.Y.H, 2003 ; Amatucci 2001 ; Huang.S, 2006).
Untuk meningkatkan nilai konduktifitas tersebut, beberapa cara yang efektif telah
diusulkan, termasuk sintesis Li4Ti5O12 (Guerfi.A, 2003 ; Nakahara.K, 2003)
dengan doping ion logam aliovalent (V5+, Mn4+, Fe3+, Al3+, Ga3+, Co3+,Cr3+, Ni2+,
Mg2+ dan F-) pada Li, Ti atau situs O (Kubiak.P, 2003 ; Huang.S, 2007). Dengan
penambahan Al3+ terbentuklah Li4Ti5−xAlxO12 yang dapat meningkatkan
kapasitas reversibel dan stabilitas pada saat pengisian dan pemakaian doping pada
Li4Ti5O12 dengan tegangan berkisar 0,5 - 2,5 V (Huang,S. 2005).
Doping Al dan Li4Ti5O12 yang tidak didoping (Al4 – xAlxTi5O12, x=0, 0,05,
0,1 dan 0,2) tersusun oleh reaksi padatan konvensional. LiOH - H2O dan TiO2,
digunakan sebagai bahan baku (Hailei Zhao, 2008). Pada penelitian stuktur dan
karakterisasi elektrokimia pada L14-xAlxTi5O12 sebagai material anoda baterai ion
lithium oleh Hailei Zhao, dkk (2008) menunjukkan bahwa Li4Ti5O12 doping Al
dengan rumus kimia L14-xAlxTi5O12 (x=0, 0,05, 0,1 dan 0,2) disintesis dengan
metode reaksi padatan. Doping Al tidak merubah komposisi fasa dan morfologi
partikel, tapi mudah menghasilkan distorsi kisi sehingga kristalinitas buruk pada
Li4Ti5O12. Kelebihan Al menyebabkan polarisasi elektroda yang besar karena
konduktivitas ion Li yang lebih rendah, sehingga menyebabkan kapasitas yang
rendah pada densitas arus tinggi.
J. Y. Lin dkk (2013) mensintesis lithium titanate doping Al dengan rumus
kimia Li4-xTi5-xAlxO12 (x=0,05) melalui proses sol-gel. Hasil sintesa menunjukkan
bahwa ada peningkatan kapasitas discharge dan laju kapabilitas yang signifikan.
Peningkatan laju kapabilitas disebabkan difusivitas ion Li lebih tinggi dan
4TI5-xAlxO12 melalui
reaksi padatan , dan menyelidiki sifat-sifat elektrokimia dengan metode konduksi
elektronik, voltametri siklik, dan tes charge-discharge pada rentang tegangan
discharge yang berbeda (0-2,5 V dan 1-2,5 V). Hasil penelitian menunjukkan bahwa doping Al3+ tidak mempengaruhi struktur spinel tapi sangat meningkatkan
kapasitas dan kinerja awal. Doping Al3+ berguna bagi interkalasi reversible dan
deinterkalasi dari Li+.
Jung Soo Park dkk (2013) mensintesis Li4Ti5O12 sebagai material anoda
baterai ion litium, dengan metoda reaksi padatan (Li(4-x/3)AlxTi(5-2x/3)O12),
menyatakan bahwa suhu kalsinasi optimum untuk Li4Ti5O12 doping Al ditentukan
menjadi 8500 C diantara tiga suhu yaitu, 7500 C, 8500 C, dan 9500 C, berdasarkan
struktur dan karakterisasi elektrokimia. Siklus pengujian awal pada Li4Ti5O12
tanpa doping dan doping Al3+ menyatakan bahwa performa elektreokimia pada
elektroda yang disiapkan pada suhu 8500 C lebih baik dari pada suhu 7500 C dan
9500 C. Rasio penyimpanan kapasitas pada Li(4-x/3)AlxTi(5-2x/3)O12 (x = 0.01, 0.05,
0.1) lebih dari 99,3% setelah 30 siklus.
Material elektroda praktis biasanya dioptimalkan dengan unsur doping.
Pada penelitian yang dilakukan oleh De Li dkk (2015) yaitu efek memori induksi
doping pada Li4Ti5O12 doping Al menunjukkan bahwa Li4Ti5O12 terbebas dari
efek memori, sementara efek memori yang berbeda dapat diinduksi oleh doping
Al. Setelah dilakukan discharge pada potensial cutoff rendah, Li4Ti5O12 doping Al
menunjukkan kinetika elektrokimia yang buruk, memberikan kelebihan potensial
yang besar pada saat proses charging. Ketergantungan atas kelebihan potensial