A. PENYETARAAN REAKSI REDOKS
B.
REAKSI REDOKS DALAM SEL ELEKTROKIMIA
C.
POTENSIAL ELEKTRODA POTENSIAL SEL DAN SEL VOLTA
DALAM KEHIDUPAN
D. REAKSI REDOKS DITINJAU DARI HARGA POTENSIAL SEL
E.
KOROSI
F.
ELEKTROLISIS
G. MENENTUKAN MASSA ZAT YANG MENGENDAP DI
ELEK-TRODA
H. PERANAN ELEKTROLISIS DALAM KEHIDUPAN
SEHARI-HARI
REAKSI REDOKS DAN ELEKTROKIMIA
2
Hubungan antara konsep yang satu dengan yang lain dapat Anda perhatikan pada peta konsep berikut.
Peta konsep reaksi redoks
A. PENYETARAAN REAKSI REDOKS
KIMIAXII SMA
29
1. Penyetaraan Reaksi Redoks Dengan Metode Setengah Reaksi
(Metoda Ion Elektron)
a. Reaksi redoks dalam larutan asam Contoh:
Setarakan reaksi berikut: MnO4-+ C
2O42-→CO2+ Mn2+ Langah-langkahnya sebagai berikut.
1) Tuliskan semua bilangan oksidasi atom-atom unsur yang terlibat reaksi
MnO4
-(aq)+ C2O42-(aq)→CO2(g)+ Mn2+(aq)
+7 –2 +3 –2 +4 –2 +2
2) Tuliskan setengah reaksi oksidasi dan setengah reaksi reduksi secara terpisah
oksidasi : C2O4
2-(aq)→CO2(g) →(atom C teroksidasi) reduksi : MnO4
-(aq)→Mn2+(aq) →(atom Mn tereduksi)
3) Setarakan jumlah atom yang teroksidasi dan tereduksi (atom C dan Mn) oksidasi : C2O4
2-(aq)→2CO2(g) reduksi : MnO4
-(aq)→Mn2+(aq)
4) Setarakan jumlah atom oksigen, dengan cara menambahkan molekul H2O pada ruas yang kekurangan atom oksigen.
oksidasi : C2O4
2-(aq)→2CO2(g)→(atom O ruas kanan dan kiri sudah sama maka tidak perlu ditambah H2O)
reduksi : MnO4
-(aq)→Mn2+(aq)+ 4H2O(l)
5) Setarakan jumlah hidrogen dengan menambahkan H+ pada ruas yang kekurangan atom H.
oksidasi : C2O4
2-(aq)→2CO2(g) reduksi : MnO4
-(aq)+ 8H+(aq)→Mn2+(aq) + 4H2O(l)
6) Setarakan jumlah muatan ruas kiri dan kanan dengan menambah-kan elektron di ruas yang jumlah muatannya lebih besar
oksidasi : C2O4
2-(aq)→CO2(g)+ 2e → ruas kanan = 0, ruas kiri = -2 maka ruas kanan ditambah 2e reduksi : 5e + MnO4
Pada setengah reaksi oksidasi harus dikalikan 5 dan pada setengah reaksi reduksi harus dikalikan 2 agar elektron yang dilepas sama dengan elektron yang diterima
Reaksi tersebut menjadi oksidasi : 5C2O4
2-(aq)→10CO2(g)+ 10e reduksi : 10e + 2MnO4
-(aq)+ 16H+(aq)→2Mn2+(aq) + 8H2O(l)
7) Jumlahkan setengah reaksi oksidasi dengan setengah reaksi reduksi oksidasi : 5C2O4
2-(aq) →10CO2(g)+ 10e
reduksi : 2MnO4
-(aq)+ 16H+(aq)+ 10e →2Mn2+(aq) + 8H2O(l)
+ 5C2O4
2-(aq)+2MnO4-(aq)+16H+(aq)→10CO2(g)+2Mn2+(aq)+8H2O(l) Apabila reaksinya dalam bentuk molekul, maka persamaan reaksi kita kembalikan ke bentuk reaksi molekuler (seperti soalnya), dengan cara menambahkan sejumlah ion-ion yang belum ada dalam persamaan reaksi ion.
Contoh:
KMnO4(aq+H2C2O4(aq)+H2SO4(aq)→MnSO4(aq)+K2SO4(aq)+CO2(g)+ H2O(l) 2MnO4
-(aq + 5C2O42-(aq) + 16H+(aq) → 10CO2(g) + Mn2+(aq) + 8H2O(l)
2K+ +3SO
42- 2K+ 3SO42- +
2KMnO4
-(aq + 5H2C2O4(aq) + 3H2SO4(aq) → 10CO2(g)+ 2MnSO4(aq) + K2SO4(aq) + 8H2O(l)
b. Reaksi redoks dalam larutan basa atau netral Contoh:
Setarakan reaksi berikut: HPO3
2-(aq)+ OBr-→Br-(aq)+ PO43-(aq) Langah-langkahnya sebagai berikut.
1) Tuliskan semua bilangan oksidasi atom-atom unsur yang terlibat reaksi
HPO3
2-(aq)+ OBr-(aq)→Br-(g)+ PO43-(aq)
+1 +3 –2 -2 +1 –1 +5 –2
2) Tuliskan setengah reaksi oksidasi dan setengah reaksi reduksi secara terpisah
oksidasi : HPO3
2-(aq)→PO43-(aq) reduksi : OBr
KIMIAXII SMA
31
3) Setarakan jumlah atom yang teroksidasi dan tereduksi pada setengah reaksi tersebut. (Jumlah atom yang teroksidasi dan tereduksi sudah sama)
4) Tambahkan OH- pada ruas yang kekurangan atom oksigen. (agar jumlah atom O setara)
oksidasi : HPO3
2-(aq)+ OH-(aq)→PO43-(aq) reduksi : OBr
-(aq)→Br-(aq)+ OH-(aq)
5) Tambahkan H2O pada ruas yang kekurangan hidrogen. (agar jumlah atom H setara)
oksidasi : HPO3
2-(aq)+ 3OH-(aq)→PO43-(aq)+ 2H2O(l) reduksi : OBr
-(aq)+ H2O(l)→Br-(aq)+ 2OH-(aq)
6) Setarakan jumlah muatan ruas kiri dan ruas kanan dengan cara menambahkan elektron di ruas yang jumlah muatannya lebih besar. oksidasi : HPO3
2-(aq)+ 3OH-(aq)→PO43-(aq)+ 2H2O(l)+ 2e reduksi : OBr
-(aq)+ H2O(l)+ 2e →Br-(aq)+ 2OH-(aq)
Karena jumlah elektron yang dilepaskan sudah sama dengan yang diterima maka tidak perlu dikalikan silang.
7) Jumlahkan setengah reaksi oksidasi dengan setengah reaksi reduksi oksidasi : HPO3
2-(aq)+ 3OH-(aq)→PO43-(aq)+ 2H2O(l)+ 2e reduksi : OBr
-(aq)+ H2O(l)+ 2e →Br-(aq)+ 2OH-(aq) + HPO3
2-(aq)+OH-(aq)+OBr-(aq)→PO43-(aq)+H2O(l)+Br-(aq)
2. Penyetaraan Reaksi Redoks Dengan Cara Bilangan Oksidasi
Contoh
Setarakan reaksi berikut.
K2Cr2O7(aq)+H2C2O4(aq)+H2SO4(aq)→K2SO4(aq)+Cr2(SO4)3(aq)+CO2(g)+ H2O(l)
Langah-langkahnya sebagai berikut:
a. Carilah unsur yang mengalami perubahan bilangan oksidasi.
K2Cr2O7(aq) + H2C2O4(aq) + H2SO4(aq) → K2SO4(aq) + Cr2(SO4)3(aq) + CO2(g) + H2O(l)
+1 +6 -2 +1 +3 -2 +1 +6 -2 +1 +6 -2 +3 +6 -2 +4 -2 +1 -2
oksidasi
b. Setarakan jumlah unsur yang mengalami perubahan bilangan oksidasi tersebut
c. Tentukan jumlah perubahan bilangan oksidasi tersebut. Jika jumlah unsur lebih dari satu, kalikan perubahan bilangan oksidasi itu dengan jumlah unsur
d. Setarakan jumlah perubahan bilangan oksidasinya
Angka pengalinya digunakan untuk mengalikan koefisien zat (3 untuk mengalikan koefisien zat yang ada unsur C-nya, 1 untuk mengalikan koefisien zat yang ada unsur Cr-nya)
K2Cr2O7(aq) + 3H2C2O4(aq) + H2SO4(aq) → K2SO4(aq) + Cr2(SO4)3(aq)+ 6CO2(g)+ H2O(l)
e. Setarakan atom unsur lainnya dengan urutan selain H dan O, hidrogen dan oksigen. Jumlah K di ruas kiri = jumlah di ruas kanan. Jumlah atom S pada ruas kiri = 1, pada ruas kanan = 4; maka pada ruas kiri diberi koefisien 4.
K2Cr2O7(aq) + 3H2C2O4(aq) + 4H2SO4(aq) → K2SO4(aq) + Cr2(SO4)3(aq)+ 6CO2(g)+ H2O(l)
Jumlah atom H pada ruas kiri = 14, pada ruas kanan = 2; maka H2O pada ruas kanan diberi koefisien 7. Jumlah atom O di ruas kiri sudah sama dengan ruas kanan.
K2Cr2O7(aq)+ 2H2C2O4(aq)+ 4H2SO4(aq)→K2SO4(aq)+ Cr2(SO4)3(aq)+ 6CO2(g)+ 7H2O(l)
K2Cr2O7 + H2C2O4 + H2SO4 → K2SO4 + Cr2(SO4)3 + 2CO2 + H2O
6 x 1 2 x 3
K2Cr2O7(aq) + H2C2O4(aq) + H2SO4(aq) → K2SO4(aq) + Cr2(SO4)3(aq) + 2CO2(g) + H2O(l)
+6 +3 +3 +4
3 x 2 = 6
1 x 2 = 2
K2Cr2O7(aq) + H2C2O4(aq) + H2SO4(aq) → K2SO4(aq) + Cr2(SO4)3(aq) + 2CO2(g) + H2O(l) oksidasi
KIMIAXII SMA
33
Latihan
1
1. Setarakan reaksi redoks berikut dengan cara setengah reaksi: a. SO2+ Cr2O72-→HSO
4-+ Cr3+ (suasana asam) b. Al + NO3-→NH
4++ AlO2- (suasana basa) c. Fe2++ MnO
4-+ C2O42-→Fe3++ Mn2++ CO2 d. Cl-+ SO
42-→S2O32-+ Cl2
2. Setarakan reaksi redoks berikut dengan cara bilangan oksidasi a. HNO3+ H2S →NO + S + 4H2O
b. Al + OH-→Al(OH) 4-+ H2 c. CrO2-+ H
2O2→CrO42-+ H2O d. Cu + NO3-→Cu2++ NO
2
B. REAKSI REDOKS DALAM SEL ELEKTROKIMIA
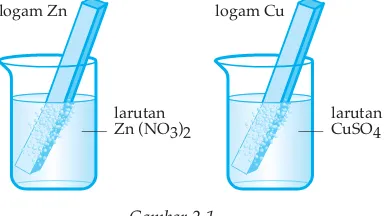
Sel elektrokimia ada 2 macam, yakni sel volta dan sel elektrolisis. Sel elektrokimia merupakan suatu sistem yang terdiri atas dua elektroda, dan larutan atau leburan elektrolit sebagai penghantar elektron. Pada sel volta maupun sel elektrolisis, reaksi redoks berlangsung dalam suatu elektroda. Contoh:
Gambar 2.1
Elektroda dibedakan menjadi 2, yaitu anoda dan katoda
•) Katoda adalah elektroda tempat berlangsungnya reaksi reduksi (Ka-red)
•) Anoda adalah elektroda tempat berlangsungnya reaksi oksidasi (Anoks)
Salah satu perbedaan sel volta dengan sel elektrolisis adalah: - pada sel volta, reaksi redoks menghasilkan energi listrik
- dan sebaliknya pada sel elektrolisis, energi listrik diperlukan untuk berlangsungnya suatu reaksi redoks
logam Zn
larutan Zn (NO3)2
logam Cu
1. Sel Volta (Sel Galvani)
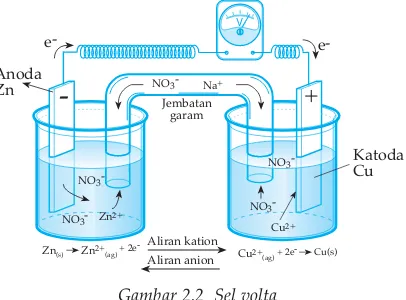
Bila dua buah elektroda yang berbeda jenisnya (misal elektroda Zn dan elektroda Cu) dihubungkan dengan kawat yang dilengkapi voltmeter, juga dihubungkan dengan jembatan garam, maka logam Zn akan teroksidasi menjadi Zn2+
Zn(s)→Zn2+
(aq)+ 2e
Elektron yang dihasilkan oleh Zn mengalir melalui voltmeter menuju ke arah elektroda Cu. Selanjutnya elektron tersebut ditangkap oleh ion Cu2+ dalam larutan Cu(NO3)2.
Cu2+
(aq)+ 2e →Cu(s)
Cu yang dihasilkan mengendap pada batang logam Cu, sehingga batang logam Cu makin tebal (massanya bertambah).
Gambar 2.2 Sel volta
Logam Zn megalami oksdasi, maka elektroda ini disebut ANODA, dan menjadi kutub negatif (karena menghasilan elektron). Ion Cu2+mengalami reduksi menjadi Cu dan menempel pada katoda sebagai kutub positif.
Ingat:
Perpindahan elektron dari anoda ke katoda menyebabkan larutan di anoda kelebihan muatan positif karena bertambahnya ion Zn2+. Larutan di katoda kelebihan muatan negatif karena berkurangnya ion Cu2+. Untuk menetralisis muatan listrik, dipasang jembatan garam, yaitu larutan NaNO3 atau KCl dalam agar-agar yang dimasukkan dalam pipa U. Adanya jembatan garam menyebabkan terjadinya aliran elektron.
Contoh sel volta di atas, notasinya dapat ditulis Zn|Zn2+||Cu2+|Cu
oksidasi reduksi
Besarnya energi listrik yang dihasilkan dari reaksi redoks ini dapat dilihat pada alat voltmeter.
KIMIAXII SMA
35
Contoh:
1. Tuliskanlah notasi sel volta dari reaksi: Co + Ag+→Co2++ Ag
Jawab:
Co|Co2+||Ag+|Ag
2. Diketahui notasi sel sebagai berikut. Fe(s)|Fe2+
(aq)||Ni2+(aq)|Ni(s)
a. Tuliskanlah persamaan reaksi selnya!
b. Tentukanlah logam yang bertindak sebagai katoda dan sebagai anoda!
Jawab:
a. Reduksi : Ni2+
(aq)+ 2e →Ni(s)
Oksidasi : Fe(s) →Fe2+
(aq)+ 2e + Reaksi sel : Ni2+
(aq)+ Fe(s) →Ni(s)+ Fe2+(aq)
b. Katodanya: batang logam Ni (menjadi tempat berlangsung reaksi reduksi)
Anodanya: batang logam Fe (karena menjadi tempat berlangsung reaksi oksidasi)
Latihan
2
1. Tuliskanlah notasi sel volta dari reaksi berikut ini! a. F2+ 2Br-→2F-+ Br
2
b. Ag++ Fe →Ag + Fe3+ c. Mn + Pb2+→Pb + Mn2+
d. Hg2Cl2+ H2+ 2OH-→2Hg + 2Cl-+ 2H 2O
2. Tuliskanlah persamaan reaksi reduksi, oksidasi dan reaksi selnya dari notasi sel berikut ini.
C. POTENSIAL ELEKTRODA, POTENSIAL SEL DAN SEL
VOLTA DALAM KEHIDUPAN
1. Potensial Elektroda
Besarnya energi listrik yang dihasilkan pada sel volta, dapat kita lihat pada angka yang ditunjukkan oleh jarum voltmeter. Timbulnya energi listrik disebabkan karena kedua elektrolit mempunyai harga "POTENSIAL ELEKTRODA" yang berbeda. Apakah yang dimaksud potensial elektroda? Pada sel volta dengan elektroda Zn dan elektroda Cu (gambar 2.2), ion Cu2+menangkap elektron sehingga berubah menjadi logamnya.
Cu2++ 2e →Cu
Penangkapan elektron oleh ion Cu2+ ini disertai dengan timbulnya sejumlah energi yang disebut potensial reduksi atau potensial elektroda (diberi lambang E). Jadi potensial elektroda adalah potensial listrik yang ditimbulkan bila suatu ion logam menangkap elektron (mengalami reduksi). Besarnya harga E tidak dapat diukur secara terpisah (hanya reaksi reduksi saja), melainkan harus selalu berpasangan dengan reaksi oksidasi. Menurut perjanjian elektroda yang digunakan sebagai standar (untuk mengukur Eo) adalah elektroda hidrogen. Elektroda standar ini sebagai elektrolitnya digunakan larutan yang mengandung konsentrasi ion H+ 1 M, yang pengukurannya dilakukan suhu 25oC, tekanan 1 atmosfer. Ditetapkan pula besarnya E untuk elektroda standar ini = 0 (nol).
Dalam pengukuran harga E dilakukan dengan cara membandingkan dengan elektroda standar, maka untuk selanjutnya E ini disebut sebagai Eo (potensial elektroda standar).
TABEL 2.1 POTENSIAL REDUKSI STANDAR PADA SUHU 25o C
DAN KONSENTRASI ION H+ 1 M
Eo(volt) Setengah Reaksi Reduksi Oksidator Reduktor
2,87 F2(g)+ 2e- →
← 2F-(aq) Kuat Lemah
2,00 S2O82+
(aq)+ 2e- ←→ 2SO42-(aq) 1,78 H2O2(aq)+ 2H++ 2e-→
← 2H2O(l) 1,69 PbO2(s)+ SO4
2-(aq)+ 4H+(aq)+ 2e- →←PbSO4(aq) + 2H2O(l)
1,49 8H+
(aq)+ MnO4-(aq)+ 5e-→←Mn2+(aq)+4H2O(l) 1,47 2ClO3
-(aq)+ 12H+(aq)+ 10e- →←Cl2(g)+6H2O(l) 1,36 Cl2(g)+ 2e- →
← 2Cl
-1,33 Cr2O7
KIMIAXII SMA
3 7
Makin besar harga Eosuatu zat, makin mudah zat tersebut mengalami reaksi reduksi.
Eo(volt) Setengah Reaksi Reduksi Oksidator Reduktor
2. Potensial Sel Standar(E
o sel)
Potensial sel standar (Eo
sel) ialah besarnya beda potensial atau besarnya potensial yang dihasilkan dari dua buah elektroda (katoda dan anoda) yang dihubungkan oleh suatu penghantar. Karena pada katoda berlangsung reaksi reduksi, sedangkan pada anoda berlangsung reaksi oksidasi, maka besarnya Eo
seldapat dirumuskan sebagai berikut.
Catatan
1. Besarnya Eo
oksidasi= besarnya Eoreduksi, hanya saja tandanya berlawanan Contoh: K++ e →K Eo= -2,92 volt (reduksi), maka
K →K++ e Eo= +2,92 volt(oksidasi)
2. Dalam sel volta, elektroda yang mengalami reduksi mempunyai harga Eolebih besar.
Contoh
Diketahui harga potensial reduksi standar sebagai berikut. Cu2+
(aq)+ 2e ←→Cu(s) Eo= 0,34 volt Ag+
(aq)+ 1e →←Ag(s) Eo= 0,80 volt Tentukan harga potensial sel Cu(s)|Cu2+
(aq)||Ag+(aq)|Ag(s)! Jawab:
Oksidasi : Cu(s)→Cu2+
(aq)+ 2e Eooks= -0,34 volt
Reduksi : Ag+
(aq)+ 1e →Ag(s) | x 2 Eored= 0,80 volt + Reaksi sel : 2Ag+
(aq)+ Cu(s)→2Ag(s)+ Cu2+(aq) Eo= 0,46 volt Eo merupakan sifat intensif, yang besarnya tidak dipengaruhi oleh banyaknya zat, sehingga harga Eotidak boleh dikalikan.
Eo
sel= Potensial reduksi standar + potensial oksidasi standar Eo
KIMIAXII SMA
39
3. Sel volta dalam kehidupan
Sel volta banyak digunakan dalam kehidupan sehari-hari antara lain baterai dan aki. Saat ini ada beberapa jenis baterai. Samakah baterai untuk mainan dengan baterai untuk telpon genggam?
Ada baterai yang dapat diisi ulang dan ada yang tidak. Sel volta yang tidak dapat diisi ulang disebut sel primer, sedangkan yang dapat diisi ulang disebut sel sekunder.
a. Sel Primer
1) Baterai kering (Sel Leclanche)
Baterai kering sering disebut sel Leclanche karena ditemukan oleh Leclanche pada tahun 1866. Sel ini menggunakan batang karbon sebagai katoda dan pelat seng sebagai anoda. Elektrolitnya digunakan pasta, yang merupakan campuran batu kawi (MnO2), amonium klorida (NH4Cl), karbon (C), dan sedikit air. Reaksi yang terjadi adalah:
Anoda : Zn(s) →Zn2+
(aq)+ 2e Katoda : 2MnO2(s)+ 2NH4+
(aq)+2e →Mn2O3(s)+ 2NH3(aq)+ H2O(l) + Reaksi sel : Zn(s) + 2MnO2(s) + 2NH4+
(aq)→Mn2O3(s)+ Zn2+(aq) + 2NH3(aq) + H2O(l) Zn2+yang terbentuk mengikat NH
3membentuk senyawa kompleks Zn(NH3)42+
Beda potensial satu sel kering adalah 1,5 volt. Notasi selnya ditulis:
Zn(s)|Zn2+
(aq)||NH4+(aq)|NH3(g) Eo= 1,5 volt
Gambar 2.3 Potongan membujur baterai kering (sel Leclanche) Baterai ini digunakan untuk radio, mainan, senter, dan lain-lain
+
-Anoda Zn
Katoda (C-grafit)
2) Baterai Alkali
Akhir-akhir ini baterai alkali banyak digunakan orang. Karena baterai alkali mempunyai kekuatan arus listrik yang lebih besar bila dibanding baterai biasa (sel Leclanche). Elektroda batu baterai alkali sama seperti pada batu baterai biasa, tetapi elektrolit yang digunakan adalah larutan KOH.
Anoda : Zn(s)+ 2OH
-(aq) →Zn(OH)2(s)+ 2e
Katoda : MnO2(s)+ 2H2O(l)+ 2e →Mn(OH)2(s)+ 2OH-(aq) + Reaksi sel : Zn(s)+ MnO2(s)+ 2H2O(l) →Mn(OH)2(s)+ Zn(OH)2(s) Baterai ini juga menghasilkan potensial 1,5 volt dan dapat bertahan secara konstan selama pemakaian.
Biasanya baterai ini digunakan untuk mainan dan tape recorder. 3) Baterai perak oksida
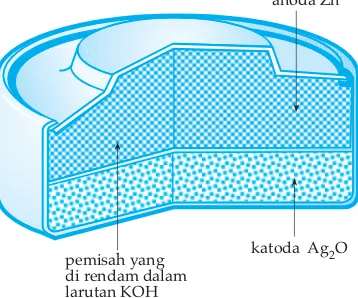
Baterai perak oksida terdiri dari anoda Zn dan katoda Ag2O dengan elektrolit KOH.
Reaksi yang terjadi sebagai berikut. Anoda : Zn(s)+ 2OH
-(aq) →Zn(OH)2(s)+ 2e Katoda : Ag2O(s)+ H2O(l)+ 2e →2Ag(s)+ 2OH-(aq) + Reaksi sel : Zn(s)+ Ag2O(s)+ H2O(l) →Zn(OH)2(s)+ 2Ag(s)
Beda potesial dari bateri ini adalah 1,5 volt dan selama pemakaian dapat bertahan secara konstan. Baterai ini digunakan untuk mainan, jam tangan, kalkulator, dan lain-lain.
Gambar 2.4 Sel perak oksida
pemisah yang di rendam dalam larutan KOH
anoda Zn
KIMIAXII SMA
41
b. Sel Sekunder 1) Aki
Aki tergolong jenis sel volta sekunder, karena jika zat yang ada di dalam aki habis, dapat diisi kembali dengan cara dialiri listrik (dicas). Sel aki terdiri atas Pb (timbal) sebagai anoda dan PbO2 (timbal oksida) sebagai katoda. Anoda dan katoda ini berupa lempeng, yang dicelupkan di dalam larutan asam sulfat.
Gambar 2.5 Aki terdiri atas sel-sel yang dihubungkan seri
Aki tidak memerlukan jembatan garam karena hasil reaksinya tidak larut dalam larutan elektrolit (asam sulfat). Kedua elektroda disekat dengan bahan fiberglass, agar tidak saling bersentuhan. Setiap selnya mempunyai potensial 2 volt. Jadi aki 6 volt terdiri atas 3 sel, aki 12 volt terdiri atas 6 sel dan sebagainya. Masing-masing sel dihubungkan secara seri. Pada saat aki digunakan (dikosongkan) berlangsung reaksi sebagai berikut.
Anoda : Pb(s)+ SO4
2-(aq) →PbSO4(s)+ 2e
Katoda : PbO2(s)+ 4H+
(aq)+ SO42++ 2e →PbSO4(s)+ 2H2O(l) + Reaksi sel : Pb(s)+ PbO2(s)+ 4H+
(aq) →2PbSO4(s)+ 2H2O(l) Dalam sel aki terjadi aliran elektron dari Pb (anoda) ke PbO2(katoda)
Selama penggunaan aki, kadar H2SO4makin lama makin berku-rang, begitu juga dengan massa jenisnya. Aki yang baru diisi massa jenis larutan H2SO4nya 1,25 – 1,30 g/cm. Jika massa jenis larutannya turun sampai 1,20 gram/cm3, maka aki harus diisi atau dicas kembali. Pada reaksi penggunaan aki, baik anoda (Pb) maupun katoda (PbO2) berubah menjadi zat yang sama, yaitu PbSO4(berupa kristal putih). Jika permukaan kedua elektroda sudah tertutup endapan PbSO4 maka dapat menyebabkan kedua elektroda tidak mempunyai beda potensial, sehingga aki tersebut harus dicas kembali.
Reaksi pengisian aki adalah sebagai berikut.
Anoda : PbSO4(s)+ 2H2O(l)→PbO2(s)+ 4H++ SO42-(aq)+ 2e Katoda : PbSO4(s)+ 2e →Pb(s)+ SO4
2-(aq) +
Reaksi sel : 2PbSO4(s)+ 2H2O(l)→Pb(s) + PbO2(s)+ 4H+(aq)+ 2SO42-(aq) (pengisian aki dilakukan dengan cara membalik arah aliran elektron pada kedua elektroda tersebut)
Elektroda Pb (Anoda)
2) Baterai Ni – Cd
Sel terdiri dari anoda Cd dan katoda NiO2 dengan elektrolit KOH.
Reaksi yang terjadi adalah: Anoda : Cd(s)+ 2OH
-(l) →Cd(OH)2(s)+ 2e
Katoda : NiO2(s)+ 2H2O(l)+ 2e →Ni(OH)2(s) + 2OH-(aq) + Reaksi sel : Cd(s)+ NiO2(s)+ 2H2O(l)→Cd(OH)2(s) + Ni(OH)2(s)
Beda potensial sel ini adalah 1,4 V dan selama pemakaian dapat bertahan secara konstan. Selama reaksi tidak terjadi perubahan konsentrasi ion karena pereaksi dan zat hasil berupa zat padat. Penggunaan baterai Ni–Cd untuk kalkulator, kamera digital, laptop, dan lain-lain.
Gambar 2.6 Sel nikel -kadmium
3) Baterai Litium
Penggunaan baterai litium sekarang ini sangat luas, antara lain untuk telepon seluler, laptop, kamera digital dan alat-alat elektronik lain. Baterai litium sangat ringan dan memiliki potensial sekitar 3,6 volt serta mempunyai umur panjang.
KIMIAXII SMA
4 3
Latihan
3
1. Berdasarkan tabel potensial reduksi standar di halmanan 40 - 41. Hitunglah harga potensial sel dari:
a. Pb2++ Cr → Cr3++ Pb b. 2I-+ Ag+ →I
2+ Ag
2. Bila diketahui harga potensial elektroda: Cu2++ 2e-→ Cu Eo= 0,34 volt Pb2++ 2e-→ Pb Eo= -0,12 volt
a. Apakah logam Cu dapat larut dalam larutan Pb(NO3)2? b. Apakah logam Pb dapat larut dalam larutan CuSO4? 3. Sel volta tersusun dari elektroda Ni danAl, jika diketahui:
Ni2++ 2e-→ Ni Eo= 0,25 volt Al3++ 3e-→ Al Eo= -1,66 volt a. Tulislah reaksi di anoda dan di katoda! b. Tentukanlah harga potensial selnya! 4. Tuliskanlah persamaan reaksi sel dari baterai:
a. seng - karbon c. perak - oksida
b. Alkalin d. Ni – Cd
D. REAKSI REDOKS DITINJAU DARI HARGA POTENSIAL SEL
Reaksi redoks yang berlangsung secara spontan dapat menghasilkan sejumlah energi listrik. Bagaimanakah cara mengetahui bahwa reaksi redoks itu berlangsung spontan atau tidak?
Ternyata dengan memanfaatkan harga Eo
selkita dapat meramalkan reaksi redoks dapat berlangsung secara spontan atau tidak.
•) Apabila harga Eo
sel= positif, maka reaksinya berlangsung (spontan) •) Apabila harga Eo
Contoh
1. Berlangsungkah reaksi: Zn + Cu2+→Zn2++ Cu
Jika diketahui: EoCu = +0,34 volt EoZn = -0,76 volt Jawab:
Pada reaksi di atas, Zn mengalami oksidasi dan Cu2+ mengalami reduksi.
Eo
sel = Eored+ Eooks
= 0,34 volt + 0,76 volt = 1,10 volt
Karena Eo
selharganya positif, maka reaksi tersebut berlangsung.
2. Diketahui harga potensial reduksi standar beberapa elektrolit sebagai berikut.
Zn2++ 2e →Zn Eo= -0,76 volt Pb2++ 2e →Pb Eo= -0,13 volt Ba2++ 2e →Ba Eo= -2,9 volt Mn2++ 2e →Mn Eo= -1,03 volt
Berdasarkan harga Eo tersebut, apakah reaksi berikut ini dapat berlangsung?
a. Pb + Zn2+→ Pb2++ Zn b. Ba + Pb2+→ Ba2++ Pb Jawab:
a. Eo
sel= Eored– Eooks
= -0,76 volt + 0,13 volt
= -0,63 volt (reaksi tidak dapat berlangsung) b. Eo
sel= Eored+ Eooks = -0,13 + (2,9)
KIMIAXII SMA
45
Apabila harga Eo atom-atom logam diurutkan dari Eo yang terkecil sampai Eo yang terbesar, maka akan kita peroleh suatu deret kereaktifan logam yang disebut DERET VOLTA. Di antara anggota deret volta tersebut adalah:
Li–K–Ba–Ca–Na–Mg–Al–Mn–Zn–Fe–Ni–Sn–Pb–H–Sb–Bi–Cu–Hg–Ag–Pt–Au
E=0
- Dari kiri ke kanan, harga Eo makin besar (makin mudah mengalami reduksi)
- Dari kiri ke kanan kereaktifan logam makin berkurang, sehingga logam yang letaknya di sebelah kiri pada deret volta, dalam reaksi kimia dapat mendesak logam di sebelah kanannya.
Contoh:
Mg(s)+ FeCl3(aq)→MgCl2(aq)+ Fe(s)
Fe(s)+ MgCl2(aq)→ (Tidak berekasi, karena Fe kurang reaktif dibanding Mg)
Latihan
4
1. Diketahui potensial reduksi empat jenis logam sebagai berikut. Sr2++ 2e-→ Sr Eo= -2,89 volt
Ga3++ 3e-→ Ga Eo= -0,55 volt Bi3++ 3e-→ Bi Eo= +0,25 volt Li++ e-→ Li Eo= -3,05 volt
a. Susunlah keempat logam tersebut dalam deret volta! b. Logam apakah yang bersifat reduktor terkuat? c. Logam manakah yang dapat bereaksi dengan air d. Adakah logam yang tidak bereaksi dengan asam? e. Apakah reaksi berikut berlangsung?
- Ga3++ Li → - Sr2++ Bi →
2. Diketahui logam-logam: Fe, Ca, Ni dan Cu berdasarkan tabel Eonya, maka: a. Susunlah deret voltanya!
E. KOROSI
Korosi adalah reaksi redoks yang terjadi pada logam, sehingga membentuk senyawa logam tersebut. Peristiwa korosi ini dipengaruhi oleh lingkungan, seperti udara, uap air, dan beberapa gas yang bersifat korosif. Faktor-faktor lain yang dapat mempercepat perkaratan adalah pH larutan, adanya suatu garam, atau kontak dengan logam lain yang mempunyai Eo lebih besar.
Korosi sering kita kenal adalah perkaratan besi yang disebabkan adanya oksigen dan air. Proses perkaratan besi menyerupai suatu sel elektrokimia. Permukaan besi berlaku sebagai anoda, sehingga mengalami oksidasi. Elektron yang dihasilkan dialirkan kebagian lain yang bertindak sebagai katoda.
Percobaan 2.1 : Korosi Besi
Sediakan 5 buah tabung reaksi, masing-masing isilah dengan sebuah paku yang diamplas bersih dan letakkan pada rak tabung reaksi.
• masukkan 5 mL aquades ke dalam tabung dan biarkan terbuka
• masukkan 2 gram kristal CaCl2dan kapas kering ke dalam tabung 2, kemu-dian tutup rapat dengan sumbat karet
• masukkan 5 mL cuka dapur ke dalam tabung 3 dan biarkan terbuka
• masukkan 5 mL larutan garam dapur 1 M ke dalam tabung dan biarkan ter buka
• masukkan 5 mL minya tanah ke dalam tabung reaksi 5
Semua tabung tersebut simpan selama 2 hari dan catatlah perubahan yang terjadi. Pernyataan:
1. Faktor apa sajakah yang mempengaruhi perkaratan besi?
2. Jelaskan terbentuk atau tidak terbentuknya karat pada setiap tabung!
Anoda : Fe(s)→Fe2+ (q)+ 2e Katoda : O2(g)+ 4H+
(aq)+ 4e →2H2O(l)
KIMIAXII SMA
4 7
Adapun reaksinya sebagai berikut.
Adanya korosi pada besi mengakibatkan kerugian materi yang sangat besar. Pada korosi logam oleh gas, terbentuk berbagai senyawa seperti oksida, sulfida, karbonat, basa, dan lain-lain. Jika korosi ini terjadi dalam air, maka senyawa logam yang terbentuk akan terlarut dalam air, sampai akhirnya logam terkikis habis.
Pencegahan Korosi
1. Cara pelapisan
Pencegahan korosi dapat dilakukan dengan cara menutup besi dengan lapisan Zn. Lapisan Zn bertindak sebagai anoda, sedang Fe sebagai katoda. Di sini akan terjadi aliran elektron dari Zn ke Fe, sehingga yang mengalami korosi adalah logam Zn sedangkan Fe tidak terkorosi. Akibatnya lapisan Zn akan habis dalam waktu tertentu. Adapun reaksi yang terjadi adalah sebagai berikut.
Anoda : Zn + 2OH-→Zn(OH) 2+ 2e Katoda : 2H++ 2e →H
2 →(Pembentukan H2dari uap air di udara) Selain dengan Zn, besi dapat juga dilapisi dengan Sn (timah). Pelapisan besi dengan timah banyak digunakan dalam pembuatan kaleng makanan. Lapisan timah ini akan melindungi besi, selama lapisan timahnya utuh. Jika lapisan robek atau rusak, lapisan timah akan mempercepat korosi.
2. Cara proteksi katodik
Pencegahan korosi pada pipa dalam tanah, dapat dilakukan dengan cara menanam logam yang lebih reaktif (misalnya Mg), didekat pipa, yang kemudian dihubungkan dengan kawat. Batang magnesium akan mengalami oksidasi, dan pipanya terlindung dari korosi. Magnesium makin lama makin terkikis, dan secara periodik harus diganti yang baru.
3. Cara pengecatan
Cara lain mencegah korosi pada besi adalah dengan mengecat permukaan besi, atau mengoles dengan minyak atau oli, tergantung penggunaan besi.
Contoh: - pagar dicat
- pisau diolesi minyak
4. Cara menghubungkan dengan katoda arus listrik. Menghubungkan logam yang dilindungi dengan kutub negatif pada sumber arus sehingga logam terhindar dari oksidasi.
4Fe2 aq O2g 4H O2 xH O2 2Fe O xH O2 3 2 s 8H karat
aq
+ +
+ + + → +
Latihan
5
1. Mengapa besi mudah berkarat?
2. Sebenarnya logam aluminium mudah bereaksi dengan oksigen tetapi mengapa aluminium sering disebut logam antikarat?
3. Apa fungsi timah (Sn) dalam pembuatan kaleng?
F. ELEKTROLISIS
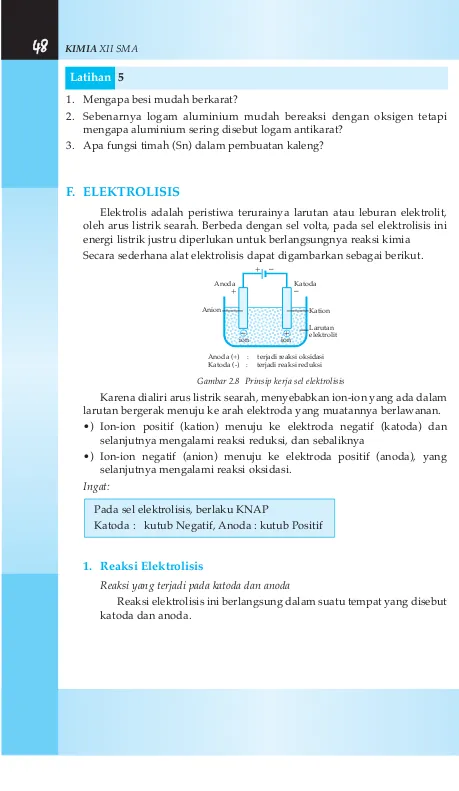
Elektrolis adalah peristiwa terurainya larutan atau leburan elektrolit, oleh arus listrik searah. Berbeda dengan sel volta, pada sel elektrolisis ini energi listrik justru diperlukan untuk berlangsungnya reaksi kimia
Secara sederhana alat elektrolisis dapat digambarkan sebagai berikut.
Gambar 2.8 Prinsip kerja sel elektrolisis
Karena dialiri arus listrik searah, menyebabkan ion-ion yang ada dalam larutan bergerak menuju ke arah elektroda yang muatannya berlawanan. •) Ion-ion positif (kation) menuju ke elektroda negatif (katoda) dan
selanjutnya mengalami reaksi reduksi, dan sebaliknya
•) Ion-ion negatif (anion) menuju ke elektroda positif (anoda), yang selanjutnya mengalami reaksi oksidasi.
Ingat:
1. Reaksi Elektrolisis
Reaksi yang terjadi pada katoda dan anoda
Reaksi elektrolisis ini berlangsung dalam suatu tempat yang disebut katoda dan anoda.
Pada sel elektrolisis, berlaku KNAP
Katoda : kutub Negatif, Anoda : kutub Positif
_ +
ion ion
_ +
Anion Kation
Larutan elektrolit
Anoda Katoda
_ +
KIMIAXII SMA
49
Tabel 2.2 Reaksi pada katoda dan anoda dengan elektroda Pt atau C
Elektroda Pt atau C ini disebut elektroda inert, yaitu elektroda yang tidak ikut bereaksi. Elektroda ini hanya menyediakan permukaannya sebagai tempat berlangsungnya reaksi. Bila elektroda yang digunakan selain Pt atau C, maka elektroda yang menjadi anoda akan teroksidasi, sehingga berubah menjadi ionnya. Akibatnya anoda ini terkikis, makin lama makin berkurang jumlahnya.
2. Contoh Reaksi Elektrolisis
a. Elektrolisis larutan NaCl dengan elektroda C NaCl(aq)→Na+
(aq)+ Cl-(aq)
Na+menuju katoda, Cl-menuju anoda. Reaksi
(Reduksi terhadap ion positif/kation)
A. Jika dalam larutan terdapat: 1. ion-ion logam golongan alkali,
alkali tanah, Al3+, dan Mn2+,
maka ion-ion ini tidak dire-duksi yang diredire-duksi adalah pelarutnya (air)
2. ion-ion selain tersebut no.1 di atas, maka ion logam ini akan direduksi menjadi logamnya Contoh: Cu2+
(aq)+ 2e →Cu(s)
3. ion H+yang berasal dari asam
maka ion ini akan direduksi menjadi gas hidrogen (H2)
2H+
(aq)+ 2e →H2(g)
B. Jika yang dielektrolisis adalah leburan (cairan) elektrolit tanpa ada air, maka semua ion logam direduksi menjadi logamnya.
(oksidasi terhadap ion negatif/anion)
A. Jika dalam larutan terdapat: 1. ion-ion yang mengandung
atom dengan bilangan oksi-dasi maksimum (misal: SO42-,
NO3-, PO
43-) maka ion ini
tidak dapat dioksidasi yang dioksidasi adalah pelarutnya (air)
2. ion-ion halida (x-), yaitu F-, Cl
-, Br-, dan I-, maka ion-ion ini
akan dioksidasi menjadi halo-gennya (x2)
Contoh: 2Cl
-(aq)→Cl2+ 2e
3. ion OH- yang berasal dari
basa, maka ion ini akan diok-sidasi menjadi gas oksigen (O2)
4OH-→O
2+ 2H2O + 4e
2H2O(l)→O2(g)+ 4H++ 4e
Reaksi sel menunjukkan bahwa ion Cl- makin berkurang membentuk Cl2, ion OH-bertambah, dan ion Na+jumlahnya tetap. Bila semua air telah terelektrolisis, maka zat yang tersisa dalam sel adalah NaOH.
b. Elektrolisis larutan CuSO4dengan elektroda Cu CuSO4(aq)→Cu2+
(aq)+ SO42-(aq) Cu2+menuju katoda SO
42-menuju anoda.
Elektroda Cu adalah elektroda aktif, sehingga Cu akan teroksidasi. Reaksi
Logam Cu pada anoda terlarut dan mengendap pada katoda. Anoda makin lama makin habis, sedangkan katoda makin tebal. Prinsip ini banyak digunakan pada pemurnian logam Cu. Perhatikan bagan elektrolisis CuSO4berikut ini!
Gambar 2.9 Elektrolisis larutan CuSO4dengan elektroda Cu
Contoh
1. Apakah yang terjadi pada katoda dan anoda dalam elektrolisis larutan berikut? Reaksi elektrolisis: 4H++ 2H
2O → 2H2+ 4H++ O2 2H2O → 2H2+ O2
_ +
Cu kotor Cu murni
_
Cu kotor Cu murni
_ +
e-
e-Cu2+
SO42
KIMIAXII SMA
51
yang terjadi adalah elektrolisis pelarut (air) di katoda terbentuk gas H2dan pada anoda terbentuk gas O2.
b. Ionisasi : KOH →K2++ OH
-Anoda : 2H2O(l)+ 2e → H2(g)+ 2OH(aq) x 2 Katoda : 4OH → O2+ 2H2O + 4e
2H2O + →2H2(g)+ O2(g)
2. Apakah yang terjadi pada katoda dan anoda dalam elektrolisis leburan NaCl dengan elektroda Pt?
Jawab:
Leburan NaCl = NaCl cair, jadi tanpa pelarut air Ionisasi : NaCl(l) →Na+(l)+ Cl-(l)
Katoda : Na+
(l)+ 2e → Na(s) | x 2
Anoda : 2Cl
-(l) → Cl2+ 2e | x 1 + 2NaCl(l) → 2Na(s)+ Cl2(g)
(K) (A)
Percobaan 2.2 : Elektrolisis Larutan KI
Masukkan larutan KI 0,2 M dalam pipa U sampai permukaan larutan ±2 cm di bawah mulut tabung. Pasanglah elektroda karbon hingga tercelup dalam larutan. Tambahkan 3 tetes fenolftalein dan 3 tetes amilium pada larutan dalam pipa U, kemudian hubungkan elektroda dengan sumber arus searah (batu baterai). Amati perubahan yang terjadi dan catatalah. Lakukan hal yang sama terhadap larutan di ruang anoda.
Latihan
6
1. Tulislah reaksi elektrolisis larutan di bawah ini! a. Kalsium iodida dengan elektroda inert. b. Perak nitrat dengan elektroda inert.
c. Tembaga (II) hidroksida dengan elektroda inert. d. Besi (III) klorida dengan elektroda inert.
G. MENENTUKAN MASSA ZAT YANG MENGENDAP
DI ELEKTRODA
Banyaknya zat yang mengendap pada elektroda dapat dihitung dengan hukum Faraday. Faradayadalah orang Inggris yang pertama menerangkan hubungan kuantitatif antara banyaknya arus listrik yang digunakan pada elektrolisis dengan hasil elektrolisisnya.
Perhatikan reaksi berikut ini! Ag+
(aq) + e →Ag(s) Cu2+
(aq)+ 2e →Cu(s)
Pada reaksi di atas untuk mereduksi satu mol ion Ag+dibutuhkan satu mol elektron yang dapat mereduksi 0,5 mol ion Cu2+.
Muatan 1 elektron = 1,6021 x 10-19 coulomb
1 mol elektron = (6,023 x 1023) x 1,6021 x 10-19coulomb = 96.478 coulomb ≈ 96.500 coulomb. Jadi, 1 Faraday = 96.500 coulomb.
Muatan listrik sebesar 1 Faraday dapat mengendapkan 1 gram ekuivalen. Massa zat hasil elektrolisis yang terbentuk pada katoda maupun anoda dirumuskan sebagai berikut.
Keterangan
m = massa zat hasil elektrolisis (gram)
e = = massa ekuivalen zat hasil elektrolisis
n = mol elektron yang terlibat dalam reaksi F = jumlah muatan listrik (Faraday)
Jika 1 coulomb = 1 ampere . detik, maka massa zat hasil elektrolisis dapat dirumuskan sebagai berikut.
Keterangan
i = arus yang mengalir (ampere) t = lama elektrolisis (detik) m= e . i . t
96.500 Ar
n
m = eF Hukum Faraday
KIMIAXII SMA
53
Berdasarkan hukum II Faraday massa zat yang dihasilkan dapat dirumus-kan sebagai berikut.
Contoh
1. Arus listrik sebesar 0,2 ampere mengalir selama 2 jam melalui larutan Co(NO3)2. Berapakah massa logam kobalt yang diendapkan?
(Ar Co = 59) Jawab:
2. Jika arus listrik dialirkan melalui AgNO3 dan larutan CuSO4 yang disusun seri, maka dihasilkan endapan perak 2,16 gram (Ar Ag = 108) (Ar Cu = 63,5). Berapa gramkah endapan tembaga yang dihasilkan? Jawab:
Latihan
7
1. Hitunglah berat endapan tembaga (Cu = 63,5) yang terbentuk di katoda, jika larutan CuSO4dielektrolisis dengan arus listrik 1950 Coulomb?
2. Berapa gramkah perak (Ag = 108) yang terbentuk di katoda, jika arus listrik 20 ampere dialirkan melalui larutan AgNO3selama 90 menit?
3. Sejumlah arus listrik mengendapkan 18 gram perak dari larutan AgNO3 dan mengendapkan 2 gram logam M dari larutan M(SO4)2, jika Ar Ag = 108 maka hitunglah Ar dan M!
: m : e
H. PERANAN ELEKTROLISIS DALAM KEHIDUPAN
SEHARI-HARI
Unsur-unsur di alam sedikti sekali yang ditemukan dalam keadaan bebas, melainkan sebagai senyawa. Unsur-unsur bebas diperoleh dengan cara elektrolisis. Dalam kehidupan sehari-hari elektrolisis banyak digunakan pada industri logam.
1. Pembuatan Aluminium
Bijih aluminium di alam terdapat sebagai bijih bauksit (Al2O3), yang memiliki titik lebur sangat tinggi (±2000oC). Dalam mereduksi bijih ini tentu memerlukan energi yang sangat besar, dan tentu juga membutuhkan biaya yang tidak sedikit.
Pada tahun 1886 Charles Hall mulai meneliti proses pembuatan aluminium dengan cara elektrolisis. Bagaimanakah untuk menurunkan titik lebur bijih bauksit tersebut agar bisa dielektrolisis? Ia mencoba mencampurkan bijih bauksit dengan kriolit cair (Na3AlF6), ternyata hasilnya mengejutkan. Bijih bauksit bisa melebur pada suhu ±900oC. Dalam penemuan ini, akhirnya aluminium dapat diproduksi secara besar-besaran dengan cara elektrolisis. Reaksi yang terjadi sebagai berikut. Mula-mula bijih bauksit Al2O3dilarutkan dalam kriolit cair, terionisasi menjadi ion aluminium dan ion oksida.
Al2O3→2Al3++ 3O
2-Kemudian larutan Al2O3 dalam kriolit cair di elektrolisis dengan menggunakan elektroda grafit (elektroda inert) sebagai berikut.
Reaksi di katoda : 2Al3++ 6e →2Al (l)
Reaksi di anoda : 3O
2-(l)→3⁄2O2(g)+ 6e Reaksi sel elektrolisisnya : 2Al3+
(l)+ 3O2-(l)→3⁄2O2(g)+ 2Al(l)
Aluminium yang dihasilkan pada suhu 900oC – 1000oC ini wujudnya cair, sehingga bisa langsung dimasukkan ke dalam cetakan untuk didinginkan. Pabrik menghasilkan aluminium dalam bentuk cetakan
2. Proses Permurnian Tembaga
KIMIAXII SMA
55
setengah reaksi sel elektrokimia sel volta
sel galvani elektroda katoda anoda
jembatan garam
• Reaksi redoks dapat disetarakan dengan dua cara, yaitu dengan cara setengah reaksi dan cara bilangan oksidasi.
Sel elektrokimia ada dua macam yaitu sel volta dan sel elektrolisis.
• Sel elektrokimia mempunyai dua buah elektroda yaitu anoda dan katoda. Pada katoda terjadi reaksi reduksi, sedang pada anoda terjadi reaksi oksidasi.
3. Pelapisan Logam (Elektroplating)
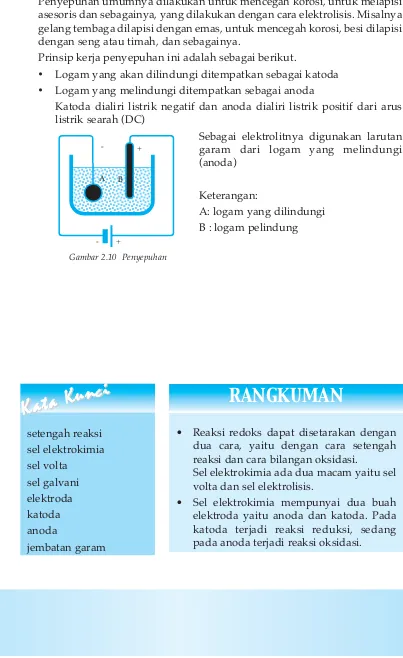
Pelapisan logam dengan logam lain biasa disebut "penyepuhan". Penyepuhan umumnya dilakukan untuk mencegah korosi, untuk melapisi asesoris dan sebagainya, yang dilakukan dengan cara elektrolisis. Misalnya gelang tembaga dilapisi dengan emas, untuk mencegah korosi, besi dilapisi dengan seng atau timah, dan sebagainya.
Prinsip kerja penyepuhan ini adalah sebagai berikut.
• Logam yang akan dilindungi ditempatkan sebagai katoda
• Logam yang melindungi ditempatkan sebagai anoda
Katoda dialiri listrik negatif dan anoda dialiri listrik positif dari arus listrik searah (DC)
Sebagai elektrolitnya digunakan larutan garam dari logam yang melindungi (anoda)
Keterangan:
A: logam yang dilindungi B : logam pelindung
Gambar 2.10 Penyepuhan
- +
- +
A B
RANGKUMAN
KK
• Ciri-ciri sel volta adalah sebagai berikut. a. Tersusun dari setengah sel katoda dan
setengah sel anoda dalam larutannya b. Anoda ada kutub negatif dan katoda
adalah kutub positif (KapAn)
c. Terdiri atas dua setengah reaksi yang dihubungkan dengan jembatan garam d. Notasi sel: A(s)|A+x
(aq)||B+y(aq)|B(s). Ciri-ciri elektroda potensial standar (Eo) adalah sebagai berikut.
a. Eo
sel= Eoreduksi+ Eooksidasi b. Jika Eo
sel positif, maka reaksi redoks dapat berlangsung. Jika Eo
sel negatif, maka reaksi redoks tidak berlangsung spontan.
c. Dalam persamaan reaksi harga Eotidak ikut dikalikan, walaupun koefisien reaksi setengah sel dikalikan.
d. Makin besar harga Eo makin mudah mengalami reduksi (makin kuat sifat oksdatornya). Makin kecil harga Eo, makin mudah mengalami oksidasi (makin kuat sifat reduktornya). • Sel volta ada dua macam, yaitu:
a. Sel volta primer adalah sel volta yang tidak dapat diisi lagi bila arusnya sudah habis, misalnya batu baterai biasa.
b. Sel volta sekunder adalah sel yang dapat diisi lagi bila arusnya sudah habis, misalnya aki.
KIMIAXII SMA
5 7
Pada aki terjadi reaksi sebagai berikut. a. Reaksi pengosongan penggunaan aki Katoda : PbO2(s)+ 4H+
(aq)+ SO42-(aq)+ 2e
→PbSO4(s)+ 2H2O(l) Anoda : Pb(s)+ SO4
2-(aq)→PbSO4(s)+ 2e + Reaksi sel:
Pb(s)+ PbO2(s)+ 4H+
(aq)+ 2SO42-(aq)
→PbSO4(s)+ 2H2O(l) b. Reaksi pengisian aki
Katoda: PbSO4(s)+ 2e →Pb(s)+ SO4 2-(aq) Anoda: PbSO4(s)+ 2H2O(l)→PbO2(s)+
4H++ SO
42-(aq)+ 2e + Reaksi sel : 2PbSO4(s)+ 2H2O(l) →Pb(s) +
PbO2(s)+ 4H+
(aq)+ 2SO42-(aq) • Deret volta
Li – K – Ba – Ca – Na – Mg – Al – Mn – Zn – Fe – Ni – Sn – Pb – H – Cu – Hg – Ag – Pt – Au
• Korosi
a. Korosi adalah reaksi redoks yang terjadi pada logam, sehingga membentuk senyawa logam tersebut. Peristiwa korosi ini dipengaruhi oleh lingkungan.
b. Faktor-faktor yang mempengaruhi korosi adalah udara (oksigen), uap air, larutan elektrolit, dan beberapa gas yang bersifat korosif.
c. Korosi pada besi dapat dihindari dengan mengecat, melapisi besi dengan logam yang memiliki Eo lebih kecil dari besi, dan menghubungkan besi dengan kutub negatif dari sumber listrik.
• Elektrolisis:
a. Elektrolisis adalah peristiwa penguraian larutan/leburan elektrolit oleh arus listrik searah.
b. Pada katoda berlangsung reaksi reduksi, pada anoda berlangsung reaksi oksidasi.
c. Katoda adalah kutub negatif dan anoda adalah kutub atau elektroda positif.
• Jika larutan mengandung ion logam golongan IA, IIA, Al3+ dan Mn2+, maka ion-ion ini tidak direduksi, yang direduksi adalah pelarutnya (air)
2H2O + 2e →H2+ 2OH -• Reaksi pada anoda:
- Anoda berupa logam inert, anion OH, I-, Br-, dan Cl-akan dioksidasi.
- jika ada anion SO42-, NO
3-, dan PO4 3-anion ini tidak akan dioksidasi tetapi yang dioksidasi H2O.
2H2O →O2+ 4H++ 4e
c. Untuk menentukan hasil elektrolisis digunakan hukum Faraday.
Satu Faraday = 96.500 coulomb. d. Hukum I Faraday
atau
Hukum II Faraday
e. Kegunaan elektrolisis adalah untuk: - pembuatan logam,
- pemurnian logam, - penyepuhan, dan - pembuatan gas.
m1: m2= e1: e2
KIMIAXII SMA
59
1. Cr2O72- + aH+ + bNO
2- → cCr3++ dNO
3-+ eH2O
Harga koefisien reaksi a, b, c, d dan e di atas berturut-turut adalah ....
2. Berikut ini merupakan persama-an reaksi redoks, kecuali.... a. 2Al(s)+ Fe2O3(s)→Al2O3(s)+ 3. Perhatikan gambar elektrolisis
larutan natrium klorida dengan elektroda karbon berikut ini! Zat yang terbentuk pada elektroda A adalah ....
a. gas O2
Agar reaksi redoks tersebut setara, maka koefisisen H2O2 dan MnO2adalah ....
a. 1 dan 1 d. 2 dan 1 b. 1 dan 2 e. 3 dan 1 c. 2 dan 2
5. Diketahui potensial elektroda standar berikut.
6. Bila dilakukan elektrolisis larutan CuSO4selama 30 menit dengan kuat arus 10 ampere, maka di katoda diendapkan tembaga sebanyak ... gram. (Ar Cu = 63,5)
a. 0,187 d. 11,845
b. 0,373 e. 5,922
c. 23,689
7. Pada elektrolisis larutan AgNO3 selama 1 jam dengan kuat arus 2 ampere, akan dihasilkan endapan perak
8. Diketahui harga potensial reduksi standar Zn2+ = -0,76 volt dan Fe2+ = -0,44 volt. Harga potensial sel Zn|Zn2+; Fe2+||Fe adalah ... volt.
a. -10,23 d. +0,32
b. +1,2 e. -0,32
c. -1,20
9. Diketahui harga Eozat elektrolit sebagai berikut.
Fe2++ 2e →Fe Eo= -0,44 volt Pb2++ 2e →Pb Eo= -0,13 volt Zn2++ 2e →Zn Eo= -0,76 volt Sn2++ 2e →Sn Eo= -0,14 volt Berdasarkan harga Eo, reaksi berikut yang dapat ber-langsung adalah .... 10. Gas klor dialirkan ke dalam
larutan NaOH pada suhu kamar, sehingga terjadi reaksi: Cl2+ 2NaOH →NaCl + NaClO + H2O. Pada reaksi ini yang bertindak sebagai oksidator dan reduktor adalah ....
a. Na+ d. H+
b. Cl2 e. ClO
-c. OH
-11. Reaksi-reaksi di bawah ini merupakan reaksi redoks, 12. Berdasarkan deret volta, reaksi
elektrokimia berikut yang
13. Persamaan reaksi redoks berikut:
KMnO4 + KCl + H2SO4 →
MnSO4+ K2SO4+ H2O + Cl2 Banyaknya (gr) Cl2 yang ter-bentuk dari 100 gram KMnO4 adalah .... (An Cl = 35,5, An K =
14. Sebuah sel volta mempunyai susunan:
Fe|Fe2+||Cd2+|Cd Bila diketahui
Cd2++ 2e-→ Cd Eo= -0,4 V Fe2++ 2e →Fe Eo= -0,44 V Maka potensial selnya adalah ....
a. 0,4 d. -0,02
b. 0,02 e. -0,04
KIMIAXII SMA
61
15. Pada elektrolisis larutan AgNO3 digunakan katoda Fe dan Anoda grafit. Setelah dialiri listrik selama 9650 detik, dihasilkan gas O2sebanyak 2,24 liter (0o C, 1 atm). Banyaknya perak yang diendapkan di katoda adalah .... (Ar Ag = 108) a. 43,2 gram d. 3,33 gram b. 33,3 gram e. 2,3 gram c. 23,2 gram
16. Pada elektrolisis larutan Na2SO4 dengan elektroda grafit, peristiwa yang terjadi di katoda adalah ....
a. dibebaskan natrium b. larutan bersifat asam
c. dibebaskannya gas oksigen dan ion H+
d. dibebaskannya gas hidrogen dan ion OH
-e. dibebaskannya gas SO2 17. Pada elektrolisis leburan garam
CaCl2dengan elektroda karbon, digunakan muatan listrik sebanyak 0,02 F. Volum gas klor yang dihasilkan di anoda jika dikukur pada tekanan dan suhu di mana 1 liter gas N2(Mr = 28) massanya 1,4 gram adalah ....
a. 448 d. 200
b. 400 e. 100
c. 224
18. Pada elektrolisis larutan CuSO4 dengan elektroda Pt dihasilkan endapan Cu sebanyak 6,35 gram. Jika arus yang digunakan adalah 2A maka waktu yang diperlukan untuk elektrolisis tersebut adalah .... (Ar Cu = 63,5, S = 32, O = 16, F = 96500
19. Elektrolisis larutan KCl dengan menggunakan elektroda karbon akan menghasilkan ....
a. larutan basa di anoda b. gas Cl2di katoda c. logam K di katoda d. gas H2di katoda e. gas O2di anoda
20. Untuk menetralkan larutan hasil elektrolisis larutan CuSO4, diperlukan 50 ml larutan NaOH 0,2 M. Banyaknya muatan listrik yang digunakan adalah .... (Ar Cu = 63,5)
II. Kerjakan soal-soal berikut ini dengan tepat!
2. Lelehan NaCl dielektrolisis selama 10 menit dengan arus listrik sebesar 10 ampere.
a. Tuliskan persamaan reaksi selnya!
b. Hitung massa logam Na yang terbentuk! (Ar Na = 23, F = 96.500 C) c. Jika logam natrium yang terbentuk dilarutkan dalam air, tuliskan
persamaan reaksinya!
3. Pada ektrolisis larutan CuSO4 dengan elektroda karbon, di katoda diendapkan 15,9 gram tembaga. (Ar Cu = 63,5)
a. Berapa Faraday jumlah listrik yang digunakan pada elektrolisis tersebut?
b. Tulislah reaksi yang terjadi pada anoda! c. Berapa mol gas O2 yang dihasilkan?
4. Tuliskan reaksi pembuatan gas klor dengan cara elektrolisis larutan NaCl. Sebagai anoda digunakan karbon, dan katodanya terbuat dari baja yang berlubang-lubang!