LAPORAN RESMI PRAKTIKUM TERMODINAMIKA
EKSPANSI GAS IDEAL
Kelompok 1 :
Ahmad Kholil (1731410131)
Almay Shinta Dara P (1731410037)
Ayu Widyatna (1731410025)
JURUSAN TEKNIK KIMIA
POLITEKNIK NEGERI MALANG
Ekspansi Gas 20 April 2018
I. Tujuan
1. Menghitung rasio kapasitas udara sebagai gas ideal 2. Mengetahui sifat-sifat gas ideal dan proses adiabatik II. Variabel
Variabel Bebas : Tekanan Variabel Kontrol : Waktu
Variabel Terikat : Rasio Panas dan Volume III. Prosedur Kerja
a. Daftar Alat
1. 1 set modul TH5
2. 1 set personal computer (PC) sebagai pencatat data b. Daftar Bahan
1. Udara c. Skema Kerja
1. Penentuan Ratio Kapasitas Panas - Persiapan
- Percobaan
Buka valve V1 dan V2 yang berada diatas tabung
Semua valve lain harus dalam keadaan tertutup
Nyalakan console yang terhubung dengan modul TH5
Nyalakan PC
Ukur dan catat tekanan udara menggunakan barometer
2. Penentuan Ratio Volume pada Proses Isotermal - Persiapan
Pilih exercise A, tekan tombol load
Buka program TH5 expansion process of a perfect gas
Pilih view table untuk data logger atau view graph untuk grafik
Nyalakan air pump dan tunggu tekanan didalam vessel 30 KN/m2
Tekan tombol GO
Matikan pompa udara dan tutup vessel V4
Tunggu sampai tekanan pressure vessel stabil
Buka sedikit valve V1 dengan cepat
Ulangi langkah diatas dengan tekanan yang berbeda Tunggu sampai T1 dan T2 sama setelah itu tekan tombol stop
- Percobaan
IV. Data Pengamatan 1. Percobaan A
Tabel 4.1a. Ratio Percobaan Kapasitas Panas
No 20
pressure) (a) 98,8 98,8 98,8 98,8
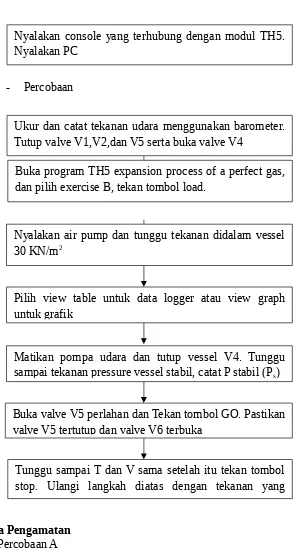
Nyalakan console yang terhubung dengan modul TH5. Nyalakan PC
Ukur dan catat tekanan udara menggunakan barometer. Tutup valve V1,V2,dan V5 serta buka valve V4
Buka program TH5 expansion process of a perfect gas, dan pilih exercise B, tekan tombol load.
Nyalakan air pump dan tunggu tekanan didalam vessel 30 KN/m2
Pilih view table untuk data logger atau view graph untuk grafik
Matikan pompa udara dan tutup vessel V4. Tunggu sampai tekanan pressure vessel stabil, catat P stabil (Ps)
Buka valve V5 perlahan dan Tekan tombol GO. Pastikan valve V5 tertutup dan valve V6 terbuka
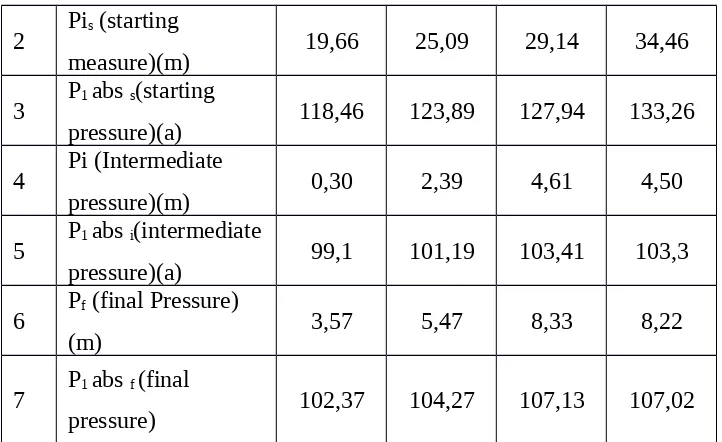
2 Pis (starting
measure)(m) 19,66 25,09 29,14 34,46
3 P1 abs s(starting
pressure)(a) 118,46 123,89 127,94 133,26
4 Pi (Intermediate
pressure)(m) 0,30 2,39 4,61 4,50
5 P1 abs i(intermediate
pressure)(a) 99,1 101,19 103,41 103,3
6 Pf (final Pressure)
(m) 3,57 5,47 8,33 8,22
7 P1 abs f (final
pressure) 102,37 104,27 107,13 107,02
Tabel 4.2a. Penentuan Ratio Volume pada Proses Isotermal
No 20
kN/m2
25 kN/m2
30 kN/m2
35 kN/m2
1
Constant
temperature in both vessel (T)
31,1 31,1 31,1 31,1
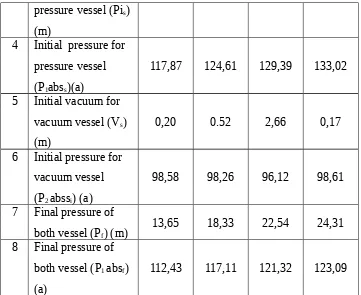
2 Atmospheric
pressure vessel (Pis)
(m)
4 Initial pressure for pressure vessel (P1abss)(a)
117,87 124,61 129,39 133,02
5 Initial vacuum for vacuum vessel (Vs)
(m)
0,20 0.52 2,66 0,17
6 Initial pressure for vacuum vessel (P2 abssi) (a)
98,58 98,26 96,12 98,61
7 Final pressure of both vessel (Pf) (m)
13,65 18,33 22,54 24,31
8 Final pressure of both vessel (P1 absf)
(a)
112,43 117,11 121,32 123,09
2. Percobaan B
Tabel 4.1b. Ratio Percobaan Kapasitas Panas
No 20
pressure) (a) 98,8 98,8 98,8 98,8
2 Pis (starting
measure)(m) 19,98 24,61 29,26 34,46
3 P1 abs s(starting
pressure)(a) 118,78 123,41 128,06 133,26
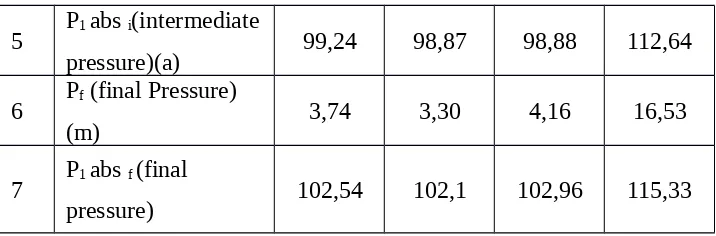
4 Pi (Intermediate
5 P1 abs i(intermediate
pressure)(a) 99,24 98,87 98,88 112,64
6 Pf (final Pressure)
(m) 3,74 3,30 4,16 16,53
7 P1 abs f (final
pressure) 102,54 102,1 102,96 115,33
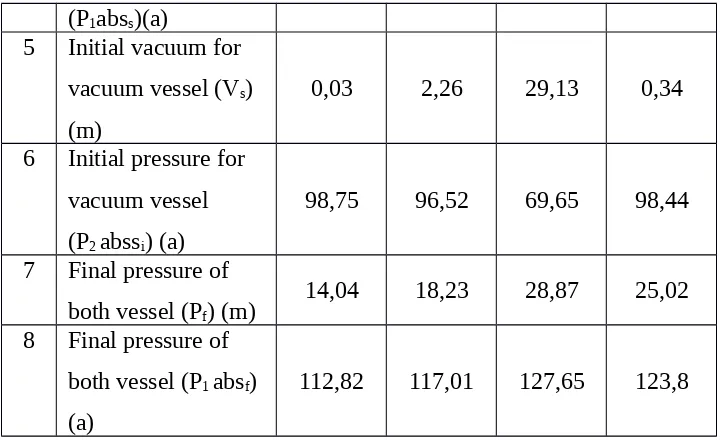
Tabel 4.2b. Penentuan Ratio Volume pada Proses Isotermal
No 20
kN/m2
25 kN/m2
30 kN/m2
35 kN/m2
1
Constant
temperature in both vessel (T)
31,1 31,1 31,1 31,1
2 Atmospheric
pressure (Patm) (a) 98,78 98,78 98,78 98,78 3 Initial pressure for
pressure vessel (Pis)
(m)
19,78 24,83 29,14 34,46
4 Initial pressure for pressure vessel
(P1abss)(a)
5 Initial vacuum for vacuum vessel (Vs)
(m)
0,03 2,26 29,13 0,34
6 Initial pressure for vacuum vessel (P2 abssi) (a)
98,75 96,52 69,65 98,44
7 Final pressure of both vessel (Pf) (m)
14,04 18,23 28,87 25,02
8 Final pressure of both vessel (P1 absf)
(a)
112,82 117,01 127,65 123,8
V. Data Perhitungan 1. Percobaan A
Tabel 5.1. Percobaan Ratio Kapasitas Panas
NO Percobaan A Percobaan B
P Cp
Tabel 5.2a. Penentuan Ratio Volume pada Proses Isotermal
NO Percobaan A Percobaan B
3 30 3,123 30 214,81
4 35 2,465 35 2,686
VI. Pembahasan
(Ahmad Kholil / 1731410131)
Gas Ideal adalah gas teoritis yang terdiri dari partikel-partikel titik yang bergerak secara acak dan tidak saling berinteraksi. Beberapa gas pada kondisi normal, seperti temperatur dan tekanan standar dapat diperlakukan seperti gas ideal dengan perbedaan yang masih bisa ditolerir. Model Gas Ideal mengikuti asumsi berikut ini :
Molekul gas tidak dibedakan, berukuran kecil, dan berbentuk bola. Semua tabrakan antar gas bersifat elastis dan semua gerakannya tanpa
friksi (tidak ada energi hilang pada gerakan atau tabrakan). Menggunakan hukum Newton.
Jarak rata-rata antar mlekul jauh lebih besar daripada ukuran molekul. Molekul secara konstan bergerak pada arah acak dengan distribusi
kecepatan.
Tidak ada gaya atraktif atau repulsif antara molekul atau sekitarnya.
Proses termodinamika terdiri atas pemanasan dan ekspansi dari gas. Pada gas terjadi berberapa jenis proses yang tergantung dari keadaan gas tersebut, yaitu :
Proses Isobarik (P konstan) Proses Isotermal (T Konstan)
Proses Adiabatik/Isentropik (Sistem terisolasi)
Pada percobaan pertama, dilakukan proses ekspansi pada gas (udara) dalam suatu tangki tabung (pressure vessel) dengam tujuan mendapatkan data selama proses yang terjadi untuk mencari rasio kapasitas paas dari udara (sebagai gas ideal). Ekspansi bertujuan untuk menempatkan gas pada tekanan awal yang akan diukur. Percobaan menggunakan 4 variabel tekanan yaitu pada 20 kPa, 25kPa, 30 kPa, dan 35 kPa. Dari gas yang tersebut, valve keluar dibuka secara sangat cepat dengan tujuan untuk membuang sedikit gas yang ada pada vessel. Saat vessel kehilangan volume, terdapat berberapa proses yang terjadi di dalam gas akibat penurunan volume dan tekanan yang sangat cepat. Sesaat setelah vessel dibuka, terjadi proses isobarik dimana tekanan sama sesaat valve dibuka dan terjadi perubahan volume, serta isokhorik dimana volume konstan dan terjadi perubahan temperatur dan tekanan saat valve telah ditutup.
Data yang didapat data logger berupa perubahan tekanan dan volume disimpan lalu dimasukkan dalam persamaan :
¿ Cp
Cv❑
=lnP1|s|−lnP1|i|
lnP1|i|−lnP1|f|
Percobaan kedua yang dilakukan adalah ekspansi gas ideal dengan tujuan memperoleh rasio volume yang ada pada kedua vessel (pressure vessel dan vaccum vessel) dalam kondisi isotermal. Pressure vessel adalah bagian dari vessel yang berisi udara terekspansi dengan tekanan rendah sementara vaccum vessel adalah bagian vessel yang hampa dengan tekanan mendekati nol. Awalnya Udara akan diekspansi ke pressure vessel sesuai dengan variabel yang digunakan, yaitu 20 kPa, 25 kPa, 30 kPa, dan 35 kPa. Udara/gas yang ada dalam pressure vessel kemudian dimasukkan secara perlahan dengan membuka valve yang menghubungkan pressure vessel dan vaccum vessel.
sistem dalam pressure vessel dan vaccum vessel tanpa ada hambatan sehingga mengakibatkan tidak ada nya perubahan temperatur/energi dalam pada gas.
Data Logger kemudian akan mencatat setiap perubahan tekanan dari kedua vessel, dari data tersebut dimasukkan kedalam persamaan untuk mendapat rasio pebandingan volume antara kedua vessel yaitu :
Vol1 Vol2
=P2|s|−Pf
Pf−P1|s|
(Almay Shinta Dara P / 1731410037)
Gas sempurna atau gas ideal didefinisikan sebagai suatu keadaan zat, yang penguapannya dari kondisi cair berlangsung sempurna. Oksigen, nitrogen, hidrogen dan udara, pada batas temperatur tertentu, bisa juga disebut sebagai gas sempurna. Sifat fisik gas dikontrol oleh tiga variabel berikut:
1. Tekanan yang digunakan oleh gas.
2. Volume yang ditempati oleh gas.
3. Temperatur gas.
Sifat-sifat gas sempurna sempurna, yang mengalami perubahan pada variable-variabel yang disebutkan di atas, akan mengikuti hukum-hukum berikut (diperoleh dari eksperimen):
1. Hukum Boyle.
2. Hukum Charles, dan
3. Hukum Gay-Lussac.
Hukum ini diformulasikan oleh Robert Boyle pada tahun 1662. Hukum ini berbunyi, ”Tekanan mutlak suatu massa dari gas sempurna berubah secara berbanding terbalik terhadap volumenya, jika temperaturnya tetap” . Secara matematik bisa ditulis:
P ∝1/v atau p/v = konstan
p1v1 = p2v2 = p3v3 = .... = konstan
dimana notasi 1, 2 dan 3 mengacu kepada kondisi yang berbeda.
Hukum Charles
Hukum ini dirumuskan oleh warga negara Perancis bernama Jacques A.C. Charles pada tahun 1787. Hukum ini dinyatakan dalam dua bentuk:
1. “ Volume suatu massa gas sempurna beruba h dengan berbanding langsung dengan temperatur mutlak, jika tekanan mutlaknya konstan” . Secara matematik:
v ∝ T atau v/T = konstan
atau: v1/T1=v2/T2=v3/T3=…= konstan
dimana notasi 1, 2 dan 3 mengacu kepada kondisi yang berbeda.
2. ” Semua gas sempurna akan menagalami perubahan volume sebesar 1/273 dari volume awalnya pada 00 C untuk setiap perubahan temperatur
sebesar 10 C.
Hukum Gay-Lussac
p ∝ T atau p/T = konstan
atau: p1/T1=p2/T2=p3/T3=…= konstan
dimana notasi 1, 2 dan 3 mengacu kepada kondisi yang berbeda.
Persamaan Gas Umum
Pada bagian sebelumnya, telah dibicarakan tentang hukum gas dimana memberikan kita hubungan antara dua variabel, ketika variabel ketiga konstan. Dalam kondisi sebenarnya, ketiga variabel yaitu: tekanan, volume dan temperatur, berubah secara bersamaan. Untuk menyatakan kondisi ini, kedua hukum Boyle dan Charles digabung, dan memberikan persamaan gas umum.
∴ pv ∝ T atau pv = CT
dimana C adalah konstanta, yang harganya tergantung pada massa dan sifat dari gas.
Proses pemanasan dan ekspansi gas secara umum bisa didefinisikan sebagai proses termodinamika . Dari pengamatan, sebagai hasil dari aliran energi, perubahan terjadi pada berbagai sifat gas seperti tekanan, volume, temperatur, energi spesifik, enthalpi spesifik, dsb. Proses termodinamika bisa terjadi dalam berbagai keadaan. Jenis-jenis proses termodinamika ada 3 jenis yaitu:
1. Proses Adiabatik
2. Proses Isokhorik
Proses isohkorik ( isochoric process) adalah proses volume konstan ketika volume suatu sistem termodinamika konstan, sistem tidak melakukan kerja dengan lingkungannya maka W = 0 danU2 – U1 = Au = Q
3. Proses Isobaric
Proses isobaric adalah proses tekanan konstan secara umum tidak satupun dari ketiga kuantitas Au, Q dan W adalah nol pada proses isobaric, Tapi menghitung W adalah sangat mudah.
W = P ( V2 - V1 )
P1 = P2
Pada percobaan kali ini kami menghitung rasio kapasitas panas yang merupakan proses adibatik dengan rumus cp/cv dan menentukan kapaitas volume dalam keadaan isothermal menggunakan rumus v2/v1. Pada beberapa kasus, percobaan yang kami lakukan menghasilkan rasio kapasitas panas bernilai nol. Padahal perbandingan tidak mungkin bernilai nol. Oleh karena itu praktikum ekspansi gas ideal kali inisangat membutuhkan ketelitian tidak hanya dalam mengoperasikan alat tapi juga pada saat percobaan. Misalnya saja waktu, disini waktu sangat mempengaruhi dan sangat penting, dimana semakin lama menekan katup vessel maka angka tekanan konstan akan semakin jauh jadi penekanan katup vessel harus dilakukan sesingkat-singkatnya atau secepat mungkin agar tercapai angka tekanan konstan atau hasil yang diperoleh lebih akurat. Selain waktu, kejeliaan mata juga sangat berpengaruh dalam percobaan ini karena semakin teliti dan jeli dalam melihat angka tekanan makan hasil percobaan akan semakin menjadi lebih akurat.
vessel tidak langsung mencapai tekanan konstan pada saat pemompaan dihentikan. Hal ini disebabkan suhu udara yang dilepas oleh pompa tidak sama degan suhu didalam vessel.
(Ayu Widyatna / 1731410025)
Praktikum pada kali ini adalah Ekspansi Gas Ideal. Gas Ideal sendiri merupakan gas teoritis yang memenuhi hukum gas ideal. Praktikum ini bertujuan untuk dapat mengetahui sifat – sifat gas ideal dan proses adiabatik. Yang mana menurut buku Panduan Praktikum Termodinamika Teknik Kimia, 2018, peubahan terjadi pada berbagai sifat gas seperti tekanan, volume, temperatur, energi spesifik, enthalpi spesifik, dan lain-lain.
Proses termodinamika bisa terjadi dalam berbagai keadaan, beberapa diantaranya adalah proses volume konstan, proses tekanan konstan, proses hiperbolik, proses isothermal (temperatur konstan), proses adiabatik atau proses isentropik, proses poliprotik, proses ekspansi bebas, dan proses throttling. Pada praktikum ini membahas proses adiabatik.
Proses adiabatik sendiri merupakan proses dimana zat kerja tidak menerima atau memberikan kalor ke lingkungan selama ekspansi atau kompresi. Keadaan ini dapat terjadi apabila zat kerja terisolasi secara termal. Dengan demikiaan keadaan yang terjadi selama proses adiabatik adalah
1. Tidak ada kalor yang masuk atau keluar dari sistem
2. Temperatur sistem berubah ketika kerja dilakukan dengan perubahan energi dalam
Pada praktikum terdapat 2 macam metode yaitu Penentuan Ratio Kapasitas Panas dan Penentuan Ratio Volume pada Proses Isotermal. Kedua metode menggunakan tekanan atmosferik sebesar 741 mmHg.
Pada metode penentuan Ratio Kapasitas Panas tekanan yang digunakan didalam Vessel Preassure adalah 20 kN/m2, 25 kN/m2, 30 kN/m2,
dan 35 kN/m2. Praktikum ini menggunakan set modul TH5 dan 1 set
Personal Computer untuk mencatat data dari Vessel. Lakukan langkah sesuai dengan metodelogi dan Stop program pada saat T1 sama dengan T2. Setelah
melakukan percobaan didapatkan data menurut tabel 4.1a dan tabel 4.1b. Percobaan dilakukan 2 kali untuk memastikan hasil yang didapat tidak jauh berbeda. Setelah didapatkan data barulah dihitung ratio kapasitas panas untuk masing – masing tekanan (Tabel 5.1). hal ini berbeda apabila dibandingkan dengan teoritis hasil yang terdapat pada lampiran tabel 9.1. Berbedanya hasil yang dapat dikarenakan tidak telitinya pada saat pengerjaan dan pengamatan data pada Personal Computer.
Pada metode percobaan Penentuan Ratio Volume pada Proses Isotermal tekana yang digunakan dalam Vessel Preasure sebesar 20 kN/m2,
25 kN/m2, 30 kN/m2, dan 35 kN/m2. Metode ini jugan menggunakan alat dan
aplikasi yang sama seperti sebelumnya, akan tetapi berbeda program. Pada metode ini, praktikum dilakukan sesuai dengan metodelogi dan tekan Stop
VII. Kesimpulan
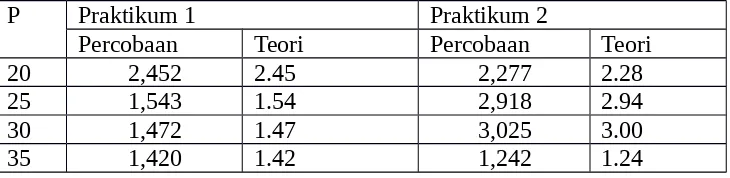
a. Kapasitas panas udara sebagai gas ideal berdasarkan teori didapatkan 2,452 , 1,543, 1,472, dan 1,420 pada masing – masing tekanan 20 kN/m2,
25 kN/m2, 30 kN/m2, dan 35 kN/m2 untuk percobaan A. 2,277, 2,918,
3,025, dan 1,242 pada masing – masing tekanan 20 kN/m2, 25 kN/m2, 30
kN/m2, dan 35 kN/m2 untuk percobaan B. Sedangkan, untuk secara teoritis
kapasitas panas pada masing – masing tekanan sebesar 2,45, 1,54, 1,47, dan 1,42 untuk percobaan A. 2,28, 2,94, 3,00, dan 1,24 untuk percobaan B. b. Sifat – sifat gas ideal antara lain
- Gas terdiri dari partikel – partikel gas yang sangat banyak - Partikel gas bergerak dalam lintasan lurus
- Semua tumbukan partikel gas bersifat lenting sempurna - Dll
c. Proses Adiabatik adalah proses dimana zat kerja tidak menerima atau memberikan kalor ke lingkungan selama ekspansi atau kompresi
VIII. Daftar Pustaka
Tim penulis.2010.Petunjuk Praktikum Termodinamika, Jurusan Teknik Kimia, Politeknik Negeri Malang.
Wood, B.D. 1988. Penerapan Termodinamika. Jakarta : Erlangga
Sears dan Zemasky. 1985. Fisika untuk Universitas 1. Jakarta : Erlangga Malang, 20 April 2018
Mengetahui,
Ernia Novika ST. MT
P Praktikum 1 Praktikum 2
Percobaan Teori Percobaan Teori
20 2,452 2.45 2,277 2.28
25 1,543 1.54 2,918 2.94
30 1,472 1.47 3,025 3.00
Tabel 9.2. Perbandingan Hasil Perhitungan Ratio Volume pada Proses Isotermal dengan Teori
P Praktikum 1 Praktikum 2
Percobaan Teori Percobaan Teori
20 2,545 2,67 2,451 2,29
25 2,513 -0,80 3,104 -0,82
30 3,123 -0,78 214,81 -0,94