Bab IV Hasil dan Pembahasan
α-Amilase (E.C 3.2.1.1) merupakan salah satu enzim hidrolitik yang memegang peranan penting di dalam industri. Hidrolisis langsung dari pati mentah secara enzimatis dibawah suhu gelatinisasi sangat diperlukan untuk menekan konsumsi energi di dalam industri yang berbasis pati. Salah satu upaya untuk mengatasi permasalahan ini adalah mencari α-amilase baru yang memiliki kemampuan dalam mendegradasi pati mentah. Studi terhadap α-amilase dari bakteri laut Vibrio sp. SFNB 3 mengindikasikan bahwa enzim ini mampu menghidrolisis pati mentah jagung.
IV.1 Kurva Pertumbuhan dan Aktivitas α-Amilase Vibrio sp. SFNB 3
Kultur Vibrio sp. SFNB 3 diremajakan di dalam media agar Marine Broth (MB) dengan komposisi 0,25% (w/v) pepton, 0,05% (w/v) ekstrak ragi, 1,5% (w/v) bakto agar, 0,1% (w/v) pati dan air laut. Pepton dan ekstrak ragi merupakan sumber nitrogen organik yang berfungsi sebagai makronutrien penting untuk pertumbuhan sel. Selain itu, sumber nitrogen organik seperti pepton dan ekstrak ragi telah banyak dilaporkan meningkatkan produksi α-amilase. Pati, selain sebagai makronutrien yang penting untuk pertumbuhan sel, juga berperan sebagai sumber karbon penginduksi α-amilase (Brock et al., 1994; Gupta et al., 2003). Air laut merupakan sumber dari berbagai ion garam penting, terutama Na+ yang vital diperlukan untuk pertumbuhan Vibrio sp. (Farmer and Brenner, 2006). Selain itu, keberadaan ion garam seperti Na+, Ca2+, dan Mg2+ di dalam media pertumbuhan telah dilaporkan dapat meningkatkan produksi α-amilase (Gupta et al., 2003: Sivaramakrishnan et al., 2006).
Inokulum dibuat dari kultur Vibrio sp. SFNB 3 yang telah diremajakan. Sebanyak satu ose kultur diinokulasikan secara aseptik ke dalam erlenmeyer yang berisi MB cair (MB tanpa bakto agar) steril dan diinkubasi pada 30oC, 150 rpm selama 16 jam. Kondisi inkubasi mempunyai pengaruh besar terhadap pertumbuhan sel. Vibrio sp. diketahui dapat tumbuh dengan baik pada suhu 30oC (Farmer and
Brenner, 2006). Intensitas agitasi mempengaruhi pencampuran dan laju transfer oksigen di dalam media. Pada umumnya, intensitas agitasi dibawah 300 rpm dipergunakan untuk produksi α-amilase seperti telah banyak dilaporkan (Gupta et al., 2003). Setelah inkubasi selama 16 jam, 1% (v/v) inokulum dipindahkan secara aseptik ke dalam labu erlenmeyer yang berisi MB cair steril dan diinkubasi pada kondisi yang sama selama 24 jam. Sebanyak 3 mL sampel diambil secara aseptik pada jam ke-0, 2, 4, 6, 8, 10, 12, 14, 16, dan 24. OD sampel diukur pada λ 600 nm dengan menggunakan spektrofotometer. Pengukuran OD sampel pada λ tertentu merupakan salah satu cara mempelajari fenomena pertumbuhan sel. Pendekatan eksperimental ini merupakan studi pertumbuhan pada tingkat populasi. Peningkatan jumlah individu atau ukuran populasi digunakan sebagai ukuran pertumbuhan sel.
Untuk uji aktivitas α-amilase, tiap sampel pada interval waktu diatas disentrifuga 12.500 rpm selama 10 menit pada 4oC. Supernatan dipisahkan dari pelet sel dan aktivitas α-amilase ditentukan dengan menggunakan metode DNS. Metode DNS didasarkan pada reaksi reduksi gugus nitro pada posisi 3 dari asam 3,5-dinitrosalisilat dan oksidasi gugus aldehida dari gula pereduksi. Produk dari reaksi ini adalah asam 3-amino-5-nitrosalisilat yang memberi serapan maksimum pada λ 500 nm. Nilai absorbansi yang didapatkan berbanding lurus dengan jumlah gula pereduksi yang terdapat di dalam sampel.
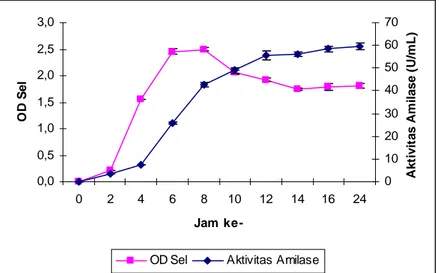
Kurva pertumbuhan dan aktivitas α-amilase yang dihasilkan dari Vibrio sp. SFNB 3 diberikan dalam Gambar IV.1. Seperti tampak dalam Gambar IV.1, kurva pertumbuhan Vibrio sp. SFNB 3 mengikuti empat fase yang jelas, berturut-turut yaitu fase lag, log, stasioner, dan kematian. Fase lag terjadi pada jam ke-0 hingga jam ke-2 dan berlangsung segera setelah inokulum diinokulasikan ke dalam media segar. Fase lag merupakan periode adaptasi, saat inokulum mengenali konstituen mikromolekul maupun makromolekul dari lingkungan yang ditempatinya dan mungkin melakukan sintesis enzim, protein atau komponen-komponen struktural sel. Saat fase lag, massa atau volume sel dapat berubah tanpa terjadi perubahan jumlah sel (Judoamidjojo dkk., 1990). Rentang waktu fase lag dipengaruhi oleh
beberapa faktor seperti volume inokulum, waktu yang diperlukan untuk pulih dari kerusakan fisik atau goncangan saat transfer inokulum, dan waktu untuk sintesis koenzim-koenzim esensial atau faktor-faktor pembelahan atau enzim-enzim yang vital dalam proses metabolisme.
0,0 0,5 1,0 1,5 2,0 2,5 3,0 0 2 4 6 8 10 12 14 16 24 Jam ke-OD S e l 0 10 20 30 40 50 60 70 A k ti vi tas A m il as e ( U /m L )
OD Sel Aktivitas Amilase
Gambar IV.1. Kurva pertumbuhan dan aktivitas α-amilase Vibrio sp. SFNB 3 Fase pertumbuhan eksponensial atau fase log ditandai dengan peningkatan massa sel secara cepat. Fase log dari Vibrio sp. SFNB 3 dimulai pada jam ke-2 dan berlangsung selama 4 jam. Fase log merupakan periode pertumbuhan seimbang atau status mantap dengan laju pertumbuhan spesifik yang konstan. Konsumsi nutrien dan produksi zat-zat metabolik selama fermentasi akan menyebabkan perubahan komposisi kimiawi media fermentasi. Sebagai akibatnya, lingkungan sel akan berada pada suatu status yang mantap (Judoamidjojo dkk., 1990).
Pada akhir fase log, laju pertumbuhan akan menurun karena berkurangnya nutrien esensial dan adanya hambatan oleh peningkatan produk metabolit. Fase stasioner terjadi bila semua sel berhenti membelah diri. Meskipun pertumbuhan bersih telah terhenti, proses metabolisme di dalam sel dan penimbunan produk di dalam cairan fermentasi mungkin masih berlangsung (Judoamidjojo dkk., 1990). Fase stasioner dari Vibrio sp. SFNB 3 berlangsung sangat singkat dari jam ke-6 hingga jam ke-8 dan langsung diikuti dengan fase kematian.
IV.2 Produksi dan Isolasi α-Amilase
Dari Gambar IV.1 tampak bahwa produksi α-amilase Vibrio sp. SFNB 3 berlangsung seiring dengan pertumbuhan selnya. Sintesis enzim yang mengikuti pertumbuhan sel merupakan tipe sintesis growth associated. Setelah jam ke-12, α-amilase masih memiliki aktivitas yang tinggi dan relatif stabil hingga jam ke-24. Produksi α-amilase dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.3. Sebanyak 500 mL MB cair digunakan untuk produksi α-amilase dari Vibrio sp. SFNB 3. Panen produksi α-amilase dilakukan pada jam ke-24. Ekstrak kasar α-amilase yang didapat dari panen produksi berjumlah 450 mL dan memiliki aktivitas spesifik 11 U/µg. Satu unit aktivitas enzim didefinisikan sebagai jumlah enzim yang dibutuhkan untuk menghasilkan 1 µmol glukosa tiap menit di bawah kondisi uji.
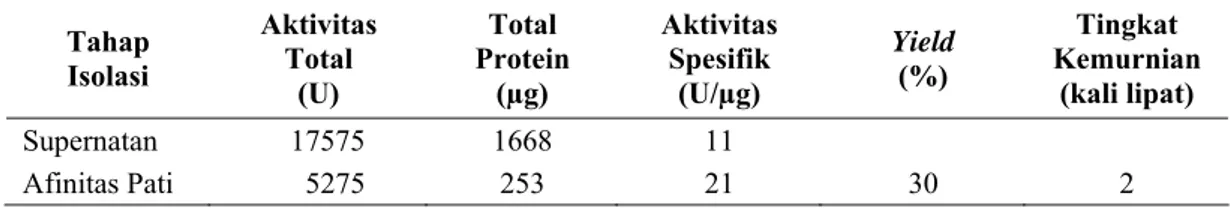
Isolasi α-amilase dari ekstrak kasar dilakukan menggunakan pati mentah jagung. Metode isolasi ini mengikuti metode yang dilaporkan Najafi and Kembhavi (2005) dengan sedikit modifikasi seperti telah dijelaskan di dalam sub bab III.3.4. Isolasi α-amilase menggunakan pati mentah jagung memberi yield sebesar 30%. Dari 450 mL ekstrak kasar diperoleh 50 mL α-amilase dengan tingkat kemurnian 2 kali lipat. Aktivitas spesifik α-amilase hasil isolasi adalah 21 U/µg. Ringkasan hasil isolasi α-amilase dari Vibrio sp. SFNB 3 diberikan dalam Tabel IV.1.
Tabel IV.1. Ringkasan hasil isolasi α-amilase dari Vibrio sp. SFNB 3
Tahap Isolasi Aktivitas Total (U) Total Protein (µg) Aktivitas Spesifik (U/µg) Yield (%) Tingkat Kemurnian (kali lipat) Supernatan 17575 1668 11 Afinitas Pati 5275 253 21 30 2
Profil α-amilase pada tiap tahap isolasi dipelajari dengan elektroforesis gel poliakrilamid yang diikuti dengan pewarnaan menggunakan iodin seperti telah dijelaskan di dalam sub bab III.3.15. Pewarnaan iodin merupakan salah satu metode untuk mendeteksi aktivitas α-amilase. Pati akan membentuk kompleks berwarna biru pekat dengan iodin. Reaksi iodin-pati disebabkan oleh adanya
heliks amilosa dan iodin dalam bentuk I3- yang mengisi inti heliks. Hidrolisis pati secara progresif oleh α-amilase akan menyebabkan kompleks pati-iodin terurai sehingga tidak terbentuk warna (Gupta et al., 2003; Koolman and Roehm, 2005). Hasil native PAGE-zymogram dari supernatan yang dikumpulkan pada tiap tahap isolasi diberikan dalam Gambar IV.2A.
Gambar IV.2. Native PAGE-zymogram (A) dan SDS PAGE-silver staining (B) dari sampel dalam tiap langkah isolasi. Ekstrak kasar α-amilase (lajur A1 dan B2), supernatan α-amilase yang tidak terikat pati mentah jagung (lajur A2 dan B3), supernatan hasil pencucian 0,5 M NaCl selama 5 menit (lajur A3), supernatan α-amilase yang terikat pati mentah jagung setelah aktivasi pada suhu 50oC, 75 rpm selama 30 menit (lajur A4 dan B4), Promega Broad Range Protein Molecular Weight Marker (lajur A1).
Seperti tampak dalam Gambar IV.2A, terdapat lebih dari satu pita pada lajur A1 untuk sampel ekstrak kasar α-amilase. Hal ini mengindikasikan bahwa Vibrio sp. SFNB 3 menghasilkan lebih dari satu macam α-amilase. Isolasi menggunakan pati mentah jagung berhasil memisahkan satu α-amilase dari yang lain.
Massa molekul dari α-amilase hasil isolasi ditentukan dengan SDS PAGE seperti telah dijelaskan di dalam sub bab III.3.17. Teknik native PAGE tidak dapat digunakan untuk menentukan massa molekul dari protein karena mobilitas protein
di dalam gel dipengaruhi oleh muatan dan ukuran. Jika protein diperlakukan sehingga memiliki muatan yang seragam, maka mobilitas elektroforetik utamanya akan bergantung pada ukuran protein. Ketika molekul protein diberi deterjen SDS, struktur protein akan terbuka dan menghasilkan rantai polipeptida lurus yang diselubungi oleh molekul SDS yang bermuatan negatif (Boyer, 2000). α-Amilase hasil isolasi dilarutkan di dalam buffer sampel yang tidak mengandung merkaptoetanol agar ikatan disulfida yang membentuk struktur α-amilase hasil isolasi tidak terputus sehingga dapat direnaturasi.
Pada SDS PAGE, gel diwarnai dengan metode silver staining. Pewarnaan dengan perak didasarkan pada reduksi ion perak yang terikat pada rantai samping asam amino (Sambrook and Russel, 2001). Dari hasil SDS PAGE-silver staining (Gambar IV.2B) diketahui bahwa massa molekul α-amilase hasil isolasi adalah sekitar 51 kDa. Jika dibandingkan dengan massa molekul α-amilase mikrobial yang lain, massa molekul α-amilase hasil isolasi dari Vibrio sp. SFNB 3 termasuk ke dalam rata-rata massa molekul kebanyakan α-amilase mikrobial, yaitu antara 50-60 kDa (Gupta et al., 2003).
IV.3 Suhu Optimum α-Amilase Hasil Isolasi
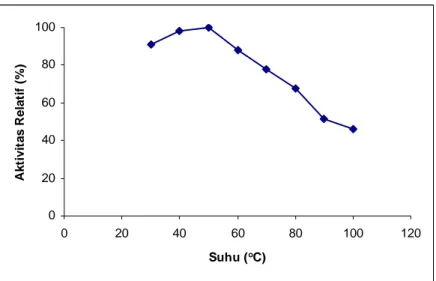
Suhu optimum untuk aktivitas α-amilase terkait dengan pertumbuhan mikroba sumber penghasil α-amilase tersebut (Gupta et al., 2003). Studi pengaruh suhu terhadap aktivitas α-amilase hasil isolasi dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.8. Profil suhu-aktivitas dari α-amilase hasil isolasi diberikan dalam Gambar IV.3. Seperti diperlihatkan dalam Gambar IV.3, suhu optimum untuk aktivitas α-amilase hasil isolasi dari Vibrio sp. SFNB 3 adalah 50oC, berbeda halnya dengan α-amilase dari Vibrio sp. yang memiliki suhu optimum 60oC seperti dilaporkan oleh Najafi and Kembhavi (2005).
0 20 40 60 80 100 0 20 40 60 80 100 120 Suhu (oC) A k ti v ita s R e la ti f (% )
Gambar IV.3. Pengaruh suhu terhadap aktivitas α-amilase hasil isolasi dari Vibrio sp. SFNB 3
Hal yang menarik dari profil suhu-aktivitas untuk α-amilase hasil isolasi ini adalah rentang suhunya yang cukup lebar. Pada suhu 30, 40, dan 60oC, α-amilase hasil isolasi mempunyai aktivitas relatif yang tinggi, yaitu sebesar 91, 98, dan 88%, berturut-turut. Selain itu, α-amilase hasil isolasi mampu mempertahankan lebih dari 50% aktivitasnya pada suhu 90oC.
IV.4 Kestabilan α-Amilase Hasil Isolasi pada Suhu Optimum
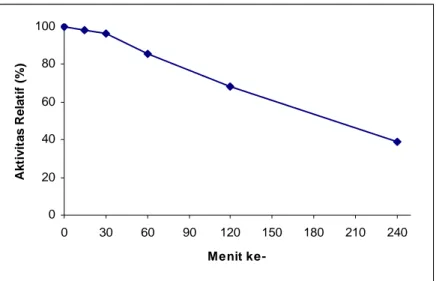
Studi kestabilan α-amilase hasil isolasi dari Vibrio sp. SFNB 3 dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.9. Dari Gambar IV.4 tampak bahwa hingga menit ke-30 α-amilase hasil isolasi mampu mempertahankan lebih dari 96% aktivitasnya. Setelah 1 jam inkubasi pada suhu optimumnya, aktivitas relatif α-amilase hasil isolasi turun menjadi 86%. Pada jam ke-2, α-amilase hasil isolasi masih mempertahankan 68% aktivitasnya, namun setelah 4 jam inkubasi α-amilase hasil isolasi kehilangan lebih dari 50% aktivitasnya. T1/2 α-amilase hasil
0 20 40 60 80 100 0 30 60 90 120 150 180 210 240 Menit ke-A k ti v ita s R e la ti f (% )
Gambar IV.4. Stabilitas α-amilase hasil isolasi dari Vibrio sp. SFNB 3 pada 50oC.
IV.5 pH Optimum α-Amilase Hasil Isolasi
Penentuan pH optimum α-amilase hasil isolasi dari Vibrio sp. SFNB 3 dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.10. Profil pH-aktivitas α-amilase hasil isolasi diberikan dalam Gambar IV.5.
0 20 40 60 80 100 0 1 2 3 4 5 6 7 8 9 10 11 pH A k ti v ita s R e la ti f (% ) 1
Gambar IV.5. Pengaruh pH terhadap aktivitas α-amilase hasil isolasi dari Vibrio sp. SFNB 3.
Dari Gambar IV.5 tampak bahwa pH optimum untuk aktivitas α-amilase hasil isolasi adalah 8. Pada pH 5, 6, dan 7, α-amilase hasil isolasi memiliki aktivitas relatif sebesar 92, 87, dan 85%, berturut-turut. Pada pH 9, α-amilase hasil isolasi masih mempertahankan 50% aktivitasnya, namun pada pH 2, 3, 4, dan 10,
α-amilase hasil isolasi kehilangan lebih dari 50% aktivitasnya. Profil pH-aktivitas dari α-amilase hasil isolasi ini menarik, karena memiliki rentang pH yang cukup lebar dan puncak yang relatif datar.
Profil pH-aktivitas dengan puncak yang datar tidak dapat dijelaskan dengan menggunakan asumsi bahwa katalisis α-amilase ditentukan oleh protonasi gugus nukleofil pada pH yang rendah dan oleh deprotonasi gugus pendonor hidrogen pada pH yang tinggi. Tahap penentu laju pada pH intermediet belum diketahui, namun diduga kuat ditentukan oleh pengikatan substrat dan pelepasan produk pada nilai pH tersebut (Nielsen et al., 2001).
IV.6 Hidrolisis Pati Mentah Jagung
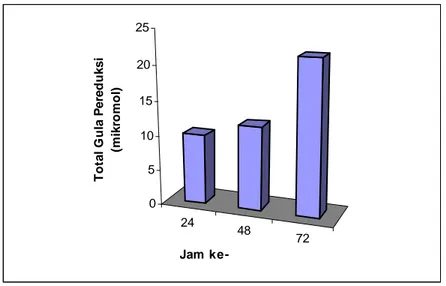
Studi hidrolisis pati mentah jagung oleh α-amilase hasil isolasi dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.11. Profil hidrolisis pati mentah jagung oleh α-amilase hasil isolasi diberikan dalam Gambar IV.6. Jumlah gula pereduksi yang dihasilkan dari hidrolisis pati mentah jagung 5% (w/v) oleh α-amilase hasil isolasi pada 37oC, 150 rpm, jam ke-24, 48, dan 72 adalah 10, 12 dan 22 mikromol, berturut-turut.
Pemindaian mikroskop elektron dari permukaan pati mentah jagung yang dihidrolisis oleh α-amilase hasil isolasi setelah inkubasi pada 37oC, 150 rpm selama 72 jam diberikan dalam Gambar IV.7. Seperti tampak dalam Gambar IV.7, permukaan granula pati mentah jagung tanpa penambahan α-amilase hasil isolasi rata tak berlubang, sedangkan permukaan granula pati mentah jagung yang diberi α-amilase hasil isolasi berlubang-lubang. Hal ini mengkonfirmasi terjadinya hidrolisis enzimatik dari pati mentah jagung oleh α-amilase hasil isolasi.
24 48 72 0 5 10 15 20 25 Tota l G u la P e re duk s i (m ikr o m o l) Jam
ke-Gambar IV.6 Profil hidrolisis pati mentah jagung 5% (w/v) oleh α-amilase hasil isolasi dari Vibrio sp. SFNB 3. Uji dilakukan pada 37oC, 150 rpm selama 24, 48, dan 72 jam.
IV.7 Mode Aksi α-Amilase Hasil Isolasi
Mode aksi α-amilase hasil isolasi dipelajari dengan cara seperti telah dijelaskan di dalam sub bab III.3.12. Pola produk hidrolisis pati oleh α-amilase hasil isolasi diberikan dalam Gambar IV.8. Seperti tampak dalam Gambar IV.8, α-amilase hasil isolasi menghidrolisis pati secara acak. Produk hidrolisis pada awal inkubasi didominasi oleh beberapa macam oligosakarida, yaitu maltotriosa (G3), maltoheksaosa (G6), dan maltoheptaosa (G7). Seiring berjalannya waktu inkubasi terjadi peningkatan produk maltosa (G2) dan glukosa (G1). Ini mengindikasikan bahwa α-amilase hasil isolasi merupakan amilase bertipe endo. Intensitas produk glukosa hingga maltoheptaosa (G1–G7) dari hidrolisis pati terlarut semakin meningkat setelah 48 jam inkubasi pada 50oC. Rentang produk hidrolisis dari pati mentah jagung oleh α-amilase hasil isolasi pada 37oC, 150 rpm adalah maltosa hingga maltoheptaosa (G2– G7). Variasi produk hidrolisis pati oleh α-amilase ditentukan oleh struktur sisi pengikatan substrat, jumlah subsisi di dalam sisi aktif, dan posisi substrat di dalam sisi aktif. Tiap subsisi di dalam sisi aktif berinteraksi dengan satu unit monomer dari substrat sehingga posisi substrat di dalam sisi aktif akan menentukan jenis produk yang dihasilkan serta frekuensi dihasilkannya produk tersebut (Kandra, 2003).
Gambar IV.7 SEM permukaan pati mentah jagung. Inkubasi dilakukan pada 37oC, 150 rpm, 72 jam tanpa penambahan α-amilase hasil isolasi (A) dan dengan penambahan α-amilase hasil isolasi (B). Skala perbesaran diindikasikan di dalam tiap gambar.
Gambar IV.8. Kromatogram produk hidrolisis oleh α-amilase hasil isolasi dari Vibrio sp. SFNB 3. G1, G2, G3, G4, G5, G6, G7 berturut-turut: glukosa, maltosa, maltotriosa, maltotetraosa, maltopentaosa, malto-heksaosa, maltoheptaosa. 1: marker, 2, 3, 4, 5, 6, 7 berturut-turut: produk hidrolisis pati terlarut menit ke-30, jam ke-1, 2, 4, 24, 48. 8, 9, 10 berturut-turut: produk hidrolisis pati mentah jagung jam ke-24, 48, 72.
IV.8 Km, Vmax dan kcat α-Amilase Hasil Isolasi
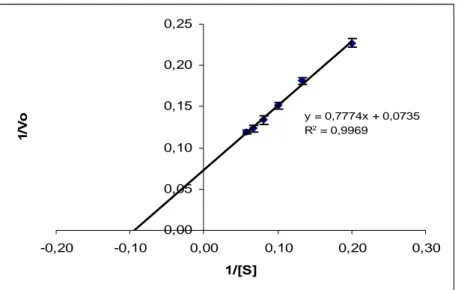
Studi kinetika α-amilase hasil isolasi dilakukan dengan cara seperti telah dijelaskan di dalam sub bab III.3.13. Hasil studi kinetika menunjukkan bahwa enzim ini mengikuti kinetika Michealis-Menten di bawah kondisi reaksi uji. Dari plot Lineweaver-Burk (Gambar IV.9) diketahui α-amilase hasil isolasi memiliki Km 10,70 mg/mL, Vmax 303 U/mL dan kcat 5 x 104 s-1.
y = 0,7774x + 0,0735 R2 = 0,9969 0,00 0,05 0,10 0,15 0,20 0,25 -0,20 -0,10 0,00 0,10 0,20 0,30 1/[S] 1/ V o
Gambar IV.9. Plot Lineweaver-Burk α-amilase hasil isolasi dari Vibrio sp. SFNB 3. Plot ini menunjukkan tipe kinetika Michealis-Menten di bawah kondisi reaksi uji.