BAB IV
HASIL DAN PEMBAHASAN
4.1
EKSTRAKSI DAN KOAGULASI PROTEIN KEDELAI
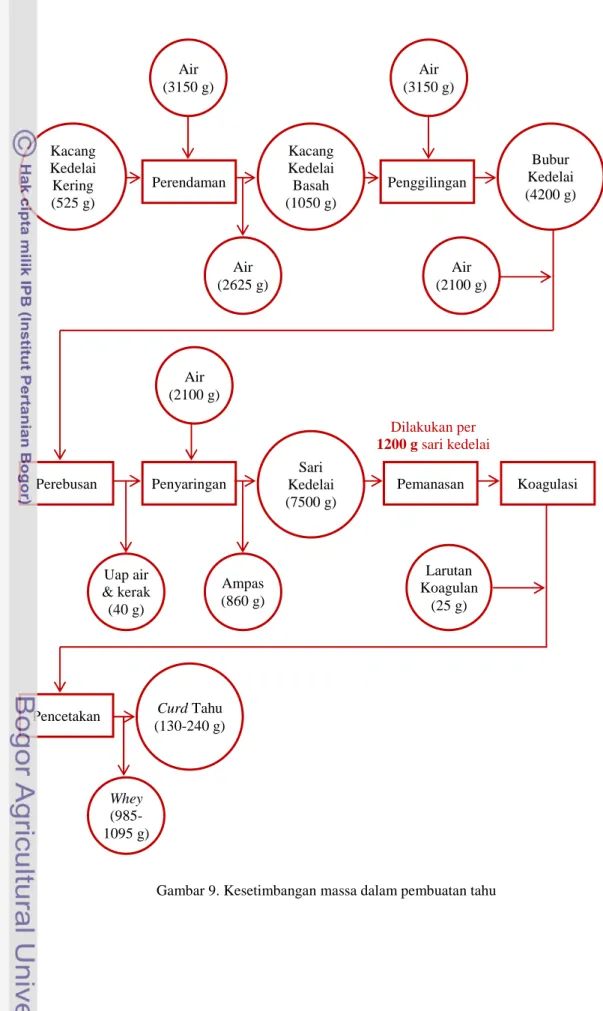
Bahan baku curd tahu adalah sari kedelai hasil ekstraksi kedelai kering yang telah direndam selama 6 jam. Setiap batch pembuatan tahu untuk penelitian tahap I menggunakan 525 gram kedelai kering. Perendaman dilakukan pada suhu ruang dengan jumlah air 3150 mL (6 kali lipat dari bobot kedelai kering). Selama perendaman, sel-sel dalam biji kedelai mengalami osmosis dan mengembang hingga massanya menjadi 1150 gram (2 kali lipat dari semula). Air rendaman kedelai berwarna kuning seperti warna whey tetapi transmittannya bernilai nol atau negatif. Pengukuran transmittan dilakukan pada panjang gelombang yang sama dengan pengukuran transmittan whey, yaitu pada gelombang λ = 595 nm. Dengan demikian dapat dipastikan bahwa air rendaman tidak mengandung protein dan proses perendaman tidak mengurangi kadar protein kedelai.
Ekstraksi didahului oleh tahap penghancuran kedelai dengan menggunakan blender. Sejumlah 3150 mL air yang bersuhu normal (tanpa pemanasan) ditambahkan untuk membantu proses penghancuran. Langkah ini dilakukan selama 3 menit dengan kecepatan yang meningkat bertahap. Penghancuran bertujuan memecah jaringan sel sehingga protein dapat diekstrak maksimal. Bubur kedelai yang dihasilkan kemudian ditambah air 2100 mL dan dipanaskan sampai mendidih. Tahap berikutnya adalah tahap ekstraksi. Bubur kedelai disaring dengan menggunakan kain blacu sebagai filter. Ampas dibilas dengan air panas yang suhunya berkisar 90-95°C sejumlah 2100 mL. Dengan demikian, total air yang ditambahkan adalah 14 kali lipat dari bobot kedelai kering. Tahap ini menghasilkan sari kedelai yang memiliki massa jenis 1 g/mL dan ampas kedelai sebanyak 810±50 gram.
Variabel proses pemanasan seperti kecepatan pengadukan, lama pemanasan, dan jeda waktu tunggu antar tahapan selama perlakuan dapat mempengaruhi karakter sari kedelai yang terbentuk. Karakter tersebut meliputi total padatan terlarut (TPT), kadar protein (yang dapat terkoagulasi), total fitat, nilai pH, total asam tertitrasi (TAT), kadar mineral, dan perbandingan jumlah protein 11S/7S (Liu et al. 2004). Maka kondisi pemasakan suspensi kedelai akan mempengaruhi titik kritis konsentrasi koagulan. Dan setiap koagulan pun memiliki titik kritis/titik optimum penambahan koagulan pada konsentrasi tertentu.
Penelitian ini mengamati proses koagulasi dengan perbedaan suhu koagulasi sari kedelai pada suhu 60ºC dan 80ºC. Untuk memperkecil variasi atribut produk tahu yang akan diukur, varibel proses pemanasan diseragamkan kecuali suhu koagulasi. Pemanasan sari kedelai untuk pembuatan tahu pres dilakukan di dalam wadah yang jenis dan ukurannya sama, serta suhu pemanasan yang sama. Pengadukan dilakukan selama pemanasan untuk mencegah suspensi berkerak dan berbusa. Kecepatan pengadukan berkisar 1 putaran per detik. Pada kedua jenis pemanasan tersebut, suhu proses terus dipantau dengan termometer untuk menciptakan suhu koagulasi yang sesuai, yaitu 60ºC dan 80ºC. Setiap koagulasi dilakukan terhadap 1.2 L sari kedelai untuk tahu press dan 12.5 mL pada skala lab pada tabung sentrifuge. Setelah suhu koagulasi 60°C atau 80°C tercapai, larutan koagulan CaSO4 dengan konsentrasi 0.015 N, 0.030 N, 0.045 N dimasukkan ke dalam wadah. Suhu diatur lebih tinggi 1°C dari target, sehingga dipastikan suhu tidak menurun terlalu besar dari suhu koagulasi target selama koagulasi berlangsung (maksimal sampai 2°C di bawah suhu target). Pengadukan dilakukan untuk meratakan koagulan dalam sari kedelai, agar seluruh protein terkoagulasi. Pengadukan dilakukan 3 kali dengan kecepatan pengadukan 2 putaran per 3 detik. Sedangkan homogenisasi
koagulan dalam tabung sentrifugasi dilakukan dengan mengocok atau membolak-balikan tabung sebanyak 3 kali dengan kecepatan 1 balikan per 2 detik.
Gambar 9. Kesetimbangan massa dalam pembuatan tahu
Whey (985-1095 g) Curd Tahu (130-240 g) Larutan Koagulan (25 g) Ampas (860 g) Uap air & kerak (40 g) Sari Kedelai (7500 g) Air (2100 g) Air (2100 g) Air (2625 g) Bubur Kedelai (4200 g) Kacang Kedelai Basah (1050 g) Kacang Kedelai Kering (525 g) Air (3150 g) Air (3150 g) Perendaman Penggilingan Penyaringan Perebusan Pemanasan Pencetakan Koagulasi Dilakukan per 1200 g sari kedelai
Koagulasi menghasilkan produk utama curd berupa padatan tahu dan produk samping berupa larutan whey. Dengan melihat diagram kesetimbangan massa tahu pada Gambar 9, jumlah curd yang semakin banyak akan diimbangi dengan jumlah whey yang semakin sedikit. Koagulasi yang berlangsung sempurna akan menghimpun protein lebih banyak ke dalam bentuk curd sehingga protein dalam whey berkurang. Kadar protein whey diinterpretasikan melalui nilai transmittan dan kadar protein whey. Maka hipotesa awal yang diambil adalah semakin tinggi nilai transmittan whey, maka kadar protein whey semakin rendah dan jumlah protein dalam curd semakin tinggi atau koagulasi berlangsung semakin sempurna.
4.1.1
Analisis terhadap Whey
Koagulasi sari kedelai menghasilkan dua bagian utama, yaitu curd dan whey. Curd adalah endapan hasil penggumpalan protein kedelai. Curd merupakan gel protein kedelai, yaitu matriks protein yang mampu mengikat air, sehingga tahu (curd kedelai) tergolong produk pangan semisolid basah. Sedangkan whey adalah larutan yang tersisa dari sari kedelai setelah curd diambil. Whey terdiri dari komponen organik larut air, seperti protein, asam amino yang berbobot molekul kecil serta beberapa lemak dan pati berbobot molekul rendah yang diasimilasi oleh pengemulsi alami yang terdapat dalam kedelai, yaitu lesitin.
Koagulasi yang sempurna telah tercapai jika curd telah terpisah dan terlihat jelas batas koagulasinya. Adapun parameter/respon yang dapat diukur untuk menyatakan keberhasilan proses koagulasi antara lain nilai transmittan whey, volume whey dan rendemen tahu, nilai pH, dan komposisi protein tahu. Dari parameter-parameter tersebut, titik optimum koagulasi dapat ditentukan, khususnya terkait dengan konsentrasi koagulan optimum (Shurtleff & Aoyagi 1979).
Gambar 10. Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap nilai transmitan whey
Perbedaan komponen terlarut dalam whey mengakibatkan perbedaan kemampuan larutan whey untuk meneruskan gelombang cahaya. Sifat ini divisualisasikan sebagai kejernihan larutan. Semakin sedikit konsentrasi partikel dalam larutan, semakin jernih larutan, semakin banyak gelombang cahaya
3.19 8.30 23.52 6.12 10.47 19.30 0.00 5.00 10.00 15.00 20.00 25.00 0.015 0.030 0.045 T ra n sm it a n W h ey Konsentrasi CaSO4(N) Suhu koagulasi 60°C Suhu koagulasi 80°C
yang dapat diteruskan, yang diinterpretasi melalui nilai transmitan pada panjang gelombang 400 nm, yang dapat dilihat pada Gambar 10. Pada taraf signifikasi 0.05, perubahan konsentrasi koagulan memberikan efek yang nyata terhadap transmittan whey, namun tidak dengan perubahan suhu koagulasi. Dan adanya interaksi antara konsentrasi koagulan dan suhu koagulasi memberikan efek yang juga nyata terhadap transmittan whey (metode analisis varian data analisis whey beserta langkah perhitungannya dapat dilihat pada Lampiran 2 sampai Lampiran 4). Dari Gambar 10, terlihat bahwa transmitan meningkat sejalan dengan peningkatan konsentrasi koagulan CaSO4. Transmittan tertinggi dicapai oleh whey yang dibentuk oleh konsentrasi 0.045 N. Suhu 80°C memberikan nilai transmittan lebih tinggi daripada suhu 60°C, tetapi tidak pada konsentrasi 0.045 N.
Mulanya nilai transmittan dianggap dapat merepresentasikan kadar protein di dalam whey, tetapi data melalui Gambar 11 menunjukkan hasil yang tidak sejalan. Kurva pada Gambar 10 menunjukkan kecenderungan yang positif dari pengaruh konsentrasi koagulan terhadap nilai transmittan whey. Semakin tinggi konsentrasi koagulan, semakin tinggi nilai transmittan whey. Namun, setelah diklarifikasi dengan pengukuran kadar protein dalam whey, perubahan konsentrasi tidak selamanya memberikan pengaruh positif. Sementara itu, suhu kogulasi yang diasumsikan dapat meningkatkan optimasi koagulasi protein yang akan berdampak pada menurunnya kadar protein whey, tidak sejalan dengan data dari Gambar 11. Suhu yang lebih tinggi justru memberikan kadar protein yang lebih tinggi pula. Oleh sebab itu, transmitan whey ini belum dapat mewakili jumlah protein terkandung dalam whey. Semakin tinggi transmitan belum tentu mengartikan semakin rendah protein
whey. Hal ini disebabkan oleh kehadiran partikel selain protein globular, yakni asam amino larut air,
lemak, dan karbohidrat, yang dapat menghalangi cahaya diteruskan.
Gambar 11. Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap jumlah protein whey
Pada taraf signifikasi 0.05, perubahan konsentrasi koagulan, perubahan suhu koagulasi, serta interaksi antara konsentrasi koagulan dan suhu koagulasi memberikan efek yang nyata terhadap kadar protein whey (analisis varian dapat dilihat pada Lampiran 5 dan Lampiran 6). Gambar 11 menunjukkan adanya titik konsentrasi CaSO4 tertentu di antara rentang 0.015-0.045 N yang memberikan kadar protein terendah yang diinginkan. Karena jika kadar protein dalam whey rendah,
0.544 0.390 0.743 0.541 0.448 0.806 0.000 0.200 0.400 0.600 0.800 1.000 0.015 0.030 0.045 P ro te in (m g /m l) Konsentrasi CaSO4(N) Suhu koagulasi 60°C Suhu koagulasi 80°C
keberhasilan koagulasi protein menjadi curd semakin tinggi. Konsentrasi koagulan tersebut dapat dinyatakan sebagai konsentrasi koagulan optimum [optimum coagulant concentration (OCC)] yang akan membentuk curd yang maksimal dan mengurangi protein whey yang terbentuk. Semakin optimum pembentukan gel curd, semakin rendah jumlah protein yang terdapat dalam whey. Dari Gambar 11 terlihat bahwa kondisi ini ditunjukkan ketika curd dibuat dengan penambahan koagulan CaSO4.H2O 0.030 N baik pada suhu 60°C maupun 80°C.
Koagulasi yang dilakukan oleh CaSO4 pada konsentrasi optimum diharapkan mencapai proses koagulasi mendekati sempurna. Sun & Breene (1991) menambahkan bahwa selesainya proses koagulasi ditandai dengan bebasnya whey dari partikel yang kemudian terendapkan kembali jika whey didiamkan. Jika diamati secara kasat mata, semakin rendah konsentrasi koagulan dan semakin rendah suhu koagulasi, semakin banyak partikel terendapkan setelah whey didiamkan. Endapan tersebut menyerupai gel tahu dan bersifat irreversible (tidak dapat larut kembali). Partikel tersebut adalah protein globular yang belum terkoagulasi. Lama koagulasi yang dilakukan adalah seragam 10 menit. Jika koagulasi diperlama, jumlah curd akan semakin banyak setelah dilakukan pengepressan, dan jumlah protein dalam whey akan semakin sedikit.
Grafik pada Gambar 12 berikut menunjukkan korelasi antara nilai transmittan whey dan jumlah protein dalam whey. Pada taraf signifikasi 0.05, kedua variabel tersebut memiliki nilai korelasi Pearson = 0.7656 dengan persamaan Yx = 0.3919 + 0.0158 Xj (analisis regresi linier dapat dilihat pada Lampiran 6). Nilai korelasinya berada pada selang 0.70-1.00 yang menandakan bahwa transmittan dan kadar protein whey memiliki keterkaitan yang kuat. Rendahnya transmittan whey pada konsentrasi 0.045 N (whey C) yang tidak diimbangi dengan rendahnya konsentrasi protein, dapat disebabkan oleh adanya partikel lain yang mengganggu jalannya cahaya seperti asam amino larut air, lemak, dan karbohidrat. Jumlah partikel tersebut lebih banyak dari protein globular yang ada, sehingga jika whey didiamkan partikel terendapkan tetap paling sedikit dibandingkan koagulasi pada konsentrasi yang lebih rendah. Dan pada konsentrasi 0.030 N, nilai transmittan masih rendah tetapi kadar proteinnya terendah dan jumlah partikel terendapkan masih lebih banyak dari yang whey C. Hal ini disebabkan oleh masih adanya protein globular dalam whey. Untuk mendapatkan informasi lebih jelas mengenai hal tersebut, perlu dilakukan analisis komponen organik whey lebih lanjut. Namun curd memiliki kemampuan mengikat air yang baik, sehingga partikel lain yang larut air seperti asam amino larut air, lemak, dan karbohidrat ikut terendapkan bersama curd.
Gambar 12. Grafik hubungan antara transmitan whey dan jumlah protein whey 0.200 0.400 0.600 0.800 1.000 0.00 5.00 10.00 15.00 20.00 25.00 P ro te in (m g /m l) Transmitan
Selain sifat fisik protein yang dapat diukur dengan analisis transmittan dan kadar protein berdasarkan kemampuannya menahan partikel cahaya, molekul protein memiliki sifat fisikokimia yng khas yakni protein memiliki gugus fungsi bermuatan positif dan negatif dalam satu molekulnya, yang kemudian disebut molekul zwitter ion. Perbedaan besar muatan menimbulkan kekuatan ionik yang mempengaruhi kestabilan molekul dalam larutan. Kekuatan ionik molekul protein tersebut dapat direpresentasikan oleh nilai pH larutan. Muatan total protein dapat bernilai positif, negatif, ataupun netral, yang dipengaruhi oleh nilai pH larutan. Nilai pH yang menjadi acuan untuk menentukan nilai muatan total protein disebut titik isoelektrik (pI).
Kitchener (1968) mengutarakan bahwa titik isoelektrik merupakan keadaan pH suspensi protein dengan muatan total protein yang bernilai nol dan gaya tolak elektrostatik antar koloid protein yang bernilai minimun. Di titik ini, interkasi antarmolekul yang dominan adalah gaya van der Waals. Suspensi akan mengalami flokulasi/ pengendapan dan berubah menjadi sistem koloid liofobik. Pada titik ini pula, proses koagulasi terjadi. Namun, jika pH larutan berada di bawah pI, protein bermuatan total positif. Muatan positif protein berasal dari ion NH4+ yang tersisa, karena gugus karbolsilat COO -telah berikatan dengan ion H+ yang melimpah. Sedangkan jika pH larutan berada di atas pI, protein bermuatan total negatif. Muatan negatif protein berasal dari ion COO- yang tersisa, karena gugus amino NH4
+
telah berikatan dengan ion OH- yang lebih banyak.
Koagulasi sari kedelai dengan koagulan CaSO4 berlangsung pada kisaran pH asam. Hal ini ditunjukkan oleh nilai pH whey yang terbentuk seperti pada Tabel 10. Data tersebut dapat mewakili kondisi pH koagulasi karena pengukuran whey segar dilakukan segera setelah curd tahu dipress. Tabel 10 menunjukkan bahwa koagulasi terjadi pada rentang pH 5.70-5.90 dengan nilai pH yang tidak berbeda nyata, di bawah pH netral. Pada taraf signifikasi 0.05, baik perubahan konsentrasi koagulan, perubahan suhu koagulasi, maupun interaksi antara konsentrasi koagulan dan suhu koagulasi tidak memberikan efek yang nyata terhadap nilai pH whey (analisis varian dapat dilihat pada Lampiran 7 dan Lampiran 8). Kondisi asam dapat meningkatkan daya tarik molekul protein terhadap ion positif dari koagulan CaSO4. Menurut Moizuddin (1999), dalam larutan, gugus fungsi anion protein memiliki afinitas terhadap kation Ca2+ dan H+. Nilai konsentrasi H+ yang besar yang menghasilkan nilai pH di antara 3 dan 7, akan menghasilkan ikatan Ca-protein yang banyak. Sehingga dengan kata lain, semakin tinggi jumlah H+ semakin rendah nilai pH, maka afinitas molekul protein terhadap ion Ca2+ semakin tinggi. Sementara ion SO42- akan berikatan dengan gugus bermuatan positif dari komponen organik (termasuk protein dalam sari kedelai). Peningkatan afinitas tersebut akan menurun setelah semua molekul protein terkoagulasi.
Tabel 10. Nilai pH whey yang terpisah dari curd
Kosentrasi CaSO4 (N) Suhu Koagulasi (ºC) 60 80 0.015 5.72 5.85 0.030 5.76 5.85 0.045 5.90 5.79
Menurut Tay & Perera (2004), kondisi pH koagulasi yang sama akan menghasilkan sifat fisik curd yang sama, antara lain tekstur, penampakan visual, dan water holding capacity (WHC). Perbedaan pH di akhir pemberntukan gel akan mempengaruhi perbandingan jumlah protein 11S dalam gel. Proporsi protein 11S yang lebih tinggi akan membuat gel memiliki nilai kekerasan, kohesivitas, daya kunyah, dan kecerahan (L*) yang lebih tinggi. Protein globulin 7S memiliki titik isoelektrik yang lebih rendah (pH 4.5-5.0) daripada globulin 11S (pH 6.3-7.0) (Brooks & Morr 1985).
4.1.2
Pengaruh Parameter Proses
4.1.2.1
Konsentrasi Koagulan
Perubahan konsentrasi memberikan efek nyata baik terhadap nilai transmittan maupun kadar protein whey. Dengan pengamatan visual dan analisis whey tersebut, kisaran konsentrasi koagulan dan suhu koagulasi yang optimum dapat diketahui. Grafik pada Gambar 10, Gambar 11, dan Gambar 12 menunjukkan bahwa proses koagulasi yang optimum terjadi ketika sari kedelai dikoagulasi oleh koagulan dengan kisaran konsentrasi CaSO4 0.030 N. Pada daerah tersebut, terdapat nilai transmittan
whey yang lebih tinggi dan konsentrasi protein whey terendah. Hal tersebut menggambarkan bahwa
protein dalam sari kedelai hampir seluruhnya terkoagulasi oleh koagulan sehingga protein yang terlarut dalam whey tersisa sedikit. Dua variabel ini dapat diketahui secara tidak langsung dengan pengamatan visual. Whey yang dihasilkan pada rentang ini lebih jernih dan tidak mengandung banyak partikel protein globular. Hal tersebut ditandai oleh lebih sedikitnya pengendapan partikel-partikel tersebut dalam 30 menit setelah pengepresan.
Koagulasi protein yang optimum secara umum terjadi pada titik isoelektrik (pI). Protein globulin 7S memiliki titik isoelektrik yang lebih rendah (pH 4.5-5.0) daripada globulin 11S (pH 6.3-7.0) (Brooks & Morr 1985). Dan dalam kedelai termasuk sari kedelai, jumlah protein globulin 11S lebih banyak dari protein globulin 7S. Titik ini direpresentasikan oleh nilai pH koagulasi. Karena keterbatasan alat pH meter yang tidak dapat mengukur pH pada suhu tinggi (lebih tinggi dari suhu ruang) seperti suhu koagulasi yang dilakukan, nilai pH koagulasi diamati dari nilai pH whey yang terbentuk. Meskipun tidak signifikan, peningkatan konsentrasi memberikan nilai pH yang semakin dekat dengan pI globulin 11S, sehingga diasumsikan jumlah protein terkoagulasi semakin banyak yang dibuktikan dengan analisis kadar protein curd. Peningkatan nilai pH juga berpengaruh terhadap kekuatan ionik protein. Semakin dekat dengan pH 7, afinitas protein globulin 11S dengan ion Ca semakin tinggi, sehingga selain meningkatkan jumlah protein terikat, proses koagulasi pun berlangsung lebih cepat. Keadaan ini pun akan menurunkan jumlah partikel-partikel makro dalam
whey yang akan terflokulasi kemudian.
4.1.2.2
Suhu Koagulasi
Interaksi antara konsentrasi koagulan dan suhu koagulasi memberikan efek yang nyata terhadap transmittan dan kadar protein, tetapi tidak pada pH whey. Sedangkan perubahan suhu koagulasi tersendiri memberikan efek yang nyata terhadap kadar protein whey, tetapi tidak terhadap nilai transmittan dan pH whey. Suhu koagulasi berpengaruh terhadap kinetika molekul-molekul yang bereaksi meliputi molekul CaSO4 dam protein globular. Peningkatan suhu meningkatkan energi kinetik molekul sehingga rekasi berjalan lebih cepat (kecepatan reaksi lebih tinggi). Oleh sebab itu
waktu koagulasi pada suhu 80°C lebih cepat dari pada suhu 60°C. Whey yang dihasilkan lebih jernih dan memiliki transmittan yang lebih tinggi (kecuali pada konsentrasi CaSO4 0.045 N). Pada suhu 60°C, waktu 10 menit untuk koagulasi masih belum cukup. Dengan demikian, pada suhu yang lebih tinggi (80°C), probabilitas kondisi optimum koagulasi lebih besar. Suhu yang lebih rendah (60°C) membutuhkan usaha lebih banyak untuk mencapai hasil maksimal. Sehingga, konsentrasi koagulan lebih tinggi (sampai dekat dengan nilai pI) tetap membutuhkan waktu koagulasi yang lebih lama.
Untuk memastikan denaturasi dan agregasi semua subunit protein pada waktu yang bersamaan, dilakukan pengadukan sebanyakan tiga kali sesaat setelah koagulan dimasukkan ke dalam suspensi kedelai. Homogenisasi ini diperlukan karena koagulan CaSO4.H2O akan terdispersi perlahan di dalam sari kedelai sehingga memberikan waktu koagulasi yang lambat (Shurtleff & Aoyogi 1984). Lama koagulasi pada data yang ditampilkan adalah 10 menit. Namun, dengan waktu 10 menit koagulasi pada suhu 60°C konsentrasi 0.015 N dan 0.030 N serta pada suhu 80°C konsentrasi 0.015 N, koagulasi yang terjadi masih belum sempurna. Hal tersebut ditandai dengan peerbedaan penampakan
whey sebelum dan sesudah pengepresan. Pada suhu rendah (60°C) dan konsentrasi rendah (0.015 N),
sebelum pengepresan, whey tampak seperti suspensi susu. Jika didiamkan selama 30 menit berikutnya, akan terlihat endapan seperti tahu yang menandakan proses koagulasi lanjutan setelah pemisahan curd untuk dicetak. Kemudian, selama pengepreasan, whey yang terbentuk lebih bening transparan seperti whey pada umumnya. Data menunjukkan bahwa proses koagulasi pada suhu 60°C memiliki nilai transmittan whey lebih rendah dan jumlah protein whey yang lebih tinggi.
4.2
PROFIL PROTEIN CURD
4.2.1
Ekstraksi
Koagulasi curd merupakan fenomena pembentukan ikatan hidrogen antar rantai polipeptida, di samping ikatan intermolekul lain yang kekuatannya lebih kecil, sehingga membentuk agregat curd. Koagulasi akan semakin terjadi jika ditambahkan koagulan yang mengandung ion yang memiliki afinitas tinggi terhadap gugus fungsi protein, seperti ion Ca2+. Kumpulan protein yang terkumpul tersebut kemudian dianalisis untuk mengetahui komposisi subunit protein yang berpengaruh terhadap tekstur. Oleh karena itu dibutuhkan proses ekstraksi protein yang dapat memutus ikatan SS dan ikatan Ca-protein. Adapun contoh senyawa pereduksi ikatan sulfida antara lain sistein, 2-merkaptoetanol, Na2SO3 (sodium sulfit)dan dithiotreitol (DTT). Senyawa 2-merkaptoetanol dipilih karena memiliki kemampuan paling besar untuk memutuskan ikatan SS dan dengan pertimbangan ketersediaan bahan.
Senyawa 2-merkaptoetanol (2-ME) berperan sebagai pemutus ikatan sulfida antara subunit asam (A) dan subunit basa (B) pada glisinin. Disosiasi ikatan sulfida dapat dioptimalisasi dengan mengkondisikan pH larutan, kekuatan ionik, dan suhu proses (Peng et al. 1984). Dengan analisis ultrasentrifugal, kekuatan ionik yang rendah yaitu dengan konsentrasi 2-ME 0.5-0.03 M pada kondisi asam (pH 3.8), glisinin (globulin 11S) mulai muncul dalam fraksi globulin 7S (Lakemond et al. 2000). Dan dengan kekuatan ionik 0.03 M 2-ME pada kondisi sedikit basa (pH 8.6), glisinin mulai terdisosiasi menjadi unit yang lebih kecil yang muncul dalam fraksi 7S dan 2S (Eldridge & Wolf 1967, Koshiyama 1972, Lakemond et al. 2000).
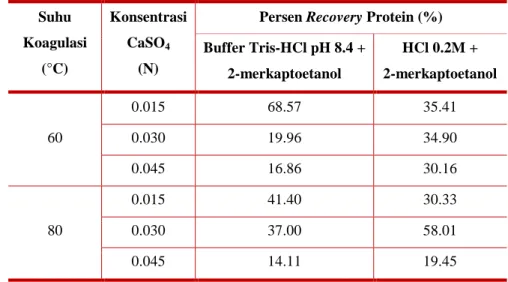
Beberapa protein memiliki afinitas yang tinggi terhadap ion, seperti pada ikatan Ca-protein pada proses koagulasi protein kedelai oleh garam sulfat dihidrat. Kehadiran garam dan interaksi ionik tersebut dapat menurunkan efisiensi ekstraksi protein dan mengganggu jalannya elektroforesis protein selanjutnya. Persen protein terekstrak dari kadar protein Kjeldahl, yang disebut dengan persen
recovery, menurun seiring meningkatnya konsentrasi CaSO4 sebagai koagulan, seperti yang dapat dilihat pada Tabel 11 (data terperinci dapat dilihat pada Lampiran 9). Antisipasi yang dapat dilakukan adalah dengan menghadirkan ion kelator atau melakukan denaturasi sebagai perlakuan awal (Rabiloud 1996).
Tabel 11. Perbandingan ekstraksi protein dengan 2-ME dan HCl
Suhu Koagulasi (°C) Konsentrasi CaSO4 (N)
Persen Recovery Protein (%) Buffer Tris-HCl pH 8.4 + 2-merkaptoetanol HCl 0.2M + 2-merkaptoetanol 60 0.015 68.57 35.41 0.030 19.96 34.90 0.045 16.86 30.16 80 0.015 41.40 30.33 0.030 37.00 58.01 0.045 14.11 19.45
Pemutusan ikatan Ca-protein juga dapat dilakukan dengan pengasaman. Data pada Tabel 11 menunjukkan bahwa ektraksi protein dengan HCl 0.2 M dan 2-ME dapat meningkatkan persen
recovery protein, kecuali untuk curd yang dikoagulasi CaSO4 0.015 N pada 60°C dan 80°C, serta 0.045 N pada 80°C. Selain efektifitas pengasaman hanya efektif pada konsentrasi dan suhu tertentu, pengasaman juga akan mengganggu distribusi molekul protein dalam gel elektroforesis. Oleh karena itu, untuk mendenaturasi ikatan antara Ca dan polipeptida protein, ekstraksi protein tetap menggunakan buffer tris pH 8.4 + 2-ME dengan pemanasan pada suhu 80°C selama 1 jam. Dan untuk mengoptimalkan hasil ekstraksi, ekstraksi pun diulang sebanyak 3 kali dan dilakukan homogenisasi dengan vortex selama 1 menit berkala setiap 20 menit selama pemanasan.
Sehubungan dengan syarat kondisi keasaman larutan untuk masuk ke dalam sumur elektroforesis yang mengharuskan larutan ber-pH basa, maka metode ekstraksi protein terpilih adalah ekstraksi dalam kondisi basa buffer Tris-HCl pH 8.4 yang mengandung 2-ME 0.02 M. Jika ektraksi dilakukan dalam kondisi asam, larutan sampel akan tersebar dalam gel separasi dan tidak membentuk barisan pita yang teratur. Walaupun dilakukan pembasaan ekstrak protein dengan penambahan NaOH, larutan sampel tetap menyebar tidak beraturan ke semua sumur gel.
4.2.2
Profil Protein dengan Teknik Elektroforesis
Penggunaan sodium dodesil sulfat (SDS) dan merkaptoetanol disertai dengan pemanasan telah memecah struktur tiga dimensi dari protein, terutama ikatan disulfida menjadi subunit-subunit polipeptida secara individual. Wijaya & Rohman 2001 memaparkan bahwa SDS juga membungkus rantai protein yang tidak terikat dengan muatan negatif yang sama membentuk kompleks SDS-protein. Kompleks SDS-protein mempunyai densitas muatan yang identik dan bergerak pada gel
hanya berdasarkan ukuran protein. Kompleks SDS yang lebih rendah dibandingkan dengan kompleks yang l
kerapatan partikel gel yang menghambat mobilitas protein. Berurut
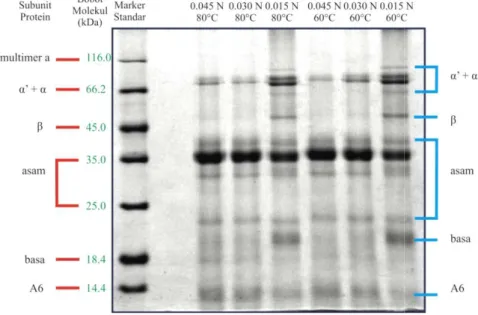
subunit protein dari berbobot molekul terbesar sampai terkecil, seperti yang ditunjukkan pada 13.
Gambar 13. Profil protein curd hasil SDS
et al. 2006 dan
Intensitas pita-pita yang terdapat pada gel protein menandakan konsentrasi subunit protein yang terdeteksi. Intensitas
menghasilkan visualisasi seperti pada
bobot molekul tertentu. Bobot molekulnya diverisfikasi sesuai dengan bobot molekul marker st Lebar kurva menandakan ketebalan pita yang tampak. Dan dengan garis dasar yang sama pada setiap kurva, luas daerah di bawah kurva yang dibatasi oleh garis dasar dihitung sebagai konsentrasi subunit protein yang dicari.
Setiap sampel curd
pita direpresentasikan oleh luas area dibawah kurva setiap puncak. Data hasil pembacaan luas area tersebut divisualisasikan ke dalam grafik pada
analisis terperinci mengenai bobot molekul dan kadar masing Lampiran 10. Gambar 15
perubahan konsentrasi koagulan yang terdiri dari subunit perubahan kadar subunit protein 11S ditampilkan oleh yang dapat dilihat pada Gambar 16
curd adalah subunit asam dari glis
proporsi protein 11S/7S akibat perubahan konsentrasi koagulan.
hanya berdasarkan ukuran protein. Kompleks SDS-protein yang lebih besar mempunyai mobilitas yang lebih rendah dibandingkan dengan kompleks yang lebih kecil. Hal tersebut disebabkan oleh kerapatan partikel gel yang menghambat mobilitas protein. Berurut-turut dari atas ke bawah adalah subunit protein dari berbobot molekul terbesar sampai terkecil, seperti yang ditunjukkan pada
ofil protein curd hasil SDS-PAGE (diidentifikasi berdasarkan hasil penelitian Poysa 2006 dan Yasir et al. 2006)
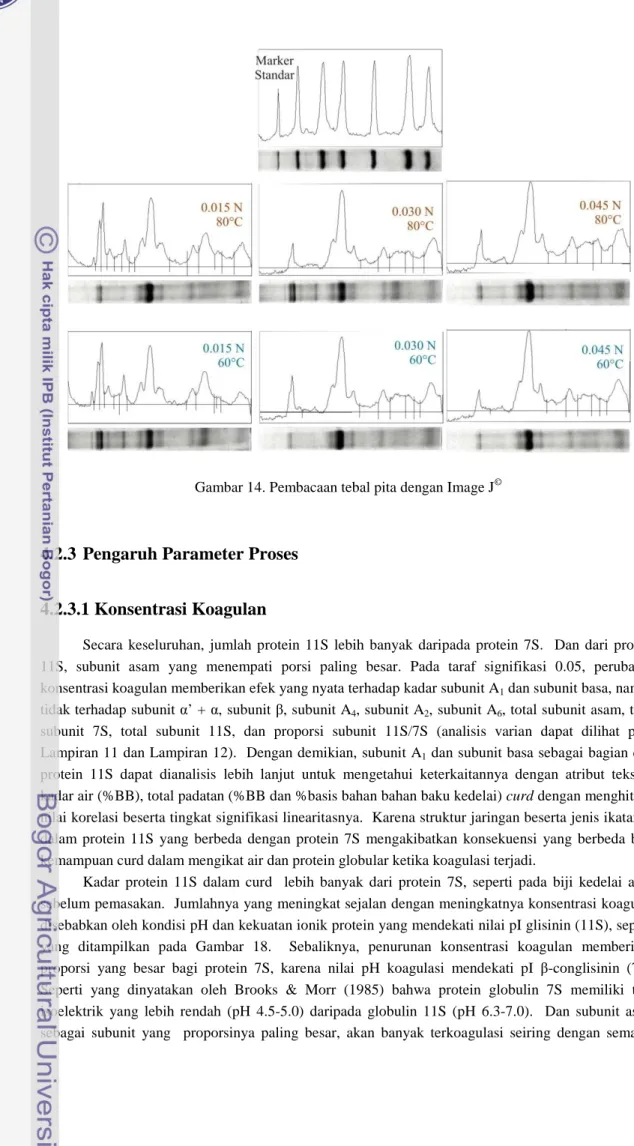
pita yang terdapat pada gel protein menandakan konsentrasi subunit protein Intensitas pita tersebut diolah dengan menggunakan program Image J
menghasilkan visualisasi seperti pada Gambar 14. Puncak kurva menandakan subunit protein dengan bobot molekul tertentu. Bobot molekulnya diverisfikasi sesuai dengan bobot molekul marker st Lebar kurva menandakan ketebalan pita yang tampak. Dan dengan garis dasar yang sama pada setiap kurva, luas daerah di bawah kurva yang dibatasi oleh garis dasar dihitung sebagai konsentrasi subunit
curd memberikan jenis dan konsentrasi subunit protein yang berbeda. Ketebalan
pita direpresentasikan oleh luas area dibawah kurva setiap puncak. Data hasil pembacaan luas area tersebut divisualisasikan ke dalam grafik pada Gambar 15-Gambar 18 selanjutnya. Sedangkan h analisis terperinci mengenai bobot molekul dan kadar masing-masing subunit dapat dilihat pada
Gambar 15 secara khusus memperlihatkan perubahan kadar subunit protein 7S akibat perubahan konsentrasi koagulan yang terdiri dari subunit α’ + α dan subunit basa. Sedangkan perubahan kadar subunit protein 11S ditampilkan oleh Gambar 16 dan Gambar 17
Gambar 16 dan Lampiran 10, subunit protein terbanyak dari semua sampel adalah subunit asam dari glisinin (globulin 11S). Dan Gambar 18 menampilkan perubahan proporsi protein 11S/7S akibat perubahan konsentrasi koagulan.
protein yang lebih besar mempunyai mobilitas . Hal tersebut disebabkan oleh turut dari atas ke bawah adalah subunit protein dari berbobot molekul terbesar sampai terkecil, seperti yang ditunjukkan pada Gambar
PAGE (diidentifikasi berdasarkan hasil penelitian Poysa
pita yang terdapat pada gel protein menandakan konsentrasi subunit protein pita tersebut diolah dengan menggunakan program Image J© sehingga . Puncak kurva menandakan subunit protein dengan bobot molekul tertentu. Bobot molekulnya diverisfikasi sesuai dengan bobot molekul marker standar. Lebar kurva menandakan ketebalan pita yang tampak. Dan dengan garis dasar yang sama pada setiap kurva, luas daerah di bawah kurva yang dibatasi oleh garis dasar dihitung sebagai konsentrasi subunit
n jenis dan konsentrasi subunit protein yang berbeda. Ketebalan pita direpresentasikan oleh luas area dibawah kurva setiap puncak. Data hasil pembacaan luas area selanjutnya. Sedangkan hasil masing subunit dapat dilihat pada secara khusus memperlihatkan perubahan kadar subunit protein 7S akibat dan subunit basa. Sedangkan Gambar 17. Berdasarkan data dan Lampiran 10, subunit protein terbanyak dari semua sampel menampilkan perubahan
Gambar 14. Pembacaan tebal pita dengan Image J©
4.2.3
Pengaruh Parameter Proses
4.2.3.1
Konsentrasi Koagulan
Secara keseluruhan, jumlah protein 11S lebih banyak daripada protein 7S. Dan dari protein 11S, subunit asam yang menempati porsi paling besar. Pada taraf signifikasi 0.05, perubahan konsentrasi koagulan memberikan efek yang nyata terhadap kadar subunit A1 dan subunit basa, namun tidak terhadap subunit α’ + α, subunit β, subunit A4, subunit A2, subunit A6, total subunit asam, total subunit 7S, total subunit 11S, dan proporsi subunit 11S/7S (analisis varian dapat dilihat pada Lampiran 11 dan Lampiran 12). Dengan demikian, subunit A1 dan subunit basa sebagai bagian dari protein 11S dapat dianalisis lebih lanjut untuk mengetahui keterkaitannya dengan atribut tekstur, kadar air (%BB), total padatan (%BB dan %basis bahan bahan baku kedelai) curd dengan menghitung nilai korelasi beserta tingkat signifikasi linearitasnya. Karena struktur jaringan beserta jenis ikatan di dalam protein 11S yang berbeda dengan protein 7S mengakibatkan konsekuensi yang berbeda bagi kemampuan curd dalam mengikat air dan protein globular ketika koagulasi terjadi.
Kadar protein 11S dalam curd lebih banyak dari protein 7S, seperti pada biji kedelai awal sebelum pemasakan. Jumlahnya yang meningkat sejalan dengan meningkatnya konsentrasi koagulan disebabkan oleh kondisi pH dan kekuatan ionik protein yang mendekati nilai pI glisinin (11S), seperti yang ditampilkan pada Gambar 18. Sebaliknya, penurunan konsentrasi koagulan memberikan proporsi yang besar bagi protein 7S, karena nilai pH koagulasi mendekati pI β-conglisinin (7S). Seperti yang dinyatakan oleh Brooks & Morr (1985) bahwa protein globulin 7S memiliki titik isoelektrik yang lebih rendah (pH 4.5-5.0) daripada globulin 11S (pH 6.3-7.0). Dan subunit asam sebagai subunit yang proporsinya paling besar, akan banyak terkoagulasi seiring dengan semakin
basanya larutan atau meningkatnya pH larutan, yaitu dengan meningkatkan kosentrasi koagulan CaSO4. Dengan demikian, konsentrasi optimum koagulasi pada 0.030-0.045 N memberikan porsi protein 11 S yang paling besar, khususnya subunit asam glisinin.
4.2.3.2
Suhu Koagulasi
Secara keseluruhan pada taraf signifikasi 0.05, baik perubahan suhu koagulasi maupun interaksi antara konsentrasi koagulan dan suhu koagulasi tidak memberikan efek yang nyata terhadap kadar semua subunit protein dalam curd. Suhu koagulasi hanya mempengaruhi kecepatan koagulasi subunit-subunit protein tersebut. Jika dibandingkan dengan protein 7S, gelasi protein 11S lebih cepat. Hashizume (1975) membuktikan fenomena tersebut lewat struktur jaringan gel (SEM) globulin 7S yang lebih halus daripada protein 11S. Kenaikan suhu meningkatkan energi kinetik molekul sehingga rekasi berjalan lebih cepat. Akan tetapi, jika pengamatan perubahan kadar masing-masing subunit dilakukan per perlakuan suhu, terlihat bahwa kedua nilai suhu koagulasi memberikan trend perubahan kadar subunit yang tidak selalu sama.
(A) (B)
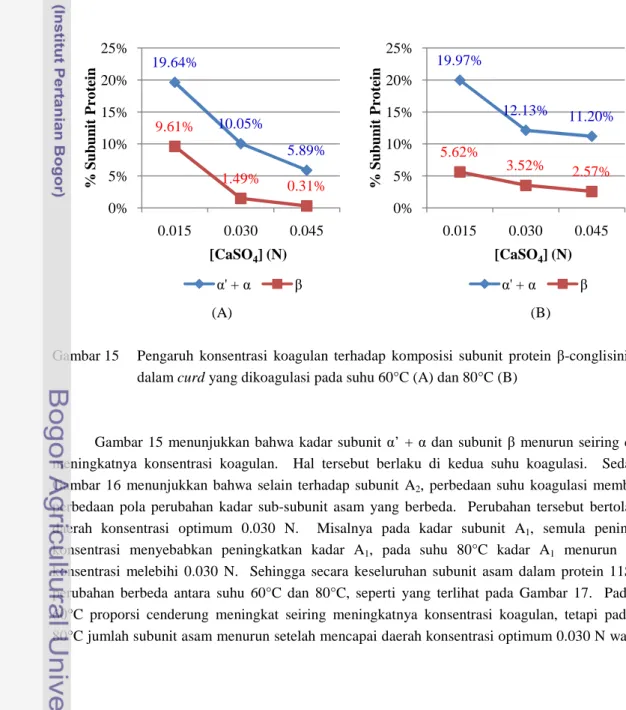
Gambar 15 Pengaruh konsentrasi koagulan terhadap komposisi subunit protein β-conglisinin (7S) dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B)
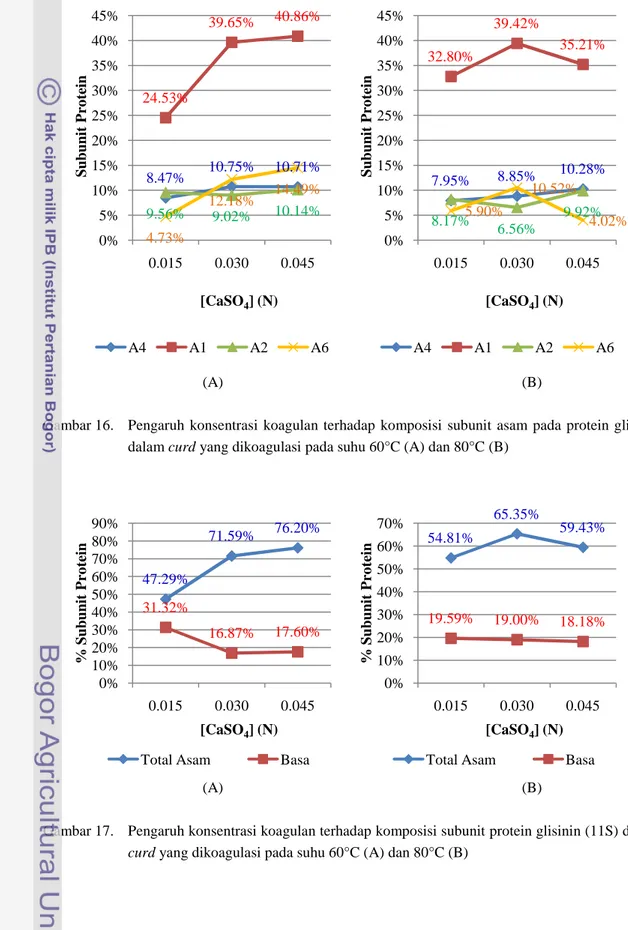
Gambar 15 menunjukkan bahwa kadar subunit α’ + α dan subunit β menurun seiring dengan meningkatnya konsentrasi koagulan. Hal tersebut berlaku di kedua suhu koagulasi. Sedangkan Gambar 16 menunjukkan bahwa selain terhadap subunit A2, perbedaan suhu koagulasi memberikan perbedaan pola perubahan kadar sub-subunit asam yang berbeda. Perubahan tersebut bertolak dari daerah konsentrasi optimum 0.030 N. Misalnya pada kadar subunit A1, semula peningkatan konsentrasi menyebabkan peningkatkan kadar A1, pada suhu 80°C kadar A1 menurun setelah konsentrasi melebihi 0.030 N. Sehingga secara keseluruhan subunit asam dalam protein 11S, pola perubahan berbeda antara suhu 60°C dan 80°C, seperti yang terlihat pada Gambar 17. Pada suhu 60°C proporsi cenderung meningkat seiring meningkatnya konsentrasi koagulan, tetapi pada suhu 80°C jumlah subunit asam menurun setelah mencapai daerah konsentrasi optimum 0.030 N walaupun
19.64% 10.05% 5.89% 9.61% 1.49% 0.31% 0% 5% 10% 15% 20% 25% 0.015 0.030 0.045 % S u b u n it P ro te in [CaSO4] (N) α' + α β 19.97% 12.13% 11.20% 5.62% 3.52% 2.57% 0% 5% 10% 15% 20% 25% 0.015 0.030 0.045 % S u b u n it P ro te in [CaSO4] (N) α' + α β
masih lebih besar dari 0.015 N. Sedangkan peningkatan konsentrasi koagulan menyebabkan kadar subunit basa dalam protein 11S sama-sama cenderung menurun di kedua suhu koagulasi.
(A) (B)
Gambar 16. Pengaruh konsentrasi koagulan terhadap komposisi subunit asam pada protein glisinin dalam curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B)
(A) (B)
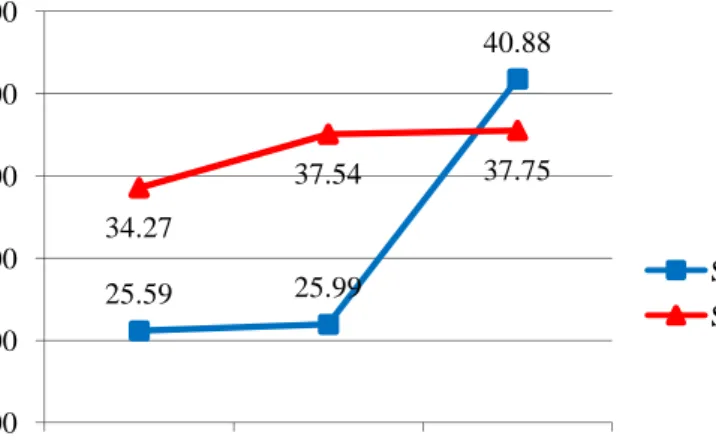
Gambar 17. Pengaruh konsentrasi koagulan terhadap komposisi subunit protein glisinin (11S) dalam
curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B)
8.47% 10.75% 10.71% 24.53% 39.65% 40.86% 9.56% 9.02% 10.14% 4.73% 12.18% 14.49% 0% 5% 10% 15% 20% 25% 30% 35% 40% 45% 0.015 0.030 0.045 S u b u n it P ro te in [CaSO4] (N) A4 A1 A2 A6 7.95% 8.85% 10.28% 32.80% 39.42% 35.21% 8.17% 6.56% 9.92% 5.90% 10.52% 4.02% 0% 5% 10% 15% 20% 25% 30% 35% 40% 45% 0.015 0.030 0.045 S u b u n it P ro te in [CaSO4] (N) A4 A1 A2 A6 47.29% 71.59% 76.20% 31.32% 16.87% 17.60% 0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 0.015 0.030 0.045 % S u b u n it P ro te in [CaSO4] (N)
Total Asam Basa
54.81% 65.35% 59.43% 19.59% 19.00% 18.18% 0% 10% 20% 30% 40% 50% 60% 70% 0.015 0.030 0.045 % S u b u n it P ro te in [CaSO4] (N)
(A) (B)
Gambar 18. Pengaruh konsentrasi koagulan terhadap komposisi subunit protein 7S san 11S dalam
curd yang dikoagulasi pada suhu 60°C (A) dan 80°C (B)
Seperti yang ditunjukkan oleh Gambar 18, perubahan kadar protein 7S dan 11S di kedua suhu memiliki pola serupa. Peningkatan konsentrasi koagulan menyebabkan total 11S meningkat sedangkan total 7S menurun. Namun berbeda halnya dengan proporsi 11S/7S. Pada suhu 60°C proporsi cenderung meningkat seiring meningkatnya konsentrasi koagulan, tetapi pada suhu 80°C proporsi 11S/7S menurun setelah mencapai daerah konsentrasi optimum 0.030 N walaupun masih lebih besar dari proporsi 0.015 N.
Dan seperti yang telah diketahui dari Thanh & Shibasaki (1976) bahwa protein dasar yang terdapat dalam kedelai adalah glisinin (11S) dan β-conglisinin (7S), yang jumlahnya berkisar 70% dari total protein dalam biji kedelai. Protein β-conglisinin merupakan glikoprotein trimerik yang terdiri atas tiga subunit, α, α’, dan β (Thanh & Shibasaki 1978). Sedangkan glisinin merupakan heksamer yang disusun oleh polipeptida asam (A) yang berikatan disulfida dengan polipeptida basa spesifik (B) (Staswick et al. 1984). Glisinin merupakan protein dominan yang terdapat dalam biji kedelai, terhitung lebih 50% dari total protein di setiap varietas kedelai, kecuali jika biji kedelai mengalami perlakuan irradiasi yang dapat menurunkan kadar glisinin (Yagasaki et al. 1996) termasuk β-conglisinin (Takahashi et al. 1994, 1996). Karena perlakuan pra proses koagulasi terhadap kedelai dapat mempengaruhi kestabilan ikatan dalam konstruksi molekul glisin, perlakuan suhu koagulasi yang berbeda disinyalir menyebabkan perbedaan kadar masing-masing subunit protein 11S dan 7S yang terkoagulasi bersama protein globular.
4.3
ANALISIS CURD
4.3.1
Tekstur dan Kadar Air
Pada dasarnya tekstur dapat dinilai dengan mengandalkan penilaian sensori dengan indera peraba secara alami oleh manusia ataupun dengan alat. Pengukuran ini dilakukan terlebih dahulu dengan analisis tekstur objektif menggunakan alat Texture Profile Analyzer (TPA) sehingga dihasilkan data kuantitatif tekstur curd. Setiap curd akan menghasilkan kurva tekstur yang memiliki pola seperti Gambar 7 pada Bab Metode Penelitian.
29.26 11.54 6.21 70.74 88.46 93.79 2.53 8.58 20.64 0 20 40 60 80 100 0.015 0.030 0.045 S u b u n it P ro te in [CaSO4] (N) 7S (%) 11S (%) 11S/7S 25.60 15.65 13.77 74.40 84.35 86.23 3.03 19.53 11.36 0 20 40 60 80 100 0.015 0.030 0.045 S u b u n it P ro te in [CaSO4] (N) 7S (%) 11S (%) 11S/7S
Sumbu y kurva di atas mewakili gaya tekan yang dikenakan pada curd. Alat TPA akan menekan curd dua kali sehingga data TPA akan menghasilkan 2 puncak kurva dalam satu grafik. Setiap kurva mewakili satu tekanan yang dianalogikan sebagai satu gigitan/kunyahan manusia. Selanjutnya, perhitungan nilai pada sumbu x dan sumbu y akan menghasilkan data parameter tekstur dengan perhitungan seperti yang dijelaskan pada Gambar 7 di Bab Metode Penelitian. Parameter tekstur yang dapat diperoleh dari kurva terdiri atas kerapuhan, kekerasan, daya kohesif, daya kenyal, kelengketan, elastisitas, dan daya kunyah.
Tidak semua produk memiliki nilai kerapuhan, begitu juga dengan curd. Beberapa tahu komersil memiliki kerapuhan, namun tidak semua sampel curd tahu yang dibuat dengan CaSO4 pada kelompok yang sama memiliki nilai kerapuhan. Meskipun ada, nilai kerapuhannya pun tidak stabil. Untuk memperkecil bias dan variasi serta untuk kepentingan analisi tekstur objektif selanjutnya yang tidak menekankan parameter kerapuhan, nilai kerapuhan ssemua sampel tidak dimasukkan ke dalam data tekstur objektif. Semua sampel tahu yang dibuat tidak menampilkan area negatif. Dengan demikian, semua sampel tahu tidak tergolong produk kenyal, sehingga nilai daya kenyal tidak diukur. Berbagai atribut tekstur itu sendiri merupakan konsekuensi langsung dari susunan mikrostruktur yang dibangun oleh komposisi kimia dan gaya fisik (Stanley & Tung 1970). Atribut tesktur curd protein kedelai dipengaruhi oleh kondisi koagulasi, seperti suhu, pH, kekuatan ionik, agen koagulan, dan denaturasi protein. Kekuatan curd berbanding lurus dengan interaksi antar molekul protein. Interaksi ini dapat berupa asosiasi hidrofobik, ikatan hidrogen, dan ikatan disulfida. Atibut ini dapat dilihat dengan menggunakan SEM dan mikroskop optik untuk melihat susunan mikrostruktur yang terintegrasi menjadi struktur jaringan yang kompak (Catsimpoolas & Meyer 1970, Aoki 1965).
Tabel 12. Data analisis tekstur per parameter
Curd
Parameter Tekstur Kekerasan
(Kg Force) Daya Kohesif
Kelengketan (Kg Force) Elastisitas Daya Kunyah (Kg Force) 0.015 N 60°C 1.532 0.442 0.680 1.000 0.680 0.015 N 80°C 1.164 0.341 0.404 1.000 0.404 0.030 N 60°C 1.455 0.435 0.639 1.000 0.640 0.030 N 80°C 1.357 0.330 0.449 1.000 0.449 0.045 N 60°C 1.059 0.317 0.336 1.000 0.336 0.045 N 80°C 2.474 0.394 0.977 1.000 0.977
Tabel 12 di atas merupakan hasil perhitungan dari analisis tekstur dengan TPA (data terperinci, proses perhitungan, dan analisis variannya dapat dilihat pada Lampiran 13 sampai Lampiran 14). Data menunjukkan bahwa peningkatan konsentrasi koagulan CaSO4.H2O menyebabkan trend tekstur
curd yang dihasilkan yang berbeda pada suhu 60°C dan 80°C. Pada suhu 60°C, peningkatan
konsentrasi koagulan cenderung menurunkan nilai kekerasan dan daya kunyah, sedangkan pada suhu 80°C cenderung meningkatkan nilai kekerasan dan daya kunyah. Perbedaan fenomena ini dipengaruhi oleh mekanisme khusus gelasi yang dilakukan oleh garam CaSO4 seperti yang dapat
dilihat sebelumnya pada Gambar 3. Tekstur curd tidak terlepas dari total padatan dan kadar air curd. Matriks curd tahu membentuk sistem pangan yang dapat mengikat air dengan baik, sehingga tahu tergolong produk pangan berkadar air tinggi. Jika kandungan air dihilangkan, tersisa padatan curd yang disebut dengan total padatan.
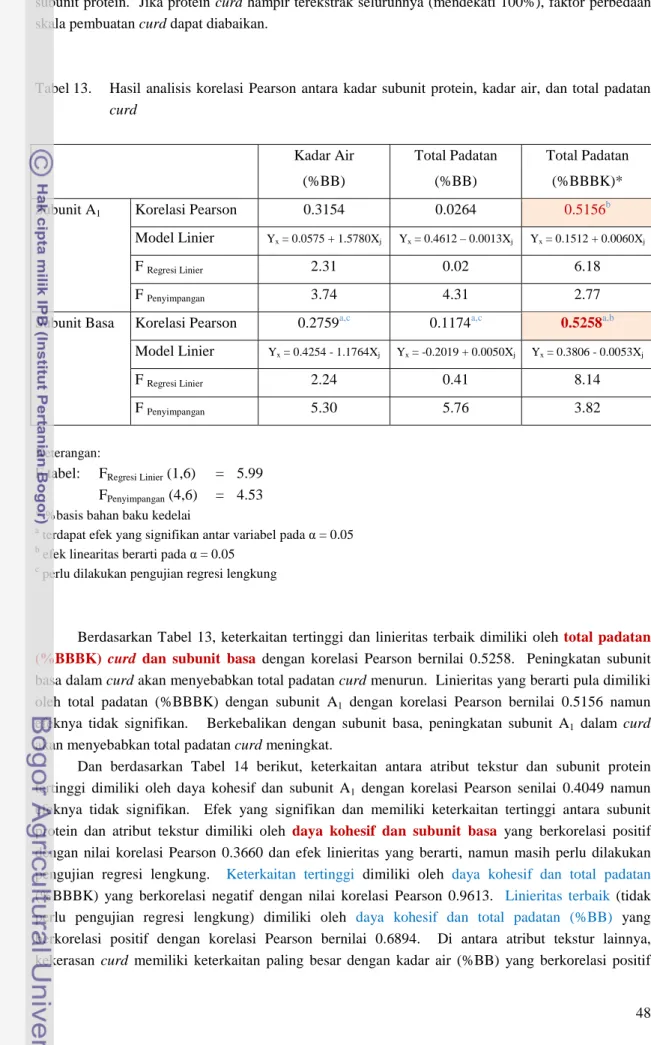
Total padatan dapat mewakili jumlah protein yang terendapkan, disamping adanya molekul lain seperti lemak dan karbohidrat yang ikut tertikat dalam matriks curd. Peningkatan konsentrasi koagulan akan memperbanyak netralisasi muatan asam amino pada protein kedelai sehingga jumlah protein yang teragreagasi dan terendapkan semakin banyak. Konsentrasi koagulan yang optimum akan membentuk curd yang maksimal dan mengurangi protein whey yang terbentuk. Semakin tinggi total padatan curd semakin tinggi keberhasilan proses koagulasi. Dari data total padatan yang dapat dilihat pada Gambar 19 (data kuantitatif terperinci beserta analisis variannya dapat dilihat pada Lampiran 15 dan Lampiran 16). Total padatan yang terbentuk meningkat sejalan dengan peningkatan konsentrasi CaSO4 dan peningkatan suhu (kecuali pada konsentrasi tertinggi).
Gambar 19. Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap total padatan curd
Kadar air curd diukur dengan metode oven segera setelah tahu diproduksi. Hasil analisis kadar air dapat dilihat pada Gambar 20 (data kuantitatif terperinci dan analisis variannya dapat dilihat pada Lampiran 17 dan Lampiran 18). Grafik menunjukkan bahwa tahu merupakan curd yang memiliki kemampuan gelasi yang cukup baik dalam mengikat air, yakni sebanyak hampir 20% dari bobot utuhnya. Penimbangan sampel mengakibatkan adanya selang waktu sekitar 30-60 menit setelah tahu selesai dicetak sampai kadar air tahu dianalisis. Selama jeda waktu tersebut, tahu yang terkoagulasi pada suhu 60°C mengalami pengeluaran air dari matriks, atau disebut sineresis. Hal tersebut tampak dari berairnya tahu setelah didiamkan beberapa jam, meskipun tahu telah ditiriskan sebelumnya dari cetakan. Sineresis ini terjadi ketika tahu segar berukuran 10 cm x 10 cm disimpan dalam wadah pada suhu ruang tanpa perendaman. Perendaman tidak dilakukan untuk menghilangkan bias kadar air lebih besar. Oleh karena itu, grafik pada Gambar 20 menunjukkan bahwa peningkatan konsentrasi koagulan menurunkan kadar air tanpa fluktuasi hanya pada suhu 80°C. Fluktuasi kadar air pada tahu 60°C terjadi karena kondisi koagulasi yang belum optimum, sehingga koagulasi protein tidak disertai dengan kempampuan mengikat air yang baik.
25.59 25.99 40.88 34.27 37.54 37.75 20.00 25.00 30.00 35.00 40.00 45.00 0.015 0.030 0.045 % P a d a ta n (b a si s b a h a n b a k u k ed el a i) Konsentrasi CaSO4 (N) Suhu koagulasi 60°C Suhu koagulasi 80°C
Tahu yang dikoagulasi pada suhu rendah (60°C) dan konsentrasi rendah memiliki kadar air yang tinggi. Tahu ini memiliki penampakan tekstur yang halus, basah, serta terlihat lebih lunak dan rapuh. Sedangkan tahu yang dikoagulasi pada konsentrasi koagulan optimum dan pada suhu tinggi (80°C) memiliki kadar air yang lebih rendah. Tahu ini memiliki penampakan tekstur yang lebih kasar, lebih kesat, serta terlihat lebih padat dan kompak. Menurut Cai et al. (1997) pun demikian, bahwa tahu dengan kandungan air yang tinggi akan memberikan penampakan yang lembut, sebaliknya, tahu dengan kandungan air rendah akan memberikan penampakan tekstur kasar. Cai et al. (1997) mengkorelasikan antara kandungan air yang tinggi dengan rendemen tahu yang diperoleh. Semakin rendah kadar air, semakin tinggi rendemen tahu, yang diketahui dari total padatan yang diperoleh, seperti pada data sebelumnya yaitu Gambar 19.
Gambar 20. Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap kadar air curd
Untuk mendeteksi adanya keterkaitan antara atribut tekstur, kadar air (%BB), total padatan (%BB), dan total padatan (% basis bahan baku kedelai), dan komposisi subunit protein curd dilakukan pengkorelasian antar variabel tersebut dengan analisis regresi linear yang menghasilkan nilai korelasi Pearson seperti yang terangkum pada Tabel 13 dan Tabel 14. Sedangkan data analisis lengkap dapat dilihat pada Lampiran 19 sampai Lampiran 24. Nilai korelasi Pearson merepresentasikan keterkaitan antar dua variabel bersangkutan. Nilai korelasi yang mendekati nilai nol (0) mengartikan hubungan antar variabel yang melemah atau tidak saling berkaitan. Keterkaitan yang moderat direpresentasikan oleh nilai korelasi 0.3 sampai 0.7. Korelasi antar variabel dapat bernilai positif maupun negatif, dilihat dari nilai koefisien Xj pada model linier. Nilai positif mengartikan hubungan antar variabel saling sinergis sedangkan nilai negatif mengartikan hubungan yang berkebalikan. Sedangkan besar koefisien Xj menggambarkan besarnya pengaruh antar variabel jika kedua variabel dikaitkan.
Data korelasi Pearson menggambarkan bahwa sebagian besar variabel memiliki keterkaitan sedang dan memerlukan adanya pengujian lengkung, bahkan ada beberapa yang tidak signifikan. Hal ini dapat dikarenakan oleh faktor rendahnya persen recovery ekstraksi protein dan berbedanya skala pembuatan curd antara analisis tekstur (skala tahu pres) dan profil protein (skala curd dalam tabung
sentrifuge). Rendahnya nilai persen recovery ekstraksi protein memungkinkakn protein curd tidak
18.23 19.87 18.69 16.49 18.86 20.63 13.00 15.00 17.00 19.00 21.00 23.00 0.015 0.030 0.045 K a d a r A ir ( %B B ) Konsentrasi CaSO4(N) Suhu koagulasi 60°C Suhu koagulasi 80°C
terekstrak seluruhnya dan tidak terbaca saat analisis elektroforesis untuk mengetahui komposisi subunit protein. Jika protein curd hampir terekstrak seluruhnya (mendekati 100%), faktor perbedaan skala pembuatan curd dapat diabaikan.
Tabel 13. Hasil analisis korelasi Pearson antara kadar subunit protein, kadar air, dan total padatan
curd Kadar Air (%BB) Total Padatan (%BB) Total Padatan (%BBBK)*
Subunit A1 Korelasi Pearson 0.3154 0.0264 0.5156b
Model Linier Yx = 0.0575 + 1.5780Xj Yx = 0.4612 – 0.0013Xj Yx = 0.1512 + 0.0060Xj
F Regresi Linier 2.31 0.02 6.18
F Penyimpangan 3.74 4.31 2.77
Subunit Basa Korelasi Pearson 0.2759a,c 0.1174a,c 0.5258a,b
Model Linier Yx = 0.4254 - 1.1764Xj Yx = -0.2019 + 0.0050Xj Yx = 0.3806 - 0.0053Xj
F Regresi Linier 2.24 0.41 8.14
F Penyimpangan 5.30 5.76 3.82
Keterangan:
F tabel: FRegresi Linier (1,6) = 5.99 FPenyimpangan (4,6) = 4.53
* %basis bahan baku kedelai
a
terdapat efek yang signifikan antar variabel pada α = 0.05
b efek linearitas berarti pada α = 0.05 c
perlu dilakukan pengujian regresi lengkung
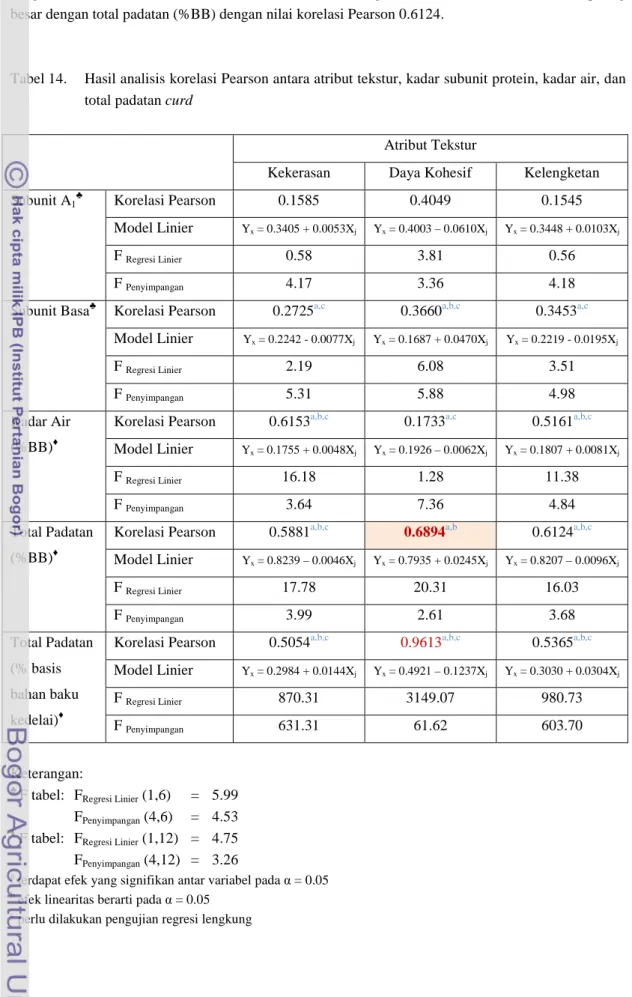
Berdasarkan Tabel 13, keterkaitan tertinggi dan linieritas terbaik dimiliki oleh total padatan (%BBBK) curd dan subunit basa dengan korelasi Pearson bernilai 0.5258. Peningkatan subunit basa dalam curd akan menyebabkan total padatan curd menurun. Linieritas yang berarti pula dimiliki oleh total padatan (%BBBK) dengan subunit A1 dengan korelasi Pearson bernilai 0.5156 namun efeknya tidak signifikan. Berkebalikan dengan subunit basa, peningkatan subunit A1 dalam curd akan menyebabkan total padatan curd meningkat.
Dan berdasarkan Tabel 14 berikut, keterkaitan antara atribut tekstur dan subunit protein tertinggi dimiliki oleh daya kohesif dan subunit A1 dengan korelasi Pearson senilai 0.4049 namun efeknya tidak signifikan. Efek yang signifikan dan memiliki keterkaitan tertinggi antara subunit protein dan atribut tekstur dimiliki oleh daya kohesif dan subunit basa yang berkorelasi positif dengan nilai korelasi Pearson 0.3660 dan efek linieritas yang berarti, namun masih perlu dilakukan pengujian regresi lengkung. Keterkaitan tertinggi dimiliki oleh daya kohesif dan total padatan (%BBBK) yang berkorelasi negatif dengan nilai korelasi Pearson 0.9613. Linieritas terbaik (tidak perlu pengujian regresi lengkung) dimiliki oleh daya kohesif dan total padatan (%BB) yang berkorelasi positif dengan korelasi Pearson bernilai 0.6894. Di antara atribut tekstur lainnya, kekerasan curd memiliki keterkaitan paling besar dengan kadar air (%BB) yang berkorelasi positif
dengan korelasi Pearson senilai 0.6513. Sementara kelengketan curd memiliki keterkaitan paling besar dengan total padatan (%BB) dengan nilai korelasi Pearson 0.6124.
Tabel 14. Hasil analisis korelasi Pearson antara atribut tekstur, kadar subunit protein, kadar air, dan total padatan curd
Atribut Tekstur
Kekerasan Daya Kohesif Kelengketan
Subunit A1♣ Korelasi Pearson 0.1585 0.4049 0.1545
Model Linier Yx = 0.3405 + 0.0053Xj Yx = 0.4003 – 0.0610Xj Yx = 0.3448 + 0.0103Xj
F Regresi Linier 0.58 3.81 0.56
F Penyimpangan 4.17 3.36 4.18
Subunit Basa♣ Korelasi Pearson 0.2725a,c 0.3660a,b,c 0.3453a,c
Model Linier Yx = 0.2242 - 0.0077Xj Yx = 0.1687 + 0.0470Xj Yx = 0.2219 - 0.0195Xj
F Regresi Linier 2.19 6.08 3.51
F Penyimpangan 5.31 5.88 4.98
Kadar Air (%BB)♦
Korelasi Pearson 0.6153a,b,c 0.1733a,c 0.5161a,b,c
Model Linier Yx = 0.1755 + 0.0048Xj Yx = 0.1926 – 0.0062Xj Yx = 0.1807 + 0.0081Xj
F Regresi Linier 16.18 1.28 11.38
F Penyimpangan 3.64 7.36 4.84
Total Padatan (%BB)♦
Korelasi Pearson 0.5881a,b,c 0.6894a,b 0.6124a,b,c
Model Linier Yx = 0.8239 – 0.0046Xj Yx = 0.7935 + 0.0245Xj Yx = 0.8207 – 0.0096Xj F Regresi Linier 17.78 20.31 16.03 F Penyimpangan 3.99 2.61 3.68 Total Padatan (% basis bahan baku kedelai)♦
Korelasi Pearson 0.5054a,b,c 0.9613a,b,c 0.5365a,b,c
Model Linier Yx = 0.2984 + 0.0144Xj Yx = 0.4921 – 0.1237Xj Yx = 0.3030 + 0.0304Xj F Regresi Linier 870.31 3149.07 980.73 F Penyimpangan 631.31 61.62 603.70 Keterangan: ♣ F tabel: F Regresi Linier (1,6) = 5.99 FPenyimpangan (4,6) = 4.53 ♦
F tabel: FRegresi Linier (1,12) = 4.75 FPenyimpangan (4,12) = 3.26 a
terdapat efek yang signifikan antar variabel pada α = 0.05
b
efek linearitas berarti pada α = 0.05
c
Maka secara umum, di antara subunit A1 dan subunit basa, subunit basa yang memiliki pengaruh paling tinggi terhadap atribut tekstur, kadar air, dan total padatan. Sementara itu, subunit basa juga berpengaruh terhadap total padatan (%BBBK) yang merepresntasikan kesempurnaan koagulasi protein kedelai. Dan atribut tekstur yang paling dipengaruhi adalah daya kohesif curd, yaitu kemampuan curd dalam menahan deformasi kedua (dengan TPA maupun kunyahan).
4.3.2
Pengaruh Parameter Proses
4.3.2.1
Konsentrasi Koagulan
Perubahan konsentrasi koagulan menghasilkan perubahan nilai atribut tekstur curd yang meliputi nilai kekerasan, daya kohesif, kelengketan, Sementara nilai elatisitas produk tidak terpengaruh. Semua sampel memiliki nilai elastisitas = 1, yang menggambarkan bahwa curd tahu tidak bersifat elastis. Oleh karena daya kunyah merupakan hasil kali kelengketan dengan elastisitas, analisis lebih lanjut terhadap daya kunyah tidak dilakukan, begitu juga dengan elastisitas curd. Grafik yang menampilkan pengaruh konsentrasi terhadap nilai atribut tekstur dapat dilihat pada Gambar 21.
(A) (B)
(C)
Gambar 21. Pengaruh konsentrasi koagulan dan suhu koagulasi terhadap kekerasan curd (A), daya kohesif curd (B), dan kelengketan curd (C)
1.532 1.455 1.059 1.164 1.357 2.474 0.150 0.650 1.150 1.650 2.150 2.650 0.000 0.010 0.020 0.030 0.040 0.050 K ek er a sa n Konsentrasi CaSO4(N) 0.442 0.435 0.317 0.341 0.330 0.394 0.150 0.250 0.350 0.450 0.550 0.000 0.010 0.020 0.030 0.040 0.050 D a y a K o h es if Konsentrasi CaSO4(N) 0.680 0.639 0.336 0.404 0.449 0.977 0.150 0.350 0.550 0.750 0.950 1.150 0.000 0.020 0.040 0.060 K el en g k et a n Konsentrasi CaSO4(N) Keterangan:
♦
: Suhu koagulasi 60°C▲
: Suhu koagulasi 80°CPada taraf signifikasi 0.05, perubahan konsentrasi koagulan memberikan efek yang nyata terhadap kekerasan, daya kohesif, dan kelengketan curd (analisis varian dapat dilihat pada Lampiran 14). Hal tersebut dikarenakan konsentrasi protein, pH, dan kekuatan ionik, yang berdampak pada perubahan kekuatan gel, seperti yang diilustrasikan pada Gambar 22. Perbedaan kekuatan gel protein menyebabkan perbedaan struktur jaringan protein globular termasuk sifat fisik dan teksturnya.
Oakenfull et al. (1997) menyatakan bahwa jika konsentrasi koagulan melebihi konsentrasi kritis, kekuatan ionik protein akan meningkat dan mendekati nilai titik isoelektrik. Namun kekuatan gel menurun yang ditandai dengan semakin turbid gel yang terbentuk. Gel yang turbid terlihat dari peningkatan intensitas opak curd. Kekuatan gel yang menurun dapat meningkatkan sineresis selama penyimpanan dan mempengaruhi daya kunyah curd. Pada titik konsentrasi kritis, curd cenderung transparan. Sedangkan jika konsentrasi koagulan kurang dari konsentrasi kritis, kekuatan ionik akan semakin melemah dan menjauhi nilai titik isoelektrik. Kekuatan gel pun makin menurun karena curd tidak akan terbentuk, yakni sari kedelai tetap berupa suspensi.
Gambar 22. Model tipe formasi struktur jaringan protein berdasarkan perubahan konsentrasi protein, pH atau kekukatan ionik (Hegg 1982 & Oakenfull et al. 1997)
Konsentrasi kritis akan menurun seiring peningkatan lama pemanasan sari kedelai atau penurunan kecepatan pemanasan. Adanya rentang waktu pemanasan awal dengan pemanasan kembali untuk persiapan suhu suspensi sari kedelai menjelang koagulasi ikut mempengaruhi konsentrasi kritis tersebut (Liu et al. 2004). Hal ini pula yang menyebabkan adanya sedikit fluktuasi tingkat kekerasan
curd dan kadar air curd ketika konsentrasi koagulan ditingkatkan pada suhu yang berbeda (Oakenfull et al. 1997). Terbukti bahwa pada taraf signifikasi 0.05, perubahan konsentrasi koagulan memberikan
efek yang nyata terhadap kadar air (%BB), total padatan (%BB), dan total padatan (% basis bahan baku kedelai) curd (analisis varian dapat dilihat pada Lampiran 16 dan Lampiran 18). Suspensi kedelai yang ditambahkan koagulan pada titik optimum akan mengasilkan kekuatan ionik gel yang maksimal, ditandai dengan stabilnya gel yang terbentuk tanpa sineresis berlebihan, dan teksturnya kompak serta disukai oleh konsumen. Selain itu, total padatan (% basis bahan baku kedelai) pun terus meningkat sejalan peningkatan konsentrasi koagulan yang manandakan koagulasi protein sari kedelai semakin sempurna.
Kekuatan gel dan kekerasan tekstur curd yang dibangun oleh struktur jaringan curd terbentuk karena adanya ikatan hidrofobik didalamnya. Semakin banyak ikatan antarmolekul, semakin kuat jaringan tersebut, dan semakin besar gaya yang dibutuhkan untuk merapuhkannya. Struktur gel protein kedelai dominan dibangun oleh subunit protein globulin 7S dan 11S, yang masing-masing
mempunyai kekuatan struktur berbeda. Saio & Watanabe (1978) bahwa glisinin (11S) dan β-conglisinin (7S) yang merupakan fraksi protein terbesar dalam kedelai, berpengaruh terhadap kekerasan dan kelembutan tekstur tahu. Subunit 11S (glisinin) dapat membuat tekstur mengeras karena banyaknya ikatan SS, gaya elektrostatik, dan ikatan hidrogen di dalamnya.
Di dalam subunit 7S itu sendiri dapat dicacah menjadi komponen α, α’, dan β, sedangkan 11S dapat dicacah menjadi komponen asam dan basa. Beberapa penelitian sebelumnya juga telah mencacah lebih rinci subsubunit asam menjadi komponen A1, A2, A4, dan A6. Sehingga perubahan konsentrasi tidak hanya berdampak pada perubahan kadar subunit 7S dan 11S maupun proporsinya, tetapi juga pada subsubunit di dalamnya. Dan kemudian perubahan tiap subsubunit protein dalam
curd akan menentukan nilai atribut tekstur, kadar air, dan total padatan yang dapat diamati pada Tabel
13 dan Tabel 14.
Jika dibandingkan dengan protein 7S, gelasi protein 11S lebih cepat. Hashizume (1975) membuktikan fenomena tersebut lewat struktur jaringan gel (SEM) globulin 7S yang lebih halus daripada protein 11S (menggunakan koagulan yang berbeda: GDL). Kecepatan dan kesempurnaan proses koagulasi protein selain dipengaruhi oleh keoptimuman konsentrasi koagulan, juga dipengaruhi oleh suhu. Hal inilah yang mengakibatkan protein 11S tidak selalu memberikan pengaruh kekerasan yang sama terhadap gel yang dibentuk.
Konsentrasi koagulan menentukan kondisi pH dan kekuatan ionik yang sesuai bagi koagulasi subunit protein tertentu. Unit globulin kedelai memiliki sifat fungsional tersendiri, terutama pada aspek gelasi protein, gel yang terbuat dari glisinin lebih keras daripada gel yang terbuat dari β-conglisinin (Renkema et al. 2001, Rickert et al. 2004, Saio et al. 1969, Watanabe 1997, Yagasaki et
al. 2000). Subunit spesifik dalam glisinin (Mujoo et al. 2003, Tezuka et al. 2000, Yagasaki et al.
2000) dan β-conglisinin (Ramlan et al. 2004, Mujoo et al. 2003) memberikan konstribusi yang berbeda kepada sifat gelasi protein. Nilai pH koagulasi akan mempengaruhi penampakan visual curd yang dihasilkan akibat perbedaan struktur jaringan gel. Karena koagulasi curd berlangsung pada kisaran pH yang sama yaitu pH asam, curd yang dihasilkan oleh setiap koagulan dengan konsentrasi dan suhu yang berbeda, memiliki penampakan visual yang opak (tidak transparan).
Gambar 23. Diagram skematik jaringan teruntai (A) dan jaringan teragregasi (B), dengan skala garis 40-50 µm (Renkema 2001)
Berdasarkan pengamatan molekul protein di bawah mikroskop yang dilakukan oleh Hermansson (1994), tipe struktur gel dipengaruhi oleh pH koagulasi. Pembentukan gel yang
diinduksi panas seperti dalam pembuatan tahu, dapat digolongkan menjadi dua tipe, yaitu tipe jaringan beruntai yang halus (tipe A) dan tipe jaringan teragregasi yang kasar (tipe B), seperti yang dapat dilihat pada Gambar 23. Pada tipe A, molekul protein terikat dengan molekul lainnya seperti rangkaian manik-manik dan menghasilkan gel yang teratur (Nakamura et al. 1984b). Gel tipe ini pada umumnya transparan dan memiliki ketebalan setiap untainya berkisar 12-15 nm untuk glisinin dan 10-14 untuk β-conglisinin (Hermansson 1994 & Hermansson 1986). Gel tipe B tidak transparan dan dibentuk oleh proses agregasi acak protein menjadi bentuk kluster dan menghasilkan untaian yang tebal (Doi 1993).
Ketika struktur gel berubah menjadi tipe B, kemampuan gel mengikat air menurun (Hermansson 1994, Hermansson 1986). Struktur gel tipe B diperoleh jika koagulasi berlangsung di sekitar titik isoelektrik atau ketika kekuatan ionik menurun (Doi 1993). Stuktur gel glisinin tipe A diperoleh pada kondisi pH 7.0-7.6 (Hermansson 1985, Mori et al. 1986, Nakamura et al. 1984b). Sehingga menurut Hermansson, jika potongan curd dilihat dibawah mikroskop elektron, maka akan terlihat struktur gel seperti tipe A, yang jika dilihat dengan kasat mata, curd tampak tidak transparan. Sementara ini, penelitian belum dapat memastikan struktur jaringan protein secara mikroskopis. Namun, berdasarkan hasil penelitian Hermansson (1994), dapat diambil hipotesa bahwa curd tahu yang dihasilkan pada semua kisaran nilai konsentrasi koagulan dan suhu koagulasi memiliki struktur jaringan menyerupai tipe B, yang mengasilkan penampakkan visual opak (tidak transparan).
4.3.2.2
Suhu Koagulasi
Data analisis tekstur pada Gambar 21. menunjukkan bahwa peningkatan suhu mengubah trend tekstur tahu. Pada taraf signifikasi 0.05, perubahan suhu koagulasi memberikan efek yang nyata terhadap kekerasan, daya kohesif, dan kelengketan curd. Demikian pula dengan interaksi antara konsentrasi koagulan dan suhu koagulasi. Sejalan peningkatan konsentrasi pada suhu 60°C, tekstur cenderung melunak, namun pada suhu 80°C tekstur cenderung mengeras. Kekerasan atau kemampuan gel protein menahan tekanan dipengaruhi oleh suhu pemanasan sari kedelai. Dari segi fisik molekul, kenaikan suhu menyebabkan energi kinetik molekul meningkat. Hal ini mengakibatkan ikatan hidrofobik dan elektrostatik antar molekul yang membuat protein terkoagulasi semakin cepat terjadi. Saio et al. (1971) menunjukkan bahwa peningkatan suhu dan waktu pemanasan akan meningkatkan pembentukan gugus sulfidril bebas dalam protein kedelai yang mengakibatkan tekstur tahu mengeras. Kecepatan koagulasi juga berpengaruh terhadap interaksi molekul protein dengan air. Koagulasi perlahan memperbesar peluang masuknya air ke dalam matriks agregat. Akan tetapi, pengikatan air yang tidak diimbangi dengan water holding capacity yang baik akan menyebabkan sineresis pada penyimpanan produk, sehingga tekstur tahu sesaat setelah pencetakan dapat berbeda setelah penyimpanan.
Selain itu, suhu menentukan kecepatan subunit protein tersebut membentuk ikatan hidrofobik yang akhirnya menenetukan struktur jaringan protein yang berdampak pada perbedaan kemampuan
curd menahan tekanan (kekerasan). Ditinjau dari komposisi protein penyusunnya, peningkatan
konsentrasi koagulan sebelum mencapai konsentrasi optimum pada suhu tinggi memberikan pengaruh positif terhadap jumlah protein 11S dan kekerasan curd, seperti yang dapat dilihat pada Gambar 18 dan Gambar 21. Curd yang dikoagulasi pada kisaran konsentrasi optimum 0.030 N, memiliki jumlah protein 11S yang lebih besar. Meskipun terdapat perbedaan kecenderungan pada suhu yang berbeda setelah konsentrasi koagulan meningkat melebihi 0.030 N, yakni pada suhu 60°C persen 11S cenderung naik sedangkan pada suhu 80°C persen 11S cenderung turun.
Suhu pemanasan berdampak pada proporsi glisinin (11S) terhadap β-conglisinin (7S) dan kekerasan curd. Dengan eksperimen dalam tube test pada suhu 70ºC, Hashizume (1975) melaporkan bahwa koagulasi sari kedelai yang mengandung protein 11S banding 7S sebesar 3.2 menghasilkan rendemen 40% lebih banyak dan nilai kekerasan tekstur 8-9% lebih tinggi daripada curd sari kedelai yang perbandingan 11S/7S-nya 1.6. Penelitian pun dilakukan oleh Kong et al. (1991) dan dilaporkan bahwa dengan waktu 30 menit, sari kedelai yang dipanaskan pada suhu di atas 93ºC menghasilkan gel protein dengan proporsi glisinin/β-conglisinin yang lebih besar, yakni senilai 2.41, daripada yang dipanaskan pada suhu di bawah 93ºC (hanya 0.08). Dan pada suhu pemanasan yang sama (96ºC), kekerasan gel protein yang mengandung 11S/7S lebih besar memiliki kekerasan 2.5 kali lipat daripada yang mengandung 11S/7S lebih sedikit.
Koagulasi yang dilakukan oleh Hashizume (1975) dan Kong et al. (1991) dilakukan pada konsentrasi koagulan yang optimum dan waktu yang lebih lama dari 10 menit yang dapat memastikan bahwa koagulasi berlangsung sempurna. Namun, pernyataan tersebut tidak berlaku pada rentang peningkatan suhu di bawah suhu 70°C yaitu 60°C, karena koagulasi selama 10 menit pada suhu rendah belum dapat mencapai kesempurnaan koagulasi. Demikian pula halnya pada suhu 80°C, perubahan konsentrasi dari belum optimum ke optimum memberikan pengaruh perubahan proporsi 11S/7S yang tidak signifikan.
Perbedaan suhu yang berdampak pada perbedaan kecepatan pembentukan jaringan protein juga mempengaruhi kemampuan curd mengikat air, yang dapat diamati melalui grafik pada Gambar 20. Pada taraf signifikasi 0.05, perubahan suhu koagulasi memberikan efek yang nyata terhadap total padatan (% basis bahan baku kedelai) curd, tetapi tidak nyata terhadap kadar air (%BB) dan total padatan (%BB). Sedangkan interaksi antara konsentrasi koagulan dan suhu koagulasi memberikan efek yang nyata ketiga variabel tersebut. Sebelum mencapai konsentrasi optimum, peningkatan proporsi 11S/7S meningkatkan kemampuan curd mengikat air sehingga kadar air (%BB) meningkat yang diiringi dengan peningkatan total padatan. Sedangkan setelah mencapai daerah konsentrasi optimum 0.030 N, peningkatan proporsi 11S/7S meningkatkan ikatan hidrofobik sesama protein sehingga total padatan (% basis bahan baku kedelai) meningkat. Namun, pada suhu rendah (60°C), ikatan hidrofobik tersebut melebihi daya tarik terhadap air menurun sehingga kadar air (%BB) pun menurun. Kekuatan jaringan ini dalam mempertahankan kadar air sehingga sineresis dapat dihindari, yang berdampak pula pada kekerasan curd memerlukan pengamatan lebih lanjut dengan analisis visual struktur jaringan protein. Dengan menggunakan scanning electron mirosope (SEM), pengaruh perbedaan struktur dari segi kerapatan dan keteraturan bentuk matriks terhadap daya ikat air dan kekerasan curd akan dapat dianalisis.
4.4
UJI ORGANOLEPTIK
Sebanyak 11 orang panelis terlatih digunakan dalam uji organoleptik ini. Semua panelis yang berprofesi sebagai mahasiswa dan telah mengenal tahu. Panelis telah dilatih sebelumnya untuk memiliki persepsi yang sama dalam menilai atribut kekerasan curd/tahu pada skala garis 0-15 cm. Sakal garis terendah mewakili nilai kekerasan paling lunak dan skala garis tertinggi mewakili nilai kekerasan paling keras. Panelis menilai 6 sampel tahu komersil ditambah 2 tahu komersil sebagai standar terlunak dan terkeras untuk mendapatkan nilai kekerasan subjektif (daftar penilaian subjektif dapat dilihat pada Lampiran 25). Keenam tekstur kekerasan tahu tersebut telah dianalisis secara objektif sebelumnya. Hasil analisis subjektif dan objektif 6 sampel tahu komersil digabungkan dalam satu kurva seperti pada Gambar 24 sehingga dihasilkan persamaan garis linear y = 2.876x + 1.358.