i
TUGAS AKHIR
PERBANDINGAN PENGARUH ION Ba
2+DAN Sr
2+DALAM ANALISA Fe SEBAGAI Fe
2+FENANTROLIN
OVA MAR’ATUS SHAFWAH NRP. 1413100094
Dosen Pembimbing
Drs. R. Djarot Sugiarso K.S, M.S Dr. rer. nat. Fredy Kurniawan, M.Si
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA 2017
ii FINAL PROJECT
COMPARISON OF Ba
2+AND Sr
2+IONS INFLUENCE
ON ANALIZING Fe AS Fe
2+FENANTROLIN
OVA MAR’ATUS SHAFWAH NRP. 1413100094
Advisor Lecturer
Drs. R. Djarot Sugiarso K.S, M.S Dr. rer. nat. Fredy Kurniawan, M.Si
CHEMISTRY DEPARTEMENT
FACULTY OF MATHEMATICS AND SCIENCES
SEPULUH NOPEMBER INSTITUTE OF TECHNOLOGY SURABAYA
iii
PERBANDINGAN PENGARUH ION Ba2+ DAN Sr2+ DALAM
ANALISA Fe SEBAGAI Fe2+ FENANTROLIN
TUGAS AKHIR
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Program Studi S-1
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam Institut Teknologi Sepuluh Nopember
Surabaya
Disusun Oleh :
OVA MAR’ATUS SHAFWAH NRP. 1413 100 094
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
v
PERBANDINGAN PENGARUH ION Ba2+ DAN Sr2+
DALAM ANALISA Fe SEBAGAI Fe2+ FENANTROLIN
Nama Mahasiswa : Ova Mar’atus Shafwah
NRP : 1413100094
Jurusan : Kimia FMIPA-ITS
Pembimbing : Drs. R. Djarot Sugiarso, K.S., M.S. Dr. rer. nat. Fredy Kurniawan, M.Si
Abstrak
Fe(II) dapat membentuk kompleks dengan 1,10-fenantrolin membentuk warna merah-orange. Fe(III) direduksi menjadi Fe(II) dengan bantuan Natrium tiosulfat pentahidrat yang dianggap sebagai pereduksi yang baik untuk besi dan mudah didapat. Analisa Fe sebagai Fe(II)-fenantrolin diganggu dengan keberadaan ion strontium dan ion barium dengan metoda spektrofotometer UV-vis pada pH 4,5. Panjang gelombang maksimum Fe(II)-fenantrolin adalah 510 nm dengan koefisien korelasi yang diperoleh 0,9975. Hasil analisa menunjukkan bahwa ion Sr(II)-fenantrolin dan Ba(II)-fenantrolin memiliki panjang gelombang maksimum 326 nm dan 315 nm. Keberadaan ion Sr(II) dan Ba(II) mulai mengganggu Fe sebagai Fe(II)-fenantrolin pada konsentrasi 0,4 ppm dan 0,6 ppm dengan % recovery masing-masing yaitu 77,214 % dan 76,394 %.
Kata Kunci : Fe(II)-fenantrolin, Sr(II)-fenantrolin, Ba(II)-fenantrolin, dan spektrofotometer UV-vis.
vi
COMPARISON OF Ba2+ AND Sr2+ IONS INFLUENCE ON
ANALIZING Fe AS Fe2+ FENANTROLIN
Student’s Name : Ova Mar’atus Shafwah
NRP : 1413100094
Department : Kimia FMIPA-ITS
Supervisor : Drs. R. Djarot Sugiarso, K.S., M.S. Dr. rer. nat. Fredy Kurniawan, M.Si
Abstract
Fe(II) can form complex with 1,10-fenantrolin form red-orange color. Fe (III) is reduced to Fe(II) with the aid of sodium thiosulfate pentahydrate which is considered a good reducing agent for iron and easy to obtain. Analysis of Fe as Fe(II) -fenantrolin interfered by the presence of strontium and barium ions with the UV-vis spectrophotometer method at pH 4.5. The maximum wavelength of Fe(II) -fenantrolin is 510 nm with a correlation coefficient obtained 0.9966. The analysis shows that the ion Sr(II) -fenantrolin and Ba(II) -fenantrolin has a maximum wavelength at 314 nm and 315 nm. The existence of ion Sr(II) and Ba(II) begin to interfere Fe as Fe(II) -fenantrolin at concentrations 0.4 ppm and 0.6 ppm with% recovery respectively is 77,214 % and 76,394 %. Key words : Fe(II)-phenanthroline, Sr(II)- phenanthroline, Ba(II)-
vii
Bismillahirrahmanirrahim Karya ini saya persembahkan untuk mama, abah, kakak-kakak, adik-adik, keponakan, Zakaria Jaka Bahari, mamanya
anak-anak, Chetyre, BPJS, Geng hood dan teman-teman ANORTHITE.
viii
KATA PENGANTAR
Alhamdulillahirabbil’alamin, puji syukur atas limpahan rahmat Allah SWT sehingga naskah yang berjudul “PERBANDINGAN PENGARUH ION Ba2+ DAN Sr2+
DALAM ANALISA Fe SEBAGAI Fe2+ FENANTROLIN”
dapat diselesaikan. Tulisan ini tidak akan terwujud dengan baik tanpa bantuan, dukungan, dan dorongan dari semua pihak. Untuk itu penulis menyampaikan terima kasih kepada:
1. Drs. R. Djarot Sugiarso K.S, M.S., dosen pembimbing yang telah memberikan pengarahan dan bimbingan selama proses penyusunan naskah tugas akhir.
2. Dr. rer. nat. Fredy Kurniawan, M.Si., dosen pembimbing dan kepala Laboratorium Instrumentasi dan Sains Analitik yang telah memberikan fasilitas, pengarahan dan bimbingan selama proses penyusunan naskah tugas akhir.
3. Prof. Dr. Didik Prasetyoko, M.Sc., Ketua Jurusan Kimia atas fasilitas yang telah diberikan hingga tugas akhir ini dapat terselesaikan.
4. Dra. Ratna Ediati, MS., Ph.D., dosen wali yang memberikan pengarahan dan bimbingan yang tiada henti.
5. Dosen KIMIA ITS atas Ilmu dan pengarahan yang tiada henti
6. Kedua Orang tuaku tercinta Bapak Prof. Dr. H. Muh. Amin Suma. SH. MA. MM dan Ibu Dra. Hj. Kholiyah Thohir, MA, atas doa, dukungan, motivasi, saran, bantuan moral dan material, serta kasih sayang yang tiada henti.
7.
Kakak-kakak, Adik-adik dan keponakan atas doa,
dukungan, motivasi, saran, bantuan moral serta kasih sayang yang tiada henti.8. Zakaria Jaka Bahari atas motivasi, saran dan dukungan yang tiada henti.
ix
9. Fadhli, Fadhil, Zulfah, Ranny, Silmi, Ismi, Lia, Cici, Bila, Muti, Chaca, Dea, Hani, Mega, Dian, Nia, Dhila, Cita, Dienna, Nadya dan teman-teman ANORTHITE atas dukungan yang tiada henti.
Penulis menyadari bahwa masih terdapat kekurangan dalam penyusunan naskah ini. Penulis mengharapkan saran yang bersifat membangun terhadap tulisan ini. Semoga naskah ini memberikan manfaat dan inspirasi terutama bagi pihak-pihak yang menekuni bidang terkait dengan yang penulis kerjakan.
Surabaya, 07 Februari 2017 Penulis
x DAFTAR ISI
HALAMAN JUDUL………...…………..i
LEMBAR PENGESAHAN ... Error! Bookmark not defined. ABSTRAK ……….v
ABSTRACT ………...vi
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR GAMBAR ... xiii
DAFTAR TABEL ... xiv
BAB I PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Permasalahan ... 3 1.3 Batasan Permasalahan ... 3 1.4 Tujuan Penelitian ... 4 1.5 Manfaat ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Spektrofotometri UV-Vis ... 5
2.2 Tinjauan Umum Besi ... 6
2.3 1,10- Fenantrolin ... 8
2.4 Strontium (Sr) ... 9
2.5 Barium (Br) ...10
2.6 Metoda Standar Analisa Besi ...12
2.7 Senyawa Kompleks ...13
2.8 Larutan Buffer ...14
2.9 Natrium Tiosulfat ...14
2.10 Validasi Metoda Analisis ...15
2.10.1 Linearitas...15
2.10.2 Akurasi ...15
2.10.3 Presisi ...16
2.10.4 Recovery ...16
BAB III METODOLOGI PERCOBAAN ...19
3.1 Alat dan Bahan ...19
3.1.1 Alat ...19
3.1.2 Bahan ...19
xi
3.2.1 Pembuatan larutan stok besi (III) 100 ppm ....19
3.2.2 Pembuatan larutan stok Na2S2O3.5H2O 100 ppm……….19
3.2.3 Pembuatan pengompleks 1,10-fenantrolin 1000 ppm ...20
3.2.4 Pembuatan Larutan Buffer Asetat pH 4,5 ...20
3.2.5 Pembuatan larutan Sr(II) 100 ppm ...20
3.2.6 Pembuatan larutan Ba(II) 100 ppm ...20
3.2.7 Penentuan Panjang Gelombang Maksimum Fe(II)-Fenantrolin pada pH 4,5 ...20
3.2.8 Penentuan Panjang Gelombang Maksimum Sr(II)-Fenantrolin pada pH 4,5 ...21
3.2.9 Penentuan Panjang Gelombang Maksimum Ba(II)-Fenantrolin pada pH 4,5 ...21
3.2.10 Pembuatan Kurva Kalibrasi pada pH 4,5 ...21
3.2.11 Pengaruh Sr(II) Pada Fe(II)-Fenantrolin dengan Kondisi pH 4,5 ...22
3.2.12 Pengaruh Ba(II) Pada Fe(II)-Fenantrolin dengan Kondisi pH 4,5 ...22
BAB IV HASIL DAN PEMBAHASAN...24
4.1 Penentuan Panjang Gelombang Maksimum Fe(II)-Fenantrolin pada pH 4,5 ...25
4.2 Penentuan Panjang Gelombang Maksimum Sr(II)-Fenantrolin pada pH 4,5 ...28
4.3 Penentuan Panjang Gelombang Maksimum Ba(II)-Fenantrolin pada pH 4,5...29
4.4 Kurva Kalibrasi Fe(II)-Fenantrolin ...31
4.5 Panjang gelombang Fe(II)-Fenantrolin dan Ion Pengganggu ...33
4.6 Pengaruh Ion Strontium dan Barium pada pembentukan Fe sebagai Fe(II)-Fenantrolin ...34
BAB V KESIMPULAN ...39
DAFTAR PUSTAKA ...41
LAMPIRAN A SKEMA KERJA...45
xii
A. 2 Pembuatan Larutan Stok Sr(II) 100 ppm ...45
A. 4 Pembuatan Larutan 1,10-Fenantrolin 1000 ppm46 A. 5 Pembuatan Larutan Buffer Asetat pH 4,5 ...46
A. 6 Pembuatan Larutan pereduksi 100 ppm ...46
A. 7 Penentuan Panjang Gelombang Maksimum Fe(II)-Fenantrolin ...47
A. 8 Penentuan Panjang Gelombang Maksimum Sr(II)-Fenantrolin ...48
A. 9 Penentuan panjang gelombang maksimum Ba(II)-Fenantrolin ...49
A. 10 Pembuatan Kurva Kalibrasi Fe(II)-Fenantrolin .50 A. 11 Pengaruh Sr(II) pada Fe(II)-Fenantrolin ...51
A. 12 Pengaruh Ba(II) pada Fe(II)-Fenantrolin ...52
LAMPIRAN B PERHITUNGAN ...53
B.1 Pembuatan Larutan Stok Fe (III) 100 ppm ...53
B.2 Pembuatan Larutan Stok Sr(II) 100 ppm ...53
B.3 Pembuatan Larutan Stok Ba(II) 100 ppm ...53
B.4 Pembuatan Larutan 1,10-Fenantrolin 1000 ppm54 B.5 Pembuatan Larutan Pereduksi 100 ppm ...54
B.6 Pembuatan Larutan Buffer Asetat pH 4,5 ...54
LAMPIRAN C DATA HASIL PENELITIAN ...56
LAMPIRAN D DATA STATISTIKA ...78
D.1 Perhitungan Persamaan Regresi Linear Kurva Kalibrasi ...78
D.2 Perbandingan Koefisien Korelasi Kurva Kalibrasi ...79
D.3 Perhitungan Uji-t erhadap Kurva Kalibrasi ...80
D.4 Perhitungan Konsentrasi dan Persen Recovery ..81
D.5 Perhitungan Standar Deviasi (S), Standar Deviasi Relatif (RSD) dan Koefisien Variatif (CV)...82
LAMPIRAN E TABEL PERHITUNGAN KONSENTRASI, PERSEN RECOVERY, RSD DAN CV ...84
LAMPIRAN F TABEL NILAI KRITIK SEBARAN t ...87
xiii
DAFTAR GAMBAR
Gambar 2.1 Panjang Gelombang dan Warna Komplementer Spektrofotometri UV-Vis ...6 Gambar 2. 2 Ligan 1,10-Fenantrolin ...9 Gambar 2. 3 kompleks dari 1,10-fenantrolin-5,6-dione dimana
M dapat berupa Nikel, Besi, Kobalt, Osmium, ruthenium, Kalsium, Strontium dan Barium. .... 11 Gambar 2. 4 Struktur kimia kompleks Fe(II)-Fenantrolin ... 13 Gambar 4. 1 Panjang gelombang maksimum Fe(II)-Fenantrolin
pada pH 4,5………27 Gambar 4. 2 Panjang gelombang maksimum Sr (II) Fenantrolin pada pH 4,5...29 Gambar 4. 3 Panjang gelombang maksimum Ba(II) Fenatrolin
pada pH 4,5...30 Gambar 4. 4 Kurva kalibrasi Fe(II)-Fenantrolin ...32 Gambar 4. 5 Kurva pengaruh Sr (II) pada Fe((II) Fenantrolin
dengan pH 4,5 ...37 Gambar 4. 6 Kurva pengaruh Ba (II) pada Fe((II) Fenantrolin
xiv
DAFTAR TABEL
Tabel 2.1 Karakterisasi Besi ... 7 Tabel 2.2 Karakteristik strontium ...10 Tabel 2.3 Karakteristik Barium ...11 Tabel 4.1 Absrobansi Fe(II)-Fenantrolin dengan 5 variasi
konsentrasi………...31 Tabel 4.2 Hasil absorbansi penambahan Sr(II) pada Fe(II)-Fenantrolin ...35 Tabel 4.3 Hasil absorbansi penambahan Ba(II) pada Fe(II)-Fenantrolin ...35 Tabel 4.4 Hasil pengukuran [Fe2+] dan persen recovery pada
penambahan Sr(II)...36 Tabel 4.5 Hasil pengukuran [Fe2+] dan persen recovery pada
penambahan Ba(II) ...36 Tabel C.1 Absorbansi penentuan panjang gelombang Fe (II)
Fenantrolin antara 400-600 nm dengan interval 1 nm……….56 Tabel C.2 Absorbansi penentuan panjang gelombang Ba (II) Fenantrolin rentang 300-500 nm dengan interval 1 nm ...63 Tabel C.3 Absorbansi penentuan panjang gelombang Sr (II)
Fenantrolin rentang 300-500 nm dengan interval 1 nm ...70 Tabel C.4 Absorbansi kurva kalibrasi Fe(II)-Fenantrolin pada
510 nm ...76 Tabel C.5 Data absorbansi pengaruh ion Strontium ...76 Tabel C.6 Data absorbansi pengaruh ion Barium ...77 Tabel D.1 Perhitungan persamaan regresi linear pada kurva
kalibrasi………....78 Tabel D.2 Perhitungan Koefisien Korelasi Kurva Kalibrasi.80 Tabel D.3 Absorbansi kompleks besi (II) fenantrolin dengan
penambahan ion Sr(II) 0,2 ppm ...82 Tabel E.1 Hasil perhitungan pengaruh penambahan Sr(II)…84 Tabel E.2 Hasil perhitungan pengaruh penambahan Ba(II)..85
1 BAB I PENDAHULUAN 1.1 Latar Belakang
Besi adalah unsur yang paling berlimpah keempat dalam kerak bumi dan merupakan salah satu elemen yang paling penting dalam geokimia , lingkungan dan sistem biologi. Besi di alam digabungkan dengan unsur-unsur lain membentuk bijih besi, seperti bijih oksida dan mineral limonit (Kanyarak, 2015). Pada bidang industri besi banyak digunakan dan berperan besar pada proses pembuatan baja. Beberapa bentuk oksida besi digunakan sebagai pigmen pada cat, senyawa penggosok, tinta magnetik, dan pelapis untuk pita magnetik (Steven Wang, 2015). Pada umumnya besi cenderung membentuk senyawa dalam bentuk Fe3+ dibandingkan dengan
bentuk Fe2+ serta membentuk kompleks yang stabil dengan
senyawa tertentu (Andreana, 2013).
Saat ini, sejumlah teknik analisis telah dikembangkan untuk penentuan besi, termasuk spektrofotometri serapan atom (AAS), spektometri massa induksi plasma (ICP-MS), kromatografi cair, elektrokimia, spektrofluorometri, teknik berbasis aliran (Kanyarak,2015), Graphite Furnace AAS, semiluminisens, potensiometri, Anodic Stripping Volumetry dan spektrofotometri UV-Vis. Penentuan kadar besi secara spektrofotometri UV-Vis telah banyak dilakukan karena prosesnya cepat, mudah dan murah. Besi perlu dikomplekskan terlebih dahulu dengan pengompleks besi yang membentuk suatu warna spesifik (Novita,2015). Banyak reagen yang disarankan untuk penentuan besi seperti 1,10-fenantrolin, bathophenanthroline, ferrozine, asam thioglikolik, dan asam tiosianat. Beberapa metode menggunakan reagen ini karena selektivitas dan sensitivitas rendah. 1,10-fenantrolin adalah salah satu reagen yang paling berguna untuk menentukan besi (II) dan telah digunakan untuk penentuan besi (II) dan besi (III) (Alaa, 2008).
2
Pembentukan kompleks Fe(II)-1,10-Fenantrolin dipengaruhi oleh pH larutan dan adanya logam yang lain. Ion logam lain akan bersaing dengan ion Fe(II) untuk berikatan dengan ligan fenantrolin (Agustina,2007). Pengompleks 1,10-fenantrolin dapat digunakan untuk pengompleks besi tanpa menggunakan zat pengadsorbsi dan tidak memerlukan waktu yang lama. Pengompleksan besi dengan menggunakan 1,10-fenantrolin akan menghasilkan pewarnaan merah jingga, yang disebabkan pembentukan kation kompleks [Fe(phen)3]2+.
Warna merah jingga dari kompleks yang dihasilkan ini stabil pada kisaran pH 2-9. Oleh karena itu penelitian dapat dilakukan pada range pH asam maupun basa. Warna merah jingga terjadi pada rentang 480 nm – 560 nm (Sisca, 2013).
Sebelum dikomplekskan dengan 1,10-fenantrolin, Fe3+
direduksi terlebih dahulu menjadi Fe2+ (Andreana,2013). Pada
penelitian sebelumnya, besi direduksi dengan menggunakan hidroksilamin hidroklorida, namun pereduksi tersebut memerlukan perlakuan khusus yaitu setelah dibuat harus segera digunakan saat itu juga sehingga pereduksi hidroksilamin hidroklorida kurang efektif. Oleh karena itu, pada tahun 2004 dilakukan penelitian menggunakan pereduksi natrium tiosulfat dan mendapatkan hasil bahwa pada konsentrasi natrium tiosulfat 11 ppm mampu mereduksi larutan Fe (III) 5 ppm menjadi Fe(II) dengan nilai recovery sebesar 99,25 % dengan pH optimum buffer asetat 4,5 (Novita, 2015).
Analisa besi dengan pengompleks 1,10- fenantrolin ini dapat diganggu oleh beberapa ion logam seperti alumunium, perak, dan magnesium. Penambahan Al3+ mulai mengganggu
analisa besi pada saat penambahan 0,122 ppm dengan persen recovery sebesar 90,74% (Andreana, 2013). Penambahan ion Ag+ mulai mengganggu analisa penentuan besi pada
penambahan 0,03 ppm dengan persen recovery sebesar 92,88 % (Sisca, 2013). Ion Mg(II) mulai mengganggu analisa besi pada konsentrasi 0,04 ppm dengan persen recovery sebesar 90,99 % (Novita, 2015). 1,10-fenantrolin dapat membentuk
3
kompleks yang sangat stabil dengan sejumlah logam, khususnya logam bivalen (Novita,2015). Senyawa kompleks atom pusatnya tidak harus merupakan unsur transisi. Atom pusat senyawa kompleks juga dapat merupakan atom-atom dari unsur-unsur golongan alkali, alkali tanah atau atom logam dari golongan utama yang lain (Effendy, 2007).
Pada penelitian sebelumnya Novita (Novita, 2015) telah melakukan analisa Fe dengan diberikan ion pengganggu berupa Mg dan Kusuma (Kusuma, 2016) telah melakukan analisa Fe dengan diberikan ion pengganggu berupa Ca dan Ba. Menurut Forrow (Forrow, 2012) ion Strontium dan barium dapat membentuk kompleks dengan 1,10-fenantrolin, 5-6 dione, karena Sr dan Ba mempunyai golongan yang sama seperti Mg Ca, dan Ba, maka dipilih ion strontium dan ion barium sebagai ion pengganggu dalam analisa Fe secara Spektrofotometer UV-Vis dengan tujuan mengetahui pengaruh ion dalam analisa Fe2+ sebagai Fe2+ fenantrolin.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah apakah ion Ba2+ dan ion Sr2+ yang ditambahkan dapat mempengaruhi
analisa Fe(II) sebagai Fe2+ fenantrolin dan jika dapat
mempengaruhi, maka berapa besar konsentrasi ion Ba2+ dan
Sr2+ mulai mempengaruhi Fe2+ fenantrolin serta berapa
perbandingan pengaruh ion Ba2+ dan Sr2+ dalam analisa Fe2+
fenantrolin.
1.3 Batasan Permasalahan
Batasan permasalahan dari penelitian ini adalah analisa Fe2+ sebagai Fe2+ fenantrolin yang diganggu oleh ion Ba2+ dan
ion Sr2+ dengan variasi konsentrasi 0,0; 0,2; 0,4; 0,6; 0,8; dan
1 ppm pada kondisi pH optimum dengan menggunakan spektrofotometer UV-Vis.
4 1.4 Tujuan Penelitian
Tujuan pada penelitian ini adalah untuk mengetahui seberapa besar pengaruh ion Ba2+ dan ion Sr2+ dalam analisa Fe
sebagai Fe2+ fenantrolin dengan pengompleks 1,10-fenantrolin
menggunakan spektrofotometer UV-Vis. 1.5 Manfaat
Dengan dilakukannya penelitian ini maka manfaat yang ada adalah mendapatkan metoda analisa Fe yang lebih baik.
5 BAB II
TINJAUAN PUSTAKA 2.1 Spektrofotometri UV-Vis
Spektrofotometri UV-Vis adalah salah satu teknik yang paling sering digunakan dalam analisis. Teknik ini melibatkan pengukuran jumlah radiasi ultraviolet atau radiasi visibel yang diserab oleh suatu zat dalam larutan. Instrumen. ini digunakan untuk mengukur rasio, atau fungsi dari rasio, dari intensitas dua berkas cahaya pada wilayah UV-Vis (Siladitya, 2012). Spektrofotometer UV-Vis dapat menganalisa interaksi radiasi cahaya pada zat di daerah ultra violet (200-400 nm) dan daerah visibel (400-800 nm) (Adeeyinwo C.E, 2013).
Apabila radiasi atau cahaya putih dilewatkan melalui larutan berwarna, maka radiasi dengan panjang gelombang tertentu akan diserap (absorpsi) secara selektif dan radiasi lainnya akan diteruskan (transmisi). Nilai absorbansi akan bergantung pada kadar zat yang terkandung di dalamnya, semakin banyak kadar zat yang terkandung dalam suatu sampel maka semakin banyak molekul yang akan menyerap cahaya pada panjang gelombang tertentu. Sehingga, nilai absorbansi semakin besar atau dengan kata lain nilai absorbansi akan berbanding lurus dengan konsentrasi zat yang terkandung di dalam sampel (Neldawati, 2013).
Hukum Beer menyatakan bahwa intensitas sinar radiasi monokromatik paralel berkurang secara eksponensial dengan jumlah molekul yang diserap. Dengan kata lain, absorbansi sebanding dengan konsentrasi. Hukum Lambert menyatakan intensitas sinar radiasi monokromatik parallel berkurang secara eksponensial saat melewati media dengan ketebalan yang homogen. Kombinasi antar kedua hukum itu menghasilkan hukum Lambert-Beer (Skoog, 2007).
Hukum Lambert-Beer menyatakan bahwa absorbansi pada suatu larutan berbanding lurus dengan konsentrasi spesies yang diserap dalam larutan dan ketebalan sel. Dengan
6
demikian, Spektrofotometer UV-Vis dapat digunakan untuk menentukan konsentrasi yang terserap dalam larutan dimana panjang gelombang dan warna komplementer pada Spektrofotometer UV-Vis ditunjukkan pada Gambar 2.1. Hal ini diperlukan untuk mengetahui seberapa cepat perubahan absorbansi terhadap konsentrasi (R. Gandhimathi, 2012).
Dimana c adalah konsentrasi spesies yang terserap (biasanya dinyatakan dalam gram atau milligram per liter) persamaan ini dapat diubah menjadi persamaan linear dengan menggunakan logarithma biasanya dinyatakan dalam bentuk dekadik.
𝐴 = − log 𝑇 = − log (𝐼
𝐼𝑜) = log ( 𝐼𝑜
𝐼) = 𝜀 𝑏 𝑐 (2.1)
Gambar 2.1 Panjang Gelombang dan Warna Komplementer Spektrofotometri UV-Vis
(R. Gandhimathi, 2012). 2.2 Tinjauan Umum Besi
Kata besi berasal dari Bahasa Anglo-saxon dan simbol besi dalam kimia berasal dari Bahasa latin yaitu ferrum. Besi alami merupakan logam yang berwarna abu-abu dan berkilau
7
(Hasan, 2005). Besi adalah unsur keempat yang paling berlimpah dalam kerak bumi dan merupakan salah satu elemen yang paling penting dalam geokimia, lingkungan (Kanyarak dkk., 2015) dan sistem biologis yang penting bagi kehidupan manusia. Diketahui bahwa kekurangan zat besi adalah yang paling umum menyebabkan anemia. Di sisi lain, terlalu banyak zat besi dapat menyebabkan beberapa masalah kesehatan. Tingginya kadar zat besi berhubungan dengan peningkatan risiko kanker, penyakit jantung dan penyakit lainnya (Latif dkk., 2008).
Logam ini tampak berkilauan. Jika murni, besi bersifat lunak dan mudah dibentuk. Sifat besi unik ketika temperatur tinggi (>910 oC) besi mengadopsi fcc dan pada temperatur
sekitar 1390 oC berubah kembali menjadi bcc. Beberapa
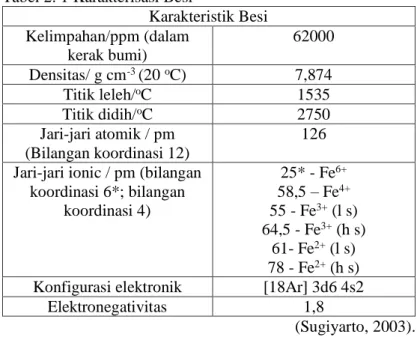
karakteristik besi ditunjukan pada Tabel 2.1 Tabel 2. 1 Karakterisasi Besi
Karakteristik Besi Kelimpahan/ppm (dalam kerak bumi) 62000 Densitas/ g cm-3 (20 oC) 7,874 Titik leleh/oC 1535 Titik didih/oC 2750 Jari-jari atomik / pm (Bilangan koordinasi 12) 126 Jari-jari ionic / pm (bilangan
koordinasi 6*; bilangan koordinasi 4) 25* - Fe6+ 58,5 – Fe4+ 55 - Fe3+ (l s) 64,5 - Fe3+ (h s) 61- Fe2+ (l s) 78 - Fe2+ (h s)
Konfigurasi elektronik [18Ar] 3d6 4s2
Elektronegativitas 1,8
8
Besi alami mudah berkarat ketika terkena udara dan lembab. Besi lebih berguna ketika dikombinasikan dengan unsur lain sebagai logam campuran untuk membuat baja, unsur lain yang dapat dikombinasikan yaitu karbon, nikel, kromium, dan titanium. Di alam, besi dikombinasikan dengan unsur-unsur lain membentuk bijih besi, seperti bijih oksida dan mineral limonit. Umumnya zat besi dalam air berasal dari pelepasan senyawa besi kedalam tanah, pencucian ke air tanah dimana besi akan mendistribusikan ke sumur dan akuifer yang digunakan untuk memasok minum (Kanyarak dkk., 2015).
Metoda yang digunakan untuk analisa besi antara lain metoda ICP-AES, elektroforesis kapiler dengan metode deteksi ultraviolet, spektrometri serapan atom, selektif ion membran potensiometri sensor, kombinasi analisis injeksi, ion kromatografi mikro kolom dengan deteksi UV-Vis (Shujuan, 2015).
2.3 Orto- Fenantrolin
Ligan merupakan gugus atom netral atau ion yang mampu bertindak sebagai basa lewis yaitu menyediakan pasangan elektron menyendiri untuk mengadakan ikatan koordinasi dengan atom pusat dalam senyawa kompleks (Sugiarto dkk., 2010). Ligan dengan satu atom donor disebut ligan monodentat; ligan dengan dua atom donor disebut ligan bidentate; ligan dengan tiga atom donor disebut ligan tridentat; ligan dengan empat atom donor disebut ligan tetradentat; ligan dengan lima atom donor disebut ligan pentadentat; ligan dengan enam atom donor disebut ligan heksadentat (Effendy, 2007).
Senyawa 1,10-fenantrolin adalah ligan bidentat yang memainkan peran penting dalam pengembangan koordinasi kimia dan masih cukup menarik sebagai bahan awal yang serbaguna baik untuk organik, anorganik, maupun supramolekul kimia. Phen berbentuk kaku planar, bersifat hidrofobik, miskin elektron dengan sistem heteroatomik
9
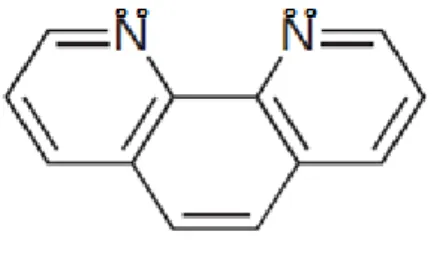
dimana atom nitrogen bertindak kooperatif dalam mengikat kation. Fitur-fitur strukturalnya memiliki kemampuan untuk menentukan koordinasi menuju ion logam. Gambar ligan 1,10-fenantrolin ditunjukkan pada Gambar 2.2
Gambar 2. 2 Ligan 1,10-Fenantrolin
(Andrea dkk., 2010). Senyawa 1,10-Fenantrolin membentuk kompleks yang kuat dengan Fe(II) dengan absorptivitas pada daerah visible dan relatif lebih murah sehingga menjadi pilihan reagen yang tepat pada penentuan besi. Ilmuwan menyadari bahwa analisa ini dapat digunakan untuk analisa kimia. Pada awal analisa, fenantrolin digunakan untuk menentukan kandungan Fe pada jus buah dan wine. Rentang pH yang optimal untuk 1,10-fenantrolin yaitu berada pada 2-9 (Amonette, 1998).
2.4 Strontium (Sr)
Strontium merupakan unsur yang memiliki isotop radioaktif seperti 89Sr (t ½ = 50,5 d) dan 90Sr (t ½ = 28,5y) yang
diproduksi dengan tingkat tinggi selama reaksi fisi dan dianggap sebagai salah satu radionukleotida yang paling penting dari sudut pandang limbah radioaktif (T. Shahwan, 2005). Strontium merupakan logam lunak dengan warna putih keperakan. Permukaannya dioksidasi oleh udara pada suhu kamar, dan menjadi oksidanya, SrO dan nitridanya Sr3N2, pada
suhu tinggi (Saito, 1996). Strontium biasa digunakan dalam kembang api, kaca, dan warna tabung televisi. Strontium memiliki karakteristik yang ditunjukkan pada Tabel 2.2
10 Tabel 2. 2 Karakteristik strontium
Karakteristik 38Strontium Konfigurasi Elektronik [36Kr] 5s2 Titik Leleh/oC 768 Titik Didih/oC 1384 Densitas / g cm-3 (20oC) 2,58 Jari-jari atomik/pm 215 Jari-jari Ionik / pm 132
Potesnial reduksi standar -2,89
∆Hionisasi / kJ mol-1 164
Elektonegativitas 1,0
Warna nyala Krimson (merah tua) (Sugiyarto, 2003) 2.5 Barium (Br)
Barium berwarna keabu-abuan, bereaksi lambat dengan oksigen udara pada temperatur kamar tetapi terbakar hebat pada pemanasan. Barium dapat menghasilkan dioksida (2-) dalam kondisi oksigen berlebihan. Barium merupakan unsur alkali tanah (Z= 56), senyawa yang digunakan dalam berbagai industri seperti kaca, cat, keramik (Celebi dkk., 2007) elektronika, industri tekstil, gelas keramik, pada pembuatan kertas, pada farmasi, pada kosmetik dan pada industri minyak dan gas (WHO, 2004). Meskipun barium tidak ditemukan bebas di alam, tetapi terdapat di sejumlah senyawa yang paling umum yaitu barium sulfat (barit) dan pada tingkat yang lebih rendah terdapat barium karbonat.
Barium memiliki sejumlah isotop radioaktif tetapi yang paling penting berada 133Ba (t ½ = 10,7 tahun) yang memiliki paruh waktu yang relative lama dan 104 Ba (t ½ = 12,97 hari) yang merupakan produk fisi yang dihasilkan dalam produksi tinggi. Selain itu, Ba merupakan analog ideal dengan Ra karena keduanya terjadi pada kelompok yang sama dan
11
memiliki jari-jari ionik yang berdekatan (Ba2+ = 1,34 amstrong,
Ra2+ 1,23 amstrong). (Celebi dkk, 2007). Barium memiliki
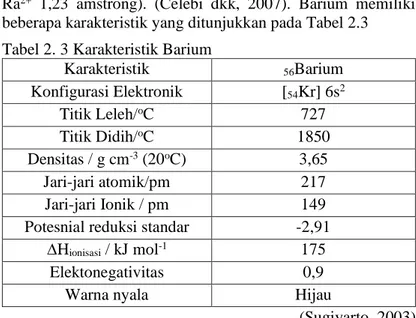
beberapa karakteristik yang ditunjukkan pada Tabel 2.3 Tabel 2. 3 Karakteristik Barium
Karakteristik 56Barium Konfigurasi Elektronik [54Kr] 6s2 Titik Leleh/oC 727 Titik Didih/oC 1850 Densitas / g cm-3 (20oC) 3,65 Jari-jari atomik/pm 217 Jari-jari Ionik / pm 149
Potesnial reduksi standar -2,91
∆Hionisasi / kJ mol-1 175
Elektonegativitas 0,9
Warna nyala Hijau
(Sugiyarto, 2003) Menurut paten dengan inventor Forrow (Forrow, 2012) barium dan strontium dapat membentuk kompleks dengan 1,10-fenantrolin-5,6-dione yang ditunjukkan pada Gambar 2.3
Gambar 2. 3 kompleks dari 1,10-fenantrolin-5,6-dione dimana M dapat berupa Nikel, Besi, Kobalt, Osmium, ruthenium, Kalsium, Strontium dan Barium.
12 2.6 Metoda Standar Analisa Besi
Metoda standar ini digunakan untuk penentuan besi dimana metoda dapat digunakan pada larutan sampel yang memiliki pH kurang dari 2. Metode pengujian ini didasarkan pada penentuan fotometri pada kompleks 1,10-fenantrolin dengan ion besi (II). Sampel dilarutkan dalam pelarut yang sesuai dan besi direduksi dengan penambahan hidroksilamin hidroklorida. Warna ini kemudian terbentuk dengan penambahan 1,10-fenantrolin. Setelah reaksi yang singkat, absorbansi larutan diukur pada sekitar 510 nm menggunakan fotometer yang sesuai. Absorbansi larutan stabil selama paling sedikit beberapa bulan. Metode pengujian ini cocok untuk menentukan konsentrasi jejak besi dalam berbagai macam produk, dengan syarat persiapkan sampel secara tepat dan sampel larut dalam air atau pelarut lain yang cocok. Metode pengujian ini mengasumsikan bahwa jumlah warna yang timbul adalah sebanding dengan jumlah zat besi dalam larutan uji. Kurva kalibrasi akan linier selama rentang telah ditetapkan. Fortune dan Mellon telah membuat studi komprehensif dari gangguan berbagai ion anorganik yang menunjukkan efek dari berbagai kation dan anion pada penentuan besi dengan konsentrasi 2,0 ppm. Jika pada tingkat maksimum 500 ppm tidak mengganggu, maka sangat mungkin bahwa ion tidak akan mengganggu dalam jumlah apapun (ASTM, 2000).
Diimbang tiga sampel dengan angka-angka secara signifikan (pH kurang dari 2) yang mengandung 1 sampai 100 μg zat besi ke dalam 100 mL. Jika sampel larut dalam air maka diencerkan sampai 80 mL dengan air. Jika sampel tidak larut dalam air, dapat digunakan metanol atau pelarut lain yang cocok. Kemudian ditambahkan masing-masing 2 mL larutan hidroksilamin hidroklorida. Diaduk dengan membalik labu ukur beberapa kali. Ditambahkan masing-masing 5 mL larutan 1,10-fenantrolin, selanjutnya disesuaikan pH larutan menjadi antara 3,0 sampai 4,0 dengan penambahan tetes demi tetes larutan asam asetat-amonium asetat ke masing-masing labu
13
ukur sampai 5 mL. Diencerkan sampai 100 ml dengan air. Dan diaduk dengan membalik labu ukur beberapa kali. Dibiarkan larutan sampel dan reagen untuk bereaksi secara sempurna pada suhu kamar selama minimal 15 menit (ASTM, 2000). 2.7 Senyawa Kompleks
Senyawa kompleks adalah senyawa yang terdiri atas atom pusat dan ligan sebagai gugus pengeliling dengan atau tanpa ion penetral. Atom pusat ini sering merupakan kelompok transisi. Ikatan antara atom pusat dengan ligan adalah ikatan koordinasi dengan atom donor dari ligan yang bersangkutan. Oleh karena itu sering disebut sebagai senyawa koordinasi, dan ini mencakup kelompok non transisi sebagai atom pusat.
Dengan 1,1-fenantrolin, Fe(II) dengan panjang gelombang 508 nm dapat membentuk kompleks yang stabil berwarna merah yang disebut sebagai Ferroin yang ditunjukkan pada Gambar 2.4. Senyawa kompleks ini stabil pada interval pH 2-9 (Dragia dkk., 2010).
14
Langkah-langkah berikut ini merupakan mekanisme pembentukan Ferroin:
Fe2+(s) + phen(aq) ↔ [Fe(phen)]2+ (aq) (2.2)
[Fe(phen)]2+ (aq)+ phen(aq) ↔ [Fe(phen)
2]2+ (aq) (2.3)
[Fe(phen)]2+ (aq)+ phen(aq) ↔ [Fe(phen)
3]2+(aq) (2.4)
(Dragia dkk., 2010). 2.8 Larutan Buffer
Buffer didefinisikan sebagai larutan yang tahan terhadap perubahan pH baik pada penambahan asam atau basa kuat (Mathew dkk., 2015). Larutan buffer terdiri dari asam lemah dan basa konjugasinya, buffer merupakan hasil dari dua reaksi kesetimbangan yang reversible dalam larutan dimana konsentrasi proton dan konjugat akseptor proton sama. Misalnya dalam sistem buffer saat konsentrasi asam dan ion asetat sama, penambahan jumlah kecil dari asam atau basa tidak memiliki pengaruh terhadap pH. Hal ini umumnya dikenal sebagai titik isoelektrik dimana pada titik ini tidak adanya muatan dan pH pada titik ini sama.
pH=pKa+ log[CH3COO -] [CH3COOH]
(Mohan, 2003). Banyak proses kimia dan biologi sangat peka terhadap perubahan pH suatu larutan, dan bukan main pentingnya untuk menjaga agar pH sekonstan mungkin. Oleh karena itu, larutan buffer cukup penting dalam sains kimia dan biologi. Pada umumnya, larutan buffer mengandung suatu pasangan asam-basa konjugasi (Day & A.L, 1996).
2.9 Natrium Tiosulfat
Natrium tiosulfat yang juga disebut sebagai natrium hiposulfit. Natrium tiosulfat merupakan sumber ion tiosulfat
15
(S2O32-) yang sangat efektif dalam ion perak yang kompleks,
dan juga merupakan reduktor moderat yang kuat. Reaksi pembentukan ion tiosulfat sebagai berikut:
S4O62- + 2e- ⇌ 2S2O32- Eo sel= +0,08
(Tuba, 2006) 2.10 Validasi Metoda Analisis
Pengembangan validasi metoda analisis meliputi linearitas, akurasi, presisi, dan rekoveri. Validasi analisis dilakukan dalam rangka menunjukkan bahwa prosedur yang dimaksudkan cocok untuk digunakan (Tedesse ,2015). 2.10.1 Linearitas
Linearitas prosedur analitis adalah kemampuan untuk mendapatkan hasil dalam pengujian secara langsung yang sebanding dengan konsentrasi dari analit dalam sampel tersebut. Linearitas biasanya dinyatakan dalam perbedaan pada sekitar slope pada garis regresi yang dihitung menurut persamaan matematis dari hasil pengujian yang diperoleh dalam analisis sampel dengan berbagai konsentrasi analit. Linearitas biasanya ditunjukkan dengan analisis berbagai konsentrasi analit di jangkauan tertentu, dan diwakili oleh grafik. Dalam keadaan normal, linearitas dicapai apabila regresi lebih besar dari 0,997 dengan minimal 5 konsentrasi yang dianjurkan (Tedesse, 2015). Korelasi antara koefisien, intercept, slope, dan jumlah kuadrat pada garis regresi harus disampaikan, serta plot data harus dimasukkan (Mcpollin, 2009).
2.10.2 Akurasi
Akurasi pada prosedur analitis adalah pengungkapan kedekatan diantara nilai yang diterima baik sebagai nilai konvensional yang sebenarnya atau nilai referensi yang diterima dan nilai yang ditemukan. Dengan demikian, akurasi adalah ukuran ketepatan metoda analisis. Akurasi juga dapat
16
digambarkan sampai sejauh mana hasil tes yang dilakukan oleh metoda (Rajendra dkk., 2014). Akurasi juga dapat ditentukan dengan membandingkan hasil tes dengan yang diperoleh dengan menggunakan validasi tes lain. ICH menyarankan akurasi harus menggunakan minimal sembilan penentuan selama minimal tiga kali tingkat konsentrasi (misalnya adalah tiga konsentrasi dan tiga replikasi untuk setiap konsentrasi) (Ravichandran, 2010).
2.10.3 Presisi
Presisi pada prosedur analitis mengungkapkan kedekatan antara serangkaian pengukuran yang diperoleh dari beberapa sampling pada sampel homogen dalam kondisi yang ditentukan. Presisi biasanya dinyatakan sebagai standar deviasi relatif (Fereja dkk., 2015). Selanjutnya, intermediet presisi yang mengungkapkan variasi dalam laboratorium seperti hari yang berbeda, peralatan yang berbeda, dan lain-lain. Intermediet presisi ditentukan dengan membandingkan hasil dari metoda run tunggal dalam laboratorium selama beberapa hari. Metoda ini memungkinkan adanya perbedaan dalam hasil yang diperoleh dari perbedaan operator, perbedaan instrument, kombinasi, standard dan reagen dari suplier yang berbeda (Patil, 2014). Presisi tergantung konsentrasi dan harus diukur pada konsentrasi yang berbeda dalam rentang kerja, biasanya dibawah, pertengahan dan bagian atas. Presisi diterima pada konsentrasi yang lebih rendah adalah 20 % (Riyanto, 2012). 2.10.4 Recovery
Recovery dari suatu analit adalah respon detektor yang diperoleh dari jumlah analit ditambahkan dan diekstrak dari matriks, dibandingkan dengan respon detektor untuk konsentrasi benar murni otentik dari standar. Recovery tidak harus 100%. Recovery dapat ditentukan dengan cara membuat sampel kemudian ditambahkan analit dengan konsentrasi tertentu (Riyanto, 2012). Nilai kisaran persentase recovery
17
yang baik untuk sampel disyaratkan berada pada rentang 100% ± 20. Rentang tersebut dianggap akurat karena menunjukkan metode tersebut mempunyai ketepatan yang baik dengan tingkat kesesuaian nilai suatu pengukuran yang sebanding dengan nilai sebenarnya (Hidayati., dkk, 2014).
18
19 BAB III
METODOLOGI PERCOBAAN 3.1 Alat dan Bahan
3.1.1 Alat
Peralatan yang digunakan dalam penelitian ini adalah seperangkat alat Spektrofotometer UV-Vis Genesys 10S, neraca analitik Ohaus, hot plate AREC, pH meter OAKION, kuvet, pengaduk, botol timbang, corong, botol semprot, stirrer, labu ukur 100 mL, beaker gelas 50 mL dan 100 mL, pipet tetes, pipet ukur 1 mL, 2 mL, 5 mL, dan 10 mL, pipet mikro, dan neraca analitik.
3.1.2 Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah FeCl3.6H2O p.a (Merck; kemurnian > 99%),
1,10-Fenantrolin monohidrat p.a (Merck), Natrium Tiosulfat Pentahidrat (Na2S2O3.5H2O), Asam asetat glasial 100 %
(CH3COOH) p.a (Merck; kemurnian > 99,5 %), Strontium
Nitrat Sr(NO3)2 p.a (Merck), Barium Nitrat Ba(NO3)2 p.a
(Merck; kemurnian > 99 %), Sodium Asetat trihydrate (CH3COONa.3H2O) p.a, aseton p.a (Merck; kemurnian> 99%),
dan aqua DM.
3.2 Prosedur Penelitian
3.2.1 Pembuatan larutan stok besi (III) 100 ppm
Larutan Fe (III) 100 ppm diperoleh dengan melarutkan 0,0484 gram FeCl3.6H2O dalam beberapa mL aqua DM,
kemudian diencerkan hingga volume 100 mL dengan aqua DM.
3.2.2 Pembuatan larutan stok Na2S2O3.5H2O 100 ppm
Larutan stok Natrium Tiosufat Pentahidrat 100 ppm diperoleh dengan cara padatan Na2S2O3.5H2O ditimbang
20
sebanyak 0,0220 gram dan dilarutkan dengan aqua DM hingga volume mencapai 100 mL
3.2.3 Pembuatan pengompleks 1,10-fenantrolin 1000 ppm Padatan 1,10-Fenantrolin monohydrate sebanyak 0,1000 gram diaduk dan dipanaskan pada suhu 70ºC dengan aqua DM hingga volume mencapai 100 mL, sehingga didapat larutan 1,10-fenantrolin 1000 ppm.
3.2.4 Pembuatan Larutan Buffer Asetat pH 4,5
Natrium asetat pentahidrat sebanyak 6,7200 gram dan asam asetat sebanyak 5 mL (Ka = 1,75 x 10-5 dilarutkan dengan aqua DM sampai volume 50 mL
3.2.5 Pembuatan larutan Sr(II) 100 ppm
Larutan Sr(II) 100 ppm dibuat dengan melarutkan padatan Sr(NO3)2 sebanyak 0,0242 gram dalam aqua DM
hingga volume 100 mL.
3.2.6 Pembuatan larutan Ba(II) 100 ppm
Larutan Ba(II) 100 ppm dibuat dengan melarutkan padatan Ba(NO3)2 sebanyak 0,0190 gram dalam aqua DM
hingga volume 100 mL.
3.2.7 Penentuan Panjang Gelombang Maksimum Fe(II)-Fenantrolin pada pH 4,5
Larutan standar Fe(III) 100 ppm sebanyak 0,5 mL dimasukkan ke dalam labu ukur 10 mL, kemudian ditambah dengan 1,1 mL larutan Na2S2O3.5H2O 100 ppm sebagai
pereduksi. Ditambahkan 1,5 mL larutan 1,10-fenantrolin 1000 ppm; 1,5 mL larutan buffer asetat pH 4,5 dan 5 mL aseton, kemudian ditambah aqua DM hingga volume mencapai 10 mL. Campuran tersebut dikocok dan didiamkan selama 15 menit, diukur absorbansinya pada panjang gelombang 400-600 nm. Dibuat variasi panjang gelombang dalam range 1 nm dan 5 nm dan dilakukan pengulangan pengukuran sebanyak 2 kali.
21
Panjang gelombang maksimum ditentukan berdasarkan absorbansi maksimum yang diperoleh (Novita, 2015).
3.2.8 Penentuan Panjang Gelombang Maksimum Sr(II)-Fenantrolin pada pH 4,5
Larutan standar Sr(II) 100 ppm sebanyak 0,5 mL dimasukkan ke dalam labu ukur 10 mL, selanjutnya diitambahkan 1,5 mL larutan 1,10-fenantrolin 1000 ppm, ditambahkan 1,5 mL larutan buffer pH 4,5 dan 5 mL aseton, kemudian ditambah aqua DM hingga volume mencapai 10 mL. Campuran tersebut dikocok dan didiamkan selama 15 menit, dan diukur absorbansinya pada panjang gelombang 300-500 nm. Dibuat variasi panjang gelombang dalam range 1 nm dan 5 nm. Dilakukan pengulangan pengukuran sebanyak 2 kali. Panjang gelombang maksimum ditentukan berdasarkan absorbansi maksimum yang diperoleh.
3.2.9 Penentuan Panjang Gelombang Maksimum Ba(II)-Fenantrolin pada pH 4,5
Larutan standar Ba(II) 100 ppm sebanyak 0,5 mL dimasukkan ke dalam labu ukur 10 mL, selanjutnya diitambahkan 1,5 mL larutan fenantrolin 1000 ppm, ditambahkan 1,5 mL larutan buffer pH 4,5 dan 5 mL aseton, kemudian ditambah aqua DM hingga volume mencapai 10 mL. Campuran tersebut dikocok dan didiamkan selama 15 menit, dan diukur absorbansinya pada panjang gelombang 300-500 nm. Dibuat variasi panjang gelombang dalam range 1 nm dan 5 nm. Dilakukan pengulangan pengukuran sebanyak 2 kali. Panjang gelombang maksimum ditentukan berdasarkan absorbansi maksimum yang diperoleh.
3.2.10 Pembuatan Kurva Kalibrasi pada pH 4,5
Larutan standar Fe (III) 100 ppm dengan volume masing-masing 0 mL; 0,1 mL; 0,2 mL; 0,3 mL; 0,4 mL; dan 0,5 mL dimasukkan kedalam labu ukur 10 mL, selanjutnya ditambah 1,1 mL larutan Na2S2O3.5H2O 100 ppm sebagai
22
pereduksi; 1,5 mL larutan fenantrolin 1000 ppm, 1,5 mL larutan buffer aserat pH 4,5, dan 5 mL aseton, kemudian ditambahkan aqua DM hingga volume 10 mL. Campuran tersebut dikocok dan didiamkan selama 15 menit dan diukur absorbansi pada panjang gelombang 510 nm. Dilakukan pengulangan pengukuran sebanyak 2 kali. Panjang gelombang maksimum ditentukan berdasarkan absorbansi maksimum yang diperoleh (Novita, 2015).
3.2.11 Pengaruh Sr(II) Pada Fe(II)-Fenantrolin dengan Kondisi pH 4,5
Larutan standar Fe (III) 100 ppm sebanyak 0,5 mL dimasukkan ke dalam 6 labu ukur 10 mL, selanjutnya ditambah 1,1 mL larutan Na2S2O3.5H2O 100 ppm sebagai pereduksi; 0
mL; 0,02 mL; 0,04 mL; 0,06 mL; 0,08 mL dan 0,1 mL larutan Sr(II) 100 ppm. Selanjutnya, ditambahkan 1,5 mL larutan fenantrolin 1000 ppm; 1,5 mL larutan buffer aserat pH 4,5, dan 5 mL aseton, Campuran tersebut dikocok dan didiamkan selama 15 menit, dan diukur absorbansi pada panjang gelombang 510 nm. Dilakukan pengulangan pengukuran sebanyak dua kali dan dibuat kurva antara absorbansi dengan konsentrasi larutan Sr(II). Dari kurva tersebut dapat diketahui pada konsentrasi berapa Sr(II) mulai mengganggu analisa besi. 3.2.12 Pengaruh Ba(II) Pada Fe(II)-Fenantrolin dengan
Kondisi pH 4,5
Larutan standar Fe (III) 100 ppm sebanyak 0,5 mL dimasukkan ke dalam 6 labu ukur 10, selanjutnya ditambah 1,1 mL larutan Na2S2O3.5H2O 100 ppm sebagai pereduksi 0 mL;
0,02 mL; 0,04 mL; 0,06 mL; 0,08 mL; dan 0,1 mL larutan Ba(II) 100 ppm. Selanjutnya, ditambahkan 1,5 mL larutan fenantrolin 1000 ppm; 1,5 mL larutan buffer aserat pH 4,5, dan 5 mL aseton, Campuran tersebut dikocok dan didiamkan selama 15 menit, dan diukur absorbansi pada panjang gelombang 510 nm. Dilakukan pengulangan pengukuran sebanyak dua kali dan dibuat kurva antara absorbansi dengan
23
konsentrasi larutan Ba(II). Dari kurva tersebut dapat diketahui pada konsentrasi berapa Ba(II) mulai menganggu analisa besi.
24
25 BAB IV
HASIL DAN PEMBAHASAN
Penelitian perbandingan pengaruh ion barium(II) dan strontium(II) pada kompleks Fe sebagai Fe(II)-Fenantrolin pada pH 4,5 telah dilakukan dengan metoda spektrofotometer UV-Vis. Metoda spektrofotometer UV-Vis melibatkan pengukuran jumlah radiasi ultraviolet atau radiasi visibel yang diserap oleh suatu zat dalam larutan. Spektrofotometer UV-Vis digunakan untuk mengukur rasio, atau fungsi dari rasio, dari intensitas dua berkas cahaya pada wilayah UV-Vis (Siladitya,2012). Penelitian ini dilakukan pada Laboratorium Instrumentasi dan Sains Analitik Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam.
Pada dasarnya besi (III) direduksi terlebih dahulu menjadi besi (II) dengan natrium tiosulfat pentahidrat. Besi (II) akan dikomplekskan dengan ligan bidentat berupa 1,10-fenantrolin yang membentuk warna merah-orange pada kisaran 500 nm. Namun, pada penelitian ini sebelum besi (II) dikomplekskan terlebih dahulu ditambahkan ion pengganggu berupa strontium dan barium dengan 6 variasi. Penambahan kedua ion akan menimbulkan kompetisi dengan Fe(II) yang ditunjukkan dengan adanya penurunan persen recovery seiring dengan penambahan ion strontium (II) dan ion barium (II). Berikut merupakan hasil penelitian dan penjelasannya.
4.1 Penentuan Panjang Gelombang Maksimum Fe(II)-Fenantrolin pada pH 4,5
Pada tahap ini bertujuan untuk mengetahui panjang gelombang maksimum Fe(II) fenantrolin yang akan digunakan pada tahapan selanjutnya. Besi yang digunakan adalah FeCl3.6H2O berbentuk serbuk berwarna hitam kehijauan yang
dilarutkan dengan aqua DM karena memiliki sifat yang dapat larut dalam air, warna larutan yang terbentuk adalah kuning yang merupakan larutan Fe3+. Hasil yang diharapkan berupa
26
Fe2+ sehingga, digunakan larutan pereduksi natrium tiosulfat
pentahidrat yang berbentuk kristal tidak berwarna dengan reaksi yang terjadi yaitu:
2Fe3+
(aq) + 2S2O32-(aq) ↔2Fe2+ (aq) + S4O62-(aq) Eo sel = +0,779
(Hapsoro, 2012). Larutan natrium tiosulfat pentahidrat dipilih karena merupakan pereduksi yang kuat untuk besi selain itu menurut penelitian yang diungkapkan oleh Hapsoro (Hapsoro,2012) bahwa natrium tiosulfat dapat mereduksi larutan Fe3+ dengan
persen recovery yang tinggi. Setelah penambahan pereduksi maka dilakukan penambahan 1,10-fenantrolin dan larutan buffer dengan pH 4,5 sehingga, terbentuk kompleks Fe(II) fenantrolin yang ditandai dengan perubahan warna dari kuning menjadi merah-orange. Seperti pada penelitian yang dikemukakan oleh Oktavia (Oktavia, 2008) bahwa warna kompleks Fe(II) fenantrolin adalah merah orange dimana 1,10-fenantrolin akan membentuk kompleks dengan Fe(II) pada pH 2-9 karena, pembentukan kompleks Fe(II) fenantrolin bergantung pada pH dan kompleks Fe(II) fenantrolin stabil selama 2 jam atau lebih dengan reaksi pembentukan yang terjadi adalah:
Fe2+ + 3C
12H8N2 [Fe(C12H8N2)3]2+
Pembentukan Fe(II)-Fenantrolin membentuk hibridisasi sebagai berikut: 26Fe = 18[Ar] 4s2 3d6
↿⇂
↿
↿
↿
↿
↿⇂
3d 4s Fe2+ = 18[Ar] 4s0 3d6
↿⇂
↿
↿
↿
↿
3d 4s
27 [Fe(C12H8N2)3]2+
↿⇂
↿⇂
↿⇂
⦁⦁
⦁⦁
⦁⦁
⦁⦁
⦁⦁
⦁⦁
3d 4s 4p
Dimana: ↿⇂ merupakan pasangan elektron atom pusat ⦁⦁ merupakan pasangan elektron ligan
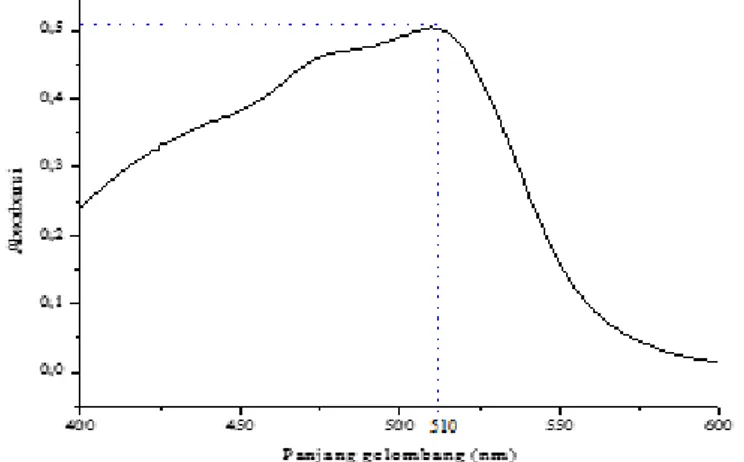
Pengukuran dengan spektrofotometer UV-vis yang telah dilakukan, didapatkan hasil dari panjang gelombang maksimum Fe(II)-Fenantrolin yaitu terdapat pada Gambar 4.1:
Gambar 4. 1 Panjang gelombang maksimum Fe(II)-Fenantrolin pada pH 4,5
Gambar 4.5 menunjukkan bahwa panjang
gelombang maksimum Fe(II)-Fenantrolin berada pada
510 nm dengan absorbansi 0,506. Hal ini sesuai dengan
penelitian yang dilakukan oleh (Oktavia,2008) bahwa
panjang gelombang maksimum untuk Fe(II) fenantrolin
berada pada kisaran 510 nm.
28
4.2 Penentuan Panjang Gelombang Maksimum Sr(II)-Fenantrolin pada pH 4,5
Sr(II)-fenantrolin memiliki bentuk cairan tidak berwarna dan tidak berbau. Tujuan menentukan panjang gelombang Sr(II)-Fenantrolin adalah untuk mengetahui pada konsentrasi berapa Sr mulai menganggu kompleks Fe(II)-fenantrolin. Pada penelitian ini digunakan Strontium Nitrat berbenuk padat tidak berwarna, tidak berbau yang dilarutkan dalam aqua DM sebagai penghasil Sr(II) karena sifat dari Sr(NO3)2 yang dapat larut dalam air. Hal ini sesuai yang
disampaikan oleh Sugiyarto (Sugiyarto, 2003) bahwa logam golongan alkali tanah yang larut dalam air adalah garam-garam nitrat dan klorida (dari anion valensi tunggal) sedangkan yang sukar larut adalah garam-garam seperti karbonat, dan fosfat (anion bervalensi ganda). Berdasarkan konfigurasi electron ion Sr(II) pada pembentukan dengan 1,10-fenantrolin akan membentuk hibridisasi sp3 dengan struktur molekulnya yaitu
tetrahedral, hibridisasi tersebut ditunjukkan sebagai berikut, :
38Sr = 36[Kr] 5s2
↿⇂
5s Sr2+ = 36[Kr] 5s0 ; maka [Sr(C12H8N2)2]2+
⦁⦁
⦁⦁
⦁⦁
⦁⦁
5s 5p
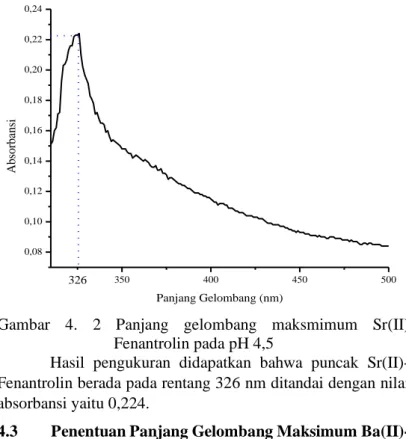
Pengukuran lamda maksimum Sr(II)-Fenantrolin dilakukan pada panjang gelombang 310-500 nm. Pada penentuan panjang gelombang dilakukan pendiaman selama 15 menit agar Sr(II) dapat bergabung secara sempurna pada
29
larutan fenantrolin. Grafik panjang gelombang maksimum Sr(II)-Fenantrolin ditunjukan pada Gambar 4.2:
Gambar 4. 2 Panjang gelombang maksmimum Sr(II) Fenantrolin pada pH 4,5
Hasil pengukuran didapatkan bahwa puncak Sr(II)-Fenantrolin berada pada rentang 326 nm ditandai dengan nilai absorbansi yaitu 0,224.
4.3 Penentuan Panjang Gelombang Maksimum Ba(II)-Fenantrolin pada pH 4,5
Ba (NO3)2 mempunyai sifat yang larut dengan air yang
akan menghasilkan ion Ba(II). Ba(II)-Fenantrolin tidak berwarna dan tidak berbau. Pengukuran terhadap panjang gelombang Ba(II)-Fenantrolin yaitu untuk menentukan pada konsentrasi berapa Ba mulai menganggu kompleks Fe(II)-Fenantrolin. Ketika Ba(II) dikomplekskan dengan fenantrolin terbentuk hibridisasi sebagai berikut:
350 400 450 500 0,08 0,10 0,12 0,14 0,16 0,18 0,20 0,22 0,24 A b so rb an si Panjang Gelombang (nm) 326
30 56Ba = 54[Xe] 6s2
↿⇂
6s Ba2+ = 54[Xe] 6s0 maka; [Ba(C12H8N2)2]2+
⦁⦁
⦁⦁
⦁⦁
⦁⦁
5s 5p
Ba(II)-Fenantrolin dilakukan pengukuran dengan rentang yang sama seperti Sr(II)-Fenantrolin yaitu pada 310-500 nm.
Gambar 4. 3 Panjang gelombang maksimum Ba(II) Fenatrolin pada pH 4,5
Hasil pengukuran didapatkan puncak Ba(II)-Fenantrolin yaitu pada 315 nm dengan absorbansi sebesar 0,457. 350 400 450 500 0,0 0,1 0,2 0,3 0,4 0,5 A b so rb an si Panjang Gelombang (nm) 315
31
4.4 Kurva Kalibrasi Fe(II)-Fenantrolin
Pembuatan kurva kalibrasi dimaksudkan agar mendapatkan persamaan linear y=ax+b dimana y merupakan asorbansi yang didapat dan x adalah konsentrasi yang dicari. Kurva standar Fe(II)-fenantrolin akan digunakan untuk mengetahui pada konsentrasi berapa Fe sebagai Fe(II)-fenantrolin mulai terganggu dengan keberadaan barium (II) dan strontium (II).
Larutan Fe(II)-Fenantrolin yang digunakan sebagai standar memiliki 5 variasi konsentrasi yaitu 1, 2, 3, 4 dan 5 ppm memiliki warna merah-orange dengan kepekatan yang berbeda. Dimana, semakin tinggi konsentrasi Fe maka akan semakin pekat warna yang dihasilkan.
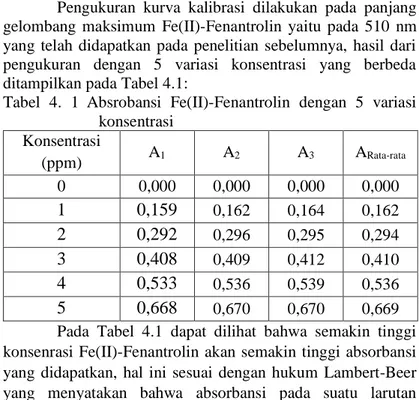
Pengukuran kurva kalibrasi dilakukan pada panjang gelombang maksimum Fe(II)-Fenantrolin yaitu pada 510 nm yang telah didapatkan pada penelitian sebelumnya, hasil dari pengukuran dengan 5 variasi konsentrasi yang berbeda ditampilkan pada Tabel 4.1:
Tabel 4. 1 Absrobansi Fe(II)-Fenantrolin dengan 5 variasi konsentrasi Konsentrasi (ppm) A1 A2 A3 ARata-rata 0 0,000 0,000 0,000 0,000
1
0,159
0,162 0,164 0,1622
0,292
0,296 0,295 0,2943
0,408
0,409 0,412 0,4104
0,533
0,536 0,539 0,5365
0,668
0,670 0,670 0,669 Pada Tabel 4.1 dapat dilihat bahwa semakin tinggi konsenrasi Fe(II)-Fenantrolin akan semakin tinggi absorbansi yang didapatkan, hal ini sesuai dengan hukum Lambert-Beer yang menyatakan bahwa absorbansi pada suatu larutan32
berbanding lurus dengan konsentrasi spesies yang diserap dalam larutan (R. Gandhimathi, 2012).
Setelah didapatkan absorbansi dari masing-masing konsentrasi maka diplot ke dalam kurva dengan x berupa konsentrasi dan y berupa absorbansi, dimana hasil dari kurva kalibrasi dtunjukkan pada Gambar 4.4
Gambar 4. 4 Kurva kalibrasi Fe(II)-Fenantrolin
Gambar 4.4 menunjukkan bahwa R2 = 0,9975 dan r =
0,9987 yang menyatakan bahwa kurva kalibrasi dapat digunakan. Selain itu, menurut (Riyanto, 2012) parameter hubungan kelinieran yang digunakan yaitu koefisien korelasi (r) dan koefisien determinasi (R) pada analisis regresi linier y = ax + b dimana a adalah slope dan b adalah intersep, x adalah konsentrasi analit dan y adalah respon instrument. Hubungan linier yang ideal dicapai jika nilai a=0 dan r = +1 atau -1.
33
4.5 Panjang gelombang Fe(II)-Fenantrolin dan Ion Pengganggu
Keberadaan Sr(II) dan Ba(II) dapat menganggu Fe(II)-Fenantrolin dapat terlihat dari perhitungan sebagai berikut. Diketahui bahwa massa 5 ppm FeCl3.6H2O sebesar 0,0024
gram, massa 11 ppm Na2S2O3.5H2O sebesar 0,0024 gram dan
massa 150 ppm 1,10-fenantrolin monohidrat sebesar 0,0160 gram. Maka, dilakukan perhitungan sebagai berikut:
Mol Fe3+ = 0,0024 𝑔𝑟𝑎𝑚 270,47 𝑔𝑟𝑎𝑚/𝑚𝑜𝑙= 8,87 x 10 -6 mol Mol S2O32- = 0,0024 𝑔𝑟𝑎𝑚 248,19 𝑔𝑟𝑎𝑚/𝑚𝑜𝑙
=
9,67 x 10 -6 mol Mol C12H8N2= 0,016 𝑔𝑟𝑎𝑚 198,22 𝑔𝑟𝑎𝑚/𝑚𝑜𝑙= 8,07 x 10 -5 mol 2Fe3+(aq) + 2S2O32-(aq) ↔ 2Fe2+ (aq) + S4O62-(aq)
8,87 x 10-6 9,67 x 10-6 - - 8,87 x 10-6 8,87 x 10-6 8,87 x 10-6 4,43 x 10-6 - 8 x 10-7 8,87 x 10-6 4,43 x 10-6 Fe2+ + 3C 12H8N2 → [Fe(C12H8N2)3]2+ 8,87 x 10-6 8,07 x 10-5 - 8,87 x 10-6 1,13 x 10-5 4,43 x 10-6 - 6,74 x 10-5 4,43 x 10-6
Perhitungan diatas menunjukkan bahwa terdapat fenantrolin yang berlebih pada reaksi pembentukan Fe(II) fenantrolin, sehingga fenantrolin tersebut dapat berikatan dengan Sr dan Ba. Selain itu berdasarkan potensial reduksi bahwa natrium tiosulfat tidak dapat mereduksi Sr2+ maupun
Ba2+ menjadi Sr maupun Ba, hal tersebut dapat diamati melalui
34
S4O62- + 2e ⇌ 2S2O32- Eo = + 0,08 (Katoda)
Ba2+ + 2e-⇌ Ba Eo = -2,096 (Anoda)
Sr2+ + 2e-⇌ Sr Eo = -2,89 (Anoda)
Dimasukkan nilai katoda dan anoda pada formula : E sel = Eo Katoda- Eo Anoda
Maka untuk Ba;
E sel = + 0,08 – ( 2,096) E sel = -2,016 V
Pada Sr;
E sel = + 0,08 – (2,89) E sel = -2,81 V
Setelah dilakukan perhitungan diatas maka diketahui bahwa Sr dan Ba memiliki kemampuan untuk menggantikan posisi Fe pada Fe (II) fenantrolin. Sehingga, dilakukan tahapan selanjutnya untuk menentukan pada konsentrasi berapa Fe(II) mulai terganggu.
4.6 Pengaruh Ion Strontium dan Barium pada pembentukan Fe sebagai Fe(II)-Fenantrolin
Pada tahap ini, dilakukan dengan 6 variasi konsentrasi larutan Sr(II) dan Ba(II) yang berbeda yaitu 0, 0,2, 0,4, 0,6, 0,8 dan 1 ppm. Pada penggunaan ion penganggu digunakan ion Strontium dan ion Barium karena kedua ion ini dapat membentuk kompleks dengan fenantrolin. Sehingga, dilakukan analisa perbandingan pengaruh pengukuran konsentrasi Fe(II)-Fenantrolin yang mulai terganggu oleh keberadaan Sr(II) dan Ba(II). Larutan yang berwarna merah-orange diukur pada panjang gelombang maksimum Fe(II)-Fenantrolin yaitu 510 nm. Menurut Ravichandran (Ravichandran, 2010) akurasi harus menggunakan minimal sembilan penentuan selama minimal tiga kali tingkat konsentrasi (misalnya adalah tiga
35
konsentrasi dan tiga replikasi untuk setiap konsentrasi). Oleh karena itu, absorbansi pada masing-masing konsentrasi ditambahkan dan dibagi sesuai dengan jumlah pengulangan sehingga didapatkan absorbansi rata-rata. Hasil pengukuran pada pengaruh ion Strontium dan ion Barium dapat dilihat pada Tabel 4.2 dan 4.3.
Tabel 4. 2 Hasil absorbansi penambahan Sr(II) pada Fe(II)-Fenantrolin [Sr2+](ppm) A 1 A2 A3 ARata-rata 0,0 0,641 0,640 0,640 0,640 0,2 0,538 0,539 0,541 0,539 0,4 0,499 0,501 0,503 0,501 0,6 0,490 0,491 0,494 0,492 0,8 0,410 0,414 0,417 0,414 1,0 0,391 0,394 0,396 0,394
Tabel 4. 3 Hasil absorbansi penambahan Ba(II) pada Fe(II)-Fenantrolin [Ba2+] (ppm) A 1 A2 A3 ARata-rata 0,0 0,641 0,640 0,640 0,640 0,2 0,564 0,567 0,571 0,567 0,4 0,514 0,517 0,519 0,517 0,6 0,,489 0,493 0,494 0,492 0,8 0,408 0,413 0,415 0,412 1,0 0,390 0,390 0,392 0,391
Konsentrasi masing-masing Fe dihitung menggunakan persamaan yang didapatkan pada analisa sebelumnya yaitu :
Y= 0,1309 x + 0,0178
Setelah didapatkan data konsentrasi Fe, maka dihitung persen recovery. Perhitungan ini bertujuan untuk mengetahui pada konsentrasi berapa Fe mulai terganggu. Persen recovery yang
36
baik berada pada rentang 80-120 %. Hasil perhitungan persen recovery dapat dilakukan dengan formula:
% 𝑟𝑒𝑐𝑜𝑣𝑒𝑟𝑦 = 𝐾𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝐹𝑒 𝑎𝑘ℎ𝑖𝑟 𝐾𝑜𝑛𝑠𝑒𝑛𝑡𝑟𝑎𝑠𝑖 𝐹𝑒 𝑎𝑤𝑎𝑙 𝑥 100
Persen recovery pada pengaruh Strontium dan Barium dapat dilihat pada Tabel 4.4 dan 4.5 sebagai berikut:
Tabel 4. 4 Hasil pengukuran [Fe2+] dan persen recovery pada
penambahan Sr(II)
[Sr2+](ppm) [Fe2+] yang terukur (ppm) % Recovery
0 4,753 95,060 0,2 3,991 83,968 0,4 3,670 77,214 0,6 3,631 76,394 0,8 3,034 63,833 1 2,881 60,614
Tabel 4. 5Hasil pengukuran [Fe2+] dan persen recovery pada
penambahan Ba(II)
[Ba2+] ppm [Fe2+] yang terukur (ppm) % Recovery
0 4,753 95,060 0,2 4,205 88,470 0,4 3,822 80,412 0,6 3,631 76,394 0,8 3,018 63,497 1 2,857 60,109
Dari Tabel diatas maka dapat dilihat bahwa Fe mulai terganggu dengan keberadaan Sr(II) pada konsentrasi 0,4 ppm dan Ba(II) pada konsentrasi 0,6 ppm. Untuk melihat lebih jelas maka ditunjukkan pada grafik yang dirujuk pada Gambar 4.5 dan 4.6
37
Gambar 4. 5Kurva pengaruh Sr (II) pada Fe((II) Fenantrolin dengan pH 4,5
Gambar 4. 6 Kurva pengaruh Ba (II) pada Fe((II) Fenantrolin dengan pH 4,5 0,0 0,2 0,4 0,6 0,8 1,0 60 65 70 75 80 85 90 95 100 Re co ve ry ( %) Konsentrasi Sr (II) (ppm)
ion Sr (II) Mulai Mengganggu
0,0 0,2 0,4 0,6 0,8 1,0 55 60 65 70 75 80 85 90 95 100 Re co ve ry ( %) Konsentrasi Ba (II) (ppm)
38
Hasil tersebut menunjukan bahwa terdapat perbedaan yang signifikan diantara ion barium dan strontium. Hal ini dikarenakan adanya perbedaan periode pada barium dan strontium. Periode barium yaitu 6 dengan orbital 5d sementara periode strontium 5 dengan orbital 4d sehingga medan kristal Sr(II) > Ba (II). Dimana dalam satu golongan dari atas ke bawah terjadi kenaikan muatan inti efektif dengan bertambahnya periode. Kenaikan yang terjadi disebabkan oleh efek shielding orbital dimana 5d<4d<3d. Kenaikan muatan inti efektif menyebabkan ligan tertarik lebih dekat ke ion pusat, sehingga interaksi antara ligan dengan elektron pada orbital d semakin kuat dan pemisahan orbital d semakin besar (Effendy, 2007).
Fe mulai terganggu dengan keberadaan strontium dan barium ditandai dengan berkurangnya persen recovery dari Fe(II) fenantrolin. Pada saat strontium dan barium direaksikan dengan ligan 1,10-fenantrolin tidak menghasilkan warna karena strontium dan barium memiliki orbital d yang telah terisi penuh. Menurut Effendy (Effendy, 2010) senyawa-senyawa kompleks yang tidak berwarna dapat terjadi apabila senyawa tersebut menyerap sinar didaerah ultraviolet (λ < 400 nm). Selain itu, dapat juga terjadi karena atom pusat memiliki orbital d yang telah terisi penuh oleh elektron atau orbital d yang tidak terisi elektron. Pada saat, strontium dan barium secara sengaja ditambahkan pada Fe(II) fenantrolin terjadi penurunan intensitas warna kompleks pada Fe(II) fenantrolin yang ditandai dengan adanya penurunan absorbansi yang mengakibatkan konsentrasi Fe menurun, sehingga persen recovery berkurang.
39 BAB V KESIMPULAN
Dari penelitian perbandingan pengaruh ion Ba2+ dan Sr2+ dalam
analisa Fe sebagai Fe2+ fenantrolin yang telah dilakukan maka
dapat disimpulkan bahwa:
1. Panjang gelombang maksimum Fe(II)-Fenantrolin berada pada 510 nm dengan absorbansi 0,504 sesuai dengan teori yang ada.
2. Panjang gelombang maksimum Sr(II)-Fenantrolin berada pada 326 nm dengan absorbansi 0,224.
3. Panjang gelombang maksimum Ba(II)-Fenantrolin berada pada 315 nm dengan absorbansi 0,457.
4. Kurva kalibrasi Fe(II)-Fenantrolin mempunyai nilai korelasi sebesar 0,9975.
5. Fe(II)-Fenantrolin mulai terganggu dengan keberadaan ion strontium (II) pada konsentrasi 0,4 ppm dan ion barium (II) 0,6 ppm dengan persen recovery masing-masing 77,214 % dan 76,394 %
40
41
DAFTAR PUSTAKA
Adeeyinwo C.E, O. N. (2013). Basic Calibration of UV/ Visible Spectrophotometer. International Journal of Science and Technology Volume 2, 247-251.
Agustina, F. T. (2007). Ekstraksi Fe (II)-1,10-Fenantrolin Menggunakan Metode Cloud Point Dengan Surfaktan Tween 80. Surakarta: Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret.
Alaa S. Amin, A. A. (2008). Utility of solid-phase spectrophotometry for determination of dissolved iron(II) and iron(III) using 2,3-dichloro-6-(3-carboxy-2-hydroxy-1-naphthylazo)quinoxaline. Journal of Talanta, 1241-1245.
Amonette, J., & C, T. (1998). Improvements to The Quantitative Assay of Non Refractory Mineral for Fe(II) and Total Fe Using 1,10-Phenanthroline. Journal of Clays and Clay Minerals Vol 46 No 1, 51-62.
Andrea Bencini, V. L. (2010). 1,10-Phenanthroline: A versatile building block for the construction of ligands for various purposes. Coordination Chemistry Reviews, 2096-2180. Andreana Rifki, R. D. (2013). Pengaruh Penambahan Al3+ dalam
Penentuan Analisa Fe2+ pada pH 4,5 dengan Pengompleks
1,10-Fenantrolin secara Spektrofotometri Sinar Tampak. Jurnal Sains dan Seni POMITS.
ASTM. (2000). Standard Test Method for Iron in Trace Quantities Using the 1,10-Phenanthroline Method. United States: ASTM Committee E15.
Celebi, u. S. (2007). A radiotracter study of the adsorption behavior of aqueous Ba2+ ions on nanoparticles of zero valent iron.
Journal of Hazardous Materials 148, 761-767.
Day, R., & A.L, U. (1996). Analisis Kimia Kuantitatif . Jakarta: Erlangga.
Dragia Lazic, B. S. (2010). Stability of Tris-1,10-Phenanthroline Iron (II) Complex in Different Composites. Journal of Chemical Industry & Chemical Engineering, 193-198.
42
Effendy, P. (2007). Kimia Koordinasi Jilid 1. Malang: Bayumedia. Forrow, N. J. (2012). Mediator Stabilized Reagent Compositions For Use In Biosensor Electrodes. United States: Patent Apllication Publication.
Hapsoro, R. D. (2012). Perbandingan Kemampuan Pereduksi Natrium Tiosulfat dengan Kalium Oksalat pada Analisa Kadar Total Besi Secara Spektrofotometri Uv-Vis. Institut Teknologi Sepuluh Nopember.
Hasan, H. (2005). Understanding the Elements of the Periodic Table "IRON". New York: The Rosen Publishing Group, Inc.
Hidayati, E. N., Alauhdin, M., & Prasetya, A. T. (2014). Perbandingan Metoda Destruksi pada Analisis Pb dalam Rambut Dengan AAS. Indonesian Journal of Chemical Science Vol 3 No 1, 36-41.
James, A., & Charles, T. (1998). Improvements to The Quantitative Assay of Nonrefractory Minerals For Fe(II) and Total Fe Using 1,10-Phenanthroline. Journal of Clays and Clay Minerals, 51-62.
Kanyarak Prasertboonyai, O.-A. A. (2015). Miniaturization of spectrophotometry based on micro flow analysis using norfloxacin as less-toxic reagent for iron determination. Journal of Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 532-537.
Kusuma, N. D., & K.S, R. S. (2016). Studi Pengaruh Ion Ca2+ dan
Ba2+ Pada Analisa Besi (III) dengan Pengompleks
1,10-Fennatrolin pada pH 3,5 Secara Spektrofotometer UV-Vis. Journal Sains dan Seni POMITS .
Latif Elci, A. A. (2008). Solid phase extraction method for the determination of iron, lead and chromium by atomic absorption spectrometry using Amberite XAD-2000 column in various water samples. Journal of Hazardous Materials, 454-461.
Matthew S. Fox, J. W. (2015). An Algebraic Derivation of Buffer Capacity. Journal of Chemical Education, 124-126. Mcpollin, O. (2009). Validation of Analytical Methods for
Pharmaceutical Analysis. United Kingdom: Mourne Training Service.