II. TINJAUAN PUSTAKA
A. Ficus racemosa, Linn 1. Taksonomi
Berikut adalah taksonomi tanaman Ara (Shikhsarthi et al., 2011). Kingdom : Plantae Subkingdom : Tracheobionata Superdivisi : Spermathophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Subkelas : Hamamelididae Ordo : Urticales FamilI : Moraceae Genus Spesies : Ficus
: Ficus racemosa, Linn atau Ficus
glomerata, Roxb
2. Habitat dan Morfologi
Ficus racemosa, Linn termasuk dalam genus ficus yang terdiri dari 750-800
spesies yang memiliki manfaat medis dan telah digunakan secara empiris untuk pengobatan berbagai penyakit (Shiksharti et al., 2011). Tanaman ini merupakan tumbuhan asli Australia, Asia Tenggara dan semenanjung India.
Biasanya tumbuh di hutan tropis dan dekat dengan air (Joseph et al., 2011). Habitat terbaik pada ketinggian sekitar 1200 m di atas permukaan laut. Tinggi tanaman dapat mencapai 12 m (Paarakh, 2009).
3. Efek Farmakologi
Dalam sistem pengobatan tradisional India, semua bagian tanaman ini dapat digunakan sebagai obat (Shikhsarthi et al., 2011). Beberapa kegunaan empiris yang pernah dilaporkan disajikan dalam Tabel 1.
Tabel 1. Penggunaan empiris tanaman Ara untuk tujuan pengobatan
Tujuan Pengobatan Referensi
1.Lepra, diare, menorhagi, gangguan pernapasan dan sirkulasi darah
2.Anti kanker dan untuk pengobatan scabies,
myalgia, epididimitis, haemoptysis dan gangguan
kesuburan
3.Gangguan ginekologi, penyakit kulit, disentri,
gonorrhoae, leucorrhoae, mennorrhagie, galactogogue, asma, diabetes dan untuk tujuan
aborsi
4.Edema, parotitis, vaginal disorders, aprodisiak, analgesik pada sakit gigi, anti infeksi dan untuk penyembuhan luka
5.Bronkitis, astringent, pengobatan abses dan anti infeksi pada mulut
6.Disentri, diabetes dan anti inflammasi
Buah Buah Batang dan kulit Lateks Daun Akar
(Joseph et al., 2010; Sharma et
al., 2008)
(Paarakh, 2009; Bheemachari et
al., 2007)
(Kumar et al., 2011; Shikhsarthi
et al., 2011)
(Paarakh, 2009)
(Bheemachari et al., 2007; Paarakh, 2009)
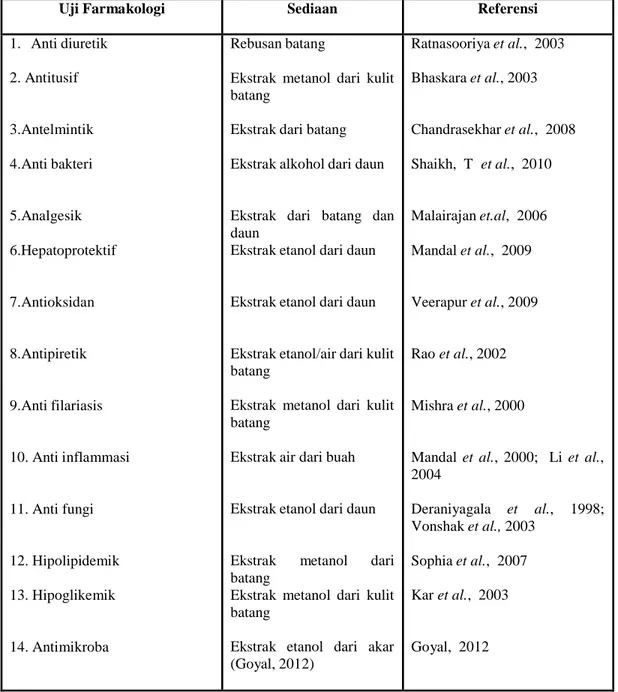
Uji farmakologis tanaman Ara yang pernah diteliti dan dilaporkan adalah seperti ditunjukkan Tabel 2.
Tabel 2. Aktivitas farmakologi tanaman Ara yang telah diteliti dan dilaporkan
Uji Farmakologi Sediaan Referensi
1. Anti diuretik 2. Antitusif 3.Antelmintik 4.Anti bakteri 5.Analgesik 6.Hepatoprotektif 7.Antioksidan 8.Antipiretik 9.Anti filariasis 10. Anti inflammasi 11. Anti fungi 12. Hipolipidemik 13. Hipoglikemik 14. Antimikroba Rebusan batang
Ekstrak metanol dari kulit batang
Ekstrak dari batang Ekstrak alkohol dari daun
Ekstrak dari batang dan daun
Ekstrak etanol dari daun Ekstrak etanol dari daun
Ekstrak etanol/air dari kulit batang
Ekstrak metanol dari kulit batang
Ekstrak air dari buah
Ekstrak etanol dari daun
Ekstrak metanol dari batang
Ekstrak metanol dari kulit batang
Ekstrak etanol dari akar (Goyal, 2012) Ratnasooriya et al., 2003 Bhaskara et al., 2003 Chandrasekhar et al., 2008 Shaikh, T et al., 2010 Malairajan et.al, 2006 Mandal et al., 2009 Veerapur et al., 2009 Rao et al., 2002 Mishra et al., 2000
Mandal et al., 2000; Li et al., 2004 Deraniyagala et al., 1998; Vonshak et al., 2003 Sophia et al., 2007 Kar et al., 2003 Goyal, 2012
4. Akar Tanaman Ara
Akar tanaman Ara berwarna kecoklatan, panjang dan memiliki rasa dan bau yang khas. Bentuknya relatif tak beraturan seperti terlihat pada Gambar 1. Menurut Krishna et al. (2011), akar mengandung glikosida, flavonoid dan senyawa fenolik lain.
Gambar 1. Tanaman Ara (Ficus racemosa, Linn) dan akar tanaman Ara (Ficus racemosa, Linn)
B. Flavonoid
1. Pengertian Umum
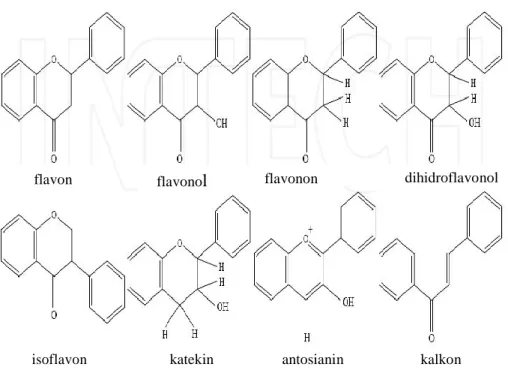
Istilah flavonoid diberikan untuk senyawa-senyawa fenol yang berasal dari flavon, yaitu nama dari salah satu jenis flavonoid yang paling banyak jumlah dan sebarannya. Senyawa flavon ini mempunyai kerangka 2 fenil kromon. Struktur senyawa ini memiliki kerangka C6-C3-C6. Pengelompokan golongan flavonoid
didasarkan pada pola substitusi pada kedua cincin aromatik dan pola yang berbeda pada C3 menjadi flavon, flavonol, flavanon, antosianidin, katekin dan kalkon.
flavon flavonol flavonon dihidroflavonol
isoflavon katekin antosianin kalkon
Gambar 2. Struktur umum senyawa flavonoid
Flavonoid merupakan metabolit sekunder yang paling banyak jumlahnya yaitu sekitar 5-10% total metabolit sekunder. Senyawa ini terdapat dalam tanaman terutama yang berpembuluh (kecuali alga). Diperkirakan 2% dari karbon yang difotosintesis tumbuhan akan menjadi flavonoid dengan struktur dan fungsi yang berbeda. Flavonoid terdapat dalam semua bagian tanaman seperti buah, biji, akar, batang, kayu batang, daun dan bunga (Markham, 1998).
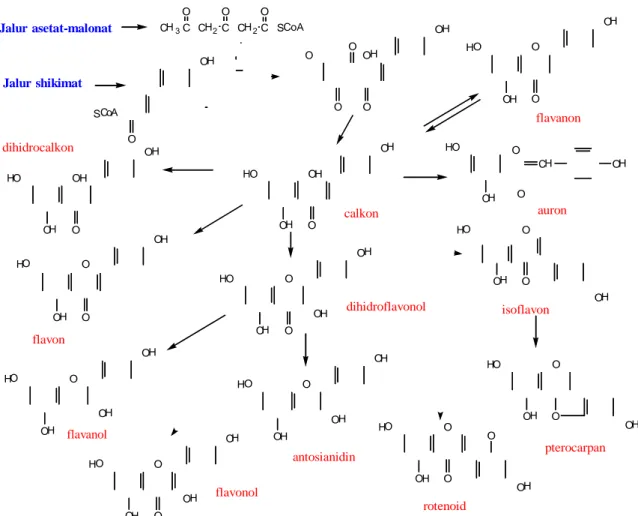
Di alam, keberadaan flavonoid umumnya tidak tunggal karena adanya pengaruh air, panas matahari dan enzim maka strukturnya cepat berubah bentuk dan seringkali terdapat pada suatu kesetimbangan. Hal ini bisa kita pahami bila melihat alur biogenesis dari flavonoid secara umum seperti Gambar 3.
Jalur asetat-malonat Jalur shikimat SCoA dihidrocalkon O CH 3 C O OH O CH2 C OH O CH 2 C SCoA O O OH O O OH OH HO OH HO O OH O O flavanon CH OH HO OH OH O HO O HO OH OH O OH HO O calkon OH OH O HO O OH O auron OH OH O flavon OH HO O OH OH O HO OH dihidroflavonol OH O OH HO O isoflavon HO O OH O OH OH flavanol OH OH O pterocarpan HO O OH flavonol antosianidin OH O OH OH O rotenoid
Gambar 3. Alur biosintesis beberapa senyawa flavonoid (Mabry et al., 1970)
2. Efek Farmakologi
Flavonoid memiliki aktivitas biologi seperti sebagai anti bakteri, anti kolesterol, anti hiperlipidemia, anti virus, anti diabetes, anti radang, anti kanker (Neldawati et al., 2013; Nakamura et al., 2003). Flavonoid juga dapat berlaku sebagai antioksidan karena sifatnya sebagai akseptor yang baik terhadap radikal bebas, yaitu suatu spesies yang memiliki satu atau lebih elektron tak berpasangan dalam orbitalnya seperti hidroksi radikal dan superoksida yang biasa disebut sebagai ROS (Reactive Oxigen Species) (Sathiskumar et al., 2008).
Efek antioksidan senyawa flavonoid disebabkan oleh adanya penangkapan radikal bebas melalui donor proton hidrogen dari gugus hidroksil flavonoid (Amic
et al., 2003). Aktivitas antioksidan pada flavonoid terutama dipengaruhi
substitusi gugus hidroksi pada posisi orto dan para terhadap gugus OH dan OR (Pratiwi, 2006).
C. Radikal bebas 1. Pengertian Umum
Secara terminologi, pengertian oksidan dan radikal bebas seringkali dianggap sama. Aktivitas keduanya menghasilkan akibat yang serupa walaupun prosesnya berbeda. Namun secara kimia, keduanya adalah berbeda karena istilah oksidan dimaksudkan untuk spesies kimia yang bisa menerima elektron, yaitu senyawa yang dapat menarik elektron seperti halnya Fe3+ yang dapat menarik elektron sehingga menjadi Fe2+ sedangkan radikal bebas adalah suatu bahan kimia baik berupa atom maupun molekul yang memiliki elektron tidak berpasangan pada lapisan luarnya (Droge, 2002).
Pada proses metabolisme normal, tubuh memproduksi radikal bebas. Atom atau molekul dengan elektron bebas ini dapat digunakan untuk menghasilkan tenaga dan beberapa fungsi fisiologis seperti kemampuan untuk membunuh virus dan bakteri dan mengatur tonus otot polos pada organ tubuh dan pembuluh darah.
Namun karena mempunyai tenaga yang sangat tinggi dan kecenderungan untuk berikatan dengan elektron dari substrat lain, zat ini akan merusak jaringan normal terutama jika jumlahnya terlalu banyak. Radikal bebas dapat mengganggu produksi DNA, lapisan lipid pada dinding sel, mempengaruhi pembuluh darah, dan produksi prostaglandin (Droge, 2002).
Radikal bebas juga dijumpai pada lingkungan, beberapa logam (misalnya besi dan tembaga), asap rokok, polusi udara, obat, bahan beracun, makanan dalam kemasan, bahan aditif dan sinar ultraviolet dari matahari maupun radiasi.
Radikal bebas dapat terbentuk in vivo dan in vitro dengan cara :
a. Pemecahan satu molekul normal secara homolitik. Proses ini jarang terjadi pada sistem biologi karena memerlukan tenaga yang tinggi dari sinar ultraviolet, panas dan radiasi ion.
b. Kehilangan satu elektron dari molekul normal. c. Penambahan elektron pada molekul normal.
Radikal bebas terpenting dalam tubuh adalah radikal derivat dari oksigen yang disebut kelompok oksigen reaktif (reactive oxygen species/ROS), termasuk oksigen triplet (3O2), tunggal (singlet/1O2), anion superoksida (O2.-), radikal
hidroksil (-OH), nitrit oksida (NO-), peroksi nitrit (ONOO-), asam hipoklorit (HOCl), hidrogen peroksida (H2O2), radikal alkoksi (LO-), dan radikal peroksil
(LO-2). Radikal bebas yang mengandung karbon (CCl3-) yang berasal dari oksidasi
Radikal yang mengandung hidrogen hasil dari penyerangan atom H (H-). Bentuk lain adalah radikal yang mengandung sulfur yang diproduksi pada oksidasi glutation menjadi radikal tiol (R-S-), radikal yang mengandung nitrogen juga ditemukan seperti radikal fenildiazin (Araujo et al., 1998).
ROS dapat menginduksi kerusakan oksidatif berbagai makromolekul seperti asam lemak tak jenuh dalam membran sel, karbohidrat, protein dan DNA yang mengganggu kesetimbangan homeostasis. Radikal bebas dapat menyebabkan berbagai penyakit di antaranya arterosklerosis, diabetes, alzheimer, parkinson dan penurunan kekebalan tubuh (Amic et al., 2003).
2. Senyawa Penangkap Radikal Bebas/Antioksidan
Antioksidan merupakan suatu senyawa yang dapat menginaktifkan radikal bebas yang dihasilkan oleh berbagai proses normal tubuh, radiasi matahari, asap rokok, asap kendaraan bermotor dan faktor-faktor lain (Osawa et al., 1992). Berdasarkan mekanisme kerjanya, antioksidan dibagi menjadi 3 yaitu antioksidan primer, sekunder dan tersier. Antioksidan primer bekerja dengan cara mencegah pembentukan senyawa radikal bebas yang terbentuk menjadi molekul yang kurang aktif, termasuk di dalamnya adalah sistem antioksidan tubuh. Antioksidan sekunder bekerja dengan cara mendonorkan proton pada spesies radikal bebas sehingga terbentuk senyawa yang bersifat netral yang umumnya merupakan senyawa dari luar tubuh seperti vitamin dan senyawa fitokimia.
Sedangkan antioksidan tersier bekerja dengan cara memperbaiki kerusakan yang ditimbulkan oleh radikal bebas.
Sejatinya, tubuh mempunyai mekanisme sendiri dalam upaya mereduksi efek berbahaya dari radikal bebas (oksidan) yang terbentuk karena proses fisiologis, namun karena faktor tertentu seperti penurunan fungsi organ penghasil antioksidan endogen, malnutrisi dan usia maka mutlak diperlukan antioksidan dari luar (eksogen). Antioksidan endogen misalnya enzim superoksida, katalase dan glutation peroksidase sedangkan antioksidan eksogen seperti vitamin A, vitamin E, betakaroten dan flavonoid.
3. Pengukuran Potensi Suatu Antioksidan
Potensi antioksidan dapat diukur dengan berbagai metode. Salah satu metode yang tepat dan valid untuk menetapkan aktivitas antioksidan senyawa- senyawa alam adalah dengan DPPH assay (Kumar et al., 2013). Parameter yang diperoleh adalah IC50, yaitu banyaknya konsentrasi senyawa flavonoid yang
diperlukan untuk menghambat aktivitas radikal bebas DPPH sebesar 50 % (Molyneux, 2004; Mosquera et al., 2007) dengan ketentuan makin kecil nilai IC50
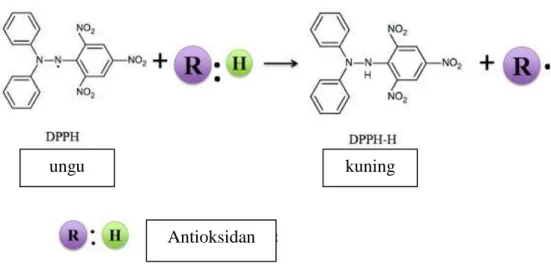
yang diperoleh maka efektifitas antioksidannya makin tinggi. Untuk kontrol positif, digunakan asam askorbat atau senyawa antioksidan lain. Mekanisme penangkapan radikal bebas (DPPH) oleh suatu senyawa uji ditandai oleh adanya perubahan warna larutan DPPH karena proses reduksi dari ungu menjadi kuning seperti reaksi pada Gambar 4.
ungu kuning
Antioksidan
Gambar 4. Reaksi peredaman radikal bebas DPPH oleh antioksidan
(Molyneux, 2004)
D. Isolasi dan Identifikasi Senyawa Flavonoid 1. Aspek Umum
Isolasi merupakan proses untuk memisahkan senyawa aktif dari komponen lain yang tidak diinginkan. Istilah isolasi ini kemudian berkembang menjadi ekstraksi yaitu metode untuk menarik komponen aktif dari suatu bahan berdasarkan prinsip perpindahan massa komponen zat ke dalam pelarut yang dimulai dari lapisan antar muka kemudian berdifusi masuk kedalam pelarut (Harborne, 1987).
Untuk ekstraksi bahan alam, tidak ada metode yang benar-benar baku dan bisa diterapkan untuk semua kasus, karena banyak variabel yang berpengaruh terutama dari bahan alam yang akan diekstraksi (Zhide et al., 2002).
Oleh karena itu, harus ada modifikasi pada metode yang digunakan dan standarisasi pada bahan yang akan diekstraksi. Menurut Satishkumar et al. (2008), faktor-faktor yang berpengaruh dalam ekstraksi senyawa flavonoid adalah waktu ekstraksi, suhu, jenis dan komposisi pelarut serta perbandingan pelarut terhadap bahan yang akan diekstraksi.
2. Isolasi Senyawa Flavonoid
Metode ekstraksi untuk senyawa flavonoid yang sederhana namun memberikan hasil yang baik adalah maserasi (Turkmen et al., 2006), yaitu dengan melakukan perendaman bahan lalu dilanjutkan dengan pemisahan menggunakan Kromatografi Lapis Tipis (KLT). Metode ini walaupun sederhana namun dapat diandalkan dan dapat memberikan hasil yang sepadan dibandingkan metode lain yang lebih rumit (Yaxin et al., 2005; Svetlana et al., 2013).
Metode maserasi cocok untuk mengekstraksi senyawa flavonoid mengingat karakteristiknya yang cenderung mudah teroksidasi dan tidak tahan panas bila dilakukan dengan metode lain seperti refluks dan destilasi. Prinsip metode ini adalah adanya perbedaan gradien tekanan antara bagian dalam sel dan luar sel sehingga akan terjadi pembengkakan dan pemecahan membran serta dinding sel sehingga akan terjadi difusi bahan aktif yang akan masuk/tertarik kedalam sistem pelarut yang digunakan. Proses ini biasanya berlangsung antara 1- 3 hari bahkan dalam Farmakope disebutkan bahwa proses maserasi bisa berlangsung sampai 10 hari (Anonim, 2000).
3. Pemisahan Senyawa Dengan KLT a. Prinsip Kerja KLT
Pemisahan bahan aktif dilakukan dengan 2 tahap, yaitu skrining fitokimia melalui fraksinasi dan dilanjutkan dengan pemisahan untuk tujuan pemurnian. Fraksinasi merupakan proses yang didasarkan pada adanya perbedaan kelarutan bahan uji terhadap pelarut yang digunakan.
Tahap fraksinasi diawali dengan pelarut non polar lalu dilanjutkan secara bertahap dengan pelarut yang lebih polar (Harborne, 1987). Jenis pelarut dipilih berdasarkan sifat bahan aktif yang akan diisolasi. Untuk senyawa flavonoid, fraksinasi diawali dengan heksana dan diakhiri dengan pelarut polar. Metode pemisahan yang umum digunakan untuk bahan alam di antaranya adalah kromatografi seperti kromatografi kertas, kromatografi kolom, kromatografi cair kinerja tinggi dan kromatografi gas. Tiap metode memiliki kelemahan dan kelebihan masing-masing dan tidak ada metode yang diklaim paling baik.
Secara umum, untuk senyawa-senyawa yang berada pada rentang polar sampai semi polar (seperti senyawa flavonoid), KLT cocok digunakan dan efektifitas pemisahan diperoleh dengan melakukan penetapan komposisi fase gerak sedemikian rupa sehingga diperoleh hasil pemisahan yang sempurna (Harborne, 1987).
Prinsip KLT adalah adanya interaksi senyawa uji terhadap fase diam (adsorben) atau terhadap fase gerak (eluen) yang digunakan. Fase diamnya terikat pada suatu lempeng kaca, plastik atau aluminium. Bahannya berupa alumina, selulosa, diatomae atau silika (SiO2). Jenis yang paling banyak digunakan adalah
silika gel. Senyawa uji akan naik mengikuti fase gerak sesuai dengan kemampuan interaksinya terhadap adsorben. Makin kuat interaksinya, maka dia akan sedikit bergerak (berinteraksi kuat dengan adsorben) sehingga memiliki jarak rambat yang rendah. Sebaliknya, jika senyawa uji memiliki interaksi yang lebih besar dengan fase gerak maka dia akan mempunyai jarak rambat yang lebih jauh.
Pemilihan pelarut sebagai fase gerak merupakan faktor penentu berhasil tidaknya suatu matriks campuran dapat dipisahkan dari komponen penyusunnya dengan sempurna (Sastrohamidjojo, 1991). Data kualitatif yang diperoleh dari KLT adalah Rf (Retardation factor), yaitu :
Rf = jarak rambat senyawa Jarak perambatan
Suatu senyawa uji dianggap identik bila memiliki harga Rf yang sama/mirip dengan harga Rf suatu senyawa standar pada perlakuan yang sama.
b. High Performance Thin Layer Chromatography (HPTLC)
Untuk meningkatkan kapasitas dan selektifitas KLT maka dikembangkan fase diam KLT dengan ukuran partikel yang sangat kecil dan diintegrasikan dengan penotol otomatis, chamber otomatis dan perangkat visualisasi yang mumpuni yang selanjutnya diperkenalkan sebagai HPTLC.
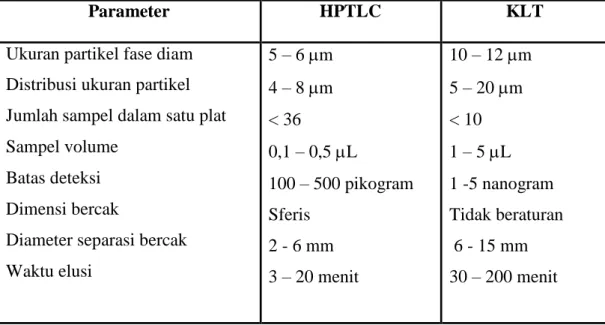
Tujuan utamanya adalah meningkatkan separasi bercak senyawa sehingga pola kromatogram yang terbentuk dapat digunakan sebagai sidik jari bagi suatu matriks senyawa uji. Penggunaan HPTLC kini makin banyak digunakan karena prosesnya cepat dan limit deteksinya tinggi. Keunggulan HPTLC dibandingkan dengan KLT konvensional dirangkum dalam Tabel 3.
Tabel 3. Perbandingan keunggulan HPTLC dibandingkan KLT konvensional
(Wagner et al., 1996).
Parameter HPTLC KLT
Ukuran partikel fase diam Distribusi ukuran partikel Jumlah sampel dalam satu plat Sampel volume
Batas deteksi Dimensi bercak
Diameter separasi bercak Waktu elusi 5 – 6 m 4 – 8 m < 36 0,1 – 0,5 L 100 – 500 pikogram Sferis 2 - 6 mm 3 – 20 menit 10 – 12 m 5 – 20 m < 10 1 – 5 L 1 -5 nanogram Tidak beraturan 6 - 15 mm 30 – 200 menit
4. Pemisahan Senyawa Dengan Kromatografi Kolom
Prinsip utama kromatografi kolom hampir sama dengan KLT, perbedaan terletak pada jumlah fase diam dan fase gerak yang digunakan. Pada kromatografi kolom fase diam yang dipakai tergantung pada panjang dan besar kolom yang digunakan, begitu juga fase geraknya tergantung pada jumlah senyawa yang akan dipisahkan dan dimensi kolom yang dipakai.
Oleh karena itu kromatografi kolom efektif untuk tujuan kuantitatif artinya dapat digunakan untuk isolasi senyawa dalam jumlah besar.
E. Identifikasi Senyawa Flavonoid 1. Pereaksi Semprot
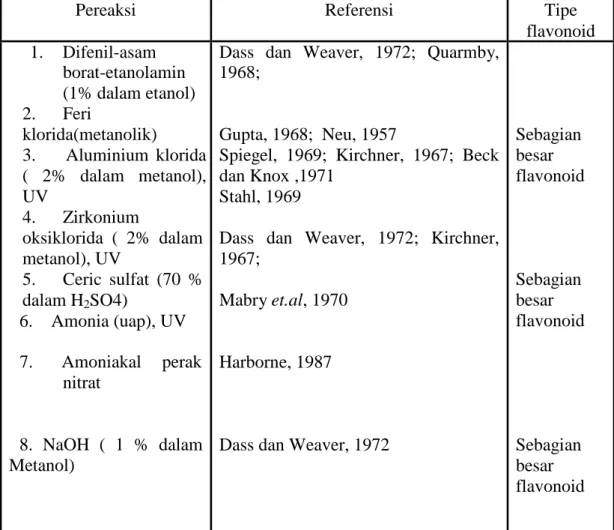
Identifikasi awal senyawa golongan flavonoid dapat dilakukan dengan berbagai cara di antaranya adalah menggunakan pereaksi semprot pada lempeng KLT seperti terlihat pada Tabel 4 berikut (Harborne, 1987).
Tabel 4. Jenis pereaksi semprot dan flavonoid yang terdeteksi (Harborne, 1987)
Pereaksi Referensi Tipe
flavonoid 1. Difenil-asam borat-etanolamin (1% dalam etanol) 2. Feri klorida(metanolik) 3. Aluminium klorida ( 2% dalam metanol), UV 4. Zirkonium oksiklorida ( 2% dalam metanol), UV 5. Ceric sulfat (70 % dalam H2SO4) 6. Amonia (uap), UV 7. Amoniakal perak nitrat 8. NaOH ( 1 % dalam Metanol)
Dass dan Weaver, 1972; Quarmby, 1968;
Gupta, 1968; Neu, 1957
Spiegel, 1969; Kirchner, 1967; Beck dan Knox ,1971
Stahl, 1969
Dass dan Weaver, 1972; Kirchner, 1967;
Mabry et.al, 1970
Harborne, 1987
Dass dan Weaver, 1972
Sebagian besar flavonoid Sebagian besar flavonoid Sebagian besar flavonoid
2. Spektroskopi UV -VIS
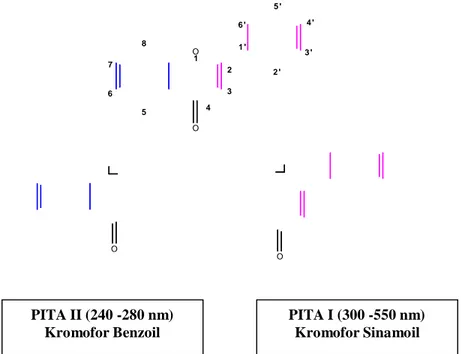
Cara lain yang dipakai untuk identifikasi senyawa flavonoid adalah menggunakan spektroskopi UV-VIS yang saat ini umum digunakan karena sifatnya yang tidak destruktif. Prinsip utama metode ini adalah mendeteksi adanya serapan gelombang UV-VIS pada cincin aromatis terkonjugasi dari struktur flavonoid yang menyebabkan pita pada dua daerah yang berbeda yaitu 300-560 nm (pita I) dan 230-295 nm (pita II). Hal ini tejadi karena struktur umum flavonoid terdiri dari dua kerangka gugus kromofor yaitu cincin benzoil (pita II) dan cincin sinamoil (pita I) seperti terlihat pada Gambar 5.
5 ' 6 ' 4 ' 8 O 1 ' 3 ' 1 7 2 2 ' 6 3 5 4 O O O PITA II (240 -280 nm) Kromofor Benzoil PITA I (300 -550 nm) Kromofor Sinamoil
Adapun interpretasi dari panjang gelombang UV -VIS yang terdeteksi akan terlihat seperti pada Tabel 5 (Markham, 1998).
Tabel 5. Rentangan serapan spektrum UV -VIS pada flavonoid (Markham, 1998)
Pita II Pita II Jenis flavonoid
250-280 250-280 250-285 245-275 275-295 230-270 230-270 270-280 310-350 330-360 350-383 310-330 300-330 340-390 380-430 465-560 Flavon
Flavonol (3-OH tersubstitusi) Flavonol
Isoflavon
Flavanon dan Dihidroflavonol Calkhon
Auron
Antosianidin dan Antosianin
F. Penentuan Struktur
Penentuan struktur flavonoid secara umum dapat ditentukan dengan menginterpretasi spektrum dari spektroskopi IR, MS, 1H-NMR dan 13C-NMR yang diolah sedemikian rupa hingga diperoleh struktur yang sebenarnya dan dapat ditentukan jenis dan golongannya. Berikut jenis spektroskopi yang dapat digunakan untuk menentukan struktur suatu flavonoid.
1. Spektroskopi Infra Merah (IR)
Prinsip dari spektroskopi ini didasarkan pada adanya vibrasi atom pada suatu molekul. Vibrasi terjadi pada ikatan antar atom berupa uluran, bengkokan dan guntingan yang terjadi karena adanya interaksi dengan gelombang infra merah yang diberikan.
Frekuensi vibrasi ini khas dan spesifik untuk tiap ikatan atom dan sesuai dengan panjang gelombang IR yang diserap. Panjang gelombang IR berada pada rentang 625cm-1- 4000cm-1.
Area pada 625cm-1 -1300cm-1 merupakan sidik jari (finger print) dari setiap senyawa dan menunjukkan kekhasan yang tinggi (Sastrohamidjojo, 1991). Spektroskopi IR terutama digunakan untuk mengetahui gugus-gugus fungsional suatu senyawa (Silverstein, 1991).
2. Spektroskopi NMR
Interpretasi dari NMR akan menghasilkan kerangka utama suatu senyawa. Tantangan menggunakan spektroskopi ini adalah karakteristiknya yang memerlukan bahan yang cukup banyak yaitu antara 5-50 mg, sehingga cukup menyulitkan untuk isolat bahan aktif yang berada pada kisaran g (Sastrohamidjojo, 1991; Silverstein, 1991).
a. Spektroskopi 13 C-NMR
Spektroskopi 13 C-NMR dapat memberikan informasi tentang posisi dan jumlah atom karbon (C) dalam suatu molekul. Hal tersebut diperoleh dengan mengolah data tentang pergeseran kimia (), nilai integral dan pola splitting dari spin yang terbentuk.
b. Spektroskopi 1 H-NMR
Jenis spektroskopi ini dapat mengungkapkan keberadaan proton (H) baik posisi relatif terhadap proton sekitar dan jumlahnya dalam suatu molekul. Informasi tersebut merupakan interpretasi dari pola splitting, coupling, nilai integral spin dan pergeseran kimia yang terjadi (Silverstein, 1991).
3. Spektroskopi Massa
Spektroskopi jenis ini akan memberikan gambaran umum suatu molekul. Data yang diperoleh berupa fragmentasi hasil penembakan molekul oleh elektron berkekuatan tinggi (Sastrohamidjojo, 1991; Silverstein, 1991).