TOKSISITAS KADMIUM (Cd) DAN TEMBAGA (Cu)
TERHADAP PERKEMBANGAN EMBRIO-LARVA
KERANG HIJAU (Perna viridis)
Rubinita Desratriyanti C54052825
SKRIPSI
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN KELAUTAN
INSTITUT PERTANIAN BOGOR 2009
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI Dengan ini, saya menyatakan bahwa skripsi yang berjudul :
TOKSISITAS KADMIUM (Cd) DAN TEMBAGA (Cu) TERHADAP PERKEMBANGAN EMBRIO-LARVA KERANG HIJAU
(Perna viridis)
Adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan pada Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
RUBINITA DESRATRIYANTI C54052825
RINGKASAN
RUBINITA DESRATRIYANTI. TOKSISITAS KADMIUM DAN TEMBAGA TERHADAP PERKEMBANGAN EMBRIO-LARVA KERANG HIJAU (Perna
viridis). DIBIMBING OLEH TRI PRARTONO dan DWI HINDARTI.
Perairan Teluk Jakarta merupakan salah satu contoh dari perairan yang sampai saat ini telah tercemar oleh logam berat seperti kadmium dan tembaga. Uji toksisitas perlu dilakukan untuk mendeteksi adanya pencemaran dan
mengetahui pengaruh bahan pencemar terhadap biota perairan umumnya. Salah satu biota perairan yang dapat digunakan sebagai bioindikator pencemaran perairan adalah larva kerang hijau (Perna viridis).
Penelitian ini bertujuan menduga nilai konsentrasi kadmium (Cd) dan tembaga (Cu) yang menyebabkan 50% larva kerang hijau (Perna viridis) berkembang abnormal dan Menduga nilai NOEC (No Observed Effect
Concentration) dan LOEC (Lowest Observed Effect Concentration) dari kadmium
(Cd) dan tembaga (Cu) terhadap perkembangan larva kerang hijau (Perna viridis). Penelitian ini merupakan bagian dari kegiatan penelitian Laboratorium
Ekotoksikologi, Pusat Penelitian Oseanografi – Lembaga Ilmu Pengetahuan Indonesia (P2O-LIPI) dan dilakukan pada bulan Maret 2009 sampai Mei 2009.
Uji toksisitas dilakukan dengan menggunakan sistem statik. Larva kerang hijau hasil fertilisasi dipaparkan pada berbagai konsentrasi toksikan yang diuji selama 48 jam. Uji dihentikan pada saat larva kerang berbentuk D (D-shaped
larvae) telah mencapai ≥ 90% dari initial density. Kualitas air pada saat
pengujian diamati dalam kisaran normal. Nilai-nilai akhir dihitung berdasarkan jumlah larva abnormal.
Hasil uji toksisitas menunjukkan bahwa tembaga mempunyai daya toksik lebih tinggi daripada kadmium terhadap larva kerang. Nilai EC50-48 jam untuk kadmium sebesar 1,97 ppm dan untuk tembaga diperkirakan sebesar 11,70 ppb. Konsentrasi terendah yang memberikan pengaruh nyata pada perkembangan larva kerang (LOEC) untuk kadmium adalah 0,33 ppm dan 5,56 ppb untuk tembaga. Sedangkan konsentrasi tertinggi yang belum mempengaruhi perkembangan larva kerang (NOEC) diperkirakan terletak antara nilai LOEC dan kontrol masing-masing perlakuan.
TOKSISITAS KADMIUM (Cd) DAN TEMBAGA (Cu)
TERHADAP PERKEMBANGAN EMBRIO-LARVA
KERANG HIJAU (Perna viridis)
RUBINITA DESRATRIYANTI C54052825
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Ilmu Kelautan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
DEPARTEMEN ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN KELAUTAN
INSTITUT PERTANIAN BOGOR 2009
SKRIPSI
Judul : TOKSISITAS KADMIUM (Cd) DAN TEMBAGA (Cu)
TERHADAP PERKEMBANGAN EMBRIO-LARVA KERANG HIJAU (Perna viridis)
Nama : RUBINITA DESRATRIYANTI NRP : C54052825
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Tri Prartono, M.Sc Ir. Dwi Hindarti, M.Sc NIP. 19600727 198603 1 005 NIP. 19610501 198603 2 003
Mengetahui,
Ketua Departemen Ilmu dan Teknologi kelautan
Prof. Dr. Ir. Setyo Budi Susilo, M.Sc NIP. 19580909 198303 1 003
KATA PENGANTAR
Alhamdulillaahirobbil ‘alamin, segala puji bagi Allah SWT yang telah memberikan karunia-Nya sehingga penulis data menyelesaikan skripsi ini sebagai tugas akhir untuk mendapatkan gelar Sarjana Kelautan pada Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama melaksanakan penelitian dan penyelesaian skripsi ini, penulis telah mendapatkan banyak bantuan dari berbagai pihak. Oleh karena itu, penulis
mengucapkan terima kasih sebesar-besarnya kepada :
1. Dr. Ir. Tri Prartono, M.Sc selaku dosen pembimbing utama yang banyak memberikan arahan, motivasi, dan bimbingannya kepada penulis.
2. Ir. Dwi Hindarti, M.Sc selaku pembimbing anggota yang telah memberikan kesempatan kepada penulis untuk melakukan penelitian ini, saran, dan bimbingannya kepada penulis.
3. Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc selaku dosen penguji yang telah memberikan masukkan kepada penulis.
4. Dr. Ir. Henry M. Manik, M.T selaku ketua komisi pendidikan yang telah memberikan masukkan kepada penulis.
5. Dr. Ir. Totok Hestirianoto, M.Sc selaku pembimbing akademik yang telah memberikan motivasi, saran, dan bimbingannya kepada penulis.
6. Kedua orang tua yang selalu memberikan doa, kasih sayang, nasehat, dukungan, dan kepercayaan.
8. Triyoni Purbonegoro, S.si, Rachma Puspitasari, S.si, Eston Matondang, dan Suratno, S.si selaku peneliti dan teknisi laboratorium Ekotoksikologi yang telah banyak membantu penulis saat penelitian.
9. Gesha Yuliani Nattasya dan Martiwi Diah Setiawati, teman satu tim dalam penelitian ini.
10. Femi Z., Riesni F., Asyari A., Ika F., Nofaria S., dan Iqbal S. Gultom atas bantuannya selama penelitian dan penyusunan skripsi ini.
11. Warga ITK khususnya ITK 42 yang selalu memberi saran dan semangat. 12. Seluruh dosen dan staf Departemen Ilmu dan Teknologi Kelautan yang telah
memberi ilmu dan mendukung kemajuan penulis.
13. Terima kasih juga penulis sampaikan kepada semua pihak yang tidak bisa disebutkan satu per satu atas semua bantuan dan doa selama penelitian dan penyusunan skripsi ini.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini, namun diharapkan informasi yang diperoleh dapat bermanfaat.
Bogor, Agustus 2009
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix 1. PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 3 2. TINJAUAN PUSTAKA ... 4 2.1 Logam Berat ... 4 2.1.1 Kadmium... 5 2.1.2 Tembaga... 7 2.2 Toksisitas ... 9
2.2.1 Toksisitas Kadmium pada Organisme Laut... 10
2.2.2 Toksisitas Tembaga pada Organisme Laut... 11
2.2.3 Toksisitas Logam pada Larva Kerang... 12
2.3 Kerang Hijau (Perna viridis) ... 12
3. BAHAN DAN METODE ... 17
3.1 Waktu dan tempat penelitian ... 17
3.2 Alat dan bahan ... 17
3.3 Metode Kerja ... 18
3.3.1 Persiapan Penelitian ... 18
3.3.1.1 Pencucian Peralatan ... 18
3.3.1.2 Pembuatan Larutan Stok Toksikan Kadmium dan Tembaga ... 18
3.3.1.3 Pembuatan Larutan Buffered Formalin 50% ... 19
3.3.2 Pelaksanaan Penelitian ... 20
3.3.2.1 Pengaturan Wadah Uji ... 20
3.3.2.2 Pembuatan Larutan Uji ... 20
3.3.2.3 Pengukuran Kualitas Air dan Konsentrasi Aktual Larutan Uji ... 21
3.3.2.4 Pemijahan Kerang ... 22
3.3.2.5 Fertilisasi Embrio Kerang ... 22
3.3.2.6 Uji Definitif ... 23
3.4 Analisis Data ... 24
4. HASIL DAN PEMBAHASAN ... 26
4.1 Hasil ... 26
4.1.1 Konsentrasi Aktual Larutan Uji ... 26
4.1.3 Kepadatan Larva Awal dan Pengamatan Perkembangan
Larva Kerang Hijau (Perna viridis) selama 48 jam ... 28
4.1.4 Toksisitas Kadmium dan Tembaga terhadap Perkembangan Larva Kerang Hijau (Perna viridis) ... 29
4.2 Pembahasan ... 33 5. KESIMPULAN ... 40 5.1 Kesimpulan ... 40 5.2 Saran ... 40 DAFTAR PUSTAKA ... 41 LAMPIRAN ... 47
DAFTAR TABEL
Halaman 1. Toksisitas kadmium terhadap beberapa jenis organisme laut... 10 2. Toksisitas tembaga terhadap beberapa jenis organisme laut ... 11 3. Konsentrasi nominal dan aktual kadmiun dan tembaga dalam larutan uji . 26 4. Hasil pengukuran kualitas air larutan uji kadmium dan tembaga ... 27 5. Hasil perhitungan kepadatan awal embrio (initial density) dari 5 tabung . . 28 6. Perkembangan pembentukan D-shape selama 48 jam ... 29 7. Keabnormalan dan mortalitas rata-rata pada uji kadmium dan tembaga
terhadap larva kerang hijau (Perna viridis) ... 30 8. Hasil uji toksisitas kadmium dan tembaga pada larva kerang hijau (Perna
DAFTAR GAMBAR
Halaman 1. Morfologi kerang Mytilidae (Perna viridis)... 13 2. Perkembangan larva kerang hijau ... 14 3. Bentuk D-shape normal (a) dan D-shape abnormal (b) pada larva kerang
hijau (Perna viridis) ... 15 4. Grafik hubungan konsentrasi kadmium dan tembaga dengan persentase rata-rata jumlah larva abnormal ... 31
DAFTAR LAMPIRAN
Halaman
1. Prosedur Pengukuran Konsentrasi Aktual dengan Metode AAS... 48
2. Foto Kegiatan Pengukuran Konsentrasi Aktual... 49
3. Foto Kegiatan Uji Toksisitas Pengukuran Konsentrasi Aktual... 50
4. Kondisi yang direkomendasikan Asean-Canada CPMS II(1995) untuk uji toksisitas kerang ... 51
5. Perkembangan Larva Kerang Hijau (Perna viridis) selama 48 jam ... 52
6. Data Uji Toksisitas Kadmium (CdCl2)... 53
7. Data Uji Toksisitas Tembaga (CuSO4) ... 54
8. Foto Larva Normal dan Abnormal ... 55
9. Perhitungan EC50 Kadmium dengan Perangkat Lunak EFFL ... 56
10. Perhitungan EC50 Tembaga dengan Perangkat Lunak EFFL... 57
11. Analisis Statistik untuk menentukan nilai LOEC dan NOEC Kadmium dengan Perangkat Lunak TOXSTAT ... 58
12. Analisis Statistik untuk menentukan nilai LOEC dan NOEC Tembaga dengan Perangkat Lunak TOXSTAT... 60
1. PENDAHULUAN
1.1 Latar belakang
Kadmium (Cd) dan Tembaga (Cu) adalah salah satu contoh logam berat yang digunakan dalam berbagai kegiatan industri. Kadmium ditemukan dalam buangan limbah industri tekstil, electroplating, dan pabrik kimia. Tembaga digunakan dalam kegiatan industri seperti pelapisan logam, cat, plastic, baterai, insektisida, pestisida, gelas, dan keramik. Kontribusi limbah mengandung kadmium dan tembaga yang masuk ke badan perairan yang semakin meningkat akan sangat membahayakan kehidupan ekosistem perairan (Darmono, 1995).
GESAMP (Group of Expert on Scientific Aspect on Marine Pollution) mendefinikan pencemaran laut sebagai masuknya zat-zat (substansi) atau energi ke dalam lingkungan laut dan estuari baik langsung maupun tidak langsung akibat adanya kegiatan manusia yang menimbulkan kerusakan pada lingkungan laut, kehidupan di laut, kesehatan manusia, mengganggu aktivitas di laut serta secara visual mereduksi keindahan (Sanusi, 2006). Perairan Teluk Jakarta merupakan salah satu contoh dari perairan yang sampai saat ini telah tercemar oleh logam berat. Kajian logam berat di Teluk Jakarta pertama kali dilakukan pada tahun 1979 (S. Yatim et.al., 1979 in Rochyatun dan Rozak, 2007). Hasil penelitiannya menunjukkan bahwa kadar logam berat dalam air di Teluk Jakarta sudah
tergolong tinggi, bahkan di beberapa lokasi seperti muara Angke kadar logam beratnya cenderung meningkat. Saat ini, Teluk Jakarta masih dimanfaatkan untuk berbagai kegiatan seperti budidaya kerang hijau (Perna viridis) yang terus
berkembang walaupun kondisi perairannya sudah kurang baik (Arifin dan Fitriani, 2006).
Kerang hijau (Perna viridis) merupakan organisme yang bersifat filter
feeder non selective. Kerang hijau dapat digunakan sebagai bioindikator
pencemaran perairan karena biota ini bersifat menetap, penyebarannya luas, masih mampu hidup pada daerah tercemar, dan dapat mengakumulasi logam berat dengan faktor konsentrasi sebesar 10 (Hartanti, 1998). Pada tingkatan hidup embrio dan larva, kerang hijau banyak digunakan sebagai biota uji karena fase tersebut paling sensitif terhadap pengaruh bahan asing yang bersifat racun.
Penelitian yang menggunakan kerang hijau sebagai biota uji telah banyak dilakukan diantaranya Studi Kandungan Kadmium pada Kerang Hijau (Perna
viridis) di Selat Madura (Indarto, 2008), Tingkat Akumulasi Pb, Cd, Cu, dan Zn
pada Kerang Hijau (Perna viridis) di Perairan Muara Kamal, Teluk Jakarta (Ningtyas, 2002), dan Bioakumulasi Logam Hg, Pb, dan Cd pada Kerang Hijau yang dibudiayakan di Perairan Pesisir Kamal dan Cilincing Jakarta (Fitriati, 2003). Secara umum penelitian di atas lebih banyak menjelaskan pada tingkat monitoring dan laju akumulasi pada kerang hijau. Penelitian mengenai pengaruh Kadmium dan Tembaga terhadap organisme air pada tingkat letal (LC50) telah banyak dilakukan pada berbagai biota uji seperti larva lobster Amerika (Homarus
americanus) (Johnson dan Gentile, 1979), larva kerang biru (Mytilus edulis)
(Martin et.al., 1981), dan larva Dekapoda (Wong et.al.1993).
Uji toksisitas perlu dilakukan untuk mendeteksi pengaruh bahan pencemar terhadap biota perairan umumnya. Uji toksisitas merupakan suatu uji yang digunakan untuk mengevaluasi konsentrasi bahan kimia dan lamanya pemaparan
yang menimbulkan pengaruh tertentu (Hindarti, 1997). Pada penelitian ini dilakukan uji toksisitas kadmium (Cd) dan tembaga (Cu) dengan menggunakan larva kerang hijau (Perna viridis). Prinsip uji toksisitas tersebut untuk
mengevaluasi suatu pengaruh toksik (Cd dan Cu) terhadap biota target (kerang hijau).
1.2 Tujuan
Tujuan yang diharapkan dalam penelitian ini adalah :
1. Menentukan nilai konsentrasi kadmium (Cd) dan tembaga (Cu) yang menyebabkan 50% larva kerang hijau (Perna viridis) berkembang abnormal. 2. Menentukan nilai NOEC (No Observed Effect Concentration) dan LOEC
(Lowest Observed Effect Concentration) dari kadmium (Cd) dan tembaga (Cu) terhadap perkembangan larva kerang hijau (Perna viridis).
2. TINJAUAN PUSTAKA
2.1 Logam Berat
Di bumi ini sedikitnya terdapat 80 jenis dari 109 unsur kimia yang telah teridentifikasi sebagai jenis logam berat. Berdasarkan sudut pandang toksikologi, logam berat ini dapat dibagi dalam dua jenis. Jenis pertama adalah logam berat esensial, di mana keberadaannya dalam jumlah tertentu sangat dibutuhkan oleh organisme hidup, namun dalam jumlah yang berlebihan dapat menimbulkan efek racun. Contoh logam berat ini diantaranya Zn, Cu, Fe, Co, dan Mn. Jenis kedua adalah logam berat tidak esensial atau beracun, di mana keberadaannya dalam tubuh masih belum diketahui manfaatnya atau bahkan dapat bersifat racun, seperti Hg, Cd, Pb, dan Cr (Palar, 2004)
Berbeda dengan logam biasa, logam berat adalah istilah yang digunakan secara umum untuk kelompok logam berat dan metaloid yang densitasnya lebih besar dari 5 g/cm3 (Hutagalung, 1991). Dalam perairan, logam berat dapat ditemukan dalam bentuk terlarut dan tidak terlarut. Logam berat terlarut adalah logam yang membentuk komplek dengan senyawa organik dan anorganik, sedangkan logam berat yang tidak terlarut merupakan partikel-partikel yang berbentuk koloid dan senyawa kelompok metal yang teradsorbsi pada partikel-partikel yang tersuspensi (Razak, 1980 in Hutagalung, 1991).
Logam berat biasanya erat kaitannya dengan masalah pencemaran dan toksisitas. Pencemaran yang dapat menghancurkan tatanan lingkungan hidup, biasanya berasal dari limbah-limbah yang sangat berbahaya dalam arti memiliki daya racun (toksisitas) yang tinggi. Limbah industri merupakan salah satu
sumber pencemaran logam berat yang potensial bagi perairan. Pembuangan limbah industri secara terus menerus tidak hanya mencemari lingkungan perairan tetapi menyebabkan terkumpulnya logam berat dalam sedimen dan biota perairan. Dalam lingkungan perairan ada tiga media yang dapat dipakai sebagai indikator pencemaran logam berat, yaitu air, sedimen dan organisme hidup (Hutagalung, 1991).
2.1.1 Kadmium (Cd)
Kadmium merupakan salah satu unsur pada golongan II B periode 5 dalam tabel periodik kimia. Kadmium mempunyai nomor atom 48, massa atom relatif 112,40, titik lebur 321 oC, dan titik didih 767 oC (Shadily, 1980). Kandungan Cd di dalam perairan tawar berkisar 0,0001-0,01 mg/L, sedangkan pada perairan laut sekitar 0,0001 mg/L (Effendie, 2003). Berdasarkan pada sifat-sifat fisikanya, Cd merupakan logam yang lunak, ductile, berwarna putih seperti putih perak. Logam
ini akan kehilangan kilapnya jika berada dalam udara yang basah atau lembab serta akan cepat mengalami kerusakan bila dikenai uap ammonia (NH3) dan sulfur hidroksida (SO2). Berdasarkan pada sifat-sifat kimianya, Cd di dalam
persenyawaan yang dibentuknya pada umumnya mempunyai bilangan valensi 2+, sangat sedikit yang mempunyai bilangan valensi 1+ (Palar, 2004).
Kadmium ini ditemukan dalam bebatuan Calamine (Seng Karbonat). Cd
mempunyai penyebaran sangat luas di alam, hanya ada satu jenis mineral kadmium di alam yaitu greennockite (CdS) yang selalu ditemukan bersamaan
dengan mineral spalerite (ZnS). Di udara, uap teroksidasi dengan cepat dan
sumber alam namum yang paling melimpah terdapat dalam bijih seng, timah, dan tembaga sulfida. Sumber kadmium lainnya adalah bijih nitrat tetrahedrit-tenartile, yang dapat ditemukan pada lapisan air bagian atas yang dipengaruhi zona fotik dan produktivitas fitoplankton (Simpson, 1981 in Lestari, 2007). Sumber
antropogenik kadmium yang utama adalah tambang bijih, industri metalurgi, dan lumpur kotoran. Konsentrasi kadmium pada asap dari peleburan tembaga, timbal, nikel dan seng sulfida relatif tinggi karena logam tersebut mudah menguap. (Chongprasith et al., 1999).
Menurut Clark (1989) sumber kadmium yang masuk ke perairan berasal dari:
1. Uap, debu dan limbah dari pertambangan timah dan seng 2. Air bilasan dari electroplating
3. Besi, tembaga dan industri logam non ferrous yang menghasilkan abu dan uap serta air limbah dan endapan yang mengandung kadmium
4. Seng yang digunakan untuk melapisi logam mengandung kira-kira 0, 2 % Cd sebagai bahan ikutan (impurity); semua Cd ini akan masuk ke perairan melalui proses korosi dalam kurun waktu 4-12 tahun
5. Pupuk phosfat dan endapan sampah.
Senyawa kadmium seperti CdS, CdCO3, dan Cd(OH)2 tidak larut dalam air. Fluorida, khlorida, bromida, iodida, nitrat, dan sulfat dari kadmium
merupakan senyawa-senyawa yang relatif larut. Berbeda dengan turunan alkil merkuri, senyawa-senyawa alkil kadmium sangat tidak stabil, bereaksi dengan air dan udara basah pada kondisi alami. Oleh karena itu, senyawa tersebut tidak dipertimbangkan keberadaannya sebagai pencemar lingkungan (CEC, 1978).
Kadmium dalam perairan merupakan ion biovalen yang dapat terikat membentuk CdCl2, CdSO4, dan Cd(NO3)2 (Wu in Purbonegoro, 2005). Di perairan laut dengan sainitas 10 sampai dengan 35 ‰, didominasi oleh kandungan kompleks kadmium klorida (CdCl2) (Chongprasith et al, 1999). Kadmium kloro (CdCl2, CdCl3+ and CdCl-) banyak di temukan pada air laut pada pH 7 sampai 9.
Hasil pengamatan kandungan kadmium dalam air laut dan sedimen dari estuari, perairan dekat pantai, laut dengan sirkulasi terbatas, perairan dasar selat, dan laut terbuka adalah 0,00001-0,0002 mg/L. Berdasarkan Keputusan Menteri Negara Lingkungan Hidup No. 51 tahun 2004 tentang Baku Mutu Air Laut, konsentrasi kadmium yang diinginkan untuk biota laut adalah 0,001 mg Cd/L atau 1 µg Cd/L.
2.1.2 Tembaga (Cu)
Tembaga merupakan unsur pada golongan I B periode 4 dalam tabel periodi kimia. Tembaga mempunyai lambang Cu dengan nomor atom 29, massa atom relatif 63,546, titik lebur 1983,4 oC, dan titik didih 2567 oC. Unsur logam ini berbentuk kristal dengan warna kemerahan. Tembaga mempunyai potensial elektrode standar positif, tidak larut dalam asam klorida dan asam sulfat encer, meskipun dengan adanya oksigen bisa larut sedikit (Palar, 2004).
Keberadaan unsur tembaga di alam dapat ditemukan dalam bentuk logam bebas, akan tetapi lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa padat dalam bentuk mineral seperti CuCO3+ dan CuOH+ (Palar, 2004). Di perairan alami tembaga (Cu) terdapat dalam bentuk partikulat, koloid dan terlarut. Fase terlarut merupakan Cu2+ bebas dan ikatan kompleks, baik dengan ligan inorganik, terutama (CuOH+, Cu
Cu kompleks dengan ligan organik, terutama adalah oleh material humus. Ikatan kompleks Cu yang terjadi dalam sedimen laut adalah yang paling stabil,
sementara yang terbentuk dalam kolom air laut stabilitasnya paling rendah (Moore dan Ramamoorthy, 1984 in Sanusi, 2006).
Tembaga masuk ke dalam suatu tatanan lingkungan secara alamiah
sebagai akibat dari peristiwa alam. Tembaga bersumber dari peristiwa pengikisan (erosi) dari batuan mineral, debu, dan atau partikulat-partikulat Cu yang ada dalam lapisan udara yang dibawa turun oleh hujan (Laws, 1993). Secara non alamiah, Cu masuk ke dalam suatu tatanan lingkungan sebagai akibat dari aktivitas manusia seperti buangan industri yang menggunakan Cu dalam proses produksinya, produksi galangan kapal menggunakan Cu sebagai campuran bahan pengawet, industri pengelolaan kayu, buangan rumah tangga, dan sebagainya (Palar, 1994).
Tembaga (Cu) termasuk logam berat essensial karena keberadaannya dalam tubuh sangat sedikit namun diperlukan dalam proses fisiologis organisme. Walaupun dibutuhkan tubuh dalam jumlah sedikit, bila kelebihan dapat
mengganggu kesehatan atau mengakibatkan keracunan (Clark, 1989). Tembaga dimanfaatkan dalam proses pertmbuhan, metabolisme, dan aktivitas enzim pada berbagai jenis alga, cyanobakteria, dan organisme perairan lainnya. Namun jika konsentrasi Cu pada suatu perairan tinggi, maka akan menyebabkan terhambatnya pertumbuhan organisme perairan (Laing dan Helm, 1987 in Lestari, 2007).
Pada perairan alami, kadar tembaga biasanya < 0,02 mg/L. Air tanah dapat mengandung tembaga sekitar 12 mg/L. Pada umumnya jumlah Cu yang terlarut dalam badan perairan laut adalah 0,002 mg/L sampai 0,005 mg/L (Palar,
1994). Batas konsentrasi dari unsur ini yang mempengaruhi pada air berkisar antara 1 – 5 mg/l merupakan konsentrasi tertinggi. Berdasarkan Keputusan Menteri Negara Lingkungan Hidup No. 51 Tahun 2004, Tentang Baku Mutu Air Laut, konsentrasi tembaga yang diperbolehkan untuk biota laut (budidaya
perikanan) adalah 0,008 mg/L.
2.2 Toksisitas
Toksisitas suatu bahan dapat ditentukan dengan mengkaji seberapa besar pengaruhnya terhadap biota uji. Suatu bahan pencemar digolongkan toksik jika pada konsentrasi terkecil mengakibatkan timbulnya pengaruh pada organisme uji (Taurusman, 1996). Pengaruh yang timbul dapat berupa kematian, pengaruh terhadap fisiologi maupun pertumbuhan organisme.
Uji toksisitas adalah suatu uji yang digunakan untuk mengevaluasi konsentrasi bahan kimia dan lamanya pemaparan yang dapat menimbulkan pengaruh tertentu. Uji toksisitas bertujuan untuk mengevaluasi pencemaran perairan. Prinsip dari uji toksisitas adalah mengidentifikasikan bahan kimia yang dapat menimbulkan dampak negatif bagi biota perairan (Hindarti, 1997).
Uji toksisitas perairan dapat dikategorikan menurut respon organisme yang diuji (Palar, 2004) sebagai berikut :
1. Uji toksisitas akut, yaitu suatu uji untuk melihat respon organisme terhadap keadaan yang cukup parah dan diindikasikan dengana 50 % respon,
umumnya dalam waktu 96 jam atau kurang misalnya LC50, efek berupa kematian.
2. Uji toksisitas subakut, yaitu suatu uji yang melihat pengaruh kondisi yang kurang parah pada organisme, dibandingkan dengan pengaruh akut, dan dalam waktu yang lama
3. Uji toksisitas kronik, merupakan uji yang melihat respon organisme terhadap kondisi berkesinambungan. Umumnya 10% organisme bertahan hidup. Efek berupa penurunan pertumbuhan dan reproduksi maupun aktivitas enzim.
2.2.1 Toksisitas Kadmium pada Organisme Laut
Beberapa penelitian toksisitas akut terhadap organisme air, menempatkan toksisitas kadmium pada urutan kedua setelah merkuri (Hg). Urutan toksisitas logam dari yang paling tinggi sampai yang paling rendah adalah: Hg2+ > Cd2+ > Ag2+ > Ni2 + > Pb2+ > As2+ > Cr2+ > Sn2+ > Zn2+ (Darmono, 1995). Data toksisitas kadmium terhadap organisme laut di kawasan ASEAN atau wilayah tropis secara keseluruhan masih terbatas. Chongprasith et al. (1999) menentukan nilai baku sementara bagi kadmium untuk kawasan ASEAN sebesar 0,00078 mg/L. Pada Tabel 1 ditunjukkan beberapa hasil uji toksisitas kadmium terhadap berbagai organisme laut tropis.
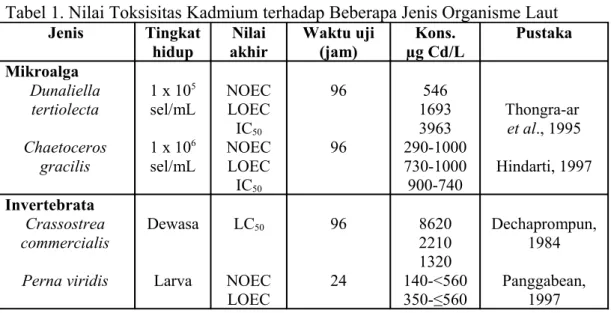
Tabel 1. Nilai Toksisitas Kadmium terhadap Beberapa Jenis Organisme Laut Jenis Tingkat hidup Nilai akhir Waktu uji (jam) Kons. µg Cd/L Pustaka Mikroalga Dunaliella tertiolecta Chaetoceros gracilis 1 x 105 sel/mL 1 x 106 sel/mL NOEC LOEC IC50 NOEC LOEC IC50 96 96 546 1693 3963 290-1000 730-1000 900-740 Thongra-ar et al., 1995 Hindarti, 1997 Invertebrata Crassostrea commercialis Perna viridis Dewasa Larva LC50 NOEC LOEC 96 24 8620 2210 1320 140-<560 350-≤560 Dechaprompun, 1984 Panggabean, 1997
EC50 590-880 Ikan Lates calcarifer Lutjanus argentimaculatus 10 hari juvenil NOEC LOEC IC50 LC50 168 96 3000 9500 > 9500 6300 Sulaiman, 1997 Chumnantana et al, 1992
Menurut laporan Enviroment Canada (1992), kadmium merupakan salah satu toksikan rujukan (reference toxicant) yang potensial. Walaupun demikian, kadmium mungkin bukan termasuk bahan kimia yang paling diinginkan untuk penggunaan standar karena merupakan toksikan bioakumulatif yang berbahaya.
2.2.2 Toksisitas Tembaga pada Organisme Laut
Tembaga termasuk dalam kelompok logam esensial, dan dalam kadar yang rendah dibutuhkan oleh organisme sebagai ko-enzim dalam proses metabolisme tubuh dan sifat racunnya baru muncul dalam kadar yang tinggi. Biota perairan sangat peka terhadap kelebihan Cu dalam badan perairan tempat hidupnya (Tarigan et al., 2003 in Lestari, 2007). Kadar Cu sebesar 2,5-3,0 ppm dalam perairan dapat membunuh ikan-ikan (Bryan, 1976). Pada Tabel 2 ditunjukkan beberapa hasil uji toksisitas tembaga terhadap berbagai organisme laut.
Tabel 2. Nilai Toksisitas Tembaga terhadap Beberapa Jenis Organisme Laut Jenis Tingkat hidup Nilai akhir Waktu uji (jam) Kons. µg Cu/L Referensi Mikroalga Dunaliella tertiolecta Scenedesmus quadricauda Tingkat pertumbuhan Tingkat pertumbuhan IC50 LOEC 48 24 44760 1100 Edding and Tala, 1996 Bringmann and Kuhn, 1978 Invertebrata Homarus americanus Perna viridis 450 gr 24 mm LC50 LC50 96 96 560 8,20 McLeese, 1974 Mathew and Menon, 1983 Ikan
Anguilla japonica Luxilus chrysocephalus juvenil 55 mm LC50 LC50 96 24 60 \830 Yang and Chen, 1996 Geckler dkk, 1976
2.2.3 Toksisitas Logam pada Larva Kerang
Hewan air jenis bivalvia atau jenis moluska, baik jenis kerang besar atau kerang kecil, pergerakannya sangat lambat di dalam air. Stadium larva dari jenis kerang yang disebut fase pelagik biasanya peka terhadap pengaruh polusi logam daripada masa dewasanya. Pertumbuhan dan perkembangan larva kerang untuk menjadi dewasa akan terhambat karena pengaruh toksisitas logam dalam
konsentrasi subletal (Darmono, 1995). Daya toksisitas logam pada jenis kerang dari yang kuat ke yang lemah secara berurutan (Darmono, 1995) sebagai berikut :
Hg2+ > Ag+ > Cu2+ > Zn2+ > Ni2+ > Pb2+ > Cd2+ > As2+ > Cr2+
Beberapa penelitian mengenai toksisitas logam pada jenis kerang yang telah dilakukan, menunjukkan fase embrio dan larva sangat peka terhadap pengaruh toksikan. Hal ini terlihat dari proses pertumbuhan kerang, pada fase awal pertumbuhan telur (embriologi) banyak terjadi kematian pada konsentrasi logam yang rendah (Darmono, 1995).
2.3 Kerang Hijau (Perna viridis)
Kerang hijau (Perna viridis) merupakan anggota kerang yang terdapat pada famili Mytilidae. Nama lain kerang hijau (Perna viridis) yaitu Asian Green Mussel, Green-Lipped Mussel, kijing (Jakarta), kemudi kapal (Riau), dan kedaung (Banten) (Wahyuni, 2007). Kerang hijau (Perna viridis) diklasifikasikan sebagai berikut (Siddal in Vakily, 1989):
Kingdom : Animalia Phylum : Mollusca Class : Bivalvia Order : Lamellibranchia Family : Mytilidae Genus : Perna Spesies : Perna viridis
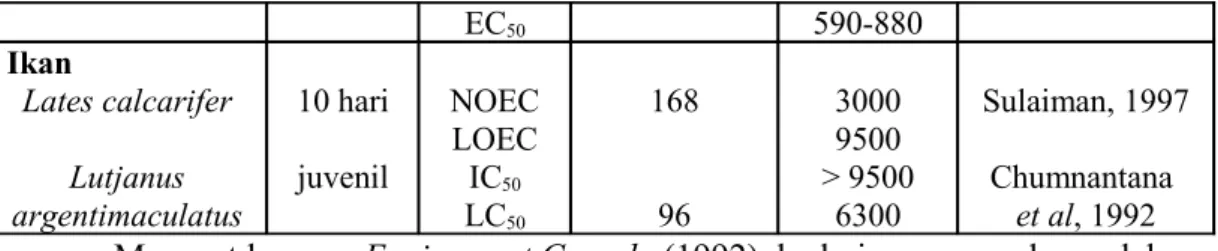
Kerang hijau termasuk binatang lunak (Mollusca) yang hidup di laut, bercangkang dua (bivalve), berwarna hijau. Insangnya berlapis-lapis
(Lamellibranchia) dan berkaki kapak (Pelecypoda) serta memiliki benang byssus. Kerang hijau adalah plankton feeder, dapat berpindah-pindah tempat dengan menggunakan kaki dan benang byssus, hidup baik pada perairan dengan kisaran kedalaman 1-7 meter dan memiliki toleransi terhadap perubahan salinitas antara 27-35 per mil (Ditjen Perikanan Budidaya, 2008).
Gambar 1. Morfologi kerang Mytilidae (Perna viridis) (Harris, 1990)
Kerang genus Mytilus ini sering disebut highly spesialized filter feeder dan digunakan sebagai bioindikator pencemaran perairan karena biota ini bersifat
menetap, penyebarannya luas, masih mampu hidup pada daerah tercemar, dapat mengakumulasi logam berat dengan faktor konsentrasi sebesar 10 (Hartanti, 1998). Habitat kerang hijau mempunyai kisaran temperatur 27 – 30 °C, salinitas 27 – 34 ‰, pH 6 – 8, kecerahan 2,6 – 4,0 m dan kedalaman sampai 20 m
(Kastoro, 1981 in Afianty, 2002). Kerang hijau hidup di daerah pasang surut dan subtidal, menempel kuat dan bergerombol pada benda-benda keras dengan menggunakan benang byssusnya (Ditjen Perikanan Budidaya, 2008).
Perkembangan kerang hijau dari larva hingga dewasa sangat dipengaruhi oleh salinitas. Pada tingkat larva, salinitas antara 21 – 33 ‰ memungkinkan larva tersebut tumbuh normal nerkembang menjadi tingkat berikutnya sebagai veliger (Romimohtarto dan Juwana, 1998). Perkembangan dari telur sampai tingkat metamorfose dapat dilihat pada Gambar 2.
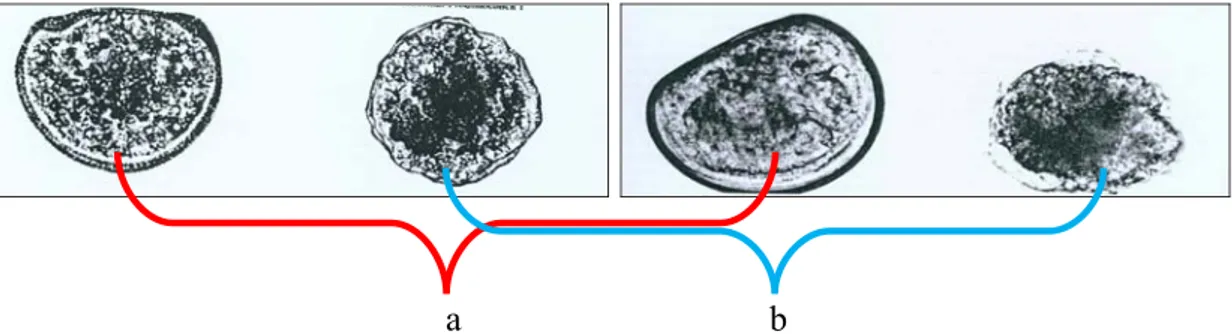
Kerang hijau memiliki alat reproduksi yang terpisah atau diocious, bersifat ovipora yaitu memiliki telur dan sperma yang berjumlah banyak dan mikroskopik. Induk kerang hijau yang telah matang kelamin mengeluarkan sperma dan sel telur kedalam air sehingga bercampur dan kemudian terjadi pembuahan. Telur yang telah dibuahi tersebut setelah 24 jam akan menetas dan tumbuh berkembang menjadi larva kemudian menjadi spat yang masih bersifat planktonik hingga berumur 15-20 hari (Ditjen Perikanan Budidaya, 2008). Pada tingkatan hidup embrio dan larva, kerang hijau banyak digunakan sebagai biota uji karena pada fase tersebut paling sensitif terhadap pengaruh toksikan. Efek toksikan yang umumnya dilihat pada larva kerang adalah abnormalitas dari D-shape larva. Bentuk D-shape normal dan abnormal dapat dilihat pada Gambar 3.
a b
Gambar 3. Bentuk D-shape normal (a) dan D-shape abnormal (b) pada larva kerang hijau (Perna viridis) (ASTM, 2004)
Kerang hijau secara umum merupakan agen biomonitoring yang baik, logam yang terakumulasi dalam jaringan kerang akan menjadi ukuran
bioavailibilitas dari sumber antropogenik dan alami logam. Konsentrasi logam berat yang terakumulasi dalam jaringan tubuh kerang merupakan fungsi
keseimbangan antara tingkat pengambilan (rate of uptake) dan tingkat pengeluaran (rate of excretion). Perbedaan kedua sistem tersebut yang menjelaskan terjadinya proses akumulasi logam berat dan penyebarannya di jaringan tubuh kerang (Phillip, 1980 in Ningtyas, 2002).
3. BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini merupakan bagian dari kegiatan penelitian Laboratorium Ekotoksikologi, Pusat Penelitian Oseanografi – Lembaga Ilmu Pengetahuan Indonesia (P2O-LIPI). Penelitian dilakukan pada bulan Maret 2009 sampai Mei 2009 di Laboratorium Ekotoksikologi dan Laboratorium Pencemaran, P2O-LIPI, Ancol, Jakarta Utara.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah water bath, heater, gelas beaker, seperangkat aerator, alat ukur kualitas air (Thermometer, pH dan
dissolved oxygen (DO) meter, refractometer), aparatus milipore dengan kertas
saring 0,45 µm, saringan dengan ukuran 0,25 mm, perforated plunger, gelas ukur,
automatic micropipette, tabung reaksi dengan tutup/parafilm, mikroskop, Sedgewick-Rafter counter, Hand Tally counter, autoclave dan oven, dan Kamera.
Bahan-bahan yang digunakan dalam penelitian ini adalah kerang hijau (Perna viridis) dan larvanya; air laut; larutan buffered formalin 50 %; larutan stok toksikan kadmium; larutan stok toksikan tembaga; akuades.
3.3 Metode Kerja
3.3.1 Persiapan Penelitian 3.3.1.1 Pencucian Peralatan
Peralatan gelas yang akan digunakan dalam uji toksisitas harus dicuci sesuai dengan prosedur ASEAN-Canada CPMS II (1995). Seluruh peralatan dibersihkan dengan cara perendaman dan pencucian menggunakan deterjen non fosfat (teepol). Setelah dibilas dengan air, pembilasan lanjut dilakukan dengan asam nitrat 10% untuk menghilangkan logam berat yang masih ada lalu dibilas tiga kali dengan akuades hingga bersih. Peralatan selanjutnya dibilas kembali dengan aseton untuk menghilangkan bahan organik yang masih ada dan diikuti pembilasan tiga kali dengan akuades hingga bersih
Peralatan gelas yang telah dicuci dan dikeringkan kemudian dibungkus dengan aluminium foil. Peralatan gelas tersebut kemudian disterilkan dengan menggunakan autoclave pada tekanan 15 psi sampai mencapai suhu 121°C selama 15 menit lalu didinginkan.
3.3.1.2 Pembuatan Larutan Stok Toksikan Kadmium dan Tembaga Larutan stok kadmium 1000 mg/L dibuat dengan melarutkan kristal kadmium khlorida monohidrat (CdCl2.H2O) ke dalam 1 L akuades, dengan persamaan sebagai berikut :
…(1)
Berat molekul CdCl2.H2O = 201,32 g/mol Berat molekul logam kadmium (Cd) = 112,40 g/mol
Jadi larutan stok kadmium 1000 mg/L dibuat dengan melarutkan 1791,10 mg CdCl2.H2O dengan 1 L akuades.
Larutan stok tembaga 1000 mg/L dibuat dengan melarutkan kristal tembaga (II) sulfat pentahidrat (CuSO4.5H2O) ke dalam 1 L akuades, dengan persamaan (1) :
Berat molekul CuSO4.5H2O = 249,68 g/mol Berat molekul logam tembaga (Cu) = 63,55 g/mol
Untuk membuat 100 mg/L larutan induk tembaga (Cu), dibutuhkan :
Jadi larutan stok tembaga 100 mg/L dibuat dengan melarutkan 3929,20 mg CuSO4.5H2O dengan 1 L akuades.
3.3.1.3 Pembuatan Larutan Buffered Formalin 50%
Larutan buffered formalin 50% dibuat dengan melarutkan 250 mL full
strength formalin dalam gelas beaker 250 mL dengan akuades, tambahkan ± 0,13
g borax supaya pH larutan menjadi 7, dan diaduk hingga homogen. Kemudian larutan tersebut dimasukkan ke dalam botol plastik, beri label, dan simpan dalam lemari pendingin.
3.3.2 Pelaksanaan Penelitian 3.3.2.1 Pengaturan Wadah Uji
Tabung-tabung reaksi yang telah bersih kemudian diberi label dan diletakkan pada rak tabung reaksi. Satu set perlakuan reference toxicant disiapkan dengan 6 konsentrasi dengan setiap konsentrasi memiliki 5 ulangan. Perlakuan ini dimulai dengan kontrol dan diteruskan dengan konsentrasi yang meningkat (contoh : kontrol; 1,0; 1,8; 3,2; 5,6; dan 10 mg/L). Satu set perlakuan toksikan lain yang diujikan disiapkan dengan cara yang sama.
Satu set perlakuan lain berisi enam tabung reaksi berlabel ID disiapkan untuk mengetahui initial density (ID). Perlakuan ini berfungsi untuk mengetahui jumlah embrio yang dimasukkan ke dalam masing-masing tabung reaksi.
Sedangkan untuk mengetahui perkembangan embrio hingga tahap D-shape, disiapkan satu set perlakuan berisi ± 12 tabung reaksi berlabel observation.
3.3.2.2 Pembuatan Larutan Uji
Larutan uji dibuat dengan mengencerkan larutan stok yang telah dibuat, dengan persamaan berikut :
C1.V1 = C2.V2 …..(2)
Dimana :
C1 = Konsentrasi larutan stok
V1 = Volume larutan stok
C2 = Konsentrasi larutan uji yang diinginkan
Konsentrasi larutan Cd yang akan digunakan untuk uji toksisitas adalah 0,32 mg/L; 0,56 mg/L; 1,0 mg/L; 1,8 mg/L; 3,2 mg/L; dan 5,6 mg/L. Konsentrasi larutan Cu yang akan digunakan untuk uji toksisitas adalah 1,0 µg/L; 1,8 µg/L; 3,2 µg/L; 5,6 µg/L; dan 10 µg/L. Larutan uji yang dibutuhkan sebanyak 250 mL untuk setiap konsentrasi. Berikut ini contoh pembuatan larutan uji Cd:
Volume larutan uji Cd yang ingin dibuat = 250 mL
Konsentrasi larutan stok Cd = 1000 mg/L
Konsentrasi larutan uji Cd yang diinginkan = 0,32 mg/L Larutan stok Cd yang dibutuhkan :
Jadi larutan uji Cd 0,32 mg/L dibuat dengan melarutkan 0,08 mL larutan stok Cd dengan 250 mL air laut yang telah steril. Hal yang sama dapat dilakukan untuk membuat larutan uji lainnya.
3.3.2.3 Pengukuran Kualitas Air dan Konsentrasi Aktual Larutan Uji Kualitas air larutan uji merupakan hal yang penting dalam penelitian ini, dimana hal ini menentukan bahwa hanya logam berat kadmium dan tembaga yang berpengaruh terhadap larva kerang hijau (Perna viridis), maka kondisi kualitas air pada larutan uji diusahakan optimum. Parameter yang diukur dalam uji toksisitas ini adalah salinitas, temperatur, pH, dan oksigen terlarut. Salinitas diukur
menggunakan refraktometer, temperatur dan pH diukur dengan pH-meter, dan oksigen terlarut diukur dengan DO-meter. Larutan uji yang telah dibuat, terlebih dahulu diukur kualitas airnya sebelum digunakan dalam uji definitif.
Larutan uji yang dibutuhkan untuk uji definitif hanya 9 mL. Sisa larutan uji diawetkan dengan HNO3 untuk selanjutkan diukur konsentrasi aktualnya.
Pengukuran konsentrasi aktual larutan uji menggunakan metode AAS (Atomic
Absorption Spectrophotometry) yang rincian prosedurnya disajikan pada
Lampiran 1 dan gambar saat pengukuran konsentrasi aktual dapat dilihat pada Lampiran 2.
3.3.2.4 Pemijahan Kerang
Sebanyak ± 40 ekor kerang diletakkan dalam water bath yang berisi air laut dan telah dipasang heater. Suhu awal diatur dengan heater pada 28 °C dan dinaikkan 2 derajat secara berkala sampai kerang-kerang tersebut memijah. Kerang jantan yang mengeluarkan sperma dipisahkan dan diletakkan dalam gelas beaker 250 mL yang telah berisi air laut saring dan steril. Hal yang sama
dilakukan pada kerang betina yang mengeluarkan telur. Pencampuran antara sperma dan telur harus dihindari hingga saat fertilisasi dilakukan.
3.3.2.5 Fertilisasi Embrio Kerang
Telur yang dihasilkan kemudian disaring dengan saringan 0,25 mm dan ditampung pada gelas beaker 1 L. Sperma dipilih yang berkualitas (aktif dan banyak) dengan manggunakan mikroskop, kemudian beberapa mL sperma tersebut ditambahkan ke dalam larutan berisi telur. Telur harus dikelilingi 7-10 sperma, dapat dipastikan dengan mengamatinya pada mikroskop. Bila terlalu banyak sperma yang ditambahkan, akan terjadi polyspermy dan dapat
menghambat fertilisasi.
Setelah 2 jam pembuahan, kepadatan embrio dihitung dengan cara
mencampur 1 mL larutan embrio dengan 99 mL air laut steril (pengenceran 100x). Setelah tercampur dengan baik, 1 ml diambil dan diletakkan pada
Sedgewick-Rafter counter untuk dihitung kepadatan embrio dengan bantuan mikroskop.
Jumlah embrio yang teramati dikalikan dengan 100 dalam skala 100 mL.
Larutan embrio disiapkan dengan kepadatan 300 embrio/mL, dengan cara mengencerkan larutan stok embrio terdahulu. Hal ini agar saat inokulasi akan terdapat 30 embrio/mL dalam setiap tabung reaksi. Kemudian larutan embrio tersebut dihomogenkan dengan perforated plunger.
3.3.2.6 Uji Definitif
Uji toksisitas ini dilakukan menggunakan 5 konsentrasi larutan toksikan dan kontrol untuk masing-masing logam, dengan lima kali ulangan untuk konsentrasi dan kontrol. 1 mL stok embrio diinokulasikan ke dalam masing-masing tabung reaksi dan tutup dengan parafilm. Tabung reaksi yang berlabel ID (initial density) dipisahkan dan ditambahkan 1 mL Formalin 50 % ke dalam masing-masing tabung reaksi tersebut. Tabung berlabel ID disebut sebagai penanda 0 jam (zero time). Setelah satu jam atau hari berikutnya, kepadatan awal pada tabung-tabung ID dapat dihitung.
Perkembangan embrio kerang diamati secara berkala melalui tabung-tabung Observation dan jumlah larva normal yang teramati dibandingkan dengan kepadatan awal. Jika larva normal (mencapai tahap prodissoconch I atau bentuk D, D-shape) pada tabung pengamatan berjumlah ≥ 90 % dari kepadatan awal, uji dapat diakhiri. Kemudian masing-masing tabung reaksi dipreservasi dengan menambahkan Buffered Formalin 50 %. Selanjutnya pengamatan harian dapat dilakukan untuk menghitung jumlah larva yang berkembang normal dan
Lampiran 3. Lampiran 4 menyajikan kondisi yang direkomendasikan untuk uji toksisitas kerang.
3.4 Analisis Data
Data yang diperoleh selanjutnya dianalisis secara deskriptif dengan menggunakan parameter pengamatan secara mikroskopis. Penghitungan rata-rata abnormalitas dan mortalitas larva kerang hijau dengan menggunakan rumus berikut:
Mean abnormality (%) = (jumlah total larva abnormal dari tiap ulangan) x 100 ....(3)
(total jumlah larva dari tiap ulangan)
Mean mortality (%) = (100 – jumlah total larva survive ) x 100 …(4) (total jumlah larva)
Corrected response (%) = (% test response - % kontrol respon) x 100 …(5) (100 - % kontrol respon)
Nilai atau hasil yang didapat dari uji toksisitas akut dengan menggunakan embrio Bivalvia dilaporkan sebagai nilai EC50 (Effective Concetration) berdasarkan jumlah abnormalitas dan mortalitas biota uji. Perhitungan nilai EC50 dilakukan dengan program EFFL dengan metode Spearman-Karber. Nilai EC50 dapat juga dihitung menggunakan grafik regresi linier antara konsentrasi toksikan dengan % abnormalitas. Regresi linier yang digunakan dengan persamaan matematis sebagai berikut :
Y = ax ± b ….(6) Dimana :
Y = % abnormalitas larva akibat pengaruh toksikan
x = konsentrasi toksikan
Penghitungan nilai NOEC (No Observed Effect Concentration) dan LOEC (Lowest Observed Effect Concentration) dilakukan dengan program TOXSTAT. Selanjutnya menggunakan transformasi Arcsine square-root, Shapiro-Wilks untuk uji normalitas data, dan Bartlett untuk uji homogenitas. Jika uji tersebut telah dilakukan dan data menyebar normal serta seragam, kemudian dilakukan uji statistik dengan t-dunnett’s. Analisis Rancangan Acak Lengkap dapat juga digunakan untuk perhitungan nilai NOEC dan LOEC dengan persamaan matematis sebagai berikut:
yij = µ + αi + εij
….(7)
Dimana:
yij : Jumlah larva akibat perlakuan logam berat
µ : rataan umum
αi : pengaruh logam berat ke-i
4. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Konsentrasi Aktual Larutan Uji
Konsentrasi aktual diukur menggunakan metode AAS (Atomic Absorption
Spectrophotometry) (Lampiran 1 dan 2). Larutan uji yang sebelumnya telah
diawetkan dengan HNO3 diektrak terlebih dahulu untuk selanjutnya dapat diukur konsentrasi aktualnya. Hasil pengukuran konsentrasi aktual dapat dilihat pada Tabel 3.
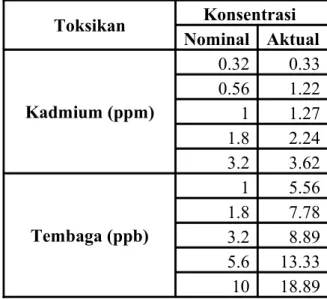
Tabel 3. Konsentrasi nominal dan aktual kadmiun (Cd) dan tembaga (Cu) dalam larutan uji
Toksikan Konsentrasi Nominal Aktual Kadmium (ppm) 0.32 0.33 0.56 1.22 1 1.27 1.8 2.24 3.2 3.62 Tembaga (ppb) 1 5.56 1.8 7.78 3.2 8.89 5.6 13.33 10 18.89
Konsentrasi nominal larutan uji kadmium yang digunakan berkisar 0,32 – 3,2 ppm dan kisaran konsentrasi nominal larutan uji tembaga 1,0- 10 ppb.
Berdasarkan Darmono (1995), larva kerang lebih sensitif terhadap tembaga dibandingkan kadmium sehingga konsentrasi tembaga yang digunakan dalam uji
toksisitas ini lebih rendah dengan satuan ppb dibandingkan kadmium dengan satuan ppm.
Hasil konsentrasi aktual kadmium yang diperoleh cukup mendekati nilai nominalnya, kecuali untuk konsentrasi nominal 0,56 ppm yang hasil konsentrasi aktualnya sampai dua kali lipatnya yaitu 1,22 ppm. Hasil konsentrasi aktual tembaga memiliki simpangan yang sangat jauh dari nilai nominalnya. Hal tersebut dapat dikarenakan beberapa hal diantaranya air laut yang digunakan diduga sudah mengandung tembaga, kemampuan alat AAS yang umumnya digunakan untuk pengukuran logam dengan satuan ppm, dan ada kesalahan dalam proses pembuatan larutan stok atau larutan uji.
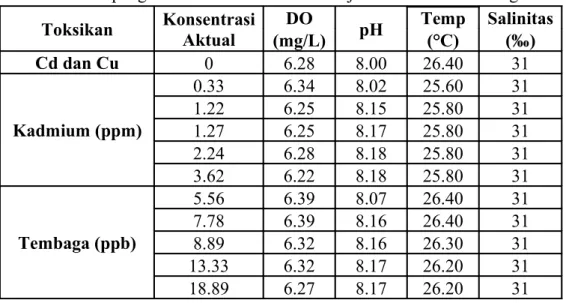
4.1.2 Parameter Kualitas Air
Parameter yang digunakan dalam penentuan kualitas air larutan uji adalah suhu, salinitas, pH, dan oksigen terlarut. Tabel 4 menunjukkan hasil pengukuran kualitas air larutan uji kadmium dan tembaga secara lengkap.
Tabel 4. Hasil pengukuran kualitas air larutan uji kadmium dan tembaga Toksikan Konsentrasi Aktual DO pH Temp Salinitas (mg/L) (°C) (‰) Cd dan Cu 0 6.28 8.00 26.40 31 Kadmium (ppm) 0.33 6.34 8.02 25.60 31 1.22 6.25 8.15 25.80 31 1.27 6.25 8.17 25.80 31 2.24 6.28 8.18 25.80 31 3.62 6.22 8.18 25.80 31 Tembaga (ppb) 5.56 6.39 8.07 26.40 31 7.78 6.39 8.16 26.40 31 8.89 6.32 8.16 26.30 31 13.33 6.32 8.17 26.20 31 18.89 6.27 8.17 26.20 31
Parameter kualitas air larutan uji yang diukur sebelum inokulasi larva dilakukan. Hasil pengukuran kualitas air kontrol menunjukkan oksigen terlarut 6,28 mg/L, pH 8, suhu 26,40 °C, dan salinitas 31 ‰. Pada larutan uji diperoleh kisaran oksigen terlarut 6,22-6.39 mg/L dengan rata-rata 6,30 mg/L, kisaran pH 8,02-8,18 dengan rata-rata 8,14, kisaran suhu 25,60-26,40 °C dengan rata-rata 26,03 °C, dan rata-rata salinitas 31 ‰. Kualitas air larutan uji merupakan hal yang penting dalam penelitian ini, dimana hal ini menentukan bahwa hanya logam berat kadmium dan tembaga yang berpengaruh terhadap larva kerang hijau
(Perna viridis).
4.1.3 Kepadatan Larva Awal dan Pengamatan Perkembangan Larva
Kerang Hijau (Perna viridis) selama 48 jam
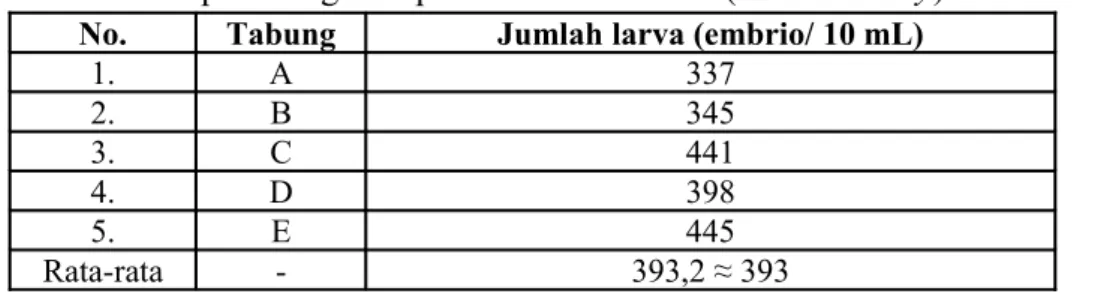
Kepadatan awal diperoleh dengan menghitung minimal tiga tabung reaksi
Initial density. Rata-rata kepadatan larva yang dihitung menggunakan Sedgewick-Rafter counter adalah 393 larva/mL. Hal tersebut berarti dalam satu tabung reaksi
diperkirakan terdapat 393 larva. Hasil perhitungan initial density dapat dilihat pada Tabel 5.
Tabel 5. Hasil perhitungan kepadatan awal embrio (initial density) dari 5 tabung No. Tabung Jumlah larva (embrio/ 10 mL)
1. A 337 2. B 345 3. C 441 4. D 398 5. E 445 Rata-rata - 393,2 ≈ 393
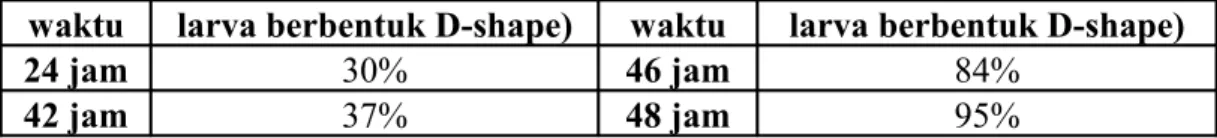
Pengamatan terhadap perkembangan larva kerang hijau selama 48 jam dilakukan untuk menghitung jumlah larva yang telah berbentuk D-shape. Pada saat itu larva kerang dalam wadah kontrol diharapkan telah berkembang menjadi
D-shape. Tabel 6 menunjukkan hasil perhitungan larva kerang hijau yang telah berkembang menjadi D-shape selama 48 jam. Perkembangan larva kerang hijau (Perna viridis) selama 48 jam dapat dilihat di Lampiran 5.
Tabel 6. Perkembangan pembentukan D-shape selama 48 jam
waktu larva berbentuk D-shape) waktu larva berbentuk D-shape)
24 jam 30% 46 jam 84%
42 jam 37% 48 jam 95%
Larva D-shape berjumlah lebih besar dari 90 % baru terjadi pada jam ke-48. Kemudian uji dapat dihentikan dengan memberikan larutan formalin pada setiap tabung uji. Jika pada jam ke-48 larva D-shape belum mencapai 90%, maka uji toksisitas dianggap gagal.
4.1.4 Toksisitas Kadmium dan Tembaga terhadap Perkembangan Larva
Kerang Hijau (Perna viridis)
Efek yang diukur dalam uji ini adalah keabnormalan larva setelah 48 jam. Pada Tabel 7 ditunjukkan hasil perhitungan larva kerang hijau yang abnormal dan mortalitasnya. Grafik hubungan konsentrasi kadmium dan tembaga dengan persentase rata-rata jumlah larva yang abnormal ditunjukkan pada Gambar 4. Hasil perhitungan larva normal dan abnormal dapat dilihat pada Lampiran 6 dan 7. Perbedaan bentuk larva normal dan abnormal dapat dilihat pada Lampiran 8.
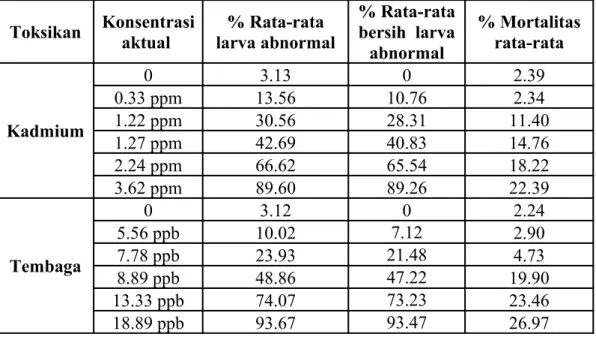
Tabel 7. Keabnormalan dan mortalitas rata-rata pada uji kadmium dan tembaga terhadap larva kerang hijau (Perna viridis)
Toksikan Konsentrasi aktual % Rata-rata larva abnormal % Rata-rata bersih larva abnormal % Mortalitas rata-rata Kadmium 0 3.13 0 2.39 0.33 ppm 13.56 10.76 2.34 1.22 ppm 30.56 28.31 11.40 1.27 ppm 42.69 40.83 14.76 2.24 ppm 66.62 65.54 18.22 3.62 ppm 89.60 89.26 22.39 Tembaga 0 3.12 0 2.24 5.56 ppb 10.02 7.12 2.90 7.78 ppb 23.93 21.48 4.73 8.89 ppb 48.86 47.22 19.90 13.33 ppb 74.07 73.23 23.46 18.89 ppb 93.67 93.47 26.97
Hasil uji definitif menunjukkan rata-rata larva abnormal pada kontrol kadmium dan tembaga tidak terlalu berbeda yaitu 3,13 % dan 3,12 %. Rata-rata mortalitas pada kontrol kadmium adalah 2,39 % dan pada kontrol tembaga adalah 2,24 %. Berdasarkan kriteria yang ditetapkan oleh Asean Canada CPMS-II (1995) untuk uji toksisitas pada larva kerang hijau, hasil penelitian ini dapat dinyatakan valid karena abnormalitas pada kontrol kurang dari 10 % dan mortalitas kurang dari 30 %.
Pada konsentrasi terendah kadmium yaitu 0,33 ppm, rata-rata larva yang berkembang abnormal adalah 13,56 %, sementara pada konsentrasi tertinggi yaitu 3,62 ppm, rata-rata larva yang berkembang abnormal adalah 89,60 %. Pada konsentrasi terendah tembaga yaitu 5,56 ppb, rata-rata larva yang berkembang abnormal adalah 10,02 %, sementara pada konsentrasi tertinggi yaitu 18,89 ppb, rata-rata larva yang berkembang abnormal adalah 93,67 %.
Gambar 4. Grafik hubungan konsentrasi kadmium dan tembaga dengan persentase rata-rata jumlah larva abnormal
Berdasarkan data pada Tabel 7 kemudian dapat diduga nilai EC50, LOEC (Lowest Observed Effect Concentration), dan NOEC (No Observed Effect
Concentration). Hasil pengujian EC50, LOEC, dan NOEC pada kadmium dan
tembaga terhadap abnormalitas larva kerang hijau (Perna viridis) dapat dilihat pada Tabel 8.
Tabel 8. Hasil uji toksisitas kadmium dan tembaga pada larva kerang hijau (Perna viridis)
Toksikan EC50 - 48 jam LOEC NOEC
Kadmium 1,97 ppm 0.33 ppm < 0.33 ppm Tembaga 11.70 ppb 5.56 ppb < 5.56 ppb
Penentuan nilai EC50 terhadap abnormalitas larva kerang hijau (Perna
viridis) dengan menggunakan metode Spearman-Karber menunjukkan konsentrasi
efektif yang menyebabkan 50% larva kerang hijau berkembang abnormal terjadi pada konsentrasi 1,97 ppm untuk Cd dan 11,70 ppb untuk Cu. Nilai tersebut terletak pada selang kepercayaan 95 % antara konsentrasi 1,89 – 2,05 ppm untuk Cd dan konsentrasi 11,36 – 12,04 ppb untuk Cu (Lampiran 9 dan 10). Nilai EC50 juga dapat diperoleh dari persamaan regresi linier pada Gambar 4. Persamaan regresi linier untuk kadmium dan tembaga berturut-turut adalah y = 25.07x + 2.86 dan y = 5.54x - 9.82.
Hasil analisis statistik menunjukkan bahwa kadmium dan tembaga mempunyai pengaruh yang berbeda nyata terhadap keabnormalan larva kerang hijau (Perna viridis). Hal tersebut ditunjukkan dengan nilai Fhitung yang lebih besar dari Ftabel. Selanjutnya dilakukan uji lanjut Dunnetts untuk mengetahui nilai LOEC dan NOEC. Nilai LOEC diperoleh dari hasil uji lanjut Dunnetts yang menunjukkan nilai konsentrasi terendah yang signifikan dan ditandai dengan
tanda bintang (*). Nilai NOEC diperoleh dari hasil uji lanjut Dunnetts yang menunjukkan nilai konsentrasi terendah yang tidak signifikan dan tidak ditandai dengan tanda bintang (*). Pada penelitian ini hanya nilai LOEC yang dapat diketahui yaitu 0,32 ppm untuk kadmium dan 5,56 ppb untuk tembaga. Nilai NOEC tidak diperoleh dikarenakan konsentrasi terendah yang digunakan dalam penelitian ini sudah berpengaruh signifikan terhadap abnormalitas larva kerang hijau. Nilai NOEC diperkirakan terletak antara nilai LOEC dan kontrol masing-masing perlakuan. Perhitungan LOEC dan NOEC dapat dilihat pada lampiran 11 dan 12.
4.2 Pembahasan
Pencemaran logam berat seperti kadmium dan tembaga di Teluk Jakarta dapat mempengaruhi biota yang hidup di perairan tersebut. Data toksisitas kedua logam tersebut terhadap biota yang paling sensitif sangat diperlukan untuk dapat melindungi biota perairan dari pencemaran dan selanjutnya dapat mengetahui batas kadar yang aman bagi lingkungan perairan. Larva kerang merupakan tahapan yang paling rentan terhadap pengaruh toksikan. Pengaruh toksikan terhadap larva kerang umumnya berupa larva abnormal yaitu larva veliger yang gagal dalam pembentukan cangkang D (Darmono, 1995)
Pada penelitian ini, kadmium digunakan sebagai kontrol positif (reference
toxicant) dikarenakan sifat kadmium dalam air yang stabil dan kadmium telah
banyak digunakan dalam penelitian toksisitas yang telah diketahui pengaruhnya pada biota uji. Penelitian toksisitas tembaga pada larva kerang sendiri masih
belum banyak dilakukan sehingga diperlukan kontrol positif (reference toxicant) sebagai dasar bahwa penelitian yang dilakukan telah sesuai dengan prosedur.
Persentase rata-rata larva abnormal pada konsentrasi aktual kadmium 0,33 ppm, 1,22 ppm, 1,27 ppm, 2,24 ppm, dan 3,62 ppm berturut-turut adalah 13,56 %, 30,56 %, 42,69 %, 66,62 %, dan 89,60 %. Persentase rata-rata larva abnormal pada konsentrasi aktual tembaga adalah 5,56 ppb, 7,78 ppb, 8,89 ppb, 13,33 ppb, dan 18,89 ppb masing-masing sebesar 10,02 %, 23,93 %, 48,86 %, 74,07 %, dan 93,67 % (Tabel 7). Hasil uji definitif tersebut menunjukkan bahwa semakin tinggi konsentrasi kadmium maupun tembaga, keabnormalan larva semakin meningkat pula.
Nilai EC50 kadmium dan tembaga terhadap abnormalitas larva kerang hijau (Perna viridis) berturut-turut adalah 1,971 ppm dan 11,70 ppb. Penelitian sebelumnya tentang toksisitas kadmium dan tembaga terhadap larva kerang hijau yang dilakukan oleh Afianty (2002) menghasilkan nilai EC50 yang jauh berbeda yaitu EC50 kadmium sebesar 0,91 ppm dan EC50 tembaga sebesar 17,93 ppb. Berdasarkan data tersebut dapat dilihat bahwa larva kerang hijau yang digunakan dalam penelitian ini lebih tahan terhadap kadmium tetapi lebih sensitif terhadap tembaga dibandingkan penelitian yang dilakukan Afianty (2002).
Menurut Bryan in Darmono (1995) beberapa faktor yang mempengaruhi kekuatan racun logam berat terhadap ikan dan organisme air lainya adalah : • Bentuk ikatan kimia dari logam yang terlarut dalam air
• Pengaruh interaksi antara logam dan jenis racun lainnya
• Pengaruh lingkungan seperti temperatur, salinitas, pH, atau kadar oksigen dalam air
• Kondisi hewan, fase siklus hidup (telur, larva, dewasa), ukuran organisme, jenis kelamin, dan kecukupan kebutuhan nutrisi
• Kemampuan hewan untuk menghindar dari kondisi buruk (polusi) • Kemampuan hewan untuk beradaptasi terhadap racun, misalnya
detoksikasi.
Faktor lingkungan dalam uji diwakili oleh parameter kualitas air larutan uji sebagai media pertumbuhan larva yang diukur sebelum inokulasi larva. Hasil pengukuran menunjukkan kisaran salinitas, oksigen terlarut, pH, dan suhu sesuai dengan yang dianjurkan Asean Canada CPMS-II (1995). Sehingga pengaruh yang terjadi dalam uji ini bukan diakibatkan oleh faktor keadaan organisme (kualitas telur yang buruk atau stress) maupun kondisi media uji, melainkan lebih diakibatkan oleh perlakuan yang diberikan.
Pengukuran salinitas pada kontrol, larutan kadmium, dan tembaga adalah 31 ‰. Kerang hijau merupakan organisme yang memiliki kisaran toleransi salinitas yang besar. Menurut Romimohtarto dan Juwana (1998) perkembangan kerang hijau dari larva hingga dewasa sangat dipengaruhi oleh salinitas. Pada tingkat larva, salinitas 21-33 ‰ memungkinkan larva tersebut berkembang normal menjadi tingkat berikutnya sebagai veliger. Semua larutan uji seharusnya berada dalam kisaran salinitas 23 sampai 34 ‰, dan tidak lebih dari 1 ‰ salinitas kontrol (Enviroment Canada, 1992). Peningkatan kepekaan terhadap toksikan dapat disebabkan oleh penurunan salinitas (ASTM, 2006).
Pengukuran oksigen terlarut pada kontrol menghasilkan nilai sebesar 6,28 mg/L, pada kadmium rata oksigen terlarut 6,27 mg/L, dan pada tembaga rata-rata oksigen terlarut 6,34 mg/L. Kondisi tersebut sesuai dengan Keputusan
Menteri Negara Lingkungan Hidup No. 51 Tahun 2004, Tentang Baku Mutu Air Laut, oksigen terlarut yang diperbolehkan untuk biota laut adalah > 6 mg/L. Menurut Enviroment Canada (1992) kadar oksigen terlarut yang terlampau tinggi merupakan tekanan bagi banyak organisme air dan mungkin memberikan
pengaruh pada larva kerang hijau juga. Selain itu dinyatakan pula bahwa tekanan akibat oksigen rendah mungkin bersaing saling mempengaruhi dengan beberapa tekanan yang berasal dari toksikan.
Pengukuran pH pada kontrol menghasilkan nilai 8, pada kadmium rata-rata pH adalah 8,14, dan pada tembaga rata-rata-rata-rata pH adalah 8,15. Menurut Ditjen Perikanan Budidaya (2008) kisaran pH yang sesuai untuk perkembangan kerang hijau adalah 6,5 sampai 9. Waldichuk (1974) in Hutagalung (1991) menyatakan bahwa penurunan pH perairan menyebabkan tingkat bioakumulasi logam berat semakin besar, sehingga penurunan pH dapat menyebabkan daya racun logam berat semakin besar.
Hasil pengukuran suhu pada kontrol, larutan uji kadmium maupun tembaga diperoleh bahwa kisaran suhu antara 25,6 sampai 26,4 °C. Kondisi tersebut masih sesuai dengan kisaran suhu ideal untuk perkembangan kerang hijau adalah 18,0 sampai 34,4 °C (EPS, 1980). Menurut Enviroment Canada (1992) suhu yang tinggi dapat membuat uji lebih peka dalam mendeteksi beberapa toksikan.
Darmono (1995) menyatakan toksisitas logam dapat mempengaruhi masa pertumbuhan dan perkembangan larva. Beberapa penelitian mengenai toksisitas logam pada jenis kerang yang telah dilakukan menunjukkan bahwa dalam proses pertumbuhan kerang, fase awal perkembangan larva kerang merupakan tahap
yang paling sensitif terhadap toksisitas logam sehingga banyak terjadi kematian pada konsentrasi logam yang rendah. Nilai EC50 – 48 jam terhadap larva kerang hijau dari penelitian ini (Cd 1,97 ppm dan Cu 11,70 ppb) lebih rendah
dibandingkan nilai EC50 – 24 jam terhadap kerang dewasa dengan ukuran 3 – 4 cm yang dilakukan oleh Yap et.al. (2003) yaitu Cd 1,53 ppm dan Cu 0,25 ppm.
Nilai EC50 untuk uji toksisitas dengan larva kerang ternyata selalu bervariasi dari uji yang berlainan. Hal ini disebabkan karena perbedaan
sensitifitas dari biota uji. Bila dibandingkan dengan kondisi subtropis, toksisitas kedua logam uji dalam kondisi tropis lebih besar. Mclucky (1986) menyatakan bahwa suhu rendah menurunkan toksisitas logam. Data toksisitas kadmium dan tembaga terhadap biota uji kerang biru (Mytilus edulis) dari subtropis mungkin dapat dijadikan pembanding. Kerang hijau (Perna viridis) dan kerang biru (Mytilus edulis) termasuk dalam satu marga, dan mempunyai kemiripan dalam sifat-sifat biologi dan morfologi. Nilai EC50-48 jam terhadap larva kerang hijau (Cd 1,97 ppm dan Cu 11,70 ppb) lebih rendah dibandingkan nilai EC50-48 jam terhadap larva kerang biru menurut Martin et.al. (1981) (Cd 12 ppm) dan Tucker (1998) (Cu 17,6 ppb).
Hasil perhitungan EC50 pada penelitian ini juga menunjukkan bahwa larva kerang hijau paling sensitif terhadap tembaga dibandingkan kadmium. Hal tersebut sesuai dengan hasil penelitian Yap et.al. (2003) yang menyatakan bahwa
Perna viridis paling sensitif terhadap Cu (EC50 0,25 ppm) dibandingkan Cd
(EC50 1,53 ppm), Pb (EC50 4,12 ppm), dan Zn (EC50 3,2 ppm). Walaupun tembaga termasuk logam esensial untuk makhluk hidup, tetapi logam ini dapat bersifat toksik dan dapat menyebabkan keabnormalan sampai kematian larva
kerang pada konsentrasi tinggi. Menurut Darmono (1995) kandungan logam esensial dalam jaringan organisme biasanya mengalami regulasi (diatur pada batas-batas konsentrasi tertentu). Konsentrasi logam yang tinggi dalam air dapat mengganggu proses regulasi logam dalam tubuh organisme.
Jika hasil uji toksisitas kadmium dan tembaga terhadap larva kerang hijau dibandingkan dengan hasil uji toksisitas terhadap oganisme laut lain, terlihat bahwa larva kerang hijau merupakan biota uji paling sensitif terhadap tembaga dibandingkan organisme air lain. Hasil penelitian ini menunjukkan nilai EC50 tembaga terhadap kerang hijau adalah 11,70 ppb lebih rendah dibandingkan nilai EC50 tembaga terhadap Isochrysis galbana (Yap et.al., 2003), Sphaeroma
serratum (Prato et.al., 2005) dan larva Chasmagnathus granulata (Marcovecchio et.al., 2005) berturut-turut sebesar 0,91 ppm, 4,60 ppm, dan 219,20 ppb.
Mathew dan Menon (1983) menyatakan bahwa tembaga dapat
mempengaruhi produksi benang byssal kerang hijau. Filamen-filamen insang kerang terlepas selama pengujian toksisitas tembaga, sehingga pada konsentrasi yang berlebihan tembaga dapat membahayakan kehidupan kerang hijau.
Kerang hijau (Perna viridis) umum digunakan dalam studi toksikologi sebagai bio-indikator lingkungan. Berbagai bio-marker telah banyak
menggunakan kerang dalam memonitor tingkat polusi lingkungan diantaranya Biomarker Genotoksisitas dan Aktivitas Acetylcholinesterase di Populasi Alam
Mytilus galloprovincialis sepanjang gradient polusi di Teluk Oristano (Sardinia,
Mediterania Barat) (Magni et.al., 2006), Selular Biomarker untuk Monitoring Lingkungan Estuari: Kerang Transplantasi versus Pertumbuhan Alami (Nigro
Kerang Hijau (Perna viridis) pada daerah Terkontaminasi di Perairan Pesisir Hong Kong (Nicholson, 1999). Walaupun kerang hijau dikenal sebagai agen bimonitoring yang baik karena dapat mengakumulasi logam dalam jaringan tubuhnya tetapi jika kadar logam berat yang terserap oleh tubuh kerang terlalu tinggi juga dapat menyebabkan keabnormalan pada tahap larva dan kematian pada kerang dewasa yang kemudian akan menyebabkan kepunahan.
Fase larva merupakan tingkat hidup yang paling sensitif terhadap perubahan lingkungan hidup, karena pada fase ini terjadi pembelahan sel yang menentukan keberhasilan pembentukan organ tubuh. Pada kondisi lingkungan normal pembentukan cangkang awal pada fase larva kerang hijau menentukan keberhasilan hidupnya sampai dewasa. Kegagalan pembentukan cangkang akan mengurangi daya tahan hidup kerang hijau. Fase larva Prodisoconch I (D-shape) merupakan tahap yang paling sensitif pada Bivalvia karena merupakan
pembentukan cangkang larva paling awal (Strathmann, 1987 in Afianty, 2002). Kondisi lingkungan yang tidak sesuai akan menyebabkan perkembangan cangkang terganggu. Oleh karena itu diduga bahwa Kadmium dan Tembaga mengganggu sistem enzimatis pada larva sehingga saat pembelahan dan pembentukan organ tubuh termasuk cangkang sebagai pelindung organ yang lunak, menjadi terganggu. Akibatnya terjadi abnormalitas saat fase larva
Prodisoconch I (D-shape) yang merupakan fase pembentukan cangkang larva
5. KESIMPULAN
5.1 Kesimpulan
Hasil uji toksisitas kadmium dan tembaga terhadap perkembangan larva kerang hijau (Perna viridis) menunjukkan semakin tinggi konsentrasi kadmium dan tembaga maka semakin tinggi pula tingkat keabnormalan larva. Uji toksisitas kadmium terhadap perkembangan abnormal larva kerang hijau menghasilkan nilai EC50-48 jam sebesar 1,97 ppm. Nilai EC50-48 jam dari tembaga terhadap
perkembangan abnormal larva kerang hijau adalah 11,70 ppb.
Nilai LOEC dan NOEC kadmium yang diperoleh pada penelitian ini berturut-turut sebesar 0,33 ppm dan < 0,33 ppm. Nilai LOEC dan NOEC tembaga adalah 5,56 ppb dan < 5,56 ppb. Berdasarkan hasil penelitian ini dapat
disimpulkan bahwa larva kerang lebih sensitif terhadap tembaga dibandingkan kadmium.
5.2 Saran
Pengukuran konsentrasi aktual sebaiknya dilakukan terlebih dahulu sebelum melakukan uji toksisitas supaya diperoleh konsentrasi aktual yang sesuai dengan konsentrasi nominal. Konsentrasi yang digunakan saat uji akhir
disarankan lebih rendah dari 0.33 ppm untuk Cd dan 5,56 ppb untuk Cu supaya nilai NOEC dapat diperoleh.
DAFTAR PUSTAKA
Afianty, L. 2002. Pengaruh Tembaga dan Kadmium terhadap Perkembangan Embrio-Larva Kerang Hijau (Perna viridis). Skripsi. Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Padjadjaran. Jatinangor, Bandung.
Arifin, Z dan M. Fitriati. 2006. Trace Metal Accumulation by Green Mussel (Perna viridis) Cultured in a Highly Polluted Area of Jakarta Bay, Indonesia. International Conference Hubs, Harbour Delta’s in Southeast Asia;
Multidiciplinary and Inter Cultural Perspective. Royal Academy of Overseas Science, Pnom Penh, Cambodia.
Asean Canada Cooperative Programme on Marine Science Phase II. 1995. Phase II. Draft Protocol for Subtidal Toxicity Tests Using Tropical Marine
Organisms. Regional Workshop on Chronic Toxicity Testing. Burapha University, Institute of Marine Science. Pp. 14-19.
ASTM. 2006. Annual Book of ASTM Standards. Section 11. ASTM International. West Conshohocken.
Bringmann, G., and R. Kuhn. 1978. Limiting Values for the Noxious Effects of Water Pollutant Material to Blue Algae (Microcystis aeruginosa) and Green Algae (Scenedesmus quadricauda) in Cell Propagation Inhibition Tests. Vom
Wasser. 50:45-60
Bryan, G. W. 1976. Effects of Pollutants on Aquatic Organisms. Cambridge University Press. Cambridge.
CEC. 1978. Criteria (Dose/Effect Relationships) for Cadmium. Report of Working Group of Experts Prepared for the Commission of the European Communities. Directorated-General for Social Affairs, Health and Safety Directorate. Pergamon Press. Oxford, New York, Toronto, Sydney, Paris, Frankfurt.
Chongprasith, P., W. Utomprurkporn, and C. Rattikhansuka. 1999. ASEAN Marine Water Quality Criteria For Cadmium. ASEAN-Canada CPMS-II AMWQC for Cadmium. Marine Environment Division, Water Quality Management Bureau, Pollution Control Department. VII-1 to VII-64
Chumnantana, R., J. Sanguansin and J. Koyama. 1992. Study on Acute Toxicity Test of Cadmium to Red Snapper Juvenile, Lutjanus argentimaculatus (Forskal). Thai Mar. Fish. Res. Bull. 3 : 55-59.
Clark, R. B. 1989. Marine Pollution. Second Edition. Clarendon Press Oxford. Pp. 1-105.
Darmono. 1995. Logam Dalam Sistem Biologi Makhluk Hidup. Universitas Indonesia Press. Jakarta.
Dechamprompun, S. 1984. Effects of Temperature and Heavy Metals on Embryonic Development and Adult Oyster (Crassostrea commercialis Iredale and Roughly). Thesis. Faculty of Graduate Studies, Chulalongkom University, Bangkok, Thailand.
Ditjen Perikanan Budidaya. 2008. Budidaya Kerang Hijau (Perna viridis). http:// www.indonesia.go.id. Diakses 8 Maret 2009.
Edding, M., and F. Tala. 1996. Copper Transfer and Influence on a Marine Food Chain. Bull.Environ.Contam.Toxicol. 57(4):617-624
Effendie, H. 1995. Abnormal Shape and Size of Scenedesmus armatusl as Indicator of Cooper and Cadmium Pollution. Jurnal Ilmu-ilmu Perairan dan
Perikanan Indonesia. Volume III (2) : 51-70.
Effendie, H. 2003. Telaah Kualitas Air: Bagi Pengelolaan Sumber Daya dan Lingkungan Perairan. Kanasius. Yogyakarta.
Enviroment Canada. 1992. Biological Test Method. Enviroment Canada :
Conservation and Protection. Ontario.
EPS (Enviroment Protection Service). 1980. Standard Procedure for Testing Acute Lethaly of Liquid Effluents. Enviroment Canada. EPS 1-WP-80-1. Fitriati, M. 2003. Bioakumulasi Logam Hd, Pb, dan Cd pada Kerang Hijau yang
dibudidayakan di Perairan Pesisir Kamal dan Cilincing Jakarta. Tesis. Program Pasca Sarjana. IPB. Bogor.
Geckler, J.R., W.B. Horning, T.M. Neiheisel, Q.H. Pickering, E.L. Robinson, and C.E. Stephan. 1976. Validity of Laboratory Tests for Predicting Copper Toxicity in Streams. EPA-600/3-76-116, U.S.EPA, Duluth, MN . Pp. 208. Harris, V.A. 1990. Sessile Animals of Sea Shore. Chapman and Hall.
London-New York-Tokyo-Melbourne. Pp. 379.
Hartanti. 1998. Analisis Kandungan Logam Berat Merkuri (Hg), Kadmium (Cd), Timbal (Pb), Arsen (As), dan Tembaga (Cu) Dalam Tubuh Kerang Konsumsi Serta upaya penurunannya. Tesis. Bogor: Fakultas Perikanan dan Kelautan IPB.
Hindarti, D. 1997. Metode Uji Toksisitas in Metode Analisis Air Laut, Sedimen, dan Biota. Buku 2. Pusat Penelitian dan Pengembangan Oseanografi – LIPI. Jakarta.