1
STUDI EKSPRESI TRANSFORMING GROWTH FACTOR (TGF- β) DAN GAMBARAN HISTOPATOLOGI GLOMERULUS GINJAL PADA TIKUS (Rattus
norvegicus) FIBROSIS GINJAL HASIL
Expression of Transforming Growth Factor (TGF- β) and Histopathological Renal in Rats (Rattus norvegicus) Renal Fibrosis Post Induced Streptokinase
Ken Ranisa Kusuma, Aulanni’am, Dyah Kinasih Wuragil
Program Studi Pendidikan Dokter Hewan, Program Kedokteran Hewan, Universitas Brawijaya [email protected]
ABSTRAK
Fibrosis ginjal adalah kelainan yang terjadi akibat inflamasi akut dan merupakan kerusakan ginjal tahap awal yang berujung pada gagal ginjal. Fibrosis ginjal ditandai dengan adanya glomerulosklerosis pada glomerulus ginjal, rusaknya sel-sel epitel ginjal dan ditemukannya sel-sel fibroblas pada jaringan ginjal. Streptokinase adalah protein ekstracelluler β-hemolytic streptococci yang digunakan untuk mengatasi permasalahan penyakit jantung dan sistem sirkulasi. Penggunaan Streptokinase dapat menyebabkan fibrosis ginjal. Kejadian fibrosis ginjal akan disertai dengan adanya peningkatan level marker fibrosis, salah satunya TGF-β. Tujuan penelitian ini untuk mengetahui ekspresi TGF-β dan gambaran histopatologi glomerulus ginjal pada tikus renal fibrosis pasca diinjeksi streptokinase. Pada penelitian ini terdapat 4 kelompok perlakuan yaitu kontrol (A), Streptokinase satu kali induksi (B), Streptokinase dua kali induksi (C), Streptokinase tiga kali induksi (D). Induksi pada tikus dilakukan secara injeksi intravena pada vena coccygea, dengan dosis Streptokinase 6000 IU/ekor tikus. Interval waktu pemberian induksi pada kelompok perlakuan C dan D yang mendapat induksi lebih dari satu kali adalah 5 hari. Data yang diamati dalam penelitian ini adalah gambaran histopatologi dan ekspresi TGF-β yang diamati dengan metode immunohistokimia. Hasil penelitian menunjukkan adanya kerusakan pada sel-sel epitel ginjal, terjadinya glomerulosklerosis dan perubahan struktur jaringan, pada gambaran histopatologi ginjal pasca induksi Streptokinase. Hasil analisis statistika terhadap ekspresi TGF-β berbeda nyata secara signifikan (P>0,05) dan persentase ekspresi TNF-α yang tertinggi sebesar 750% pada kelompok D yang diinduksi streptokinase dengan dosis 6000 IU/ekor tikus sebanyak tiga kali.
Kata kunci : Fibrosis ginjal, Streptokinase, Transforming Growth Factor (TGF-β), Glomerulus, Glomerulosklerosis
2 ABSTRACT
Renal fibrosis is an abnormal condition on renal occurred by acute inflammation. The development of kidney damage from the acute phase to renal fibrosis is characterized by glomerulosclerosis, epithelial cells damaged and presence of fibroblast cells with it’s products such as collagen fiber. Streptokinase is the β-hemolytic streptococci extracelluler protein that is used to overcome the problems of heart disease and circulation system. Streptokinase usage can lead to renal fibrosis. Occurrence of renal fibrosis will be followed by increasing of fibrosis marker’s such as, Transforming Growth Factor (TGF-β). The purpose of this study was to determine the expression of TGF-β and histopathology of glomerulus on renal fibrosis rats induced by streptokinase. In this study, rats were divided into 4 groups: control (A), group that induced 1x by streptokinase (B), group that induced 2x by streptokinase (C), group that induced 3x by streptokinase (D). Inducing of streptokinase on rats conducted by intravenous injection on vena coccygea with dose 6000 IU/rats. Group C and D here induced within five days interval. The histopathology of kidney were confirmed microscopically and TGF-β expression were observed by immunohistochemistry technique. The image of renal histopathology streptokinase induced rats showed epithelial cells damaged, glemerulosclerosis and transformation of renal tissue into mesenchymal tissue. The result of statistic analisis showed that TGF-β expression were significantly different between group (P>0,05) and the highest percentage of the TGF-β expression is 750% on group rats that induced by 3 x 6000 IU/rats Streptokinase in five days intervals.
Keywords: Renal fibrosis, Streptokinase, Transforming Growth Factor (TGF-β), Glomerulus, Glomerulosclerosis
3 PENDAHULUAN
Badan Kesehatan Dunia (WHO) menyatakan bahwa Penyakit Gagal Ginjal (PGG) menyumbang 850.000 kematian setiap tahunnya. Di Indonesia pada tahun 2007, angka kejadian PGG adalah 30,7 per satu juta penduduk (Suhardjono, 2007). Tingginya biaya pengobatan dan kurangnya fasilitas pengobatan penyakit ini menyebabkan banyak penderita tidak tertangani dengan baik. Menurut data dari Persatuan Nefrologi Indonesia (PERNEFTRI) terdapat 70.000 penderita PGG di Indonesia dan hanya 5.000 penderita yang tercacat telah menjalani pengobatan (Marbun, 2012). Sedangkan pada hewan, prevalensi dari penyakit tersebut diestimasi sebesar 1,6-20% untuk pet animal. Anjing dibawah umur 7 tahun beresiko terkena penyakit ini sebesar 0,3% dan pada anjing dengan umur diatas 7 tahun sebesar 0,7-2,9%. Pada kucing, untuk yang berumur dibawah 7 tahun resiko terkena penyakit ini sebesar 0,2-0,6% dan untuk kucing diatas 7 tahun resiko kejadiannya meningkat hingga 1,8-8,6%(Francey and Ariane, 2008; Kirk, 2000).
Fibrosis ginjal adalah kelainan yang terjadi akibat inflamasi akut dan merupakan kerusakan ginjal tahap awal yang nantinya akan berujung pada gagal ginjal. Gagal ginjal pada umumnya bersifat kronik dan irreversibel sehingga upaya pengobatan yang dilakukan selama ini tidak berhasil maksimal (Chatziantoniou, 2005).
Ginjal yang mengalami kelainan fibrosis ginjal akan terbentuk jaringan fibrosa yang banyak mengandung serat kolagen akibat dari kerusakan sel-sel epitel pada organ ginjal. Penyakit ini ditandai dengan terjadinya glomerusklerosis dan kemunculan jaringan fibrosa pada organ ginjal (Chatziantoniou, 2005).
Kejadian fibrosis ginjal ditandai dengan adanya peningkatan level marker fibrosis
diantaranya, NF-Kb, TNF-α dan TGF-β. Diyakini bahwa peran TGF-β sebagai salah satu sitokin mengaktifkan patomekanisme biomolekuler yang mendasari progresifitas penyakit ginjal (Border and Noble, 1994; Chen, 2012). TGF-β akan menginduksi Epithelial to Mesenchymal Transition (EMT), aktivasi fibroblas, infiltrasi monosit dan makrofag, juga apoptosis sel, sehingga akibat dari serangkaian proses tersebut berujung pada terbentuknya jaringan parut ginjal. Jumlah TGF-β di daerah tubulointerstisial ginjal berkorelasi dengan derajat inflamasi dan atrofi pada sel ginjal (Trihono, 2011).
Streptokinase merupakan obat trombolitik yang digunakan secara luas untuk mengatasi permasalahan seputar penyakit jantung, seperti myocardiac infarction. Streptokinase yang adalah protein ekstraselular dengan berat molekul 46-kDa dan terdiri dari 414 asam amino ini dipergunakan sebagai obat trombolitik oleh karena kemampuannya dalam meningkatkan jumlah plasmin dalam darah melalui proses aktivasi plasminogen (Petersen, 2007).
Streptokinase memiliki sifat toksik terhadap ginjal, Hu et al., (2008) menyatakan bahwa aktivasi plasminogen menjadi plasmin akan menginduksi peningkatan TGF-β dan Matrix Metalloproteinases (MMPs). Seperti yang telah dijelaskan sebelumnya bahwa TGF-β diyakini berperan penting dalam inisiasi dan progresifitas kejadian fibrosis ginjal, sedang peningkatan MMPs akan berperan langsung pada kejadian fibrosis ginjal (Hu et al., 2008; Pardede, 2009).
Penelitian yang dilakukan sejauh ini belum memberikan informasi mengenai patomekanisme kerusakan ginjal dari normal menjadi fibrosis pasca induksi Streptokinase. Oleh karena itu pengukuran level TGF-β dan perbandingan tingkat keparahan kerusakan ginjal melalui pengamatan gambaran histopatologi glomerulus pada tikus (Rattus
4 norvegicus) pasca injeksi Streptokinase sangat penting dipelajari guna memberikan gambaran mengenai patomekanisme terjadinya fibrosis ginjal, sehingga dapat digunakan sebagai dasar penelitian untuk pengembangan terapi maupun deteksi dini terhadap penyakit gagal ginjal.
MATERI DAN METODE Persiapan Hewan Coba
Tikus di adaptasi terhadap lingkungan selama tujuh hari dengan pemberian makanan berupa ransum basal pada semua tikus. Tikus ditaruh dalam tempat yang bahannya terbuat dari plastik memiliki diameter 80 cm dengan tinggi 40 cm. Komposisi ransum basal disusun berdasarkan standar AOAC (2005) yaitu mengandung karbohidrat, protein, lemak, mineral, vitamin. Hewan model renal fibrosis yang digunakan adalah tikus (Rattus norvegicus) dari Universitas Gadjah Mada Yogyakarta dengan umur 10 minggu dan berat badan antara 150-250 gram yang telah mendapatkan persetujuan Komisi Layak Etik UB dengan No. 132-KEP-UB.
Preparasi Dan Injeksi Streptokinase Pada Bagian ekor Tikus
Streptokinase sebanyak 1.500.000 IU ditmbahkan larutan ringer laktat sebanyak 2 mL dan dihomogenkan dengan vortex kemudian dibagi dengan 2 stock streptokinase yang mengandung 750.000 IU dalam 1 mL kemudian ditambahkan lagi ringer laktat hingga 5 mL kemudian dihomogengkan lagi dengan menggunakan vortex. Diambil 1 mL dari larutan akhir yang mengandung 150.000 IU. Untuk menyiapkan larutan streptokinase dengan dosis 6000 IU dengang kandungan 40 µl yang masing-masing larutan ditambahkan ringer laktat sampai dengan 100 µl per ekor tikus yang dihitung kedalam konversi sebagai berikut:
Streptokinase ini diinduksi pertama kali dengan dosis 6000 IU dibagian ekor vena coccygea sebanyak 100µL. Diinjeksikan pada kelompok B, C dan D. Pada hari ke-enam induksi Streptokinase dilakukan pada kelompok C dan D, dan pada hari ke-sebelas induksi streptokinase dilakukan hanya pada kelompok D. Pembedahan dilakukan pada hari ke-enambelas.
Pengamatan Histopatologi Dan Pewarnaan Imunohistokimia (IHK)
Pengamatan ini dilakukan pada bagian glomerulus pewarnaan hematoksilin eosin (HE) dan pewarnaan Imunohistokimia untuk mengetahui ekspresi TGF-β. Gambaran glomerulus dan tubulus diamati secara kualitatif menggunakan mikroskop Olympus BX51 dengan perbesaran 400x. Analisa Data
Analisis data yang digunakan dalam penelitian ini yaitu menggunakan analisa kualitatif deskriptif untuk gambaran histopatologi ginjal dan kuantitatif statistik untuk ekspresi TGF-β dengan uji ANOVA untuk mengetahui perbedaan antar perlakuan yang dilanjutkan dengan uji BNJ untuk mengetahui perlakuan yang memberikan hasil terbaik. 1mL = 150.000 IU 1µL = 150 IU Vinjeksi = 6000 IU 150 IU Vinjeksi = 40µL + RL s/d 100µL
5 HASIL DAN PEMBAHASAN
Ekspresi Transforming Growth Factor
(TGF-β)) Pada Tikus Fibrosis Ginjal
Ekspresi Transforming Growth Factor (TGF-β) pada ginjal renal fibrosis setelah dilakukan injeksi dengan
Streptokinase menunjukkan hasil yang berbeda nyata antara tikus kontrol tanpa pemberian Streptokinase dengan tikus yang mendapat perlakuan Streptokinase ditunjukkan pada Gambar 5.1.
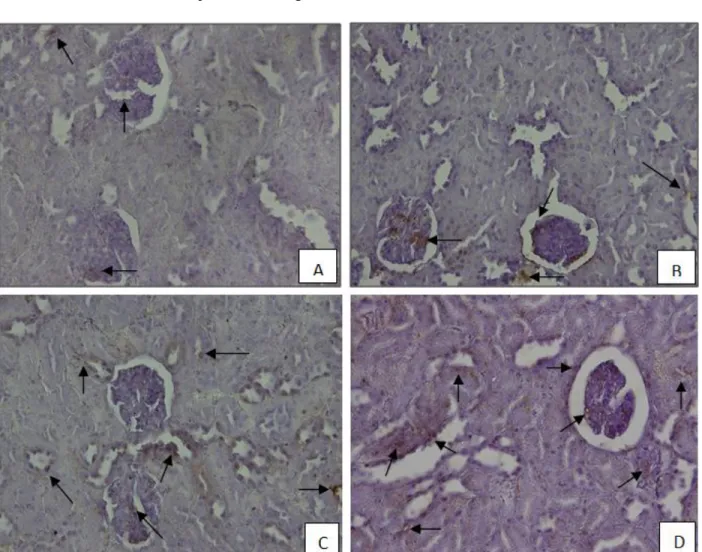
Gambar 1: Ekpresi Transforming Growth Factor (TGF-β) pada Renal Fibrosis (Perbesaran 400x).
Keterangan: A = ginjal tikus kontrol; B = ginjal tikus renal fibrosis dosis 1 x 6000 IU; C = ginjal tikus renal fibrosis dosis 2 x 6000 IU dan D = ginjal tikus renal fibrosis dosis 3 x 6000 IU. (↑) Ekspresi TGF-β
Pada Gambar 5.1 terlihat bahwa pada gambaran preparat imunohistokimia ekspresi Transforming Growth Factor (TGF-β) didapati spot-spot berwarna kecoklatan pada keempat kelompok perlakuan. Spot-spot kecoklatan yang muncul pada peraparat imunohistokimia merupakan gambaran ekspresi dari TGF-β. Ekspresi TGF-β dapat
terlihat dalam bentuk spot kecoklatan diakibatkan oleh adanya ikatan antara antigen yang berada pada jaringan dengan antibodi yang diberikan. Pada penelitian ini digunakan 2 jenis antibodi, yaitu antibodi primer yang berikatan dengan antigen pada jaringan, dan antibodi sekunder berlabel biotin. Pemberian antibodi sekunder diikuti
6 dengan penambahan enzim berupa SA-HRP (Strepta Avidin-Horseradish Peroxidase) dan substratnya berupa kromogen DAB. Kromogen DAB merupakan substrat dari peroksidase yang dapat menghasilkan warna kecoklatan, sehingga akan terbentuk warna yang lebih jelas pada jaringan tersebut (Elias et all, 1989).
Ekspresi TGF-β pada keempat kelompok perlakuan diatas terlihat bahwa bila dibandingkan dengan gambaran kelompok A (kontrol), ketiga kelompok perlakuan lainnya memiliki ekspresi TGF-β yang lebih banyak, sehingga terlihat lebih
banyak ditemukan spot-spot kecoklatan pada ketiga kelompok perlakuan lainnya. Kelompok D merupakan kelompok yang memiliki spot-spot kecoklatan yang paling banyak diantara empat kelompok perlakuan. kelompok D merupakan kelompok yang mendapatkan perlakuan induksi streptokinase dengan dosis 6000 IU/ekor tikus sebanyak 3x.
Rata-rata ekspresi TGF-β keempat kelompok perlakuan beserta dengan persentase peningkatannya tercantum dalam Tabel 5.1
Tabel 1. Peningkatan Ekspresi Transforming Growth Factor (TGF-β) Rata-rata
Kelompok Rata-rata Ekspresi
TGF-β
Peningkatan Ekspresi TGF-β terhadap kontrol (%) Perlakuan A (kontrol)
Perlakuan B (Dosis 6000IU 1x) Perlakuan C (Dosis 6000IU 2x) Perlakuan D (Dosis 6000IU 3x)
1,3388 ± 0,081 a 4,2940 ± 0,484 b 8,1400 ± 0,435 c 11,4940 ± 0,670d 0 220 508 750
Keterangan: Notasi diatas menunjukkan perlakuan A, B, C dan D berbeda nyata (P< 0,05) Hasil ANOVA menunjukkan adanya
perbedaan antar perlakuan, dilanjutkan dengan uji BNJ yang menunjukkan hasil berbeda nyata antar perlakuan secara signifikan (p>0,05). Persentase peningkatan rata-rata ekspresi TGF-β (Tabel 5.1) tertinggi didapatkan pada perlakuan Streptokinase 3 x 6000 IU (D) sebesar 750%.
Hasil rata-rata ekspresi TGF-β pada tabel 5.1 didapatkan dengan penghitungan persentase area dari 5 bidang pandang perbesaran 400 dengan menggunakan program axio vixion. Hasil yang diperoleh kemudian dikonversikan kedalam persentase dengan cara rata-rata perlakuan (B, C dan D) dikurangi dengan rata-rata kontrol (A) dibagi dengan rata-rata kontrol kemudian dikalikan dengan 100% (Calnek, 1997)
Kelompok A (kontrol) menunjukkan nilai rata-rata ekspresi TGF-β sebesar 1,3388±0,08105. Nilai ekspresi TGF-β pada kelompok kontrol digunakan sebagai standar untuk menentukan adanya peningkatan atau penurunan yang terjadi karena pengaruh perlakuan. Perhitungan uji statistik secara lengkap dapat dilihat pada Lampiran 6.
Kelompok tikus yang diberi perlakuan D memiliki nilai rata-rata ekspresi TGF-β tertinggi, yaitu 11,4940±0,670 jika dibandingkan dengan perlakuan B yang memiliki nilai rata-rata ekspresi TGF-β sebesar 4,2940±0,484 dan perlakuan C yang memiliki nilai rata-rata ekspresi TGF-β sebesar 8,1400±0,435. Hal ini menunjukkan adanya pengaruh pada masing-masing kelompok perlakuan yang ditunjukkan dengan perbedaan nilai rata-rata ekspresi TGF-β. dimana pada setiap kelompok
7 perlakuan terdapat peningkatkan ekspresi TGF- β. Ekspresi TGF-β pada kelompok perlakuan B memiliki peningkatan ekspresi TGF-β sebesar 220%, pada kelompok perlakuan C memiliki peningkatan ekspresi TGF-β sebesar 508% dan pada kelompok perlakuan D peningkatan ekspresi TGF-β sebesar 750%.
Peningkatan ekspresi TGF-β pada kelompok B, C dan D karena streptokinase dalam sistem sirkulasi secara tidak langsung akan menginduksi peningkatan ekspresi TGF-β yang merupakan sitokin pro-inflamasi dan pro-fibrosis melalui dua mekanisme, yaitu melalui mekanisme binding dengan LRP-1 pada membran sel ginjal dan yang kedua melalui mekanisme aktivasi plasminogen menjadi plasmin.
Streptokinase ketika berada dalam sistem sirkulasi, secara spesifik akan berikatan dengan Low Density Lipoprotein (LDL) Receptor-related Protein-1 (LRP-1) yang berada pada membran sel, salah satunya membran sel organ ginjal (Hu, 2008). Menurut Liu (2006) Ikatan antara streptokinase dengan LRP-1 ini akan bekerja sinergis dengan β2 integrin, sehingga akan terjadi peningkatan migrasi makrofag akibat aktivitas β2 integrin. Chatziantoniou (2005), Frank dan Michael (2006) dan Chen (2012) menyatakan bahwa TGF-β merupakan salah satu sitokin inflamasi yang dihasilkan oleh makrofag, sehingga ketika terjadi peningkatan migrasi makrofag pada sel-sel ginjal maka pada daerah tersebut juga akan mengalami peningkatan ekspresi dari sitokin-sitokinnya termasuk TGF-β.
Streptokinase dapat menyebabkan peningkatan ekspresi TGF-β selain melalui mekanisme binding dengan LRP-1 juga dapat melalui jalur aktivasi plasminogen menjadi plasmin (Hu, 2008). Selain itu Hu (2008) juga menyatakan bahwa plasmin selain berperan dalam proses fibrinolisis, juga berperan dalam post-translasi aktivasi TGF-β dari bentuk Latent Transforming
Growth Factor β (LTGF-β) menjadi bentuk aktifnya yaitu TGF-β. Sehingga peningkatan jumlah plasmin dalam darah akan diikuti dengan peningkatan TGF-β akibat adanya peningkatan aktivasi Lβ menjadi TGF-β.
Menurut Chen (2012) peningkatan ekspresi TGF-β pada daerah yang terekspresikan (ginjal) mengindikasikan terjadinya terjadinya proses inflamasi dan fibrosis pada daerah tersebut. TGF-β merupakan sitokin inflamasi dan pro-fibrosis yang mampu mengaktifkan patomekanisme biomolekuler yang mendasari progresifitas penyakit fibrosis ginjal, melalui mekanisme Epithelial to Mesenchymal Transition (EMT) (Border dan Noble, 1994; Chen, 2012). Pernyataan tersebut juga diperkuat oleh Frank dan Michael (2006) yang menyatakan bahwa TGF-β merupakan penginduksi utama Epithelial to Mesenchymal Transition (EMT) dalam perkembangan fibrosis.
TGF-β dalam proses fibrosis mulanya akan mengaktifkan proses Epithelial to Mesenchymal Transition (EMT), dimana pada proses ini akan terjadi perubahan sel-sel epitel ginjal menjadi sel-sel-sel-sel fibroblas. Perubahan sel-sel epitel menjadi sel-sel fibroblas akan menyebabkan terjadi jaringan parut ginjal dengan meningkatnya produksi kolagen, fibronectin, proteoglican dan penghambatan degradasi kolagen sehingga fibrosis ginjal terjadi (Border dan Noble, 1994; Frank dan Michael, 2006). Berdasarkan penelitian Wati et al. (2013), digambarkan bahwa dalam proses perubahan sel epitel normal menjadi sel fibroblas pada kejadian fibrosis ginjal, sel-sel epitel ginjal dapat mengalami kerusakan membran ataupun inti sel menghilang.
8 Histopatologi Ginjal Renal Fibrosis Dengan Pewarnaan Hematoxylin Eosin (HE)
Hasil histopatologi ginjal menunjukkan perbedaan antar perlakuan dimana kelompok A kontrol tanpa induksi sehat dan induksi Streptokinase dengan dosis 6000 IU pada tikus secara intravena kelompok B
(1 x 6000 IU), kelompok C (2 x 6000 IU) dan kelompok D (3 x 6000 IU) dengan interval waktu lima hari. Berdasarkan perlakuan tersebut didapatkan hasil histopatologi pada jaringan ginjal tikus seperti pada Gambar 5.2.
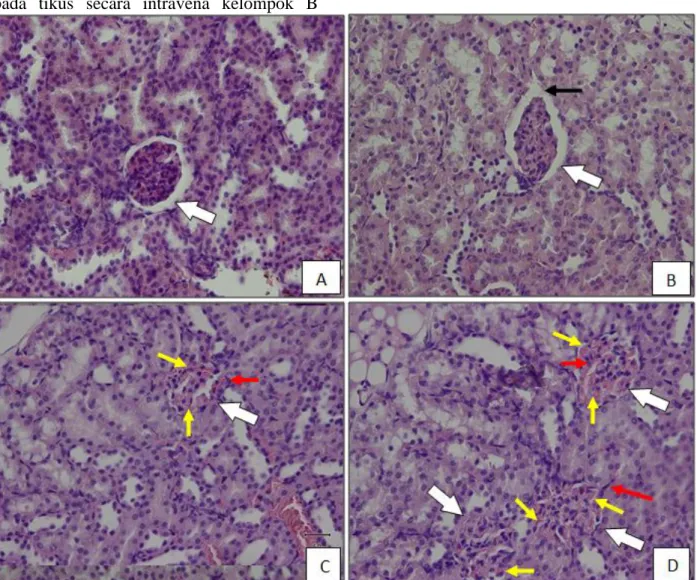
Gambar 2. Histopatologi ginjal tikus induksi streptokinase dengan pewarnaan HE(Perbesaran 400x).
Keterangan: A = ginjal tikus kontrol; B = ginjal tikus induksi streptokinase dosis 6000 IU 1x; C = ginjal tikus induksi streptokinase dosis 6000 IU 2x; D = ginjal tikus induksi streptokinase dosis 6000 IU 3x. ( ) Menunjukkan glomerulus. ( ) menunjukkan sel darah merah. ( ) menunjukkan kerusakan capsula bowman. ( ) menunjukkan kerusakan sel epitel.
Gambaran histopatologi ginjal tikus di atas menunjukkan adanya perbedaan gambaran histopatologi glomerulus ginjal
yang ditunjukkan pada setiap kelompok perlakuan. Panah berwarna putih ( ) menunjukkan letak dari glomerulus pada
9 keempat gambaran histopatologi kelompok perlakuan. Panah kuning ( ) menunjukkan adanya sel darah merah. Pada gambaran histopatologi glomerulus kelompok C dan D terlihat keberadaan sel darah merah pada glomerulus, hal ini terjadi karena adanya proses inflamasi pada daerah tersebut. Bila terjadi inflamasi, sel endotel mengkerut sehingga permeabilitas kapiler akan meningkat dan molekul-molekul besar seperti sel darah merah dapat melewati dinding vaskuler. Panah berwarna hitam ( ) menunjukkan bahwa telah terjadi kerusakan capsula bowman, dimana hal ini terjadi pada kelompok B sedang pada kelompok C dan D capsula bowman sudah sulit untuk diidentifikasi dikarenakan telah terjadi sklerosis (penebalan) lumen dari glomerulus. Panah berwarna merah ( ) menunjukkan terjadinya kerusakan epitel pada glomerulus. Kerusakan epitel glomerulus yang mulai nampak terlihat adalah pada gambaran histopatologi kelompok perlakuan C dan D dimana didapati sel-sel glomerulus ada yang telah berubah bentuk maupun kehilangan inti.
Secara keseluruhan pada histopatologi glomerulus ginjal kelompok A (kontrol) didapatkan gambaran jaringan ginjal yang normal dengan glomerulus ginjal yang masih normal, dimana struktur glomerulus ginjal yang meliputi membran basal glomerulus/capsula bowman dan lapisan sel epitel masih terlihat kompak dan bagus serta untuk sel epitelnya masih berinti. Pada gambaran histopatologi kelompok perlakuan B, telah terjadi kerusakan pada bagian capsula bowman dari glomerulus ginjal dan sel epitelnya mulai banyak yang rusak. Demikian juga pada gambaran histopatologi ginjal kelompok perlakuan C, glomerulus ginjal sulit diidentifikasi pada bagian capsula bowman, juga pada bagian lumen glomerulus mengalami sklerosis (penebalan) telah mengalami kerusakan terutama pada bagian capsula bowman yang
semakin sulit untuk diidentifikasi, sel epitel glomerulus semakin banyak yang rusak, juga pada bagian lumen glomerulus telah mengalami sklerosis (penebalan), serta terjadinya kerusakan membran filtrasi glomerulus, yang ditandai dengan adanya sel darah merah pada glomerulus. Kerusakan membran filtrasi glomerulus mengakibatkan peningkatan permeabilitas pada membrane tersebut, sehingga memungkinkan molekul-molekul yang berukuran besar seperti sel darah merah dapat ikut masuk. Pada gambaran histopatologi kelompok perlakuan D kerusakan terlihat semakin parah, dimana capsula bowman sulit untuk diidentifikasi, sel epitel yang mengalami kerusakan seperti kehilangan inti dan mengalami perubahan bentuk semakin banyak, dan kerusakan membran filtrasi glomerulus semakin parah D.
Secara histopatologi, fibrosis ginjal menyebabkan perubahan glomerulus, yang ditandai oleh proliferasi reaktif sel mesangial, infiltrasi makrofag dan deposisi matriks ekstraselular yang berisi fibronektin diantara lamina densa dan lamina rara mesangial dan membrane basalins glomerulus, sehingga menimbulkan hialinosis serta sklerosis fokal dan segmental pada glomerulus (Cho, 2010). Kejadian ini akan menyebabkan lumen dari glomerulus semakin menebal oleh karena proliferasi sel mesangial dan matriksnya sehingga terjadi mesangiosklerosis, dan apabila berlanjut keadaan ini akan menyebabkan terjadinya glomerulosklerosis.
Fibrosis ginjal selain ditunjukkan dengan adanya glomerulosklerosis juga akan disertai dengan kerusakan sel-sel epitel ginjal dan akumulasi dari maktriks ekstraseluler, serta ditemukannya fiboblas pada jaringan ginjal (Wati et al., 2013). Pemberian injeksi streptokinase terbukti dapat menginduksi kejadian fibrosis ginjal dengan ditemukannya kerusakan pada capsula bowman, sklerosis pada lumen
10 glomerulus, adanya infiltrasi sel darah merah dan kerusakan sel-sel epitel glomerulus. Hal ini didukung oleh pendapat Schrarnm et al. (2003) bahwa Pemberian streptokinase bersifat nephrotoxic dapat menyebakan kerusakan ginjal dan dapat menyebabkan fibrosis ginjal. Didukung juga oleh pernyataan Strutz and Muller (2000); Liu (2006); Eddy (2000) bahwa fibrosis ginjal ditandai dengan terjadinya Epithelial to Mesenchymal Transition (EMT) sehingga pada gambaran histopatologi jaringan ginjal akan banyak ditemukan sel-sel fibroblas yang berbentuk runcing dan pipih menggantikan sel epitel.
Kesimpulan
Ada peningkatan level ekspresi Transforming Growth Factor TGF-β pada tikus (Rattus norvegicus) setelah diinduksi streptokinase dengan dosis 6000 IU/ekor. Induksi streptokinase dengan dosis 6000 IU/ekor tikus (Rattus norvegicus), dapat menyebabkan terjadinya kerusakan ginjal secara histopatologi, meliputi kerusakan capsula bowman, sklerosis pada lumen glomerulus, kerusakan membran filtrasi dan sel-sel epitel glomerulus.
Saran
Perlu dilakukan penelitian lebih lanjut tentang induksi streptokinase yang berkaitan dengan peran LRP-1 dan migrasi makrofag dalam meningkatkan TGF-β.
DAFTAR PUSTAKA
Armitage, D. 2004. Rattus Norvegicus. Animal Diversity Web. University of Michigan of Zoology.
Bascands, J.L and Schanstra, J. P. 2005. Obstructive Nephropathy Insights
From Genetically Engineered Animals. Kidney Int. 68:925-937.
Bijanti, R., M.G.A. Yuliani, R.S. Wahjuni dan R.B. Utomo. 2010. Patologi Klinik Veteriner. 1st edition. Airlangga University Press. Surabaya : 59-62 Boor, P. and J. Floege. 2011. Chronic kidney
disease growth factors in renal fibrosis. Germany: Clin Exp Pharmacol Physiol. Hlm 441-50
Border and Noble. 1994. Transforming growth factor beta in tissue fibrosis. N
Engl J Med. 1994 Nov
10;331(19):1286-92.
Border, W.A., A.B Fogo, H.E. Abboud, N.A. Noble, H.W. Schnaper, V.E. Kelly .1999. Renal Disease Progression. Research Progress Reviews.
Campbell, N.A., J.B. Reece and L.G. Mitchell. 2006. Biologi-Edisi Kelima-Jilid III. Addison Wesley Longman, Inc.
Chatziantoniou, 2005. Insights into the mechanisms of renal fibrosis: is it possible to achieve regression?. Am J Physiol Renal Physiol. 2005 Aug; 289(2): F227-34.
Chen, Jianchun. 2012. EGFR Signaling Promotes TGFb-Dependent Renal Fibrosis. J Am Soc Nephrol 23:215–
224, 2012. doi:
10.1681/ASN.2011070645
Cho, Min Hyun. 2010. Renal Fibrosis. di dalam Korean J Pediatr 2010. Daegu: Kyungpok National University School of Medicine. Hlm 735-740
Dellmann H.D., J.A. Eurell. 2006. Textbook of Veterinary Histology. Ed ke-6. USA: Blackwell Publishing.
Dewi, S. 2011. Fraksi Air Bunga Kecubung (Datura metel L.) Memicu Aktivitas
11 Imunokompeten Subset Sel T Pada Mencit Balb/C Model Asma [Skripsi]. Fakultas Matematika dan Ilmu Pengetahuan Alam. Universitas Brawijaya Malang.
Eddy, A.A. 2000. Molecular Basis of Renal Fibrosis. Pediatric Nephrology. 15(3-4): 290-30.
Elias J.M., M. Margiotta, D. Gaborc. 1989. Sensitivity and detection efficiency of the peroxidase antiperoxidase (PAP), avidin-biotin peroxidase complex (ABC), and peroxidase-labeled avidin-biotin (LAB) methods. Department of Pathology, Health Sciences Center, Stony Brook, New York. American Journal of Clinical Pathology [1989, 92(1):62-67]
Fogo, Agnes B. 2007. Mechanisms of Progression of Chronic Kidney Disease. di dalam Pediatr Nephrl. Nasville :Vanderbilt Univesity Medical Center. Hlm 2011-2022.
Francey, Thierry dan A. Schweighauser. 2008. Clinical Epidemiology Of Kidney Diseases In The Cat. 2. Veterinary Focus Vol 18 No 2 2008 Guyton, A.C. 1994. Buku Ajar Fisiologi
Kedokteran. Ed ke-7. Jakarta: Kedokteran EGC.
Hu, Kebin, M.M. Wendy dan L. Youhua. 2008. Novel actions of tissue-type plasminogen activator in chronic kidney disease. Frontiers in Bioscience 13: 5174-5186.
Junqueira, L.C.. 2007. Persiapan jaringan untuk pemeriksaan mikroskopik. Histology Dasar: teks dan atlas. Edisi 10. Jakarta : EGC. 3 – 5.
Kirk, C.A. and M.A. Hickman. 2000. Dietary protein requirement of cats with spontaneous renal disease. J Vet Intern Med 2000; 13:351.
Kusriningrum. 2008. Dasar Perancangan Percobaan dan Rancangan Acak Lengkap. Fakultas Kedokteran Hewan. Universitas Airlangga. Surabaya. Kusumawati, D. 2004. Bersahabat Dengan
Hewan Coba. Universitas Gadjah Mada. Yogyakarta.
Liu, Y. 2004. Epithelial to mesenchymal transition in renal fibrogenesis: Pathologic significance, molecular mechanism, and therapeutic intervention. J Am Soc Nephrol 15: 1– 12, 2004
Liu, Y. 2006. Renal fibrosis: New insights into the pathogenesis and therapeutics. Kidney Int 69: 213–217, 2006
Marbun, J. 2012. Gambaran Karakteristik Penderita Gagal Ginjal Kronik Yang Di Hemodialisa Di Rumah Sakit Umum Herna Medan. Medan : Universitas Darma Agung.
Mauviel, A. 2005. Transforming Growth Factor β key mediator of Fibrosis. Fibrosis research. Humana Press inc. Cicago
Miller, SD; Russel, JC; MacInes, HE; Abdelkrim J; Fewster,RM. 2010. Multiple peternity in wild population of invasive Rattus species. New Zeland Journal of Ecology 34(3): 360-362. Pardede, S.O. 2009. Struktur Sel
Streptokokus dan Patogenesis Glomeluronefritis Akut Pascarastreptokokus. Jakarta: Departemen Ilmu Kesehatan Anak FKUI-RSCM.
Ponticelli, C. 2000. Cyclosporine: Nephrologic indications. Dalam Yocum De (Ed). Cyclosporine. Clinical application in autoimmune diseases.Philadelphia. Mosby-Wolfe:111-20.
Potter, W.P. 2007. Rats and Mice :Introduction and use In Research.
12 Health Sciences Center for Educational Resources University of Washington. Robbins, S.L and V. Kumar. 1995. Buku
Ajar Patologi II 4th. Jakarta. ECG. Slattery, C., E. Campbell, T. McMorrow and
P. Michael. 2005. Cyclosporine A-Induced Renal Fibrosis A Role for Epithelial- Mesenchymal Transition. Dublin: University College Dubli. Strutz, F. and G.A. Muller. 2000.
Transdifferentation Comes of Age. Nephrol Dial Transplant. 15. 1729-1731.
Suhardjono. 2007. The Development of A Continuous Ambulatory Peritoneal Dialysis Program in Indonesia. di dalam Peritoneal Dialysis International, Vol 28. Canada: International Society for Peritoneal Dyalisis. Hlm. 59-62.
Tjay, Tan Hoan dan Kirana Rahardja. 2007. Obat-obat Penting: Kasiat, Penggunaan dan Efek-efek Sampingnya Ed:VI. Jakarta : PT. Elex Media Komputindo.
Trihono, P.P. 2011. Peran Transforming Growth Factor Beta-1 Pada Penyakit Ginjal. Sari Pediatri, Vol. 13, No. 1, Juni 2011. Sari Pediatri 2011;13(1):49-54.
Wati I.P, Aulanni’am dan C. Mahdi. 2013. Aktivitas Protease Dan Gambaran Histologi Ginjal Tikus Putih (Rattus Norvegicus) Pasca Induksi Cyclosporine-A. Kimia. Student journal, Vol. 1, No. 2, Pp. 257-263 Universitas Brawijaya Malang
Zhang, Qiu-Li and D. Rothenbacher. 2008. Prevalence of chronic kidney disease in population-based studies: Systematic review. London: BMC Public Health 8:117