Kelompok I14 Bab III Kalorimeter
BAB III
Kalorimeter
3.1 Maksud dan Tujuan
1. Dapat menentukan energi listrik yang dilepaskan dalam kalorimeter. 2. Dapat menentukan energi kalor yang diterima kalorimeter.
3. Dapat menentukan kalor jenis suatu zat.
4. Dapat menentukan nilai kesetaraan kalor listrik. 5. Dapat menentukan kapasitas kalor dari calorimeter
3.2 Dasar Teori
Hukum kekalan energi menyatakan bahwa energi tidak dapat dimusnahkan dan diciptakan melainkan hanya dapat diubah dari suatu bentuk energi kebentuk energi yang lain. Misalnya pada peristiwa gesekan energi mekanik berubah menjadi panas. Pada mesin uap panas diubah menjadi energi mekanik. Demikian pula energi listrik dapat diubah menjadi panas atau sebaliknya. Sehingga dikenal adanya kesetaraan antara panas dengan energi mekanik/listrik, secara kuantitatif hal ini dinyatakan dengan angka kesetaraan panas-energi listrik/mekanik. Kesetaraan panas-energi mekanik pertama kali diukur oleh Joule dengan mengambil energi mekanik benda jatuh untuk mengaduk air dalam kalorimeter sehingga air menjadi panas. Energi listrik dapat diubah menjadi panas dengan cara mengalirkan arus listrik pada suatu kawat tahanan yang tercelup dalam air yang berada dalam kalorimeter.
Energi listrik yang hilang dalam kawat tahanan besarnya adalah:
t i v
W ..
Keterangan:
W = energi listrik (joule) v = tegangan listrik (volt) i = arus listrik (ampere) t = lama aliran listrik (sekon)
Kelompok I14 Bab III Kalorimeter
Kalor adalah suatu bentuk energi yang berpindah dari benda yang bersuhu tinggi ke benda yang bersuhu lebih rendah ketika benda itu saling berhubungan. Benda yang menerima kalor, suhunya akan naik sedangkan benda yang melepas kalor, suhunya akan turun.
Besarnya kalor yang diserap atau dilepas oleh suatu benda berbanding lurus dengan:
1. Massa benda 2. Kalor jenis benda 3. Perubahan suhu
Jadi besarnya kalor dapat dirumuskan:
t c m
Q . .
Dalam satuan SI, kalor adalah joule. Satuan kalor yang lain adalah kalori. Kesetaraan joule dan kalori adalah sebagai berikut:
1 joule = 0,24 kalori 1 kalori = 4,184 joule
Satu kalori adalah banyaknya kalor yang diperlukan untuk menaikan suhu 1oC air murni yang massanya 1 gram.
Kalor jenis (c) adalah banyaknya kalor yang diperlukan untuk menaikan 1 kg zat sebesar 1K atau 1oC. T m Q c . Keterangan:
Q = jumlah kalor (kalori) m = massa zat (gram)
c = kalor jenis zat (kal/gr oC)
∆t = perubahan suhu suhu (oC)
Hukum kekalan energi kalor (azas black) menyatakan bahwa “Pada pencampuran dua zat, banyaknya kalor yang dilepas zat bersuhu tinggi sama dengan banyaknya kalor yang diterima zat bersuhu rendah.”
Kelompok I14 Bab III Kalorimeter
Atau dapat dirumuskan:
terima
lepas Q
Q
Maka energi listrik yang dilepaskan akan diterima oleh air dalam kalorimeter dan kalorimeter itu sendiri, sehingga akan terjadi perubahan panas pada air dan kalorimeter.
Adapun besarnya nilai kesetaraan kalor listrik dapat dinyatakan dengan persamaan:
Keterangan:
γ = kesetaraan kalor
ma = massa air dalam calorimeter (gram)
ca = kalor jenis air (kal/gr oC)
mk = massa calorimeter (gram)
ck = kalor jenis calorimeter (kal/gr oC)
ta = suhu akhir (oC)
t = suhu awal (oC)
Kapasitas Kalor (C) adalah yaknya kalor yang dibutuhkan untuk menaikan suhu suatu benda sebesar 1K atau 1 oC. Dirumuskan dengan:
c m C . Atau T Q C
Q = jumlah kalor (kalori) m = massa zat (gram)
c = kalor jenis zat (kal/gr oC)
∆t = perubahan suhu suhu (oC) C = kapasitas kalor (kal/oC)
) )( (m c m c t t t i v a a a k k
Kelompok I14 Bab III Kalorimeter
3.3 Alat dan Bahan
a. Kalorimeter b. Voltmeter c. Ampermeter d. Neraca e. Catu daya f. Thermometer g. Kabel Penghubung h. Stopwatch
3.4 Gambar Alat dan Bahan
Thermometer Stopwatch Neraca
Catu Daya Kabel
Kelompok I14 Bab III Kalorimeter
Kalorimeter Voltmeter Ampermeter Gambar 3.1 Alat dan Bahan Percobaan
3.5 Prosedur Percobaan
Set percobaan
1. Memasang rangkaian listrik seperti gambar di atas.
2. Menghubungkan dengan sumber tegangan, mengatur arusnya kira-kira 2 Ampere, kemudian mematikan lagi saklarnya.
3. Menimbang calorimeter kosong (bejana dalam) dan pengaduk. 4. Mencatat massa calorimeter kosong.
5. Mangisi calorimeter dengan air secukupnya ( kumparan tercelup ) dan menimbang kembali sehingga massa airnya diketahui.
6. Mencatat massa air dalam calorimeter.
7. Memasang calorimeter yang sudah berisi air.Mengukur suhu air dan calorimeter danmencatat hasil pengukuran.
A V Pengaduk Termometer Kalorimeter Catu daya
Kelompok I14 Bab III Kalorimeter
8. Menyalakan catu daya dan menghidupkan stopwatch.Mencatat penunjuk tegangan dan arus setiap 2 menit danmengaduk terus air dalam calorimeter dengan pengaduk.
9. Mencatat suhu air setiap 2 menit selama 6 menit.
10. Mengulangi percobaan di atas sekali lagi dengam massa air berbeda.
3.6 Alur Percobaan
Menimbang kembali kalorimeter yang terisi air dengan menggunakan neraca
Menimbang kalorimeter kosong dengan menggunakan neraca
Mengukur suhu awal air dengan thermometer Menyimpulkan massa air
Menyiapkan alat dan bahan
Mencatat v,i,T yang dihasilkan setiap 120 s,240s, 360 s
Air mulai dipanaskan dan aduk terus Mengisi kalorimeter dengan air
MULAI
Kelompok I14 Bab III Kalorimeter
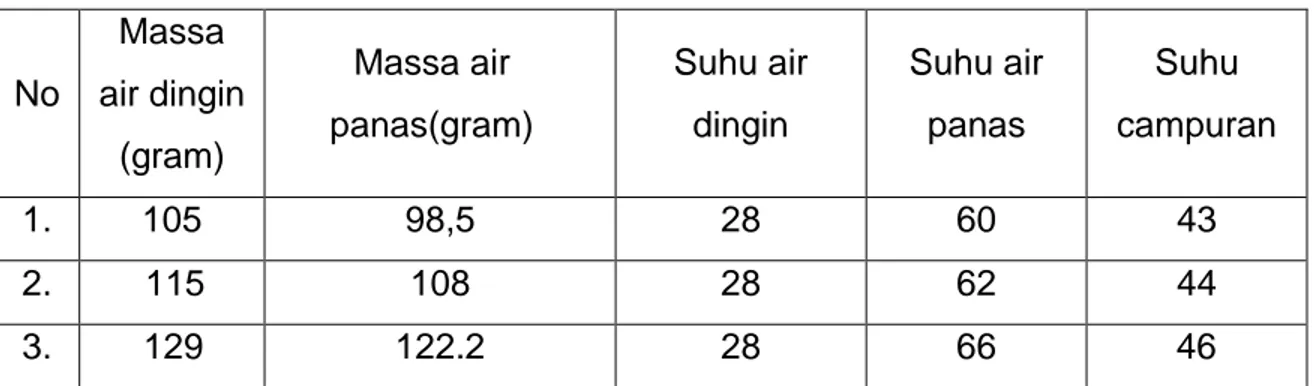
3.7 Data Percobaan
Tabel 3.1 Percobaan 1
Tabel 3.2 Percobaan 2
No v (volt) i(ampere) t(sekon) mk(gram) ma(gram) T (oC) T akhir (oC)
1. 14 0,52 120 145 67,6 28 30
2. 14 0,52 240 145 67,6 28 32
3. 14 0,52 360 145 67,6 28 34
No v (volt) i(ampere) t(sekon) mk(gram) ma(gram) T (oC) T akhir (oC)
1. 14 0,55 120 145 123 28 29,8
2. 14 0,55 240 145 123 28 31,3
3. 14 0,55 360 145 123 28 33
Menganalisis energi, kalor,kalor jenis,dan kapasitas kalor
Mengulang langkah 2-7 dengan massa air yang berbeda
Selesai
Kelompok I14 Bab III Kalorimeter
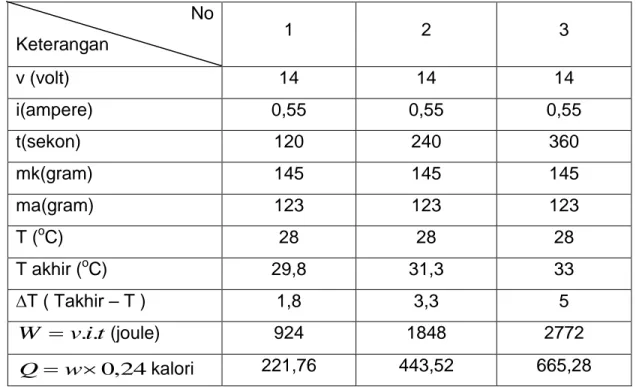
Tabel 3.3 Percobaan Tambahan
No Massa air dingin (gram) Massa air panas(gram) Suhu air dingin Suhu air panas Suhu campuran 1. 105 98,5 28 60 43 2. 115 108 28 62 44 3. 129 122.2 28 66 46
3.8 Analisis Data
Tabel 3.4 perhitungan energi,kalor jenis,dan kapasitas kalor percobaan 1 No Keterangan 1 2 3 v (volt) 14 14 14 i(ampere) 0,52 0,52 0,52 t(sekon) 120 240 360 mk(gram) 145 145 145 ma(gram) 67,6 67,6 67,6 T (oC) 28 28 28 T akhir (oC) 30 32 34 ∆T ( Takhir – T ) 2 4 6 t i v W .. (joule) 873,6 1747,2 2620,8 24 , 0 w Q kalori 209,664 419,328 628,992 T m Q c . (kal/gr o C) 1,55 1,55 1,55 T Q C (kal/oC) 104,832 104,832 104,832
Kelompok I14 Bab III Kalorimeter
Tabel 3.5 perhitungan energi,kalor jenis,dan kapasitas kalor percobaan 2 No Keterangan 1 2 3 v (volt) 14 14 14 i(ampere) 0,55 0,55 0,55 t(sekon) 120 240 360 mk(gram) 145 145 145 ma(gram) 123 123 123 T (oC) 28 28 28 T akhir (oC) 29,8 31,3 33 ∆T ( Takhir – T ) 1,8 3,3 5 t i v W .. (joule) 924 1848 2772 24 , 0 w Q kalori 221,76 443,52 665,28
Tabel 3.6 menentukan kalor jenis kalorimeter
No Massa air dingin (gram) Massa air panas (gram) Suhu air dingin Suhu air panas Suhu campuran ∆T1 ∆T2 1 105 98,5 28 60 43 17 15 2 115 108 28 62 44 18 16 3 129 122.2 28 66 46 20 18 Keterangan : ∆T1 = Tap -Tcamp ∆T2 =Tcamp -Tair Cair = 4,18 x 103joule/kgK = 4,18 x 103 joule/kgKx 0,24 kalori
Kelompok I14 Bab III Kalorimeter
= 1,0032 x 103kal/kg oC = 1,0032 kalori/gr oC
Percobaan 1 pada tabel 3.3
Qlepas = Qterima Qap = Qad + Qkalori map x cair x ∆T1 = mad x cair x ∆T2 + mk x ck x ∆T2 98,5 x 1,0032 x 17 = 105 x 1,0032 x 15 + 145 x ck x 15 1679,8584 = 1580,04 +2175 ck 99,8184 = 2175 ck ck = 0,0459 kalori/gr oC Percobaan 2 pada tabel 3.3
Qlepas = Qterima Qap = Qad + Qkalori map x cair x ∆T1 = mad x cair x ∆T2 + mk x ck x ∆T2 108 x 1,0032 x 18 = 115 x 1,0032 x 16 + 145 x ck x 16 1950,2208 = 1845,888 +2320 ck ck = 0,045 kalori/gr oC Percobaan 3 pada tabel 3.3
Qlepas = Qterima Qap = Qad + Qkalori map x cair x ∆T1 = mad x cair x ∆T2 + mk x ck x ∆T2 122,2x1,0032x20 = 129 x 1,0032 x 18 + 145 x ck x 1 2451,8208 = 2329,4304 +2610 ck ck = 0,046 kalori/gr oC Kalori rata – rata :
n
c
c
k k Kelompok I14 Bab III Kalorimeter = 3 046 , 0 045 , 0 0459 , 0 = 0,0456 kalori/gr oC = 190,8 joule/kgK
Kapasitas Kalor dari Kalorimeter:
C = m.c
= 145 x 0,0456 = 6,612 kalori/ oC
Kesetaraan kalor listrik :
Percobaan 1 a. = 5,869 b. = 5,869 c. = 5,869 ) )( (m c m c T t i v a a k k ) )( (m c m c T t i v a a k k ) 2 )( 0032 , 1 . 6 , 67 0456 , 0 . 145 ( 6 , 873 ) )( (m c m c T t i v a a k k ) 4 )( 0032 , 1 . 6 , 67 0456 , 0 . 145 ( 2 , 1747 ) )( (m c m c T t i v a a k k ) 6 )( 0032 , 1 . 6 , 67 0456 , 0 . 145 ( 8 , 2620
Kelompok I14 Bab III Kalorimeter Percobaan 2 a. = 4 b. = 4,3 c. = 4,26
Kesetaraan rata – rata :
= = 5 Ketidakpastian: ∆γ = ) 1 ( ) ( 2 n n i = ) 1 6 ( 6 74 , 0 7 , 0 1 86 , 0 86 , 0 86 , 0 2 2 2 2 2 2 ) )( (m c m c T t i v a a k k ) 8 , 1 )( 0032 , 1 . 123 0456 , 0 . 145 ( 924 ) )( (m c m c T t i v a a k k ) 3 , 3 )( 0032 , 1 . 123 0456 , 0 . 145 ( 1848 ) )( (m c m c T t i v a a k k ) 5 )( 0032 , 1 . 123 0456 , 0 . 145 ( 2772 n
6 26 , 4 3 , 4 4 869 , 5 869 , 5 869 , 5 6 167 , 30 Kelompok I14 Bab III Kalorimeter = 30 303083 , 4 = 0,38
Kesalahan rata – rata
KR = 100% 38 , 5 38 , 0 = 7 % Ketelitian : Ket = 100% - 7% = 93 % 3.9 Pembahasan
Dalam percobaan yang kami lakukan di atas menggunakan alat kalorimeter. Yaitu alat yang digunakan untuk mengukur kalor jenis suatu zat. Pada kalori meter terdapat thermometer yang digunakan untuk mengukur suhu campuran.
Untuk menentukan kapasitas kalor mula-mula mengukur suhu air dingin kemudian menimbangnya. Setelah itu memanaskan air hingga panas. Setelah panas dan telah diukur suhunya dicampur dengan air dingin yang berada dalam kalori meter. Kemudian kita ukur suhu campuran air tersebut. Dalam memasukkan air yang panas tadi harus cepat supaya suhu air panas tidak turun dan jangan sampai tumpah karena dapat mengurangi massa dari air panas tadi.
Untuk mengetahui kalor jenis kalori meter menggunakan rumus :
Qlepas = Qterima
Qap = Qad + Qkalori
map x cair x ∆T1 = mad x cair x ∆T2 + mk x ck x ∆T2
Dengan rumus diatas kita mendapatkan hasil kalor jenis kalorimeter yaitu: 0,0456 kalori/gr oC atau 190,8 joule/kgK. Dengan menemukan hasil kalor jenis calorimeter
Kelompok I14 Bab III Kalorimeter
ini kita dapat menentukan kapasitas kalor dari kalorimeter yaitu sebesar 6,612 kalori/oC.
Selain dapat menentukan kalor jenis dan kapasitas dari calorimeter, kita juga dapat menghitung kalor jenis air serta kapasitas kalor dari air. Kalor jenis air yang didapatkan adalah 1 kalori/gr oC yang setara dengan 4,180 x 103 joule/kgK.
Hasil yang kami peroleh mungkin belum sempurna. Karena ketelitian yang kita dapatkan sebesar 93%. Hal ini dapat disebabkan karena:
a. Kurang teliti dalam menimbang air dan kalorimeter. b. Kurang teliti dalam mengukur suhu air.
c. Kemungkinan ada energi yang diserap oleh benda lain atau suhu logam waktu dipanaskan banyak yang hilang ke lingkungan.
d. Kesalahan dalam perhitungan
e. Dalam pengukuran suhu akhir campuran air belum tercampur seluruhnya.
3.10 Kesimpulan
1. Kalorimeter adalah alat untuk mengukur kalor jenis suatu zat. 2. Energi tidak dapat dimusnahkan dan tidak dapat diciptakan.
3. Kalor berpindah dari suhu tinggi ke suhu yang lebih rendah hingga suhu menjadi termal.
4. Kalor sebanding dengan massa benda, kalor jenis benda dan perubahan suhu. 5. Kalor jenis adalah banyaknya kalor yang diperlukan untuk menaikan 1 kg zat
sebesar 1K atau 1oC.
6. Perbandingan antara banyaknya kalor yang diberikan terhadap kenaikan suhu benda dinamakan kapasitas kalor.
7. Dalam suatu sistem, jumlah kalor yang diberikan oleh suatu zat yang mempunyai suhu lebih tinggi sama dengan jumlah kalor yang diterima zat lain yang bersuhu lebih rendah.
Kelompok I14 Bab III Kalorimeter 3.11 Penerapan dalam Bidang Teknik Sipil
1. Untuk mengetahui pengaruh suhu tehadap bentuk dan kekuatan dari bahan yang digunakan dalam kontruksi sebuah bangunan.
2. Dapat digunakan untuk merubah posisi dan bentuk benda, misalnya membuat lengkungan, meluruskan dan sebagainya.
3. Dapat diketahui jenis bahan yang akan digunakan dalam sebuah kontruksi bangunan.