BAB 2
TINJAUAN PUSTAKA
2.1 Sumber Air
Air yang keluar dari perut bumi pada umumnya merupakan air asin panas yang disebut “Brine”. Air yang terproduksi ini banyak mengandung mineral - mineral yang dapat menyebabkan kerak dan korosi. Terbentuknya kerak disebabkan adanya senyawa – senyawa dalam air dengan jumlah yang melebihi kelarutannya pada keadaan kesetimbangan. Salah satu senyawa tersebut antara lain adalah kalsium karbonat, yang memberikan konstribursi terbesar dalam proses terjadinya kerak dan korosi. (Effendi,H.2003)
Adapun didaratan, proses presipitasi lebih banyak terjadi dibandingkan dengan evaporasi, transpirasi dan sublimasi. Akibatnya, secara total terjadi aliran air dari atmosfer menuju daratan dalam bentuk hujan dan salju. Di daratan, sebagian air membeku menjadi es (puncak gunung yang tinggi), sebagian air masuk tanah (infiltrasi), dan sebagian lainnya mengalir di permukaan membenrtuk sungai menuju laut kembali.
Air yang digunakan untuk keperluan sehari – hari bersifat tawar sehingga dikenal dengan istilah air tawar. Akan tetapi, hanya 3% air yang ada di bumi ini berupa air tawar dan dua pertiganya membeku di kutub dan puncak gunung yang tinggi. Sisanya merupakan air tanah dan 0,3% adalah air permukaan (sungai, danau, dan rawa).Tidak semua air tawar dapat langsung digunakan untuk kegiatan sehari – hari. Pemerintah telah menerapkan standar kualitas air yang berbeda – beda bergantung pada tujuan penggunaannya. (Rahayu,I.2007)
Air yang diperlukan dalam dunia industri dapat diambil dari setiap titik dalam siklus hidrologis, tergantung teknologi yang dimiliki dan biaya yang tersedia untuk pengambilan dan untuk memperbaiki kualitasnya sehingga sesuai untuk penggunaannya.
Sumber – sumber air :
1. Air Hujan
2. Air Permukaan
3. Air Tanah
Ditinjau dari sudut kualitasnya, secara singkat diuraikan sebagai berikut :
2.1.1 Air Hujan
Dalam lintasan jatuhnya air hujan mengabsorpsi gas-gas dan uap-uap yang terdapat di udara, terutama oksigen, nitrogen dan karbon dioksida, yang merupakan komponen-komponen utama dari udara.
Air hujan mempunyai sifat agresif terutama terhadap pipa-pipa penyalur maupun bak-bak penampungan air, sehingga hal ini akan mempercepat terjadinya korosi, dan air hujan juga bersifat lunak, sehingga boros terhadap pemakaian sabun. Maka untuk menjadikan air hujan sebagai air minum hendaknya pada waktu mulai turun dibiarkan dan diendapkan terlebih dahulu, karena masih banyak mengandung kotoran.
Air hujan yang jatuh ke bumi dan menjadi air permukaan memiliki kadar bahan-bahan terlarut atau unsur hara yang sangat sedikit. Air hujan biasanya bersifat asam, dengan nilai pH sekitar 4,2. Hal ini disebabkan air hujan melarutkan gas-gas yang terdapat di atmosfer, misalnya gas karbon dioksida (CO2), sulfur (S), dan nitrogen oksida (NO2) yang
dapat membentuk asam lemah. Setelah jatuh ke permukaan bumi, air hujan mengalami kontak dengan tanah dan melarutkan bahan-bahan yang terkandung di dalam tanah.
2.1.2 Air Permukaan
Air permukaan adalah air yang berada di sungai, danau, waduk, rawa, dan badan air lain, yang tidak mengalami infiltrasi ke bawah tanah. Areal tanah yang mengalirkan air ke suatu badan air disebut watersheds atau drainage basins.
Air permukaan yang mencakup : air sungai, air danau, air kolam dapat merupakan kumpulan air hujan yang jatuh dan mengalir diatas permukaan tanah atau campuran antara lain aliran permukaan dan air tanah ataupun air yang mengalir ke luar pada musim kemarau.
Air yang mengalir dari daratan menuju suatu badan air disebut limpasan permukaan
(surface run off), dan air yang mengalir di sungai menuju laut disebut aliran air sungai (river
run off). Sekitar 69% air yang masuk ke sungai berasal dari hujan, pencairan es/salju
(terutama untuk wilayah ugahari), dan sisanya berasal dari air tanah.
Secara alamiah, sungai, danau, kolam dapat tercemar pada daerah permukaan air saja. Pada sungai yang besar dan arus air yang deras,sejumlah kecil bahaya pencemar akan mengalami pengenceran sehingga tingkat pencemaran menjadi sangat rendah. Di Indonesia air permukaan ini banyak digunakan sebagai sumber air minum tetapi harus diolah terlebih dahulu agar sesuai dengan standar baku mutu.
2.1.3 Air Tanah
Air Tanah merupakan air yang berada di bawah permukaan tanah. Air tanah ditemukan pada akifer. Pergerakan air tanah sangat lambat, kecepatan arus berkisar antara 10-10 – 10-3 m/detik dan dipengaruhi oleh porositas, permeabilitas dari lapisan tanah, dan pengisian kembali air (recharge).
Air tanah umumnya mengandung garam terlarut. Jenis dan kadar garam-garam terlarut yang tergantung dalam air tanah adalah tergantung pada kondisi tanah dalam lintasan aliran air tanah. Umumnya kadar konstituen terlarut dalam air tanah adalah lebih tinggi jika dibandingkan dengan kadarnya pada air permukaan, disebabkan oleh lebih lamanya periode kontak antara air dan zat-zat yang dapat larut yang berada dalam lapisan tanah.
Konsentrasi utama yang terdapat dalam air tanah adalah :
- Kation : Ca2+, Mg2+
- Anion : CO32- , HCO3-, Cl- dan NO3
-Konstituen-konstituen yang dapat dijumpai dalam kadar yang relative rendah atau sangat rendah adalah : Fe2+, Mn2+, Al3+, F-.
Disamping itu, air tanah mengadsorpsi pula gas-gas hasil penguraian dan zat-zat anorganik. Gas-gas tersebut dapat berupa CO2, H2S dan NH4. Air tanah yang mengalir
melalui daerah yang kaya akan zat organik yang sifatnya dapat terurai, dapat kehilangan kandungan oksigen terlarutnya. Oksigen tersebut digunakan oleh mikroorganisme dalam perombakan zat organik. (Fardias,S.1992)
Diantara sumber-sumber air yang ditinjau tersebut, air permukaan dan air tanah merupakan sumber-sumber air yang paling luas penggunaannya sebagai sumber air untuk berbagai keperluan, keperluan industri maupun keperluan konsumsi domestik. Mata air juga merupakan bagian dari air tanah. Mata air adalah air tanah yang keluar dengan sendirinya kepermukaan tanah. Mata air ini hampir tidak terpengaruh oleh musim dan kualitasnya sama dengan keadaan air pada bagian dalamnya.
Karakteristik utama yang membedakan air tanah dan air permukaan adalah pergerakan yang sangat lambat dan waktu tinggal (residence time) yang sangat lama, dapat mencapai puluhan bahkan ratusan tahun. Karena pergerakan yang sangat lambat dan waktu tinggal yang lama tersebut, air tanah akan sulit untuk pulih kembali jika mengalami pencemaran.
Air tanah banyak mengandung ion Kalsium (Ca) dan Magnesium (Mg) yang menyebabkan air bersifat sadah. Air tanah ini juga membawa dan melarutkan berbagai mineral apalagi karena sifatnya yang asam (CO2 terlarut). Air tersebut memiliki kemampuan
membentuk padatan kalsium karbonat. Bila keasaman hilang, air akan bersifat sadah (sementara). Penggunaan air tanah cenderung membentuk kerak pada ketel. Walau tak menimbulkan korosi, air tanah sering banyak mengandung besi dan mangan. (Effendi,H.2003)
Daerah dibawah tanah yang terisi air disebut daerah saturasi (zone of saturation). Pada daerah saturasi, setiap pori tanah dan batuan terisi oleh air, yang merupakan air tanah
saturasi/jenuh (unsaturated/vadose zone) yang masih mampu menyerap air. (Effendi,H.2003)
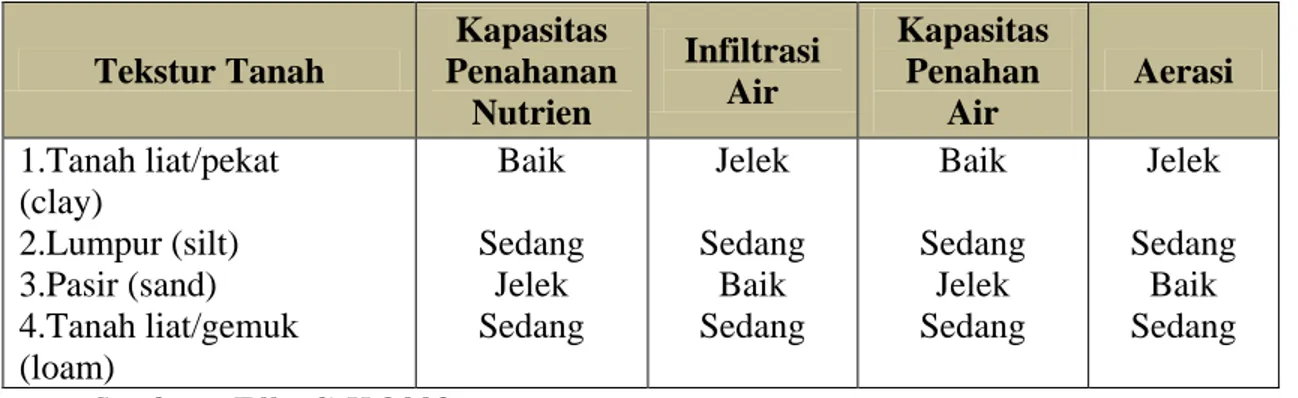
Tabel 2.1 Karakteristik Fisika dan Kimia Tanah dengan Tekstur yang Berbeda
Tekstur Tanah Kapasitas Penahanan Nutrien Infiltrasi Air Kapasitas Penahan Air Aerasi 1.Tanah liat/pekat (clay) 2.Lumpur (silt) 3.Pasir (sand) 4.Tanah liat/gemuk (loam) Baik Sedang Jelek Sedang Jelek Sedang Baik Sedang Baik Sedang Jelek Sedang Jelek Sedang Baik Sedang Sumber : Effendi,H.2003 2.2 Penggolongan Air
Kualitas air diatur oleh pemerintah dalam beberapa peraturan, yakni Peraturan Pemerintah Republik Indonesia Nomor 20 Tahun 1990 tentang Pengendalian Pencemaran Air, Peraturan Pemerintah Republik Indonesia Nomor 82 Tahun 2001 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air,Peraturan Menteri Kesehatan Republik Indonesia nomor 416/Menkes/Per/IX/1990 tentang syarat-syarat dan Pengawasan Kualitas Air, serta Keputusan Menteri Kesehatan Republik Indonesia Nomor 907/Menkes/Sk/VII/2002 tentang syarat-syarat dan Pengawasan Kualitas Air Minum.
Dalam Peraturan Pemerintah Republik Indonesia Nomor 20 Tahun 1990 tentang Pengendalian Pencemaran Air, air menurut peruntukannya digolongkan menjadi empat golongan, yakni A, B, C, dan D, golongan – golongan air tersebut dapat di uraikan sebagai berikut :
1. Golongan A
Air yang dapat digunakan sebagai air minum secara langsung tanpa pengolahan terlebih dahulu.
2. Golongan B
Air yang dapat digunakan sebagai air baku air minum.
3. Golongan C
Air yang dapat digunakan untuk keperluan perikanan dan peternakan.
4. Golongan D
Air yang dapat digunakan untuk keperluan pertanian dan dapat dimanfaatkan untuk usaha perkotaan, industri, pembangkit listrik tenaga air.
Menurut Peraturan Pemerintah Republik Indonesia Nomor 82 Tahun 2001 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air, Klassifikasi mutu air ditetapkan menjadi 4 (empat) kelas. Berikut diuraikan kelas-kelas air tersebut :
1. Kelas Satu
Air yang peruntukannya dapat digunakan untuk air baku air minum, dan atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
2. Kelas Dua
Air yang peruntukannya dapat digunakan untuk prasarana/sarana rekreasi air, pembudidayaan ikan air tawar, peternakan, air untuk mengairi pertanaman, dan atau peruntukkan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut.
3. Kelas Tiga
Air yang peruntukannya dapat digunakan untuk pembudidayaan ikan air tawar, peternakan, air untuk mengairi pertanaman, dan atau peruntukan lain yang mempersyaratkan air yang sama dengan kegunaan tersebut.
4. Kelas Empat
Air yang peruntukannya dapat digunakan untuk mengairi pertanaman dan atau peruntukan lain yang mempersyaratkan mutu air yang sama dengan kegunaan tersebut. (Rahayu,I.2007)
2.3 Pencemaran Air
Pencemaran air adalah masuknya atau dimasukkannya mahluk hidup, zat, energi atau komponen lain kedalam air atau berubahnya tatanan air oleh kegiatan manusia atau oleh proses alam, sehingga kualitas air menurun sampai ke tingkat tertentu yang menyebabkan air berkurang atau tidak dapat berfungsi lagi sesuai kegunaannya.
Air merupakan substrat yang paling parah akibat pencemaran. Berbagai jenis pencemaran baik yang berasal dari :
a. Sumber domestik (rumah tangga), perkampungan, kota, pasar, jalan, dan sebagainya. b. Sumber non-domestik seperti pabrik, pertanian, peternakan, perikanan serta
sumber-sumber lainnya.
Secara langsung ataupun tidak langsung pencemaran tersebut akan berpengaruh terhadap kualitas air, baik untuk keperluan air minum, air industri ataupun keperluan lainnya. Berbagai cara dan usaha telah banyak dilakukan agar pencemaran terhadap air dapat dihindari, dikurangi atau minimal dapat dikendalikan. (Fardias,S.1992)
Dewasa ini air menjadi masalah yang perlu mendapat perhatian yang seksama dan cermat. Untuk mendapatkan air yang baik, sesuai dengan standar tertentu, saat ini menjadi barang yang mahal karena air sudah banyak tercemar oleh bermacam-macam limbah dari hasil kegiatan manusia, baik limbah dari kegiatan rumah tangga, limbah dari kegiatan industri dan kegiatan-kegiatan lainnya.
Walaupun penetapan standar air yang bersih tidak mudah, namun ada kesepakatan bahwa air yang bersih tidak ditetapkan pada kemurnian air akan tetapi didasarkan pada keadaan normalnya. Apabila terjadi penyimpangan dari keadaan normal maka hal itu berarti air tersebut telah mengalami pencemaran. Air dari mata air di pegunungan, apabila lokasi pengambilannya lain, akan menghasilkan keadaan normal yang lain pula. (Wardhana,W.A.1995)
Masalah pencemaran serta efisiensi penggunaan sumber air, merupakan pokok persoalan yang paling banyak dibahas. Hal ini mengingat keadaan perairan alami dibanyak Negara yang cenderung semakin menyusut dan menurun. Baik kualitas maupun kuantitasnya. Sehingga tidak berlebihan pendapat peserta bahwa dikemudian hari dunia akan
dilanda krisis air seperti halnya krisis pangan, energi dan sebagainya. Bahkan untuk beberapa Negara masalah kekurangan air sudah terjadi sejak lama.
Beberapa pokok-pokok yang ditekankan pada pengertian Pencemaran Air meliputi dasar-dasar sebagai berikut :
1. Air pada suatu “badan air” dikatakan mengalami pencemaran, bila pembebasan akan bahan-bahan buangan (kontaminan) sampai pada suatu tingkat/keadaan tertentu dapat membahayakan fungsi air dari badan air tersebut.
2. Bahwa masing-masing fungsi air dalam badan-badan air memiliki suatu “standar kualitas” yang perlu ditentukan terlebih dahulu sebagai batasan sebelum dapat dilakukan suatu penilaian apakah suatu pencemaran pada suatu badan air itu terjadi atau tidak. Jelasnya, masing-masing badan air sesuai dengan fungsinya mempunyai standar kualitas sendiri-sendiri.
3. Masing-masing standar tersebut diatas masih perlu ditentukan pula secara lokal, nasional, atau internasional. Dasar-dasar pertimbangan yang digunakan untuk penentuan standar tersebut bermacam-macam, tergantung pada dominasi sasaran yang akan dilindungi.
Karena air memiliki jaringan aliran yang luas (hydrological cycle), maka air yang berada disuatu tempat baik mengalir maupun menetap (relatif) pada permukaan tanah disebut “Badan Air”. Yang termasuk dalam klassifikasi badan air adalah sungai, waduk, saluran air, rawa-rawa dan lain-lain. (Suriawiria,U.1993)
2.4 Teori Kesadahan
2.4.1 Pengertian Kesadahan
Kesadahan merupakan sifat air yang disebabkan oleh adanya ion-ion atau kation logam valensi dua. Kation-kation penyebab utama dari kesadahan adalah Ca2+, Mg2+, Sr2+, Fe2+ dan Mn2+, sedangkan anion-anionnya yang terdapat dalam air adalah HCO3-, SO42-, Cl-,
NO3-. (Sutrisno,C.T.1996)
Air sadah mengakibatkan konsumsi sabun lebih tinggi, karena adanya hubungan kimiawi antara ion kesadahan dengan molekul sabun menyebabkan sifat detergen sabun hilang. Kelebihan ion Ca2+ serta ion CO32- (salah satu ion alkaliniti) mengakibatkan
terbentuknya kerak pada dinding pipa yang disebabkan oleh endapan kalsium karbonat CaCO3. Kerak ini akan mengurangi penampang basah pipa dan menyulitkan pemanasan air
dalam ketel. (Allaerts,G.1987)
Air sadah umumnya digambarkan sebagai reaksi air terhadap sabun untuk menghasilkan busa atau kemampuan menimbulkan kerak pada pipa air panas, boiler, dan peralatan logam lainnya.
Kesadahan air sangat penting sehubungan dengan berbagai penggunaan air, karena kecenderungan membentuk kerak. Air yang kesadahannya amat rendah, dengan sedikit sabun saja telah berbuih banyak, tetapi jika terdapat kesadahan air tinggi, dapat menyebabkan pemborosan sabun. Kesadahan air harus optimum, karena apabila terlalu tinggi akan menimbulkan kerak, dan apabila terlalu rendah menyebabkan korosi pada suhu tinggi.
Kesadahan air bervariasi dari satu tempat dengan tempat lain. Umumnya, air permukaan lebih sadah dari pada air tanah. Kesadahan air bergantung pada formasi geologi alami dengan apa air tersebut mengalami kontak. Air yang sadah ditemukan di Negara Inggris, Atlantik Selatan, Bagian Utara Pasifik, Lowa, India, Arizona, Meksiko adalah Negara yang memiliki kesadahan air cukup tinggi. (Sawyer and Mc Carty.1998)
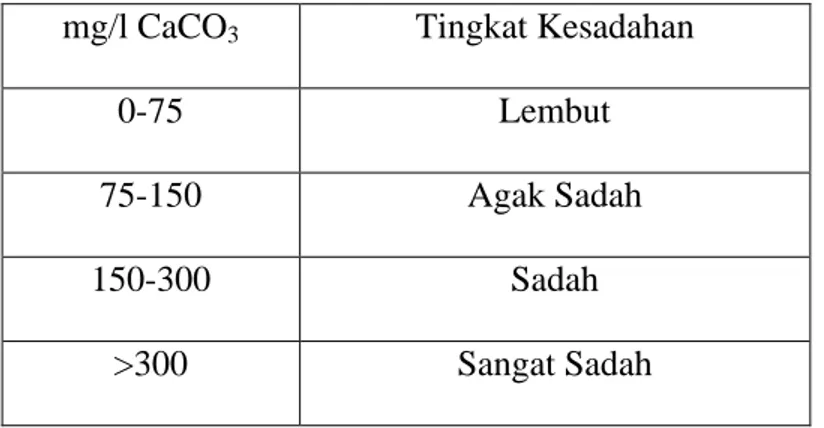
Tabel 2.4 Klassifikasi air dengan tingkat kesadahannya
mg/l CaCO3 Tingkat Kesadahan
0-75 Lembut 75-150 Agak Sadah 150-300 Sadah >300 Sangat Sadah Sumber : Fardias,S.1992 2.4.2 Penyebab Kesadahan
Kesadahan disebabkan kation logam divalent. Dengan kata lain kemampuan ion untuk bereaksi dengan sabun untuk menimbulkan endapan dan tentunya dengan kehadiran anion dalam air untuk membentuk kerak. Dalam prinsipnya kesadahan disebabkan kation antara lain, Ca2+, Mg2+, Sr2+, Fe2+, dan Mn2+.
Kesadahan air juga disebabkan kontak dengan tanah dan formasi bebatuan. Air hujan sebenarnya tidak memiliki kemampuan untuk melarutkan ion-ion penyusun kesadahan yang banyak terikat di dalam tanah dan batuan kapur, meskipun memiliki kadar karbon dioksida yang relative tinggi. Larutnya ion-ion yang dapat meningkatkan nilai kesadahan tersebut
lebih banyak disebabkan oleh aktivitas bakteri didalam tanah, yang banyak mengeluarkan karbon dioksida.
Keberadaan karbon dioksida membentuk kesetimbangan dengan asam karbonat. Pada kondisi yang relatif asam, senyawa-senyawa karbonat yang terdapat di dalam tanah dan batuan kapur yang sebelumnya tidak larut berubah menjadi senyawa bikarbonat yang bersifat larut. Batuan kapur pada dasarnya tidak hanya mengandung karbonat, tetapi juga mengandung sulfat, klorida dan silikat. Ion-ion ini juga ikut terlarut dalam air.
2.4.3 Klassifikasi Kesadahan
Klassifikasi kesadahan berdasarkan dua cara, yaitu berdasarkan ion logam dan berdasarkan anion yang berasosiasi dengan ion logam. Berdasarkan ion logam, kesadahan dibedakan menjadi kesadahan kalsium dan kesadahan magnesium.Berdasarkan anion yang berasosiasi dengan ion logam, kesadahan dibedakan menjadi kesadahan karbonat dan kesadahan non-karbonat.
2.4.3.1 Kesadahan Kalsium dan Magnesium
Kesadahan perairan dikelompokkan menjadi kesadahan kalsium dan kesadahan magnesium karena pada perairan alami kesadahan banyak disebabkan oleh kation kalsium dan magnesium. Kesadahan kalsium dan magnesium sering kali perlu diketahui untuk menentukan jumlah kapur dan soda abu yang dibutuhkan dalam proses pelunakan air(lime-soda ash softening). Jika nilai kesadahan kalsium diketahui maka kesadahan magnesium dapat ditentukan melalui persamaan. ( Cole,G.A.1998 )
Pada penentuan nilai kesadahan baik kesadahan total, kesadahan kalsium maupun kesadahan magnesium, keberadaan besi dan mangan dianggap sebagai pengganggu karena dapat bereaksi dengan pereaksi yang digunakan. Oleh karena itu, kesadahan kalsium dianggap lebih besar dari kadar ion kalsium, dan sebaliknya. Untuk mendapatkan kadar ion kalsium dan ion magnesium dari nilai kesadahan, digunakan persamaan :
Kadar Ca2+ (mg/liter) = 0,4 x kesadahan kalsium
Kadar Mg2+ (mg/liter) = 0,243 x kesadahan magnesium
( Effendi,H.2003)
2.4.3.2 Kesadahan Karbonat dan Non-karbonat
Pada kesadahan karbonat, kalsium dan magnesium berasosiasi dengan ion CO32- dan
HCO3-. Pada kesadahan non-karbonat, kalsium dan magnesium berasosiasi dengan ion SO4
2-, Cl-, dan NO3-. Kesadahan karbonat sangat sensitif terhadap panas dan mengendap dengan
mudah pada suhu tinggi. Seperti reaksi berikut ini :
Ca(HCO3)2 → CaCO3 endapan + CO2 + H2O
Mg(HCO3)2 → Mg(OH)2 endapan + 2CO2
Oleh karena itu, kesadahan karbonat disebut juga kesadahan sementara. Kesadahan non-karbonat disebut kesadahan permanen karena kalsium dan magnesium yang berikatan dengan sulfat dan klorida tidak mengendap dan nilai kesadahan tidak berubah meskipun suhu tinggi.
Bagian dari total kesadahan yaitu ekuivalen dengan bikarbonat yang berperan serta dalam kehadiran alkalinitas karbonat sesuai dengan kesadahan karbonat. Sejak alkalinitas dan kesadahan ditentukan dalam CaCO3, kesadahan karbonat dapat dihitung berdasarkan :
Apabila alkalinitas total < kesadahan total : Maka kesadahan karbonat = alkalinitas total. Apabila alkalinitas total ≥ kesadahan total : Maka kesadahan karbonat = kesadahan total. Kesadahan non karbonat = kesadahan total – kesadahan karbonat.(Sawyer and Mc Carty.1998)
Jika alkalinitas total melebihi kesadahan total maka sebagian dari anion penyusun alkalinitas (bikarbonat dan karbonat) berasosiasi dengan kation valensi satu (monovalent), misalnya kalium (K+) dan Natrium (Na+) yang tidak terdeteksi pada penentuan kesadahan. Sebaliknya, jika kesadahan total melebihi alkalinitas total maka sebagian dari kation penyusun kesadahan (kalsium dan magnesium) berikatan dengan sulfat (SO42-), klorida (Cl
-), silikat (SiO32-) atau nitrat (NO3-) yang tidak terdeteksi pada penentuan alkalinitas. Oleh
karena itu hubungan antara kesadahan dan alkalinitas tidak selalu positif atau semakin besar kesadahan tidak selalu disertai dengan semakin tingginya alkalinitas dan sebaliknya. ( Effendi,H.2003)
2.5 Metode Penentuan Kesadahan
Kesadahan biasanya dinyatakan sebagai CaCO3. Beberapa metode telah digunakan
2.5.1 MetodeTotal
Metode ini menghitung kesadahan berdasarkan konsentrasi ion-ion divalen dalam air, diantaranya Ca2+, Mg2+, dan Sr2+.
Perhitungan kesadahan berdasarkan kosentrasi ion-ion divalent tersebut menggunakan persamaan :
Kesadahan(mg/l) sebagai CaCO3 = M2+ (mg/l) x
50 𝑏𝑟𝑡 .𝑒𝑘𝑖𝑣𝑎𝑙𝑒𝑛 𝑀2+
Dimana M2+ = ion logam divalent
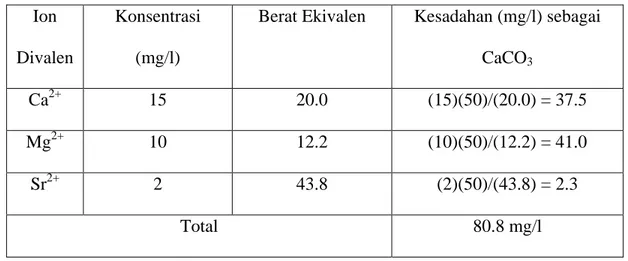
Contoh: Dari hasil analisa air diketahui kandungan ion-ionnya (mg/l) sebagai berikut: Hanya kation divalent,Ca2+, Mg2+, dan Sr2+ yang diperhitungkan sebagai penyebab kesadahan, maka kesadahan total berdasarkan konsentrasi dan berat ekivalen masing-masing ion divalent kesadahan :
Tabel 2.5 Perhitungan Kesadahan Metode Total Ion
Divalen
Konsentrasi (mg/l)
Berat Ekivalen Kesadahan (mg/l) sebagai CaCO3 Ca2+ 15 20.0 (15)(50)/(20.0) = 37.5 Mg2+ 10 12.2 (10)(50)/(12.2) = 41.0 Sr2+ 2 43.8 (2)(50)/(43.8) = 2.3 Total 80.8 mg/l Sumber : Fardias,S.1992
2.5.2 Metode Titrasi EDTA
Titrasi kompleksometri meliputi reaksi pembentukan ion-ion kompleks ataupun pembentukan molekul netral yang terdisosiasi dalam larutan. Persyaratan mendasar terbentuknya kompleks demikian adalah tingkat kelarutannya tinggi. Titik akhir titrasi ditetapkan dengan indicator logam ataupun secara potensiometer dan spektrofotometri. (Khopkar,2003)
Metode ini menggunakan larutan EDTA (ethylenediamine tetra eacetic acid) sebagai larutan standarnya. Untuk mengetahui titik akhir titrasi digunakan indikator logam. Diantara indikator yang biasa digunakan adalah Eriochrome Black T (EBT). (Sawyer and Mc Carty.1998)
Eriochrome Black T sebagai indicator akan membentuk senyawa kompleks seluruhnya dengan EDTA yang ditambahkan, dengan kata lain kapan penambahan larutan EDTA mulai berlebih yang ditunjukkan oleh perubahan warna larutan dari merah menjadi biru. Reaksi ini berlangsung sempurna pada pH 8-10. Untuk mempertahankan larutan pada pH tersebut ditambahkan larutan buffer salmiak.Ca2+ dan Mg2+ akan membentuk senyawa kompleks warna merah anggur, dengan EBT.
M2+ + EBT → (M EBT)kompleks merah anggur
Perubahan semakin jelas bila pH semakin tinggi, namun pH yang tinggi dapat menyebabkan ion-ion kesadahan hilang dari larutan, karena terjadi pengendapan Mg(OH)2
dan CaCO3. Pada pH > 9, CaCO3 sudah mulai terbentuk.
2.6 Menghilangkan Kesadahan Air
Ada beberapa cara untuk menghilangkan kesadahan air. Dalam skala besar, misalnya air untuk konsumsi masyarakat digunakan proses penghilangan kesadahan air dengan penambahan soda. Dalam proses pengolahan air ditambahkan soda Ca(OH)2 dan abu soda
Na2CO3 sehingga kalsium akan mengendap sebagai CaCO3 dan magnesium sebagai
Mg(OH)2. Bila kesadahan hanya disebabkan oleh „kesadahan karbonat‟ maka cukup hanya
dengan menambahkan Ca(OH)2 untuk menghilangkannya.
Untuk menghilangkan kesadahan air yang disebabkan oleh ion magnesium agar magnesium dapat mengendap dalam bentuk Mg(OH)2 harus dibuat pH air tinggi, yaitu
penambahan abu soda.
Cara lain untuk menghilangkan kesadahan air adalah secara pertukaran ion, dengan cara melewatkan air ke dalam wadah penukar kation yaitu bahan resin yang sudah mengandung senyawa kimia penukar kation, kemudian dilanjutkan dengan melewatkan air kedalam wadah penukar anion, sehingga kation didalam air ditukar dengan ion hidrogen dan anion ditukar dengan ion hidroksida dan menghasilkan air dalam keadaan murni. Beberapa materi telah dikembangkan sebagai wadah penukar ion, termasuk diantaranya mineral aluminium silikat atau zeolit. Zeolit yang sudah berhasil digunakan dalam pemurnian air secara komersil adalah glaukonit [K2(MgFe)2Al6(Si4O10)3(OH)12]. (Situmorang,M.2007)