SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan oleh : Raden Pradipta Satriyajati
NIM : 058114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
UJI DAYA ANTIBAKTERI EKSTRAK ETANOL KULIT BATANG ASAM JAWA (Tamarindus indicaLinn.) TERHADAP ISOLAT BAKTERI
EKSUDAT JERAWAT
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Diajukan oleh : Raden Pradipta Satriyajati
NIM : 058114086
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
v
melakukan apa-apa...
Belajarlah dari kesalahan orang lain, karena kita tidak punya cukup
waktu untuk melakukan semua kesalahan itu sendiri...
Life is not as simple as it looks.. I will keep moving on, no matter what in front of me.. let everybody think what they want to think about me.. you will be the only one..
Nobody’s perfect
I’m nobody
So I’m perfect...
Karya ini aku dedikasikan kepada:
My Dad n My Mom
My two little sisters, Thira and Aya
Fairy, Angel and Devils on my side
Almamaterku
vii
penyusunan skripsi berjudul ”UJI DAYA ANTIBAKTERI EKSTRAK ETANOL KULIT BATANG ASAM JAWA (Tamarindus indica Linn.) TERHADAP ISOLAT BAKTERI EKSUDAT JERAWAT”.
Penulis menyadari bahwa penulis tidak dapat menyelesaikan skripsi ini sendiri tanpa bantuan, dukungan, bimbingan, arahan, kritik, dan saran dari berbagai pihak. Maka pada kesempatan ini penulis hendak menyampaikan ungkapan terimakasih yang sebesar-besarnya kepada:
1. Kedua orangtua penulis atas bantuan, bimbingan, motivasi, dukungan dan kasih sayangnya yang telah diberikan kepada penulis.
2. Bapak Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
3. Bapak Ign. Y. Kristio Budiasmoro, M.Si. selaku dosen pembimbing skripsi yang telah memberikan bimbingan, saran dan evaluasi kepada penulis sejak penyusunan proposal hingga selesainya penulisan skripsi ini. 4. Ibu Erna Tri Wulandari, M. Si., Apt., selaku dosen penguji, atas
bimbingan, arahan, dan penjelasannya.
viii
6. Ibu Dra. M. M. Yetty Tjandrawati, M. Si., selaku dosen pembimbing akademik yang telah memberi bimbingan dan arahan pada penulis selama menjalani masa kuliah.
7. Ibu Rini Dwiastuti, S.Farm., Apt. selaku dosen pembimbing kelompok PKM yang memberi gagasan sehingga penulis dapat melakukan penelitian ini.
8. Susthira Astasari dan Gratsia Kancanamaya, adik-adik penulis yang telah memberi warna pada hari-hari penulis, dan meramaikan suasana di rumah. 9. Ade Entyna atas segala bantuan, dukungan, ketabahan, kasih sayang, dan
senyumannya yang membuat penulis tidak pernah menyerah hingga akhirnya dapat menyelesaikan penelitian dan penyusunan skripsi ini. 10. Omega Bagus Pamuji, Ong Hengky S.S., dan Gadissa Meiheritta selaku
anggota kelompok PKM Asam Jawa atas bantuan, dukungan, dan semangatnya yang menjadi motivasi bagi penulis.
11. Tobias Timothy Budiman, Vincent Mananda H., Susilo Aji Saputro, Andreas Agung Laksono, Hernawan dan teman-teman ex-JB 2005 lainnya atas dukungannya.
12. Stephanie Pramasanti dan Helena Angelina yang telah memberikan dukungan terbaiknya kepada penulis, sehingga penulis dapat tetap bersemangat sekalipun dalam keadaan yang dapat membuat seseorang menyerah.
ix
15. Semua pihak yang tidak dapat disebutkan satu persatu, atas segala bantuannya hingga penulis menyelesaikan skripsi ini.
Penulis menyadari bahwa penulis tidak luput dari kekurangan dalam penulisan naskah skripsi ini mengingat segala keterbatasan wawasan dan kemampuan penulis. Untuk itu, penulis membuka diri untuk adanya kritik dan saran yang membangun sehingga skripsi ini menjadi lebih baik. Akhir kata, dengan segala kerendahan hati penulis berharap semoga tulisan ini berguna bagi semua pihak, terutama untuk kemajuan pengetahuan dalam bidang ilmu Farmasi.
xi
asam jawa memiliki aktivitas antibakteri spektrum luas yang berarti dapat membunuh bakteri Gram positif maupun Gram negatif, sehingga memiliki potensi digunakan sebagai alternatif pengobatan penyakit yang disebabkan oleh bakteri, seperti jerawat.
Tujuan dari penelitian ini adalah untuk mengetahui daya antibakteri ekstrak etanol kulit batang asam jawa terhadap isolat bakteri eksudat jerawat serta untuk menentukan nilai Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) terhadap isolat bakteri eksudat jerawat.
Penentuan diameter zona hambat pertumbuhan bakteri dilakukan dengan metode difusi sumuran. Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) dilakukan dengan metode dilusi padat. Data-data hasil penelitian yang didapatkan dianalisis secara eksploratif deskriptif. Data hasil pengukuran diameter zona hambat kemudian dianalisis dengan analisis statistik one wayANOVA yang dilanjutkan dengan LSDtest.
Hasil penelitian menunjukkan bahwa ekstrak etanol kulit batang asam jawa memiliki daya antibakteri terhadap isolat bakteri eksudat jerawat, dengan nilai KHM sebesar 20 mg/ml dan nilai KBM sebesar 30 mg/ml.
xii ABSTRACT
Tamarind (Tamarindus indica Linn.) is a medicinal plant that often be used as an alternative medication. Chemical constituents on tamarind’s bark is alkaloids and tannins. A research on a tamarind’s bark shows that tamarind’s bark has a broad spectrum of antibacterial activity, so it is potential to be used as an alternative medication of diseases caused by bacteria, such as acne.
The purpose of this research was to determine the antibacterial activity of tamarind’s bark extract and to defined the Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) against acne’s exudate bacteria.
The determination of the inhibitory diameter zone of bacterial growth using diffusion method. The determination of Minimum Inhibitory Concentration (MIC) and Minimum Bactericidal Concentration (MBC) using solid dilution method. The experimental data was analyzed by descriptive explorative. The results of inhibitory diameter zone was analyzed with a one way ANOVA and then continued with LSD test.
The results showed that extract of tamarind’s bark had an antibacterial activity against acne’s exudate bacteria, with MIC value of: 20 mg/ml and MBC value of: 30 mg/ml.
xiii
HALAMAN PENGESAHAN... iv
HALAMAN PERSEMBAHAN ... v
PERNYATAAN PERSETUJUAN PUBLIKASI...vi
PRAKATA... vii
PERNYATAAN KEASLIAN KARYA ... x
INTISARI... xi
ABSTRACT... xii
DAFTAR ISI... xiii
DAFTAR TABEL... xvii
DAFTAR LAMPIRAN... xviii
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Perumusan Masalah ... 4
2. Keaslian Penelitian ... 4
3. Manfaat Penelitian ... 5
B. Tujuan Penelitian ... 5
xiv
A. Tanaman Asam Jawa (Tamarindus indicaLinn.)... 6
B. Jerawat dan Bakteri Jerawat... 10
C. Ekstraksi... 11
D. Antibakteri ... 13
E. Keterangan Empiris ... 15
BAB III METODOLOGI PENELITIAN... 17
A. Jenis dan Rancangan Penelitian ... 17
B. Variabel Penelitian dan Definisi Operasional... 17
1. Variabel penelitian... 17
2. Definisi operasional ... 18
C. Bahan dan Alat Penelitian... 19
1. Bahan ... 19
2. Alat... 19
D. Tata Cara Penelitian ... 19
1. Pengumpulan bahan kulit batang asam jawa ... 19
2. Pembuatan serbuk kulit batang asam jawa ... 20
3. Pembuatan ekstrak etanol kulit batang asam jawa... 20
4. Skrining fitokimia ekstrak etanol kulit batang asam jawa... 21
5. Isolasi bakteri eksudat jerawat ... 22
xv
9. Uji penegasan daya antibakteri ekstrak etanol kulit batang asam jawa
dengan metode difusi sumuran... 28
E. Analisis Data... 29
BAB IV HASIL DAN PEMBAHASAN ... 30
A. Pengumpulan Bahan Kulit Batang Asam Jawa ... 30
B. Pembuatan Serbuk Kulit Batang Asam Jawa... 31
C. Ekstraksi Serbuk Kulit Batang Asam Jawa ... 31
D. Skrining Fitokimia Ekstrak Etanol Kulit Batang Asam Jawa... 33
1. Uji alkaloid ... 34
2. Uji saponin... 35
3. Uji tanin ... 35
4. Uji steroid ... 36
5. Uji antrakuinon ... 37
E. Isolasi Bakteri Eksudat Jerawat ... 38
F. Identifikasi Isolat Bakteri Eksudat Jerawat... 39
1. Morfologi Koloni pada Media Cair ... 39
xvi
3. Uji biokimia ... 41
G. Uji Daya Antibakteri Ekstrak Etanol Kulit Batang Asam Jawa dengan Metode Difusi Sumuran... 47
H. Penentuan KHM dan KBM Ekstrak Etanol Kulit Batang Asam Jawa dengan Metode Dilusi Padat ... 50
I. Uji Penegasan Daya Antibakteri Ekstrak Etanol Kulit Batang Asam Jawa dengan Metode Difusi Sumuran ... 52
BAB V KESIMPULAN DAN SARAN... 56
A. Kesimpulan ... 56
B. Saran ... 56
DAFTAR PUSTAKA ... ..57
xvii
Tabel II. Hasil reisolasi bakteri eksudat jerawat berdasarkan pengecatan Gram...38 Tabel III. Hasil identifikasi isolat bakteri eksudat jerawat...46 Tabel IV. Diameter zona hambat pertumbuhan bakteri eksudat jerawat yang
terbentuk pada uji daya antibakteri ekstrak etanol kulit batang asam jawa... 48 Tabel V. Hasil pengamatan penentuan nilai KHM dan KBM... 52 Tabel VI. Diameter zona hambat pertumbuhan bakteri eksudat jerawat yang
terbentuk pada uji penegasan daya antibakteri ekstrak etanol kulit
xviii
DAFTAR LAMPIRAN
Lampiran 1. Surat Pernyataan Kesediaan sebagai Probandus ... 60
Lampiran 2. Kulit Batang Asam Jawa (Tamarindus indicaLinn)... 61
Lampiran 3. Hasil Skrining Fitokimia Ekstrak Etanol Kulit Batang Asam Jawa ... 62
Lampiran 4. Hasil Identifikasi Isolat Bakteri Eksudat Jerawat …………...64
Lampiran 5. Hasil Uji Daya Antibakteri dengan Metode Difusi Sumuran... 69
Lampiran 6. Hasil Uji Penentuan KHM dan KBM ... 70
Lampiran 7. Hasil Uji Penegasan Daya Antibakteri dengan Metode Difusi Sumuran... 74
1
A. Latar Belakang
Jerawat merupakan jenis penyakit kulit yang biasa ditemukan di semua kalangan, terutama remaja. Penyebab umumnya adalah stress, hormon dan udara lembab yang dapat memicu kulit memproduksi minyak secara berlebih sehingga dapat menjadi tempat berkembangbiaknya bakteri. Folikel rambut, terutama yang memiliki kelenjar sebasea yang besar, menjadi tersumbat karena hiperkeratosis yang menyebabkan penumpukan minyak di bawah kulit. Bakteri bereaksi pada produksi minyak berlebih tersebut dengan melepaskan lipase. Kombinasi antara lipase dan asam lemak menimbulkan respon kulit berupa peradangan akut, maka terbentuklah jerawat (Burns, 2005).
Doughari (2006) melakukan penelitian daya antibakteri ekstrak kulit batang dan ekstrak daun asam jawa terhadap beberapa bakteri patogen dan didapatkan hasil bahwa ekstrak kulit batang dan ekstrak daun asam jawa memiliki aktivitas antibakteri dengan spektrum yang luas, yang artinya dapat membunuh banyak macam bakteri, baik itu bakteri Gram positif maupun bakteri Gram negatif. Beberapa bakteri uji yang digunakan dalam penelitian Doughari (2006) adalah Escherichia coli, Proteus mirabilis, Pseudomonas aerugenosa, Staphylococcus aureus, dan Bacillus subtilis. Diketahui kandungan kulit batang
2
Kemampuan antibakteri ekstrak kulit batang asam jawa memberi gagasan untuk menguji kemampuan ekstrak tersebut terhadap bakteri jerawat, sehingga dapat diketahui potensi ekstrak kulit batang asam jawa sebagai alternatif pengobatan jerawat. Kulit batang asam jawa dipilih karena daya antibakterinya yang lebih besar daripada daun asam jawa. Data penelitian menunjukkan rata-rata zona hambat ekstrak etanol daun asam jawa pada bakteri Gram negatif sebesar 0,7 cm dan pada bakteri Gram positif sebesar 0,9 cm. Sedangkan rata-rata zona hambat ekstrak etanol kulit batang asam jawa pada bakteri Gram negatif dan bakteri Gram positif yang digunakan sebagai bakteri uji sama besar, yaitu sebesar 2,2 cm (Doughari, 2006).
Obat tradisional untuk jerawat biasanya menggunakan ramuan daun lidah buaya, sirih, dan sambiloto kering, atau menggunakan belimbing wuluh (Haryana, 2009). Kulit batang asam jawa menarik untuk diteliti karena bahan tersebut belum banyak penggunaannya sebagai obat tradisional, terutama sebagai pengobatan jerawat. Hal ini mendorong untuk melakukan eksplorasi tentang aktivitas dan kegunaan dari kulit batang asam jawa, sehingga nantinya dapat dikembangkan menjadi obat tradisional. Ekstraksi kulit batang asam jawa menggunakan pelarut etanol 70% karena lebih selektif untuk mendapatkan senyawa yang terkandung dalam kulit batang asam jawa, yaitu alkaloid, tanin, dan saponin sehingga zat pengganggu yang terlarut hanya terbatas (Anonim, 1986a).
berbeda. Perbedaan dapat meliputi perbedaan jenis senyawa ataupun konsentrasi senyawa. Perbedaan tersebut dapat disebabkan oleh iklim atau cuaca, jenis tanah, keadaan lingkungan, dan jumlah curah hujan. Kulit batang asam jawa yang digunakan dalam penelitian ini didapatkan dari pohon asam jawa yang terdapat di Wonosari, Yogyakarta.
Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) dilakukan untuk mengetahui potensi ekstrak kulit batang asam jawa dalam membunuh isolat bakteri eksudat jerawat, sehingga dapat diketahui konsentrasi minimal yang dibutuhkan untuk mendapatkan efek daya antibakteri yang diinginkan.
4
batang asam jawa dalam mengobati jerawat yang disebabkan bakteri dapat diamati.
1. Perumusan Masalah
Berdasarkan uraian di atas, maka muncul permasalahan sebagai berikut : a. Apakah ekstrak etanol kulit batang asam jawa memiliki daya
antibakteri terhadap isolat bakteri eksudat jerawat?
b. Berapakah Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanol kulit batang asam jawa terhadap isolat bakteri eksudat jerawat?
2. Keaslian Penelitian
3. Manfaat Penelitian
a. Manfaat teoritis: menambah khasanah ilmu pengetahuan mengenai pengembangan dan pemanfaatan obat tradisional di masyarakat, khususnya kulit batang asam jawa.
b. Manfaat praktis: mengetahui kegunaan kulit batang asam jawa sebagai obat tradisional bagi pengobatan terhadap jerawat.
B. Tujuan Penelitian
1. Mengetahui daya antibakteri ekstrak etanol kulit batang asam jawa terhadap bakteri eksudat jerawat.
6 BAB II
PENELAAHAN PUSTAKA
A. Tanaman Asam Jawa (Tamarindus indicaLinn.)
1. Keterangan botani
Asam jawa (Tamarindus indica Linn.) biasa disebut tamarind (Inggris), tamarinier (Perancis), sedangkan di Indonesia lebih dikenal dengan nama asam jawa (Arisandi, 2006). Asam jawa termasuk dalam famili Fabaceae, subfamily Caesalpiniaceae dan digolongkan dalam genus Tamarindus, dengan nama spesies Tamarindus indica Linn. (Anonim, 2009; Doughari, 2006).
2. Deskripsi
3. Kegunaan
Bagian tanaman asam jawa yang sering digunakan dalam pengobatan tradisional adalah daun, buah, dan bijinya. Diketahui daun asam jawa berguna dalam pengobatan demam, reumatik, luka, eksim, dan bisul. Buah asam jawa dapat digunakan dalam pengobatan batuk, sariawan, dan morbili. Biji asam jawa digunakan dalam pengobatan luka borok, bengkak karena disengat lipan atau lebah, mencegah rambut rontok, dan mengobati gigitan ular berbisa (Anonim, 2009).
Kulit batang asam jawa masih belum umum digunakan dalam masyarakat sebagai obat tradisional. Salah satu yang diketahui adalah kulit batang asam jawa digunakan sebagai obat asma dengan diramu bersama adas pulawaras kemudian direbus hingga mendidih (Anonim, 2009). Belum ada keterangan empiris yang dipublikasikan mengenai kegunaan kulit batang asam jawa dalam mengobati jerawat.
4. Kandungan Kimia Kulit Batang Asam Jawa
Menurut Doughari (2006), kulit batang asam jawa mengandung alkaloid, saponin, tanin, seskuiterpen, dan phlobatanin. Sumber lain, yaitu Duke (2010), menyebutkan kandungan kulit batang asam jawa adalah tanin dan hordenin.
8
umumnya alkaloid mengandung satu atom nitrogen, akan tetapi beberapa alkaloid mempunyai lebih dari satu nitrogen dalam molekulnya. Peran alkaloid bagi tumbuhan penghasil antara lain sebagai (1) zat racun yang melindungi tumbuhan dari gangguan serangga dan hewan, (2) produk akhir detoksifikasi hasil metabolisme, (3) faktor pengatur tumbuhan, dan (4) persediaan unsur nitrogen yang mungkin diperlukan bagi tumbuhan (Mursyidi, 1989). Alkaloid juga diketahui memiliki aktivitas antibakteri, tetapi mekanisme aksinya terhadap mikrobia masih belum diketahui secara pasti (Ezekiel, Anokwuru, Nsofor, Odusanya dan Adebanjo, 2009).
Tanin secara kimia dibagi menjadi dua golongan yaitu tanin terhidrolisis dan tanin terkondensasi. Tanin terhidrolisis biasanya berupa senyawa amorf, higroskopis, berwarna coklat kuning yang larut dalam air membentuk larutan koloid (Robinson, 1991). Tanin terhidrolisis terdiri dari dua kelas yaitu galotanin dan elagitanin. Tanin terkondensasi atau flavolan secara biosintesis dapat terbentuk dengan cara kondensasi katekin tunggal yang membentuk senyawa dimer dan kemudian oligomer yang lebih tinggi. Nama lain untuk tanin terkondensasi adalah proantosianidin karena bila direaksikan dengan asam panas, beberapa ikatan karbon-karbon penghubung satuan terputus dan dibebaskan monomer antosianidin (Harborne, 1996).
pada kemampuan senyawa ini menghambat kerja enzim tertentu secara selektif, seperti reverse transkriptase dan DNA topoisomerase atau kemampuannya dalam menghambat ikatan antar ligan dengan suatu reseptor (Mahtuti, 2004; Robinson, 1991).
Keberadaan saponin ditandai dengan pembentukan koloidal dalam air yang berbuih pada penggojokan. Glikosida saponin tersebar luas pada tanaman tinggi dan pada hidrolisa, saponin menghasilkan aglikon yang disebut sapogenin. Menurut struktur aglikon atau sapogenin dapat dibedakan menjadi dua macam saponin, yaitu tipe steroida dan triterpenoida. Obat-obat yang mengandung saponin biasanya menimbulkan bersin atau merangsang selaput lendir. Saponin menghancurkan butir darah merah secara hemolisa dan bersifat racun terutama terhadap binatang berdarah dingin. Pereaksi Liebermann-Burchard dapat digunakan untuk mengidentifikasi saponin. Terbentuknya warna biru atau biru hijau menunjukkan adanya steroida saponin dan pada triterpenoida akan terbentuk warna merah, ungu merah, atau ungu (Anonim, 1978).
10
Phlobatanin yang diungkapkan oleh Doughari (2006), merupakan senyawa golongan tanin, sedangkan hordenin yang diungkapkan Duke (2010) merupakan senyawa golongan alkaloid (Robinson, 1991). Dapat disimpulkan, menurut kedua pustaka tersebut, kulit batang asam jawa mengandung alkaloid, tanin, saponin, dan seskuiterpen.
B. Jerawat dan Bakteri Jerawat
Jerawat adalah manifestasi inflamasi lokal pada kulit sebagai akibat dari infeksi bakteri yang dipicu oleh produksi minyak yang berlebih. Patogenesis jerawat dimulai dari meningkatnya produksi minyak. Folikel rambut terutama yang memiliki kelenjar sebasea besar menjadi tersumbat karena hiperkeratosis, yang menyebabkan penumpukan minyak di bawah kulit. Bakteri bereaksi pada produksi minyak berlebih tersebut dengan melepaskan lipase. Kombinasi antara lipase dan asam lemak menimbulkan respon kulit berupa peradangan akut, maka terbentuklah jerawat (Burns, 2005).
Pengobatan yang sering digunakan adalah antibiotik, karena jerawat disebabkan oleh infeksi bakteri. Antibiotik yang sering digunakan adalah klindamisin, tetrasiklin, atau eritromisin (Burns, 2005).
cotton bud steril dan kemudian diinokulasikan pada media Nutrien Agar secara streak plate. Hasil reisolasi pada pertumbuhan bakteri pada media tersebut yang
akan digunakan sebagai bakteri uji (Bonang dan Koeswandono, 1982).
C. Ekstraksi
Ekstraksi adalah kegiatan penarikan zat yang dapat larut dari bahan yang tidak dapat larut dengan pelarut cair. Simplisia yang diekstraksi mengandung zat aktif yang dapat larut dan zat yang tidak larut seperti serat, karbohidrat, protein, dan lain-lain (Anonim, 1986a).
Metode yang digunakan untuk ekstraksi antara lain: 1. Infundasi
Infundasi adalah proses ekstraksi yang umumnya digunakan untuk mengekstrak senyawa kandungan aktif yang larut dalam air dari bahan-bahan nabati. Ekstraksi dengan cara ini menghasilkan ekstrak yang tidak stabil dan mudah tercemar oleh bakteri dan kapang. Maka ekstrak yang diperoleh dengan cara ini tidak boleh disimpan lebih dari 24 jam (Anonim, 1986a).
2. Maserasi
12
maka larutan yang terpekat didesak keluar. Peristiwa tersebut berulang sehingga terjadi keseimbangan konsentrasi antara larutan diluar sel dan di dalam sel. Maserasi digunakan untuk ekstraksi simplisia yang mengandung zat aktif yang mudah larut dalam pelarut ekstraksi, tidak mengandung zat yang mudah mengembang dalam pelarut ekstraksi, tidak mengandung benzoin, stirak, dan lain-lain (Anonim, 1986a).
3. Perkolasi
Perkolasi adalah cara ekstraksi yang dilakukan dengan mengalirkan cairan penyari melalui serbuk simplisia yang telah dibasahi. Prinsip perkolasi adalah sebagai berikut: serbuk simplisia ditempatkan dalam suatu bejana silinder, yang bagian bawahnya diberi sekat berpori. Pelarut ekstraksi dialirkan dari atas ke bawah melalui serbuk tersebut. Pelarut ekstraksi akan melarutkan zat aktif sel-sel yang dilalui hingga mencapai keadaan jenuh. Gerak ke bawah disebabkan oleh kekuatan gaya beratnya sendiri dan cairan di atasnya, dikurangi daya kapiler yang cenderung untuk menahan (Anonim, 1986a).
Hasil dari ekstraksi disebut dengan ekstrak. Ekstrak adalah sediaan kering, kental, atau cair dibuat dengan ekstraksi simplisia menurut cara yang cocok di luar pengaruh cahaya matahari langsung. Ekstrak kering harus mudah digerus menjadi serbuk (Anonim, 2000).
Ekstrak diperoleh dengan cara melepaskan zat aktif dari masing-masing bahan obat, menggunakan pelarut yang cocok, uapkan semua atau hampir semua dari pelarutnya dan sisa endapan atau serbuk diatur untuk ditetapkan standarnya (Ansel, 1989).
Ekstrak dapat dibuat menjadi 3 bentuk, yaitu ekstrak setengah cair atau kental seperti sirup, butir-butir atau ekstrak padat yang dibuat dengan menguapkan hampir semua pelarutnya, dan ekstrak kering (serbuk) yang dibuat dengan cara menguapkan semua pelarutnya (Ansel, 1989).
D. Antibakteri
Antibakteri sebagai obat pembasmi bakteri, khususnya bakteri yang merugikan. Suatu antibakteri diharuskan memiliki sifat toksisitas selektif, yaitu kemampuan antibakteri untuk membunuh bakteri tanpa merusak sel inang (Setiabudy dan Gan, 1995).
14
dan Kadar Bunuh Minimum (KBM). Antibakteri tertentu aktivitasnya dapat meningkat dari bakteriostatik menjadi bakterisida bila kadar antibakterinya ditingkatkan melebihi KHM (Ganiswarna, 1995).
Pengukuran aktivitas antibakteri dapat dilakukan dengan salah satu dari dua metode utama berikut :
1. Metode dilusi
hasil streak plate yang menandakan bakteri uji mati karena larutan uji dengan konsentrasi tersebut (McKane dan Kandel, 1996; Koneman, Allen, Schreckenbergerr, dan Winn, 1997).
2. Metode difusi
Paper disk, lubang sumuran, atau silinder tidak beralas, yang mengandung senyawa antibakteri dalam jumlah tertentu ditempatkan pada media padat yang telah ditanami dengan bakteri yang diuji. Setelah inkubasi, diameter daerah hambatan jernih yang mengelilingi senyawa antibakteri dianggap sebagai ukuran kekuatan hambatan senyawa tersebut terhadap bakteri uji (Jawetz dkk, 1995).
E. Keterangan Empiris
Asam jawa diketahui banyak digunakan sebagai obat tradisional. Bagian-bagian yang sering digunakan adalah daun, buah, dan biji asam jawa. Bagian kulit batang asam jawa belum banyak digunakan. Daun dan kulit batang asam jawa diketahui memiliki aktivitas antibakteri dengan spektrum yang luas. Dari kedua bagian tersebut, kulit batang asam jawa memiliki aktivitas antibakteri yang lebih besar dibandingkan dengan daun asam jawa. Senyawa yang terkandung dalam kulit batang asam jawa antara lain adalah tanin, saponin, dan alkaloid (Doughari, 2006).
16
bakteri yang benar-benar ada dalam jerawat, bukan bakteri yang terdapat di permukaan kulit.
Penelitian ini dilakukan untuk mengetahui daya antibakteri ekstrak etanol kulit batang asam jawa terhadap bakteri jerawat, sehingga untuk selanjutnya dapat dikembangkan menjadi obat tradisional bagi jerawat. Pengujian yang dilakukan meliputi uji daya antibakteri menggunakan metode difusi sumuran dan penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) menggunakan metode dilusi padat.
17
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk jenis penelitian eksploratif deskriptif. Analisis statistik one way ANOVA yang dilanjutkan dengan LSD test dilakukan untuk mengetahui adanya kebermaknaan dalam perbedaan hasil tiap sampel. Penelitian dilakukan di Laboratorium Mikrobiologi dan Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi, Universitas Sanata Dharma, Yogyakarta.
B. Variabel Penelitian dan Definisi Operasional 1. Variabel penelitian
a. Variabel bebas: ekstrak etanol kulit batang asam jawa dengan berbagai macam variasi konsentrasi (Uji daya antibakteri: 5, 10, 20, 25, 50, 100 mg/ml; Penentuan KHM dan KBM: 10, 15, 20, 25, 30 mg/ml; Uji penegasan daya antibakteri: 25, 30, 35, 40, 45 mg/ml). b. Variabel tergantung: diameter zona hambat ekstrak etanol kulit
batang asam jawa pada pertumbuhan bakteri jerawat, nilai KHM, nilai KBM.
c. Variabel pengacau terkendali: asal tanaman dari Wonosari, Yogyakarta, proses isolasi bakteri eksudat jerawat secara aseptis, waktu inkubasi 24 jam, suhu inkubasi 37°C, volume larutan uji yang diinokulasikan 30 µl.
18
2. Definisi operasional
a. Kulit batang asam jawa adalah korteks tanaman asam jawa yang telah dikeringkan dalam oven dengan suhu 32-35°C yang diperoleh dari daerah Wonosari, Yogyakarta.
b. Zona hambat adalah suatu daerah jernih di sekitar sumuran yang telah diinokulasi ekstrak yang tidak terdapat pertumbuhan bakteri atau terhambat pertumbuhannya, dibandingkan dengan kontrol negatifaquadest.
c. Ekstrak etanol kulit batang asam jawa adalah ekstrak kulit batang asam jawa yang disari dengan cara maserasi menggunakan penyari etanol 70%, dilanjutkan dikeringkan dalam oven hingga bobot tetap. d. Isolat bakteri eksudat jerawat adalah bakteri yang diisolasi dari
jerawat probandus yang berbentukpustuledengan nanah atau cairan di dalamnya dan ditumbuhkan dalam media Nutrien Agar secara streak platelalu dilakukan reisolasi bakteri hingga didapatkan kultur murni.
e. Kultur murni adalah biakan isolat bakteri eksudat jerawat dengan warna dan bentuk pertumbuhan koloni yang dominan pada hasil isolasi, kemudian direisolasi secara streak plate, lalu pada hasil identifikasi menggunakan pengecatan Gram sudah memiliki bentuk dan warna sel yang seragam.
bakteri dibandingkan dengan kontrol negatif yang disimpulkan melalui uji difusi sumuran dan penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM).
C. Bahan dan Alat Penelitian 1. Bahan
Kulit batang asam jawa yang diperoleh dari daerah Wonosari, Yogyakarta. Etanol 70% sebagai pelarut untuk maserasi, asam tartrat 3%, reagen Mayer, FeCl3, KOH, media Nutrien Agar (Oxoid) dan Nutrien Broth (Oxoid) sebagai media pertumbuhan bakteri uji, larutan Standar Mc Farland 0,5. Klindamisin fosfat 10 mg/ml sebagai kontrol positif, dan aquadestsebagai kontrol negatif.
2. Alat
Alat-alat gelas (Pyrex), jarum ose, mikropipet, pipet ukur (Pyrex), inkubator (Heraeus), autoclave tipe KT-40 (ALP), neraca analitik, shaker (Innova 2100), Microbiological Safety Cabinet, oven (Memmert), mikroskop (BOECO Germany).
D. Tata Cara Penelitian 1. Pengumpulan bahan kulit batang asam jawa
20
terlebih dahulu dengan cara dikerok menggunakan alat bermata pisau, kemudian bagian korteks dikupas menggunakan alat tersebut, dibersihkan, kemudian dikumpulkan. Kulit batang yang dibutuhkan kurang lebih 2-3 kilogram.
2. Pembuatan serbuk kulit batang asam jawa
Kulit batang asam jawa yang sudah terkumpul kemudian dipotong menjadi bagian kecil-kecil menggunakan gunting atau dipatahkan untuk memudahkan pengeringan, kemudian dikeringkan dalam oven pada suhu 32-350C (Doughari, 2006) selama 4 hari. Simplisia dikatakan kering bila simplisia tersebut sudah dapat dipatahkan dengan mudah menggunakan tangan. Sejumlah simplisia kering diserbuk menggunakan blender kemudian diayak untuk mendapatkan serbuk halus. Tidak digunakan ayakan ukuran tertentu. Tujuan pengayakan untuk memisahkan bagian-bagian simplisia yang masih belum hancur untuk kembali diserbuk.
3. Pembuatan ekstrak etanol kulit batang asam jawa
sudah hilang bila didapatkan bobot ekstrak tidak berkurang saat pengeringan dalam oven dilanjutkan selama kurang lebih 1 jam.
4. Skrining fitokimia ekstrak etanol kulit batang asam jawa
a. Uji alkaloid. Satu gram ekstrak dilarutkan dalam etanol yang mengandung asam tartrat 3%. Filtrat kemudian dipindahkan ke dalam tabung reaksi dan diuji keberadaan alkaloid dengan cara menambahkan reagen Mayer ke dalam tabung reaksi. Bila terjadi pengendapan menunjukkan keberadaan alkaloid.
b. Uji saponin. Kira-kira 0,5 gram ekstrak tanaman dimasukkan dalam tabung reaksi, kemudian ditambahkan air, lalu digojok. Adanya buih yang bertahan saat tabung reaksi dibiarkan menjadi bukti adanya saponin.
c. Uji tanin. Ekstrak dari sampel diberi perlakuan larutan uji FeCl3. Warna yang terbentuk kemudian diamati. Warna biru menunjukkan adanya tanin terhidrolisis. Atau 0,5 gram ekstrak dimasukkan ke dalam 10 ml KOH yang baru dibuat, kemudian digojok hingga larut. Adanya endapan mengindikasikan keberadaan tanin.
22
e. Uji antrakuinon. Kira-kira 0,5 gram ekstrak dimasukkan ke dalam tabung reaksi kemudian ditambahkan 5 ml kloroform dan digojok selama 5 menit. Ekstrak kemudian disaring lalu ditambahkan larutan amonia 10%. Munculnya warna merah keunguan pada lapisan amonia (lapisan bawah) menunjukkan keberadaan antrakuinon (Osamudiamen dan Aiyelaagbe, 2009).
5. Isolasi bakteri eksudat jerawat
6. Identifikasi isolat bakteri eksudat jerawat
a. Morfologi koloni. Dilakukan identifikasi morfologi koloni bakteri pada media cair. Bakteri diinokulasikan pada media cair, kemudian diamati morfologi koloninya setelah diinkubasi 24 jam. Diamati sifat pertumbuhan bakteri pada bagian permukaan, di bawah permukaan, dan dasar tabung. Pengamatan meliputi terbentuknya pelikel atau jernih pada bagian permukaan. Pada bagian bawah permukaan diamati adanya kekeruhan, bentuk menyerupai granul, atau keruh. Pada dasar dilihat adanya endapan menyerupai granul atau endapan yang lengket, atau tidak ada endapan sama sekali. Media yang digunakan adalah Nutrien Broth (Lay, 1994).
b. Morfologi sel. Dilakukan pengecatan Gram dan uji motilitas bakteri. 1) Pengecatan Gram. Isolat ditempatkan pada gelas obyek steril
24
positif mengikat kristal ungu sehingga berwarna ungu sedangkan bakteri Gram negatif berwarna merah karena mengikat safranin.
2) Uji motilitas bakteri. Media Nutrien Agar semisolid diinokulasikan dengan bakteri yang akan diuji secara tusukan, kemudian diinkubasi selama 24 jam. Pengamatan dilakukan pada pertumbuhan bakteri sepanjang bekas tusukan.
c. Uji biokimia. Untuk mengetahui sifat biokimia bakteri, dilakukan uji biokimia yang meliputi uji katalase, oksidase, sitrat, lisin, gelatin, H2S, indol, dan MR-VP. Hasil uji identifikasi yang telah didapatkan kemudian dibandingkan dengan sifat-sifat yang dimiliki oleh bakteri jerawat berdasarkan Holt et al. (1994), antara lain Propionibacterium acnes, Propionibacterium granulosum, dan
Staphylococcus epidermidis(Oakley, 2009).
7. Uji daya antibakteri ekstrak etanol kulit batang asam jawa dengan metode difusi sumuran
b. Pembuatan double layer pada media NA. Media yang akan digunakan dibagi menjadi 2 dengan kira-kira perbandingan volume 1:3. 1 bagian digunakan sebagai layer bawah, dituang ke dalam cawan petri steril dan dibiarkan memadat terlebih dahulu. 3 bagian digunakan sebagailayeratas, yang dituang setelah media diinokulasi dengan bakteri uji.
c. Penanaman isolat bakteri secara pour plate. Diambil 1 ml dari suspensi bakteri uji yang sudah disetarakan dengan larutan standar Mc Farland 0,5, diinokulasikan ke media NA secara pour plate. Media NA yang mengandung bakteri dibiarkan beberapa saat supaya memadat. Kemudian dengan menggunakan pelubang sumuran, dibuat lubang-lubang pada media NA yang telah memadat dengan diameter 6 mm, sebagai tempat ekstrak dengan berbagai variasi konsentrasi, serta kontrol positif dan kontrol negatif. Pembuatan lubang hanya menembus layeratas, layer bawah digunakan sebagai alas supaya ekstrak tidak menyebar pada dasar cawan petri.
d. Pembuatan variasi konsentrasi ekstrak kulit batang asam jawa. Dibuat beberapa variasi konsentrasi ekstrak kulit batang asam jawa, meliputi konsentrasi 100 dan 50 mg/ml, dengan cara melarutkan ekstrak ke dalam aquadest steril hingga mencapai konsentrasi yang diinginkan.
26
(0, 5, 10, 20, 25, 50, 100 mg/ml) diinokulasikan pada lubang sumuran yang tersedia. Kontrol positif yang digunakan adalah klindamisin fosfat 10 mg/ml dan kontrol negatif yang digunakan adalah aquadest steril. Volume yang diinokulasikan adalah 30 µl. Diinkubasi 37°C, 24 jam, kemudian diamati hasilnya.
Penentuan konsentrasi yang digunakan dalam orientasi berdasarkan penelitian Doughari (2006). Digunakan konsentrasi 100 mg/ml dan 50 mg/ml lalu konsentrasi diturunkan terus menerus hingga ditemukan konsentrasi di mana ekstrak etanol kulit batang asam jawa sudah tidak dapat menghambat pertumbuhan bakteri jerawat sebagai bakteri uji. Daya antibakteri diamati berdasarkan diameter zona hambat yang terbentuk dibandingkan dengan kontrol negatifaquadeststeril.
8. Penentuan Kadar Hambat Minimum (KHM) dan Kadar Bunuh Minimum (KBM) ekstrak etanol kulit batang asam jawa terhadap bakteri jerawat dengan metode dilusi padat
diinkubasikan selama 24 jam dalam suhu 37°C, dilakukan pengamatan. Pertumbuhan bakteri ditunjukkan dengan kekeruhan media. Semakin subur pertumbuhan bakteri pada media, maka semakin keruh media tersebut. KHM dan KBM dapat diketahui dengan cara membandingkan kejernihan media yang diinokulasi larutan uji dengan kontrol negatif aquadest steril secara visual. Setelah didapatkan media pertumbuhan yang jernih, dilakukan pengujian berikutnya dengan melakukan pemindahan bakteri secara streak dari setiap media yang jernih ke media yang baru. KHM adalah konsentrasi terkecil di mana ekstrak mampu menghambat pertumbuhan bakteri, ditunjukkan dengan media pertumbuhan yang jernih, tetapi masih menunjukkan adanya pertumbuhan pada hasil streak. KBM adalah konsentrasi terkecil yang dapat membunuh bakteri, ditandai dengan tidak adanya pertumbuhan pada hasil streak plate yang menandakan bakteri uji mati karena larutan uji dengan konsentrasi tersebut (McKane dan Kandel, 1996; Konemanet al., 1997).
28
Penentuan rentang konsentrasi uji yang digunakan dalam uji ini mengacu pada hasil uji sebelumnya di mana didapatkan konsentrasi ekstrak kulit batang asam jawa sudah tidak dapat menghambat pertumbuhan bakteri, yang ditunjukkan dengan tidak adanya zona hambat yang terbentuk.
9. Uji penegasan daya antibakteri ekstrak etanol kulit batang asam jawa dengan metode difusi sumuran
Diambil 1-3 ose bakteri dari bakteri yang sudah kita biakkan, diinokulasikan ke dalam 5 ml NB dan divortex agar tercampur merata, kemudian diinkubasi pada suhu 37°C selama 24 jam. Dibuat suspensi bakteri uji dan disetarakan dengan larutan standar Mc Farland 0,5. Lalu diambil 1 ml dari suspensi bakteri uji yang sudah disetarakan dengan larutan standar Mc Farland 0,5, diinokulasikan ke media NA secara pour plate.
konsentrasi uji yang digunakan mengacu dari nilai KBM yang didapatkan dari uji sebelumnya.
E. Analisis Data
Data yang diperoleh dari penelitian ini berupa data hasil skrining fitokimia, data hasil identifikasi isolat bakteri jerawat, dan data nilai KHM dan KBM dideskripsikan dengan disertai data pendukung berupa foto-foto dan disajikan dalam bentuk tabel.
30 BAB IV
HASIL DAN PEMBAHASAN
A. Pengumpulan Bahan Kulit Batang Asam Jawa
Kulit batang asam jawa yang digunakan dalam penelitian ini diperoleh dari daerah Wonosari, Yogyakarta. Asal tanaman dipilih dari daerah Wonosari, Yogyakarta untuk membedakan dengan penelitian Doughari (2006) yang menggunakan bahan yang berasal dari Nigeria. Perbedaan tempat tumbuh suatu tanaman dapat mempengaruhi kandungan kimia tanaman tersebut, baik secara kualitatif maupun secara kuantitatif. Hal-hal yang menyebabkan perbedaan tersebut antara lain iklim atau cuaca, jenis tanah, keadaan lingkungan, dan jumlah curah hujan.
B. Pembuatan Serbuk Kulit Batang Asam Jawa
Pembuatan serbuk bertujuan untuk memperbesar luas permukaan kontak antara bahan dengan pelarut ekstraksi yang digunakan, sehingga hasil ekstraksi dapat maksimal (Anonim, 1986a). Saat bahan telah terkumpul, dilakukan sortasi kering untuk membersihkannya dari kotoran dan tanah yang menempel. Kulit batang segar kemudian diperkecil ukurannya, dengan tujuan untuk meningkatkan efektivitas pengeringan, dengan cara dipatahkan dengan tangan atau dipotong menggunakan gunting, lalu dikeringkan dalam oven dengan suhu 32-35°C. Suhu tersebut disesuaikan dengan penelitian Doughari (2006) yang melakukan pengeringan bahan dengan suhu 32-35°C. Pengeringan bertujuan untuk mengurangi kadar air dalam bahan sehingga dapat mencegah tumbuhnya bakteri, jamur, dan reaksi enzimatik (Doughari, 2006; Anonim, 1986b). Bahan yang telah kering kemudian diserbuk menggunakan blender. Ayakan digunakan untuk memisahkan serbuk yang sudah halus dengan yang masih kasar yang nantinya akan diserbuk kembali menggunakan blender. Tidak digunakan ayakan dengan ukuran tertentu. Berdasarkan pengamatan secara organoleptik terhadap hasil yang diperoleh, pemerian serbuk kulit batang asam jawa yang didapatkan berwarna coklat muda, berbau khas kulit batang, berbentuk serbuk halus.
C. Ekstraksi Serbuk Kulit Batang Asam Jawa
32
metode maserasi adalah caranya sederhana, peralatan yang digunakan sederhana, dan juga mudah dilakukan. Prinsip maserasi adalah perbedaan konsentrasi antara larutan senyawa aktif di dalam sel dengan pelarut ekstraksi, yang menyebabkan terjadinya difusi hingga terjadi kesetimbangan konsentrasi antara larutan di luar sel dan di dalam sel. Keuntungan utama maserasi dibanding perkolasi adalah, dengan sampel yang kecil seperti dalam skala laboratorium dapat dipreparasi dengan perlakuan yang sama seperti dalam skala industri (List dan Schmidt, 2000), maka dipilih maserasi sebagai metode ekstraksi dalam penelitian ini karena keuntungan tersebut. Alasan penggunaan etanol 70% sebagai pelarut ekstraksi karena dapat mencegah tumbuhnya kapang dan kuman, tidak beracun, lebih selektif, dan lebih sedikit panas yang diperlukan untuk pemekatan. Farmakope Indonesia III (1979) juga menyebutkan bahwa pelarut ekstraksi yang diijinkan adalah air, eter, atau campuran etanol dan air.
Ekstraksi dilakukan dengan menggunakan pelarut etanol 70% sebanyak 100 ml untuk setiap 25 gram serbuk. Sejumlah simplisia kering beserta pelarut dimasukkan dalam erlenmeyer bertutup. Proses ekstraksi dilakukan di atasshaker dengan kecepatan 120 rpm selama 24 jam (Doughari, 2006). Penggunaan shaker bertujuan untuk meratakan konsentrasi senyawa aktif dalam pelarut penyari, sehingga perbedaan konsentrasi antara larutan di dalam dan di luar sel tetap terjaga.
sebanyak 14,287 g, dari 200 g serbuk kulit batang asam jawa. Rendemen yang didapatkan dari hasil ekstraksi satu kali sebesar 0,0714%. Berdasarkan pengamatan secara organoleptik terhadap hasil yang diperoleh, pemerian ekstrak etanol kulit batang asam jawa dalam penelitian ini berwarna coklat tua, tidak berbau, berbentuk serbuk.
D. Skrining Fitokimia Ekstrak Etanol Kulit Batang Asam Jawa Bahan yang digunakan dalam skrining fitokimia adalah ekstrak etanol kulit batang asam jawa. Skrining fitokimia dilakukan untuk mengetahui senyawa yang terdapat dalam ekstrak etanol kulit batang asam jawa. Uji kualitatif yang dilakukan bertujuan untuk mengetahui keberadaan senyawa alkaloid, saponin, tanin, steroid, dan antrakuinon. Hasil studi literatur mengungkapkan keberadaan alkaloid, saponin, dan tanin dalam ekstrak etanol kulit batang asam jawa. Uji adanya kandungan steroid dan antrakuinon dilakukan untuk mengidentifikasi kemungkinan adanya senyawa lain yang memiliki aktivitas antibakteri.
Tabel I. Hasil skrining fitokimia ekstrak etanol kulit batang asam jawa
Uji Hasil (Lampiran 3) Penafsiran hasil
Alkaloid Terbentuk endapan (+)
Saponin Tidak muncul buih (-)
Tanin Dengan KOH menunjukkan endapan (+)
Steroid Tidak terbentuk warna merah kecoklatan pada
permukaan (-)
Antrakuinon Tidak terbentuk warna merah ungu pada bagian
34
1. Uji alkaloid
2. Uji saponin
Saponin diketahui memiliki aktivitas antifungi, dan juga memiliki aktivitas antibakteri (Robinson, 1991). Saponin adalah senyawa yang menimbulkan busa jika dikocok dalam air. Hal itu pula yang diamati pada uji ini. Sejumlah ekstrak dikocok bersama dengan air dan diamati terbentuknya busa setinggi 3 cm, dan tidak segera hilang setelah didiamkan beberapa menit. Hasil uji menunjukkan tidak tampaknya busa (lampiran 3), sehingga disimpulkan bahwa ekstrak etanol kulit batang asam jawa diduga tidak mengandung saponin (Osamudiamen dan Aiyelaagbe, 2009). Hal ini tidak sesuai dengan hasil penelitian Doughari (2006) yang menemukan saponin sebagai kandungan ekstrak kulit batang asam jawa. Hal tersebut dimungkinkan karena kadar saponin dalam ekstrak etanol kulit batang asam jawa terlalu kecil, sehingga tidak terdeteksi oleh metode uji. Alasan lain dimungkinkan karena perbedaan asal sampel yang memungkinkan adanya perbedaan konsentrasi kandungan kimia dalam tumbuhan. Sampel yang digunakan dalam penelitian Doughari (2006) berasal dari Nigeria, sedangkan sampel dalam penelitian ini didapatkan dari daerah Wonosari, Yogyakarta.
3. Uji tanin
36
Hasil uji tidak menunjukkan warna biru, sehingga disimpulkan bahwa ekstrak etanol kulit batang asam jawa tidak mengandung tanin terhidrolisis (Lampiran 3). Uji lain dilakukan dengan mengamati terbentuknya endapan saat direaksikan dengan KOH yang menunjukkan adanya tanin. Sehingga disimpulkan bahwa ekstrak kulit batang asam jawa diduga mengandung tanin (Osamudiamen dan Aiyelaagbe, 2009). Tanin direaksikan dengan KOH dapat membentuk endapan karena gugus dalam tanin bergabung dengan KOH yang menghasilkan senyawa yang tidak larut air, sehingga menjadi endapan. Kemampuan antimikroba dari senyawa tanin berdasarkan pada kemampuan senyawa ini menghambat kerja enzim tertentu secara selektif, seperti reverse transkriptase dan DNA topoisomerase atau kemampuannya dalam menghambat ikatan antar ligan dengan suatu reseptor (Mahtuti, 2004; Robinson, 1991).
4. Uji steroid
aktivitas sebagai insektisida dan antibakteri, maka dilakukan uji untuk mengetahui keberadaan steroid untuk memperkirakan senyawa aktif yang berperan dalam aktivitas antibakteri ekstrak kulit batang asam jawa (Osamudiamen dan Aiyelaagbe, 2009).
5. Uji antrakuinon
Pembentukan warna merah keunguan menjadi indikator adanya antrakuinon. Hasil uji yang telah dilakukan menunjukkan hasil negatif, karena tidak ditemukan pembentukan warna merah keunguan setelah penambahan amonia (lampiran 3). Disimpulkan bahwa ekstrak kulit batang asam jawa diduga tidak mengandung antrakuinon. Penelitian Doughari (2006) juga tidak menemukan adanya antrakuinon sebagai kandungan ekstrak kulit batang asam jawa, akan tetapi diketahui antrakuinon pada umumnya digunakan sebagai pewarna dan juga diketahui memiliki aktivitas antibakteri, maka dilakukan uji untuk mengetahui keberadaan antrakuinon dalam ekstrak etanol kulit batang asam jawa (Osamudiamen dan Aiyelaagbe, 2009).
38
E. Isolasi Bakteri Eksudat Jerawat
Tujuan dilakukan isolasi bakteri jerawat adalah untuk mendapatkan bakteri yang benar-benar berasal dari jerawat dengan memecahkan jerawat berbentuk pustule untuk mengeluarkan eksudatnya, bukan hanya bakteri yang tumbuh di kulit, tapi ada di dalam jerawat.
Bakteri diisolasi dari jerawat probandus berusia 23 tahun. Isolasi dilakukan secara streak plate. Metode streak plate merupakan metode isolasi secara goresan dengan tujuan mendapatkan koloni terpisah yang dapat diduga merupakan satu spesies yang sama. Koloni adalah kumpulan sel bakteri dengan spesies yang sama dan berasal dari perbanyakan satu sel tunggal. Koloni terpisah dari hasil streak plate kemudian direisolasi, hingga didapatkan kultur murni. Koloni yang dipilih untuk reisolasi adalah koloni yang memiliki bentuk dan warna yang mendominasi seluruh populasi hasil streak plate, yaitu koloni berwarna putih kekuningan dengan bentuk bulat cembung. Kultur murni adalah suatu biakan bakteri yang terdiri dari satu spesies yang sama dan merupakan perbanyakan dari satu sel tunggal. Pengecatan Gram dilakukan pada setiap hasil reisolasi untuk melihat apakah sudah didapatkan kultur murni atau belum. Yang diamati pada hasil pengecatan Gram adalah bentuk dan warna sel yang seragam.
Tabel II. Hasil Reisolasi Bakteri Jerawat Berdasarkan Pengecatan Gram
Reisolasi Hasil pengamatan
I Terdapat sel yang berbentuk batang dan kokus, serta terdapat sel yang berwarna ungu dan merah
II Semua sel berbentuk kokus dan berwarna ungu
Reisolasi II sudah menunjukkan bentuk sel dan warna yang seragam, dengan bentuk bakteri kokus dan warna sel ungu, yang menandakan bakteri tersebut bersifat Gram positif, lalu selanjutnya hasil reisolasi II digunakan sebagai bakteri uji.
F. Identifikasi Isolat Bakteri Eksudat Jerawat 1. Morfologi Koloni pada Media Cair
Uji yang dilakukan untuk mengetahui morfologi koloni adalah identifikasi morfologi koloni bakteri pada media cair. Bakteri uji dibiakkan dalam media cair, kemudian diinkubasi. Hasil inkubasi diamati sifat pertumbuhan bakteri pada bagian permukaan, di bawah permukaan, dan dasar tabung. Beberapa hasil pengamatan yang mungkin didapatkan pada bagian permukaan antara lain terbentuknya pelikel, atau jernih. Pada bagian bawah permukaan hasil yang mungkin didapatkan adalah terlihat pertumbuhan yang keruh, atau menyerupai granul, atau jernih. Pada dasar permukaan dapat dilihat adanya endapan seperti granul, atau endapan yang lengket, atau tidak ada endapan sama sekali (Lay, 1994). Hasil pengamatan pada identifikasi ini menunjukkan pada bagian permukaan terbentuk pelikel. Pada bagian bawah permukaan terlihat pertumbuhan yang keruh, sedangkan pada dasar tabung terlihat adanya endapan berupa granula.
40
tanpa adanya oksigen, tetapi juga dapat bertahan hidup pada lingkungan yang kaya akan oksigen.
2. Morfologi Sel
a. Pengecatan Gram. Uji ini dilakukan untuk mengetahui bentuk sel bakteri dan mengetahui sifat Gram dari bakteri tersebut. Hasil pengecatan Gram yang telah dilakukan kemudian diamati di bawah mikroskop. Hasilnya tampak warna ungu pada bakteri yang menunjukkan bahwa bakteri tersebut merupakan bakteri Gram positif, dan bakteri berbentuk kokus. Bakteri Gram positif tampak berwarna ungu setelah pengecatan Gram karena memiliki lapisan peptidoglikan yang lebih tebal dibanding bakteri Gram negatif. Kristal ungu yang menjadi pewarna utama dalam pengecatan Gram diikat kuat oleh lapisan peptidoglikan pada bakteri Gram positif, kemudian saat dicuci dengan alkohol 95%, cat kristal ungu tetap tidak hilang dari peptidoglikan, sehingga saat ditambahkan safranin, dinding sel tidak mampu mengikat safranin. Hasilnya, sel berwarna ungu. b. Uji motilitas bakteri. Uji motilitas dilakukan dengan melakukan inokulasi
maka bergerak ke sekitar untuk mencari nutrisi yang masih tersedia di media. Disimpulkan bahwa bakteri tersebut motil. Berdasarkan kesimpulan, dapat diperkirakan bahwa bakteri uji memiliki flagel atau struktur lain yang berfungsi sebagai alat gerak.
3. Uji biokimia
Uji biokimia yang dilakukan meliputi uji katalase, uji oksidase, uji penggunaan sitrat, uji dekarboksilasi lisin, hidrolisis gelatin, uji hidrogen sulfida, uji indol, dan uji MR-VP. Uji biokimia didasarkan pada berbagai hasil metabolisme yang disebabkan oleh daya kerja enzim yang khas untuk setiap spesies bakteri (Lay, 1994).
a. Uji Katalase. Katalase adalah enzim yang mengkatalisasi penguraian hidrogen peroksida (H2O2) menjadi air dan O2. Hidrogen peroksida bersifat toksik terhadap sel karena bahan ini menginaktivasi enzim dalam sel. Uji ini menggunakan hidrogen peroksida sebagai reagen. Hasil positif uji ini ditandai oleh pembentukan buih seketika setelah penambahan H2O2 pada kultur bakteri. Hasil uji yang dilakukan tidak menunjukkan adanya buih seketika, maka hasil uji ini negatif (Lay, 1994).
tetrametil-42
parafenildiamin. Perubahan warna disebabkan sitokrom oksidase mengoksidasi larutan reagen. Hasil pengamatan tidak menunjukkan perubahan warna setelah 30 menit, maka disimpulkan hasil uji ini negatif (Lay, 1994).
c. Uji Penggunaan Sitrat. Uji sitrat digunakan untuk melihat kemampuan mikroorganisme menggunakan sitrat sebagai satu-satunya sumber karbon dan energi. Media yang digunakan dalam uji ini adalah media Simmon’s citrate yang mengandung Na sitrat sebagai satu-satunya sumber karbon, dan brom thymol blue sebagai indikator pH. Bila mikroorganisme mampu menggunakan sitrat, maka asam akan dihilangkan dari media, sehingga menyebabkan peningkatan pH dan mengubah warna hijau menjadi biru. Hasil positif ditunjukkan dengan perubahan warna media dari hijau menjadi biru. Hasil pengamatan menunjukkan hasil negatif, karena tidak adanya perubahan warna media (Lay, 1994).
d. Uji Dekarboksilasi Lisin. Dekarboksilasi merupakan penguraian gugus karboksil dari suatu molekul organik. Media yang digunakan dalam uji ini adalah media yang mengandung lisin, karbohidrat, dan indikator pH brom cresol purple. Mekanisme proses dekarboksilasi lisin dimulai dari asam
ini sehingga terjadi pembentukan amin yang menetralkan suasana asam media pertumbuhan mikroorganisme. Hal ini dapat ditunjukkan dengan perubahan warna media dari kuning kembali menjadi ungu. Uji yang telah dilakukan menunjukkan hasil negatif, karena adanya perubahan warna media menjadi kuning setelah inkubasi 24 jam, tetapi tidak berubah menjadi ungu kembali setelah inkubasi 48 jam (Lay, 1994).
e. Hidrolisis Gelatin. Gelatin merupakan salah satu protein yang dibutuhkan oleh mikroorganisme untuk kemudian dihidrolisiskan oleh enzim gelatinase sehingga asam amino yang dihasilkan dapat digunakan sebagai zat hara. Gelatin yang telah dicerna tidak mampu membentuk gel dan bersifat cair. Hasil positif uji hidrolisis gelatin adalah mencairnya media pada suhu 35°C dan tetap mencair ketika dimasukkan ke dalam lemari es selama 30 menit. Bila mikroorganisme mampu mencerna gelatin, maka media tidak mampu memadat walaupun sudah dimasukkan dalam lemari es. Uji yang telah dilakukan menunjukkan hasil negatif, karena media gelatin membeku setelah dimasukkan ke dalam lemari es (Lay, 1994).
f. Uji Hidrogen Sulfida. Uji ini untuk mengetahui apakah suatu mikroorganisme mengandung enzim desulfurase atau tidak. Media yang digunakan adalah TSIA (Triple Sugar Iron Agar) dengan indikator warna phenol red. Media ini mengandung tiga macam gula, yaitu glukosa,
44
adalah, bagianbuttberwarna kuning karena suasana berubah menjadi asam dan bagian slant berwarna merah karena suasana basa, menandakan terjadinya fermentasi glukosa. Pada seluruh media terlihat berwarna kuning, pembentukan gas di bagian butt, menandakan terjadinya fermentasi laktosa atau sukrosa atau keduanya dan pembentukan gas, misalnya CO2 dan H2S. Endapan hitam pada bagian butt menandakan pembentukan H2S. Mikroorganisme yang menghasilkan desulfurase saat ditumbuhkan dalam media yang mengandung banyak asam amino akan membentuk H2S. Fe yang terdapat dalam media pertumbuhan bereaksi dengan H2S dan menghasilkan senyawa FeS yang berwarna hitam dan tidak larut air. Senyawa itulah yang akan terlihat berwarna hitam pada bagian butt. Seluruh media berwarna merah, menandakan tidak terjadi fermentasi ketiga macam gula. Uji yang dilakukan menunjukkan hasil negatif, dilihat dari tidak adanya perubahan warna media yang berwarna merah, dan tidak terdapat endapan hitam pada bagian butt, sehingga dapat disimpulkan bahwa tidak terjadi fermentasi ketiga gula dan tidak terjadi pembentukan H2S (Lay, 1994).
ditunjukkan dengan pembentukan senyawa yang tidak larut air dan berwarna merah pada permukaan medium setelah ditambahkan reagen kovac. Uji yang telah dilakukan menunjukkan hasil negatif, karena tidak terjadinya pembentukan senyawa tidak larut air yang berwarna merah (Lay, 1994).
h. Uji MR. Uji MR digunakan untuk menentukan adanya fermentasi karbohidrat yang menghasilkan asam campuran. Perubahan pH karena fermentasi tersebut diamati menggunakan indikator methyl red. Indikator ditambahkan pada media berisi bakteri yang telah diinkubasi sebelumnya. Hasil positif bila media berwarna merah setelah penambahan indikator, sedangkan bila hasil uji negatif maka media berubah menjadi kuning. Uji yang telah dilakukan menunjukkan hasil negatif, karena media berwarna kuning setelah ditambah dengan indikator (Lay, 1994).
2,3-46
butanadiol. Hasil positif ditunjukkan dengan perubahan warna media menjadi merah muda setelah penambahan reagen. Uji yang telah dilakukan menunjukkan hasil negatif, karena tidak terjadi perubahan warna media setelah penambahan reagen (Lay, 1994).
Berikut hasil uji identifikasi isolat bakteri eksudat jerawat akan disajikan dalam bentuk tabel, disertai perbandingan sifat-sifat bakteri jerawat yang umum ditemukan.
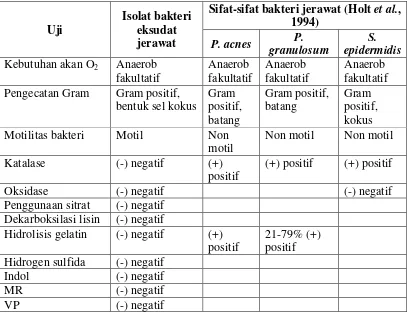
Tabel III. Perbandingan Hasil Identifikasi Isolat Bakteri Eksudat Jerawat dengan Beberapa Bakteri Jerawat
Uji
Isolat bakteri eksudat jerawat
Sifat-sifat bakteri jerawat (Holtet al., 1994)
P. acnes P. granulosum
S. epidermidis Kebutuhan akan O2 Anaerob
fakultatif Pengecatan Gram Gram positif,
bentuk sel kokus Motilitas bakteri Motil Non
motil
Non motil Non motil
Katalase (-) negatif (+)
positif
(+) positif (+) positif
Oksidase (-) negatif (-) negatif
Penggunaan sitrat (-) negatif Dekarboksilasi lisin (-) negatif
Hidrolisis gelatin (-) negatif (+) positif
21-79% (+) positif Hidrogen sulfida (-) negatif
Indol (-) negatif
MR (-) negatif
VP (-) negatif
didapatkan dari Holtet al.(1994), bukan dari hasil uji. Berdasarkan perbandingan, dapat diduga bahwa isolat bakteri eksudat jerawat yang digunakan sebagai bakteri uji dalam penelitian merupakan bakteri jerawat karena memiliki beberapa ciri yang dimiliki oleh bakteri jerawat yang sering ditemukan, akan tetapi butuh identifikasi lebih lanjut untuk menentukan identitas isolat bakteri eksudat jerawat.
G. Uji Daya Antibakteri Ekstrak Etanol Kulit Batang Asam Jawa terhadap Isolat Bakteri Eksudat Jerawat dengan Metode Difusi
Sumuran
48
melarutkan ekstrak dengan baik. Maka dalam uji yang dilakukan, digunakan aquadeststeril sebagai pelarut ekstrak dan sebagai kontrol negatif.
Fungsi dari kontrol negatif adalah untuk melihat apakah pelarut ekstrak yang digunakan memiliki kemampuan untuk menghambat pertumbuhan bakteri uji. Kontrol positif digunakan sebagai perbandingan daya antibakteri dengan perlakuan ekstrak etanol kulit batang asam jawa dengan mengamati diameter zona hambat yang terbentuk, sehingga dapat dilihat potensi daya antibakteri ekstrak etanol kulit batang asam jawa. Saat didapatkan hasil diameter zona hambat ekstrak etanol kulit batang asam jawa lebih besar dari diameter zona hambat kontrol positif, maka ekstrak kulit batang asam jawa memiliki potensi yang kuat sebagai antibakteri dan dapat dikembangkan lebih lanjut menjadi obat tradisional skala industri.
Tabel IV. Diameter zona hambat pertumbuhan bakteri jerawat yang terbentuk pada uji daya antibakteri ekstrak etanol kulit batang asam jawa
Konsentrasi ekstrak (mg/ml)
Diameter zona hambat
(cm) ̅± SD
I II III
Kontrol negatif (aquadest) 0 0 0 0±0
Kontrol positif (klindamisin 10) 2,5 2,6 2,5 2,53±0,06
100 1,5 1,55 1,45 1,5±0,05
50 0,9 1 0,85 0,92±0,08
25 0,7 0,7 0,65 0,68±0,03
20 0,5 0,45 0,5 0,48±0,03
10 - - -
-5 - - -
sedangkan pada kontrol negatif tidak terbentuk zona hambat, yang berarti zona hambat yang muncul pada perlakuan ekstrak etanol kulit batang asam jawa adalah benar-benar berasal dari kemampuan ekstrak, bukan karena pengaruh pelarut ekstrak. Pada ekstrak kulit batang asam jawa juga terbentuk zona hambat pada konsentrasi 100, 50, 25, dan 20 mg/ml, tetapi pada konsentrasi 10 dan 5 mg/ml sudah tidak terlihat adanya zona hambat yang terbentuk. Dapat disimpulkan bahwa konsentrasi 10 mg/ml adalah konsentrasi di mana ekstrak kulit batang asam jawa sudah tidak dapat menghambat pertumbuhan bakteri uji, maka konsentrasi ini digunakan sebagai acuan konsentrasi terendah untuk penentuan nilai KHM dan KBM. Hasil perhitungan standar deviasi menunjukkan deviasi yang kecil pada setiap perlakuan. Hal ini menunjukkan bahwa uji yang dilakukan reprodusibel, sehingga dapat menunjukkan hasil yang tidak jauh berbeda saat dilakukan pengulangan (Lampiran 5).
50
H. Penentuan KHM dan KBM Ekstrak Etanol Kulit Batang Asam Jawa dengan Metode Dilusi Padat
Uji ini dilakukan untuk mengetahui potensi ekstrak kulit batang asam jawa dalam membunuh isolat bakteri eksudat jerawat, sehingga dapat diketahui konsentrasi minimal yang dibutuhkan untuk mendapatkan efek daya antibakteri yang diinginkan.
Konsentrasi larutan uji yang digunakan dalam uji ini mengacu pada hasil uji sebelumnya. Sebagai perlakuan, digunakan 5 konsentrasi larutan uji, yaitu 10, 15, 20, 25, dan 30 mg/ml. Larutan uji dibuat dengan melarutkan ekstrak menggunakan aquadest. Kontrol yang digunakan adalah kontrol kontaminasi media, kontrol pertumbuhan bakteri uji dan kontrol negatif (kontrol pelarut). Bakteri uji yang digunakan adalah bakteri jerawat hasil isolasi pada langkah sebelumnya.
pertumbuhan normal bakteri uji tanpa penghambatan. Kontrol negatif dibuat dengan menambahkan pelarut ekstrak pada media NA kemudian dilakukan pour plate pada cawan petri steril. Kontrol ini berfungsi untuk melihat apakah pelarut ekstrak yang digunakan memiliki kemampuan untuk menghambat pertumbuhan bakteri uji. Hasil pengamatan menunjukkan pelarut tidak memiliki kemampuan menghambat pertumbuhan bakteri uji. Pelarut yang memiliki kemampuan menghambat pertumbuhan bakteri uji akan mengacaukan hasil uji karena kemampuan antibakteri yang ditimbulkan tidak hanya dari ekstrak etanol kulit batang asam jawa, namun juga dari pelarut yang digunakan.
Penentuan KHM dan KBM dilakukan dengan cara mengamati secara visual hasil dilusi padat larutan uji dan bakteri uji dengan media NA. Adanya pertumbuhan bakteri ditandai dengan media yang menjadi keruh. Pengamatan secara visual akan menggolongkan kekeruhan bakteri tersebut, apakah sangat keruh (+++), keruh (++), agak keruh (+), atau jernih (-) yang berarti tidak ada pertumbuhan bakteri. Pada petri yang nampak jernih, dilakukan pemindahan bakteri secara streak ke media Nutrien Agar dalam cawan petri, untuk kemudian diinkubasi dan diamati setelah 24 jam untuk menentukan nilai KHM dan KBM. Suatu konsentrasi larutan uji dikatakan merupakan KHM apabila pada hasil dilusi menunjukkan hasil yang jernih yang berarti larutan uji dapat menghambat pertumbuhan bakteri, tetapi masih menunjukkan pertumbuhan pada hasil streak plate. KBM ditentukan dengan melihat konsentrasi terkecil hasil pemindahan
52
Tabel V. Hasil pengamatan penentuan nilai KHM dan KBM
Konsentrasi (mg/ml) Kekeruhan
Replikasi I Replikasi II Replikasi III
Kontrol negatif (aquadest) +++ +++ +++
10 ++ ++ ++
15 + + +
20 - -
-25 - -
-30 - -
-Kontrol positif (klindamisin 10) - -
-Keterangan: +++ : sangat keruh, ++ : keruh, + : agak keruh, - : jernih
Uji yang telah dilakukan menunjukkan bahwa pada konsentrasi 20, 25, dan 30 mg/ml tidak tampak pertumbuhan bakteri uji. Kemudian dilakukanstreak dari ketiga konsentrasi tersebut. Hasilnya, pada konsentrasi 20 mg/ml dan 25 mg/ml bakteri masih dapat tumbuh, sedangkan pada konsentrasi 30 mg/ml tidak terlihat adanya pertumbuhan bakteri, maka disimpulkan bahwa nilai KHM ekstrak etanol kulit batang asam jawa adalah 20 mg/ml dan nilai KBM dari ekstrak etanol kulit batang asam jawa adalah 30 mg/ml (Lampiran 6).
I. Uji Penegasan Daya Antibakteri Ekstrak Etanol Kulit Batang Asam Jawa dengan Metode Difusi Sumuran
digunakan sebagai kontrol positif karena merupakan salah satu obat di pasaran yang digunakan untuk mengobati jerawat yang disebabkan oleh bakteri.
Uji ini dilakukan untuk mengetahui kemampuan ekstrak etanol kulit batang asam jawa dalam aplikasinya sebagai obat jerawat yang disebabkan oleh bakteri. Untuk tujuan tersebut, maka pada uji ini digunakan nilai KBM ekstrak etanol kulit batang asam jawa, karena saat mengobati jerawat, aksi obat yang diharapkan adalah dapat membunuh bakteri, tidak hanya menghambat pertumbuhan bakteri.
Uji yang telah dilakukan dengan kondisi kontrol positif, yaitu klindamisin fosfat 10 mg/ml memiliki zona hambat paling besar, dengan rata-rata 2,5 cm, sedangkan kontrol negatif, yaitu aquadest steril tidak memiliki zona hambat. Hasil pengukuran diameter zona hambat pertumbuhan bakteri dengan metode difusi sumuran menunjukkan bahwa semakin besar konsentrasi ekstrak yang digunakan, maka semakin besar pula diameter zona hambat pertumbuhan bakteri yang terbentuk.
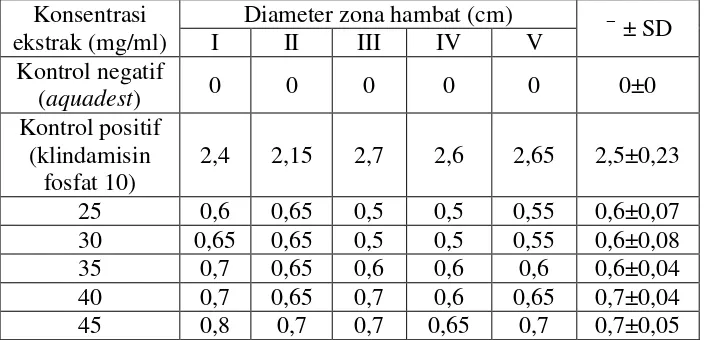
Tabel VI. Diameter zona hambat pertumbuhan bakteri jerawat yang terbentuk pada uji penegasan daya antibakteri ekstrak etanol kulit batang
asam jawa Konsentrasi
ekstrak (mg/ml)
Diameter zona hambat (cm)
54
Data hasil uji (tabel II) kemudian dianalisis menggunakan one way ANOVA pada taraf kepercayaan 95% untuk mengetahui apakah ada perbedaan antar perlakuan. Hnulldalam uji ini adalah tidak ada perbedaan antar perlakuan dan H1 adalah terdapat perbedaan antar perlakuan. Diperoleh F hitung 317,142 lebih besar daripada F tabel 2,44 sehingga Hnull ditolak dan H1 diterima. Hal ini berarti bahwa terdapat perbedaan antar perlakuan yang diujikan.
Uji statistik dilanjutkan menggunakan LSD test untuk mengetahui ada tidaknya perbedaan yang bermakna antar perlakuan. Hasil uji tersebut menunjukkan adanya perbedaan secara bermakna pada kontrol, baik kontrol positif maupun kontrol negatif terhadap setiap perlakuan. Pada perlakuan larutan uji, terdapat perbedaan secara bermakna hanya pada konsentrasi 25 mg/ml dengan 45 mg/ml dan 35 mg/ml dengan 45 mg/ml, sedangkan untuk konsentrasi lain tidak menunjukkan perbedaan secara bermakna (Lampiran 8).
Tabel VII. Hasil analisis dengan menggunakan metode LSDtest Perlakuan Kontrol
25 mg/ml 0,56* -1,94*
30 mg/ml 0,57* -1,93* 0,01
35 mg/ml 0,63* -1,87* 0,07 0,06
40 mg/ml 0,66* -1,84* 0,10 0,09 0,03
45 mg/ml 0,71* -1,79* 0,15* 0,14* 0,08 0,05 Keterangan:
Hasil perbandingan daya antibakteri ekstrak etanol kulit batang asam jawa dengan kontrol positif (klindamisin fosfat 10 mg/ml) menunjukkan perbedaan yang bermakna (Tabel III), dengan nilai perbedaan yang negatif menunjukkan bahwa daya antibakteri ekstrak etanol kulit batang asam jawa lebih kecil dibanding kontrol positif (klindamisin fosfat 10 mg/ml), sehingga ekstrak etanol kulit batang asam jawa tidak potensial pada konsentrasi yang diujikan.
56 BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan hasil penelitian, dapat diambil kesimpulan bahwa:
1. Ekstrak kulit batang asam jawa memiliki daya antibakteri terhadap bakteri jerawat.
2. Ekstrak etanol kulit batang asam jawa memiliki nilai KHM sebesar 20 mg/ml dan nilai KBM sebesar 30 mg/ml.
B. Saran
1. Perlu dilakukan identifikasi lebih lanjut terhadap isolat bakteri jerawat yang didapatkan untuk mengetahui identitasnya dibandingkan dengan standar Propionibacterium acnes, Propionibacterium granulosum, dan Staphylococcus epidermidis.
DAFTAR PUSTAKA
Anonim, 1978, Analisis Obat Tradisional, Jilid I, 117-118, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1985, Cara Pembuatan Simplisia, 5, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1986a, Sediaan Galenik, 1, 2, 10, Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 1986b, Dasar-Dasar Mikrobiologi, 24-27, Bagian Biologi Fakultas Farmasi Universitas Gadjah Mada, Yogyakarta
Anonim, 2000, Acuan Sediaan Herbal, Edisi 1, 7-8, Ditjen POM-Departemen Kesehatan Republik Indonesia, Jakarta
Anonim, 2007, Tanaman Obat Indonesia: Asam Jawa,
http://www.iptek.net.id/ind/pd_tanobat/view.php?mnu=2&id=132, diakses 26 September 2007
Anonim, 2009, Asam Jawa, http://www.plantamor.com/index.php?plant=1229, diakses tanggal 15 Agustus 2009
Ansel, H.C., 1989,Pengantar Bentuk Sediaan Farmasi, Edisi 4, 616-618, Penerbit Universitas Indonesia Press, Jakarta
Arisandi, 2006, Khasiat Berbagai Tanaman Untuk Pengobatan, 36, Eska Media, Jakarta
Burns, T., 2005,Lecture Notes Dermatology, 59-61, Erlangga, Jakarta
Bonang, G. dan Koeswandono, E.S., 1982, Mikrobiologi Kedokteran Untuk Laboratorium dan Klinik, 114-116, Penerbit PT Gramedia, Jakarta
Doughari, J.H., 2006, Antimicrobial Activity ofTamarindus indicaLinn,Tropical Journal Pharmaceutical Research,5 (2), 597-603
Duke, J., 2010, Phytochemical and Ethnobotanical Databases, http://www.ars-grin.gov/duke, diakses tanggal 6 Maret 2010
58
Ganiswarna, S.G., 1995, Farmakologi dan Terapi, Edisi 4, 571, Bagian Farmakologi Fakultas Kedokteran Universitas Indonesia, Jakarta
Harborne, J.B., 1996, Metode Fitokimia : Penuntun Cara Modern Menganalisis Tumbuhan, 102-109, Penerbit ITB, Bandung
Haryana, A., 2009, Obat Tradisional Jerawat, http://www.tanaman-obat.com/index.php?option=com_content&task=view&id=258&Itemid=57, diakses tanggal 9 Februari 2010
Holt, J. G., Krieg, N. R., Sneath, P. H. A., Staley, J. T.,andWilliams, S. T., 1994, Bergey’s Manual of Determinative Bacteriology. 528. Lippincott Williams & Wilkins, Philadelphia
Jawetz, Melnick, dan Adelberg’s, 1995, Medical Microbiology, diterjemahkan oleh Edi Nugroho, Edisi 20, 54, 160, Penerbit Buku Kedokteran EGC, Jakarta
Koneman, E.W., Allen, S.D., Schreckenbergerr, P.C., Winn, W.C., 1997, Color Atlas and Textbook of Diagnostic Microbiology, 5th Ed, 840-841, Lippincott Williams and Wilkins, Philadelphia, USA
Lay, B.W., 1994, Analisis Mikrobiologi di Laboratorium, 20, 77-102, Raja Grafindo Persada, Jakarta
Lenny, S., 2006, Senyawa Terpenoida dan Steroida, 7-14, http://library.usu.ac.id/download/fmipa/, diakses 26 Februari 2010
List, P.H. and Schmidt, P.C., 2000, Phytopharmaceutical Technology, 107-112, CRC Press Inc., Florida
Mahtuti, E. Y., 2004, Pengaruh Daya Antimikroba Asam Tanat Terhadap Pertumbuhan Bakteri Salmonella typhi Secara In Vitro: Penelitian Eksperimental Laboratoris, http://adln.lib.unair.ac.id, diakses 20 Februari 2010
McKane, L., and J. Kandel, 1996, Microbiology: Essentials and Applications, 397-398 Mc Graw Hill Inc., New York
Mursyidi, A., 1989, Analisis Metabolit Sekunder, 63, Universitas Gadjah Mada, Yogyakarta
Osamudiamen, P.M and Aiyelaagbe, O.O, 2009, Phytochemical Screening for Active Compounds in Mangifera indica Leaves from Ibadan, Oyo State, Plant Science Research,2 (1), 11-13
Robinson, T., 1991, The Organic Constituents of Higher Plants, diterjemahkan oleh Kosasih Padmawinata, Edisi 6, 71-78, 157-158, ITB, Bandung
Voigt, R., 1994, Buku Pelajaran Teknologi Farmasi, Edisi 5, 563-567, Gadjah Mada University Press, Yogyakarta
Thomas, 1989,Tanaman Obat Tradisional 1, 20, Kanisius, Yogyakarta
60
Lampiran 1
Lampiran 2
Kulit Batang Asam Jawa (Tamarindus indicaLinn.)
Gambar 1. Kulit batang asam jawa (Tamarindus indicaLinn.) Keterangan:
62
Lampiran 3
Hasil Uji Tabung dari Skrining Fitokimia Ekstrak Etanol 70% Kulit Batang Asam Jawa
Gambar 2. Alkaloid Keterangan:
Tanda panah menunjuk adanya endapan Kesimpulan:
ekstrak mengandung alkaloid (+)
Gambar 3. Saponin Keterangan:
Tidak muncul buih pada permukaan Kesimpulan: ekstrak tidak
mengandung saponin (-)
Gambar 4. Tanin dengan KOH Keterangan:
Tanda panah menunjuk adanya endapan Kesimpulan:
ekstrak mengandung tanin (+)
Gambar 5. Tanin dengan FeCl3 Keterangan:
Larutan berwarna kehijauan Kesimpulan: ekstrak tidak